요 약
PALB2 생식세포 변이는 BRCA1/2를 제외한 가장 중요한 유방암 감수성 유전자로 유방암 이외에도 난소암, 췌장암 발생과 연관성이 있으며 전립선암의 예후와도 관련이 있다. 본 종설에서는 PALB2 유전자의 변이에 대한 해석과 미국국립종합암네트워크 관리 방침 및 현재까지 보고된 문헌들에 대해 정리하였다.
Abstract
Germline mutations in PALB2 are associated with an increased risk of breast, ovarian, and pancreatic cancer. PALB2 is considered the most important breast cancer predisposition gene after BRCA1 and BRCA2. However, the management and surveillance of PALB2 germline pathogenic variant carriers have not been well described and have continued to change over the years. Herein, we review the pan-cancer risk of PALB2 germline pathogenic variants and present clinical surveillance practices based on the most recent National Comprehensive Cancer Network guidelines. This will be helpful for genetic counseling of Korean patients with PALB2 germline variants.
PALB2 (partner and localizer of BRCA2; NM_024675.4)는 종양 억제 유전자(tumor suppressor gene)로 DNA 상동 재조합(homologous recombination, HR) 경로를 통해 DNA 이중 가닥 손상(double-strand break, DSB) 복구 과정에서 중요한 역할을 하는 인자이다. 명명된 이름에서 알 수 있듯이, BRCA2-상호작용 단백질(BRCA2-interacting protein)로 2006년 처음으로 보고되었으나[1] 후에 연구를 통해 BRCA1과도 상호작용함이 밝혀졌다[2].
PALB2의 이대립인자성 변이(biallelic variant)는 판코니 빈혈(Fanconi anemia)을 유발하는 것으로 알려져 있으나 단일대립인 자성 변이(monoallelic variant)는 유방암, 난소암, 췌장암 등의 암종과 연관이 있는 것으로 밝혀졌으며 특히 유방암의 경우 PALB2는 BRCA1, BRCA2 다음으로 가장 중요한 유방암 유전자로 알려져 있다[3, 4]. 그러나 PALB2 병원성 변이 보인자에 대한 관리와 감시에 대한 지침은 계속해서 변화하고 있으며, 이마저도 주로 백인 인구 집단을 대상으로 한 연구를 바탕으로 하기 때문에 아시아인에게 적용하기에 간극이 있는 실정이다.
따라서 본 종설에서는 기존의 PALB2 병원성 생식세포 변이의 빈도(prevalence) 및 침투율(penetrance)에 대한 연구들에 대해 종합적으로 기술하고 최근 갱신된 미국국립종합암네트워크(National Comprehensive Cancer Network, NCCN)의 지침을 기반으로 하여 PALB2 변이 보인자의 최적의 관리 및 감시 방안에 대하여 다루고자 한다.
PALB2 유전자는 상동 재조합 경로에서 BRCA 복합체(BRCA1-PALB2-BRCA2-RAD51)를 연결하는 결합 분자(bridging molecule) 역할을 하며 RAD51의 기능을 촉진하는 중요한 유전자이다(Fig. 1) [5]. 상동 재조합이란 비상동 말단 연결(non-homologous end joining, NHEJ)과 함께 세포가 DNA 이중가닥 손상을 복구하는 방법 중 하나로 상동 염기 서열의 주형 DNA를 바탕으로 DNA 이중 가닥 손상을 복구하는 경로이다. 절단된 끝에서 연결되는 비상동 말단연결과 달리 손상되지 않은 자매 염색 분체(sister chromatids)를 이용하여 비교적 정확하게 수선된다는 특징이 있다[6, 7]. 상동 재조합의 한 과정으로 PALB2 단백질은 각각 N-말단 코일형 코일(Nterminal coiled-coil)과 C-말단 WD-40 (C-terminal WD-40) 구역(domain)을 통해 BRCA1과 BRCA2와 각각 상호작용하며, BRCA 복합체를 생성한다. 이렇게 생성된 BRCA 복합체는 DNA 손상 반응(DNA damage response, DDR)에서 상동 재조합을 시작하는 데 중요한 역할을 하는데[2, 8], DNA 이중가닥 손상을 복구하는 과정에 있어 핵심 구성 요소인 RAD51이 손상된 DNA 부위로 모이게끔 작용한다[9].
따라서 PALB2는 종양 발생을 억제하는 유전자로 PALB2 변이가 발생할 경우 상동 재조합 결핍(homologous recombination deficiency, HRD)이 발생하여 암을 유발하는 원인이 될 수 있다[10]. 특히 PALB2는 DNA 손상 반응에서 BRCA1 및 BRCA2와 함께 기능하기 때문에 이들 변이와 유사하게 유방암, 난소암, 췌장암 환자군에서 발생 빈도가 증가하는 것으로 알려져 있다[11].
또한 BRCA1, BRCA2와 마찬가지로 PALB2 병원성 변이 보인자에게 다중 ADP-리보스 중합효소(poly ADP-ribose polymerase, PARP) 억제제가 효과적으로 작용할 수 있다. PARP 억제제는 단일 가닥 DNA의 파열을 복구하고 DDR에서 중요한 역할을 하는 PARP 효소를 억제하는 약물인데[12], 이로 인해 DNA 단일 가닥 손상(single-strand break, SSB) 복구 과정이 저해되며 축적된 단일 가닥 손상은 이중 가닥 손상으로 전환된다[13]. 이때 BRCA1, BRCA2, PALB2와 같이 상동 재조합 경로에 관여하는 유전자에 변이가 있을 경우 상동 재조합 기능의 결함으로 이중 가닥 손상을 복구할 수 있는 경로가 없어 궁극적으로 세포의 사멸로 이어지게 되며, 이러한 과정을 합성 치사(synthetic lethality)라고 한다[14].
PALB2 병원성 생식세포 변이의 빈도는 암종 및 연구 설계에 따라 차이가 있으나 암 환자 집단에서는 약 0.10–2.65% [11, 15-50] 일반 인구 집단에서는 약 0.02–1.80%로 추정된다(Table 1).
Genome Aggregation Database (gnomAD) v.4.1.0 (https://gnomad.broadinstitute.org/)에 의하면 ClinVar에서 병원성(pathogenic/likely pathogenic)으로 분류되는 PALB2 생식세포 변이 중 MANE Select 전사물(transcript) NM_024675.4 기준 c.3113G>A (p.Trp1038Ter)와 c.1592del (p.Leu531CysfsTer30) 변이가 전체 일반 인구 집단의 대립유전자 빈도가 각각 0.02%, 0.01%로 가장 높은 빈도로 나타났다[51]. 이외에도 유방암, 난소암, 췌장암 환자가 보유하는 PALB2 생식세포 병원성 변이의 종류에 대해 115개의 문헌을 검토한 체계적 문헌고찰에 따르면[52] 가장 빈번하게 보고된 상위 5개 병원성 변이인 c.509_510del (p.Arg170IlefsTer14), c.3113G>A (p.Trp1038Ter), c.1592del (p.Leu531CysfsTer30), c.172_175del (p.Gln60ArgfsTer7), c.1240C>T (p.Arg414Ter) 변이가 환자들에서 발견된 병원성 변이의 57.3%를 차지하는 것으로 확인되었다. 반면, gnomAD v4.1.0에 ClinVar로부터 병원성으로 분류된 변이들 중, 동아시아인에서 c.3350+5G>A 변이가 전체 동아시아인의 0.02% 빈도로 가장 높게 나타났다[51].
c.1592del 변이의 경우 핀란드에서는 유방암 환자의 약 1%에서 확인된 창시자 돌연변이(founder mutation)로 여겨진다[20]. gnomAD v4.1에서도 c.1592del 변이는 핀란드인(대립유전자 빈도: 0.2%)에서 주로 확인되었으며, 유럽인(비 핀란드인)을 제외한 다른 인종에 대해서는 c.1592del 변이가 발견되지 않았다. c.1592del 변이는 Kwong 등의 유방암/난소암 코호트에서 보고된 2예[19]를 제외하고는, 한국인을 포함한 다수의 동아시아인 유방암, 난소암, 췌장암 환자 코호트에서 확인되지 않았다[11, 16, 24, 31, 32, 36, 42-44, 46, 53].
국내의 연구에서는 262명의 유방암 및 난소암 환자(유방암 132명, 난소암 125명, 유방암 및 난소암 1명) 코호트에서 1명의 난소암 환자에게서 c.3351-1G>C 변이가 확인되었으며[36], 693명의 유방암 환자를 대상으로 조사하여 17명에게서 PALB2 변이가 확인된 연구에서는 c.1426del (p.Arg476GlufsTer9), c.2748+1G>A, c.3350+5G>A 변이가 각각 0.3% (2/693)의 빈도로 확인되었다[32]. 이 외에 도 510명의 유방암 환자를 대상으로 한 연구에서 c.2834+2T>C, c.902del (p.Asp301ValTer5), c.454A>T (p.Lys152Ter), c.1048C>T (p.Gln350Ter)의 4개의 변이가 발견된 바 있으며[31], 300명의 췌장암 환자 중 1명의 환자에서 c.3256C>T (p.Arg1086Ter) 변이가 확인된 적이 있었다[43].
PALB2는 BRCA1, BRCA2와 함께 고침투율의 유방암 성향 유전자(predisposition gene)로 잘 알려져 있다. 21개 국가의 PALB2 생식세포 병원성 변이 보인자가 있는 764개 가족을 대상으로 한 연구에서 여성 유방암에 대한 상대위험도는 7.18 (95% CI=5.82–8.85), 남성 유방암에 대한 상대위험도는 7.34 (95% CI=1.28–42.18)로 확인되었다[4]. 타 연구들의 경우 대상군에 따라 차이가 있으나 PALB2 생식세포 병원성 변이 보인자의 유방암 오즈비는 대략 3.20–12.67의 범위로 나타난 바 있다(Table 1) [16, 20-30, 34, 54].
또한 상술한 연구에 따르면 연령대에 따라 30대에 가장 높은 수치(RR=11.25, 95% CI=7.42–17.05)를 보였으며 70대에 가장 낮은 경향을 보였다(RR=4.84, 95% CI=2.80–8.36). 80세까지 유방암이 발병할 절대 위험도는 여성 유방암이 53% (95% CI=2–10%), 남성 유방암이 1% (0.2–5%)로 추정되었다. 여성 유방암의 경우 출생 기간에 따른 집단별로도 위험도에 차이가 있었는데, 80세까지 유방암이 발병할 절대위험도는 1930년대 출생 여성은 29.5% (95% CI=21.0–40.4%), 1950년대 출생 여성의 경우 57.7% (95% CI=45.0–71.2%)로 확인되었다. 상대위험도의 경우 1940–1969년 출생 여성의 유방암은 2.09, 1969년 이후 출생 여성의 상대위험도는 4.02로 최근의 출생 집단 및 어린 연령에서 위험도가 더 높은 경향이 나타났는데 이는 이전의 암 신고 미비, 생활 방식 변화, 증가한 암 검진율 등이 원인으로 추정된다.
해당 연구에서 PALB2 병원성 변이 보인자 여성에게서 유방암의 가족력의 수준에 따라 위험도에 차이가 있었다. 가족력을 고려하지 않을 경우 80세까지 유방암의 누적 위험도(cumulative risk)는 54% (95% CI=44–63%)인 반면 어머니가 35세 이전에 유방암에 걸렸을 경우 71% (95% CI=62–80%), 어머니와 자매가 50세 이전에 유방암에 걸렸을 경우 76% (95% CI=69–83%)까지 증가하였다[4].
이외에도 PALB2 변이는 반대측 유방암(contralateral breast cancer) 발생과 연관성이 있는데, PALB2 생식세포 병원성 변이 여성 보인자의 반대측 유방암의 10년 누적 발생률(10-year cumulative incidence)은 폐경 전 여성은 12.2% (95% CI=4.8–31.1%)이고, 이 중 에스트로겐 수용체(estrogen receptor)가 음성일 경우에는 35.5% (95% CI=15.0–84.0%)로 추정되었으며 폐경 후 여성은 5.1%(95% CI=1.7–15.6%)로 나타났다[55]. 또한 PALB2 생식세포 병원성 변이는 높은 삼중 음성 유방암 위험과 연관이 있는 것으로 확인되었다(OR=14.41, 95% CI=9.3–22.6) [56].
선행 연구에 따르면 난소암 환자의 약 20%는 유전적 감수성을 갖고 있으며, BRCA1, BRCA2 유전자 이외에도 PALB2 등의 DNA 이중 가닥 손상에 관여하는 유전자들과 연관성이 있다고 알려져 있다[58]. PALB2 생식세포 병원성 변이 보인자의 난소암 상대위험도는 유방암에 비해서는 낮은 2.91 (95% CI=1.40–6.04)로 확인되었으며, 80세까지 난소암이 발병할 절대위험도는 약 5%로 측정되었다[4]. 또한 유방암과 마찬가지로 PALB2 병원성 변이 보인자 여성에게서 난소암의 가족력의 수준에 따라 위험도에 차이가 있었는 데, 가족력을 고려하지 않을 경우 80세까지 난소암이 발병할 누적 위험도는 5% (95% CI=2–10%)이나 어머니가 35세 이전에 난소암에 걸렸을 경우 9% (95% CI=5–18%), 어머니와 자매가 50세 이전에 난소암에 걸렸을 경우 16% (95% CI=8–28%)까지 증가하였다.
54개의 문헌을 체계적으로 분석한 Narayan 등의 연구에서는 전체 난소암 환자 중 약 0.4%가 PALB2 생식세포 병원성 변이를 가지고 있으며 오즈비는 2.48 (95% CI=1.57–3.90)로 보고되었다[59]. 해당 연구의 분석에는 앞서 상술한 Yang 등의 연구는 포함되지 않았으나 상대위험도와 유사한 수치의 오즈비의 결과가 나왔으며, 한국인을 대상으로 한 문헌이 3개 포함되어 있었다[36, 60, 61]. 이외에도 여러 코호트 연구들과 환자 대조군 연구(case-control study)에서 오즈비의 범위는 1.60–10.2로 측정되었으나[21, 37-41] 일부 연구들에서는 유의하지 않은 P-value가 산출되었다(Table 1) [37-39, 41].
췌장암의 약 20% 이상은 유전적 변이로 인해 발생하며[62], PALB2 변이 역시 최근 잠재적인 췌장암 감수성 유전자로 보고되고 있다. PALB2 생식세포 병원성 변이 보인자의 췌장암 상대위험도는 2.37 (95% CI=1.24–4.50), 80세까지 췌장암을 발병할 절대위험도는 2–3%로 추정되었으며 1950–1959년 출생 여성의 경우 2.2%, 남성의 경우는 2.8%로 남성이 여성보다 더 높은 위험도를 보여주었다[4]. 췌관선암종(pancreatic ductal adenocarcinoma) 환자의 생식세포 병원성 변이의 유병률에 대해 체계적으로 검토한 Astiazaran-Symonds 등의 연구에 의하면 가족성 췌장암의 경우 PALB2 병원성 변이의 유병률은 0.97% (11/1,132), 선별되지 않은 췌관선암종 환자의 경우는 0.65% (50/7,751)로 확인되었다[62].
가장 최신의 미국국립종합암네트워크에 따르면 유전적 소인이 의심되는 유방암, 난소암, 췌장암 환자에게 PALB2를 포함한 유전자 검사를 시행할 것을 권고하고 있다[65]. PALB2 병원성 변이 보인자에 대한 검진 권고안의 자세한 내용은 Table 2에 요약되어 있다.
미국국립종합암네트워크 및 미국의학유전학회(American Medical College of Medical Genetics and Genomics, ACMG)는 PALB2 병원성 변이 보인자는 BRCA1/2 병원성 변이 보인자와 유사하거나 동등한 유방암 검진을 시행 받을 것을 권고하고 있다[65, 66]. 이들은 25–29세에는 매년 유방 자기공명영상(magnetic resonance imaging, MRI) 촬영을 통한 검진이 권장되고, 이때 자기공명영상은 유방 조영술(mammogram)로 대체할 수 있다. 30–75세에는 매년 유방 조영술 및 유방 자기공명영상 촬영이 권고되며 위험 감소 유방 절제술(risk-reducing mastectomy, RRM)을 고려할 수 있다.
남성 보인자의 경우에는 35세부터 유방 자가검진(breast selfexam) 훈련 및 교육을 하여야 12개월 간격으로 임상의에 의한 유방 검진을 시행할 것을 권장하고 있다. 남성 유방암의 가족력이 있는 경우, 50세부터 혹은 가족 중 가장 이른 나이의 남성 유방암 발생 나이에서 10년 전부터 매년 유방 조영술을 시행하는 것을 고려해야 한다.
PALB2 병원성 변이 보인자는 45–50세부터 예방적 위험 감소 난관 난소 절제술(risk-reducing salpingo-oophorectomy, RRSO)을 고려할 수 있다.
유전상담은 환자에게 유전자 검사의 결과를 전달하고 환자가 자기결정권을 행사할 수 있도록 필요한 정보와 심리사회적 지지를 제공하는 과정으로 최근 유전자 검사의 시행 빈도가 증가함에 따라 그 중요성 또한 더욱 강조되고 있다[68]. PALB2의 경우 2007년에 최초로 암과의 연관성에 대해 보고되었으며[20, 69], 2012–2013년부터 다중 유전자 패널 검사에 포함되기 시작하며 그 빈도가 증가하였다. 또한 후속 연구들을 통해 BRCA2와 유사한 강력한 유방암 위험 추정치가 발표되고 기타 암과의 연관성에 대한 가능성이 제기되며 유전 상담에 있어 다루어야 할 내용이 포괄적으로 넓어진 바 있다[66].
PALB2 병원성 변이 보인자, 특히 HRD 점수가 높은 암 환자는 올라파립(olaparib), 탈라조파립(talazoparib)과 같은 PARP 억제제를 치료의 옵션으로 고려할 수 있으며 미국국립종합암네트워크와 미국의학유전학회에서도 이를 권장하고 있다[65, 66, 70-72].
현재까지 PALB2 병원성 변이를 가진 암 환자들을 단독으로 조사한 무작위 대조 시험은 없으며 상동 재조합 복구 유전자의 리스트에 포함되어 시행되고 있다[66]. 올라파립의 2상 임상시험에서는 PALB2 병원성 변이를 보유한 11명의 유방암 환자 중 9명(82%)이 부분적으로 반응을 보였으며[73], 6명의 PALB2 병원성 변이를 가진 췌장암 환자에게서 루카파립(rucaparib)의 효능을 조사한 2상 임상시험에선 3명(50%)이 치료에 대한 반응을 보였다[74].
또한 상동 재조합 복구 유전자 변이가 있는 전이성 거세저항성전립선암(metastatic castrate-resistant prostate cancer) 환자를 대상으로 탈라조파립(talazoparib)과 엔잘루타마이드(enzalutamide) 병용 요법의 효과에 대해 조사한 3상 임상시험에서 엔잘루타마이드 단독 요법에 비해 병용 요법에서 방사선학적 무진행 생존율(radiographic progression-free survival)의 유의한 향상을 확인하였고[75], 이러한 결과를 바탕으로 2023년 6월 미국 식품의약국(Food and Drug Administration, FDA)은 PARP 억제제의 일종인 탈라조파립을 엔잘루타미드와 병용하여 PALB2를 포함한 상동재조합 복구 유전자 변이가 있는 전이성 거세저항성 전립선암의 1차 치료제로 승인하였다.
미국국립종합암네트워크의 지침에서는 진단 연령, 병리학적 특성, 가족력 등과 관련하여 PALB2를 포함한 패널 검사를 시행하는 검사 기준을 Supplementary Table 1과 같이 정리하고 있다 [65]. 다만 이러한 임상 특성 및 지침만을 기반으로 한 위험 평가에는 한계가 있으며, 병원성 변이 보인자의 30–50%를 놓칠 수 있음을 인식 해야 한다[76].
PALB2 병원성 보인자에 대한 유전 상담 시 가장 민감한 논의는 바로 위험 감소 유방 절제술 및 위험 감소 난관 난소 절제술에 대한 필요 여부일 것이다. 미국국립종합암네트워크의 지침에서는 PALB2 병원성 보인자에 대해 위험 감소 유방 절제술과 위험 감소 난관 난소 절제술을 고려해 볼 수 있다고 제시하고 있다. 위험 감소 유방 절제술은 BRCA1/2 병원성 변이 보인자에게서 유방암 위험을 85–95% 감소시키는 것으로 나타났으며, 난소암 위험을 72–85% 감소시키는 것으로 보고되었다[77-79]. 하지만 위험 감소 절제술은 삶의 질 저하를 야기할 수 있는데, 침습적 수술인 만큼 신체적 및 정신적인 후유증이 발생할 수 있다. 위험 감소 유방 절제술의 경우 신체 이미지 변화에 대한 혼돈 및 우울을 야기할 수 있으나 최근 유두 보존 유방 절제술 및 유방 재건술의 발전으로 인해 이러한 부정적인 영향은 감소하였다[80]. 특히 위험 감소 난관 난소 절제술은 조기 폐경으로 이어져 골다공증 및 인지저하와 같은 증상을 호소하는 경우가 높으며 영국에서 시행된 코호트 연구에서는 위험감소 난관 난소 절제술에 대한 후회율이 폐경 전 여성은 9.4% (15/160), 폐경 후 여성은 1.2% (1/81)로 폐경 전 여성이 더 높은 것으로 보고되었다[81]. 그러나 위험 감소 난관 난소 절제술은 현재로서는 가장 효과적인 예방적 옵션으로, 환자에게 현 시점의 주된 난소암 검진 전략인 CA-125 종양표지자 검사와 경질 초음파(transvaginal ultrasound)로는 민감도가 부족하여 조기 발견에 한계가 있음을 설명할 필요성이 있다[66, 82].
위험 감소 유방 절제술 및 위험 감소 난관 난소 절제술은 비가역적인 수술인 만큼 개인력, 가족력, 가족 계획, 연령 등에 대한 포괄적인 고려가 필요하며 환자에게 수술의 이점 및 합병증에 대하여 자세히 설명할 필요가 있다. 하지만 유전상담에서 무엇보다 가장 중요한 것은 비지시적인 태도로 환자의 의견을 존중하는 것이라고 할 수 있겠다. 실제로 위험 감소 유방 절제술을 수행한 여성에게서 수술의 이유를 조사하였을 때, 의사의 조언으로 수술을 결정한 여성일수록 수술에 대하여 불만족하였다는 연구 결과가 있다[83].
PALB2 생식세포 변이는 여러 암종과 연관성이 있으므로 병원성 변이 보인자에 대한 적절한 검진 전략이 요구된다. 최근 PALB2 변이 환자에게서 BRCA1/2 변이와 마찬가지로 PARP 억제제가 임상적 이점이 있다는 보고들이 있으므로 PALB2 변이를 주목해야 할 필요성은 더욱 크다고 할 수 있다[84].
한편 현재까지 PALB2에 대한 연구는 유방암에 치중된 경향이 있으므로 타 암종에 대한 후속 연구가 더 진행되어야 할 것이다.
REFERENCES
1. Xia B, Sheng Q, Nakanishi K, Ohashi A, Wu J, Christ N, et al. 2006; Control of BRCA2 cellular and clinical functions by a nuclear partner, PALB2. Mol Cell. 22:719–29. DOI: 10.1016/j.molcel.2006.05.022.
2. Zhang F, Ma J, Wu J, Ye L, Cai H, Xia B, et al. 2009; PALB2 links BRCA1 and BRCA2 in the DNA-damage response. Curr Biol. 19:524–9. DOI: 10.1016/j.cub.2009.02.018.
3. Tischkowitz M, Xia B. 2010; PALB2/FANCN: recombining cancer and Fanconi anemia. Cancer Res. 70:7353–9. DOI: 10.1158/0008-5472.CAN-10-1012.
4. Yang X, Leslie G, Doroszuk A, Schneider S, Allen J, Decker B, et al. 2020; Cancer risks associated with germline PALB2 pathogenic variants: an international study of 524 families. J Clin Oncol. 38:674–85. DOI: 10.1200/JCO.19.01907.
5. Sy SM, Huen MS, Chen J. 2009; PALB2 is an integral component of the BRCA complex required for homologous recombination repair. Proc Natl Acad Sci U S A. 106:7155–60. DOI: 10.1073/pnas.0811159106.
6. Chapman JR, Taylor MR, Boulton SJ. 2012; Playing the end game: DNA double-strand break repair pathway choice. Mol Cell. 47:497–510. DOI: 10.1016/j.molcel.2012.07.029. PMID: 22920291.
7. Yamamoto H, Hirasawa A. 2021; Homologous recombination deficiencies and hereditary tumors. Int J Mol Sci. 23:348. DOI: 10.3390/ijms23010348. PMID: 35008774. PMCID: PMC8745585. PMID: da74b3aa87214a8987623052d3d14cae.
8. Park JY, Zhang F, Andreassen PR. 2014; PALB2: the hub of a network of tumor suppressors involved in DNA damage responses. Biochim Biophys Acta. 1846:263–75. DOI: 10.1016/j.bbcan.2014.06.003.
9. Foo TK, Xia B. 2022; BRCA1-dependent and independent recruitment of PALB2-BRCA2-RAD51 in the DNA damage response and cancer. Cancer Res. 82:3191–7. DOI: 10.1158/0008-5472.CAN-22-1535.
10. Li A, Geyer FC, Blecua P, Lee JY, Selenica P, Brown DN, et al. 2019; Homologous recombination DNA repair defects in PALB2-associated breast cancers. NPJ Breast Cancer. 5:23. DOI: 10.1038/s41523-019-0115-9.
11. Cao AY, Huang J, Hu Z, Li WF, Ma ZL, Tang LL, et al. 2009; The prevalence of PALB2 germline mutations in BRCA1/BRCA2 negative Chinese women with early onset breast cancer or affected relatives. Breast Cancer Res Treat. 114:457–62. DOI: 10.1007/s10549-008-0036-z. PMID: 18446436.
12. Fisher AE, Hochegger H, Takeda S, Caldecott KW. 2007; Poly(ADP-ribose) polymerase 1 accelerates single-strand break repair in concert with poly(ADP-ribose) glycohydrolase. Mol Cell Biol. 27:5597–605. DOI: 10.1128/MCB.02248-06. PMID: 17548475. PMCID: PMC1952076.
13. Nambiar DK, Mishra D, Singh RP. 2023; Targeting DNA repair for cancer treatment: lessons from PARP inhibitor trials. Oncol Res. 31:405–21. DOI: 10.32604/or.2023.028310. PMID: 37415740. PMCID: PMC10319588.
14. Dedes KJ, Wilkerson PM, Wetterskog D, Weigelt B, Ashworth A, Reis-Filho JS. 2011; Synthetic lethality of PARP inhibition in cancers lacking BRCA1 and BRCA2 mutations. Cell Cycle. 10:1192–9. DOI: 10.4161/cc.10.8.15273.
15. Nguyen-Dumont T, Hammet F, Mahmoodi M, Tsimiklis H, Teo ZL, Li R, et al. 2015; Mutation screening of PALB2 in clinically ascertained families from the Breast Cancer Family Registry. Breast Cancer Res Treat. 149:547–54. DOI: 10.1007/s10549-014-3260-8.
16. Zhou J, Wang H, Fu F, Li Z, Feng Q, Wu W, et al. 2020; Spectrum of PALB2 germline mutations and characteristics of PALB2-related breast cancer: screening of 16,501 unselected patients with breast cancer and 5890 controls by next-generation sequencing. Cancer. 126:3202–8. DOI: 10.1002/cncr.32905.
17. Siraj AK, Bu R, Parvathareddy SK, Iqbal K, Azam S, Qadri Z, et al. 2023; PALB2 germline mutations in a large cohort of Middle Eastern breastovarian cancer patients. Sci Rep. 13:7666. DOI: 10.1038/s41598-023-34693-9. PMID: 0c97e2f47b824050854ac2fed92effc0.
18. Kluska A, Balabas A, Piatkowska M, Czarny K, Paczkowska K, Nowakowska D, et al. 2017; PALB2 mutations in BRCA1/2-mutation negative breast and ovarian cancer patients from Poland. BMC Med Genomics. 10:14. DOI: 10.1186/s12920-017-0251-8.
19. Kwong A, Shin VY, Ho CYS, Khalid A, Au CH, Chan KKL, et al. 2021; Germline PALB2 mutation in high-risk Chinese breast and/or ovarian cancer patients. Cancers (Basel). 13:4195. DOI: 10.3390/cancers13164195. PMID: 34439348. PMCID: PMC8394494.
20. Erkko H, Xia B, Nikkilä J, Schleutker J, Syrjäkoski K, Mannermaa A, et al. 2007; A recurrent mutation in PALB2 in Finnish cancer families. Nature. 446:316–9. DOI: 10.1038/nature05609.
21. Kurian AW, Hughes E, Handorf EA, Gutin A, Allen B, Hartman AR, et al. 2017; Breast and ovarian cancer penetrance estimates derived from germline multiple-gene sequencing results in women. JCO Precis Oncol. 1:1–12. DOI: 10.1200/PO.16.00066.
22. Girard E, Eon-Marchais S, Olaso R, Renault AL, Damiola F, Dondon MG, et al. 2019; Familial breast cancer and DNA repair genes: insights into known and novel susceptibility genes from the GENESIS study, and implications for multigene panel testing. Int J Cancer. 144:1962–74. DOI: 10.1002/ijc.31921. PMID: 30303537. PMCID: PMC6587727.
23. Hauke J, Horvath J, Groß E, Gehrig A, Honisch E, Hackmann K, et al. 2018; Gene panel testing of 5589 BRCA1/2-negative index patients with breast cancer in a routine diagnostic setting: results of the German Consortium for Hereditary Breast and Ovarian Cancer. Cancer Med. 7:1349–58. DOI: 10.1002/cam4.1376. PMID: ef20fad57668492e8e5c076a0c75dc32.
24. Momozawa Y, Iwasaki Y, Parsons MT, Kamatani Y, Takahashi A, Tamura C, et al. 2018; Germline pathogenic variants of 11 breast cancer genes in 7,051 Japanese patients and 11,241 controls. Nat Commun. 9:4083. DOI: 10.1038/s41467-018-06581-8. PMID: 30287823. PMCID: PMC6172276. PMID: f152bcaf7fbb4ab986305cf674e86064.
25. Castéra L, Harter V, Muller E, Krieger S, Goardon N, Ricou A, et al. French Exome Project Consortium. 2018; Landscape of pathogenic variations in a panel of 34 genes and cancer risk estimation from 5131 HBOC families. Genet Med. 20:1677–86. DOI: 10.1038/s41436-018-0005-9.
26. Thompson ER, Rowley SM, Li N, McInerny S, Devereux L, Wong-Brown MW, et al. 2016; Panel testing for familial breast cancer: calibrating the tension between research and clinical care. J Clin Oncol. 34:1455–9. DOI: 10.1200/JCO.2015.63.7454. PMID: 26786923.
27. Southey MC, Goldgar DE, Winqvist R, Pylkäs K, Couch F, Tischkowitz M, et al. 2016; PALB2, CHEK2 and ATM rare variants and cancer risk: data from COGS. J Med Genet. 53:800–11. DOI: 10.1136/jmedgenet-2016-103839.
28. Decker B, Allen J, Luccarini C, Pooley KA, Shah M, Bolla MK, et al. 2017; Rare, protein-truncating variants in ATM, CHEK2 and PALB2, but not XRCC2, are associated with increased breast cancer risks. J Med Genet. 54:732–41. DOI: 10.1136/jmedgenet-2017-104588.
29. Heikkinen T, Kärkkäinen H, Aaltonen K, Milne RL, Heikkilä P, Aittomäki K, et al. 2009; The breast cancer susceptibility mutation PALB2 1592delT is associated with an aggressive tumor phenotype. Clin Cancer Res. 15:3214–22. DOI: 10.1158/1078-0432.CCR-08-3128.
30. Slavin TP, Maxwell KN, Lilyquist J, Vijai J, Neuhausen SL, Hart SN, et al. 2017; The contribution of pathogenic variants in breast cancer susceptibility genes to familial breast cancer risk. NPJ Breast Cancer. 3:22. DOI: 10.1038/s41523-017-0024-8. PMID: 22db8878f67d44d09b2b4f5b6bb65e1c.
31. Ryu JS, Lee HY, Cho EH, Yoon KA, Kim MK, Joo J, et al. 2020; Exon splicing analysis of intronic variants in multigene cancer panel testing for hereditary breast/ovarian cancer. Cancer Sci. 111:3912–25. DOI: 10.1111/cas.14600. PMID: 32761968. PMCID: PMC7540976.
32. Park JS, Shin S, Lee YJ, Lee ST, Nam EJ, Han JW, et al. 2022; Implication and influence of multigene panel testing with genetic counseling in Korean patients with BRCA1/2 mutation-negative breast cancer. Cancer Res Treat. 54:1099–110. DOI: 10.4143/crt.2021.978.
33. Pritzlaff M, Summerour P, McFarland R, Li S, Reineke P, Dolinsky JS, et al. 2017; Male breast cancer in a multi-gene panel testing cohort: insights and unexpected results. Breast Cancer Res Treat. 161:575–86. DOI: 10.1007/s10549-016-4085-4.
34. Lu HM, Li S, Black MH, Lee S, Hoiness R, Wu S, et al. 2019; Association of breast and ovarian cancers with predisposition genes identified by large-scale sequencing. JAMA Oncol. 5:51–7. DOI: 10.1001/jamaoncol.2018.2956.
35. Bucalo A, Conti G, Valentini V, Capalbo C, Bruselles A, Tartaglia M, et al. 2023; Male breast cancer risk associated with pathogenic variants in genes other than BRCA1/2: an Italian case-control study. Eur J Cancer. 188:183–91. DOI: 10.1016/j.ejca.2023.04.022.
36. Yoo J, Lee GD, Kim JH, Lee SN, Chae H, Han E, et al. 2020; Clinical validity of next-generation sequencing multi-gene panel testing for detecting pathogenic variants in patients with hereditary breast-ovarian cancer syndrome. Ann Lab Med. 40:148–54. DOI: 10.3343/alm.2020.40.2.148. PMID: 31650731. PMCID: PMC6822011.
37. Lhotova K, Stolarova L, Zemankova P, Vocka M, Janatova M, Borecka M, et al. 2020; Multigene panel germline testing of 1333 Czech patients with ovarian cancer. Cancers (Basel). 12:956. DOI: 10.3390/cancers12040956. PMID: 32295079. PMCID: PMC7226062.
38. Arvai KJ, Roberts ME, Torene RI, Susswein LR, Marshall ML, Zhang Z, et al. 2019; Age-adjusted association of homologous recombination genes with ovarian cancer using clinical exomes as controls. Hered Cancer Clin Pract. 17:19. DOI: 10.1186/s13053-019-0119-3. PMID: 84cd957c7ef5414fb2a8517d356d7ae4.
39. Łukomska A, Menkiszak J, Gronwald J, Tomiczek-Szwiec J, Szwiec M, Jasiówka M, et al. 2021; Recurrent mutations in BRCA1, BRCA2, RAD51C, PALB2 and CHEK2 in Polish patients with ovarian cancer. Cancers (Basel). 13:849. DOI: 10.3390/cancers13040849.
40. Norquist BM, Harrell MI, Brady MF, Walsh T, Lee MK, Gulsuner S, et al. 2016; Inherited mutations in women with ovarian carcinoma. JAMA Oncol. 2:482–90. DOI: 10.1001/jamaoncol.2015.5495. PMID: 26720728. PMCID: PMC4845939.
41. Ramus SJ, Song H, Dicks E, Tyrer JP, Rosenthal AN, Intermaggio MP, et al. AOCS Study Group. 2015; Germline mutations in the BRIP1, BARD1, PALB2, and NBN genes in women with ovarian cancer. J Natl Cancer Inst. 107:djv214. DOI: 10.3410/f.725755674.793527271.
42. Yin L, Wei J, Lu Z, Huang S, Gao H, Chen J, et al. 2022; Prevalence of germline sequence variations among patients with pancreatic cancer in China. JAMA Netw Open. 5:e2148721. DOI: 10.1001/jamanetworkopen.2021.48721. PMID: 35171259. PMCID: PMC8851306.
43. Ryu KH, Park S, Chun JW, Cho E, Choi J, Lee DE, et al. 2023; Prevalence and risk factors of germline pathogenic variants in pancreatic ductal adenocarcinoma. Cancer Res Treat. 55:1303–12. DOI: 10.4143/crt.2023.291. PMID: 37024097. PMCID: PMC10582541.
44. Zhao Z, Li X, Wang F, Xu Y, Liu S, Han Q, et al. 2023; Pathogenic genomic alterations in Chinese pancreatic cancer patients and their therapeutical implications. Cancer Med. 12:11672–85. DOI: 10.1002/cam4.5871. PMID: 36999792. PMCID: PMC10242355. PMID: 51b379596788480cb0b8b717dbd72b78.
45. Muhammad N, Sadaqat R, Naeemi H, Masood I, Hassan U, Ijaz B, et al. 2022; Contribution of germline PALB2 variants to an unselected and prospectively registered pancreatic cancer patient cohort in Pakistan. HPB (Oxford). 24:2134–44. DOI: 10.1016/j.hpb.2022.09.003.
46. Mizukami K, Iwasaki Y, Kawakami E, Hirata M, Kamatani Y, Matsuda K, et al. 2020; Genetic characterization of pancreatic cancer patients and prediction of carrier status of germline pathogenic variants in cancerpredisposing genes. EBioMedicine. 60:103033. DOI: 10.1016/j.ebiom.2020.103033. PMID: 32980694. PMCID: PMC7519363.
47. Paulo P, Cardoso M, Brandão A, Pinto P, Falconi A, Pinheiro M, et al. 2023; Genetic landscape of homologous recombination repair genes in early-onset/familial prostate cancer patients. Genes Chromosomes Cancer. 62:710–20. DOI: 10.1002/gcc.23190. PMID: 37436117.
48. Wokołorczyk D, Kluźniak W, Stempa K, Rusak B, Huzarski T, Gronwald J, et al. Polish Hereditary Prostate Cancer Consortium. 2021; PALB2 mutations and prostate cancer risk and survival. Br J Cancer. 125:569–75. DOI: 10.1038/s41416-021-01410-0.
49. Pritchard CC, Mateo J, Walsh MF, De Sarkar N, Abida W, Beltran H, et al. 2016; Inherited DNA-repair gene mutations in men with metastatic prostate cancer. N Engl J Med. 375:443–53. DOI: 10.1056/NEJMoa1603144. PMID: 27433846. PMCID: PMC4986616.
50. Leongamornlert D, Saunders E, Dadaev T, Tymrakiewicz M, Goh C, Jugurnauth-Little S, et al. UKGPCS Collaborators. 2014; Frequent germline deleterious mutations in DNA repair genes in familial prostate cancer cases are associated with advanced disease. Br J Cancer. 110:1663–72. DOI: 10.1038/bjc.2014.30. PMID: 24556621. PMCID: PMC3960610.
51. Karczewski KJ, Francioli LC, Tiao G, Cummings BB, Alföldi J, Wang Q, et al. Genome Aggregation Database Consortium. 2020; The mutational constraint spectrum quantified from variation in 141,456 humans. Nature. 581:434–43. DOI: 10.1038/s41586-020-2308-7. PMID: 32461654. PMCID: PMC7334197.
52. Janssen B, Bellis S, Koller T, Tischkowitz M, Liau SS. 2020; A systematic review of predicted pathogenic PALB2 variants: an analysis of mutational overlap between epithelial cancers. J Hum Genet. 65:199–205. DOI: 10.1038/s10038-019-0680-7.
53. Kim JH, Choi DH, Cho DY, Ahn SH, Son BH, Haffty BG. 2010; PALB2 mutations 1592delT and 229delT are not present in Korean breast cancer patients negative for BRCA1 and BRCA2 mutations. Breast Cancer Res Treat. 122:303–6. DOI: 10.1007/s10549-010-0806-2.
54. Couch FJ, Shimelis H, Hu C, Hart SN, Polley EC, Na J, et al. 2017; Associations between cancer predisposition testing panel genes and breast cancer. JAMA Oncol. 3:1190–6. DOI: 10.1001/jamaoncol.2017.0424. PMID: 28418444. PMCID: PMC5599323.
55. Yadav S, Boddicker NJ, Na J, Polley EC, Hu C, Hart SN, et al. 2023; Contralateral breast cancer risk among carriers of germline pathogenic variants in ATM, BRCA1, BRCA2, CHEK2, and PALB2. J Clin Oncol. 41:1703–13. DOI: 10.1200/JCO.22.01239.
56. Shimelis H, LaDuca H, Hu C, Hart SN, Na J, Thomas A, et al. 2018; Triplenegative breast cancer risk genes identified by multigene hereditary cancer panel testing. J Natl Cancer Inst. 110:855–62. DOI: 10.1093/jnci/djy106. PMID: 30099541. PMCID: PMC6093350.
57. Miao H, Verkooijen HM, Chia KS, Bouchardy C, Pukkala E, Larønningen S, et al. 2011; Incidence and outcome of male breast cancer: an international population-based study. J Clin Oncol. 29:4381–6. DOI: 10.1200/JCO.2011.36.8902. PMID: 21969512.
58. Toss A, Tomasello C, Razzaboni E, Contu G, Grandi G, Cagnacci A, et al. 2015; Hereditary ovarian cancer: not only BRCA 1 and 2 genes. Biomed Res Int. 2015:341723. DOI: 10.1155/2015/341723.
59. Narayan P, Ahsan MD, Webster EM, Perez L, Levi SR, Harvey B, et al. 2023; Partner and localizer of BRCA2 (PALB2) pathogenic variants and ovarian cancer: a systematic review and meta-analysis. Gynecol Oncol. 177:72–85. DOI: 10.1016/j.ygyno.2023.07.017.
60. Eoh KJ, Kim JE, Park HS, Lee ST, Park JS, Han JW, et al. 2018; Detection of germline mutations in patients with epithelial ovarian cancer using multi-gene panels: beyond BRCA1/2. Cancer Res Treat. 50:917–25. DOI: 10.4143/crt.2017.220.
61. Choi MC, Bae JS, Jung SG, Park H, Joo WD, Song SH, et al. 2018; Prevalence of germline BRCA mutations among women with carcinoma of the peritoneum or fallopian tube. J Gynecol Oncol. 29:e43. DOI: 10.3802/jgo.2018.29.e80. PMID: 29770616. PMCID: PMC5981097.
62. Astiazaran-Symonds E, Goldstein AM. 2021; A systematic review of the prevalence of germline pathogenic variants in patients with pancreatic cancer. J Gastroenterol. 56:713–21. DOI: 10.1007/s00535-021-01806-y.
63. Russo J, Giri VN. 2022; Germline testing and genetic counselling in prostate cancer. Nat Rev Urol. 19:331–43. DOI: 10.1038/s41585-022-00580-7. PMID: 35449224. PMCID: PMC9022414.
64. Darst BF, Dadaev T, Saunders E, Sheng X, Wan P, Pooler L, et al. 2021; Germline sequencing DNA repair genes in 5545 men with aggressive and nonaggressive prostate cancer. J Natl Cancer Inst. 113:616–25. DOI: 10.1093/jnci/djaa132. PMID: 32853339. PMCID: PMC8599772.
65. National Comprehensive Cancer Network (NCCN). 2024. Genetic/familial high-risk assessment: breast, ovarian, and pancreatic, version 3. https://www.nccn.org/professionals/physician_gls/pdf/genetics_bop.pdf. Last accessed on Mar 2024.
66. Tischkowitz M, Balmaña J, Foulkes WD, James P, Ngeow J, Schmutzler R, et al. ACMG Professional Practice and Guidelines Committee. 2021; Management of individuals with germline variants in PALB2: a clinical practice resource of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 23:1416–23. DOI: 10.1038/s41436-021-01151-8.
67. Lowry KP, Geuzinge HA, Stout NK, Alagoz O, Hampton J, Kerlikowske K, et al. Breast Working Group of the Cancer Intervention and Surveillance Modeling Network (CISNET), in collaboration with the Breast Cancer Surveillance Consortium (BCSC), and the Cancer Risk Estimates Related to Susceptibility (CARRIERS) Consortium. 2022; Breast cancer screening strategies for women with ATM, CHEK2, and PALB2 pathogenic variants: a comparative modeling analysis. JAMA Oncol. 8:587–96. DOI: 10.1001/jamaoncol.2021.6204.
68. Resta RG. 2006; Defining and redefining the scope and goals of genetic counseling. Am J Med Genet C Semin Med Genet. 142C:269–75. DOI: 10.1002/ajmg.c.30093. PMID: 16878300.
69. Rahman N, Seal S, Thompson D, Kelly P, Renwick A, Elliott A, Easton DF, Stratton MR, et al. Breast Cancer Susceptibility Collaboration (UK). 2007; PALB2, which encodes a BRCA2-interacting protein, is a breast cancer susceptibility gene. Nat Genet. 39:165–7. DOI: 10.1038/ng1959.
70. Telli ML, Timms KM, Reid J, Hennessy B, Mills GB, Jensen KC, et al. 2016; Homologous recombination deficiency (HRD) score predicts response to platinum-containing neoadjuvant chemotherapy in patients with triple-negative breast cancer. Clin Cancer Res. 22:3764–73. DOI: 10.1158/1078-0432.CCR-15-2477. PMID: 26957554. PMCID: PMC6773427.
71. Hodgson DR, Dougherty BA, Lai Z, Fielding A, Grinsted L, Spencer S, et al. 2018; Candidate biomarkers of PARP inhibitor sensitivity in ovarian cancer beyond the BRCA genes. Br J Cancer. 119:1401–9. DOI: 10.1038/s41416-018-0274-8.
72. Lenz L, Neff C, Solimeno C, Cogan ES, Abramson VG, Boughey JC, et al. 2023; Identifying homologous recombination deficiency in breast cancer: genomic instability score distributions differ among breast cancer subtypes. Breast Cancer Res Treat. 202:191–201. DOI: 10.1007/s10549-023-07046-3. PMID: 37589839. PMCID: PMC10504389.
73. Tung NM, Robson ME, Ventz S, Santa-Maria CA, Nanda R, Marcom PK, et al. 2020; TBCRC 048: phase II study of olaparib for metastatic breast cancer and mutations in homologous recombination-related genes. J Clin Oncol. 38:4274–82. DOI: 10.1200/JCO.20.02151. PMID: 33119476.
74. Reiss KA, Mick R, O'Hara MH, Teitelbaum U, Karasic TB, Schneider C, et al. 2021; Phase II study of maintenance rucaparib in patients with platinum-sensitive advanced pancreatic cancer and a pathogenic germline or somatic variant in BRCA1, BRCA2, or PALB2. J Clin Oncol. 39:2497–505. DOI: 10.1200/JCO.21.00003.
75. Fizazi K, Azad AA, Matsubara N, Carles J, Fay AP, De Giorgi U, et al. 2024; First-line talazoparib with enzalutamide in HRR-deficient metastatic castration-resistant prostate cancer: the phase 3 TALAPRO-2 trial. Nat Med. 30:257–64. DOI: 10.1038/s41591-023-02704-x.
76. Samadder NJ, Riegert-Johnson D, Boardman L, Rhodes D, Wick M, Okuno S, et al. 2021; Comparison of universal genetic testing vs guidelinedirected targeted testing for patients with hereditary cancer syndrome. JAMA Oncol. 7:230–7. DOI: 10.1001/jamaoncol.2020.6252.
77. Li X, You R, Wang X, Liu C, Xu Z, Zhou J, et al. 2016; Effectiveness of prophylactic surgeries in BRCA1 or BRCA2 mutation carriers: a metaanalysis and systematic review. Clin Cancer Res. 22:3971–81. DOI: 10.1158/1078-0432.CCR-15-1465.
78. Rebbeck TR, Friebel T, Lynch HT, Neuhausen SL, Garber JE, et al. van 't Veer L. 2004; Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol. 22:1055–62. DOI: 10.1200/JCO.2004.04.188.
79. Ludwig KK, Neuner J, Butler A, Geurts JL, Kong AL. 2016; Risk reduction and survival benefit of prophylactic surgery in BRCA mutation carriers, a systematic review. Am J Surg. 212:660–9. DOI: 10.1016/j.amjsurg.2016.06.010.
80. Torrisi C. 2021; Body image in BRCA-positive young women following bilateral risk-reducing mastectomy: a review of the literature. Front Psychol. 12:778484. DOI: 10.3389/fpsyg.2021.778484. PMID: 03b7ea6a8e184029ad319ef29e4267a4.
81. Gaba F, Blyuss O, Chandrasekaran D, Osman M, Goyal S, Gan C, et al. 2021; Attitudes towards risk-reducing early salpingectomy with delayed oophorectomy for ovarian cancer prevention: a cohort study. BJOG. 128:714–26. DOI: 10.1111/1471-0528.16424. PMID: 32803845. PMCID: PMC7614715.
82. Forstner R. 2020; Early detection of ovarian cancer. Eur Radiol. 30:5370–3. DOI: 10.1007/s00330-020-06937-z. PMID: 32468105. PMCID: PMC7476911.
83. Frost MH, Schaid DJ, Sellers TA, Slezak JM, Arnold PG, Woods JE, et al. 2000; Long-term satisfaction and psychological and social function following bilateral prophylactic mastectomy. JAMA. 284:319–24. DOI: 10.1001/jama.284.3.319.
84. Batalini F, Madison RW, Sokol ES, Jin DX, Chen KT, Decker B, et al. 2023; Homologous recombination deficiency landscape of breast cancers and real-world effectiveness of poly ADP-ribose polymerase inhibitors in patients with somatic BRCA1/2, germline PALB2, or homologous recombination deficiency signature. JCO Precis Oncol. 7:e2300091. DOI: 10.1200/PO.23.00091. PMID: 37992259. PMCID: PMC10681426.
Fig. 1
Model of the BRCA1-PALB2-BRCA2-RAD51 complex during homologous recombination repair.
Abbreviations: DSB, DNA double-strand break; RPA, replication protein A; HR, homologous recombination.
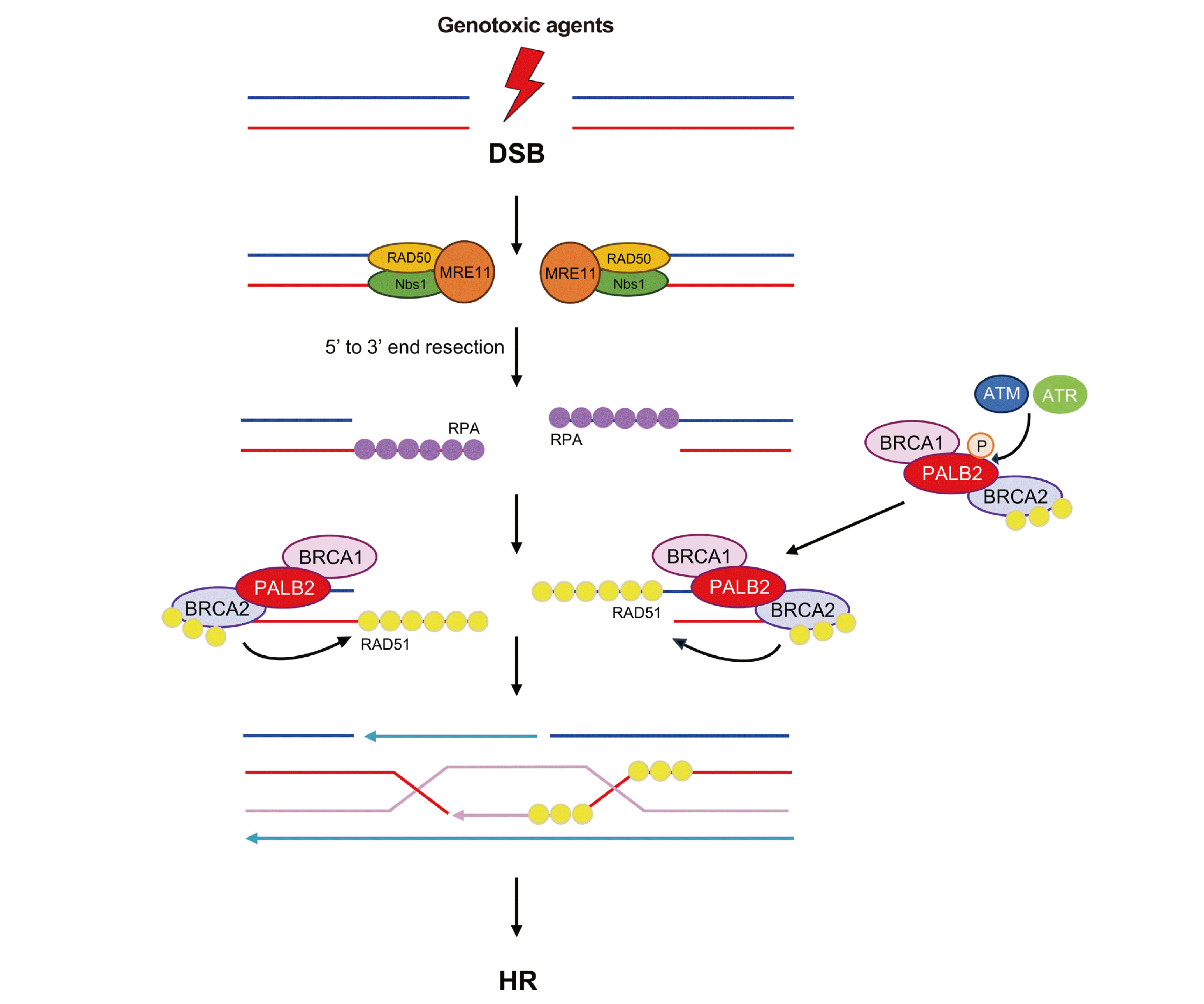
Table 1
Life-time risk and prevalence of cancer phenotypes for carriers of PALB2 germline pathogenic variants
| Cancer type | Prevalence (%) | RR (95% CI) | Life-time risk by age (%) | OR* | References | |
|---|---|---|---|---|---|---|
| Breast cancer | Female | 0.10–2.65 | 7.18 (5.82–8.85) |
Born between 1930 and 1939: (50 yr) 6.9%, (80 yr) 29.5%
Born between 1950 and 1959: (50 yr) 17.4%, (80 yr) 57.7%
|
3.20–12.67 | [4, 11, 15-32, 34, 54] |
| Male | 0.70–0.90 | 7.34 (1.28–42.18) |
Born between 1950 and 1959: (80 yr) 0.9%
|
6.60–22.73 | [4, 33-35] | |
| Ovarian cancer | 0.28–0.95 | 2.91 (1.40–6.04) |
Born between 1950 and 1959: (50 yr) 0.6%, (80 yr) 4.8%
|
1.69–10.20† | [4, 19, 21, 36-41] | |
| Pancreatic cancer | 0.20–1.33 | 2.37 (1.24–4.50) |
Born between 1950 and 1959 males: (80 yr) 2.8%
Born between 1950 and 1959 females: (80 yr) 2.2%
|
5.2–7.9 | [4, 42-46] | |
| Prostate cancer | 0.29–0.52 | 0.42 (0.21–0.84) | NK | 1.1–3.5† | [4, 47-50] |
Table 2
| Site | Technique | Age (yr) | Interval (yr) |
|---|---|---|---|
| Breast (female) | MRI | 30 | 1 |
| Mammogram | 30 | 1 | |
| RRM | NA | NA | |
| Breast (male) | Clinical breast exam | 35 | 1 |
| Mammogram | 50 or 10 years before the earliest known MBC in the family | 1 | |
| Ovary | RRSO | 45–50 | NA |
| Pancreas | Contrast-enhanced MRI/MRCP and/or EUS | 50 or 10 years before the earliest known PC in the family | 1 |
| Prostate | Cancer screening* | 40 | 1 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download