Abstract
Objectives
During the initial clozapine titration, it is crucial to monitor for inflammatory reactions to ensure safe and effective administration. Clozapine metabolism varies by ancestry, particularly among Asians, warranting lower dosage. Recently, Dr. De Leon introduced guidelines based on ancestral differences. We aimed to provide a Korean translation, focusing on illustrating the necessity through clinical cases.
Methods
The Korean translation of the guidelines, approved by Dr. De Leon, involved two psychiatrists who reviewed and revised each other’s work. An additional board-certified psychiatrist conducted an independent review. We examined two clinical cases from our institution’s database, where clozapine titration faced challenges due to fever and pneumonia, assessing guideline applicability.
Results
The guidelines recommend a target clozapine dose of 175-300 mg/day for Asians with average metabolism and a slower titration rate compared to other ancestries. In both cases, CRP elevation was detected either before or simultaneously with the onset of fever, with a concentration-to-dose ratio ranging from 3.06 to 6.97.
조현병 환자 중 약 1/3은 치료저항성이며[1] 클로자핀은 치료저항성 조현병 환자에게 가장 효과적인 항정신병약물이다[2]. 클로자핀은 항정신병약물 중 유일하게 자살행동을 줄여주는 효과가 있음을 미국 식품의약국(U.S. Food and Drug Administration, FDA)에게 승인 받았으며[3] 적대성과 공격성을 감소시키는 것으로도 입증되어 있어[4] 활용 범위가 매우 넓다. 하지만 많은 임상가들이 투약의 관리가 어렵고 위험하다는 이유로 클로자핀의 사용을 아직 어려워하고 있다[5].
1970년대 초 유럽에 처음 도입되었던 클로자핀은 무과립구증으로 인한 사망 사례들이 잇따라 보고되면서 판매 중지되었다. 그러나 1988년 Kane 등[6]이 임상시험을 통해 치료저항성 조현병 환자들에게 클로자핀이 월등한 치료 효과를 보인다는 점을 입증하게 되면서 FDA는 클로자릴 환자 관리 시스템(Clozaril Patient Management System, CPMS) 하에 클로자핀의 사용을 다시 허가했고 이후 유럽 대륙, 영국, 캐나다, 호주, 일본 등에서도 클로자핀을 다시 사용하기 시작했다.
무과립구증에 대해서는 관리 시스템이 마련되었지만, 클로자핀을 안전하게 사용하려면 다른 약물유해반응들에도 여전히 주의를 기울여야 한다. 세계보건기구(World Health Organization, WHO)의 약품감시 데이터베이스인 VigiBase에 의하면 클로자핀을 사용한 환자들의 사망 원인에는 발생 빈도가 높은 순서대로 폐렴[7-10], 심정지[11,12], 무과립구증[13,14], 심근염[15-17], 변비[18-20], 부정맥[21,22], 경련[21,23-25], 실신[26-28] 등이 있다(Supplementary Table 1 in the online-only Data Supplement). 이 데이터베이스에 따르면 1975년 이후 클로자핀 사용과 관련하여 무과립구증으로 인해 환자가 사망한 경우는 550건뿐(사망원인 순서 상 3번째)이며, 상대사망률 또한 2%로 비교적 낮다. 따라서 무과립구증은 더 이상 클로자핀 사용과 연관된 사망의 주된 원인이라고 할 수 없다.
클로자핀의 부작용을 최소화하기 위해서는 적정(titration) 속도 및 용량을 개개인에 맞게 적용하는 것이 매우 중요하다. 클로자핀의 사용설명서(package insert)에는 약동학에 대한 고려가 반영되어 있지 않은데 1989년 미국에서 클로자핀이 승인될 당시에는 FDA가 약물의 사용을 승인할 때 약동학 연구 결과를 전혀 요구하지 않았기 때문이다[29]. 약학이 발전함에 따라 FDA는 약동학 연구를 필수적으로 요구하기 시작했지만 이미 일반약품(generic drug)까지 출시되어 있었던 클로자핀에 대해서는 어느 제약회사도 약동학 연구 결과를 제시하지 않았다. 클로자핀을 안전하게 사용하려면 클로자핀의 사용설명서는 약동학에 대한 고려를 반영하도록 개정되어야 한다.
클로자핀의 혈중 농도에는 다양한 인자들이 영향을 미친다. 클로자핀은 사이토크롬 P450 1A2 (CYP1A2)에 의해 대사되기 때문에[30] CYP1A2에 영향을 주는 인자는 클로자핀의 혈중 농도에도 영향을 줄 수 있다. 대표적으로 담배는 CYP1A2의 유도 인자이고 에스트로젠은 저해제이므로 클로자핀의 용량은 복용자의 성별과 흡연 여부에 따라 다르게 조절해야 한다[31]. 발프로산은 경우에 따라 CYP1A2의 유도 인자도 될 수 있고 저해제도 될 수 있지만 클로자핀을 안전하게 적정하기 위해서는 잠재적인 저해제로 간주하는 것이 좋다[32]. 감염 등 전신에 염증이 발생했을 때 방출되는 사이토카인들은 CYP1A2의 저해제로서 작용하여 클로자핀의 혈중 농도를 높일 수 있다[33]. 클로자핀은 지질 친화성이므로 지방 조직에 잘 축적되고 비만인 사람들에게서 클로자핀의 대사는 감소하게 된다[34]. 클로자핀의 대사 및 CYP1A2의 활성도는 인종에 따라 다른데 특히 아시아 인종과 미국 원주민들은 CYP1A2의 활성도가 낮기 때문에 다른 인종에 비해 클로자핀의 최소치료용량이 낮다[35].
클로자핀의 용량을 각 개인에 맞게 설정하기 위해 최소 농도(trough conditions) 항정상태(steady-state) 치료약물농도 감시(therapeutic drug monitoring, TDM)를 활용할 수 있다. 클로자핀의 용량이 치료용량(therapeutic dosage)이면서 저해제/유도인자의 작용이 없을 때에 한해서 클로자핀의 용량과 혈중 농도 사이에 선형적인 관계가 형성된다. 클로자핀의 농도-용량 비(concentration-to-dose ratio, C/D비)는 각 개인에게서 비교적 일정하게 나타나는데 높은 C/D비는 대사 능력이 낮음을 의미하고 낮은 C/D비는 대사 능력이 높음을 의미한다. 대부분의 환자에서 클로자핀의 효과가 나타나기 위해 필요한 최소 혈중 농도가 일정하다고 가정할 수 있다면[36] 인종, 성별, 흡연 여부 등 각 개인의 약동학적 특성에 따라 클로자핀의 용량과 적정속도를 조절할 수 있을 것이다.
본 논문에서는 클로자핀의 개인 맞춤형 적정법에 대하여 de Leon 등[37]이 2022년에 Pharmacopsychiatry 저널에 발표한 국제 성인용 지침서를 한국어로 번역하여 제시하였다. 아울러, 해당 지침서의 권고 사항과 실제 임상에서의 현황을 비교하기 위해 저자들이 재직 중인 병원에서 클로자핀의 혈중 농도 및 C-Reactive Protein (CRP)을 활용한 클로자핀의 적정법의 필요성을 보여주는 사례들을 함께 제시하였다.
클로자핀의 개인 맞춤형 적정법에 대한 국제 성인용 지침서에는 인종에 기반한 6가지 개인 맞춤형 적정 속도와 용량 결정 방법이 기술되었다. 저자들은 지침서를 통해 클로자핀의 적정 과정에서 TDM을 이용하여 용량과 적정 속도를 결정하는 것과 CRP를 추적 관찰하는 것의 중요성을 강조했다. 지침서의 원저에는 클로자핀의 용량 및 적정 속도를 결정할 때 고려해야 할 요인들에 대한 고찰이 포함되어 있다. 본 논문의 서론에서는 지침서의 내용을 설명하기 위해 필요한 부분을 선별하여 번역하였고, 지침서의 내용은 원저를 번역하여 기술하였다. 지침서의 한국어 번역 작업은 Pharmacopsychiatry 저널과 원저 논문의 교신 저자인 de Leon의 승인을 받은 후, 정신건강의학과 전문의 1명과 전공의 1명이 각각 번역을 수행하고 상호 검토하여서 수정하였다. 이후 추가적으로 정신건강의학과 전문의 1명이 독립적으로 검토를 수행한 후 완료하였다. 본 번역에 참여한 정신건강의학과 전문의들은 클로자핀 임상 처방 관련 전문가들이며, 최종 검토를 수행한 본 논문의 책임저자는 de Leon (2022)의 영문 지침서 개발 과정 및 논문 발표에 참여하였다. 이와 같이 클로자핀 처방 임상 전문성에 기반하여 지침서의 한국어 번역을 수행하였다.
클로자핀을 안전하게 사용하기 위해서는 인종적 차이를 고려하여 적절한 속도의 개인 맞춤형 적정법을 적용하는 것이 중요하다. 본 지침서에는 각 인종별로 대사 능력의 정도에 따라 구분한 6가지 개인 맞춤형 적정 스케줄을 제안한다: 1) 아시아 인종 혹은 미국 원주민 중 클로자핀 저대사자(Supplementary Table 2 in the online-only Data Supplement), 2) 아시아 인종 혹은 미국 원주민 중 클로자핀 평균대사자(Supplementary Table 3 in the online-only Data Supplement), 3) 유럽/서부 아시아 인종 중 클로자핀 저대사자(Supplementary Table 4 in the online-only Data Supplement), 4) 유럽/서부 아시아 인종 중 클로자핀 평균대사자(Supplementary Table 5 in the online-only Data Supplement), 5) 아시아 인종이나 미국 원주민을 제외한 다른 인종의 미국인 중 클로자핀 저대사자(Supplementary Table 6 in the online-only Data Supplement), 6) 아시아 인종이나 미국 원주민을 제외한 다른 인종의 미국인 중 클로자핀 평균대사자(Supplementary Table 7 in the online-only Data Supplement).
클로자핀을 적정할 때 인종에 상관없이 공통적으로 고려해야 할 기본적인 사항들이 있다(Supplementary Table 8 in the online-only Data Supplement). Supplementary Table 8에는 적정의 속도를 늦춰야 하는 경우(저대사자의 스케줄을 적용해야 하는 경우: 경구피임제나 발프로산을 복용하고 있거나 비만인 환자)와 사용을 삼가야 하는 강한 유도인자(리팜피신, 페니토인, 페노바비탈), 벤조다이아제핀 중단의 권고[28] 등이 포함되어 있다. 클로자핀은 주로 환자가 입원했을 때 처음으로 투약이 이루어지므로 본 지침서는 입원환자의 경우에 초점을 두었다.
첫 4주간 백혈구(white blood cell, WBC) 수를 측정할 때 CRP를 함께 측정해야 하며(Supplementary Table 9 in the online-only Data Supplement) [35,38-40], 가능하다면 troponin도 함께 측정하는 게 좋다. 적정 과정 중 CRP의 상승이 처음으로 확인되는 경우, 염증, 특히 상기도 감염이 동반되었는지 확인하고 적정 속도가 너무 빠른 것은 아닌지 검토해야 한다. 추적 검사에서도 CRP와 troponin이 정상화되지 않을 경우에는 클로자핀을 감량하거나 중단하기를 고려해야 한다.
Supplementary Table 2-7 (in the online-only Data Supplement)의 스케줄에는 적정 2주차, 3주차, 4주차의 첫날 아침에 비항정상태(non-steady-state)에서 측정한 TDM 결과의 대략적인 예측치가 제시되어 있다. 클로자핀 TDM은 결과가 보고되는 데에 수 일이 소요되기 때문에 즉각적인 처치를 위해 활용하기는 어려우나 복잡한 사례들을 후향적으로 해석할 때 도움이 될 수 있다.
적정 4주차에 목표 용량에 도달했다면 5일 이상 같은 용량을 유지하여 항정상태에 도달했을 때에 최소 농도의 TDM을 측정하는 것이 중요하다. 치료용량에서 클로자핀의 용량과 혈중 농도 사이에는 선형적인 관계가 형성되고, 염증 혹은 연관된 환경적 요인의 방해만 없다면 클로자핀의 C/D비도 비교적 일정하다. TDM을 여러 번 시행하는 것이 제한적인 상황이라면 적정 4주차에 1회의 TDM을 시행하여 그 결과를 최소치료용량을 예측하는 데 사용할 수 있다. Supplementary Table 10 (in the online-only Data Supplement)에는 서로 다른 용량의 클로자핀을 사용했을 때 TDM 결과의 예시와 최소치료용량을 예측하는 방법이 제시되어 있다.
클로자핀의 대사는 교란 요인의 영향을 받아 크게 변할 수 있다. 모든 교란 요인이 안정적인 상태를 가정하더라도 1회의 최소 농도 항정상태 TDM으로는 클로자핀 C/D비의 대략적인 예측치 만을 알 수 있다. 반면에, 교란 요인이 안정적인 상태에서 적어도 5회 이상 반복하여 최소 농도 항정상태 TDM을 측정하고 클로자핀 C/D비를 계산할 수 있다면 더욱 정확하게 치료용량을 예측할 수 있다.
환자는 17세에 환청과 피해망상이 시작됐고, 우울감, 무가치감, 자살사고를 경험하여 정신건강의학과를 방문해 약물 치료를 시작하였다. 치료 시작 후 3년간 퀘티아핀, 올란자핀, 리스페리돈, 지프라시돈, 아리피프라졸 등 다양한 항정신병 약물을 복용하였지만 환청, 피해망상 및 기분기복이 지속되어, 클로자핀 투약을 시작하기 위해 입원하였다. 입원 2일차부터 일일용량 12.5 mg으로 클로자핀 복용을 시작하였으며, 이후 매일 12.5 mg씩 증량되어 입원 6일차 62.5 mg/day에 도달하였다. 해당일 WBC 수와 함께 CRP 검사를 시행하였고 0.87 mg/dL로 경한 상승 소견이 확인되었다.
입원 7일차 38.2°C의 발열과 기침이 발생하였으며, CRP는 3.93 mg/dL로 상승 소견이 있었으며 흉부 X선 검사 상 이상은 없었다. 해열제 투약 후 체온은 정상화되었다. 이후 클로자핀을 50 mg/day로 감량하여 유지하다가, 다시 하루에 12.5 mg씩 증량하여 입원 14일차 클로자핀 일일 용량은 100 mg이 되었다.
입원 15일차, 38.1°C의 발열과 호흡곤란이 발생했으며, 흉부 전산화 단층촬영(computed tomography, CT) 검사 상 양측 폐의 다발성 결절과 흉막 삼출이 동반된 폐렴 소견이 발견되었다. 당시 CRP의 상승(8.42 mg/dL)이 있었다. 항생제(레보플록사신) 투여를 시작하였으며, 클로자핀은 50 mg/day로 감량하였다. 당시 클로자핀 혈중 농도는 348.4 ng/mL (C/D비=6.97)로 확인되었다. 입원 17일차부터 클로자핀 일일용량을 25 mg으로 감량하여 이후 유지하였다. 입원 24일차 이후 체온이 정상화되었으며, 당시 클로자핀의 혈중 농도는 146.2 ng/mL (C/D비=5.85)로 확인되었다. 신체징후 안정화 후 클로자핀을 50 mg/day로 증량한 뒤 유지하였다. 입원 32일차에 퇴원하였으며, 당시에도 CRP의 상승(7.82 mg/dL)이 지속되었다. 퇴원 1주후 외래에서 확인한 CRP는 1.28 mg/dL로 감소되었다. 그림 1에는 사례 1 환자의 클로자핀 용량, CRP, 발열 여부를 표기해 두었다.
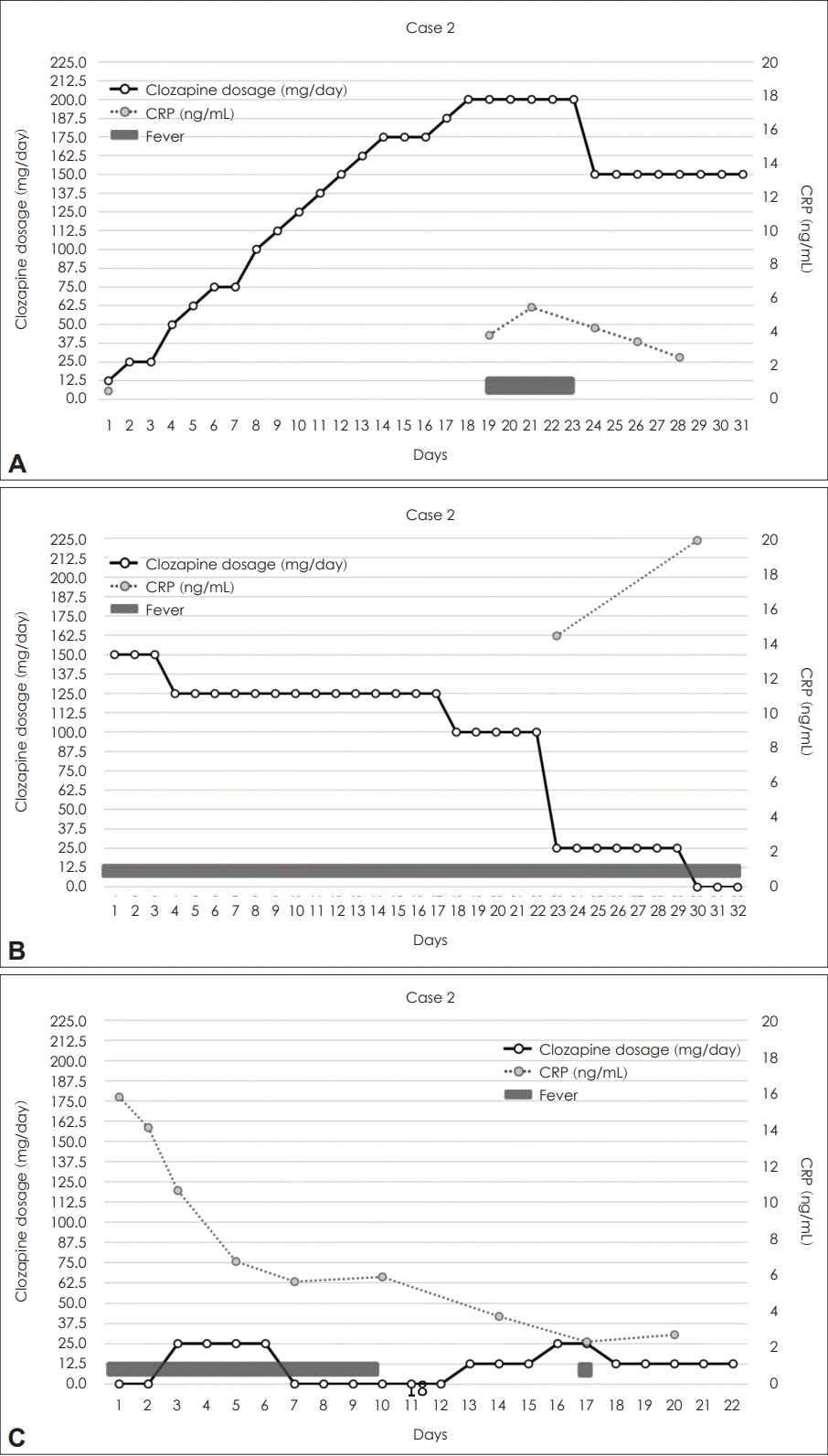
환자는 18세에 환청이 시작됐고 공격적인 행동을 보여 정신건강의학과에 방문해 약물 치료를 시작하였다. 치료 시작 후 3년간 아리피프라졸, 아미설프라이드, 팔리페리돈, 지프라시돈 등의 항정신병약물을 사용해보았지만 환청, 피해망상, 와해된 행동, 공격성이 지속되어 클로자핀 투약을 시작하기 위해 입원했다. 초기 검사 상 CRP는 정상 범위(0.50 mg/dL)임이 확인되었다. 입원 2일차부터 일일용량 12.5 mg으로 클로자핀 복용을 시작하였으며, 이후 주말을 제외하고 매일 12.5 mg씩 증량하여 입원 19일차에 클로자핀 일일용량은 200 mg이 되었고 활력징후는 안정적이었다. 175 mg/day로 3일간 복용한 뒤 입원 18일차에 측정한 클로자핀 혈중 농도는 535.2 ng/mL (C/D비=3.06)였다.
입원 20일차 38.0°C의 발열이 발생했고 CRP는 3.81 mg/dL로 상승했다. 입원 24일차까지 매일 발열이 반복되었고 구토와 설사가 한 번씩 동반되었다. 입원 25일차 체온은 정상화되었고 다른 이상 신체징후는 없었지만 CRP가 4.24 mg/dL로 상승 소견이 지속되어 클로자핀을 150 mg/day로 감량하였다. 입원 29일차까지 CRP는 2.49 mg/dL로 감소되었고 입원 32일차에 퇴원하였다.
환자는 퇴원 후 미열과 복통을 지속적으로 호소했다. 퇴원 23일 후 CRP가 14.4 mg/dL, 퇴원 30일 후 CRP가 19.87 mg/dL로 크게 증가했고 이에 클로자핀을 빠르게 감량하여 완전히 중단한 뒤 재입원하였다.
입원 1일차 38.4°C의 발열이 발생했고 CRP 상승 소견(15.7 mg/dL)이 지속되었다. 요로감염 발생을 의심하여 경험적 항생제(시프로플록사신)을 투여하기 시작했지만 입원 2일차에 시행한 소변배양검사와 혈액배양검사에서 세균은 동정되지 않았다. 입원 3일차 클로자핀을 25 mg/day로 다시 투약하기 시작했고 다음 날 37.5 mg/day까지 증량하였다. 감염내과 진료 결과 감염의 증거가 뚜렷하지 않아 항생제의 투여를 중단했고, 클로자핀-유발 염증의 가능성이 높다고 판단되어 클로자핀이 체내에서 충분히 제거될 때까지 투약을 완전히 중단할 것을 계획하였다. 입원 10일차까지 매일 38.0°C 이상의 발열이 발생했고, 입원 11일차 이후 체온은 정상 범위로 회복되었다. 입원 13일차 CRP는 3.73 mg/dL까지 안정되었고 클로자핀을 12.5 mg/day로 다시 투약하기 시작했다. 입원 16일차 클로자핀을 25 mg/day로 증량하자 입원 17일차에 미열이 다시 나타났다. 입원 18일차 클로자핀을 12.5 mg/day로 다시 감량하여 체온은 정상으로 회복되었고 입원 22일차에 퇴원했다. 그림 2에는 사례 2 환자의 클로자핀 용량, CRP, 발열 여부를 표기해 두었다.
본 논문에서는 de Leon 등(2022)이 클로자핀을 안전하게 사용하기 위해 입원환자를 대상으로 제안한 6가지 개인 맞춤형 적정 스케줄과 추적 관찰 방법에 대한 국제 성인용 지침서를 한국어로 번역하여 제시했다. 6가지 개인 맞춤형 적정 스케줄은 인종, 성별, 흡연, 병용 약물, 비만 등의 요인이 클로자핀 대사에 미치는 영향을 고려하여 작성되었다. 지침서에서는 클로자핀을 적정하는 첫 4주간 WBC 수와 함께 CRP를 측정할 것을 권고하며, CRP가 상승할 경우 동반된 감염의 가능성을 배제하고 적정 속도를 늦출 것을 강조한다. 충분한 자원이 있는 국가에서는 troponin도 함께 측정하는 것이 좋고 추적 결과 CRP와 troponin이 정상화되지 않는다면 클로자핀을 감량하거나 중단하기를 고려해야 한다. 클로자핀은 치료용량으로 사용 시 용량과 혈중 농도 사이에 선형적인 관계가 형성된다. 만약 TDM을 여러 차례 시행하는 것이 제한적인 경우라면, 목표 용량에 도달하는 적정 4주차에 TDM을 1회 시행하고 그 결과를 이용해 최소치료용량을 예측할 수 있다. TDM을 여러 차례 시행할 수 있는 여건이 된다면, 교란 요인이 안정적인 상태에서 최소 농도 항정상태 TDM을 5회 이상 반복하여 클로자핀의 C/D비를 계산하고 이를 이용해 더욱 정확하게 치료용량을 예측할 수 있다.
전문가들은 클로자핀의 혈중 농도를 측정하고 치료참고범위(therapeutic reference range)와 치료지수(therapeutic index)를 고려하여 클로자핀의 용량을 조절할 것을 권고한다[36]. 항정상태의 최저 혈중 농도를 기준으로 할 때 클로자핀의 치료적 유효 혈중 농도는 350-600 ng/mL이고, 치료지수는 1.7 (600/350=1.7)이다. 클로자핀의 치료지수는 항정신병 약물 중 가장 낮으며[36,41,42] 용량 의존성 약물유해반응을 유발할 가능성이 가장 높을 수 있다 (Supplementary Table 11 in the online-only Data Supplement) [43].
클로자핀의 복용을 시작했을 때 적정의 속도는 초기 클로자핀에 의한 부작용 발현에 큰 영향을 준다. 클로자핀을 느린 속도로 적정하는 유럽의 많은 국가들에서는 심근염 발생률이 현저히 낮은 것으로 보고되었다[44]. 반면 클로자핀을 빠른 속도로 적정하는 호주의 경우, 전세계의 클로자핀-유발 심근염 중 절반 이상이 호주에서 발생한 것으로 나타날 정도로[45] 발생률이 높다. 또한 클로자핀을 빠르게 적정할 경우 진정, 침의 과도한 분비, 삼킴 곤란 등이 발생해 흡인성 폐렴의 위험이 높아질 수 있다. 덴마크에서는 클로자핀을 처방 받은 환자 중 일부가 첫 2개월 안에 폐렴으로 사망한 사례들이 보고되었고[46] 클로자핀 투약 환자들의 연간 폐렴 발생률은 2.1% 로 높았다[9]. 로마니아에서도 클로자핀을 빠른 속도로 적정했을 때 첫 2주 만에 폐렴의 발생률이 2.3%로 높았다[47].
많은 연구 결과, 치료 저항성 조현병 환자에서 클로자핀이 효과를 나타내기 위해서는 최소 350 ng/mL 이상의 혈중 농도가 필요하다는 사실이 입증되었다[36]. 그러나 실제 임상에서는 클로자핀의 혈중 농도를 측정하는 것이 어려운 경우가 많다. 조현병 치료 반응 연구 그룹인 Treatment Response and Resistance in Psychosis (TRRIP)는 혈중 농도 측정이 어려운 경우 클로자핀 일일 용량 500 mg 이상을 사용하여 치료 효과를 확인하길 권장하는데, 이는 클로자핀 일일 용량 400 mg 이상인 경우에 효능의 우월성이 확인되었다는 보고를 근거로 한다[1,48]. 하지만 실제 임상에서 우리나라 환자에게는 이보다 훨씬 낮은 용량이 사용되고 있다[49]. 기존 우리나라 연구에 따르면 치료적 유효 혈중농도 유지에 필요한 클로자핀 용량은 300-400 mg/day이었다[50,51]. de Leon 등은 지침서를 통해 평균적인 대사 능력을 가진 아시아인의 목표 치료용량을 일일용량 기준 175-300 mg으로 제시했는데, 이는 실제 임상에서 환자들에게 적용되는 클로자핀 용량과 다소 차이가 있다. 이에 본 논문에서는 실제 임상에서 클로자핀을 적정한 사례를 지침서에서 권고하는 바와 비교하여 제시하였다.
본 논문에서 제시한 사례에 등장하는 두 환자는 모두 아시아 인종의 비흡연자 여성이고 클로자핀을 적정하는 과정에서 전신 염증을 경험했다. 사례 1의 환자는 클로자핀을 일일용량 12.5 mg으로 복용하기 시작해서 매일 12.5 mg씩 증량하였다. 62.5 mg을 복용한 다음 날 환자는 처음으로 발열을 겪었고 흉부 CT 등의 검사를 통해 폐렴이 동반되었음을 확인했다. 발열이 발생하기 하루 전 CRP는 경미하게 상승했고, 항생제를 투여하고 클로자핀을 감량하면서 전신 염증은 호전 추세를 보였다. 적정 기간 중 총 2회의 클로자핀 TDM을 시행했는데 두번째 TDM 측정 당시 클로자핀은 7일 동안 일일용량 25 mg으로 동일하게 투여되어 항정상태에 도달했으며, 이 때 클로자핀 혈중 농도는 146.2 ng/mL, C/D비는 5.85였다. 두번째 TDM을 시행하기 2일 전의 CRP가 8.84 mg/dL로 다소 높았기 때문에 염증이 동반된 상태에서 시행되었을 가능성이 있고 C/D비가 안정 시에 비해 다소 상승했을 수 있다. 사례 2의 환자도 마찬가지로 클로자핀을 일일용량 12.5 mg으로 시작해서 매일 12.5 mg씩 증량했고 200 mg을 복용한 다음 날 처음으로 발열이 발생하였다. 동반된 감염의 증거는 확인되지 않았고 발열은 클로자핀-유발 염증에 의해 발생한 것으로 의심되었다. 환자는 외래에서 클로자핀을 중단한 뒤 안전한 적정을 위해 재입원했고 발열 및 CRP가 안정되기 위해 클로자핀을 일일용량 12.5 mg의 소량만 사용할 수 있었다. 적정 기간 중 TDM은 총 1회 이루어졌는데, 첫번째 입원 시 일일용량 175 mg으로 3일간 복용한 뒤에 측정한 클로자핀의 혈중 농도는 535.2 ng/mL, C/D비는 3.06이었다. TDM을 시행한 당시에 발열이나 CRP 상승 등 전신 염증의 증거는 없었다. 두 사례는 모두 저대사자 아시아 인종에서 통상적인 클로자핀의 적정 스케줄을 적용했을 때 전신 염증이 동반될 수 있음을 시사하였다.
클로자핀을 복용하는 많은 환자들은 복용 초기에 발열과 함께 피로감과 근육통, 몸살을 호소한다. 이는 클로자핀이 사이토카인 네트워크에 변화를 초래하여[52] 바이러스나 세균 감염 시와 유사하게 다양한 생리학적 현상을 유발하기 때문이다. 감염 등 전신 염증 상황에서 방출되는 사이토카인들은 CYP1A2의 저해제로서 작용하여 클로자핀의 혈중 농도를 높일 수 있다[33]. 염증이 클로자핀의 농도에 미치는 영향은 다양해서, 경우에 따라 혈중 농도의 변화가 미미해 용량을 변경할 필요가 없을 수도 있고 혈중 농도가 3배나 올라서 용량을 1/3까지 줄여야 할 수도 있다[35]. 클로자핀을 빠른 속도로 적정하면 전신 염증이 유발되어 클로자핀의 대사가 저해되고 이 때문에 클로자핀의 농도가 더욱 증가하게 되는 양성 피드백(positive feedback)이 이루어질 수도 있다.
국제 성인용 지침서에서는 인종, 성별, 흡연, 병용 약물 등의 고려 사항에 대해서 상세히 잘 제시해 주었으나, 제시한 사례에서 살펴본 바와 같이 실제 환자에서는 임상 상황에 맞추어 적절한 가변적 적용이 필요하다. 지침서에는 클로자핀의 대사에 영향을 줄 수 있는 인자들에 대한 고려가 반영되었지만, 보다 안전하면서도 효과적인 클로자핀 개인 맞춤형 적정을 위해서는 개별 환자의 유전적 소인, 신체 활동 수준, 부작용에 대한 주관적 고통의 수준 등 클로자핀의 대사 및 복용에 영향을 줄 수 있는 다른 다양한 요소에 대해서도 고려하여 유연한 적용이 필요할 것이다.
한국어로 번역된 지침서에 대한 원저자의 역번역 과정을 수행하지 못한 제한점을 지닌다. 그러나 전술한 바와 같이 영문 원저 지침서 개발 과정부터 참여한 클로자핀 처방 관련 임상 전문가들이 직접 번역 과정을 수행하였으며, 정확한 지침서 확립을 위해 상호 검토를 철저히 수행하였다.
본 논문에서 지침서의 임상 적용 필요성을 보여주는 증례 2례를 제시하였지만, 클로자핀을 복용하는 한국 환자들의 적정 과정에서의 부작용 발현에 대한 체계적인 분석과 보고는 아직 없다. 향후 우리 나라 환자에서의 근거 확충을 통해 우리 임상 현실에 더욱 잘 적용이 가능한 지침서로의 보완이 필요할 것이다.
본 논문에서는 클로자핀 사용의 안전성을 높이기 위해, 인종, 성별, 흡연, 비만, 병용약물 등의 요인이 클로자핀 대사에 미치는 영향을 고려하여 6가지 개인 맞춤형 적정 스케줄과 추적 관찰 방법을 담은 국제 성인용 지침서를 한국어로 번역하여 제시하였다. 지침서에서는 클로자핀을 안전하게 적정하기 위해 CRP, troponin 등을 측정해야 하며 용량 예측을 위한 TDM을 1회 이상 시행하는 것이 좋다는 결론을 내리고 있다. 클로자핀의 적정 속도는 초기 클로자핀에 의한 부작용 발현에 큰 영향을 줄 수 있기 때문에 대사 정도에 따라 달리 해야 한다. 국제 성인용 지침서와 실제 클로자핀 사용 사례를 비교한 결과, 인종, 성별, 흡연 등 다양한 요인이 클로자핀의 용량 및 적정 속도 결정에 중요한 역할을 하는 것으로 확인됐다. 더 안전하고 효과적인 클로자핀 개인 맞춤형 적정 방법을 개발하기 위해 각 환자의 개별적인 요소가 클로자핀의 대사에 어떤 영향을 미치는지 추가 연구가 필요할 것으로 생각된다.
Supplementary Materials
The online-only Data Supplement is available with this article at https://doi.org/10.16946/kjsr.2023.26.2.52.
Supplementary Table 1.
VigiBase[43]에 근거한 클로자핀 약물유해반응과 관련된 주요 사망 원인 8 가지
Supplementary Table 6.
아시아인/미국 원주민을 제외한 다른 인종의 미국인 입원환자(유럽 혹은 흑인 인종): 저대사자의 적정
Supplementary Table 7.
아시아인/미국 원주민을 제외한 다른 인종의 미국인 입원환자(유럽 혹은 흑인 인종): 평균대사자의 적정
Supplementary Table 10.
클로자핀의 항정상태 최저농도를 이용해 최종 용량을 추정하는 방법
REFERENCES
1. Howes OD, McCutcheon R, Agid O. Treatment-resistant schizophrenia: Treatment Response and Resistance in Psychosis (TRRIP) Working Group Consensus Guidelines on diagnosis and terminology. Am J Psychiatry. 2017; 174:216–229.

2. Siskind D, McCartney L, Goldschlager R, Clozapine v. first- and second-generation antipsychotics in treatment-refractory schizophrenia: systematic review and meta-analysis. Br J Psychiatry. 2016; 209:385–392.

3. Meltzer HY, Alphs L, Green AI. Clozapine treatment for suicidality in schizophrenia: International Suicide Prevention Trial (InterSePT). Arch Gen Psychiatry. 2003; 60:82–91.

4. Citrome L, Volavka J. Specific anti-hostility effects of atypical antipsychotics in persons with schizophrenia: from clozapine to cariprazine. Harv Rev Psychiatry. 2021; 29:20–34.

5. Bachmann CJ, Aagaard L, Bernardo M. International trends in clozapine use: a study in 17 countries. Acta Psychiatr Scand. 2017; 136:37–51.

6. Kane J, Honigfeld G, Singer J. Clozapine for the treatment-resistant schizophrenic: a double-blind comparison with chlorpromazine. Arch Gen Psychiatry. 1988; 45:789–796.
7. de Leon J, Sanz EJ, Norén GN. Pneumonia may be more frequent and have more fatal outcomes with clozapine than with other second-generation antipsychotics. World Psychiatry. 2020; 19:120–121.

8. Rohde C, Siskind D, de Leon J. Antipsychotic medication exposure, clozapine, and pneumonia: results from a self-controlled study. Acta Psychiatr Scand. 2020; 142:78–86.

9. Villasante-Tezanos AG, Rohde C, Nielsen J. Pneumonia risk: approximately one-third is due to clozapine and two-thirds is due to treatment-resistant schizophrenia. Acta Psychiat Scand. 2020; 142:66–67.

10. Schoretsanitis G, Ruan CJ, Rohde C. An update on the complex relationship between clozapine and pneumonia. Expert Rev Clin Pharmacol. 2021; 24:1–5.

12. Papola D, Ostuzzi G, Gastaldon C. Antipsychotic use and risk of life- threatening medical events: umbrella review of observational studies. Acta Psychiatr Scand. 2019; 140:227–243.

13. Myles N, Myles H, Xia S. A meta-analysis of controlled studies comparing the association between clozapine and other antipsychotic medications and the development of neutropenia. Aust N Z J Psychiatry. 2019; 53:403–412.

14. Wiciński M, Węclewicz MM. Clozapine-induced agranulocytosis/granulocytopenia: mechanisms and monitoring. Curr Opin Hematol. 2018; 25:22–28.

15. Winckel K, Siskind D, Hollingworth S. Clozapine-induced myocarditis: separating the wheat from the chaff. Aust N Z J Psychiatry. 2015; 49:188.

16. Ronaldson KJ, Fitzgerald PB, Taylor AJ. A new monitoring protocol for clozapine-induced myocarditis based on an analysis of 75 cases and 94 controls. Aust NZ J Psychiatry. 2011; 45:458–465.

17. Ronaldson KJ, Fitzgerald PB, Taylor AJ. Rapid clozapine dose titration and concomitant sodium valproate increase the risk of myocarditis with clozapine: a case-control study. Schizophr Res. 2012; 141:173–178.

18. Shirazi A, Stubbs B, Gomez L. Prevalence and predictors of clozapine-associated constipation: a systematic review and meta-analysis. Int J Mol Sci. 2016; 17:863.

19. West S, Rowbotham D, Xiong G. Clozapine induced gastrointestinal hypomotility: a potentially life threatening adverse event. A review of the literature. Gen Hosp Psychiatry. 2017; 46:32–37.

21. de Leon J, Schoretsanitis G, Kane JM. Using therapeutic drug monitoring to personalize clozapine dosing in Asians. Asia Pac Psychiatry. 2020; 12:e12384.

22. Spina E, de Leon J. Clinically relevant interactions between newer antidepressants and second-generation antipsychotics. Expert Opin Drug Metab Toxicol. 2014; 10:721–746.

23. Pacia SV, Devinsky O. Clozapine-related seizures: experience with 5,629 patients. Neurology. 1994; 44:2247–2249.

24. Clancy MJ, Clarke MC, Connor DJ. The prevalence of psychosis in epilepsy; a systematic review and meta-analysis. BMC Psychiatry. 2014; 14:75.

25. Asenjo Lobos C, Komossa K, Rummel-Kluge C. Clozapine versus other atypical antipsychotics for schizophrenia. Cochrane Database Syst Rev. 2010; CD006633.

26. Trifirò G, Spina E. Age-related changes in pharmacodynamics: focus on drugs acting on central nervous and cardiovascular systems. Curr Drug Metab. 2011; 12:611–620.

27. Nielsen J, Correll CU, Manu P. Termination of clozapine treatment due to medical reasons: when is it warranted and how can it be avoided? J Clin Psychiatry. 2013; 74:603–613.
28. Sabaawi M, Singh NN, de Leon J. Guidelines for the use of clozapine in individuals with developmental disabilities. Res Dev Disabil. 2006; 27:309–336.

29. de Leon J, Ruan CJ, Schoretsanitis G. A rational use of clozapine based on adverse drug reactions, pharmacokinetics, and clinical pharmacopsychology. Psychother Psychosom. 2020; 89:200–204.

30. Bertilsson L, Carrillo JA, Dahl ML. Clozapine disposition covaries with CYP1A2 activity determined by a caffeine test. Br J Clin Pharmacol. 1994; 38:471–473.

31. Perry PJ, Bever KA, Arndt S. Relationship between patient variables and plasma clozapine concentrations: a dosing nomogram. Biol Psychiatry. 1998; 44:733–738.

32. de Leon J. Future studies on the interaction between clozapine and valproic acid should aspire to include longitudinal designs and free valproate concentrations, and should consider that inducer and/or inhibitory effects may vary with time, the individual, and the autoinduction of valproic acid. Ther Drug Monit. 2020; 42:159–161.

33. Clark SR, Warren NS, Kim G. Elevated clozapine levels associated with infection: a systematic review. Schizophr Res. 2018; 192:50–56.

34. Diaz FJ, Josiassen RC, de Leon J. The effect of body weight changes on total plasma clozapine concentrations determined by applying a statistical model to the data from a double-blind trial. J Clin Psychopharmacol. 2018; 38:442–446.

35. Ruan CJ, Zang YN, Cheng YH. Around 3% of 1,300 levels were elevated during infections in a retrospective review of 131 Beijing hospital in-patients with more than 24,000 days of clozapine treatment. Psychother Psychosom. 2020; 89:255–257.

36. Hiemke C, Bergemann N, Clement HW. Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: update 2017. Pharmacopsychiatry. 2018; 51:9–62.
37. de Leon J, Schoretsanitis G, Smith RL, Molden E, Solismaa A, Seppälä N, et al. An international adult guideline for making clozapine titration safer by using six ancestry-based personalized dosing titrations, CRP, and clozapine levels. Pharmacopsychiatry. 2022; 55:73–86.
38. de Leon J, Rhee DW, Kondracke A. Rapid titration and decreased clozapine clearance may help explain five cases of clozapine-induced myocarditis in a New York Hospital. Psychosomatics. 2020; 61:102–103.

39. Danilewitz M, Rafizadeh R, Bousman CA. Successful clozapine rechallenge after suspected clozapine-associated myocarditis: a case report. J Clin Psychopharmacol. 2021; 41:218–220.

40. Verdoux H, Quiles C, de Leon J. Clinical determinants of fever in clozapine users and implications for treatment management: a narrative review. Schizophr Res. 2019; 211:1–9.

41. Schoretsanitis G, Kane JM, Correll CU. Blood levels to optimize antipsychotic treatment in clinical practice: a joint consensus statement of the American Society of Clinical Psychopharmacology and the Therapeutic Drug Monitoring Task Force of the Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie. J Clin Psychiatry. 2020; 81:19. cs13169.
42. Williams RL. FDA position on product selection for “narrow therapeutic index” drugs. Am J Health Syst Pharm. 1997; 54:1630–1632.

43. Spina E, Hiemke C, de Leon J. Assessing drug-drug interactions through therapeutic drug monitoring when administering oral second-generation antipsychotics. Expert Opin Drug Metab Toxicol. 2016; 12:407–422.

44. Cohen D, Bogers JP, van Dijk D. Beyond white blood cell monitoring: screening in the initial phase of clozapine therapy. J Clin Psychiatry. 2012; 73:1307–1312.
45. de Leon J, Sanz EJ, De Las Cuevas C. Data from the World Health Organization’s pharmacovigilance database supports the prominent role of pneumonia in mortality associated with clozapine adverse drug reactions. Schizophr Bull. 2020; 46:1–3.

46. Rohde C, Polcwiartek C, Kragholm K. Adverse cardiac events in out-patients initiating clozapine treatment: a nationwide register-based study. Acta Psychiatr Scand. 2018; 137:47–53.

47. Ifteni P, Correll CU, Nielsen J. Rapid clozapine titration in treatment-refractory bipolar disorder. J Affect Disord. 2014; 166:168–172.

48. Sherwood M, Thornton AE, Honer WG. A quantitative review of the profile and time course of symptom change in schizophrenia treated with clozapine. Journal of Psychopharmacology. 2012; 26:1175–1184.

49. Kim SH. Current status of clozapine for treatment-resistant schizophrenia. Korean Journal of Schizophrenia Research. 2021; 24:1–7.

50. Kim CE, Lee YH, Lee KH, Kang MH. Clozapine dosage and blood concentrations of Korean adult schizophrenic patients. Journal of Korean Neuropsychiatric Association. 2001; 109–117.
Fig. 1.
Changes in Clozapine Dosage, C-reactive Protein (CRP) Levels, and Fever in Case 1 Patient. This graph represents the dosage of clozapine administered to the patient and the corresponding levels of C-reactive protein (CRP) from the initial day of hospitalization to the first outpatient visit following discharge. The solid line represents the dosage of clozapine, while the dotted line represents the CRP levels. The gray rectangles indicate the days on which fever with a temperature of 37.5ºC or higher was observed at least once.
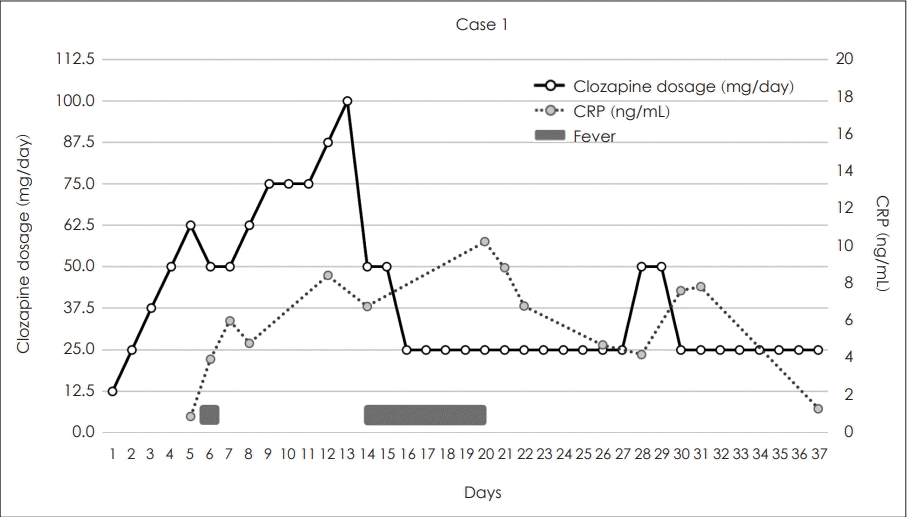
Fig. 2.
Changes in Clozapine Dosage, C-reactive Protein (CRP) Levels, and Fever in Case 2 Patient. This graph represents the dosage of clozapine administered to the patient and the corresponding levels of C-reactive protein (CRP). The solid line represents the dosage of clozapine, while the dotted line represents the CRP levels. The gray rectangles indicate the days on which the patient experienced fever with a temperature of 37.5ºC or higher on one or more occasions. The timeline is divided into three periods: the first hospitalization (A), the period between discharge and the second hospitalization (B), and the second hospitalization (C).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download