요 약
배경
최근 백혈구 감별계산에서 수기법의 단점을 보완하기 위해 디지털 세포형태 분석기의 사용이 증가하고 있다. 본 연구에서는 백혈구감소증이 있는 검체들을 대상으로 새로 개발된 디지털 세포형태 분석기인 UIMD PBIA (ANI CO., Korea)의 성능을 평가하였다.
방법
백혈구감소증이 있는 총 159건의 검체를 백혈구감소증의 정도에 따라 4개의 그룹으로 나누었다(그룹 1: 백혈구 ≤1.0×109/L, 그룹 2: 1.0–2.0×109/L, 그룹 3: 2.0–3.0×109/L, 그룹 4: 3.0–4.0×109/L). 검체에서 얻은 23,358개의 백혈구 세포 이미지를 이용하여 UIMD PBIA의 정확도와 처리속도를 분석하고 비교하였다.
Abstract
Background
Recently, digital morphology analyzer use to compensate for the disadvantages of manual counting in white blood cell (WBC) differentials is increasing. In this study, we evaluated the accuracy and throughput of UIMD PBIA (ANI CO., Korea), a newly developed digital morphology analyzer, in samples from patients with leukopenia.
Methods
A total of 159 samples from patients with leukopenia were divided into four groups according to the degree of leukopenia (group 1: WBC ≤1.0×109/L, group 2: 1.0–2.0×109/L, group 3: 2.0–3.0×109/L, group 4: 3.0–4.0×109/L). We analyzed and compared the accuracy and throughput of UIMD PBIA using 23,358 WBC images obtained from the samples.
Results
UIMD PBIA was 97.5% accurate in all samples and over 90% accurate in cell types except abnormal lymphocytes. Blasts showed a statistically significant correlation (r> 0.7) between manual count and UIMD PBIA. When both experts counted more than 1% blasts or immature granulocytes, the UIMD PBIA showed 100% positive agreement with the manual count. The turnaround time of UIMD PBIA was shorter than that of manual count in groups 1 and 2 compared to that in groups 3 and 4.
Conclusions
Although some areas in abnormal cell misclassification need to be improved, UIMD PBIA provides quick and accurate results for WBC differentials in samples from patients with leukopenia. If applied selectively according to the WBC count and patient diagnosis, UIMD PBIA could be useful in clinical practice.
백혈구감소증은 백혈구수가 참고범위보다 낮은 것을 말하며, 항암제 등의 약물, 바이러스 감염, 급성백혈병이나 골수형성이상증후군 같은 혈액암의 진단 및 치료 과정에서 종종 동반된다[1]. 백혈구감소증이 있는 말초혈액도말에서 모세포나 미성숙 과립구(immature granulocyte) 같은 비정상세포를 찾는 것은 백혈구수가 정상이거나 증가한 검체에 비해 상대적으로 더 많은 시간과 노력이 필요하다. Clinical and Laboratory Standards Institute (CLSI) 가이드라인에서는 수기법으로 백혈구 감별계산을 시행할 때, 두 명의 숙련된 검사자들이 현미경 렌즈 1,000배 시야에서 200개의 세포를 세는 것을 권장하고 있다[2]. 하지만 판독 시간이 오래 걸리고 노동력도 많이 소모되며, 검사자의 주관적인 판단이 관여할 수 있기 때문에 정도관리를 일정하게 유지하기 위한 주기적인 교육 및 점검이 필요하다. 이러한 단점을 극복하고 보다 빠른 시간 내에 효율적인 백혈구 감별계산을 위해 고배율 렌즈로 카메라에 포착된 세포의 감별계산 및 형태 분석을 수행하는 디지털 세포형태 분석기가 출시되었으며, CellaVision DM96 (CellaVision AB, Lund, Sweden), Sysmex DI-60 (Sysmex, Kobe, Japan), UIMD PBIA (ANI CO., Suwon, Korea) 등이 국내 혈액검사실에서 활용되고 있다[3-5].
그중 최근 국내에서 개발된 UIMD PBIA는 혈액학에 특화된 인공지능 기술을 이용한 알고리즘을 통해 말초혈액도말의 세포를 분석하여 백혈구 감별계산, 적혈구 및 혈소판 형태정보 등을 제공한다[3]. 특히 기존 디지털 세포형태 이미지 분석기들과 달리 기관별 수집된 분석자료를 토대로 학습을 통해 감별계산 성능을 향상시킬 수 있다[3]. 전체혈구계산(complete blood count, CBC)에서 주로 관찰되는 5가지 세포 감별계산의 경우 기존 디지털 세포형태 분석기들보다 높은 정확도를 보였다[3, 4, 6-9]. 또한 타 장비와 달리 비정상 림프구 감별이 가능하며 미성숙 과립구의 세포 감별 정확도도 높은 것으로 보고되었다[3].
기존 디지털 세포형태 분석기 평가는 주로 정상 검체 및 이상 소견이 있는 검체를 대상으로 수기법과 비교하여 얼마나 신뢰성 있는 백혈구 감별계산 결과를 제공하는가에 집중하였다[3, 4, 6, 8-12]. 백혈구감소증 검체는 감별계산을 위해 말초혈액도말을 이용한 수기법 관찰이 필수이기 때문에 디지털 세포형태 분석기 평가 시 반드시 포함되어야 한다. 그러나 기존 평가에서 백혈구감소증 검체는 이상 소견이 있는 검체 중 일부 범혈구감소증에 포함되어 평가된 경우가 대부분이었다[4, 9, 13-16]. 최근 Yoon 등이 백혈구 수가 감소된 검체를 대상으로 Sysmex DI-60의 세포 감별 정확성에 대한 예비평가를 보고한 바 있다[17].
본 연구에서는 백혈구수가 감소된 검체를 백혈구수 감소 정도에 따라 4개의 그룹으로 세분화하여 백혈구 감별계산의 표준 검사법인 수기법과 비교하여 UIMD PBIA의 백혈구 감별계산 정확도 및 처리속도를 평가하고자 하였다.
2023년 6월 26일부터 7월 7일까지 인제대학교 부산백병원 진단검사의학과에 CBC가 의뢰된 검체 중 총 백혈구수 4.0×109/L 미만인 검체를 백혈구수에 따라 다음과 같이 4개의 그룹으로 분류하여 그룹별 40개 수집을 목표로 하여 슬라이드를 수집하였으며, 총 159개를 대상으로 하였다; 그룹 1: WBC 1.0×109/L 이하, 44 검체, 그룹 2: WBC 1.0×109/L 초과–2.0×109/L 이하, 38 검체, 그룹 3: WBC 2.0×109/L 초과–3.0×109/L 이하, 38 검체, 그룹 4: WBC 3.0×109/L 초과–4.0×109/L 미만, 39 검체. 고형암 환자의 검체(N=60), 급성골수백혈병 환자의 검체(N=24), 비호지킨림프종 환자의 검체(N=20), 골수형성이상증후군 환자의 검체(N=19), 다발성 골수종 환자의 검체(N=10), 재생불량빈혈 환자의 검체(N=5) 및 장기 이식 및 감염 등의 기타 질환을 가진 환자의 검체(N=21)가 포함되었다.
검체는 K2EDTA 항응고제가 첨가된 진공채혈관(Becton Dickinson, USA)에 채혈한 전혈을 이용하였으며, Sysmex SP-50 (Sysmex, Kobe, Japan)을 이용하여 말초혈액도말 및 Wright Giemsa 염색을 시행하였다. CBC는 Sysmex XN-9100 (Sysmex, Kobe, Japan)을 이용하였다.
본 연구는 CBC 및 말초혈액도말검사 후 잔여 검체 사용을 거부하지 않은 환자의 슬라이드를 이용하였으며 인제대학교 부산백병원 IRB 승인(2022-09-005)을 받았다.
UIMD PBIA는 백혈구를 다음과 같은 13가지 종류로 사전분류(pre-classification)하였다: 중성구, 림프구, 단핵구, 호산구, 호염기구, 모세포, 반응림프구, 비정상 림프구, 전골수구, 골수구, 후골수구, 형질세포, 유핵적혈구. 사전분류 후 검정(verification) 작업은 UIMD PBIA의 소프트웨어에서 진행되었고 화면에서 두 명의 검사자가 이미지를 확인하여 직접 재분류를 시행하였다. 백혈구의 절대치와 백분율이 최종 결과로 표시되며, 유핵적혈구와 인공물(artifact)은 따로 계수되었다.
수기법은 CLSI H20-A2 가이드라인에 따라 두 명의 숙련된 검사자가 현미경 검경을 시행하였다[2]. 그러나 백혈구수가 적은 검체를 대상으로 하였기 때문에 200배 시야로 슬라이드당 100개의 세포를 계수하였으며, 필요시 정확한 형태 판별을 위해 1,000배 시야에서 세포 형태를 확인하는 과정을 거쳐 두 검사자의 평균값을 이용하였다. UIMD PBIA도 100개 계수를 목표로 하여 평가하였다.
비정형림프구를 분류할 때 다우니 유형(Downey type)을 이용하여 반응림프구와 비정상 림프구로 나누었다[18]. 콩팥 모양의 핵과 거품 같은(foamy) 호염기세포질을 가진 다우니 유형 1 림프구와 그보다 조금 덜 성숙한 모양이며 형질세포양 핵을 지닌 다우니 유형 2 림프구를 반응림프구로 분류하였다. 다우니 유형 3 림프구는 고운 염색질(fine chromatin) 형태의 세포질과 1–2개의 핵소체를 지닌 면역모세포로 이를 비정상 림프구로 분류하였다. 반응림프구는 그 수가 적어 림프구에 합쳤고, 전골수구, 골수구 및 후골수구는 미성숙 과립구로 합쳐 비교하였다.
처리속도는 UIMD PBIA에서 슬라이드 하나당 백혈구 감별시간을 재었고, 수기법에서는 현미경에 슬라이드를 장착하여 백혈구 감별계산 후 기록까지의 시간을 재어 비교하였다.
검사 결과는 전체 검체 및 백혈구수에 따른 각 그룹별로 분류하여 비교하였다. 정확도를 평가하기 위해 전체 백혈구가 UIMD PBIA에서 사전분류 후 검정 과정에서 어느 분류로 얼마나 이동하였는지 표시하였고, 민감도, 특이도, 양성예측도, 음성예측도 및 일치율은 이동한 개수를 정확하게 계산하기 위해 인공산물도 전체값에 포함하여 분석하였다.
각 그룹별로 사전분류, 검정 및 수기법 간 상관 분석을 시행하여 상관계수를 구하였다. 백혈구감소증이 있는 검체의 경우 데이터분석 시에 낮은 값의 차이가 상쇄될 수 있어 International Council for Standardization in Hematology (ICSH) 가이드라인에서는 Bland–Altman plot 또는 평균차(mean difference)를 제시하도록 하고 있다[19]. 본 연구에서도 상관계수와 함께 paired samples ttest를 이용하여 평균차를 계산하였다. UIMD PBIA와 수기법에서 전체 백혈구수가 낮아 100개의 세포를 정확하게 계수하지 못한 경우, 백분율로 계산하여 분석하였다.
통계 및 분석은 Microsoft Excel Software (version 2016; Microsoft Corporation, Redmond, WA, USA) 및 MedCalc Statistical Software (version 22.016; MedCalc Software, Ostend, Belgium)를 이용하였고 양측검정 P 값이 0.05 미만인 경우 통계적으로 유효한 것으로 간주하였다.
UIMD PBIA가 슬라이드당 100개의 세포를 감별계산하도록 하였을 때, 전체 159 검체의 계수 중앙값은 101개였다. 100개 이상 계수가 불가능했던 슬라이드는 38개로, 그중 31개의 슬라이드가 백혈구수 1.0×109/L 이하인 그룹 1이었으며, UIMD PBIA는 그룹 1에서 평균 77.5개(범위, 21–101)의 세포를 세었다. 수기법에서는 그룹 1 슬라이드 4개를 제외하고 모두 100개 계수가 가능했다(Table 1).
UIMD PBIA의 사전분류 성능을 확인하기 위해 사전분류 및 검정 후의 결과를 비교하였다(Table 2). UIMD PBIA에서 사전분류를 진행한 23,358개의 세포 중 22,767개가 일치하여 전체 정확도는 97.5%였고, 비정상 림프구를 제외한 모든 세포군에서 90% 이상의 높은 정확도와 민감도를 보였다. 양성예측도는 미성숙 과립구, 모세포, 형질세포 및 비정상 림프구에서 다른 세포군보다 낮은 수치를 보였는데, 사전분류 단계에서 해당 세포로 분류오류가 생기는 경우가 많았다. 하지만 특이도, 음성예측도 및 일치율은 모든 세포군에서 98% 이상이었다(Table 3).
전체 검체를 대상으로 사전분류 결과와 검정 결과 간 평균차의 절대값은 0.05에서 3.41까지, 사전분류 결과와 수기법 간 평균차의 절대값은 0.06에서 1.91까지, 검정 결과와 수기법의 경우 평균차의 절대값이 0.01에서 2.80까지 분포하였다(Table 4). 그룹별로 비교해보면 그룹 1 및 그룹 2에서 사전분류와 검정 결과 간 평균차의 절대값이 각각 0.00에서 4.27, 0.00에서 4.63까지 분포하여 나머지 그룹들에 비해 컸으며, 그룹 1에서는 림프구, 모세포, 미성숙 과립구 및 중성구, 그룹 2에서는 림프구, 단구 및 모세포에서 다른 세포들보다 상대적으로 큰 평균차의 절대값을 보였다. UIMD PBIA 결과(사전분류 및 검정 후)와 수기법 간의 평균차의 절대값도 그룹 1에서 각각 0.06-3.86, 0.00-6.36로 나머지 그룹에 비해 컸다.
전 검체에서 UIMD PBIA 사전분류와 수기법 결과에 대한 상관분석을 시행하였을 때, 정상 CBC 감별계산에서 주로 관찰되는 세포군 5종(중성구, 림프구, 단구, 호산구 및 호염기구) 중 호염기구를 제외한 나머지 세포들은 대체적으로 높은 수치의 상관 계수(r≥0.7)를 보였다(Table 4). 백혈구 감소 정도에 따라 그룹별로 상관 분석을 시행했을 때 백혈구수 1.0×109/L 이하인 그룹 1에서 단구의 상관계수가 0.7 미만으로 낮았으나, 백혈구수 1.0×109/L 초과하는 다른 그룹들에서 호염기구를 제외하고 모두 0.7 이상의 상관계수를 보였다. 임상적으로 중요한 모세포 및 미성숙과립구의 경우 그룹 1에서 주로 관찰되었는데 수기법과 비교하였을 때 UIMD PBIA 사전분류보다 검정 후 상대적으로 높은 상관계수를 보였다. UIMD PBIA 사전분류와 수기법 결과에 대한 상관 분석에서 모세포만 0.8 이상의 높은 상관계수를 보였다(Fig. 1).
수기법을 기준으로 하였을 때, 그룹 1의 16검체, 그룹 2의 1검체에서 모세포가 검출되었다. 수기법으로 두 명의 검사자가 둘 다 모세포를 1% 초과하여 관찰한 경우를 모세포 양성 기준치로 하였을 때 수기법에서 모세포 양성 검체 10개의 UIMD PBIA 사전분류 결과와 모세포 양성일치율은 100%였다. 나머지 7검체는 한 명 혹은 두 명의 검사자에서 모세포가 1%만 관찰되었으며 이때 수기법과 UIMD PBIA의 모세포 양성 결과는 3검체에서만 일치하였다. 미성숙 과립구의 경우 두 명의 검사자가 모두 1%를 초과하여 관찰한 미성숙 과립구 양성 검체는 11개였으며 이 역시 UIMD PBIA 사전분류의 양성 결과와 100% 일치하였다. 한 명 혹은 두 명의 검사자에서 미성숙 과립구가 1%만 관찰된 검체 62개의 UIMD PBIA 결과와 미성숙 과립구 양성일치율은 66.1% (41/62)였다.
백혈구수 1.0×109/L 이하인 그룹 1에서 수기법과 UIMD PBIA 모두 슬라이드당 소요시간이 다른 그룹들과 비교했을 때 가장 길었으며, 수기법이 디지털 세포형태 분석기에 비해 슬라이드당 백혈구 감별계산 소요시간이 2배 이상 길었다(Table 5). 그러나 수기법과 UIMD PBIA 간의 백혈구 감별계산 소요시간 차이는 그룹 1에 비해 그룹 2에서 많이 줄었으며, 그룹 3과 4에서는 수기법과 UIMD PBIA의 백혈구 감별계산 소요시간 차이가 20초 미만으로 수기법이 좀 더 빠르게 검체를 처리할 수 있었다.
본 연구에서 우리는 백혈구수가 감소된 범위를 좀 더 세분화하고, 그룹별 검체 수를 늘려서 디지털 세포형태 분석기 평가를 진행하였다. 백혈구감소증이 있는 전체 검체에서 UIMD PBIA의 정확도는 97.5%로 동일 장비를 이용한 다른 연구의 결과[3]와 비슷하였고, 인공물을 제외하더라도 전체 15,600 세포 중 15,056 세포를 올바르게 감별해 96.5%의 정확도를 보였다. UIMD PBIA를 이용한 이전 연구와 비슷하게 비정상 림프구가 사전분류 단계에서 잘못 분류되는 경우가 가장 많았다[3]. 본 연구에서 검정 결과 비정상 림프구로 분류된 38 세포 중 2개의 세포만 사전분류 결과와 일치하였으며 나머지 세포들은 UIMD PBIA가 사전분류 단계에서 단구, 형질세포, 림프구 및 모세포 등으로 잘못 분류하였다. 말초혈액도말에서 비정상 림프구 감별은 Epstein-Barr virus 같은 바이러스감염 및 림프종 등 질환을 진단하는 데 중요하다. UIMD PBIA 활용도를 높이기 위해 검사자와 장비 간 비정상 림프구 감별의 일치율을 향상시킬 수 있는 지속적인 학습 및 데이터 수집이 필요하겠다.
본 연구에서 UIMD PBIA가 시행한 백혈구감소증 검체 감별계산의 전체적인 민감도, 특이도 및 양성예측도는 Sysmex DI-60를 이용한 기존 평가보다 높았다. Sysmex DI-60의 경우 중성구, 림프구, 호염기구, 모세포 및 유핵적혈구에서 전체적으로 높은 민감도(86.5–95.8%)를 보였지만, 단구, 호산구 및 미성숙 과립구에서는 상대적으로 낮은 민감도(52.6–60.0%)를 보였다[17]. 이에 비해 UIMD PBIA는 비정상 림프구를 제외한 모든 세포군에서 90% 이상의 높은 민감도를 보였다. 미성숙 과립구 및 모세포의 경우 다른 세포들에 비해 양성예측도가 낮았지만 Sysmex DI-60을 이용한 기존 연구에서 보고된 이들 세포의 양성예측도에 비하면 높은 수치였다. 그러나 본 연구보다 적은 수의 백혈구감소증이 있는 검체를 대상으로 연구한 결과이기 때문에 이 결과만으로 UIMD PBIA의 성능이 Sysmex DI-60보다 뛰어나다고 단정할 수는 없다.
ICSH 가이드라인에 따르면 디지털 세포형태 분석기를 사용하는 경우, 숙련된 검사자가 사전분류 결과를 꼭 재검토하고, 필요시 재분류하는 검정 과정을 거치도록 권고하고 있다[13]. 특히 본 연구처럼 백혈구감소증이 있는 검체의 사전분류에서 미성숙 과립구, 모세포 및 비정상 림프구가 검출될 경우, 검정 과정이 반드시 필요하겠다.
본 연구에서 백혈구수가 낮은 그룹일수록 UIMD PBIA와 수기법의 평균차 절대값이 컸는데, 감별계산 시 주로 관찰되는 5개 주요 세포군의 경우 림프구 및 단구에서 평균차 절대값이 컸으며, 비정상 세포군의 경우 모세포 및 미성숙 과립구가 상대적으로 더 큰 평균차 절대값을 보였다. 본 평가에 고형암 및 혈액암 환자의 검체가 다수를 차지하며 항암치료 등으로 인한 림프구 및 단구의 세포형태 변화로 UIMD PBIA와 수기법의 결과 차이가 관찰된 것으로 판단한다. 모세포 및 미성숙 과립구의 경우 수기법에 비해 UIMD PBIA에서 더 많이 계수하는 경향이 있었다. 하지만 검정 후 수기법과 비교 시 평균차는 감소하였다.
백혈구가 감소된 검체에서 모세포 및 미성숙 과립구를 정확하게 검출하는 것은 급성백혈병 등 혈액암을 조기 진단하는데 중요하기 때문에 디지털 세포형태 분석기 평가 시 위음성율 및 수기법과 일치율 확인이 필요하다[5]. 본 평가에서 수기법으로 두 명의 검사자 중 한 명만 1개의 모세포를 관찰하거나 두 명 모두 1%의 모세포를 관찰한 경우 UIMD PBIA와 모세포 양성일치율은 감소하였다. 디지털 세포형태 분석기도 백혈구수가 낮거나 모세포 비율이 1% 이하로 낮을 경우 모세포를 놓칠 수 있기 때문에 이럴 경우 설정된 총 감별계산 세포수를 증가시키는 것이 정확도를 높이는 해결책이 될 수 있다[5]. 총 감별계산 세포수를 300–500개로 늘렸을 때 모세포 및 미성숙 과립구 검출 능력이 향상된다는 보고가 있다[6]. 미성숙 과립구의 경우 이전 연구[6]에서 수기법과 디지털 세포 형태 분석기의 양성일치율 비교를 위해 양성기준치를 3% 초과로 하였으나 본 연구에서는 모세포와 동일하게 양성기준치 1% 초과로 정하여도 모세포와 동일하게 100% 양성일치율을 보였다.
디지털 세포형태 분석기 처리속도의 경우 이전 연구에서 UIMD PBIA가 슬라이드당 소모하는 시간은 평균 85.16초였으며, 범혈구 감소증이 있는 검체는 124.04초였다[3]. 본 연구의 평균 소요시간은 135.02초로 동일장비를 이용한 이전 보고[3]보다 약간 길게 측정되었다. Sysmex DI-60은 백혈구감소증이 있는 40 검체를 대상으로 200개의 백혈구를 감별하였으며, 슬라이드를 장비에 장착하는 순간부터 검정을 완료하는 시간까지 포함하여 백혈구 감별계산 처리 시간을 재었을 때, 슬라이드당 300초가 소모되었다[20]. Sysmex DI-60을 이용한 백혈구감소증 검체를 대상으로 한 평가[20]와 같이 본 연구에서도 백혈구수가 낮을수록 수기법에 비해 디지털 세포형태 분석기의 백혈구 감별계산 소요시간이 짧았다. 본 연구 결과를 바탕으로 그룹 3, 4보다 백혈구감소가 심한 그룹 1, 2에서 UIMD PBIA 사용 시 검사자의 노동 강도를 낮추고 업무 효율을 높이는 데 도움이 될 것으로 판단된다. 그러나 백혈구수가 1.0×109/L 이하로 심하게 감소된 그룹에서 디지털 세포형태 분석기가 목표로 정해 둔 세포수까지 세지 못하는 경우들이 있기 때문에 주의가 필요하겠다.
본 논문은 몇 가지 한계점이 있다. 첫째, 본 평가를 위해 슬라이드를 모으는 과정에서 잔여 검체 사용에 동의하지 않은 환자들이 포함되어 결과 분석 시에 일부 배제하였다. 이로 인해 그룹별 검체 수가 1–4개 정도 차이를 보였으며, 그룹별로 완벽히 동등한 조건의 비교를 할 수 없었다. 둘째, 수기법으로 백혈구 감별계산 시 CLSI 가이드라인 기준을 따르지 못하였으며 일부 백혈구수 1.0×109/L 이하인 검체에서는 두 검사자 간의 소요시간 차이가 발생하였고, 100개를 계수하지 못하는 슬라이드도 일부 있었다. 셋째, 민감도, 특이도 및 양성예측도 계산에서 인공물로 재분류되거나, 인공물에서 백혈구로 재분류되는 것들은 제외할 수 없어 인공물도 전체 세포 계산에 포함시켰다. 사전분류에서 인공물은 주로 깨진 백혈구 및 Wright Giemsa 염색 잔류물 등이었으나 일부 검정 단계에서 림프구, 단구 및 모세포로 분류되어 주의가 필요하다. 마지막으로 처리속도 계산 시에 UIMD PBIA는 다른 디지털 세포형태 분석기와 달리 전체 처리 시간을 세분화할 수 없었으며, 본 연구 수행 시검정 시간은 포함하지 않아 이전 연구[20]와 동등한 조건의 비교를 할 수 없었다.
본 연구에서 UIMD PBIA는 백혈구감소증이 있는 검체에서 백혈구 감별계산 시 높은 정확도를 보였으며 대부분의 세포군에서 높은 민감도 및 특이도를 보였다. UIMD PBIA의 처리속도는 백혈구 수가 정상보다 약간 낮은 검체에서는 수기법과 비슷하며, 특히 백혈구수가 2.0×109/L 이하인 검체에서 수기법보다 상대적으로 빨라 수기법을 대체하여 이용 가능할 것으로 판단된다. 하지만 백혈구수 1.0×109/L 이하로 심한 백혈구감소증을 보이는 검체에서 설정된 목표 세포수를 계수하지 못할 수 있어 목표치를 변경하거나 모세포 검출이 의심되는 환자의 경우 수기법을 통한 추가 확인이 필요하다. 또한 사전분류에서 미성숙 과립구, 모세포 및 비정상 림프구로 감별된 세포들은 반드시 검정 과정을 거쳐 보고해야 한다. 결론적으로 UIMD PBIA는 백혈구감소증이 있는 검체에서 백혈구 감별계산 시 총 백혈구수 및 환자의 진단명에 따라 수기법과 적절히 혼용하여 사용한다면 유용하게 이용할 수 있을 것이다.
REFERENCES
1. Nasr MR, Hutchinson RE, editors. 2021. Henry's clinical diagnosis and management by laboratory methods. 24th ed. Elsevier;Philadelphia, PA: p. 636–88.
2. Clinical, Laboratory Standards Institute (CLSI). 2007. Reference leukocyte (WBC) differential count (proportional) and evaluation of instrumental methods; approved standard-second edition. Clinical and Laboratory Standards Institute;Wayne, PA: CLSI document H20-A2.
3. Lee JM, Kim M, Han K, Kim Y. 2023; Evaluation of a digital image analyzer UIMD PBIA for determining white blood cell differential count. Lab Med Online. 13:7–12. DOI: 10.47429/lmo.2023.13.1.7.
4. Kim HN, Hur M, Kim H, Kim SW, Moon HW, Yun YM. 2017; Performance of automated digital cell imaging analyzer Sysmex DI-60. Clin Chem Lab Med. 56:94–102. DOI: 10.1515/cclm-2017-0132.
5. Park SH, Park CJ, Choi MO, Kim MJ, Cho YU, Jang S, et al. 2013; Automated digital cell morphology identification system (CellaVision DM96) is very useful for leukocyte differentials in specimens with qualitative or quantitative abnormalities. Int J Lab Hematol. 35:517–27. DOI: 10.1111/ijlh.12044. PMID: 23286314.
6. Kratz A, Bengtsson HI, Casey JE, Keefe JM, Beatrice GH, Grzybek DY, et al. 2005; Performance evaluation of the CellaVision DM96 system: WBC differentials by automated digital image analysis supported by an artificial neural network. Am J Clin Pathol. 124:770–81. DOI: 10.1309/XMB9K0J41LHLATAY. PMID: 16203273.
7. Ceelie H, Dinkelaar RB, van Gelder W. 2007; Examination of peripheral blood films using automated microscopy; evaluation of Diffmaster Octavia and Cellavision DM96. J Clin Pathol. 60:72–9. DOI: 10.1136/jcp.2005.035402. PMID: 16698955. PMCID: PMC1860603.
8. Briggs C, Longair I, Slavik M, Thwaite K, Mills R, Thavaraja V, et al. 2009; Can automated blood film analysis replace the manual differential? An evaluation of the CellaVision DM96 automated image analysis system. Int J Lab Hematol. 31:48–60. DOI: 10.1111/j.1751-553X.2007.01002.x.
9. Tabe Y, Yamamoto T, Maenou I, Nakai R, Idei M, Horii T, et al. 2015; Performance evaluation of the digital cell imaging analyzer DI-60 integrated into the fully automated Sysmex XN hematology analyzer system. Clin Chem Lab Med. 53:281–9. DOI: 10.1515/cclm-2014-0445.
10. Da Costa L. 2015; Digital image analysis of blood cells. Clin Lab Med. 35:105–22. DOI: 10.1016/j.cll.2014.10.005.
11. Stouten K, Riedl JA, Levin MD, van Gelder W. 2015; Examination of peripheral blood smears: performance evaluation of a digital microscope system using a large-scale leukocyte database. Int J Lab Hematol. 37:e137–40. DOI: 10.1111/ijlh.12391. PMID: 26059017.
12. Kratz A, Lee SH, Zini G, Riedl JA, Hur M, Machin S. International Council for Standardization in Haematology. 2019; Digital morphology analyzers in hematology: ICSH review and recommendations. Int J Lab Hematol. 41:437–47. DOI: 10.1111/ijlh.13042. PMID: 31046197.
13. Yu H, Ok CY, Hesse A, Nordell P, Connor D, Sjostedt E, et al. 2012; Evaluation of an automated digital imaging system, Nextslide Digital Review Network, for examination of peripheral blood smears. Arch Pathol Lab Med. 136:660–7. DOI: 10.5858/arpa.2011-0285-OA.
14. La Gioia A, Fiorini F, Fumi M, Fiorini M, Pancione Y, Rocco L, et al. 2017; A prolonged microscopic observation improves detection of underpopulated cells in peripheral blood smears. Ann Hematol. 96:1749–54. DOI: 10.1007/s00277-017-3073-z. PMID: 28752394.
15. Da Rin G, Benegiamo A, Di Fabio AM, Dima F, Francione S, Fanelli A, et al. 2021; Multicentric evaluation of analytical performances digital morphology with respect to the reference methods by manual optical microscopy. J Clin Pathol. 74:377–85. DOI: 10.1136/jclinpath-2020-206857.
16. Yoon S, Hur M, Park M, Kim H, Kim SW, Lee TH, et al. 2021; Performance of digital morphology analyzer Vision Pro on white blood cell differentials. Clin Chem Lab Med. 59:1099–106. DOI: 10.1515/cclm-2020-1701. PMID: 33470955.
17. Yoon S, Hur M, Lee GH, Nam M, Kim H. 2021; How reproducible is the data from Sysmex DI-60 in leukopenic samples? Diagnostics (Basel). 11:2173. DOI: 10.3390/diagnostics11122173. PMID: 34943409. PMCID: PMC8700691. PMID: c5f5c7b4abc340129d52233289a41340.
18. Downey H, McKinlay CA. 1923; Acute lymphadenosis compared with acute lymphatic leukemia. Arch Intern Med (Chic). 32:82–112. DOI: 10.1001/archinte.1923.00110190085006.
19. Briggs C, Culp N, Davis B, Zini G, d'Onofrio G, Machin SJ. International Council for Standardization in Haematology (ICSH), Writing Group. 2014; ICSH guidelines for the evaluation of blood cell analysers including those used for differential leucocyte and reticulocyte counting. Int J Lab Hematol. 36:613–27. DOI: 10.1111/ijlh.12201. PMID: 24666725.
20. Nam M, Yoon S, Hur M, Lee GH, Kim H, Park M, et al. 2022; Digital morphology analyzer Sysmex DI-60 vs. manual counting for white blood cell differentials in leukopenic samples: a comparative assessment of risk and turnaround time. Ann Lab Med. 42:398–405. DOI: 10.3343/alm.2022.42.4.398. PMID: 35177560. PMCID: PMC8859564.
Fig. 1
Comparison of differential cell categories between UIMD PBIA and manual count in group 1 (WBC ≤1.0×109/L). Passing–Bablok regression analysis for immature granulocyte count between UIMD PBIA [(A) pre-classification, (B) verification] and manual count as well as blast count between UIMD PBIA [(C) pre-classification, (D) verification] and manual count. Solid line, Passing–Bablok regression; dashed line, 95% CI line. Abbreviations: CI, confidence interval.
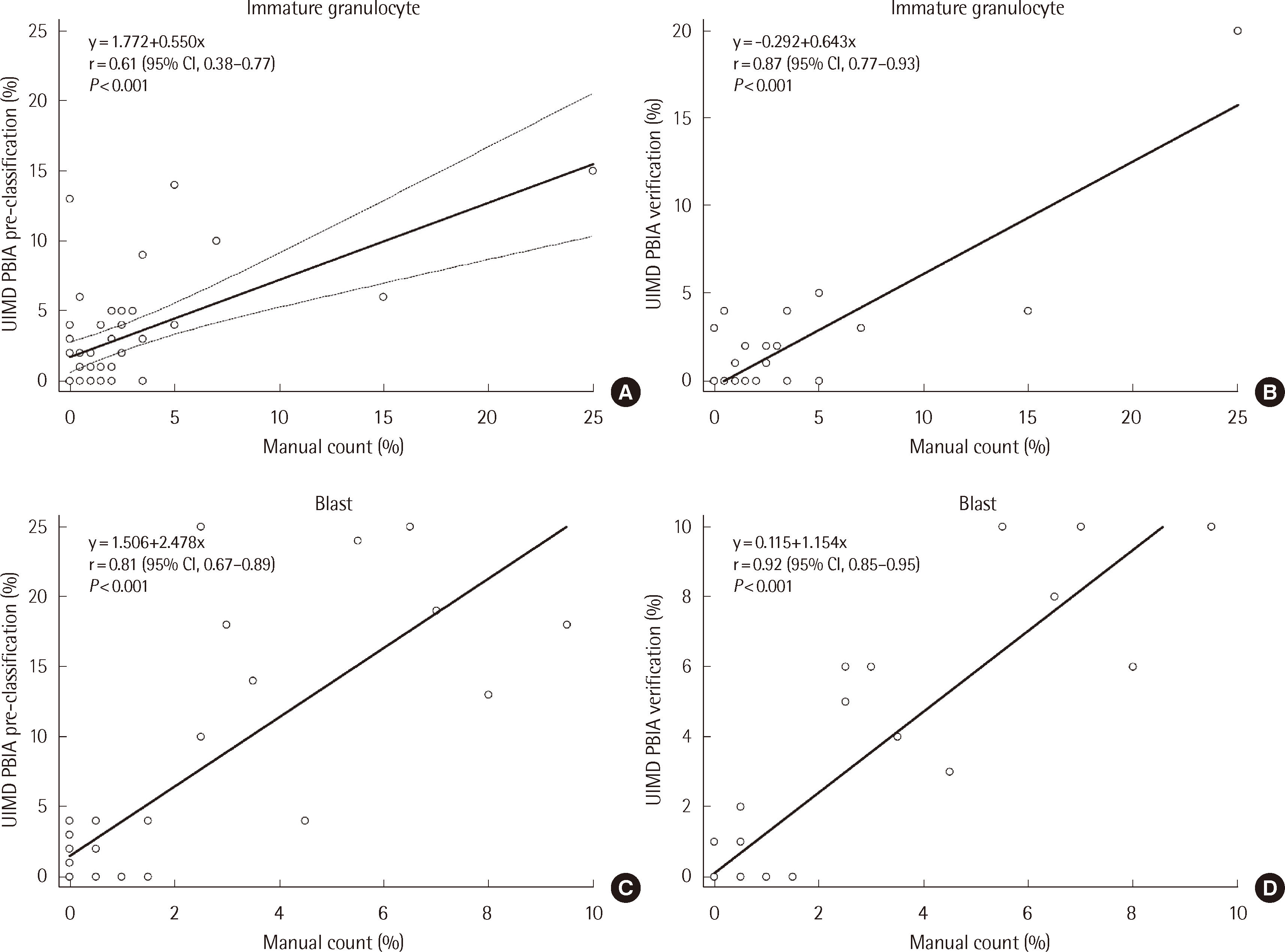
Table 1
Study population and counted cells per slide of samples by UIMD PBIA and manual count
Table 2
Details of pre- and post-classification by UIMD PBIA
Table 3
Performance of pre-classification by UIMD PBIA based on verification
Table 4
Comparison of WBC differential counts between UIMD PBIA and manual count
| (A) Total samples (N=159) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cell type | Number of cells* | Mean difference (%, 95% CI) | Correlation coefficient (r) | ||||||
| Pre | Post | Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | |
| Neutrophil | 7,725 | 7,821 | 7,752 | -0.61 (-0.89 to -0.33) | -0.40 (-1.46 to 0.66) | 0.21 (-0.84 to 1.27) | 0.997 | 0.939 | 0.940 |
| Lymphocyte | 5,435 | 5,975 | 5,540.5 | -3.41 (-3.96 to -2.86) | -0.61 (-1.88 to 0.67) | 2.80 (1.63 to 3.97) | 0.986 | 0.912 | 0.933 |
| Monocyte | 1,483 | 1,353 | 1,812 | 0.82 (0.23 to 1.42) | -1.91 (-2.59 to -1.22) | -2.73 (-3.38 to -2.08) | 0.832 | 0.762 | 0.776 |
| Eosinophil | 365 | 352 | 310.5 | 0.08 (-0.03 to 0.19) | 0.34 (0.05 to 0.62) | 0.25 (0.01 to 0.52) | 0.980 | 0.862 | 0.880 |
| Basophil | 169 | 161 | 128 | 0.05 (0.00 to 0.10) | 0.26 (0.06 to0.46) | 0.21 (0.02 to 0.39) | 0.984 | 0.628 | 0.660 |
| IG | 262 | 120 | 155.5 | 0.91 (0.63 to 1.19) | 0.71 (0.36 to 1.07) | -0.19 (-0.45 to 0.07) | 0.806 | 0.682 | 0.793 |
| Blast | 320 | 74 | 58.5 | 1.37 (0.89 to 1.85) | 1.66 (1.13 to 2.18) | 0.29 (0.14 to 0.44) | 0.906 | 0.815 | 0.930 |
| Plasma cell | 24 | 1 | 0 | 0.14 (0.087 to 0.20) | 0.15 (0.09 to 0.21) | 0.01 (-0.01 to 0.02) | 0.180 | 0.000 | 0.000 |
| nRBC | 30 | 22 | 39 | 0.05 (0.01 to 0.09) | -0.06 (-0.15 to 0.04) | -0.11 (-0.19 to -0.02) | 0.904 | 0.600 | 0.660 |
| AL | 115 | 43 | 49 | 0.45 (0.25 to 0.65) | 0.42 (0.23 to 0.60) | -0.04 (-0.19 to 0.11) | 0.123 | 0.186 | -0.047 |
| (C) Group 2 (WBC >1.0–≤2.0×109/L, N=38) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cell type | Number of cells* | Mean difference (%, 95% CI) | Correlation coefficient (r) | ||||||
| Pre | Post | Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | |
| Neutrophil | 1,689 | 1,702 | 1,674 | -0.37 (-0.77 to 0.03) | -0.55 (-2.80 to 1.70) | -0.18 (-2.36 to 1.99) | 0.999 | 0.892 | 0.898 |
| Lymphocyte | 1,427 | 1,601 | 1,524 | -4.63 (-5.74 to -3.53) | -2.32 (-4.42 to -0.21) | 2.31 (0.18 to 4.46) | 0.989 | 0.948 | 0.946 |
| Monocyte | 425 | 349 | 480 | 2.03 (1.28 to 2.77) | -0.76 (-1.74 to 0.21) | -2.79 (-3.87 to -1.71) | 0.956 | 0.793 | 0.791 |
| Eosinophil | 85 | 76 | 65 | 0.24 (-0.19 to 0.67) | 0.50 (-0.13 to 1.13) | 0.26 (-0.18 to 0.71) | 0.886 | 0.735 | 0.839 |
| Basophil | 35 | 32 | 28.5 | 0.08 (-0.01 to 0.17) | 0.17 (-0.15 to 0.49) | 0.09 (-0.20 to 0.39) | 0.976 | 0.689 | 0.726 |
| IG | 60 | 25 | 24 | 0.97 (0.59 to 1.36) | 1.13 (0.64 to 1.62) | 0.16 (-0.09 to 0.40) | 0.879 | 0.788 | 0.859 |
| Blast | 44 | 2 | 0.5 | 1.16 (0.82 to 1.50) | 1.20 (0.81 to 1.59) | 0.04 (-0.04 to 0.12) | 0.680 | -0.164 | -0.039 |
| Plasma cell | 8 | 0 | 0 | 0.21 (0.07 to 0.35) | 0.21 (0.07 to 0.35) | 0.00 (0.00 to 0.00) | NA | NA | NA |
| nRBC | 3 | 3 | 10 | 0.00 (0.00 to 0.00) | -0.18 (-0.32 to -0.05) | -0.18 (-0.32 to -0.05) | 1.000 | 0.548 | 0.548 |
| AL | 25 | 13 | 9 | 0.32 (-0.04 to 0.68) | 0.42 (0.11 to 0.73) | 0.11 (-0.16 to 0.37) | 0.221 | 0.206 | -0.278 |
| (D) Group 3 (WBC >2.0–≤3.0×109/L, N=38) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cell type | Number of cells* | Mean difference (%, 95% CI) | Correlation coefficient (r) | ||||||
| Pre | Post | Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | |
| Neutrophil | 2,154 | 2,183 | 2,179.5 | -0.76 (-1.45 to -0.07) | -0.67 (-2.85 to 1.51) | 0.09 (-2.08 to 2.27) | 0.994 | 0.936 | 0.936 |
| Lymphocyte | 985 | 1,097 | 1,022.5 | -2.95 (-4.05 to -1.85) | -0.99 (-2.85 to 0.87) | 1.96 (0.13 to 3.80) | 0.980 | 0.923 | 0.937 |
| Monocyte | 415 | 343 | 463 | 1.89 (0.92 to 2.87) | -1.26 (-2.62 to 0.09) | -3.16 (-4.79 to -1.53) | 0.901 | 0.814 | 0.698 |
| Eosinophil | 109 | 106 | 78.5 | 0.08 (-0.08 to 0.24) | 0.80 (0.13 to 1.48) | 0.72 (0.08 to 1.37) | 0.994 | 0.887 | 0.895 |
| Basophil | 40 | 37 | 29 | 0.08 (-0.01 to 0.17) | 0.29 (-0.23 to 0.81) | 0.21 (-0.28 to 0.70) | 0.983 | 0.150 | 0.177 |
| IG | 43 | 26 | 20.5 | 0.45 (0.14 to 0.75) | 0.59 (0.03 to 1.15) | 0.14 (-0.43 to 0.72) | 0.963 | 0.943 | 0.961 |
| Blast | 34 | 0 | 0 | 0.89 (0.45 to 1.34) | 0.89 (0.45 to 1.34) | 0.00 (0.00 to 0.00) | NA | NA | NA |
| Plasma cell | 4 | 1 | 0 | 0.08 (-0.01 to 0.17) | 0.11 (0.00 to 0.21) | 0.03 (-0.03 to 0.08) | 0.479 | NA | NA |
| nRBC | 2 | 1 | 7.5 | 0.03 (-0.03 to 0.08) | -0.14 (-0.40 to 0.11) | -0.17 (-0.42 to 0.08) | 0.697 | 0.017 | 0.067 |
| AL | 16 | 7 | 7 | 0.24 (-0.01 to 0.48) | 0.24 (-0.03 to 0.50) | 0.00 (-0.20 to 0.20) | 0.178 | -0.043 | 0.030 |
| (E) Group 4 (WBC >3.0–<4.0×109/L, N=39) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cell type | Number of cells* | Mean difference (%, 95% CI) | Correlation coefficient (r) | ||||||
| Pre | Post | Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | Pre vs. Post | Pre vs. Manual | Post vs. Manual | |
| Neutrophil | 2,349 | 2,356 | 2,311 | -0.18 (-0.37 to 0.02) | 0.97 (-0.98 to 2.93) | 1.15 (-0.81 to 3.12) | 0.999 | 0.915 | 0.914 |
| Lymphocyte | 1,039 | 1,105 | 1,102 | -1.69 (-2.35 to -1.04) | -1.62 (-3.52 to 0.29) | 0.08 (-1.65 to 1.81) | 0.989 | 0.903 | 0.924 |
| Monocyte | 288 | 281 | 344 | 0.18 (-0.24 to 0.60) | -1.44 (-2.55 to -0.33) | -1.62 (-2.72 to -0.51) | 0.964 | 0.800 | 0.801 |
| Eosinophil | 106 | 106 | 104.5 | 0.00 (0.00 to 0.00) | 0.04 (-0.46 to 0.53) | 0.04 (-0.46 to 0.53) | 1.000 | 0.940 | 0.940 |
| Basophil | 34 | 32 | 24 | 0.05 (-0.02 to 0.12) | 0.26 (-0.08 to 0.59) | 0.21 (-0.11 to 0.52) | 0.972 | 0.212 | 0.252 |
| IG | 26 | 15 | 7 | 0.28 (0.09 to 0.48) | 0.49 (0.11 to 0.86) | 0.21 (-0.13 to 0.54) | 0.886 | 0.534 | 0.507 |
| Blast | 32 | 0 | 0 | 0.82 (0.40 to 1.24) | 0.82 (0.40 to 1.24) | 0.00 (0.00 to 0.00) | NA | NA | NA |
| Plasma cell | 6 | 0 | 0 | 0.15 (0.04 to 0.27) | 0.15 (0.04 to 0.27) | 0.00 (0.00 to 0.00) | NA | NA | NA |
| nRBC | 1 | 1 | 1.5 | 0.00 (0.00 to 0.00) | -0.01 (-0.09 to 0.07) | -0.01 (-0.09 to 0.07) | 1.000 | -0.036 | -0.036 |
| AL | 20 | 5 | 7.5 | 0.38 (0.08 to 0.69) | 0.32 (0.01 to 0.63) | -0.06 (-0.24 to 0.11) | -0.148 | -0.106 | -0.088 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download