요약: 제2형 당뇨병 및 비만과 같은 많은 만성 대사질환은 여전히 현재의 현대의학적 치료에 완전히 반응하지는 못한다. 한 가지 가능한 치료 방법이 비만 수술이다. 그러나 최소 침습 내시경인 duodenal mucosal resurfacing (DMR)이 최근 더욱 인기를 얻고 있다. 비인슐린 혈당 강하제를 복용 중인 환자 28명을 대상으로 open-label DMR과 mixed meal test를 시행 후 3개월 뒤의 결과를 본 REVITA-11 혹은 REVITA-22 연구에 참여한 환자들을 대상으로 사후 분석한 연구를 소개하고자 한다.3 DMR 시행 3개월 뒤, 공복 혈당, 글루카곤, C-pep-tide가 유의하게 감소하였고, 인슐린 민감도와 베타 세포 기능 모두 유의하게 개선되었다. 공복 혈당의 감소로 인하여 식후 혈당의 감소가 동반하였고, 이에 따라 식후 글루카곤도 감소하였으나, glucagon-like peptide-1이나 glucose-dependent insulinotropic polypeptide에는 변화는 없었다. 이러한 결과를 토대로 십이지장이 제2형 당뇨 환자를 위한 치료 표적임을 다시 한번 입증하는 데에 중요한 근거가 된다.
REVITA-1 연구1는 DMR의 효능과 안정성을 위한 전향적 다기관 임상 연구로 2020년에 발표되었다. 경구형 혈당강하제를 복용 중인 제2형 당뇨(hemoglobin A1c [HbA1c] 7.5–10.0%) 환자 46명이 DMR을 받았으며, 최종 27명을 DMR 이후 24개월 동안 추적 관찰하였다. 평균 HbA1c가 8.5±0.7%에서 6개월 뒤 7.5±0.8%로 감소되었고(p<0.001) 이러한 감소는 24개월 이후에도 유지되었다(HbA1c 7.5±1.1%, p<0.001). 50% 이상의 환자들이 혈당강하제를 줄일 수 있었고, alanine amino-transferase (ALT)의 수치 및 고밀도지질단백질 및 중성지방/고밀도지질단백질의 개선이 24개월 이후에 확인되었다.1
REVITA-2 연구2는 2017년에 진행한 전향적, 무작위, 이중맹검, 다국적(유럽과 브라질), sham 대조군 비교 연구로 2022년에 발표되었다. 56명은 DMR군, 52명은 sham 대조군 대상으로 DMR 시술 24주 이후의 DMR의 효과가 분석되었다. 이 연구에서 새로운 점은, REVITA-1 study에서 ALT 감소 및 고밀도지질단백질의 개선 효과가 확인되어 참여한 환자들 중 DMR 시행 전 비알콜성 지방간이 확인된 환자에서는 DMR 시행 12주 후 추가적인 지방간 호전 여부를 위한 정밀 검사를 시행하였다는 점이다. HbA1c의 감소 효과는 sham과 비교했을 시 경미한 차이만 관찰되었으나, 초기 고혈당으로 혈당 조절이 어려웠던 환자들(공복혈당 ≥10 mmol/L)인 그룹만 비교했을 시 sham 그룹에 비해 유의한 HbA1c의 감소 효과를 보여주었다(p<0.002). 또한, 비알콜성 지방간을 가진 환자에서의 지방간 호전 정도를 MRI-PDFF를 통해 측정하였는데, 전반적인 24주 후의 호전 차이는 경미하였으나, 이 또한 공복혈당 ≥10 mmol/L인 그룹에서는 sham group에 비해 유의한 호전이 관찰되었다(p=0.001).
해설:
제2형 당뇨병이 서양뿐 아니라 동양에서도 유행병에 이르렀다. 현재 치료 표준은 생활 방식 또는 행동 수정 후에도 조절이 어려운 경우, 경구 혹은 주사제 약물을 선택하게 된다. 약제 선택의 폭이 넓음에도 불구하고 복합적 치료에 대한 환자의 순응도가 떨어지거나, 약제가 병태생리학적 결함을 대상으로 하지 않아, 결국 많은 환자가 고혈당증의 통제를 달성하지 못하게 된다.4,5
비만 수술, 특히 상부 위장관을 우회하는 방법은 제2형 당뇨를 동반한 비만 환자에서 강력한 교정을 발휘할 수 있다.6-9 최근 제2형 당뇨 치료에 약제와 더불어 이와 같은 중재술을 추가적 접근 방식으로 개입하는 데에 관심을 갖고 있다. 이러한 대사 수술의 중요성은 국제 당뇨병 그룹에서도 강조되어 현재 치료 지침 중에 포함되어야 한다는 주장으로 이어지고 있다.
상부 위장관 중 특히 십이지장이 당의 항상성에 있어서 생리학적, 및 병태생리학적으로 중요함은 많은 실험적 증거를 통해 입증되었다.10,11 십이지장은 식이 섭취 시 가장 먼저 인식되는 해부학적 구조이다. 당뇨 동물 모델이나 당뇨 환자에서 십이지장 점막이 비정상적으로 비대해져 있음이 확인되었다.12 위장 우회 수술이나 endoluminal sleeve와 같은 기구를 사용한 중재술을 통해 십이지장의 점막이 담즙이나 영양분의 접촉하는 것을 막았을 시 인슐린의 민감성과 베타세포의 기능을 개선해 주었다.13 Roux-en-Y 위루술을 받은 제2형 당뇨 쥐 모델과 환자에서 호전된 내당능이 남은 위에 위루술을 시행하여 십이지장에 영양소의 재노출을 시켰을 시 바로 내당능 장애가 나타남이 확인되었다.14,15 이러한 결과를 통해 제2형 당뇨병에서 변성된 십이지장 점막의 영양분과의 접촉을 막는 것이 십이지장에서 분비하는 항 인슐린(항 인크레틴) 요소들의 감소로 인한 인슐린의 기능을 증가시키는 신진대사의 유익한 downstream 효과를 기대할 수 있다. 이러한 십이지장 우회술을 내시경적 중재로 고안한 방법을 DMR이라고 칭한다.
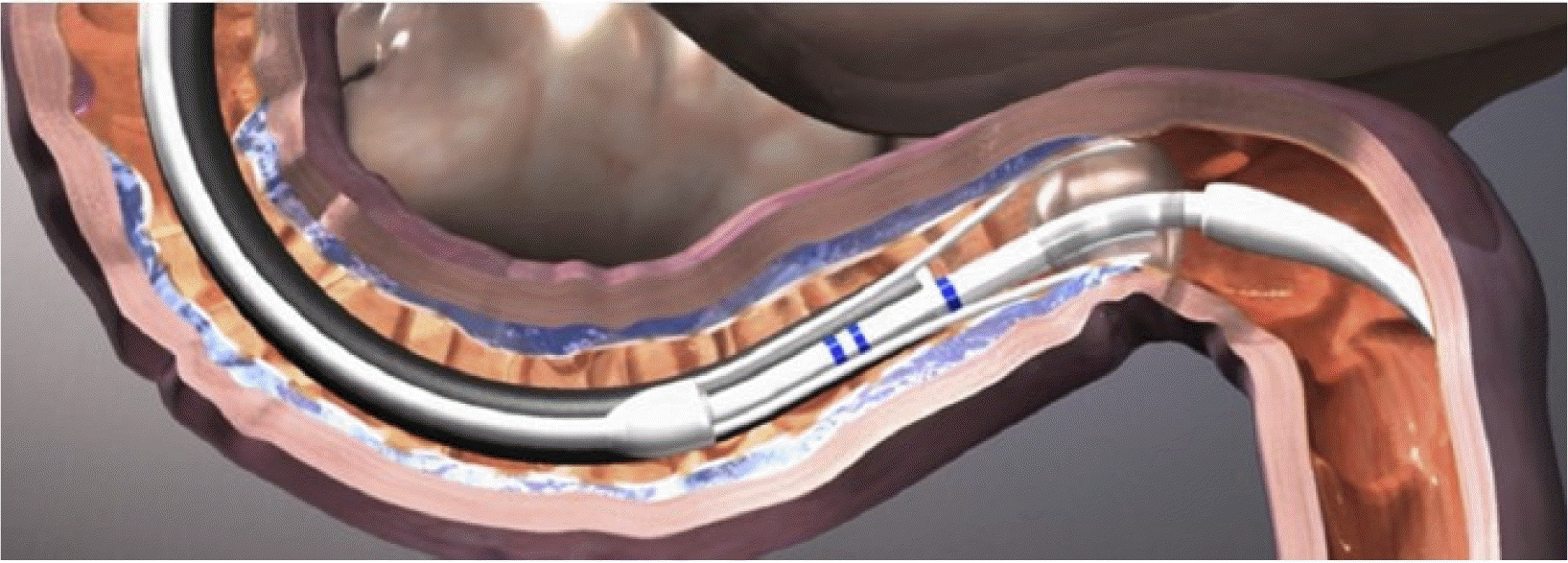
DMR은 내시경 치료로 장 내강 크기 조정, 점막하층을 식염수(획일한 융제 표면을 제공하고 사이의 식염수로 절제된 점막과 더 깊은 조직 간의 열 보호 역할)가 담긴 긴 원통형 풍선으로 팽창, 그리고 십이지장의 길이를 따라 원통형으로 절제하는 순서이다. 신소재 폴리에틸렌 테레프탈레이트 풍선 치료 카테터(REVITA 시스템; Fractyl Laboratories, Inc.)가 경 구강 내시경 접근법을 통해 마취된 환자에게 십이지장에 도입된다. 첫 번째 카테터는 십이지장의 크기를 결정하는 데 사용되고, 이후 120도 사이의 진공을 통한 3개의 바늘을 통해 식염수를 십이지장 점막 하에 주입한다. 점막 띄우기는 유두부의 원위부에서 1 cm 떨어진 유두후 십이지장부터 시작하여 Treitz 인대의 근위부까지를 포함한다. 첫 번째 카테터를 제거한 후 두 번째 풍선 카테터를 삽입한 후, 내시경으로 진입하여 관찰하에 점막이 띄워진 곳을 원주형으로 5군데를 떨어트려서 최종 위치까지 10초 이내로 90도 열을 가해 절제한다. 절대 유두부에 열이 닿지 않도록 내시경으로 잘 주시해야 한다. 환자는 시술 후 24시간 이내에 퇴원하고 퇴원 후 물 -> 유동식 -> 연식의 순으로 전환하고 2주 동안은 연식으로 유지하도록 교육한다(Fig. 1).16
DMR은 새로운 최소 침습적 카테터를 기반한 상부 내시경시술로 물을 이용한 열 전도로 십이지장 점막을 절제하고 그 이후로 점막이 치유되는 것이다. DMR은 덜 침습적으로, 위장관 우회 수술의 작용을 일부 대체할 수 있는 방법이다. DMR은 제2형 당뇨병의 새로운 치료로 제안될 수 있다. 쥐 실험을 통한 전임상 연구에서 제2형 당뇨 쥐에서의 DMR 적용은 즉각의 혈당 저하를 보였던 반면, 당뇨가 없는 건강한 쥐에서의 DMR 적용은 혈당 저하를 보이지 않았다. 이는 DMR을 통한 십이지장의 점막 절제 영향은 오직 비정상적으로 높은 혈당에만 효과를 보인다는 것을 알 수 있었다. 또한, 돼지 모델에서는 DMR의 적용이 오직 점막 표면에만 영향을 미치며, 이보다 더 깊은 점막근층이나 더 깊은 층까지는 영향을 주지 않은 안전성을 입증해 주었다(unpublished data; Fractyl Laboratories, Inc.).
2016년에 제2형 당뇨환자(HbA1c≥7.5%, 최소 한 가지 이상의 경구 혈당강하제 복용) 39명을 대상으로 한 첫 임상시험에서 6개월 뒤 HbA1c가 1.2% (p<0.001) 감량되었고, 특히 9.3 cm의 긴 영역의 적용한 그룹이 HbA1c 1.4% 감량된 반면, 3.4 cm의 짧은 영역의 적용한 군에서는 오직 0.7%만 감량되었다(p=0.3). 긴 영역 적용한 그룹 중에서 HbA1c 7.5–10%이고 혈당강하제를 그대로 유지하는 환자들은 HbA1c가 6개월 만에 더 많은 감소를 보여주었다(HbA1c 1.8%, p<0.01).17
그 이후로 DMR의 효능과 안정성을 위한 전향적 다기관 임상 연구인 REVITA-1 study가 진행되었고, REVITA-1 study에 참여했던 초기 DMR을 받았던 환자들 중 1년 뒤 DMR 이후의 부작용과 당뇨 개선 효과에 대한 중간 분석이 진행되었다. HbA1c의 감소는 24주에 감소했던 0.9±0.2%가 12개월 이후에도 유사하게 유지되었고, 체중 또한 24주 때 –2.5±0.6 kg의 감소가 12개월 후까지 –24±0.7 kg로 유사하게 유지되었으나, 이러한 체중 감소가 HbA1c의 변화와 유의적 상관관계를 보이지는 않았다(Pearson’s correlation 0.29, p=0.14). ALT의 감소 또한 12주에 감소했던 수치가 계속적으로 24개월까지 유지됨이 확인되었다. DMR 시술과 관련된부작용은 24명/46명, 52%에서 보고되었고, 이들 중 40명은소화기 증상(설사, 복통, 오심 증세)을 호소하였고, 11명은 전반적인 증상(피로함, 근육통, 발진)이 관찰되었으나 이들 대다수 81%가 경미한 정도의 불편감으로 확인되었고 일상생활이힘든 정도의 심한 증상은 아무도 없었다.18
이후 2017년에는 전향적, 무작위, 이중맹검, 다국적(유럽과 브라질), sham 대조군 비교 REVITA-2 study가 진행되었고 2022년에 발표되었다. 비알콜성 지방간을 가진 환자에서의 지방간 호전 정도를 MRI-PDFF를 통해 측정하였는데, 전반적인 24주 후의 호전 차이는 경미하였으나, 이 또한 공복혈당 ≥10 mmol/L인 그룹에서는 sham group에 비해 유의한 호전이 관찰되었다(p=0.001). 이 연구 결과를 토대로 혈당 조절이 어려운 제2형 당뇨환에게서 DMR의 더 큰 효과를 기대할수 있으며, 지방간 호전 또한 혈당 조절이 어려운 환자에서DMR의 효과를 더 높게 기대할 수 있음을 알 수 있었다.2
우선 catheter가 두 개가 필요하고, 첫 번째 카테터로 10cm 영역의 십이지장 점막을 식염수로 바늘을 통해 주입을 해야 하고, 새로운 카테터로 2 cm 크기의 풍선에 열이 전달되어 절제의 효과를 기대하게 되는데 10 cm를 포함하기 위해서는 최소 5번 이상의 열 절제 절차를 거쳐야 하는 만큼 시술의 소요 시간이 길다. 또한 십이지장 점막 띄우기를 위해 catheter의 세 방향에서 바늘이 나오기 때문에, 천공의 위험성에 대한 고려, 열 자극 이후 점막 재생 과정에서 유발되는 섬유화로 인한 십이지장 협착과 같은 부작용을 인지해야 한다. 또한, 이러한 위험성이 동반된 시술이어서 환자의 움직임이 최소화되어야 하기 때문에, 수술방에서 전신 마취가 된 상태에서 시행되어야 한다는 점에서 전신마취의 위험도 또한 고려가 필요하다. 여러 연구를 통해 DMR의 효과가 입증되었으나, DMR 시행 이후의 HbA1c의 0.9% 정도의 감소 효과는 추가적인 경구 혈당강하제를 복용하였을 때의 효과와 비슷하거나 약간 더 우월한 정도이다. 이는 DMR의 효과가 제2형 당뇨병 치료에 있어서 첫 번째 치료 선택이기보다는 보조적인 역할이 될 것이라 생각된다.
DMR은 제2형 당뇨병, 비알콜성 지방간 및 지방간염의 새로운 치료 기회를 제공할 것으로 기대된다. 또한, 혈당과 에너지 대사와 관련된 만성 질환에 대한 비수술적, 비침습적 치료의 대안으로 고려될 수 있다. 그러나 아직까지 DMR에 대한 근거 기반 연구가 부족하기 때문에, DMR의 효과는 좀 더 지켜봐야 할 것이다. 가능한 메커니즘은 십이지장에서 포도당 흡수의 변화를 분비, 장내 마이크로바이옴 개선이다. DMR의 장기적인 효과는 무작위 대조시험을 통해 향후 확인되어야 할 것이다. DMR의 반복적인 시술이 치료 효과를 증대시킬 수 있는지에 대한 연구도 필요할 것이다. 위 우회술 이후 관찰되는 식습관의 변화 가능성 또한 DMR 이후에 관찰되어야 할 것이다.
Notes
Article
Insulin sensitivity and beta cell function after Duodenal Mucosal Resurfacing (DMR): An Open-Label, Mechanistic, Pilot Study. (Gastrointest Endosc 2024 Jan 25. doi: 10.1016/j.gie.2024.01.031)
REFERENCES
1. van Baar ACG, Devière J, Hopkins D, et al. 2022; Durable metabolic improvements 2 years after duodenal mucosal resurfacing (DMR) in patients with type 2 diabetes (REVITA-1 Study). Diabetes Res Clin Pract. 184:109194. DOI: 10.1016/j.diabres.2022.109194. PMID: 35032562.
2. Mingrone G, van Baar AC, Devière J, et al. 2022; Safety and efficacy of hydrothermal duodenal mucosal resurfacing in patients with type 2 diabetes: the randomised, double-blind, sham-controlled, multicentre REVITA-2 feasibility trial. Gut. 71:254–264. DOI: 10.1136/gutjnl-2020-323608. PMID: 33597157. PMCID: PMC8761999.
3. Busch CBE, Meiring S, van Baar ACG, et al. Insulin sensitivity and beta cell function after Duodenal Mucosal Resurfacing (DMR): An Open-Label, Mechanistic, Pilot Study. Gastrointest Endosc. 2024; Jan. 25. doi: 10.1016/j.gie.2024.01.031. DOI: 10.1016/j.gie.2024.01.031. PMID: 38280531.
4. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2015; 38:140–149. DOI: 10.2337/dc14-2441. PMID: 25538310.
5. Egede LE, Gebregziabher M, Dismuke CE, et al. 2012; Medication nonadherence in diabetes: longitudinal effects on costs and potential cost savings from improvement. Diabetes Care. 35:2533–2539. DOI: 10.2337/dc12-0572. PMID: 22912429. PMCID: PMC3507586.
6. Zervos EE, Agle SC, Warren AJ, et al. 2010; Amelioration of insulin requirement in patients undergoing duodenal bypass for reasons other than obesity implicates foregut factors in the pathophysiology of type II diabetes. J Am Coll Surg. 210:564–572. 572–574. DOI: 10.1016/j.jamcollsurg.2009.12.025. PMID: 20421005.
7. Laferrère B, Reilly D, Arias S, et al. 2011; Differential metabolic impact of gastric bypass surgery versus dietary intervention in obese diabetic subjects despite identical weight loss. Sci Transl Med. 3:80re2. DOI: 10.1126/scitranslmed.3002043. PMID: 21525399. PMCID: PMC3656497.
8. Salinari S, le Roux CW, Bertuzzi A, Rubino F, Mingrone G. 2014; Duodenal-jejunal bypass and jejunectomy improve insulin sensitivity in Goto-Kakizaki diabetic rats without changes in incretins or insulin secretion. Diabetes. 63:1069–1078. DOI: 10.2337/db13-0856. PMID: 24241532.
9. Jacobsen SH, Olesen SC, Dirksen C, et al. 2012; Changes in gastrointestinal hormone responses, insulin sensitivity, and beta-cell function within 2 weeks after gastric bypass in non-diabetic subjects. Obes Surg. 22:1084–1096. DOI: 10.1007/s11695-012-0621-4. PMID: 22359255.
10. Rubino F, Marescaux J. 2004; Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239:1–11. DOI: 10.1097/01.sla.0000102989.54824.fc. PMID: 14685093. PMCID: PMC1356185.
11. Rubino F, Forgione A, Cummings DE, et al. 2006; The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244:741–749. DOI: 10.1097/01.sla.0000224726.61448.1b. PMID: 17060767. PMCID: PMC1856597.
12. Gniuli D, Calcagno A, Dalla Libera L, et al. 2010; High-fat feeding stimulates endocrine, glucose-dependent insulinotropic polypeptide (GIP)-expressing cell hyperplasia in the duodenum of Wistar rats. Diabetologia. 53:2233–2240. DOI: 10.1007/s00125-010-1830-9. PMID: 20585935.
13. Ferrannini E, Mingrone G. 2009; Impact of different bariatric surgical procedures on insulin action and beta-cell function in type 2 diabetes. Diabetes Care. 32:514–520. DOI: 10.2337/dc08-1762. PMID: 19246589. PMCID: PMC2646039.
14. Dirksen C, Hansen DL, Madsbad S, et al. 2010; Postprandial diabetic glucose tolerance is normalized by gastric bypass feeding as opposed to gastric feeding and is associated with exaggerated GLP-1 secretion: a case report. Diabetes Care. 33:375–377. DOI: 10.2337/dc09-1374. PMID: 19918005. PMCID: PMC2809286.
15. Shimizu H, Eldar S, Heneghan HM, Schauer PR, Kirwan JP, Brethauer SA. 2014; The effect of selective gut stimulation on glucose metabolism after gastric bypass in the Zucker diabetic fatty rat model. Surg Obes Relat Dis. 10:29–35. DOI: 10.1016/j.soard.2013.01.021. PMID: 23507630.
16. Haidry RJ, van Baar AC, Galvao Neto MP, et al. 2019; Duodenal mucosal resurfacing: proof-of-concept, procedural development, and initial implementation in the clinical setting. Gastrointest Endosc. 90:673–681.e2. DOI: 10.1016/j.gie.2019.03.024. PMID: 30935932.
17. Rajagopalan H, Cherrington AD, Thompson CC, et al. 2016; Endoscopic duodenal mucosal resurfacing for the treatment of type 2 diabetes: 6-month interim analysis from the first-in-human proof-of-concept study. Diabetes Care. 39:2254–2261. DOI: 10.2337/dc16-0383. PMID: 27519448.
18. van Baar ACG, Holleman F, Crenier L, et al. 2020; Endoscopic duodenal mucosal resurfacing for the treatment of type 2 diabetes mellitus: one year results from the first international, open-label, prospective, multicentre study. Gut. 69:295–303. DOI: 10.1136/gutjnl-2019-318349. PMID: 31331994. PMCID: PMC6984054.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download