Abstract
Recent evidence indicates that water is one of the most overlooked and underestimated sources of healthcare-associated infections (HAIs). Opportunistic premise plumbing pathogens (OPPPs) are a group of natural waterborne pathogens that can persist in premise plumbing for long periods because of their unique characteristics. These include disinfectant resistance, viability inside amoeba, biofilm formation, and growth in nutrient-depleted environments. The pathogens can affect patients through various mechanisms, including direct contact, ingestion, aspiration, and aerosol inhalation. Most importantly, the transfer of pathogens between human microbiota and premise plumbing can cause hospital water systems to be reservoirs of multidrug-resistant bacteria. Biofilms formed on the outlet devices, such as tap faucets, shower heads, and sink drains provides an ideal niche for transmission of antimicrobial resistance. Contaminated wastewater systems are often sources of HAIs. A combination of interventions must be employed to manage water-related HAIs, including the general reinforcement of infection control measures, thermal and chemical disinfection, and consistent water flow.
물은 생명의 근원이라고 말한다. 실제로 자연이나 인공 수계 환경에는 다양한 세균들이 상시 존재하고 있다. 음용수, 그리고 염소 소독 후 정수가 완료된 수돗물 또한 무균(sterile) 상태는 아니다. 다만, 인체에 유해한 영향을 미칠 수 있는 미생물과 무기물질, 유기물질 양의 기준을 법령으로 명시하여, 감시체계를 통해 안전성을 갖춘 수돗물이 가정, 의료기관 등으로 급수된다[1].염소계 소독제의 사용과 유기물을 효과적으로 감소시키는 상수처리시스템의 발전은 고전적인 수인성 병원체인 Eschericia coli, Shigella, Salmonella와 같은 세균들은 감소시킨 반면 선택적으로 opportunistic premise plumbing pathogens (OPPP)라 불리우는, Leigonella, nontuberculous mycobacteria (NTM), 다제 내성 그람음성균(multi-drug resistant gram negative organisms), pseudomonas, 원생생물들의 증식을 유발하였다[2-4]. OPPP의 종류를 Table 1에 정리하였다[5]. 이들은 면역저하 환자들에게 주로 질환을 유발하기 때문에, 기회감염을 의미하는 ‘opportunistic’ 이라는 단어가 붙여졌다. 이들은 건물 내의 저수조, 냉각탑, 근위부에서 원위부에 해당하는 전 구역의 배관 등 수계 시스템의 어느 부위에서나 생존이 가능하다. 특히 원내의 일부 장소에서 수질온도가 병원체 생장에 적합한 곳, 유속 정체가 있는 곳 또는 부식이 진행된 곳에서 OPPP는 균막(biofilm)을 형성하여 장기간 건축물 배관(premise plumbing)에 잔류하게 된다[2,3,6]. 이처럼 OPPP로 오염된 원내 수계환경은 직접 또는 간접 접촉, 오염된 물의 섭취나 흡입, aerosol을 통한 흡입 등의 경로로 환자에게 전파되어 원내에 대규모 유행을 초래할 수 있고, 특히 면역저하 환자들이 노출되는 경우 치명적 결과를 야기한다[4,6,7]. 수계 시스템에서 OPPP의 완전한 제거는 불가능하다. 그러므로, 이들의 증식에 영향을 미치는 요인을 적절하게 통제함으로써 배수관 집락 형성을 최소화하는 전략이 필요하다. 본 종설에서는 OPPP의 특성, 수계 시설과 관련한 의료관련감염 사례를 고찰하고, 감염 예방을 위한 안전한 물관리 전략을 소개하고자 한다.
건축물 배관(premise plumbing)은 정수장으로부터 물이 공급되는 건축물 내부의 샤워실, 화장실, 수도꼭지, 싱크대 등으로 이송하는 수관로를 의미한다. 건축물 배관의 원위부로 갈수록 낮아지는 잔류 소독제 농도, 그리고 따뜻한 수온은 OPPP가 증식할 수 있는 환경을 제공한다. 또한, 건물 내의 노후화로 부식된 곳이나 물의 정체나 유속이 느려지는 배관은(e.g. dead leg) 유기물과 무기물, 그리고 OPPP 집락의 결합체인 균막이 잘 형성되어 강력한 소독제 내성을 갖게 된다[2,8]. 실제로 염소계 소독제에 대한 OPPP의 내성을 일반적 음용수의 유해 미생물 지표인 대장균과 비교하여 Table 2에 정리 하였다[2,9].
또한 OPPP는 Acanthamoeba spp., Naegleria spp., Hartmanella spp. 등의 자유 아메바 내에서도 생존 및 증식할 수 있다. 그러므로, 저 영양물질(유기물)과 저산소 환경에서도 생존이 가능하며, 열처리나 소독제의 직접적 영향으로부터 보호되고 있어 소독제에 강한 내성을 가질 수 있다. 균막 형성과 세포 내 기생이 가능한 특성은 항생제 내성을 갖는 데에도 일조한다. 특히 의료기관의 오폐수 수계 시스템은 항생제가 농축된 환자의 배설물이나 체액뿐 아니라 각종 폐기된 수액제제 및 의료 폐기물들이 버려지므로 배수로에 집락해 있던 OPPP들은 선택적으로 항생제 내성을 획득할 수 있고, 내성 유전자를 수평 전파하여 다제 내성균 집락을 형성하기도 한다[10-14]. 오염된 배수 시스템은 주변 환경을 오염시켜 다양한 경로로 다시 싱크대 수도꼭지, 샤워기, 정수기 등의 급수 시스템을 오염시킴으로써 환자들에게 재전파가 가능하다[4,8,15]. 특히 이들은 오랫동안 수계 시스템에 잔류하며 내성균들의 저장고(reservoir)가 되기도 한다[2,10,11,16]. OPPP는 크고 복잡한 의료기관 내 배관의 다양한 곳에서 균막을 이루다가, 유속의 변화, 배수로 공사, 수압변화와 같은 상황에서 분산이 되면서 연결된 다른 배관으로 지속적 재유입이 가능하기 때문이다. 실제로 수계 시스템에 수년간 잔류하고 있던 다제 내성균 유래의 원내 유행 사례를 여러 문헌들에서 보여주고 있다[2,9-13,17]. 그러므로, 이들에 의한 위험성을 감소시키기 위해 건축물 배관 시스템 전체에서 OPPP의 분포를 확인하고 모니터링하는 것이 필요하다. 음용수의 오염기준을 판단하는 분변성 대장균군(coliform bacteria)의 개체 수와 OPPP의 개체 수는 전혀 무관한 것으로 알려져 있어 OPPP의 모니터링에는 새로운 기준이 필요하다[2,18]. 다양한 OPPP를 한 번의 검사로 확인할 수 있는 공인된 방법은 아직까지 없으며 다양한 OPPP에 대해서는 균주별로 다른 채취와 보관법, 배양 및 검출 방법이 필요하다. 예를 들어, OPPP의 대표적 균주인 레지오넬라는 무균 채수병이나 멸균용기에 채취 후 냉장 상태(4-10℃)로 24시간 이내에 수송이 되어야 배양을 할 수가 있으며 배양 조건도 까다로워 다른 미생물의 성장을 저해하기 위한 열처리 및 산처리를 진행하게 된다. 또다른 대표적 균주인 Mycobacterium은 서로 잘 뭉치고 표면에 잘 부착하는 특성으로 인해 분리(isolation) 자체가 어렵고, 다른 미생물이나 곰팡이균의 과증식 방지로 전처리를 진행하나 이 와중에 살아있는 Mycobacterium도 같이 소실이 되는 경우가 많다. 이들 모두 배양 결과가 나오기까지 시간이 많이 소요되고, 균종 사이에도 서로 배양시간이 달라 위급한 상황에서 적절한 시기에 관련 정보를 제공하지 못할 가능성이 높다[2,18,19]. 국내에서는 가장 잘 알려진 수계 시스템 관련 감염병의 하나인 3급 법정감염병 레지오넬라 증에 대해서만 질병관리청 관리지침을 발간하고 있다[20]. 수계 시스템과 관련한 원내감염에 대한 인지율이 높아짐에 따라 원내 수계 환경 관리의 중요성 또한 강조되고 있다. 앞으로는 안전한 물관리를 위한 통합적인 OPPP 관리지침 또한 필요할 것으로 생각된다.
19세기 Ignaz Semmelweis가 손위생을 통해 출산 관련 사망율을 크게 감소시킬 수 있음을 증명하면서, 손위생은 원내 감염 예방과 관리의 핵심 사항이 되었다. 이후로 의료기관 내에는 감염관리를 위한 손씻기 시설을 모든 입원실과 중환자실에 의무적으로 설치하도록 하고 있다. 국내에서도 의료기관의 시설기준에 병상 대비 최소 몇 개 이상의 손씻기 시설을 구비하도록 법령으로 공지되어 있다[21]. 이러한 기준 설정의 배경에는 싱크대의 설치가 많아질수록 손씻기가 더욱 잘 이루어졌다는 과거 연구들 때문이기도 하다[22]. 그러나, 역설적이게도 싱크대는 내성균 그리고 가장 빈번하게는 Pseudomonas의 저장소 역할을 하여 다양한 경로로 환자들에게 전파되어 원내감염을 일으킨다는 연구들이 축적되었다[16,23-27].
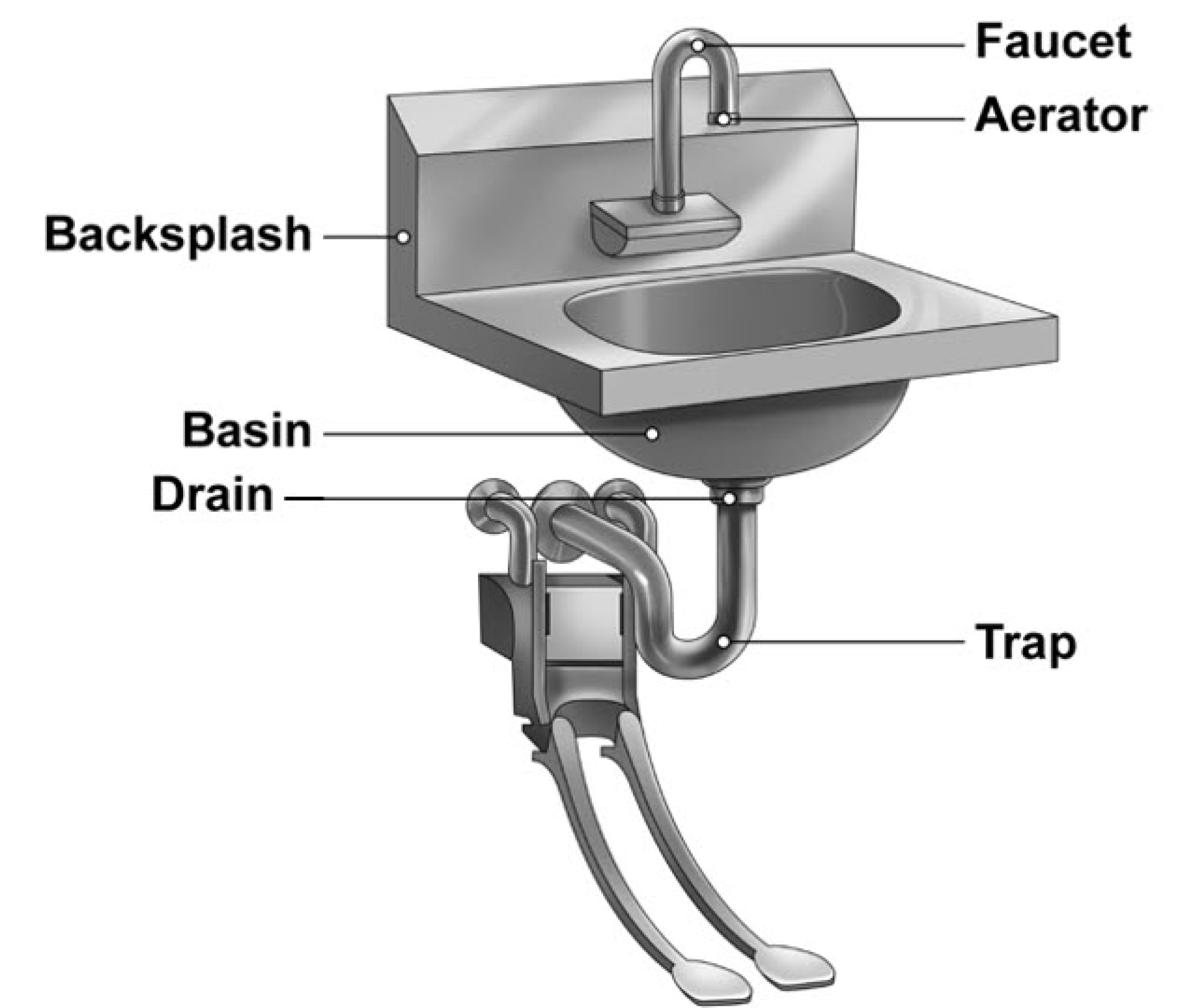
싱크대는 다양한 부속품들이 연결되어 있는 구조물로 싱크대의 다양한 장소에 미생물들이 집락할 수 있는 환경이 형성된다. 수도꼭지(faucet), 토수구, 포말기(aerator), 싱크대 배수구(drain)나 대야(basin), 그리고 배수관 트랩(trap)은 습하고 물이 항상 고여 있기 때문에 미생물의 집락이 용이하다(Fig. 1). 실제로도 수전을 통한 원내감염의 대부분은 싱크대의 오염에서 비롯된 사례가 가장 많다[24,25].
국내에서 보고한 수전을 통한 Carbapenemase-producing enterobacteriaceae (CPE) 유행 사례에서는 초기에 심혈관 중환자실 싱크대 옆의 정수기 오염을 인지하여, 정수기를 제거하고 싱크대 소독 및 배수관 교체를 진행하였다. 이 과정에서 중환자실 싱크대에 투석이 끝난 투석액을 버리는 잘못된 행태를 확인하고 교정하였다. 그러나, 이들과 접점이 없는 일반 병실환자들에게서 지속적인 유행이 발생하자 carbapenem resistant enterobacteriaceae (CRE) 양성환자와 일반환자들의 설문 조사를 통해 환경배양을 시행할 후보지를 좁혀 나갔다. CRE 양성 환자들의 공통점을 찾기 위함이다. 그 결과, pulsed field gel electrophoresis (PFGE)를 통해 환자 병실 내부 싱크대 배수구, 환자 화장실 싱크대 배수구에서 환자가 보유하고 있는 동일한 유전형의 New Delhi metallo-ß-lactamase (NDM) producing Enterobacter cloacae를 확인하여 5,500 ppm의 락스 소독 및 전체 싱크대 배수관 교체를 통해 유행을 종식시켰다[26].
Dacraene 등[27]이 보고한 영국의 Central Manchester University hospital NHS foundation Trust (CMFT)의 Klebsiella pneumoniae carbapenemase (KPC) producing E.coli 유행 사례에서도 오염된 싱크대가 CPE 유행의 원인임을 확인하였다. 이들은 2015년 대규모 KPC-producing E.coli 유행 사례를 겪으면서 대규모의 환경배양 샘플링, 그리고 환자의 CPE 스크리닝 샘플들에 대한 유전체 시퀀싱을 통해 역학연구를 진행하였으며 약 8년간의 데이터를 모두 통합하여 오염된 싱크대나 배수구로부터 환자에게 내성균의 전파가 이루어졌음을 추정하였다. 환경에 잔류하는 동일 E.coli 균주(strain)와 ST (sequence type) 내에서도, 그들이 지닌 내성 플라스미드의 유전자간 재조합은 나중에 또 다른 새로운 내성 균주를 출현시킴도 확인하였다[27]. 미국의 NIHCC (National institutes of health clinical center)에서 진행한 대규모 환경감시배양과 고위험군 환자들에 대한 스크리닝 배양 검사에서도 환경에 장기간 잔류한 미생물간의 유전자 수평이동을 통해 새로운 내성균이 출현함을 밝혔다[11]. 특히, 여기서 주목할 사항 중의 하나는 CPE 유행을 인지 후 진행했던 엄격한 접촉주의, 케이스 환자들의 코호트, 항생제 스튜어드십, 입실 전의 선제 스크리닝 등은 CPE감소에 별반 도움이 되지 않았다는 사실이다. 병동을 폐쇄하고 배수관을 모두 교체한 이후에야 CPE 빈도가 감소하였다. 이는 수계 시스템과 관련한 유행 사례이기 때문이다. 그럼에도 불구하고, 새로운 배관으로 구성된 병동은 금방 다시 환경에 CPE 오염이 발생하였고 이에 따라 환자들의 CPE 획득도 증가하였다고 한다. 저자들은 효과적 감염예방과 관리를 위해 싱크대의 첫 오염의 발생 기전을 밝히는 것부터 시작하여 환자와 환경 사이 병원균 전파 네트워크를 더욱 상세히 밝히는 노력이 필요함을 시사하였다[27].
독일에서 보고한 metallo-ß-lacatamase (MBL) 생성 Pseudomonas aeruginosa 유행사례에서는 PFGE와 MLST (Multi-Locus Sequencetyping) 방법을 통해 오염된 세면대 표면, 싱크대 배수관에서 물이 튀면서(splash) 발생하는 환자의 청결물품 오염이 유행의 원인이었음을 확인하였다[28]. 위의 사례처럼 잘못된 공간 배치 그리고 물이 잘 튈 수 있는 얕은 싱크대 디자인은 오염된 배수구의 물이 주변의 환경을 오염시키게 만든다. 위와 같은 전파경로에 의한 multidrug resistant (MDR) Pseudomonas, ESBL (extended spectrum ß-lactamase) Klebsiella oxytoca의 원내 유행 사례가 보고된 바가 있다[29,30]. 또한 위 사례에서는 환자들이 공유하는 재활용 머리감기 세면대(reusable hairwash basin)도 교차 전파(cross-transmission)를 유발하는 매개체임을 확인하였다. 의료기관에서 환자물품을 공유하는 것은 잠재적 위험이 될 수 있는 것이다[28,29]. Ashraf 등[31]은 혈액내과 외래환자들의 Mycobacterium mucogenicum 혈류감염 유행을 추적하던 중, 수도꼭지 포말기(aerator)의 오염과 함께 싱크대에서 정맥주사를 준비한다는 사실을 확인하게 되어, 오염된 싱크대의 에어로졸 발생에 의한 정맥주사 오염을 추정하였다. 그 외에도 싱크대의 수도꼭지(faucet)의 오염에 기인한 Pseudomonas, stenotrophomonas maltophilia 유행 사례들이 보고되었다[32-34]. 의료기관에서 최근 사용이 증가한 센서형 전기 수도꼭지(electronic faucet)와 관련한 사례들도 있다. 자동식 센서 수도꼭지는 의료진 및 환자들의 빈번한 접촉을 막는 동시에 절수의 목적으로 사용되고 있다. 그러나 매번 충분히 많은 양의 물이 나오지 않고, 토수구로 나오기 전까지는 미생물이 잘 자랄 수 있는 35℃ 근방의 수온이 유지되며 온수와 냉수가 혼합되어 들어오는 곳에 위치한 밸브가 고무나 플라스틱, PVC (Poly Vinyl Chloride)로 이루어져 균막이 잘 생기는 문제가 있어 오히려 일반 수도꼭지에 비해 미생물의 집락에 유리한 환경이 된다. 그러므로 중환자실이나 이식병동 등에서는 센서형 전기 수도꼭지를 설치하는 것을 권고하지 않았다[34-36].
위의 사례들처럼 다양한 미생물들이 싱크대, 세면대의 다양한 구조물에 집락하여 환자에게 전파되고, 환자들이 사용하는 기구 또는 의료진을 통한 교차전파가 이루어지면서 원내 유행을 일으킨다. 그러므로 싱크대, 세면대에 미생물의 집락을 최소화하면서 환경에서 환자로 전파되는 경로를 최소화 할 수 있는 감염예방과 관리 전략의 모색이 필요하다. 이에 대해선 마지막 장에서 논의할 것이다.
‘Potable water’는 마셔도 되는 안전한 물, 즉 식수(drinking water)를 의미하며, 수돗물, 정수기 물, 병에 담긴 물(bottled water)을 모두 포함한다. 먹는 물 수질기준 및 검사 등에 관한 규칙에 따르면 식수에는 어느 정도 허용되는 수준의 대장균군(coliform bacteria)이 허용된다(불검출/100 mL). 일반세균의 경우는 1 mL 중 100 CFU가 넘지 않으면 수질 기준을 통과하는 것이다[1]. 즉, 음용수 및 수돗물은 염소 소독을 거치기는 하나 무균상태가 아닐 뿐만 아니라, 앞의 사례에서 확인하였듯이 의료기관에서는 수인성 병원체들에 의한 수계시스템의 오염이 빈번할 수 있어 면역이 취약한 환자들에게 오염된 음용수에 의해 의료기관 내 유행이 발생할 수가 있다.
1999년도에 Los Angeles에서는 Mycobacterium avium (MAC)에 오염된 음용수에 의한 AIDS환자와 일반 인구에서의 MAC 감염사례를 확인하였다. Los Angeles의 배수지(reservoir), 31개의 일반건물, 15개의 의료기관, 그리고 무작위로 지정된 가정의 물에서 배양검사를 진행하였으며, 환자의 혈액, 객담, 또는 골수 검체에서 동정된 MAC의 PFGE (Pulsed Field Gel Electrophoresis) 분석을 통해 음용수를 MAC 의감염원으로 추정하였다[37]. 또 Wong 등[38]은 혈액내과 병동에서 매주 시행하는 인두 검체 도말 스크리닝 검사를 통해 9명의 환자들에게 발생한 Pseudomonas fluorescens 집락화가 오염된 정수기, 음용수로 인해 발생했음을 확인한 사례가 있었다. 이외에도 영국 중환자실에서 음용수로 사용하는 정수기의 water cooler 오염과 관련한 Stenotrophomonas maltophilia 유행사례를 보고하였다. 정수기의 탄소필터는 잔류 염소나 이물질을 흡착하여 물의 맛(organoleptic quality)을 좋게 한다. 탄소필터를 통과한 물은 염소농도가 감소된 상태로 water cooler를 경유하여 토수구로 나오는데, 이들을 연결한 직수관의 내부에 S.maltophilia가 균막을 형성함이 확인되었다. 이 물을 마시거나 구강 케어를 위해 이 물을 사용했던 중환자실 환자들의 인두 스크리닝 검사에서 S.maltophilia 집락의 증가가 관찰되었고, 동시에 이 균주에 의한 폐렴이 증가함을 확인하였다[39].
2012년도에 미국의 한 3차병원에서 발생한 의료기관 관련 레지오넬라증(Legionnaires’ disease) 유행 사례에 따르면, 유행은 원내의 집중적 레지오넬라증 감시, 관리 프로그램의 진행 와중에 발생하였다. 이 병원은 2009년부터 원내 수계 시스템에 레지오넬라증 예방을 위한 구리, 은 이온화 시스템을 갖고 있었고, 집중적인 레지오넬라증 감시, 관리 프로그램을 진행하면서 3개월마다 수도꼭지, 샤워기, 분수대 등을 포함한 원내 수계시스템의 말단부 채수를 진행하였다. 말단부의 30% 이상에서 레지오넬라가 배양되는 경우는 과가열(superheating), 그리고 다량의 물을 말단부를 통해 내려보냄(flushing)으로써, 말단 레지오넬라 배양 양성률이 30% 미만이 될 때까지 위와 같은 소독을 진행하였다. 그럼에도 불구하고, 말단부 배양 양성률이 30% 미만으로 감소된 시점에 원내 레지오넬라증의 유행이 발생하였으며, 당시 무작위로 채취한 25곳의 말단부 수돗물, 음용수 검체 중 23곳에서 레지오넬라가 배양되고(<10 CFU/mL), 환자의 검체와 유전학적으로 일치함을 확인하게 된다. 즉, 주기적인 환경감시 배양, 원내 수돗물, 음용수 시스템의 구리, 은 이온화 시스템 설치 및 권고된 농도 이상의 구리, 은 이온 농도의 유지, 또한 <10 CFU/mL 의 레지오넬라 배양에도 불구하고 수돗물을 통한 원내의 레지오넬라증이 유행한 사례이다[40]. 그러므로, 면역저하 환자들이 많은 의료기관 내에서는 일반적 음용수의 기준보다 더욱 엄격한 기준이 필요할 것으로 생각된다. 특히, 레지오넬라 뿐만이 아니라 Pseudomonas, S.maltophilia와 같은 비발효성 세균들에 대한 모니터링도 필요하다[38,39].
의료기관 내에서 사용하는 다양한 치료 장치에 물이 사용된다. 환자들이 의료기구에 사용되는 물에 직접적인 노출이 없는 경우에도 오염된 물은 에어로졸 발생, 물의 튐(splash) 등의 간접적 경로를 통해 환자들에게 전파되어 원내 유행을 일으킬 수 있다[41]. 브라질의 한 외래 투석실에서는 Burkholderia cepacia complex에 오염된 투석액(dialysate)으로 인한 혈류 감염을 보고하였다. 혈액투석액과 환자의 혈액 사이에는 얇은 반투막만 존재하므로 투석액의 수질관리는 매우 중요하다. 이 때 사용되는 투석액은 정수처리 과정을 통해 투석기계로 전달이 되는데, 정수 처리의 과정은 전 처리 장치, 역삼투 장치, 후처리 장치, 분배시스템 으로 나눠볼 수 있다. 이 중 역삼투압정수(reverse osmosis) 과정은 강력한 압력을 줌으로써 반투막을 통해 정수된 물의 순수도를 최대화하는 정수작업이다. 위의 사례는 역삼투압 정수과정에 있는 튜브의 물이 새면서 정수된 물에 오염된 화학물질, 미생물들이 재유입되어 발생한 유행임을 RAPD (random amplification of polymorphic DNA) 방식을 통해 확인하였다[42]. 이 외에도 투석기계의 WHO (waste handling option) 포트의 밸브고장으로, 노폐물이 역류가 되어 Pseudomonas, E.cloacae의 혈류감염이 일어났던 사례들이 있었다[43,44].
또한, 가온냉각기(heater-cooler unit)와 관련한 유행발생의 사례들도 보고되었다. 가온 냉각기는 개흉술 또는 체외막산소화장치(Extracorporeal membrane oxygenation, ECMO) 유지 시, 심폐 우회로(cardiopulmonary bypass)를 통해 환자의 혈액을 체외 순환시킬 때, 물을 열 교환기로 사용하여 혈액의 온도를 조절하는 데에 사용되는 기구이다. 유럽과 미국에서는 심장수술을 받은 환자들에게서 나타난 Mycobacterium chimaera 감염을 추적하던 중, 특정 제조사의 오염된 가온 냉각기가 100건이 넘는 M.chimerae 인공판막 감염 및 파종성 감염의 사례들의 원인이었음을 보고하였다[45,46]. 수술 중 환자가 가온 냉각기의 물과 직접적인 접촉을 하지는 않는다. 하지만, 가온 냉각기는 완전히 밀폐되어 있지 않고, 냉각 팬이 돌아가고 있어 공기의 흐름을 생성하기 때문에 오염된 가온 냉각기는 에어로졸을 발생시켜 환자에게 전파될 수 있음을 공기 배양 검사를 통해 확인하였다[47].
호흡기질환 환자들에게 흔히 사용되는 네뷸라이저(nebulizer)를 통한 유행의 사례도 보고되었다. 네뷸라이저는 호흡기 약품 용액을 분사하여 환자가 흡입할 수 있도록 만든 장치이다. 네덜란드의 두경부암 병동에서는 기관절개술 환자들에게 수분공급 목적으로 사용했던 초음파 네뷸라이저(ultrasonic nebulizer)에 의한 methicillin resistant Staphylococcus aureus (MRSA)의 유행사례를 보고하였다. MRSA 는 실내공기를 여과한 이후 가습을 하는 네뷸라이저의 필터(dust filter)에서 확인되었다. 필터의 교체와 청소가 지침대로 잘 이루어지지 않았기 때문이었다. MRSA로 오염된 필터에 의한 공기매개의 감염의 사례로 엄격한 소독과 관리 이후 MRSA 유행이 소실되었다[48]. Craven 등[49]은 인공호흡기의 호흡기 서킷과 연결된 네뷸라이저 오염은 박테리아 에어로졸을 발생시킬 수 있음을 확인하였다. 삽관튜브의 입구와 인공호흡기에 연결하여 사용하는 네뷸라이저의 입구에는 온도 차이에 의한 응결이 흔히 발생한다. 응결을 제거하지 않아 중환자실의 표면 환경에 토착화되어 있는 병원균에 의한 오염이 되거나, 오염된 응축수가 역류하는 경우 네뷸라이저의 오염을 일으켜 폐렴을 유발할 수 있다[49]. 뿐만 아니라, 인공호흡기의 워터트랩(water trap) 오염과 관련한 유행사례도 있다. 워터트랩은 가습작용이나 환자의 호흡으로 인해 인공호흡기 서킷 내에 결로가 발생 시에 환자에게 유입되는 것을 막기 위해 응축수를 모아두는 장치이다[41]. 워터트랩의 액체가 역류하는 경우 환자의 호흡기로 들어갈 수 있기 때문에 정기적으로 비우고 가급적이면 건조하게 서킷을 유지하는 것이 좋다. Sui 등[50]은 감시 환경배양 검사를 진행했을 때, 워터트랩의 표면에서 Staphylococcus aureus와 Pseudomonas가 배양됨을 확인하여, 주기적인 표면 소독의 필요성을 강조하였다. Gorman 등[51]은 중환자실 내의 Klebsiella pneumoniae에 의한 폐렴 유행을 경험하면서, 워터트랩을 비울 때 응축수가 땅에 떨어져도 닦지 않았다는 점이나 환자의 침상 주변 싱크대, 폐기물통에 응축수를 버리는 잘못된 행태를 지적하면서 에어로졸화나 의료진의 손에 의한 교차감염의 가능성을 추정하였다.
의료기관의 오폐수에는 매우 많은 미생물들이 서식한다. 뿐만 아니라, 의료 폐기물이나 환자의 분변에 농축된 항생제에 의한 선택 압력을 고려할 때 다수의 미생물들은 다양한 항생제 내성 기전을 획득하게 된다[52,53].
영국에서는 MDR-P.aeruginosa에 의한 유행을 조사하던 중, 오폐수 배출구에서 MDR-P.aeruginosa가 동정됨을 확인하였다. 실제로 원내에서는 오폐수 파이프의 누수가 잦았고, 무분별하게 종이타월이나 환자용 물티슈를 변기에 버림으로써 변기의 배관이 막히는 일이 잦았다고 한다. 그로 인한 역류와 환경오염도 빈번했다. 또한, 공간의 협소함으로 인해 의료폐기물실에도 청결물품들이 보관되어 있었기 때문에, 저자들은 오폐수 시스템이 MDR-P.aeruginosa의 저장소임을 추측하였다. 특히나 사례의 MDR-P.aeruginosa 유행하기 전 X-ray 촬영실에서도 발생했던 오폐수 노출 이벤트 당시의 배양 검사상 현재의 유행 균주와 동일한 균주가 동정되었다는 사실을 통해 오폐수 시스템 오염이 오랜 기간 지속되면서 발생한 대규모 유행임을 설명하였다[12]. 벨기에의 화상병동 사례에서는 변기 배관(toilet drain)이 OXA-48 producing Klebsiella pneumoniae 유행의 원인임을 확인하였으며, 위 사례에서도 변기 배관 폐색이 동반되어 방에서 다른 방으로(room-to-room) 전파가 가능했음을 설명하였다[54].
의료기관의 수계 시스템과 관련한 감염사례들을 살펴보면 오염된 수계 시스템에 의해 환자가 감염되고, 또 환자에 의해 기존의 수계 시스템이 오염되어, 다양한 경로를 통해 OPPP에 의한 감염이 발생함을 알 수 있다. 앞에서 논한 OPPP의 특성상 크고 복잡한 의료기관에서 이들을 완전히 박멸하는 것은 불가능한 일이다. 그러므로, 이들의 특성을 알고 증식을 효과적으로 통제할 수 있는 방법을 찾는다면 OPPP에 의한 원내 감염사례를 예방할 수 있다.
의료기관으로 물을 공급하는 수도관(water mains)은 고압으로 물을 전달하게 되지만, 건축물 배관(premise plumbing)은 건물 내의 다양한 물의 사용처인 말단부로 물을 전달하기 때문에 수압은 수도관에 비해 낮아질 수밖에 없다. 수압은 유속을 유지하는 데에 중요한 인자로, 물의 소비처에 해당하는 배관의 말단부나 물이 고이게 되는 dead leg, 또는 배수시스템에 해당하는 싱크대의 S-트랩(trap)이나 P-트랩과 같은 배수도는 낮은 유속으로 인해 균막이 잘 생기는 부위 중의 하나이다. 다시 말하면 물 연령(water age), 즉 수도관(water mains)에서 물이 최종 소비처까지 도달하는 평균적 시간은 OPPP의 통제에 중요한 요인으로, 물의 최종 소비처 도달 시간이 길수록 OPPP의 생장과 증식이 유도될 가능성이 높다[7,9].
의료기관 개설 시에는 건축물의 규모와 물의 예상 소비 규모에 합당한 수압을 유지할 수 있는 수계시스템을 설계한다. 그러나, 예상보다 소비규모가 적거나, 에너지 절약형 수도꼭지(electronic faucet), 절약형 샤워기 등을 사용하는 경우 물 연령이 증가되고 그에 따른 균의 집락이 증가함이 앞의 사례들에서 확인되었다[7,9,34-36]. 적어도 의료기관의 병동 내에서는 에너지 절약형 시스템을 사용하는 것이 권장되지는 않는다. 또한, 유속이 느려지거나 정체되는 구간을 최소화하는 설계도 필요하다[55]. 그러나 이미 설계된 건물 내의 유속을 변경시키는 것은 불가능한 일이므로, OPPP의 생장과 증식의 억제를 위해 주기적인 가온(加溫)과 염소 소독, 또는 고온의 물을 5분 이상 flushing 하는 방법을 권고하고 있다[7,55].
수계환경과 관련한 감염의 다수를 차지하고 있는 싱크대에는 특히 S-트랩, P-트랩 배수구의 정체된 물로 인한 균막 형성이 문제가 된다. 이를 방지하기 위한 self-disinfecting trap은 도움이 된다. 이 기기는 진동을 가하여 물의 흐름을 유도함과 동시에 가열이나 자외선 소독을 진행하여 기존의 균막을 파괴히거나 추가적 균막의 성장을 저해하는 방법이다. Kossow 등[56]은 위와 같이 다양한 감염 예방조치들을 결합한 번들이 효과적임을 확인하였다.
물의 소비처에 해당하는 건축물 배관의 말단부에서는 물 연령이 증가함에 따라 잔류염소 소독제 농도가 감소한다. 또한, 높은 수온에서 잔류염소 소독제의 농도는 감소하기 때문에 보통 온수탱크에선 잔류 염소 소독제의 농도는 거의 0에 가깝다. 그러므로, 이미 OPPP에 의한 유행이 발생한 경우 또는 감염 예방의 일환으로 추가 소독제 사용을 고려하게 된다. 염소계 소독제의 사용은 원생생물 통제에도 효과가 있기 때문에 균막 형성을 억제할 수 있는 장점이 있고, 특히 monochloramine (NH2Cl)은 균막 내에 침투가 가능하여 P.aeruginosa나 Legionella pneumophilia의 재성장을 방지할 수 있다는 장점을 갖는다[57,58]. 그러나 염소계 소독제의 과한 사용은 건축물 내의 배관 파이프 부식을 유도할 수 있고 소독제의 부산물(by-product) 일부는 인체에 유해한 영향을 미칠 수 있기 때문에 추가 소독제의 사용 전에는 항상 득실을 따져봐야 한다[7,9,55]. 소독제의 효과는 물의 온도, pH, 이온의 조성, 파이프의 조성 등에 따라 편차가 있을 수 있다. 또한 앞에서 언급했듯이 주기적 소독제의 노출은 염소계 소독제에 내성을 갖는 OPPP만을 선택적으로 증식 시키게 되는 문제가 있다. 케이스마다 차이는 있지만, 대부분은 250-1,000 ppm의 염소계 소독제를 다양한 주기로 사용하였다[59-61]. 하지만, 이 방법의 가장 큰 문제점은 기존의 균막 내 미생물 군집의 교란을 일으켜 OPPP를 다시 분산시킬 수 있다는 점이다[62]. 그렇기 때문에, 유행이 발생한 지역에 집중적으로 추가 소독제를 사용하는 것은 일시적인 방편으로 생각된다[9,55]. 소독제 사용은 일시적인 균의 집락 감소를 유도할 수는 있지만, 재집락화와 균의 재유입을 완전히 막을 수는 없기 때문이다. 그렇기에 대부분의 사례들에서는 유행지역의 배수관 전체를 교체하여 유행을 종식시켰다[26,27,59,63].
위와 같은 염소계 소독 이외에도 구리-은 이온화 소독, 오존 소독, 자외선 소독 등의 방법이 있다. 구리-은 이온화 소독의 경우 레지오넬라를 포함한 일부 미생물 관리에서 사용되기도 하나[64], 앞의 레지오넬라증 유행 사례에서 보았듯 그 효과에 대한 증거는 아직 불충분한 것으로 생각된다[40]. 오존이나 자외선 소독에 대해서도 아직 충분한 증거가 축적되지 않아 높은 레벨로 위 소독 방법을 권고하진 않지만, 일정 지점의 좁은 부위에서는 소독 효과를 나타낼 수 있는 것으로 생각된다[3,9,55]. 다만, 오존이나 자외선 소독은 염소와 같은 잔류 효과가 없기 때문에 소독 하류 부분의 통제가 불가능하다는 큰 제한점이 있다[9,55].
대부분의 OPPP는 25℃에서 45℃ 사이의 온도에서 잘 생장하는 것으로 알려져 있고, 특정 임계 온도 이상이나 이하에서는 생장이 느려지거나 사멸한다. 그러므로, 온도 관리는 OPPP의 생장과 증식에 영향을 미칠 수 있다[65,66]. ASHRAE (American Society of Heating, Refrigeration and Air-conditioning Engineers)에 따르면 보통 레지오넬라 관리를 위해 온수는 의료기관 수계 시스템의 모든 지점에서 49℃ 이상을 유지하도록 한다. 그러나, 저장형 온수탱크(storage water heater)의 온도를 특정 임계치 이상으로 설정할지라도 건축물 배관의 말단부에서는 그 온도를 일정하게 유지하기 어렵다. 그러므로, 온도 변화를 최소화하기 위한 순환 루프(circulation loop)를 저장형 온수탱크에 설치하여 탱크 내부에서 바깥으로 나가는 물까지 온수의 흐름을 잘 유지할 수 있는 장치를 설치하는 것이 필요하다. 그러나, 물의 최종 사용처까지 고온 유지로 인한 화상의 우려가 있기 때문에, 온도조절 밸브를(thermostatic mixing valve) 설치해야 한다. 다만, 최대한 물의 사용지점과 가깝게 밸브를 설치하여 49℃ 이상의 온수가 최대한 사용지점까지 유지될 수 있도록 권고하고 있다[55].
이는 앞에서 언급한 내용들도 일부 포함이 되어있으며, 의료기관 신축 시에 참고해볼 수 있는 내용들이다. 우선, 물 연령을 최소화 하여 건축물 배관의 균막 형성을 최소화할 수 있는 설계를 하는 것이 좋다. 유속이 느려지거나, 물이 정체되는 dead leg와 같은 불필요한 배관 시스템을 지양해야 한다[7,9,55].
또한, 앞서 언급하였듯이 물의 수요와 공급을 최소화하는 친환경 건축(green building)은 오히려 물 연령을 증가시므로 의료기관 건축에서는 바람직하지는 않았다[9].
균막의 형성에는 영양물질, 특히 유기물의 양도 중요한 요인이다. 건축 재료에 따라 유기물의 용해가 발생할 수 있기 때문에, 일부 건축재료는 균막 형성과 관련이 있다[9,20]. 일반적으로 구리배관은 OPPP의 생장과 무관하다고 여겨지지만, van der Kooij 등[70]과 Nguyen 등[71]은 염소(chlorine)나 염소아민(chloramine)의 분해를 촉진시켜 OPPP의 생장에 기여할 수 있음을 보여주기도 하였다. 반면, 플라스틱 재질이나 PVC, Ethylene propylene diene monomer (EDPM), Polyurethane 등의 합성물질은 미생물이 군집을 이루는 데 필요한 영양분의 원천이 되는 유기물을 용해시키기 때문에, 위와 같은 재질의 배관은 OPPP의 성장과 균막 형성에 기여한다고 알려져 있어 가급적이면 의료기관 건축의 재료로는 사용하지 않는 것이 좋다[72,73].
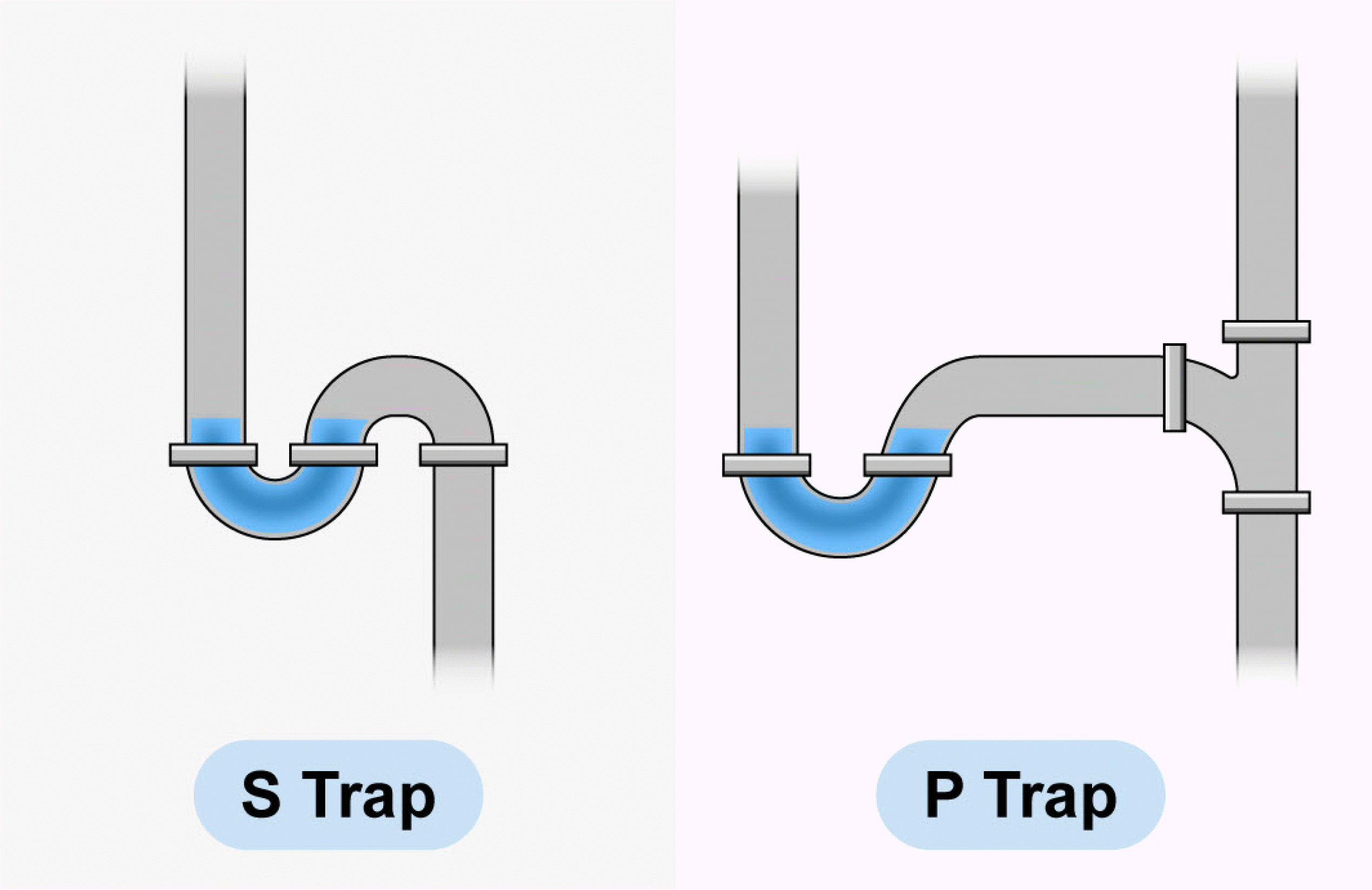
또한, 대다수의 수계 시스템 관련 유행의 근원지인 싱크대의 디자인, 구조, 배치와 관련한 다수의 연구들이 진행되었다[25,74]. 싱크대의 디자인 측면에서 보았을 때, overflow hole이 있는 경우[75], 배수구가 S-트랩이나 P-트랩 모양(Fig. 2)으로 이루어진 경우, 수도꼭지에 포말기(aerator)가 있는 경우 균막 형성이 촉진될 수 있다. 또한, 수도꼭지와 배수구가 일직선이 되는 구조이거나(Fig. 3) 싱크대의 깊이가 너무 얕은 경우는(수도꼭지에서 배수구까지 20 cm 미만인 경우) 물이 튀면서 배수구에 형성된 균막 분산을 유도하여 수도꼭지, 그리고 싱크대 주변 표면까지도 모두 오염시킬 수 있기 때문에, 의료기관 건축시에는 싱크대의 디자인과 깊이를 고려해야 한다[13,29,75]. Kotay 등[76]은 S-트랩 이나 P-트랩 배수구를 갖는 경우 빠른 속도로 균막이 배수관을 통해 연장될 수 있으며(2.5 cm/day), 하나의 싱크대가 오염이 되는 경우, 공동배관을 통해 함께 수평으로(horizontal) 연결된 주변의 싱크대까지 모두 균막으로 오염이 됨을 확인하였다. 그러므로 S-트랩, P 트랩의 배수구, 특히 플라스틱으로 된 배수구 트랩은 지양하도록 권고한다.
또한 환자에서 나온 배출물이나 오폐수, 또는 TPN (total parenteral nutrition) 등을 손씻기 싱크대에 버리는 부적절한 싱크대 사용행태나, 환자들의 물품을 싱크대 주변에 설치하여 사용하는 공간배치도 피하도록 권고하였다[24,26,31,77].
스페인에서 6년간 진행한 한 연구에서는 아예 싱크대를 과감하게 제거하는 것이 중환자실에서 MDR-Gram negative bacteria (GNB)를 통제할 수 있는 방법이라고 소개하였다. 중재 전 중환자실의 모든 병실에 있었던 싱크대를 중재 이후 중앙의 간호사실에만 2개를 남겨두고 모두 제거한 결과, MDR-GNB의 발생률이 9.15/1,000 patient-days에서 2.20/1,000 patient-days로 감소하였다[59]. Catho 등[78]도 물을 사용하지 않는(waterless care) 대신, chlorhexidine free washing glove, 또는 shampoo cap, 병에 담긴 물을 사용하는 전략을 권고하였다.
본 종설에서는 수계 시스템과 관련한 의료관련감염 사례를 검토하고 감염 예방과 관리방법에 대해 정리하였다. 상수처리 시스템의 발전으로 고전적 수인성 병원체들의 통제는 비교적 용이해진 반면, OPPP로 통칭되는 수인성 병원체들은 균막 형성, 소독제 내성, 원생생물 내 기생 가능한 특징으로 인해 장기간 건축물의 배관에 잔류가 가능하고, 그 결과 의료기관의 수계 시스템은 다제내성균의 저장소가 되기도 한다.
효과적인 감염 예방, 관리전략 개발을 위해서는 내성균들의 저장소가 될 수 있는 수계 시스템에 대해 잘 이해하고, 이들의 전파 경로를 이해하는 것이 필수적이다. OPPP는 수계 시스템에 자연적으로 존재할 수 있는 미생물이기 때문에, 이들을 완전히 제거하는 것은 어렵다. 다만 생장 및 증식을 통제함으로써 의료관련감염을 예방할 수 있다. 이 때에 우리는 사용 가능한 다양한 감염 예방 조치들을 결합하는 새로운 접근법이 필요하다. 또한 주기적인 환경감시와 물관리를 통해 수인성 의료관련감염의 위험을 감소시킬 수 있다.
최근에는 병원체를 식별할 수 있는 배양법이나 molecular typing 방법이 발전함에 따라 병원체 저장소와 환자 사이의 전파경로에 대한 이해도가 높아졌고 그에 따라 유행조사도 용이해졌다. 그러나, 아직 환자에게 수인성 병원체에 의한 의료관련감염을 예방할 수 있는 안전한 수질 미생물 기준이 결정되지 않았다. 추가적인 연구를 통해 의료기관에 적용 가능한 안전한 수질 기준을 마련하는 것이 필요하다.
REFERENCES
1. Ministry of Government Legislation. Drinking Water Management Act 2021. https://www.law.go.kr/법령/먹는물관리법. (Updated on 5 January 2024).
2. Falkinham JO 3rd. 2015; Common features of opportunistic premise plumbing pathogens. Int J Environ Res Public Health. 12:4533–45. DOI: 10.3390/ijerph120504533. PMID: 25918909. PMCID: PMC4454924.
3. Gamage SD, Ambrose M, Kralovic SM, Roselle GA. 2021; Water safety and health care: preventing infections caused by opportunistic premise plumbing pathogens. Infect Dis Clin North Am. 35:667–95. DOI: 10.1016/j.idc.2021.04.007. PMID: 34362538.
4. Ferranti G, Marchesi I, Favale M, Borella P, Bargellini A. 2014; Aetiology, source and prevention of waterborne healthcare-associated infections: a review. J Med Microbiol. 63(Pt 10):1247–59. DOI: 10.1099/jmm.0.075713-0. PMID: 25102910.
5. Centers for Disease Control. Considerations for reducing risk: water in healthcare facilities. https://www.cdc.gov/healthcare-associated-infections/php/toolkit/water-management.html. (Updated on 8 April 2024).
6. Decker BK, Palmore TN. 2013; The role of water in healthcare-associated infections. Curr Opin Infect Dis. 26:345–51. DOI: 10.1097/QCO.0b013e3283630adf. PMID: 23806897. PMCID: PMC5583640.
7. Sehulster L, Chinn RY. 2003; Guidelines for environmental infection control in health-care facilities. Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR Recomm Rep. 52:1–42.
8. Hayward C, Brown MH, Whiley H. 2022; Hospital water as the source of healthcare-associated infection and antimicrobial-resistant organisms. Curr Opin Infect Dis. 35:339–45. DOI: 10.1097/QCO.0000000000000842. PMID: 35849524.
9. Leslie E, Hinds J, Hai FI. 2021; Causes, factors, and control measures of opportunistic premise plumbing pathogens-a critical review. Appl Sci. 11:4474. DOI: 10.3390/app11104474.
10. Vergara-López S, Domínguez MC, Conejo MC, Pascual Á, Rodríguez-Baño J. 2013; Wastewater drainage system as an occult reservoir in a protracted clonal outbreak due to metallo-β-lactamase-producing Klebsiella oxytoca. Clin Microbiol Infect. 19:E490–8. DOI: 10.1111/1469-0691.12288. PMID: 23829434.
11. Weingarten RA, Johnson RC, Conlan S, Ramsburg AM, Dekker JP, Lau AF, et al. 2018; Genomic analysis of hospital plumbing reveals diverse reservoir of bacterial plasmids conferring carbapenem resistance. mBio. 9:e02011–17. DOI: 10.1128/mBio.02011-17. PMID: 29437920. PMCID: PMC5801463.
12. Breathnach AS, Cubbon MD, Karunaharan RN, Pope CF, Planche TD. 2012; Multidrug-resistant Pseudomonas aeruginosa outbreaks in two hospitals: association with contaminated hospital waste-water systems. J Hosp Infect. 82:19–24. DOI: 10.1016/j.jhin.2012.06.007. PMID: 22841682.
13. Kotsanas D, Wijesooriya WR, Korman TM, Gillespie EE, Wright L, Snook K, et al. 2013; "Down the drain": carbapenem-resistant bacteria in intensive care unit patients and handwashing sinks. Med J Aust. 198:267–9. DOI: 10.5694/mja12.11757. PMID: 23496403.
14. Betteridge T, Merlino J, Natoli J, Cheong EY, Gottlieb T, Stokes HW. 2013; Plasmids and bacterial strains mediating multidrug-resistant hospital-acquired infections are coresidents of the hospital environment. Microb Drug Resist. 19:104–9. DOI: 10.1089/mdr.2012.0104. PMID: 23067199.
15. Loveday HP, Wilson JA, Kerr K, Pitchers R, Walker JT, Browne J. 2014; Association between healthcare water systems and Pseudomonas aeruginosa infections: a rapid systematic review. J Hosp Infect. 86:7–15. DOI: 10.1016/j.jhin.2013.09.010. PMID: 24289866.
16. Kizny Gordon AE, Mathers AJ, Cheong EYL, Gottlieb T, Kotay S, Walker AS, et al. 2017; The hospital water environment as a reservoir for carbapenem-resistant organisms causing hospital-acquired infections-a systematic review of the literature. Clin Infect Dis. 64:1435–44. Erratum in: Clin Infect Dis 2017;65:1431-3. DOI: 10.1093/cid/cix132. PMID: 28200000.
17. Leitner E, Zarfel G, Luxner J, Herzog K, Pekard-Amenitsch S, Hoenigl M, et al. 2015; Contaminated handwashing sinks as the source of a clonal outbreak of KPC-2-producing Klebsiella oxytoca on a hematology ward. Antimicrob Agents Chemother. 59:714–6. DOI: 10.1128/AAC.04306-14. PMID: 25348541. PMCID: PMC4291428.
18. Wang H, Bédard E, Prévost M, Camper AK, Hill VR, Pruden A. 2017; Methodological approaches for monitoring opportunistic pathogens in premise plumbing: a review. Water Res. 117:68–86. DOI: 10.1016/j.watres.2017.03.046. PMID: 28390237. PMCID: PMC5693313.
19. Thomson R, Carter R, Gilpin C, Coulter C, Hargreaves M. 2008; Comparison of methods for processing drinking water samples for the isolation of Mycobacterium avium and Mycobacterium intracellulare. Appl Environ Microbiol. 74:3094–8. DOI: 10.1128/AEM.02009-07. PMID: 18359837. PMCID: PMC2394917.
20. Korea Disease Control. 2023. Legionellosis management guideline. KDCA;Cheongju: p. 37–49.
21. Ministry of Health. 2017. Revised facility standards for healthcare organizations. MOHW;Sejong: p. 5–7.
22. Kaplan LM, McGuckin M. 1986; Increasing handwashing compliance with more accessible sinks. Infect Control. 7:408–10. DOI: 10.1017/S019594170006464X. PMID: 3638277.
23. Kanamori H, Weber DJ, Rutala WA. 2016; Healthcare outbreaks associated with a water reservoir and infection prevention strategies. Clin Infect Dis. 62:1423–35. DOI: 10.1093/cid/ciw122. PMID: 26936670.
24. Parkes LO, Hota SS. 2018; Sink-related outbreaks and mitigation strategies in healthcare facilities. Curr Infect Dis Rep. 20:42. DOI: 10.1007/s11908-018-0648-3. PMID: 30128678.
25. Fucini GB, Hackmann C, Gastmeier P. 2024; Sink interventions in the ICU to reduce risk of infection or colonization with Gram-negative pathogens: a systematic review of the literature. J Hosp Infect. 143:82–90. DOI: 10.1016/j.jhin.2023.10.011. PMID: 38529781.
26. Jung J, Choi HS, Lee JY, Ryu SH, Kim SK, Hong MJ, et al. 2020; Outbreak of carbapenemase-producing Enterobacteriaceae associated with a contaminated water dispenser and sink drains in the cardiology units of a Korean hospital. J Hosp Infect. 104:476–83. DOI: 10.1016/j.jhin.2019.11.015. PMID: 31785319.
27. Decraene V, Phan HTT, George R, Wyllie DH, Akinremi O, Aiken Z, et al. 2018; A large, refractory nosocomial outbreak of Klebsiella pneumoniae carbapenemase-producing Escherichia coli demonstrates carbapenemase gene outbreaks involving sink sites require novel approaches to infection control. Antimicrob Agents Chemother. 62:e01689–18. DOI: 10.1128/AAC.01689-18. PMID: 30249685. PMCID: PMC6256751.
28. Wendel AF, Kolbe-Busch S, Ressina S, Schulze-Röbbecke R, Kindgen-Milles D, Lorenz C, et al. 2015; Detection and termination of an extended low-frequency hospital outbreak of GIM-1-producing Pseudomonas aeruginosa ST111 in Germany. Am J Infect Control. 43:635–9. DOI: 10.1016/j.ajic.2015.02.024. PMID: 25868648.
29. Hota S, Hirji Z, Stockton K, Lemieux C, Dedier H, Wolfaardt G, et al. 2009; Outbreak of multidrug-resistant Pseudomonas aeruginosa colonization and infection secondary to imperfect intensive care unit room design. Infect Control Hosp Epidemiol. 30:25–33. DOI: 10.1086/592700. PMID: 19046054.
30. Lowe C, Willey B, O'Shaughnessy A, Lee W, Lum M, Pike K, et al. 2012; Outbreak of extended-spectrum β-lactamase- producing Klebsiella oxytoca infections associated with contaminated handwashing sinks. Emerg Infect Dis. 18:1242–7. DOI: 10.3201/eid1808.111268. PMID: 22841005. PMCID: PMC3414015.
31. Ashraf MS, Swinker M, Augustino KL, Nobles D, Knupp C, Liles D, et al. 2012; Outbreak of Mycobacterium mucogenicum bloodstream infections among patients with sickle cell disease in an outpatient setting. Infect Control Hosp Epidemiol. 33:1132–6. DOI: 10.1086/668021. PMID: 23041812.
32. Weber DJ, Rutala WA, Blanchet CN, Jordan M, Gergen MF. 1999; Faucet aerators: a source of patient colonization with Stenotrophomonas maltophilia. Am J Infect Control. 27:59–63. DOI: 10.1016/S0196-6553(99)70077-5. PMID: 9949380.
33. Blanc DS, Nahimana I, Petignat C, Wenger A, Bille J, Francioli P. 2004; Faucets as a reservoir of endemic Pseudomonas aeruginosa colonization/infections in intensive care units. Intensive Care Med. 30:1964–8. DOI: 10.1007/s00134-004-2389-z. PMID: 15257431.
34. Yapicioglu H, Gokmen TG, Yildizdas D, Koksal F, Ozlu F, Kale-Cekinmez E, et al. 2012; Pseudomonas aeruginosa infections due to electronic faucets in a neonatal intensive care unit. J Paediatr Child Health. 48:430–4. DOI: 10.1111/j.1440-1754.2011.02248.x. PMID: 22085434.
35. Inglis TJ, Benson KA, O'Reilly L, Bradbury R, Hodge M, Speers D, et al. 2010; Emergence of multi-resistant Pseudomonas aeruginosa in a Western Australian hospital. J Hosp Infect. 76:60–5. DOI: 10.1016/j.jhin.2010.01.026. PMID: 20451300.
36. Merrer J, Girou E, Ducellier D, Clavreul N, Cizeau F, Legrand P, et al. 2005; Should electronic faucets be used in intensive care and hematology units? Intensive Care Med. 31:1715–8. DOI: 10.1007/s00134-005-2824-9. PMID: 16228175.
37. Aronson T, Holtzman A, Glover N, Boian M, Froman S, Berlin OG, et al. 1999; Comparison of large restriction fragments of Mycobacterium avium isolates recovered from AIDS and non-AIDS patients with those of isolates from potable water. J Clin Microbiol. 37:1008–12. DOI: 10.1128/JCM.37.4.1008-1012.1999. PMID: 10074518. PMCID: PMC88641.
38. Wong V, Levi K, Baddal B, Turton J, Boswell TC. 2011; Spread of Pseudomonas fluorescens due to contaminated drinking water in a bone marrow transplant unit. J Clin Microbiol. 49:2093–6. DOI: 10.1128/JCM.02559-10. PMID: 21450958. PMCID: PMC3122780.
39. Guyot A, Turton JF, Garner D. 2013; Outbreak of Stenotrophomonas maltophilia on an intensive care unit. J Hosp Infect. 85:303–7. DOI: 10.1016/j.jhin.2013.09.007. PMID: 24148363.
40. Demirjian A, Lucas CE, Garrison LE, Kozak-Muiznieks NA, States S, Brown EW, et al. 2015; The importance of clinical surveillance in detecting legionnaires' disease outbreaks: a large outbreak in a hospital with a Legionella disinfection system-Pennsylvania, 2011-2012. Clin Infect Dis. 60:1596–602. Erratum in: Clin Infect Dis 2017; 64:1635. DOI: 10.1093/cid/civ153. PMID: 25722201.
41. Yiek WK, Coenen O, Nillesen M, van Ingen J, Bowles E, Tostmann A. 2021; Outbreaks of healthcare-associated infections linked to water-containing hospital equipment: a literature review. Antimicrob Resist Infect Control. 10:77. DOI: 10.1186/s13756-021-00935-6. PMID: 33971944. PMCID: PMC8108015.
42. Souza AV, Moreira CR, Pasternak J, Hirata ML, Saltini DA, Caetano VC, et al. 2004; Characterizing uncommon Burkholderia cepacia complex isolates from an outbreak in a haemodialysis unit. J Med Microbiol. 53(Pt 10):999–1005. DOI: 10.1099/jmm.0.45702-0. PMID: 15358822.
43. Centers for Disease Control. 1998; Outbreaks of gram-negative bacterial bloodstream infections traced to probable contamination of hemodialysis machines--Canada, 1995; United States, 1997; and Israel, 1997. MMWR Morb Mortal Wkly Rep. 47:55–9.
44. Wang SA, Levine RB, Carson LA, Arduino MJ, Killar T, Grillo FG, et al. 1999; An outbreak of gram-negative bacteremia in hemodialysis patients traced to hemodialysis machine waste drain ports. Infect Control Hosp Epidemiol. 20:746–51. DOI: 10.1086/501576. PMID: 10580625.
45. van Ingen J, Kohl TA, Kranzer K, Hasse B, Keller PM, Katarzyna Szafrańska A, et al. 2017; Global outbreak of severe Mycobacterium chimaera disease after cardiac surgery: a molecular epidemiological study. Lancet Infect Dis. 17:1033–41. DOI: 10.1016/S1473-3099(17)30324-9. PMID: 28711585.
46. Chand M, Lamagni T, Kranzer K, Hedge J, Moore G, Parks S, et al. 2017; Insidious risk of severe Mycobacterium chimaera infection in cardiac surgery patients. Clin Infect Dis. 64:335–42. Erratum in: Clin Infect Dis 2017;65: 875.
47. Sax H, Bloemberg G, Hasse B, Sommerstein R, Kohler P, Achermann Y, et al. 2015; Prolonged outbreak of Mycobacterium chimaera infection after open-chest heart surgery. Clin Infect Dis. 61:67–75. DOI: 10.1093/cid/civ198. PMID: 25761866.
48. Schultsz C, Meester HH, Kranenburg AM, Savelkoul PH, Boeijen-Donkers LE, Kaiser AM, et al. 2003; Ultra-sonic nebulizers as a potential source of methicillin-resistant Staphylococcus aureus causing an outbreak in a university tertiary care hospital. J Hosp Infect. 55:269–75. DOI: 10.1016/S0195-6701(03)00263-9. PMID: 14629970.
49. Craven DE, Lichtenberg DA, Goularte TA, Make BJ, McCabe WR. 1984; Contaminated medication nebulizers in mechanical ventilator circuits. Source of bacterial aerosols. Am J Med. 77:834–8. DOI: 10.1016/0002-9343(84)90520-5. PMID: 6496537.
50. Sui YS, Wan GH, Chen YW, Ku HL, Li LP, Liu CH, et al. 2012; Effectiveness of bacterial disinfectants on surfaces of mechanical ventilator systems. Respir Care. 57:250–6. DOI: 10.4187/respcare.01180. PMID: 21762555.
51. Gorman LJ, Sanai L, Notman AW, Grant IS, Masterton RG. 1993; Cross infection in an intensive care unit by Klebsiella pneumoniae from ventilator condensate. J Hosp Infect. 23:27–34. DOI: 10.1016/0195-6701(93)90127-L. PMID: 8095945.
52. Chagas TP, Seki LM, Cury JC, Oliveira JA, Dávila AM, Silva DM, et al. 2011; Multiresistance, beta-lactamase-encoding genes and bacterial diversity in hospital wastewater in Rio de Janeiro, Brazil. J Appl Microbiol. 111:572–81. DOI: 10.1111/j.1365-2672.2011.05072.x. PMID: 21672095.
53. Prado T, Pereira WC, Silva DM, Seki LM, Carvalho AP, Asensi MD. 2008; Detection of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae in effluents and sludge of a hospital sewage treatment plant. Lett Appl Microbiol. 46:136–41.
54. Heireman L, Hamerlinck H, Vandendriessche S, Boelens J, Coorevits L, De Brabandere E, et al. 2020; Toilet drain water as a potential source of hospital room-to-room transmission of carbapenemase-producing Klebsiella pneumoniae. J Hosp Infect. 106:232–9. DOI: 10.1016/j.jhin.2020.07.017. PMID: 32707194.
55. American Society of Heating. 2023. Managing the risk of legionellosis associated with building water systems. ASHRAE;Peachtree Corners: p. 5–25.
56. Kossow A, Kampmeier S, Willems S, Berdel WE, Groll AH, Burkhardt B, et al. 2017; Control of multidrug-resistant Pseudomonas aeruginosa in allogeneic hematopoietic stem cell transplant recipients by a novel bundle including remodeling of sanitary and water supply systems. Clin Infect Dis. 65:935–42. Erratum in: Clin Infect Dis 2019;68:534. DOI: 10.1093/cid/cix465. PMID: 28520856.
57. Potgieter S, Pinto A, Sigudu M, du Preez H, Ncube E, Venter S. 2018; Long-term spatial and temporal microbial community dynamics in a large-scale drinking water distribution system with multiple disinfectant regimes. Water Res. 139:406–19. DOI: 10.1016/j.watres.2018.03.077. PMID: 29673939.
58. Wang H, Masters S, Edwards MA, Falkinham JO 3rd, Pruden A. 2014; Effect of disinfectant, water age, and pipe materials on bacterial and eukaryotic community structure in drinking water biofilm. Environ Sci Technol. 48:1426–35. DOI: 10.1021/es402636u. PMID: 24401122.
59. Shaw E, Gavaldà L, Càmara J, Gasull R, Gallego S, Tubau F, et al. 2018; Control of endemic multidrug-resistant Gram-negative bacteria after removal of sinks and implementing a new water-safe policy in an intensive care unit. J Hosp Infect. 98:275–81. DOI: 10.1016/j.jhin.2017.10.025. PMID: 29104124.
60. de Jong E, Hilkens M, Loeffen F, van Leeuwen W, Melchers W, Sturm P. 2021. A prolonged outbreak of an extended-spectrum betalactamase producing klebsiella pneumonia (EKP) on an ICU due to contamination of sinks. Oral presentation at: 22nd European Congress of Clinical Microbiology and infectious Diseases (ECCMID). London, UK: Mar 31-Apr 2.
61. Seara N, Oteo J, Carrillo R, Pérez-Blanco V, Mingorance J, Gómez-Gil R, et al. 2015; Interhospital spread of NDM-7-producing Klebsiella pneumoniae belonging to ST437 in Spain. Int J Antimicrob Agents. 46:169–73. DOI: 10.1016/j.ijantimicag.2015.04.001. PMID: 25982912.
62. Wang H, Masters S, Hong Y, Stallings J, Falkinham JO 3rd, Edwards MA, et al. 2012; Effect of disinfectant, water age, and pipe material on occurrence and persistence of Legionella, mycobacteria, Pseudomonas aeruginosa, and two amoebas. Environ Sci Technol. 46:11566–74. DOI: 10.1021/es303212a. PMID: 23046164.
63. Ambrogi V, Cavalié L, Mantion B, Ghiglia MJ, Cointault O, Dubois D, et al. 2016; Transmission of metallo-β-lactamase-producing Pseudomonas aeruginosa in a nephrology-transplant intensive care unit with potential link to the environment. J Hosp Infect. 92:27–9. DOI: 10.1016/j.jhin.2015.09.007. PMID: 26597635.
64. Shih HY, Lin YE. 2010; Efficacy of copper-silver ionization in controlling biofilm- and plankton-associated waterborne pathogens. Appl Environ Microbiol. 76:2032–5. DOI: 10.1128/AEM.02174-09. PMID: 20080997. PMCID: PMC2838026.
65. Rhoads WJ, Ji P, Pruden A, Edwards MA. 2015; Water heater temperature set point and water use patterns influence Legionella pneumophila and associated microorganisms at the tap. Microbiome. 3:67. DOI: 10.1186/s40168-015-0134-1. PMID: 26627188. PMCID: PMC4666224.
66. Cervero-Aragó S, Schrammel B, Dietersdorfer E, Sommer R, Lück C, Walochnik J, et al. 2019; Viability and infectivity of viable but nonculturable Legionella pneumophila strains induced at high temperatures. Water Res. 158:268–79. DOI: 10.1016/j.watres.2019.04.009. PMID: 31048196. PMCID: PMC6520252.
67. Trautmann M, Lepper PM, Haller M. 2005; Ecology of Pseudomonas aeruginosa in the intensive care unit and the evolving role of water outlets as a reservoir of the organism. Am J Infect Control. 33(5 Suppl 1):S41–9. Erratum in: Am J Infect Control 2008;36:4. Erratum in: Am J Infect Control 2011;39:172. DOI: 10.1016/j.ajic.2005.03.006. PMID: 15940115.
68. Carlson KM, Boczek LA, Chae S, Ryu H. 2020; Legionellosis and recent advances in technologies for Legionella control in premise plumbing systems: a review. Water (Basel). 12:1–676. DOI: 10.3390/w12030676. PMID: 32704396. PMCID: PMC7377215.
69. Chaidez C, Gerba C. 2004; Comparison of the microbiologic quality of point-of-use (POU)-treated water and tap water. Int J Environ Health Res. 14:253–60. DOI: 10.1080/09603120410001725595. PMID: 15369990.
70. van der Kooij D, Veenendaal HR, Scheffer WJ. 2005; Biofilm formation and multiplication of Legionella in a model warm water system with pipes of copper, stainless steel and cross-linked polyethylene. Water Res. 39:2789–98. DOI: 10.1016/j.watres.2005.04.075. PMID: 16019051.
71. Nguyen C, Elfland C, Edwards M. 2012; Impact of advanced water conservation features and new copper pipe on rapid chloramine decay and microbial regrowth. Water Res. 46:611–21. DOI: 10.1016/j.watres.2011.11.006. PMID: 22153355.
72. Rogers J, Dowsett AB, Dennis PJ, Lee JV, Keevil CW. 1994; Influence of plumbing materials on biofilm formation and growth of Legionella pneumophila in potable water systems. Appl Environ Microbiol. 60:1842–51. DOI: 10.1128/aem.60.6.1842-1851.1994. PMID: 16349278. PMCID: PMC201571.
73. Cullom AC, Martin RL, Song Y, Williams K, Williams A, Pruden A, et al. 2020; Critical review: propensity of premise plumbing pipe materials to enhance or diminish growth of Legionella and other opportunistic pathogens. Pathogens. 9:957. DOI: 10.3390/pathogens9110957. PMID: 33212943. PMCID: PMC7698398.
74. Valentin AS, Santos SD, Goube F, Gimenes R, Decalonne M, Mereghetti L, et al. 2021; A prospective multicentre surveillance study to investigate the risk associated with contaminated sinks in the intensive care unit. Clin Microbiol Infect. 27:1347.e9–14. DOI: 10.1016/j.cmi.2021.04.032. PMID: 33975006.
75. De Geyter D, Blommaert L, Verbraeken N, Sevenois M, Huyghens L, Martini H, et al. 2017; The sink as a potential source of transmission of carbapenemase-producing Enterobacteriaceae in the intensive care unit. Antimicrob Resist Infect Control. 6:24. DOI: 10.1186/s13756-017-0182-3. PMID: 28239453. PMCID: PMC5314675.
76. Kotay S, Chai W, Guilford W, Barry K, Mathers AJ. 2017; Spread from the sink to the patient: in situ study using green fluorescent protein (GFP)-expressing Escherichia coli to model bacterial dispersion from hand-washing sink-trap reservoirs. Appl Environ Microbiol. 83:e03327–16. DOI: 10.1128/AEM.03327-16. PMID: 28235877. PMCID: PMC5377511.
77. Gormley M, Aspray TJ, Kelly DA, Rodriguez-Gil C. 2017; Pathogen cross-transmission via building sanitary plumbing systems in a full scale pilot test-rig. PLoS One. 12:e0171556. DOI: 10.1371/journal.pone.0171556. PMID: 28187135. PMCID: PMC5302810.
78. Catho G, Martischang R, Boroli F, Chraïti MN, Martin Y, Koyluk Tomsuk Z, et al. 2021; Outbreak of Pseudomonas aeruginosa producing VIM carbapenemase in an intensive care unit and its termination by implementation of waterless patient care. Crit Care. 25:301. DOI: 10.1186/s13054-021-03726-y. PMID: 34412676. PMCID: PMC8376114.
Table 1
Opportunistic pathogens for premise plumbing [5]
Table 2
| Genus or species | CT 99.9%* |
|---|---|
| Escherichia coli | 0.09 (reference) |
| Legionella pneumophilia | |
| Medium-grown | 7.5 (83-fold) |
| Water-adapted | 52.5 (580-fold) |
| Mycobacterium avium | |
| Medium-grown | 51 (567-fold) |
| Water-adapted | - |
| Pseudomonas aeruginosa | 1.92 (21-fold) |
| Methylobacterium spp. | 1.5 (16.7-fold) |
| Acinetobacter baumanii | 59 (658-fold) |
| Aeromonas hydrophila | 2.6 (29-fold) |




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download