1. Moon JH, Hyun MK, Lee JY, Shim JI, Kim TH, Choi HS, et al. 2018; Prevalence of thyroid nodules and their associated clinical parameters: a large-scale, multicenter-based health checkup study. Korean J Intern Med. 33(4):753–62. DOI:
10.3904/kjim.2015.273. PMID:
28859466. PMCID:
PMC6030422.

2. Parsa AA, Gharib H. Parsa AA, Gharib H, editors. Epidemiology of thyroid nodules. Thyroid nodules. Springer;2018. p. 1–11. DOI:
10.1007/978-3-319-59474-3_1.

3. Gnarini VL, Brigante G, Della Valle E, Diazzi C, Madeo B, Carani C, et al. 2013; Very high prevalence of ultrasound thyroid scan abnormalities in healthy volunteers in Modena, Italy. J Endocrinol Invest. 36(9):722–8.
4. Oh EY, Jang HW, Lee JI, Kim HK, Kim SW, Chung JH. 2010; Prevalence of thyroid nodules and cancer detected by ultrasonography in healthy Korean adults: clinical features and the risk for malignancy. J Korean Thyroid Assoc. 3(2):142–8.
5. Marqusee E, Benson CB, Frates MC, Doubilet PM, Larsen PR, Cibas ES, et al. 2000; Usefulness of ultrasonography in the management of nodular thyroid disease. Ann Intern Med. 133(9):696–700. DOI:
10.7326/0003-4819-133-9-200011070-00011. PMID:
11074902.

6. Hagag P, Strauss S, Weiss M. 1998; Role of ultrasound-guided fine-needle aspiration biopsy in evaluation of nonpalpable thyroid nodules. Thyroid. 8(11):989–95. DOI:
10.1089/thy.1998.8.989. PMID:
9848711.

7. Ha EJ, Chung SR, Na DG, Ahn HS, Chung J, Lee JY, et al. 2021; 2021 Korean Thyroid Imaging Reporting and Data System and imaging-based management of thyroid nodules: Korean Society of Thyroid Radiology consensus statement and recommendations. Korean J Radiol. 22(12):2094–123. DOI:
10.3348/kjr.2021.0713. PMID:
34719893. PMCID:
PMC8628155.

8. Kim WB, Kim TY, Kwon HS, Moon WJ, Lee JB, Choi YS, et al. 2007; Management guidelines for patients with thyroid nodules and thyroid cancer. J Korean Endocr Soc. 22(3):157–87. DOI:
10.3803/jkes.2007.22.3.157.

9. Yi KH, Park YJ, Koong SS, Kim JH, Na DG, Ryu JS, et al. 2010; Revised Korean Thyroid Association management guidelines for patients with thyroid nodules and thyroid cancer. J Korean Thyroid Assoc. 3(2):65–96.

10. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2016; 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 26(1):1–133. DOI:
10.1089/thy.2015.0020. PMID:
26462967. PMCID:
PMC4739132.

11. Yi KH. 2016; The revised 2016 Korean Thyroid Association guidelines for thyroid nodules and cancers: differences from the 2015 American Thyroid Association guidelines. Endocrinol Metab (Seoul). 31(3):373–8. DOI:
10.3803/EnM.2016.31.3.373. PMID:
27704738. PMCID:
PMC5053047.

12. Yi KH, Lee EK, Kang HC, Koh Y, Kim SW, Kim IJ, et al. 2016; 2016 revised Korean Thyroid Association management guidelines for patients with thyroid nodules and thyroid cancer. Int J Thyroidol. 9:59–126. DOI:
10.11106/ijt.2016.9.2.59.

13. Jung CK, Baek JH, Na DG, Oh YL, Yi KH, Kang HC. 2020; 2019 practice guidelines for thyroid core needle biopsy: a report of the Clinical Practice Guidelines Development Committee of the Korean Thyroid Association. J Pathol Transl Med. 54(1):64–86. DOI:
10.4132/jptm.2019.12.04. PMID:
31964112. PMCID:
PMC6986975.

14. Kim JH, Baek JH, Lim HK, Ahn HS, Baek SM, Choi YJ, et al. 2018; 2017 thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol. 19(4):632–55. DOI:
10.3348/kjr.2018.19.4.632. PMID:
29962870. PMCID:
PMC6005940.

15. Orloff LA, Noel JE, Stack BC Jr, Russell MD, Angelos P, Baek JH, et al. 2022; Radiofrequency ablation and related ultrasound-guided ablation technologies for treatment of benign and malignant thyroid disease: an international multidisciplinary consensus statement of the American Head and Neck Society Endocrine Surgery Section with the Asia Pacific Society of Thyroid Surgery, Associazione Medici Endocrinologi, British Association of Endocrine and Thyroid Surgeons, European Thyroid Association, Italian Society of Endocrine Surgery Units, Korean Society of Thyroid Radiology, Latin American Thyroid Society, and Thyroid Nodules Therapies Association. Head Neck. 44(3):633–60. DOI:
10.1002/hed.26960. PMID:
34939714.
16. Yi KH, Lee EK, Kang H-C, Koh Y, Kim SW, Kim IJ, et al. 2016; 2016 revised Korean Thyroid Association management guidelines for patients with thyroid nodules and thyroid cancer. Int J Thyroidol. 9(2):59–126. DOI:
10.11106/ijt.2016.9.2.59.

17. Bibbins-Domingo K, Grossman DC, Curry SJ, Barry MJ, Davidson KW, et al. US Preventive Services Task Force. 2017; Screening for thyroid cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 317(18):1882–7. DOI:
10.1001/jama.2017.4011. PMID:
28492905.
18. Curtis RE, Rowlings PA, Deeg HJ, Shriner DA, Socie G, Travis LB, et al. 1997; Solid cancers after bone marrow transplantation. N Engl J Med. 336(13):897–904. DOI:
10.1056/NEJM199703273361301. PMID:
9070469.

19. Atlas G, Farrell S, Zacharin M. 2022; Secondary thyroid carcinoma in survivors of childhood cancer: a need to revise current screening recommendations. Clin Endocrinol (Oxf). 97(1):137–9. DOI:
10.1111/cen.14746. PMID:
35460104. PMCID:
PMC9544539.

20. Pacini F, Vorontsova T, Demidchik EP, Molinaro E, Agate L, Romei C, et al. 1997; Post-Chernobyl thyroid carcinoma in Belarus children and adolescents: comparison with naturally occurring thyroid carcinoma in Italy and France. J Clin Endocrinol Metab. 82(11):3563–9. DOI:
10.1210/jc.82.11.3563. PMID:
9360507.

21. Cahoon EK, Nadyrov EA, Polyanskaya ON, Yauseyenka VV, Veyalkin IV, Yeudachkova TI, et al. 2017; Risk of thyroid nodules in residents of Belarus exposed to Chernobyl fallout as children and adolescents. J Clin Endocrinol Metab. 102(7):2207–17. DOI:
10.1210/jc.2016-3842. PMID:
28368520. PMCID:
PMC5505199.

22. Capezzone M, Robenshtok E, Cantara S, Castagna MG. 2021; Familial non-medullary thyroid cancer: a critical review. J Endocrinol Invest. 44(5):943–50. DOI:
10.1007/s40618-020-01435-x. PMID:
33025555. PMCID:
PMC8049908.

23. Wells SA Jr, Asa SL, Dralle H, Elisei R, Evans DB, Gagel RF, et al. 2015; Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid. 25(6):567–610. DOI:
10.1089/thy.2014.0335. PMID:
25810047. PMCID:
PMC4490627.

24. Loh KC. 1997; Familial nonmedullary thyroid carcinoma: a meta-review of case series. Thyroid. 7(1):107–13. DOI:
10.1089/thy.1997.7.107. PMID:
9086578.

25. Wang X, Cheng W, Li J, Su A, Wei T, Liu F, et al. 2015; Endocrine tumours: familial nonmedullary thyroid carcinoma is a more aggressive disease: a systematic review and meta- analysis. Eur J Endocrinol. 172(6):R253–62. DOI:
10.1530/EJE-14-0960. PMID:
25637073.
26. Lee YM, Yoon JH, Yi O, Sung TY, Chung KW, Kim WB, et al. 2014; Familial history of non-medullary thyroid cancer is an independent prognostic factor for tumor recurrence in younger patients with conventional papillary thyroid carcinoma. J Surg Oncol. 109(2):168–73. DOI:
10.1002/jso.23447. PMID:
24132694.

27. Park YJ, Ahn HY, Choi HS, Kim KW, Park DJ, Cho BY. 2012; The long-term outcomes of the second generation of familial nonmedullary thyroid carcinoma are more aggressive than sporadic cases. Thyroid. 22(4):356–62. DOI:
10.1089/thy.2011.0163. PMID:
22280228. PMCID:
PMC3315159.

28. Klubo-Gwiezdzinska J, Yang L, Merkel R, Patel D, Nilubol N, Merino MJ, et al. 2017; Results of screening in familial non-medullary thyroid cancer. Thyroid. 27(8):1017–24. DOI:
10.1089/thy.2016.0668. PMID:
28657510. PMCID:
PMC5564020.

29. Rios A, Rodriguez JM, Navas D, Cepero A, Torregrosa NM, Balsalobre MD, et al. 2016; Family screening in familial papillary carcinoma: the early detection of thyroid disease. Ann Surg Oncol. 23(8):2564–70. DOI:
10.1245/s10434-016-5149-8. PMID:
27020589.

30. Lee YM, Jeon MJ, Kim WW, Chung KW, Baek JH, Shong YK, et al. 2021; Comparison between familial and sporadic non- medullary thyroid carcinoma: a retrospective individual risk factor-matched cohort study. Ann Surg Oncol. 28(3):1722–30. DOI:
10.1245/s10434-020-09025-0. PMID:
32803550.

31. Francis GL, Waguespack SG, Bauer AJ, Angelos P, Benvenga S, Cerutti JM, et al. 2015; Management guidelines for children with thyroid nodules and differentiated thyroid cancer. Thyroid. 25(7):716–59. DOI:
10.1089/thy.2014.0460. PMID:
25900731. PMCID:
PMC4854274.

32. Pazaitou-Panayiotou K, Michalakis K, Paschke R. 2012; Thyroid cancer in patients with hyperthyroidism. Horm Metab Res. 44(4):255–62. DOI:
10.1055/s-0031-1299741. PMID:
22334393.

33. Song Y, Fu L, Wang P, Sun N, Qiu X, Li J, et al. 2020; Effect of Graves' disease on the prognosis of differentiated thyroid carcinoma: a meta-analysis. Endocrine. 67(3):516–25. DOI:
10.1007/s12020-019-02111-8. PMID:
31637658.

34. Hu X, Wang X, Liang Y, Chen X, Zhou S, Fei W, et al. 2022; Cancer risk in Hashimoto's thyroiditis: a systematic review and meta-analysis. Front Endocrinol (Lausanne). 13:937871. DOI:
10.3389/fendo.2022.937871. PMID:
35903279. PMCID:
PMC9318815.

35. Moon S, Chung HS, Yu JM, Yoo HJ, Park JH, Kim DS, et al. 2018; Associations between Hashimoto thyroiditis and clinical outcomes of papillary thyroid cancer: a meta-analysis of observational studies. Endocrinol Metab (Seoul). 33(4):473–84. DOI:
10.3803/EnM.2018.33.4.473. PMID:
30513562. PMCID:
PMC6279904.

36. Tang Q, Pan W, Peng L. 2022; Association between Hashimoto thyroiditis and clinical outcomes of papillary thyroid carcinoma: a meta-analysis. PLoS One. 17(6):e0269995. DOI:
10.1371/journal.pone.0269995. PMID:
35709179. PMCID:
PMC9202927.

38. Bentrem DJ, Angelos P, Talamonti MS, Nayar R. 2002; Is preoperative investigation of the thyroid justified in patients undergoing parathyroidectomy for hyperparathyroidism? Thyroid. 12(12):1109–12. DOI:
10.1089/105072502321085207. PMID:
12593724.

39. Cetin K, Sikar HE, Temizkan S, Ofluoglu CB, Ozderya A, Aydin K, et al. 2019; Does primary hyperparathyroidism have an association with thyroid papillary cancer? A retrospective cohort study. World J Surg. 43(5):1243–8. DOI:
10.1007/s00268-019-04920-4. PMID:
30680499.

40. Haddy N, Andriamboavonjy T, Paoletti C, Dondon MG, Mousannif A, Shamsaldin A, et al. 2009; Thyroid adenomas and carcinomas following radiotherapy for a hemangioma during infancy. Radiother Oncol. 93(2):377–82. DOI:
10.1016/j.radonc.2009.05.011. PMID:
19515442.

41. Gatta G, Botta L, Rossi S, Aareleid T, Bielska-Lasota M, Clavel J, et al. Childhood cancer survival in Europe 1999-2007: results of EUROCARE-5--a population-based study. Lancet Oncol. 2014; 15(1):35–47. DOI:
10.1016/S1470-2045(13)70548-5. PMID:
24314616.

42. Lorenz E, Scholz-Kreisel P, Baaken D, Pokora R, Blettner M. 2018; Radiotherapy for childhood cancer and subsequent thyroid cancer risk: a systematic review. Eur J Epidemiol. 33(12):1139–62. DOI:
10.1007/s10654-018-0467-8. PMID:
30511135.

43. Veiga LH, Lubin JH, Anderson H, de Vathaire F, Tucker M, Bhatti P, et al. 2012; A pooled analysis of thyroid cancer incidence following radiotherapy for childhood cancer. Radiat Res. 178(4):365–76. DOI:
10.1667/RR2889.1. PMID:
22857014. PMCID:
PMC3488851.

44. Rubino C, Adjadj E, Guerin S, Guibout C, Shamsaldin A, Dondon MG, et al. 2003; Long-term risk of second malignant neoplasms after neuroblastoma in childhood: role of treatment. Int J Cancer. 107(5):791–6. DOI:
10.1002/ijc.11455. PMID:
14566829.

45. Finke I, Scholz-Kreisel P, Hennewig U, Blettner M, Spix C. 2015; Radiotherapy and subsequent thyroid cancer in German childhood cancer survivors: a nested case-control study. Radiat Oncol. 10:219. DOI:
10.1186/s13014-015-0521-6. PMID:
26517987. PMCID:
PMC4628297.

46. Clement SC, Kremer LCM, Verburg FA, Simmons JH, Goldfarb M, Peeters RP, et al. 2018; Balancing the benefits and harms of thyroid cancer surveillance in survivors of childhood, adolescent and young adult cancer: recommendations from the international late effects of childhood cancer guideline harmonization group in collaboration with the PanCareSurFup Consortium. Cancer Treat Rev. 63:28–39. DOI:
10.1016/j.ctrv.2017.11.005. PMID:
29202445.

47. Brander A, Viikinkoski P, Tuuhea J, Voutilainen L, Kivisaari L. 1992; Clinical versus ultrasound examination of the thyroid gland in common clinical practice. J Clin Ultrasound. 20(1):37–42. DOI:
10.1002/jcu.1870200107. PMID:
1309541.

49. Na DG, Baek JH, Jung SL, Kim JH, Sung JY, Kim KS, et al. 2017; Core needle biopsy of the thyroid: 2016 consensus statement and recommendations from Korean Society of Thyroid Radiology. Korean J Radiol. 18(1):217–37. DOI:
10.3348/kjr.2017.18.1.217. PMID:
28096731. PMCID:
PMC5240493.

50. Gharib H, Papini E. 2007; Thyroid nodules: clinical importance, assessment, and treatment. Endocrinol Metab Clin North Am. 36(3):707–35. viDOI:
10.1016/j.ecl.2007.04.009. PMID:
17673125.

51. Lau LW, Ghaznavi S, Frolkis AD, Stephenson A, Robertson HL, Rabi DM, et al. 2021; Malignancy risk of hyperfunctioning thyroid nodules compared with non-toxic nodules: systematic review and a meta-analysis. Thyroid Res. 14(1):3. DOI:
10.1186/s13044-021-00094-1. PMID:
33632297. PMCID:
PMC7905613.

52. Repplinger D, Bargren A, Zhang YW, Adler JT, Haymart M, Chen H. 2008; Is Hashimoto's thyroiditis a risk factor for papillary thyroid cancer? J Surg Res. 150(1):49–52. DOI:
10.1016/j.jss.2007.09.020. PMID:
17996901. PMCID:
PMC2575056.

53. Suh I, Vriens MR, Guerrero MA, Griffin A, Shen WT, Duh QY, et al. 2010; Serum thyroglobulin is a poor diagnostic biomarker of malignancy in follicular and Hurthle-cell neoplasms of the thyroid. Am J Surg. 200(1):41–6. DOI:
10.1016/j.amjsurg.2009.08.030. PMID:
20637335.
54. Lee EK, Chung KW, Min HS, Kim TS, Kim TH, Ryu JS, et al. 2012; Preoperative serum thyroglobulin as a useful predictive marker to differentiate follicular thyroid cancer from benign nodules in indeterminate nodules. J Korean Med Sci. 27(9):1014–8. DOI:
10.3346/jkms.2012.27.9.1014. PMID:
22969246. PMCID:
PMC3429817.

55. Youn I, Sung JM, Kim EK, Kwak JY. 2014; Serum thyroglobulin adds no additional value to ultrasonographic features in a thyroid malignancy. Ultrasound Q. 30(4):287–90. DOI:
10.1097/RUQ.0000000000000056. PMID:
25415866.

56. Patell R, Mikhael A, Tabet M, Bena J, Berber E, Nasr C. 2018; Assessing the utility of preoperative serum thyroglobulin in differentiated thyroid cancer: a retrospective cohort study. Endocrine. 61(3):506–10. DOI:
10.1007/s12020-018-1643-z. PMID:
29948933.

57. Verbeek HH, de Groot JWB, Sluiter WJ, Muller Kobold AC, van den Heuvel ER, Plukker JT, et al. 2020; Calcitonin testing for detection of medullary thyroid cancer in people with thyroid nodules. Cochrane Database Syst Rev. 3(3):CD010159. DOI:
10.1002/14651858.CD010159.pub2. PMID:
32176812.

58. de Groot JW, Plukker JT, Wolffenbuttel BH, Wiggers T, Sluiter WJ, Links TP. 2006; Determinants of life expectancy in medullary thyroid cancer: age does not matter. Clin Endocrinol (Oxf). 65(6):729–36. DOI:
10.1111/j.1365-2265.2006.02659.x. PMID:
17121523.

59. Elisei R, Bottici V, Luchetti F, Di Coscio G, Romei C, Grasso L, et al. 2004; Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders. J Clin Endocrinol Metab. 89(1):163–8. DOI:
10.1210/jc.2003-030550. PMID:
14715844.

60. Hahm JR, Lee MS, Min YK, Lee MK, Kim KW, Nam SJ, et al. 2001; Routine measurement of serum calcitonin is useful for early detection of medullary thyroid carcinoma in patients with nodular thyroid diseases. Thyroid. 11(1):73–80. DOI:
10.1089/10507250150500694. PMID:
11272100.

61. Niccoli P, Wion-Barbot N, Caron P, Henry JF, de Micco C, Saint Andre JP, et al. 1997; Interest of routine measurement of serum calcitonin: study in a large series of thyroidectomized patients. The French Medullary Study Group. J Clin Endocrinol Metab. 82(2):338–41. DOI:
10.1210/jcem.82.2.3737. PMID:
9024213.
62. Costante G, Meringolo D, Durante C, Bianchi D, Nocera M, Tumino S, et al. 2007; Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J Clin Endocrinol Metab. 92(2):450–5. DOI:
10.1210/jc.2006-1590. PMID:
17119000.

63. Chambon G, Alovisetti C, Idoux-Louche C, Reynaud C, Rodier M, Guedj AM, et al. 2011; The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients. J Clin Endocrinol Metab. 96(1):75–81. DOI:
10.1210/jc.2010-0162. PMID:
20881258.

64. Colombo C, Verga U, Mian C, Ferrero S, Perrino M, Vicentini L, et al. 2012; Comparison of calcium and pentagastrin tests for the diagnosis and follow-up of medullary thyroid cancer. J Clin Endocrinol Metab. 97(3):905–13. DOI:
10.1210/jc.2011-2033. PMID:
22170709.

65. Vardarli I, Weber M, Weidemann F, Fuhrer D, Herrmann K, Gorges R. 2021; Diagnostic accuracy of routine calcitonin measurement for the detection of medullary thyroid carcinoma in the management of patients with nodular thyroid disease: a meta-analysis. Endocr Connect. 10(3):358–70. DOI:
10.1530/EC-21-0030. PMID:
33638941. PMCID:
PMC8052568.

66. Cheung K, Roman SA, Wang TS, Walker HD, Sosa JA. 2008; Calcitonin measurement in the evaluation of thyroid nodules in the United States: a cost-effectiveness and decision analysis. J Clin Endocrinol Metab. 93(6):2173–80. DOI:
10.1210/jc.2007-2496. PMID:
18364376.

67. Karga H, Giagourta I, Papaioannou G, Doumouchtsis K, Polymeris A, Thanou S, et al. 2011; Changes in risk factors and tumor node metastasis stage of sporadic medullary thyroid carcinoma over 41 years, before and after the routine measurements of serum calcitonin. Metabolism. 60(5):604–8. DOI:
10.1016/j.metabol.2010.06.004. PMID:
20667564.

68. Weber T, Poplawski A, Vorlander C, Dotzenrath C, Ringelband R, Schabram J, et al. 2022; Preoperative calcitonin testing improves the diagnosis of medullary thyroid carcinoma in female and male patients. Eur J Endocrinol. 186(2):223–31. DOI:
10.1530/EJE-21-1015. PMID:
34871180.

69. Jassal K, Ravintharan N, Prabhakaran S, Grodski S, Serpell JW, Lee JC. 2022; Preoperative serum calcitonin may improve initial surgery for medullary thyroid cancer in patients with indeterminate cytology. ANZ J Surg. 92(6):1428–33. DOI:
10.1111/ans.17690. PMID:
35412008. PMCID:
PMC9321997.

70. Do Cao C, Haissaguerre M, Lussey-Lepoutre C, Donatini G, Raverot V, Russ G. 2022; SFE-AFCE-SFMN 2022 consensus on the management of thyroid nodules: initial work-up for thyroid nodules. Ann Endocrinol (Paris). 83(6):380–8. DOI:
10.1016/j.ando.2022.10.009. PMID:
36280193.

71. Dralle H, Musholt TJ, Schabram J, Steinmuller T, Frilling A, Simon D, et al. 2013; German Association of Endocrine Surgeons practice guideline for the surgical management of malignant thyroid tumors. Langenbecks Arch Surg. 398(3):347–75. DOI:
10.1007/s00423-013-1057-6. PMID:
23456424.

72. Kim PH, Suh CH, Baek JH, Chung SR, Choi YJ, Lee JH. 2020; Diagnostic performance of four ultrasound risk stratification systems: a systematic review and meta-analysis. Thyroid. 30(8):1159–68. DOI:
10.1089/thy.2019.0812. PMID:
32303153.

73. Joo L, Lee MK, Lee JY, Ha EJ, Na DG. 2023; Diagnostic performance of ultrasound-based risk stratification systems for thyroid nodules: a systematic review and meta-analysis. Endocrinol Metab (Seoul). 38(1):117–28. DOI:
10.3803/EnM.2023.1670. PMID:
36891658. PMCID:
PMC10008666.

74. Gharib H, Papini E, Garber JR, Duick DS, Harrell RM, Hegedus L, et al. 2016; American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules--2016 update. Endocr Pract. 22(5):622–39. DOI:
10.4158/EP161208.GL. PMID:
27167915.
75. Shin JH, Baek JH, Chung J, Ha EJ, Kim JH, Lee YH, et al. 2016; Ultrasonography diagnosis and imaging-based management of thyroid nodules: revised Korean Society of Thyroid Radiology consensus statement and recommendations. Korean J Radiol. 17(3):370–95. DOI:
10.3348/kjr.2016.17.3.370. PMID:
27134526. PMCID:
PMC4842857.

76. Tessler FN, Middleton WD, Grant EG, Hoang JK, Berland LL, Teefey SA, et al. 2017; ACR Thyroid Imaging, Reporting and Data System (TI-RADS): white paper of the ACR TI-RADS Committee. J Am Coll Radiol. 14(5):587–95. DOI:
10.1016/j.jacr.2017.01.046. PMID:
28372962.

77. Russ G, Bonnema SJ, Erdogan MF, Durante C, Ngu R, Leenhardt L. 2017; European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: the EU-TIRADS. Eur Thyroid J. 6(5):225–37. DOI:
10.1159/000478927. PMID:
29167761. PMCID:
PMC5652895.

78. Zhou J, Yin L, Wei X, Zhang S, Song Y, Luo B, et al. 2020; 2020 Chinese guidelines for ultrasound malignancy risk stratification of thyroid nodules: the C-TIRADS. Endocrine. 70(2):256–79. DOI:
10.1007/s12020-020-02441-y. PMID:
32827126.
79. Moon WJ, Jung SL, Lee JH, Na DG, Baek JH, Lee YH, et al. 2008; Benign and malignant thyroid nodules: US differentiation--multicenter retrospective study. Radiology. 247(3):762–70. DOI:
10.1148/radiol.2473070944. PMID:
18403624.

80. Brito JP, Gionfriddo MR, Al Nofal A, Boehmer KR, Leppin AL, Reading C, et al. 2014; The accuracy of thyroid nodule ultrasound to predict thyroid cancer: systematic review and meta-analysis. J Clin Endocrinol Metab. 99(4):1253–63. DOI:
10.1210/jc.2013-2928. PMID:
24276450. PMCID:
PMC3973781.

81. Campanella P, Ianni F, Rota CA, Corsello SM, Pontecorvi A. 2014; Quantification of cancer risk of each clinical and ultrasonographic suspicious feature of thyroid nodules: a systematic review and meta-analysis. Eur J Endocrinol. 170(5):R203–11. DOI:
10.1530/EJE-13-0995. PMID:
24536085.
82. Remonti LR, Kramer CK, Leitao CB, Pinto LC, Gross JL. 2015; Thyroid ultrasound features and risk of carcinoma: a systematic review and meta-analysis of observational studies. Thyroid. 25(5):538–50. DOI:
10.1089/thy.2014.0353. PMID:
25747526. PMCID:
PMC4447137.

83. Na DG, Baek JH, Sung JY, Kim JH, Kim JK, Choi YJ, et al. 2016; Thyroid Imaging Reporting and Data System risk stratification of thyroid nodules: categorization based on solidity and echogenicity. Thyroid. 26(4):562–72. DOI:
10.1089/thy.2015.0460. PMID:
26756476.

84. Sugitani I, Ito Y, Takeuchi D, Nakayama H, Masaki C, Shindo H, et al. 2021; Indications and strategy for active surveillance of adult low-risk papillary thyroid microcarcinoma: consensus statements from the Japan Association of Endocrine Surgery Task Force on management for papillary thyroid microcarcinoma. Thyroid. 31(2):183–92. DOI:
10.1089/thy.2020.0330. PMID:
33023426. PMCID:
PMC7891203.

85. Suzuki S. 2016; Childhood and adolescent thyroid cancer in Fukushima after the Fukushima Daiichi Nuclear Power Plant Accident: 5 years on. Clin Oncol (R Coll Radiol). 28(4):263–71. DOI:
10.1016/j.clon.2015.12.027. PMID:
26822892.

86. Chen W, Parsons M, Torigian DA, Zhuang H, Alavi A. 2009; Evaluation of thyroid FDG uptake incidentally identified on FDG-PET/CT imaging. Nucl Med Commun. 30(3):240–4. DOI:
10.1097/MNM.0b013e328324b431. PMID:
19262287.

87. Nishimori H, Tabah R, Hickeson M, How J. 2011; Incidental thyroid "PETomas": clinical significance and novel description of the self-resolving variant of focal FDG-PET thyroid uptake. Can J Surg. 54(2):83–8. DOI:
10.1503/cjs.023209. PMID:
21251421. PMCID:
PMC3116704.

88. Soelberg KK, Bonnema SJ, Brix TH, Hegedus L. 2012; Risk of malignancy in thyroid incidentalomas detected by 18F-fluorodeoxyglucose positron emission tomography: a systematic review. Thyroid. 22(9):918–25. DOI:
10.1089/thy.2012.0005. PMID:
22827552.

89. Chung SR, Choi YJ, Suh CH, Kim HJ, Lee JJ, Kim WG, et al. 2018; Thyroid incidentalomas detected on (18)F-fluorodeoxyglucose positron emission tomography with computed tomography: malignant risk stratification and management plan. Thyroid. 28(6):762–8. DOI:
10.1089/thy.2017.0560. PMID:
29759033.

90. Felder GJ, Naeem M, Shady W, Shetty AS, Fraum TJ, Itani M. 2021; Risk stratification of (18)F-fluorodeoxyglucose-avid thyroid nodules based on ACR thyroid imaging reporting and data system. J Am Coll Radiol. 18(3 Pt A):388–94. DOI:
10.1016/j.jacr.2020.08.021. PMID:
33137296.

91. de Leijer JF, Metman MJH, van der Hoorn A, Brouwers AH, Kruijff S, van Hemel BM, et al. 2021; Focal thyroid incidentalomas on (18)F-FDG PET/CT: a systematic review and meta-analysis on prevalence, risk of malignancy and inconclusive fine needle aspiration. Front Endocrinol (Lausanne). 12:723394. DOI:
10.3389/fendo.2021.723394. PMID:
34744999. PMCID:
PMC8564374.

92. Ali SZ, Cibas ES. 2010. The Bethesda system for reporting thyroid cytopathology. Springer;New York: DOI:
10.1007/978-0-387-87666-5.
93. Ali SZ, Cibas ES. 2018. The Bethesda system for reporting thyroid cytopathology. 2nd ed. Springer;New York: DOI:
10.1007/978-3-319-60570-8.
94. Ali SZ, Baloch ZW, Cochand-Priollet B, Schmitt FC, Vielh P, VanderLaan PA. The 2023 Bethesda system for reporting thyroid cytopathology. J Am Soc Cytopathol. 2023; 12(5):319–325. DOI:
10.1016/j.jasc.2023.05.005. PMID:
37438235.

95. Valderrabano P, Khazai L, Thompson ZJ, Sharpe SC, Tarasova VD, Otto KJ, et al. 2018; Cancer risk associated with nuclear atypia in cytologically indeterminate thyroid nodules: a systematic review and meta-analysis. Thyroid. 28(2):210–9. DOI:
10.1089/thy.2017.0419. PMID:
29160163. PMCID:
PMC7869885.

96. Joo L, Na DG, Kim JH, Seo H. 2022; Comparison of core needle biopsy and repeat fine-needle aspiration in avoiding diagnostic surgery for thyroid nodules initially diagnosed as atypia/follicular lesion of undetermined significance. Korean J Radiol. 23(2):280–8. DOI:
10.3348/kjr.2021.0619. PMID:
35029081. PMCID:
PMC8814697.

97. Kim K, Bae JS, Kim JS, Jung SL, Jung CK. 2022; Diagnostic performance of thyroid core needle biopsy using the revised reporting system: comparison with fine needle aspiration cytology. Endocrinol Metab (Seoul). 37(1):159–69. DOI:
10.3803/EnM.2021.1299. PMID:
35255608. PMCID:
PMC8901962.

98. Park JY, Yi SY, Baek SH, Lee YH, Kwon HJ, Park HJ. 2022; Diagnostic efficacy, performance and safety of side-cut core needle biopsy for thyroid nodules: comparison of automated and semi-automated biopsy needles. Endocrine. 76(2):341–8. DOI:
10.1007/s12020-022-02980-6. PMID:
35032314.

99. Ahn HS, Youn I, Na DG, Kim SJ, Lee MY. 2021; Diagnostic performance of core needle biopsy as a first-line diagnostic tool for thyroid nodules according to ultrasound patterns: comparison with fine needle aspiration using propensity score matching analysis. Clin Endocrinol (Oxf). 94(3):494–503. DOI:
10.1111/cen.14321. PMID:
32869866.

100. Son HM, Kim JH, Kim SC, Yoo RE, Bae JM, Seo H, et al. 2020; Distribution and malignancy risk of six categories of the pathology reporting system for thyroid core-needle biopsy in 1,216 consecutive thyroid nodules. Ultrasonography. 39(2):159–65. DOI:
10.14366/usg.19056. PMID:
32105436. PMCID:
PMC7065982.

101. Chung SR, Baek JH, Lee JH, Lee YM, Sung TY, Chung KW, et al. 2019; Risk of malignancy according to the sub- classification of atypia of undetermined significance and suspicious follicular neoplasm categories in thyroid core needle biopsies. Endocr Pathol. 30(2):146–54. DOI:
10.1007/s12022-019-9577-4. PMID:
31044350.

102. Na HY, Woo JW, Moon JH, Choi JY, Jeong WJ, Kim YK, et al. 2019; Preoperative diagnostic categories of noninvasive follicular thyroid neoplasm with papillary-like nuclear features in thyroid core needle biopsy and its impact on risk of malignancy. Endocr Pathol. 30(4):329–39. DOI:
10.1007/s12022-019-09590-5. PMID:
31605276.

103. Xiong Y, Yan L, Nong L, Zheng Y, Li T. 2019; Pathological diagnosis of thyroid nodules based on core needle biopsies: comparative study between core needle biopsies and resected specimens in 578 cases. Diagn Pathol. 14(1):10. DOI:
10.1186/s13000-019-0786-4. PMID:
30711008. PMCID:
PMC6359785.

104. Ahn HS, Seo M, Ha SM, Kim HS. 2018; Comparison of the diagnostic efficacy of ultrasound-guided core needle biopsy with 18- versus 20-gauge needles for thyroid nodules. J Ultrasound Med. 37(11):2565–74. DOI:
10.1002/jum.14614. PMID:
29575135.

105. Choe J, Baek JH, Park HS, Choi YJ, Lee JH. 2018; Core needle biopsy of thyroid nodules: outcomes and safety from a large single-center single-operator study. Acta Radiol. 59(8):924–31. DOI:
10.1177/0284185117741916. PMID:
29137498.

106. Choe JY, Kwak Y, Kim M, Chung YR, Kim HJ, Kim YK, et al. 2018; Utility of a formatted pathologic reporting system in thyroid core needle biopsy: a validation study of 1998 consecutive cases. Clin Endocrinol (Oxf). 88(1):96–104. DOI:
10.1111/cen.13397. PMID:
28618022.

107. Hong MJ, Na DG, Kim SJ, Kim DS. 2018; Role of core needle biopsy as a first-line diagnostic tool for thyroid nodules: a retrospective cohort study. Ultrasonography. 37(3):244–53. DOI:
10.14366/usg.17041. PMID:
29113031. PMCID:
PMC6044216.

108. Chung SR, Baek JH, Park HS, Choi YJ, Sung TY, Song DE, et al. 2017; Ultrasound-pathology discordant nodules on core-needle biopsy: malignancy risk and management strategy. Thyroid. 27(5):707–13. DOI:
10.1089/thy.2016.0462. PMID:
28326900.

109. Kim HC, Kim YJ, Han HY, Yi JM, Baek JH, Park SY, et al. 2017; First-line use of core needle biopsy for high-yield preliminary diagnosis of thyroid nodules. AJNR Am J Neuroradiol. 38(2):357–63. DOI:
10.3174/ajnr.A5007. PMID:
27932508. PMCID:
PMC7963827.

110. Suh CH, Baek JH, Choi YJ, Kim TY, Sung TY, Song DE, et al. 2017; Efficacy and safety of core-needle biopsy in initially detected thyroid nodules via propensity score analysis. Sci Rep. 7(1):8242. DOI:
10.1038/s41598-017-07924-z. PMID:
28811482. PMCID:
PMC5557918.

111. Suh CH, Baek JH, Lee JH, Choi YJ, Kim JK, Sung TY, et al. 2016; The role of core-needle biopsy as a first-line diagnostic tool for initially detected thyroid nodules. Thyroid. 26(3):395–403. DOI:
10.1089/thy.2015.0404. PMID:
26651390.

112. Suh CH, Baek JH, Lee JH, Choi YJ, Kim KW, Lee J, et al. 2016; The role of core-needle biopsy in the diagnosis of thyroid malignancy in 4580 patients with 4746 thyroid nodules: a systematic review and meta-analysis. Endocrine. 54(2):315–28. DOI:
10.1007/s12020-016-0991-9. PMID:
27220941.

113. Kim YH, Kwon HJ, Kim EK, Kwak JY, Moon HJ, Yoon JH. 2015; Applying ultrasound-guided core needle biopsy for diagnosis of thyroid masses: preliminary results from a single institution. J Ultrasound Med. 34(10):1801–8. DOI:
10.7863/ultra.15.14.12028. PMID:
26324755.
114. Ha EJ, Baek JH, Lee JH, Kim JK, Kim JK, Lim HK, et al. 2014; Core needle biopsy can minimise the non-diagnostic results and need for diagnostic surgery in patients with calcified thyroid nodules. Eur Radiol. 24(6):1403–9. DOI:
10.1007/s00330-014-3123-z. PMID:
24604217.

115. Trimboli P, Nasrollah N, Guidobaldi L, Taccogna S, Cicciarella Modica DD, Amendola S, et al. 2014; The use of core needle biopsy as first-line in diagnosis of thyroid nodules reduces false negative and inconclusive data reported by fine-needle aspiration. World J Surg Oncol. 12:61. DOI:
10.1186/1477-7819-12-61. PMID:
24661377. PMCID:
PMC3987871.

116. Ha EJ, Baek JH, Lee JH, Song DE, Kim JK, Shong YK, et al. 2013; Sonographically suspicious thyroid nodules with initially benign cytologic results: the role of a core needle biopsy. Thyroid. 23(6):703–8. DOI:
10.1089/thy.2012.0426. PMID:
23544697.

117. Sung JY, Na DG, Kim KS, Yoo H, Lee H, Kim JH, et al. 2012; Diagnostic accuracy of fine-needle aspiration versus core-needle biopsy for the diagnosis of thyroid malignancy in a clinical cohort. Eur Radiol. 22(7):1564–72. DOI:
10.1007/s00330-012-2405-6. PMID:
22415411.

118. Crothers BA, Henry MR, Firat P, Frates MC, Rossi ED. Ali SZ, Cibas ES, editors. 2018. Nondiagnostic/unsatisfactory. The Bethesda system for reporting thyroid cytopathology. New York: Springer;2018. p. 7–18. DOI:
10.1007/978-3-319-60570-8_2.

119. Wu HH, Rose C, Elsheikh TM. 2012; The Bethesda system for reporting thyroid cytopathology: an experience of 1,382 cases in a community practice setting with the implication for risk of neoplasm and risk of malignancy. Diagn Cytopathol. 40(5):399–403. DOI:
10.1002/dc.21754. PMID:
21681976.

120. Layfield LJ, Abrams J, Cochand-Priollet B, Evans D, Gharib H, Greenspan F, et al. 2008; Post-thyroid FNA testing and treatment options: a synopsis of the National Cancer Institute Thyroid Fine Needle Aspiration State of the Science Conference. Diagn Cytopathol. 36(6):442–8. DOI:
10.1002/dc.20832. PMID:
18478610.

121. Singh RS, Wang HH. 2011; Timing of repeat thyroid fine-needle aspiration in the management of thyroid nodules. Acta Cytol. 55(6):544–8. DOI:
10.1159/000334214. PMID:
22156464.

122. Lubitz CC, Nagarkatti SS, Faquin WC, Samir AE, Hassan MC, Barbesino G, et al. 2012; Diagnostic yield of nondiagnostic thyroid nodules is not altered by timing of repeat biopsy. Thyroid. 22(6):590–4. DOI:
10.1089/thy.2011.0442. PMID:
22667452. PMCID:
PMC3733136.

123. Valerio E, Pastorello RG, Calsavara V, Porfirio MM, Engelman GG, Francisco Dalcin J, et al. 2020; Should we wait 3 months for a repeat aspiration in non-diagnostic/indeterminate thyroid nodules? A cancer centre experience. Cytopathology. 31(6):525–32. DOI:
10.1111/cyt.12887. PMID:
32656878.

124. Orija IB, Pineyro M, Biscotti C, Reddy SS, Hamrahian AH. 2007; Value of repeating a nondiagnostic thyroid fine-needle aspiration biopsy. Endocr Pract. 13(7):735–42. DOI:
10.4158/EP.13.7.735. PMID:
18194930.

125. Alexander EK, Heering JP, Benson CB, Frates MC, Doubilet PM, Cibas ES, et al. 2002; Assessment of nondiagnostic ultrasound-guided fine needle aspirations of thyroid nodules. J Clin Endocrinol Metab. 87(11):4924–7. DOI:
10.1210/jc.2002-020865. PMID:
12414851.

126. Choi YS, Hong SW, Kwak JY, Moon HJ, Kim EK. 2012; Clinical and ultrasonographic findings affecting nondiagnostic results upon the second fine needle aspiration for thyroid nodules. Ann Surg Oncol. 19(7):2304–9. DOI:
10.1245/s10434-012-2288-4. PMID:
22395996.

127. Na DG, Kim JH, Sung JY, Baek JH, Jung KC, Lee H, et al. 2012; Core-needle biopsy is more useful than repeat fine-needle aspiration in thyroid nodules read as nondiagnostic or atypia of undetermined significance by the Bethesda system for reporting thyroid cytopathology. Thyroid. 22(5):468–75. DOI:
10.1089/thy.2011.0185. PMID:
22304417.

128. Lee SH, Kim MH, Bae JS, Lim DJ, Jung SL, Jung CK. 2014; Clinical outcomes in patients with non-diagnostic thyroid fine needle aspiration cytology: usefulness of the thyroid core needle biopsy. Ann Surg Oncol. 21(6):1870–7. DOI:
10.1245/s10434-013-3365-z. PMID:
24526545.

129. Choi SH, Baek JH, Lee JH, Choi YJ, Hong MJ, Song DE, et al. 2014; Thyroid nodules with initially non-diagnostic, fine-needle aspiration results: comparison of core-needle biopsy and repeated fine-needle aspiration. Eur Radiol. 24(11):2819–26. DOI:
10.1007/s00330-014-3325-4. PMID:
25038860.

130. Jung SM, Koo HR, Jang KS, Chung MS, Song CM, Ji YB, et al. 2021; Comparison of core-needle biopsy and repeat fine-needle aspiration for thyroid nodules with inconclusive initial cytology. Eur Arch Otorhinolaryngol. 278(8):3019–25. DOI:
10.1007/s00405-020-06473-y. PMID:
33196875.

131. Moon HJ, Kwak JY, Choi YS, Kim EK. 2012; How to manage thyroid nodules with two consecutive non-diagnostic results on ultrasonography-guided fine-needle aspiration. World J Surg. 36(3):586–92. DOI:
10.1007/s00268-011-1397-8. PMID:
22228400.

132. Vuong HG, Chung DGB, Ngo LM, Bui TQ, Hassell L, Jung CK, et al. 2021; The use of the Bethesda system for reporting thyroid cytopathology in pediatric thyroid nodules: a meta-analysis. Thyroid. 31(8):1203–11. DOI:
10.1089/thy.2020.0702. PMID:
33504264.

133. Vuong HG, Ngo HTT, Bychkov A, Jung CK, Vu TH, Lu KB, et al. 2020; Differences in surgical resection rate and risk of malignancy in thyroid cytopathology practice between Western and Asian countries: a systematic review and meta-analysis. Cancer Cytopathol. 128(4):238–49. DOI:
10.1002/cncy.22228. PMID:
31883438.

134. Chehade JM, Silverberg AB, Kim J, Case C, Mooradian AD. 2001; Role of repeated fine-needle aspiration of thyroid nodules with benign cytologic features. Endocr Pract. 7(4):237–43. DOI:
10.4158/EP.7.4.237. PMID:
11497473.

135. Orlandi A, Puscar A, Capriata E, Fideleff H. 2005; Repeated fine-needle aspiration of the thyroid in benign nodular thyroid disease: critical evaluation of long-term follow-up. Thyroid. 15(3):274–8. DOI:
10.1089/thy.2005.15.274. PMID:
15785247.

136. Oertel YC, Miyahara-Felipe L, Mendoza MG, Yu K. 2007; Value of repeated fine needle aspirations of the thyroid: an analysis of over ten thousand FNAs. Thyroid. 17(11):1061–6. DOI:
10.1089/thy.2007.0159. PMID:
17910525.

137. Illouz F, Rodien P, Saint-Andre JP, Triau S, Laboureau- Soares S, Dubois S, et al. 2007; Usefulness of repeated fine-needle cytology in the follow-up of non-operated thyroid nodules. Eur J Endocrinol. 156(3):303–8. DOI:
10.1530/EJE-06-0616. PMID:
17322489.

138. Tee YY, Lowe AJ, Brand CA, Judson RT. 2007; Fine-needle aspiration may miss a third of all malignancy in palpable thyroid nodules: a comprehensive literature review. Ann Surg. 246(5):714–20. DOI:
10.1097/SLA.0b013e3180f61adc. PMID:
17968160.
139. Pinchot SN, Al-Wagih H, Schaefer S, Sippel R, Chen H. 2009; Accuracy of fine-needle aspiration biopsy for predicting neoplasm or carcinoma in thyroid nodules 4 cm or larger. Arch Surg. 144(7):649–55. DOI:
10.1001/archsurg.2009.116. PMID:
19620545. PMCID:
PMC2910711.

140. Kuru B, Gulcelik NE, Gulcelik MA, Dincer H. 2010; The false-negative rate of fine-needle aspiration cytology for diagnosing thyroid carcinoma in thyroid nodules. Langenbecks Arch Surg. 395(2):127–32. DOI:
10.1007/s00423-009-0470-3. PMID:
19296123.

141. Wharry LI, McCoy KL, Stang MT, Armstrong MJ, LeBeau SO, Tublin ME, et al. 2014; Thyroid nodules (>/=4 cm): can ultrasound and cytology reliably exclude cancer? World J Surg. 38(3):614–21. DOI:
10.1007/s00268-013-2261-9. PMID:
24081539.
142. Nou E, Kwong N, Alexander LK, Cibas ES, Marqusee E, Alexander EK. 2014; Determination of the optimal time interval for repeat evaluation after a benign thyroid nodule aspiration. J Clin Endocrinol Metab. 99(2):510–6. DOI:
10.1210/jc.2013-3160. PMID:
24276452. PMCID:
PMC4413457.

143. Yoon JH, Kwak JY, Moon HJ, Kim MJ, Kim EK. 2011; The diagnostic accuracy of ultrasound-guided fine-needle aspiration biopsy and the sonographic differences between benign and malignant thyroid nodules 3 cm or larger. Thyroid. 21(9):993–1000. DOI:
10.1089/thy.2010.0458. PMID:
21834673.

144. Porterfield JR Jr, Grant CS, Dean DS, Thompson GB, Farley DR, Richards ML, et al. 2008; Reliability of benign fine needle aspiration cytology of large thyroid nodules. Surgery. 144(6):963–8. discussion 8–9. DOI:
10.1016/j.surg.2008.09.006. PMID:
19041004.

145. Hong MJ, Na DG, Baek JH, Sung JY, Kim JH. 2017; Cytology- ultrasonography risk-stratification scoring system based on fine-needle aspiration cytology and the Korean-Thyroid Imaging Reporting and Data System. Thyroid. 27(7):953–9. DOI:
10.1089/thy.2016.0603. PMID:
28463597.

146. Krane JF, Nayar R, Renshaw AA. Ali SZ, Cibas ES, editors. 2018. Atypia of undetermined significance/follicular lesion of undetermined significance. The Bethesda system for reporting thyroid cytopathology. New York: Springer;p. 49–70. DOI:
10.1007/978-3-319-60570-8_4.

147. Cibas ES, Baloch ZW, Fellegara G, LiVolsi VA, Raab SS, Rosai J, et al. 2013; A prospective assessment defining the limitations of thyroid nodule pathologic evaluation. Ann Intern Med. 159(5):325–32. DOI:
10.7326/0003-4819-159-5-201309030-00006. PMID:
24026318.

148. Davidov T, Trooskin SZ, Shanker BA, Yip D, Eng O, Crystal J, et al. 2010; Routine second-opinion cytopathology review of thyroid fine needle aspiration biopsies reduces diagnostic thyroidectomy. Surgery. 148(6):1294–9. discussion 9–301. DOI:
10.1016/j.surg.2010.09.029. PMID:
21134564.

149. Park KT, Ahn SH, Mo JH, Park YJ, Park DJ, Choi SI, et al. 2011; Role of core needle biopsy and ultrasonographic finding in management of indeterminate thyroid nodules. Head Neck. 33(2):160–5. DOI:
10.1002/hed.21414. PMID:
20848434.

150. Lee KH, Shin JH, Oh YL, Hahn SY. 2014; Atypia of undetermined significance in thyroid fine-needle aspiration cytology: prediction of malignancy by US and comparison of methods for further management. Ann Surg Oncol. 21(7):2326–31. DOI:
10.1245/s10434-014-3568-y. PMID:
24566858.

151. Na DG, Min HS, Lee H, Won JK, Seo HB, Kim JH. 2015; Role of core needle biopsy in the management of atypia/follicular lesion of undetermined significance thyroid nodules: comparison with repeat fine-needle aspiration in subcategory nodules. Eur Thyroid J. 4(3):189–96. DOI:
10.1159/000437051. PMID:
26558236. PMCID:
PMC4637794.

152. Kim SK, Hwang TS, Yoo YB, Han HS, Kim DL, Song KH, et al. 2011; Surgical results of thyroid nodules according to a management guideline based on the BRAF(V600E) mutation status. J Clin Endocrinol Metab. 96(3):658–64. DOI:
10.1210/jc.2010-1082. PMID:
21239517.

153. Adeniran AJ, Hui P, Chhieng DC, Prasad ML, Schofield K, Theoharis C. 2011; BRAF mutation testing of thyroid fine-needle aspiration specimens enhances the predictability of malignancy in thyroid follicular lesions of undetermined significance. Acta Cytol. 55(6):570–5. DOI:
10.1159/000333274. PMID:
22156468.
154. Ngo HTT, Nguyen TPX, Vu TH, Jung CK, Hassell L, Kakudo K, et al. 2021; Impact of molecular testing on the management of indeterminate thyroid nodules among Western and Asian countries: a systematic review and meta-analysis. Endocr Pathol. 32(2):269–79. DOI:
10.1007/s12022-020-09643-0. PMID:
32767256.

155. Roth MY, Witt RL, Steward DL. 2018; Molecular testing for thyroid nodules: review and current state. Cancer. 124(5):888–98. DOI:
10.1002/cncr.30708. PMID:
29278433.

156. Patel KN, Angell TE, Babiarz J, Barth NM, Blevins T, Duh QY, et al. 2018; Performance of a genomic sequencing classifier for the preoperative diagnosis of cytologically indeterminate thyroid nodules. JAMA Surg. 153(9):817–24. DOI:
10.1001/jamasurg.2018.1153. PMID:
29799911. PMCID:
PMC6583881.

157. Steward DL, Carty SE, Sippel RS, Yang SP, Sosa JA, Sipos JA, et al. 2019; Performance of a multigene genomic classifier in thyroid nodules with indeterminate cytology: a prospective blinded multicenter study. JAMA Oncol. 5(2):204–12. DOI:
10.1001/jamaoncol.2018.4616. PMID:
30419129. PMCID:
PMC6439562.

158. Labourier E, Shifrin A, Busseniers AE, Lupo MA, Manganelli ML, Andruss B, et al. 2015; Molecular testing for miRNA, mRNA, and DNA on fine-needle aspiration improves the preoperative diagnosis of thyroid nodules with indeterminate cytology. J Clin Endocrinol Metab. 100(7):2743–50. DOI:
10.1210/jc.2015-1158. PMID:
25965083. PMCID:
PMC4490308.

159. Lithwick-Yanai G, Dromi N, Shtabsky A, Morgenstern S, Strenov Y, Feinmesser M, et al. 2017; Multicentre validation of a microRNA-based assay for diagnosing indeterminate thyroid nodules utilising fine needle aspirate smears. J Clin Pathol. 70(6):500–7. DOI:
10.1136/jclinpath-2016-204089. PMID:
27798083. PMCID:
PMC5484037.

161. Larcher de Almeida AM, Delfim RLC, Vidal APA, Chaves M, Santiago ACL, Gianotti MF, et al. 2021; Combining the American Thyroid Association's ultrasound classification with cytological subcategorization improves the assessment of malignancy risk in indeterminate thyroid nodules. Thyroid. 31(6):922–32. DOI:
10.1089/thy.2019.0575. PMID:
33143569.

162. Słowińska-Klencka D, Wysocka-Konieczna K, Klencki M, Popowicz B. 2020; Diagnostic value of six thyroid imaging reporting and data systems (TIRADS) in cytologically equivocal thyroid nodules. J Clin Med. 9(7):2281. DOI:
10.3390/jcm9072281. PMID:
32709122. PMCID:
PMC7408998.

163. Henry MR, Westra WH, Krane JF, Schmitt F. Ali SZ, Cibas ES, editors. 2018. Follicular neoplasm/suspicious for a follicular neoplasm. The Bethesda system for reporting thyroid cytopathology. Springer;New York: p. 71–80. DOI:
10.1007/978-3-319-60570-8_5.

164. Nikiforov YE, Seethala RR, Tallini G, Baloch ZW, Basolo F, Thompson LD, et al. 2016; Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: a paradigm shift to reduce overtreatment of indolent tumors. JAMA Oncol. 2(8):1023–9. DOI:
10.1001/jamaoncol.2016.0386. PMID:
27078145. PMCID:
PMC5539411.

165. Kuru B, Kefeli M. 2018; Risk factors associated with malignancy and with triage to surgery in thyroid nodules classified as Bethesda category IV (FN/SFN). Diagn Cytopathol. 46(6):489–94. DOI:
10.1002/dc.23923. PMID:
29524316.

166. Parikh PP, Allan BJ, Lew JI. 2013; Surgeon-performed ultrasound predictors of malignancy in patients with Hurthle cell neoplasms of the thyroid. J Surg Res. 184(1):247–52. DOI:
10.1016/j.jss.2013.03.005. PMID:
23535112.
167. Petric R, Perhavec A, Gazic B, Besic N. 2012; Preoperative serum thyroglobulin concentration is an independent predictive factor of malignancy in follicular neoplasms of the thyroid gland. J Surg Oncol. 105(4):351–6. DOI:
10.1002/jso.22030. PMID:
21751218.

168. Lubitz CC, Faquin WC, Yang J, Mekel M, Gaz RD, Parangi S, et al. 2010; Clinical and cytological features predictive of malignancy in thyroid follicular neoplasms. Thyroid. 20(1):25–31. DOI:
10.1089/thy.2009.0208. PMID:
20025540.

169. Williams MD, Suliburk JW, Staerkel GA, Busaidy NL, Clayman GL, Evans DB, et al. 2009; Clinical significance of distinguishing between follicular lesion and follicular neoplasm in thyroid fine-needle aspiration biopsy. Ann Surg Oncol. 16(11):3146–53. DOI:
10.1245/s10434-009-0666-3. PMID:
19727961.

170. Choi YJ, Yun JS, Kim DH. 2009; Clinical and ultrasound features of cytology diagnosed follicular neoplasm. Endocr J. 56(3):383–9. DOI:
10.1507/endocrj.K08E-310. PMID:
19164864.

171. Gulcelik NE, Gulcelik MA, Kuru B. 2008; Risk of malignancy in patients with follicular neoplasm: predictive value of clinical and ultrasonographic features. Arch Otolaryngol Head Neck Surg. 134(12):1312–5. DOI:
10.1001/archotol.134.12.1312. PMID:
19075128.

172. Raber W, Kaserer K, Niederle B, Vierhapper H. 2000; Risk factors for malignancy of thyroid nodules initially identified as follicular neoplasia by fine-needle aspiration: results of a prospective study of one hundred twenty patients. Thyroid. 10(8):709–12. DOI:
10.1089/10507250050137806. PMID:
11014317.

173. Tuttle RM, Lemar H, Burch HB. 1998; Clinical features associated with an increased risk of thyroid malignancy in patients with follicular neoplasia by fine-needle aspiration. Thyroid. 8(5):377–83. DOI:
10.1089/thy.1998.8.377. PMID:
9623727.

174. Baloch ZW, Fleisher S, LiVolsi VA, Gupta PK. 2002; Diagnosis of "follicular neoplasm": a gray zone in thyroid fine-needle aspiration cytology. Diagn Cytopathol. 26(1):41–4. DOI:
10.1002/dc.10043. PMID:
11782086.

175. Kim HJ, Mok JO, Kim CH, Kim YJ, Kim SJ, Park HK, et al. 2017; Preoperative serum thyroglobulin and changes in serum thyroglobulin during TSH suppression independently predict follicular thyroid carcinoma in thyroid nodules with a cytological diagnosis of follicular lesion. Endocr Res. 42(2):154–62. DOI:
10.1080/07435800.2016.1262395. PMID:
27936964.

176. Giorgadze T, Rossi ED, Fadda G, Gupta PK, Livolsi VA, Baloch Z. 2004; Does the fine-needle aspiration diagnosis of "Hurthle-cell neoplasm/follicular neoplasm with oncocytic features" denote increased risk of malignancy? Diagn Cytopathol. 31(5):307–12. DOI:
10.1002/dc.20132. PMID:
15468114.
177. Raparia K, Min SK, Mody DR, Anton R, Amrikachi M. 2009; Clinical outcomes for "suspicious" category in thyroid fine-needle aspiration biopsy: patient's sex and nodule size are possible predictors of malignancy. Arch Pathol Lab Med. 133(5):787–90. DOI:
10.5858/133.5.787. PMID:
19415954.

178. Durante C, Hegedus L, Czarniecka A, Paschke R, Russ G, Schmitt F, et al. 2023; 2023 European Thyroid Association clinical practice guidelines for thyroid nodule management. Eur Thyroid J. 12(5):e230067. DOI:
10.1530/ETJ-23-0067.

179. Cho YY, Ahn SH, Lee EK, Park YJ, Choi D, Kim BY, et al. 2024; Malignancy risk of follicular neoplasm (Bethesda IV) with variable cutoffs of tumor size: a systemic review and meta-analysis. J Clin Endocrinol Metab. 109(5):1383–92. DOI:
10.1210/clinem/dgad684. PMID:
38113188.

180. Ali SZ, Baloch ZW, Cochand-Priollet B, Schmitt FC, Vielh P, VanderLaan PA. 2023; The 2023 Bethesda system for reporting thyroid cytopathology. Thyroid. 33(9):1039–44. DOI:
10.1089/thy.2023.0141. PMID:
37427847.

181. Lasolle H, Lopez J, Pattou F, Borson-Chazot F, Bardet S, Groussin L, et al. 2022; SFE-AFCE-SFMN 2022 consensus on the management of thyroid nodules : role of molecular tests for cytologically indeterminate thyroid nodules. Ann Endocrinol (Paris). 83(6):395–400. DOI:
10.1016/j.ando.2022.10.006. PMID:
36283464.

182. Hu TX, Nguyen DT, Patel M, Beckett K, Douek M, Masamed R, et al. 2022; The effect modification of ultrasound risk classification on molecular testing in predicting the risk of malignancy in cytologically indeterminate thyroid nodules. Thyroid. 32(8):905–16. DOI:
10.1089/thy.2021.0659. PMID:
35611970.

183. Stewardson P, Eszlinger M, Paschke R. 2022; Diagnosis of endocrine disease: usefulness of genetic testing of fine-needle aspirations for diagnosis of thyroid cancer. Eur J Endocrinol. 187(3):R41–R52. DOI:
10.1530/EJE-21-1293. PMID:
35900312.

184. Colombo C, Muzza M, Pogliaghi G, Palazzo S, Vannucchi G, Vicentini L, et al. 2021; The thyroid risk score (TRS) for nodules with indeterminate cytology. Endocr Relat Cancer. 28(4):225–35. DOI:
10.1530/ERC-20-0511. PMID:
33640868.

185. VanderLaan PA, Chandra A, Filie AC, Randolph GW, Powers CN. Ali SZ, Cibas ES, editors. 2018. Suspicious for malignancy. The Bethesda system for reporting thyroid cytopathology. Springer;New York: p. 101–18. DOI:
10.1007/978-3-319-60570-8_7.
186. Chen B, Shi Y, Xu Y, Zhang J. 2021; The predictive value of coexisting BRAFV600E and TERT promoter mutations on poor outcomes and high tumour aggressiveness in papillary thyroid carcinoma: a systematic review and meta-analysis. Clin Endocrinol (Oxf). 94(5):731–42. DOI:
10.1111/cen.14316. PMID:
32816325.

187. Moon S, Song YS, Kim YA, Lim JA, Cho SW, Moon JH, et al. 2017; Effects of coexistent BRAF(V600E) and TERT promoter mutations on poor clinical outcomes in papillary thyroid cancer: a meta-analysis. Thyroid. 27(5):651–60. DOI:
10.1089/thy.2016.0350. PMID:
28181854.

188. Ha EJ, Lim HK, Yoon JH, Baek JH, Do KH, Choi M, et al. 2018; Primary imaging test and appropriate biopsy methods for thyroid nodules: guidelines by Korean Society of Radiology and National Evidence-based Healthcare Collaborating Agency. Korean J Radiol. 19(4):623–31. DOI:
10.3348/kjr.2018.19.4.623. PMID:
29962869. PMCID:
PMC6005947.

189. Ito Y, Miyauchi A, Inoue H, Fukushima M, Kihara M, Higashiyama T, et al. 2010; An observational trial for papillary thyroid microcarcinoma in Japanese patients. World J Surg. 34(1):28–35. DOI:
10.1007/s00268-009-0303-0. PMID:
20020290.

190. Molinaro E, Campopiano MC, Pieruzzi L, Matrone A, Agate L, Bottici V, et al. 2020; Active surveillance in papillary thyroid microcarcinomas is feasible and safe: experience at a single Italian center. J Clin Endocrinol Metab. 105(3):e172–80. DOI:
10.1210/clinem/dgz113. PMID:
31652318. PMCID:
PMC8105780.

191. Sanabria A. 2020; Experience with active surveillance of thyroid low-risk carcinoma in a developing country. Thyroid. 30(7):985–91. DOI:
10.1089/thy.2019.0522. PMID:
31950887.

192. Jin M, Kim HI, Ha J, Jeon MJ, Kim WG, Lim DJ, et al. 2021; Tumor volume doubling time in active surveillance of papillary thyroid microcarcinoma: a multicenter cohort study in Korea. Thyroid. 31(10):1494–501. DOI:
10.1089/thy.2021.0094. PMID:
34225475.

193. Nagaoka R, Ebina A, Toda K, Jikuzono T, Saitou M, Sen M, et al. 2021; Multifocality and progression of papillary thyroid microcarcinoma during active surveillance. World J Surg. 45(9):2769–76. DOI:
10.1007/s00268-021-06185-2. PMID:
34100116.

194. Ho AS, Kim S, Zalt C, Melany ML, Chen IE, Vasquez J, et al. 2022; Expanded parameters in active surveillance for low-risk papillary thyroid carcinoma: a nonrandomized controlled trial. JAMA Oncol. 8(11):1588–96. DOI:
10.1001/jamaoncol.2022.3875. PMID:
36107411. PMCID:
PMC9478884.

195. Lee EK, Moon JH, Hwangbo Y, Ryu CH, Cho SW, Choi JY, et al. 2022; Progression of low-risk papillary thyroid microcarcinoma during active surveillance: interim analysis of a multicenter prospective cohort study of active surveillance on papillary thyroid microcarcinoma in Korea. Thyroid. 32(11):1328–36. DOI:
10.1089/thy.2021.0614. PMID:
36205563. PMCID:
PMC9700369.

196. Ito Y, Miyauchi A, Fujishima M, Noda T, Sano T, Sasaki T, et al. 2023; Thyroid-stimulating hormone, age, and tumor size are risk factors for progression during active surveillance of low-risk papillary thyroid microcarcinoma in adults. World J Surg. 47(2):392–401. DOI:
10.1007/s00268-022-06770-z. PMID:
36182976. PMCID:
PMC9803751.

197. Miyauchi A, Ito Y, Fujishima M, Miya A, Onoda N, Kihara M, et al. 2023; Long-term outcomes of active surveillance and immediate surgery for adult patients with low-risk papillary thyroid microcarcinoma: 30-year experience. Thyroid. 33(7):817–25. DOI:
10.1089/thy.2023.0076. PMID:
37166389. PMCID:
PMC10354707.

198. Tuttle RM, Fagin J, Minkowitz G, Wong R, Roman B, Patel S, et al. 2022; Active surveillance of papillary thyroid cancer: frequency and time course of the six most common tumor volume kinetic patterns. Thyroid. 32(11):1337–45. DOI:
10.1089/thy.2022.0325. PMID:
36178355. PMCID:
PMC9700377.

199. Oh HS, Kwon H, Song E, Jeon MJ, Kim TY, Lee JH, et al. 2019; Tumor volume doubling time in active surveillance of papillary thyroid carcinoma. Thyroid. 29(5):642–9. DOI:
10.1089/thy.2018.0609. PMID:
30864894.

200. Lee JY, Kim JH, Kim YK, Lee CY, Lee EK, Moon JH, et al. 2023; US predictors of papillary thyroid microcarcinoma progression at active surveillance. Radiology. 309(1):e230006. DOI:
10.1148/radiol.230006. PMID:
37906009.

201. Ito Y, Miyauchi A, Kihara M, Higashiyama T, Kobayashi K, Miya A. 2014; Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation. Thyroid. 24(1):27–34. DOI:
10.1089/thy.2013.0367. PMID:
24001104. PMCID:
PMC3887422.

202. Mazzaferri EL. 2011; Approach to the pregnant patient with thyroid cancer. J Clin Endocrinol Metab. 96(2):265–72. DOI:
10.1210/jc.2010-1624. PMID:
21296990.

203. Oh HS, Kim WG, Park S, Kim M, Kwon H, Jeon MJ, et al. 2017; Serial neck ultrasonographic evaluation of changes in papillary thyroid carcinoma during pregnancy. Thyroid. 27(6):773–7. DOI:
10.1089/thy.2016.0618. PMID:
28446078.

204. Ito Y, Miyauchi A, Kudo T, Ota H, Yoshioka K, Oda H, et al. 2016; Effects of pregnancy on papillary microcarcinomas of the thyroid re-evaluated in the entire patient series at Kuma Hospital. Thyroid. 26(1):156–60. DOI:
10.1089/thy.2015.0393. PMID:
26670937. PMCID:
PMC4739387.

205. Horiguchi K, Yoshida Y, Iwaku K, Emoto N, Kasahara T, Sato J, et al. 2021; Position paper from the Japan Thyroid Association task force on the management of low-risk papillary thyroid microcarcinoma (T1aN0M0) in adults. Endocr J. 68(7):763–80. DOI:
10.1507/endocrj.EJ20-0692. PMID:
33762511.

206. Hwang H, Choi JY, Yu HW, Moon JH, Kim JH, Lee EK, et al. 2023; Surgical outcomes in patients with low-risk papillary thyroid microcarcinoma from MAeSTro study: immediate operation versus delayed operation after active surveillance: a multicenter prospective cohort study. Ann Surg. 278(5):e1087–e95. DOI:
10.1097/SLA.0000000000005841. PMID:
36912439.
207. Kim K, Choi JY, Kim SJ, Lee EK, Lee YK, Ryu JS, et al. 2022; Active surveillance versus immediate surgery for low-risk papillary thyroid microcarcinoma patients in South Korea: a cost-minimization analysis from the MAeSTro study. Thyroid. 32(6):648–56. DOI:
10.1089/thy.2021.0679. PMID:
35570657.

208. Baek HS, Ha J, Kim K, Bae J, Kim JS, Kim S, et al. 2023; Cost-effectiveness of active surveillance compared to early surgery of small papillary thyroid cancer: a retrospective study on a Korean population. J Korean Med Sci. 38(34):e264. DOI:
10.3346/jkms.2023.38.e264. PMID:
37644680. PMCID:
PMC10462480.

209. Kong SH, Ryu J, Kim MJ, Cho SW, Song YS, Yi KH, et al. 2019; Longitudinal assessment of quality of life according to treatment options in low-risk papillary thyroid microcarcinoma patients: active surveillance or immediate surgery (interim analysis of MAeSTro). Thyroid. 29(8):1089–96. DOI:
10.1089/thy.2018.0624. PMID:
31161898.

210. Moon JH, Ryu CH, Cho SW, Choi JY, Chung EJ, Hah JH, et al. 2021; Effect of initial treatment choice on 2-year quality of life in patients with low-risk papillary thyroid microcarcinoma. J Clin Endocrinol Metab. 106(3):724–35. DOI:
10.1210/clinem/dgaa889. PMID:
33248442.

211. Hwangbo Y, Choi JY, Lee EK, Ryu CH, Cho SW, Chung EJ, et al. 2022; A cross-sectional survey of patient treatment choice in a multicenter prospective cohort study on active surveillance of papillary thyroid microcarcinoma (MAeSTro). Thyroid. 32(7):772–80. DOI:
10.1089/thy.2021.0619. PMID:
35698288.

212. Brito JP, Moon JH, Zeuren R, Kong SH, Kim YG, Iniguez-Ariza NM, et al. 2018; Thyroid cancer treatment choice: a pilot study of a tool to facilitate conversations with patients with papillary microcarcinomas considering treatment options. Thyroid. 28(10):1325–31. DOI:
10.1089/thy.2018.0105. PMID:
29905089.

213. Goldner WS, Angell TE, McAdoo SL, Babiarz J, Sadow PM, Nabhan FA, et al. 2019; Molecular variants and their risks for malignancy in cytologically indeterminate thyroid nodules. Thyroid. 29(11):1594–605. DOI:
10.1089/thy.2019.0278. PMID:
31469053. PMCID:
PMC6864764.

214. Gilani SM, Abi-Raad R, Garritano J, Cai G, Prasad ML, Adeniran AJ. 2022; RAS mutation and associated risk of malignancy in the thyroid gland: an FNA study with cytology-histology correlation. Cancer Cytopathol. 130(4):284–93. DOI:
10.1002/cncy.22537. PMID:
34847284. PMCID:
PMC9467821.
215. Yang J, Gong Y, Yan S, Chen H, Qin S, Gong R. 2020; Association between TERT promoter mutations and clinical behaviors in differentiated thyroid carcinoma: a systematic review and meta-analysis. Endocrine. 67(1):44–57. DOI:
10.1007/s12020-019-02117-2. PMID:
31655978. PMCID:
PMC6969012.

216. Shonka DC Jr, Ho A, Chintakuntlawar AV, Geiger JL, Park JC, Seetharamu N, et al. 2022; American Head and Neck Society Endocrine Surgery Section and International Thyroid Oncology Group consensus statement on mutational testing in thyroid cancer: defining advanced thyroid cancer and its targeted treatment. Head Neck. 44(6):1277–300. DOI:
10.1002/hed.27025. PMID:
35274388. PMCID:
PMC9332138.

217. Kim SY, Jung CK. Frequency of TERT promoter mutations in real-world analysis of 2,092 thyroid carcinoma patients (Endocrinol Metab 2022;37:652-63, Heera Yang et al.). Endocrinol Metab (Seoul). 2022; 37(6):947–8. DOI:
10.3803/EnM.2022.1596. PMID:
36353807. PMCID:
PMC9816498.

218. Yang H, Park H, Ryu HJ, Heo J, Kim JS, Oh YL, et al. 2022; Frequency of TERT promoter mutations in real-world analysis of 2,092 thyroid carcinoma patients. Endocrinol Metab (Seoul). 37(4):652–63. DOI:
10.3803/EnM.2022.1477. PMID:
35864728. PMCID:
PMC9449103.
219. Kim SY, Kim T, Kim K, Bae JS, Kim JS, Jung CK. 2020; Highly prevalent BRAF V600E and low-frequency TERT promoter mutations underlie papillary thyroid carcinoma in Koreans. J Pathol Transl Med. 54(4):310–7. DOI:
10.4132/jptm.2020.05.12. PMID:
32527075. PMCID:
PMC7385264.

220. Choi YS, Choi SW, Yi JW. 2021; Prospective analysis of TERT promoter mutations in papillary thyroid carcinoma at a single institution. J Clin Med. 10(10):2179. DOI:
10.3390/jcm10102179. PMID:
34070093. PMCID:
PMC8158380.

221. Lee J, Ha EJ, Roh J, Kim HK. 2021; Presence of TERT +/- BRAF V600E mutation is not a risk factor for the clinical management of patients with papillary thyroid microcarcinoma. Surgery. 170(3):743–7. DOI:
10.1016/j.surg.2021.03.056. PMID:
33952391.

222. Wang N, Zhai H, Lu Y. 2013; Is fluorine-18 fluorodeoxyglucose positron emission tomography useful for the thyroid nodules with indeterminate fine needle aspiration biopsy? A meta- analysis of the literature. J Otolaryngol Head Neck Surg. 42(1):38. DOI:
10.1186/1916-0216-42-38. PMID:
24228840. PMCID:
PMC3765697.
223. Vriens D, Adang EM, Netea-Maier RT, Smit JW, de Wilt JH, Oyen WJ, et al. 2014; Cost-effectiveness of FDG-PET/CT for cytologically indeterminate thyroid nodules: a decision analytic approach. J Clin Endocrinol Metab. 99(9):3263–74. DOI:
10.1210/jc.2013-3483. PMID:
24873995.

224. Deandreis D, Al Ghuzlan A, Auperin A, Vielh P, Caillou B, Chami L, et al. 2012; Is (18)F-fluorodeoxyglucose-PET/CT useful for the presurgical characterization of thyroid nodules with indeterminate fine needle aspiration cytology? Thyroid. 22(2):165–72. DOI:
10.1089/thy.2011.0255. PMID:
22257371.

225. de Koster EJ, de Geus-Oei LF, Brouwers AH, van Dam E, Dijkhorst-Oei LT, van Engen-van Grunsven ACH, et al. 2022; [(18)F]FDG-PET/CT to prevent futile surgery in indeterminate thyroid nodules: a blinded, randomised controlled multicentre trial. Eur J Nucl Med Mol Imaging. 49(6):1970–84. DOI:
10.1007/s00259-021-05627-2. PMID:
34981165. PMCID:
PMC9016050.

226. de Koster EJ, Vriens D, van Aken MO, Dijkhorst-Oei LT, Oyen WJG, Peeters RP, et al. 2022; FDG-PET/CT in indeterminate thyroid nodules: cost-utility analysis alongside a randomised controlled trial. Eur J Nucl Med Mol Imaging. 49(10):3452–69. DOI:
10.1007/s00259-022-05794-w. PMID:
35435497. PMCID:
PMC9308600.

227. Papini E, Guglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, et al. 2002; Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab. 87(5):1941–6. DOI:
10.1210/jcem.87.5.8504. PMID:
11994321.

228. Brito JP, Yarur AJ, Prokop LJ, McIver B, Murad MH, Montori VM. 2013; Prevalence of thyroid cancer in multinodular goiter versus single nodule: a systematic review and meta- analysis. Thyroid. 23(4):449–55. DOI:
10.1089/thy.2012.0156. PMID:
23067375.

229. Leenhardt L, Hejblum G, Franc B, Fediaevsky LD, Delbot T, Le Guillouzic D, et al. 1999; Indications and limits of ultrasound-guided cytology in the management of nonpalpable thyroid nodules. J Clin Endocrinol Metab. 84(1):24–8. DOI:
10.1210/jcem.84.1.5418. PMID:
9920057.

230. Baser H, Topaloglu O, Bilginer MC, Ulusoy S, Kilicarslan A, Ozdemir E, et al. 2019; Are cytologic and histopathologic features of hot thyroid nodules different from cold thyroid nodules? Diagn Cytopathol. 47(9):898–903. DOI:
10.1002/dc.24251. PMID:
31190472.

231. Carmeci C, Jeffrey RB, McDougall IR, Nowels KW, Weigel RJ. 1998; Ultrasound-guided fine-needle aspiration biopsy of thyroid masses. Thyroid. 8(4):283–9. DOI:
10.1089/thy.1998.8.283. PMID:
9588492.

232. Ylagan LR, Farkas T, Dehner LP. 2004; Fine needle aspiration of the thyroid: a cytohistologic correlation and study of discrepant cases. Thyroid. 14(1):35–41. DOI:
10.1089/105072504322783821. PMID:
15009912.

233. Alexander EK, Hurwitz S, Heering JP, Benson CB, Frates MC, Doubilet PM, et al. 2003; Natural history of benign solid and cystic thyroid nodules. Ann Intern Med. 138(4):315–8. DOI:
10.7326/0003-4819-138-4-200302180-00010. PMID:
12585829.

234. Brander AE, Viikinkoski VP, Nickels JI, Kivisaari LM. 2000; Importance of thyroid abnormalities detected at US screening: a 5-year follow-up. Radiology. 215(3):801–6. DOI:
10.1148/radiology.215.3.r00jn07801. PMID:
10831702.

235. Erdogan MF, Kamel N, Aras D, Akdogan A, Baskal N, Erdogan G. 1998; Value of re-aspirations in benign nodular thyroid disease. Thyroid. 8(12):1087–90. DOI:
10.1089/thy.1998.8.1087. PMID:
9920362.

236. Danese D, Sciacchitano S, Farsetti A, Andreoli M, Pontecorvi A. 1998; Diagnostic accuracy of conventional versus sonography-guided fine-needle aspiration biopsy of thyroid nodules. Thyroid. 8(1):15–21. DOI:
10.1089/thy.1998.8.15. PMID:
9492148.

237. Rosario PW, Calsolari MR. 2015; What is the best criterion for repetition of fine-needle aspiration in thyroid nodules with initially benign cytology? Thyroid. 25(10):1115–20. DOI:
10.1089/thy.2015.0253. PMID:
26148539.

238. Maino F, Bufano A, Dalmazio G, Campanile M, Pilli T, Forleo R, et al. 2021; Validation of American Thyroid Association ultrasound risk-adapted approach for repeating cytology in benign thyroid nodules. Thyroid. 31(3):446–51. DOI:
10.1089/thy.2020.0351. PMID:
32718278.

239. Kim SY, Han KH, Moon HJ, Kwak JY, Chung WY, Kim EK. 2014; Thyroid nodules with benign findings at cytologic examination: results of long-term follow-up with US. Radiology. 271(1):272–81. DOI:
10.1148/radiol.13131334. PMID:
24475857.

240. Zhang M, Zhang Y, Fu S, Lv F, Tang J. 2014; Thyroid nodules with suspicious ultrasound findings: the role of ultrasound- guided core needle biopsy. Clin Imaging. 38(4):434–8. DOI:
10.1016/j.clinimag.2014.03.010. PMID:
24746446.
241. Chung SR, Baek JH, Choi YJ, Sung TY, Song DE, Kim TY, et al. 2019; The role of core needle biopsy for the evaluation of thyroid nodules with suspicious ultrasound features. Korean J Radiol. 20(1):158–65. DOI:
10.3348/kjr.2018.0101. PMID:
30627031. PMCID:
PMC6315075.

242. Durante C, Costante G, Lucisano G, Bruno R, Meringolo D, Paciaroni A, et al. 2015; The natural history of benign thyroid nodules. JAMA. 313(9):926–35. DOI:
10.1001/jama.2015.0956. PMID:
25734734.

243. Papini E, Petrucci L, Guglielmi R, Panunzi C, Rinaldi R, Bacci V, et al. 1998; Long-term changes in nodular goiter: a 5-year prospective randomized trial of levothyroxine suppressive therapy for benign cold thyroid nodules. J Clin Endocrinol Metab. 83(3):780–3. DOI:
10.1210/jcem.83.3.4615. PMID:
9506726.

244. Zelmanovitz F, Genro S, Gross JL. 1998; Suppressive therapy with levothyroxine for solitary thyroid nodules: a double-blind controlled clinical study and cumulative meta-analyses. J Clin Endocrinol Metab. 83(11):3881–5. DOI:
10.1210/jc.83.11.3881. PMID:
9814462.

245. Wemeau JL, Caron P, Schvartz C, Schlienger JL, Orgiazzi J, Cousty C, et al. 2002; Effects of thyroid-stimulating hormone suppression with levothyroxine in reducing the volume of solitary thyroid nodules and improving extranodular nonpalpable changes: a randomized, double-blind, placebo-controlled trial by the French Thyroid Research Group. J Clin Endocrinol Metab. 87(11):4928–34. DOI:
10.1210/jc.2002-020365. PMID:
12414852.

246. Castro MR, Caraballo PJ, Morris JC. 2002; Effectiveness of thyroid hormone suppressive therapy in benign solitary thyroid nodules: a meta-analysis. J Clin Endocrinol Metab. 87(9):4154–9. DOI:
10.1210/jc.2001-011762. PMID:
12213864.

247. Ha EJ, Baek JH, Che Y, Chou YH, Fukunari N, Kim JH, et al. 2021; Radiofrequency ablation of benign thyroid nodules: recommendations from the Asian Conference on Tumor Ablation Task Force. Ultrasonography. 40(1):75–82. DOI:
10.14366/usg.20112. PMID:
33142404. PMCID:
PMC7758103.

248. Papini E, Monpeyssen H, Frasoldati A, Hegedus L. 2020; 2020 European Thyroid Association clinical practice guideline for the use of image-guided ablation in benign thyroid nodules. Eur Thyroid J. 9(4):172–85. DOI:
10.1159/000508484. PMID:
32903999. PMCID:
PMC7445670.

249. Kuo JH, Sinclair CF, Lang B, Spiezia S, Yu M, Ha EJ, et al. 2022; A comprehensive review of interventional ablation techniques for the management of thyroid nodules and metastatic lymph nodes. Surgery. 171(4):920–31. DOI:
10.1016/j.surg.2021.07.043. PMID:
34776258.

250. Guan SH, Wang H, Teng DK. 2020; Comparison of ultrasound- guided thermal ablation and conventional thyroidectomy for benign thyroid nodules: a systematic review and meta-analysis. Int J Hyperthermia. 37(1):442–9. DOI:
10.1080/02656736.2020.1758802. PMID:
32369708.
251. Jin H, Lin W, Lu L, Cui M. 2021; Conventional thyroidectomy vs thyroid thermal ablation on postoperative quality of life and satisfaction for patients with benign thyroid nodules. Eur J Endocrinol. 184(1):131–41. DOI:
10.1530/EJE-20-0562. PMID:
33112273.

252. Hahn SY, Shin JH, Na DG, Ha EJ, Ahn HS, Lim HK, et al. 2019; Ethanol ablation of the thyroid nodules: 2018 consensus statement by the Korean Society of Thyroid Radiology. Korean J Radiol. 20(4):609–20. DOI:
10.3348/kjr.2018.0696. PMID:
30887743. PMCID:
PMC6424836.

253. Bandeira-Echtler E, Bergerhoff K, Richter B. 2014; Levothyroxine or minimally invasive therapies for benign thyroid nodules. Cochrane Database Syst Rev. 2014(6):CD004098. DOI:
10.1002/14651858.CD004098.pub2. PMID:
24941398. PMCID:
PMC9039971.

254. Chung SR, Suh CH, Baek JH, Choi YJ, Lee JH. 2018; The role of core needle biopsy in the diagnosis of initially detected thyroid nodules: a systematic review and meta-analysis. Eur Radiol. 28(11):4909–18. DOI:
10.1007/s00330-018-5494-z. PMID:
29789911.

255. Park KW, Shin JH, Hahn SY, Oh YL, Kim SW, Kim TH, et al. 2020; Ultrasound-guided fine-needle aspiration or core needle biopsy for diagnosing follicular thyroid carcinoma? Clin Endocrinol (Oxf). 92(5):468–74. DOI:
10.1111/cen.14167. PMID:
32012326.

256. Na HY, Moon JH, Choi JY, Yu HW, Jeong WJ, Kim YK, et al. 2020; Preoperative diagnostic categories of fine needle aspiration cytology for histologically proven thyroid follicular adenoma and carcinoma, and Hurthle cell adenoma and carcinoma: analysis of cause of under- or misdiagnoses. PLoS One. 15(11):e0241597. DOI:
10.1371/journal.pone.0241597. PMID:
33147258. PMCID:
PMC7641403.

257. Kwak JY, Koo H, Youk JH, Kim MJ, Moon HJ, Son EJ, et al. 2010; Value of US correlation of a thyroid nodule with initially benign cytologic results. Radiology. 254(1):292–300. DOI:
10.1148/radiol.2541090460. PMID:
20019136.

258. Yang J, Schnadig V, Logrono R, Wasserman PG. 2007; Fine-needle aspiration of thyroid nodules: a study of 4703 patients with histologic and clinical correlations. Cancer. 111(5):306–15. DOI:
10.1002/cncr.22955. PMID:
17680588.

259. Gerhard R, da Cunha Santos G. 2007; Inter- and intraobserver reproducibility of thyroid fine needle aspiration cytology: an analysis of discrepant cases. Cytopathology. 18(2):105–11. DOI:
10.1111/j.1365-2303.2006.00430.x. PMID:
17397495.

260. Scappaticcio L, Trimboli P, Iorio S, Maiorino MI, Longo M, Croce L, et al. 2022; Repeat thyroid FNAC: inter-observer agreement among high- and low-volume centers in Naples metropolitan area and correlation with the EU-TIRADS. Front Endocrinol (Lausanne). 13:1001728. DOI:
10.3389/fendo.2022.1001728. PMID:
36187133. PMCID:
PMC9519850.

261. Jung SL, Baek JH, Lee JH, Shong YK, Sung JY, Kim KS, et al. 2018; Efficacy and safety of radiofrequency ablation for benign thyroid nodules: a prospective multicenter study. Korean J Radiol. 19(1):167–74. DOI:
10.3348/kjr.2018.19.1.167. PMID:
29354014. PMCID:
PMC5768499.

262. Baek JH, Ha EJ, Choi YJ, Sung JY, Kim JK, Shong YK. 2015; Radiofrequency versus ethanol ablation for treating predominantly cystic thyroid nodules: a randomized clinical trial. Korean J Radiol. 16(6):1332–40. DOI:
10.3348/kjr.2015.16.6.1332. PMID:
26576124. PMCID:
PMC4644756.

263. Sung JY, Baek JH, Kim KS, Lee D, Yoo H, Kim JK, et al. 2013; Single-session treatment of benign cystic thyroid nodules with ethanol versus radiofrequency ablation: a prospective randomized study. Radiology. 269(1):293–300. DOI:
10.1148/radiol.13122134. PMID:
23616630.

264. Choi WJ, Baek JH, Choi YJ, Lee JH, Ha EJ, Lee WC, et al. 2015; Management of cystic or predominantly cystic thyroid nodules: role of simple aspiration of internal fluid. Endocr Res. 40(4):215–9. DOI:
10.3109/07435800.2015.1015729. PMID:
25839339.

265. Kim JH, Lee HK, Lee JH, Ahn IM, Choi CG. 2003; Efficacy of sonographically guided percutaneous ethanol injection for treatment of thyroid cysts versus solid thyroid nodules. AJR Am J Roentgenol. 180(6):1723–6. DOI:
10.2214/ajr.180.6.1801723. PMID:
12760950.

266. Jang SW, Baek JH, Kim JK, Sung JY, Choi H, Lim HK, et al. 2012; How to manage the patients with unsatisfactory results after ethanol ablation for thyroid nodules: role of radiofrequency ablation. Eur J Radiol. 81(5):905–10. DOI:
10.1016/j.ejrad.2011.02.039. PMID:
21388767.

267. Sung JY, Kim YS, Choi H, Lee JH, Baek JH. 2011; Optimum first-line treatment technique for benign cystic thyroid nodules: ethanol ablation or radiofrequency ablation? AJR Am J Roentgenol. 196(2):W210–4. DOI:
10.2214/AJR.10.5172. PMID:
21257865.

268. Lee JH, Kim YS, Lee D, Choi H, Yoo H, Baek JH. 2010; Radiofrequency ablation (RFA) of benign thyroid nodules in patients with incompletely resolved clinical problems after ethanol ablation (EA). World J Surg. 34(7):1488–93. DOI:
10.1007/s00268-010-0565-6. PMID:
20376445.

269. Ahmad T, Khoja A, Rashid NH, Ashfaq MA. 2018; Outcome of radioactive iodine therapy in toxic nodular goiter in Pakistan. Pak J Med Sci. 34(5):1146–51. DOI:
10.12669/pjms.345.15244. PMID:
30344566. PMCID:
PMC6191791.

270. Tzavara I, Tzanela M, Vlassopoulou B, Kouyioumoutzakis G, Kyriazopoulou V, Alevizaki C, et al. 2002; Long term thyroid function after (131)I treatment for toxic adenoma. Hormones (Athens). 1(2):99–103. DOI:
10.14310/horm.2002.1157. PMID:
17110361.

271. Bawand R, Borzouei S, Salimbahrami SA, Sheikh V. 2022; Comparison of clinical efficacy of antithyroid drugs, radioactive iodine, and thyroidectomy for treatment of patients with graves' disease, toxic thyroid adenoma, and toxic multinodular goiter. Biomed Biotechnol Res J. 6(4):569–75. DOI:
10.4103/bbrj.bbrj_99_22.

272. Ben Hamou A, Ghanassia E, Muller A, Ladsous M, Paladino NC, Brunaud L, et al. 2022; SFE-AFCE-SFMN 2022 consensus on the management of thyroid nodules: thermal ablation. Ann Endocrinol (Paris). 83(6):423–30. DOI:
10.1016/j.ando.2022.10.011. PMID:
36306894.

273. Demir BK, Karakilic E, Saygili ES, Araci N, Ozdemir S. 2022; Predictors of hypothyroidism following empirical dose radioiodine in toxic thyroid nodules: real-life experience. Endocr Pract. 28(8):749–53. DOI:
10.1016/j.eprac.2022.05.001. PMID:
35537668.

274. Roque C, Santos FS, Pilli T, Dalmazio G, Castagna MG, Pacini F. 2020; Long-term effects of radioiodine in toxic multinodular goiter: thyroid volume, function, and autoimmunity. J Clin Endocrinol Metab. 105(7):dgaa214. DOI:
10.1210/clinem/dgaa214. PMID:
32320467.

276. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016; 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 26(10):1343–421. DOI:
10.1089/thy.2016.0229. PMID:
27521067.

277. Dobnig H, Amrein K. 2019; Value of monopolar and bipolar radiofrequency ablation for the treatment of benign thyroid nodules. Best Pract Res Clin Endocrinol Metab. 33(4):101283. DOI:
10.1016/j.beem.2019.05.007. PMID:
31278063.

278. Kim HJ, Cho SJ, Baek JH, Suh CH. 2021; Efficacy and safety of thermal ablation for autonomously functioning thyroid nodules: a systematic review and meta-analysis. Eur Radiol. 31(2):605–15. DOI:
10.1007/s00330-020-07166-0. PMID:
32816198.

279. Mauri G, Papini E, Bernardi S, Barbaro D, Cesareo R, De Feo P, et al. 2022; Image-guided thermal ablation in autonomously functioning thyroid nodules. A retrospective multicenter three- year follow-up study from the Italian minimally invasive treatment of the thyroid (MITT) group. Eur Radiol. 32(3):1738–46. DOI:
10.1007/s00330-021-08289-8. PMID:
34751793.

280. Cesareo R, Palermo A, Pasqualini V, Manfrini S, Trimboli P, Stacul F, et al. 2020; Radiofrequency ablation on autonomously functioning thyroid nodules: a critical appraisal and review of the literature. Front Endocrinol (Lausanne). 11:317. DOI:
10.3389/fendo.2020.00317. PMID:
32528412. PMCID:
PMC7256164.

282. Kung AW, Chau MT, Lao TT, Tam SC, Low LC. 2002; The effect of pregnancy on thyroid nodule formation. J Clin Endocrinol Metab. 87(3):1010–4. DOI:
10.1210/jcem.87.3.8285. PMID:
11889153.

283. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017; 2017 guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid. 27(3):315–89. DOI:
10.1089/thy.2016.0457. PMID:
28056690.

286. Moosa M, Mazzaferri EL. 1997; Outcome of differentiated thyroid cancer diagnosed in pregnant women. J Clin Endocrinol Metab. 82(9):2862–6. DOI:
10.1210/jcem.82.9.4247. PMID:
9284711.

287. Mazzaferri EL, Jhiang SM. 1994; Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med. 97(5):418–28. DOI:
10.1016/0002-9343(94)90321-2. PMID:
7977430.





 PDF
PDF Citation
Citation Print
Print



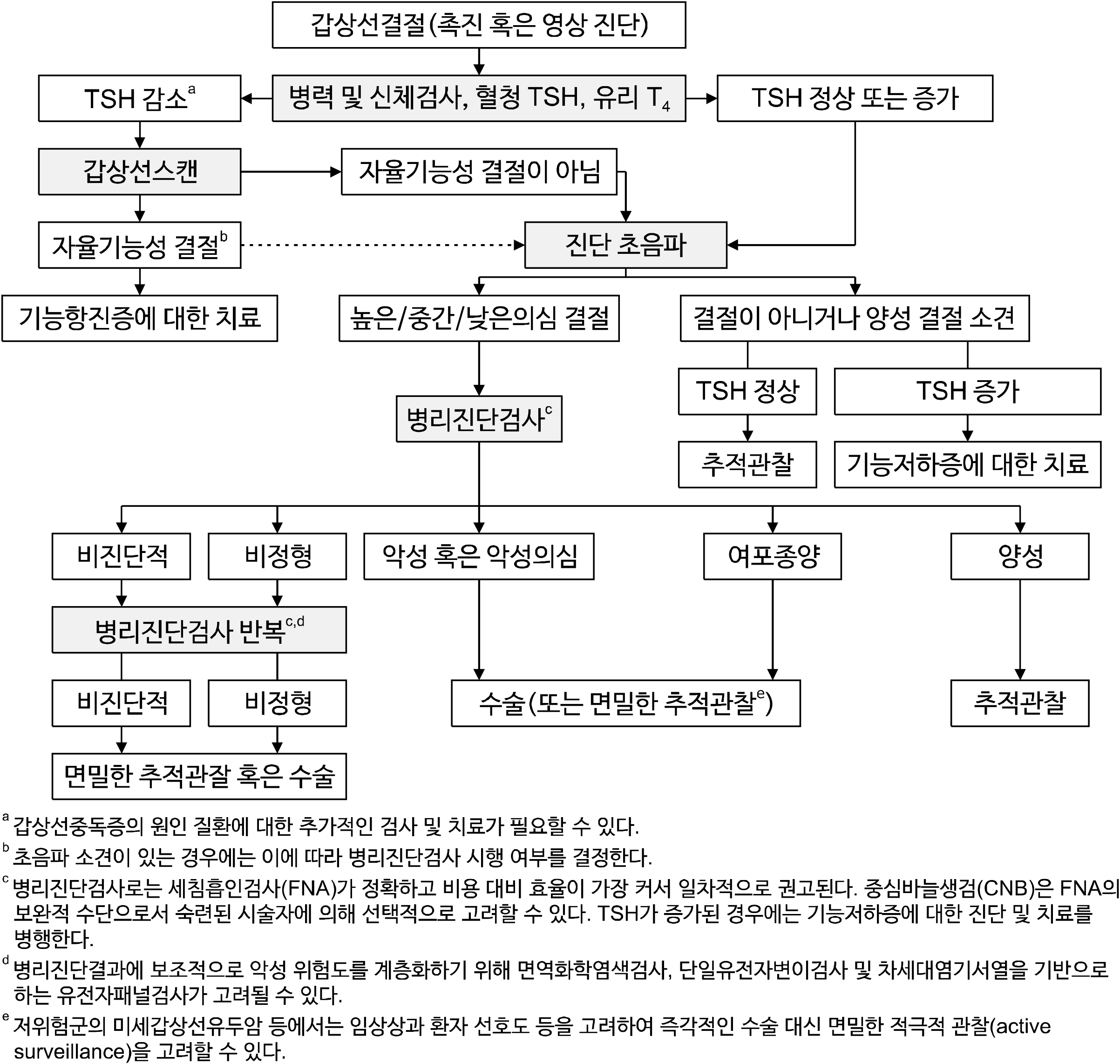
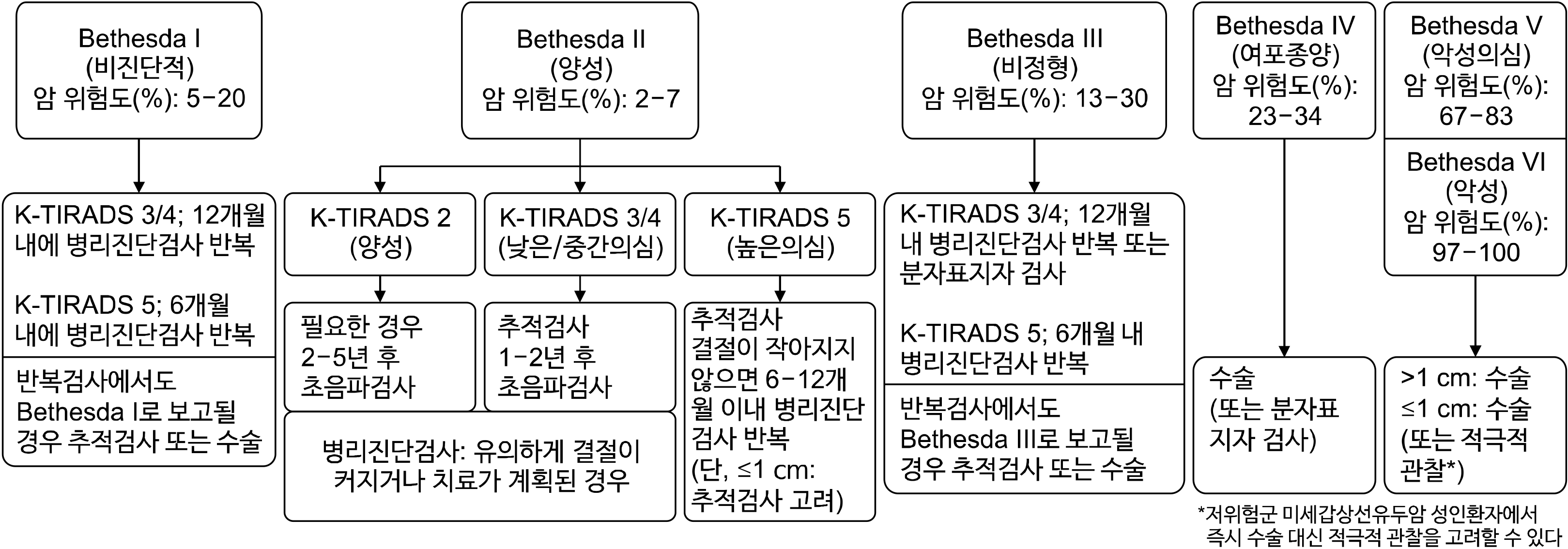
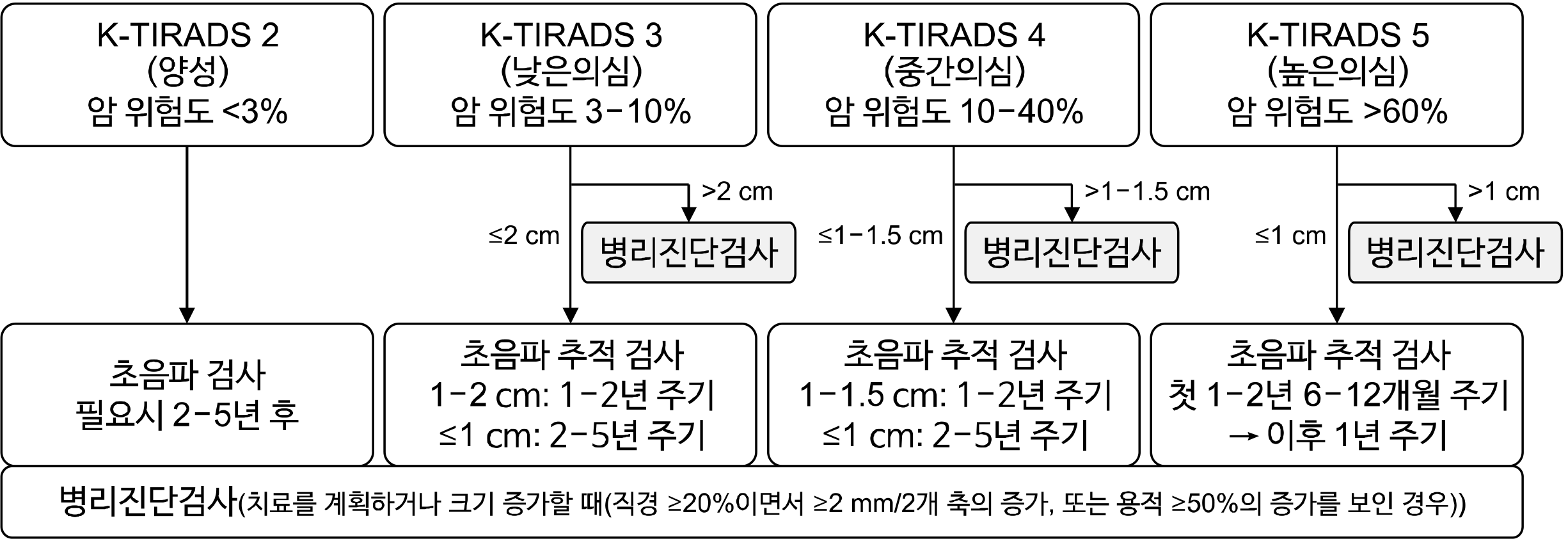
 XML Download
XML Download