Abstract
Thyroid cancer is one of the most common female cancers, and the incidence is increasing. Although surgery remains a conventional treatment for thyroid cancer, active surveillance has emerged as a reasonable option for low-risk groups. Recently, thermal ablation techniques, such as radiofrequency ablation (RFA), have attracted attention as minimally invasive alternatives for managing thyroid cancer. RFA is an outpatient ultrasound-guided thermal ablative procedure that is a potential alternative to surgery for thyroid cancer. Its applications extend to patients with local recurrence of cancer in the neck who are either unsuitable for surgery or prefer non-surgical interventions. RFA has also shown promise in cases where surgery is not feasible, particularly in low-risk papillary thyroid microcarcinoma (PTMC), showing excellent local control. Recent studies have reported favorable outcomes of RFA in various types of primary thyroid cancer beyond PTMC, as well as in cases of distant metastases such as those affecting bone. This study reviews the historical evolution, technical aspects, and clinical applications of RFA for thyroid cancer and predicts the future direction of RFA in thyroid cancer.
Go to : 
갑상선암의 대부분은 분화 갑상선암(differentiated thyroid cancer)으로 표준 치료는 수술이다. 수술 후 경우에 따라 갑상선 호르몬 억제 치료(thyroid hormone suppressive treatment)와 방사성 요오드 치료(radioactive iodine therapy) 등을 추가해 좋은 예후를 보이지만 재발율은 30%까지 보고되고 있다.(1)
미국 갑상선학회(American Thyroid Association) 진료권고안에 따르면 4 cm 이하의 분화 갑상선암은 갑상선 엽절제술(thyroid lobectomy)의 적응증이 되며, 특히 저위험군의 미세유두암(low risk papillary thyroid microcarcinoma)은 적극적 감시(active surveillance)로 추적 관찰이 가능하다.(2) 적극적 감시는 수술과 비교해 삶의 질이 좋다는 장점이 있지만, 종양 진행에 대한 불안감, 계속적인 반복 검사에 대한 호응도의 점진적 감소, 장기적인 관점에서 젊은 사람의 경우 의료 비용이 더 많이 든다는 단점이 있다.(3)
갑상선암을 최소한의 침습적인 방법(minimally invasive technique)으로 치료하기를 원하는 환자들에게 최근에 열절제술(thermal ablation)의 적용이 또 다른 치료법으로 각광받고 있다. 갑상선 결절의 치료에 적용되고 있는 열절제술로는 고주파 절제술(radiofrequency ablation; RFA), 레이저 절제술(laser ablation), 극초단파 절제술(microwave ablation), 고강도 집속 초음파술(high intensity focused ultrasound, HIFU)이 있는데 이 중 고주파 절제술이 가장 활발하게 시행되고 있다.
이에 저자들은 갑상선암에서 고주파 절제술의 역사, 술기 및 다양한 영역에서 고주파 절제술의 적용에 대해 살펴보고 향후 갑상선암에서 고주파 절제술의 발전 방향에 대해 전망해 보고자 한다.
Go to : 
고주파 절제술은 증상이 있는 갑상선 양성 종양을 치료하는 영상 유도하(image-guided) 열절제술로써, 전신마취, 절개 또는 갑상선 절제의 필요성이 없는 외래 시술로 수술의 좋은 대안이 될 수 있다.(4) 고주파 절제술은 간, 폐, 뼈 및 신장암 등의 악성 종양에서도 광범위하게 사용되고 있으며, 최근에는 갑상선암에서도 우수한 치료 결과가 보고되었다.(5)
갑상선암에서 고주파 절제술의 적용은 2001년 Dupuy 등(6)이 보고한 구역 재발(regional recurrence)한 갑상선암 환자의 치료가 최초이며, 이후 Monchik 등(7)과 Baek 등(8)이 재발 갑상선암에 대한 고주파 절제술 치료의 증례들을 보고하였다. 미세유두암의 고주파 절제술 적용은 Jeon 등(9)이 2015년 보고한 증례 보고가 최초이고, 다음 해에 Zhang 등(10)이 저위험군 미세유두암 환자 92명에 대한 전향적 치료 결과를 보고하였다. 최근에는 1 cm 이상 크기의 유두암에서도 고주파 절제술의 적용을 시도하고 있으며, 여포암(follicular carcinoma), 수질암(medullary carcinoma) 등 다른 종류의 갑상선암에 대한 고주파 절제술의 유용성 결과가 보고되었다.(11)
2006년 미국 갑상선학회는 갑상선 재발암 환자의 치료에 고주파 절제술이 도움이 될 수 있다는 지침을 발표하였고,(12) 국내에서는 2012년 대한갑상선영상의학회(Korean Society of Thyroid Radiology)에서 고주파 절제술이 갑상선 양성 종양뿐 아니라 재발암에서도 수술의 대안이 될 수 있다고 하였으며,(13) 2018년에는 수술의 위험도가 높은 재발 갑상선암에 대해 완치 또는 완화 목적의 치료법이 될 수 있다는 개정 지침을 발표하였다.(14) 이후 유럽을 포함한 세계 각국의 위원회에서 갑상선암에 고주파 절제술의 역할에 대한 진료 지침을 제시하였으며, 적용 범위의 확대가 예상되고 있다.(15,16)
초음파는 갑상선 종양의 크기와 범위를 명확히 판정하는 최선의 영상 검사로, 종양이 중요한 신경과 혈관 구조에 인접해 있는 정도를 결정하고 측경부 림프절의 전이 여부를 평가하는 데 유용하다.(2) 훌륭한 초음파 영상을 획득하는 것이 안전한 고주파 절제술의 핵심 요소이기 때문에 적절한 위치 설정(appropriate positioning)이 중요하다.
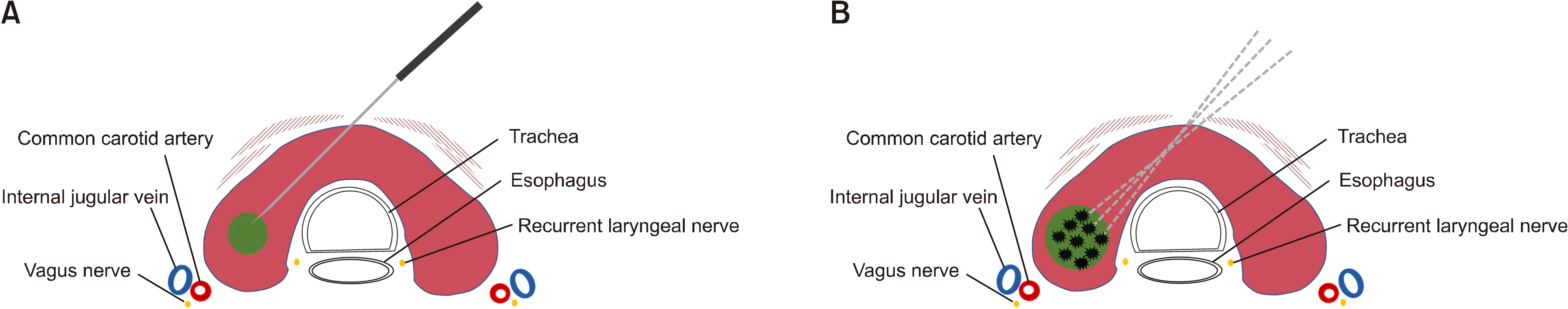
국소 마취 후 고주파 바늘을 갑상선 협부(isthmus) 위치에서 앞 목의 가운데로 삽입한다(trans-isthmic approach). 그리고 “moving shot technique”을 사용하여 초음파 유도 하에 바늘을 종양 내에서 앞, 뒤로 움직이면서 조직의 고에코(hyperechoic) 변화를 관찰한다(Fig. 1).(17) 협부를 통해 바늘을 삽입하면 갑상선 관통 부위가 많아져서 바늘 고정이 잘 되고, 기도 위쪽으로 바늘이 지나가서 신경 손상을 피할 수 있다. 고주파 장비는 바늘에 감지 장치가 있어 적정온도 이상으로 올라가거나 조직의 임피던스(impedance)가 높으면 고주파 중지(cut-off)가 발생하는데 “moving shot technique”은 이런 고주파 중지 발생이 적다. 기도, 식도 및 신경 등의 주요 구조물과 가까운 종양에 대해서는 갑상선 피막과 주요 구조물 사이에 5% 포도당 혹은 0.2% 리도카인(lidocaine) 희석액 등을 주사하여 열적 장벽(thermal barrier)을 만들기 위한 수액분리술(hydrodissection)을 사용한다.(18)
조직이 소멸되면(ablated) 시행자가 실시간으로 알 수 있는 명확한 초음파 특징이 있다. 초음파에서 고에코 신호와 ‘micro-bubbling' 뿐만 아니라 응고성 괴사를 의미하는 조직의 경직도(stiffness)에 따라 발생하는 임피던스의 증가가 이에 해당한다.(19) 혈관이 발달되어 있는 종양은 종양 주위의 혈관을 먼저 고주파로 응고시키면 종양 주위 혈관의 혈액 이동으로 바늘 주변 온도가 떨어져 고주파 절제술 효과가 감소하는 열 배출 현상(heat sink effect)이 줄어들어 열 전도 효과가 좋아지고 종양내 출혈도 감소하는 장점이 있다.(11) 결절 전체에 고에코 영역이 보이고 도플러(doppler)로 결절 내 혈류가 사라진 것을 확인하고 시술을 종료한다.
갑상선암의 대부분을 차지하는 분화 갑상선암의 예후는 매우 좋지만 환자와 종양의 특성에 따라 재발율은 20-59%까지 높게 보고된다.(20) 원발암과 마찬가지로 재발 갑상선암의 표준 치료는 수술이며, 수술 후 갑상선 호르몬 억제 치료, 방사성 요오드 치료, 외부 방사선 치료(external beam radiotherapy) 또는 항암화학요법 등의 치료를 추가로 시행한다.(2)
재발 갑상선암의 수술은 이전 수술로 인한 유착 및 해부학적 구조의 변화 등으로 신경과 부갑상선의 확인과 보존이 어려운 경우가 있어 고위험의 환자나 수술을 거부하는 환자에게 수술의 대안으로 고주파 절제술을 시도하게 되었다.
2001년 Dupuy 등(6)이 8명의 갑상선암 환자를 대상으로 고주파 절제술을 시행하여 10.3개월의 추적 관찰 기간 동안 재발 증후가 없었다는 보고를 시작으로 이후 우수한 치료 효과를 보이는 보고들이 많이 발표되었다.(7,8) Kim 등(20)이 국소 경부 재발암 치료에 대해 27명의 고주파 절제술 증례와 46명의 재수술 증례를 비교하였는데, 1년과 3년 무재발 생존율(recurrence free survival)이 고주파 절제술(96.0%와 92.6%)과 재수술(92.2%와 92.2%) 사이에 차이가 없었으며, Choi 등(21)의 보고에서도 두 군 사이에 무재발 생존율과 치료 후 thyroglobulin 감소에 차이를 보이지 않아 고주파 절제술이 재발 갑상선암 환자의 수술 대안이 될 수 있다고 하였다. 또한 80개월간의 장기간 추적 관찰에서도 재발 갑상선암의 고주파 절제술은 부피 감소율 99.5% 및 완전 소실률 91.3%와 thyroglobulin 감소 효과가 있음이 보고되었다.(22)
Jeong 등(23)이 시행한 체계적 고찰에서 재발 갑상선암에서 고주파 절제술은 64%에서 증상 완화 및 75-97%의 치료 성공률을 보였으며, 189명과 270명의 환자를 대상으로 한 두 메타 분석에서도 종양 부피와 thyroglobulin의 의미있는 감소를 보고하였다.(24,25) 재발 갑상선암에서 고주파 절제술의 적응증은 명확하게 성립되지 않았지만 전이 병변이 1 cm 이하이고 경부에 3-4개 이하의 병소가 있을 때 적용하는 것을 추천한다.(9)
갑상선암의 원격 전이가 가장 잘 일어나는 곳은 폐와 뼈로 대부분 다발성으로 발생하기 때문에 고주파 절제술의 적응증이 되기 어렵다. Luigi Cazzato 등(26)의 보고에 따르면, 갑상선, 유방, 폐 등의 암종에서 발생한 골전이를 동결절제술이나 고주파 절제술로 치료 가능함을 제시하였으며, 특히 2 cm보다 작은 크기의 희소전이(oligometastasis)가 적응증이 될 수 있다고 하여 향후 갑상선암의 골전이가 있을 때 고식적 요법으로 고주파 절제술을 사용해 볼 수 있겠다.
미세유두암 환자에서 적극적 감시의 유용성이 보고되면서 미세유두암의 적절한 치료 방법에 대해서 논란이 많은데, 고주파 절제술의 주요 적응증은 tall cell, hobnail, columnar cell 변이 같은 공격성(aggressiveness)이 없고 갑상선외 침범(extrathyroidal extension)이 없는 단일 종양으로 수술에 부적합한 경우이다.(20)
Yan 등(27)은 414명의 단일 미세유두암 고주파 절제술에 대한 후향적 연구에서 평균 42개월의 추적 검사 기간 동안 98.81%의 부피 감소율, 88.41%의 완전 소실률, 3.62%의 종양 진행률, 0.97%의 새로운 림프절 전이 발생, 2.42%의 새 미세유두암 발생률을 보고하였다. 또한 Cho 등(28)은 84명의 미세유두암 환자에게 고주파 절제술을 시행하였을 때 24개월에 98.8%, 60개월에 100%의 소실율을 보고하였다. 저위험 미세유두암에 대해 수술과 고주파 절제술의 유용성을 비교한 연구에 따르면 두 군 간에 재발률의 차이를 보이지는 않았으나 수술군에서 더 많은 합병증과 낮은 삶의 질 그리고 더 긴 입원 기간의 단점을 보였다.(29)
최근에 보고된 체계적 문헌 고찰에 따르면 1,770명 환자의 1,822개의 미세유두암에서 고주파 절제술은 79%의 완전 소실률, 1.5%의 종양 진행률, 0.2%의 새로운 림프절 전이 발생 그리고 새 미세유두암 발생률 0.9%의 우수한 결과를 보고하였다.(30)
Xiao 등(31)은 T1bN0M0 유두암 환자 182명을 대상으로 수술과 고주파 절제술을 각각 91명씩 시행한 결과 국소 종양 진행과 합병증에서 두 군 간에 차이를 보이지 않았다고 보고하였다. 세침흡인세포검사에서 여포 종양(follicular neoplasm)으로 진단된 경우 악성 가능성을 확인하기 위해 일반적으로 수술을 권고하지만 실제 여포암으로 판정되는 경우가 약 20% 정도이기 때문에 고주파 절제술은 매력적인 치료법이라 할 수 있다. Lin 등(32)은 PET/CT 상에서standardized uptake value max 5 이하의 여포성 종양 환자 22명에 대해 고주파 절제술을 시행하여 평균 73.3% 부피 감소율을 보고하였다. 수술적 치료가 어려운 수질암 및 역형성암(anaplastic carcinoma)에서도 고주파 절제술을 시행한 증례가 보고되었지만 효과는 제한적이었다.(33,34)
미세유두암과 비교해 아직 근거는 충분하지 않지만 T1bN0M0 이상의 유두암 및 다른 종류의 갑상선암에서 고주파 절제술의 유용성에 관한 연구가 앞으로 활발히 이루어질 것으로 예상된다.
지금까지 보고된 많은 연구 결과 고주파 절제술은 매우 안전한 술기로 인정되고 있지만 대부분은 심하지 않은 몇 가지 합병증들도 보고되고 있다. 24개의 연구에서 2,786개의 종양을 대상으로 한 체계적 문헌 고찰 결과 2.38%의 합병증 발생율을 보고하였으며, 특히 양성 종양(2.11%)보다 재발 악성 종양(10.98%)에서 합병증이 더 많이 발생하였다.(35) 가장 흔한 합병증은 시술 부위 통증으로 대부분 진통제 복용으로 호전된다. 일시적 성대마비로 인한 목소리 변형이 있을 수 있는데, 이는 고주파 바늘이 직접 신경에 닿지는 않았지만, 열 전도 현상으로 발생하는 것으로 추정되며 시간이 지나면 대부분 회복된다.(36) 이 외에 영구적인 신경 손상, 종양 파열, Honer’s syndrom 등의 주요 합병증이 드물게 보고되었다(Table 1). 수술 후 재발 갑상선암 환자에서 고주파 절제술을 시행하는 경우 변화된 해부학적 구조를 잘 이해하고 초음파와 고주파를 능숙하게 시행할 수 있어야 합병증 발생을 최소화할 수 있다.
Complications of Radiofrequency Ablation in Thyroid Cancer Patients
갑상선암의 고주파 절제술 후 정기적인 추적 관찰은 매우 중요하며 신체 진찰, 초음파, 갑상선 기능 검사(thyroid stimulating hormone, thyroglobulin 등)를 포함해야 한다. Cho 등(28)은 미세유두암의 고주파 절제술 후 첫 3-6개월간 종양 부피가 증가했다가 12-18개월째 사라진다고 했는데 이는 종양 주변 정상 조직 변연(margin)의 변성에 따른 위양성(false positive)의 결과라고 하였다. 일반적으로 시술 후 1, 3, 6, 12개월째 추적관찰을 시행하고 이후에는 5년이상 6개월마다 추적관찰 할 것을 권고하고 있다.(11)
지금까지 많은 논문들이 갑상선암의 재발암 및 원발암(특히 미세유두암)에 대한 우수한 결과를 보고하였지만 향후 전향적, 무작위 대조시험 그리고 장기간의 추적 관찰 결과 등의 좀 더 신뢰 있는 연구 결과가 필요하다. 또한 각 기관마다 시행하는 고주파 절제술의 술기가 차이가 있어 이의 표준화와 체계적인 교육이 필수적이다.
고주파 절제술은 초음파 유도하에 실시간으로 시행하는 시술이기 때문에 효과적인 고주파 절제술을 시행하기 위해 초음파 영상에 대한 정확한 평가와 함께 진단의 정확도를 높이기 위한 노력이 필요하다. 원발 갑상선암의 경우 수술이 일차 치료이기 때문에 수술이 불가능한 경우가 아닌 수술 가능군에서 고주파 절제술의 적응증을 명확히 할 필요가 있으며 재발 갑상선암의 경우에는 방사성 요오드 치료, 방사선 치료, 항암 치료 등의 고식적 치료(palliative therapy)에 추가된 치료법으로서의 역할에 대한 연구가 필요하다.
향후 가까운 미래에 갑상선암의 고주파 절제술은 갑상선암의 해부학적, 영상학적 지식이 충분한 숙련된 전문의가 시행한다는 전제 하에, 갑상선 원발암과 재발암 환자에서 수술이 불가능하거나 수술이 가능한 경우라도 선택된 환자에서는 수술을 대체할 수 있는 유용한 최소 침습 치료 방법이 될 것으로 예상한다.
Go to : 
REFERENCES
1. Kim TM, Kim JH, Yoo RE, Kim SC, Chung EJ, Hong EK, et al. 2018; Persistent/recurrent differentiated thyroid cancer: clinical and radiological characteristics of persistent disease and clinical recurrence based on computed tomography analysis. Thyroid. 28:1490–9. DOI: 10.1089/thy.2018.0151. PMID: 30226443.

2. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2016; 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 26:1–133. DOI: 10.1089/thy.2015.0020. PMID: 26462967. PMCID: PMC4739132.

3. Kim JH. 2023; Application of radiofrequency ablation to thyroid cancer: past, present, and future. J Korean Soc Radiol. 84:999–1008. DOI: 10.3348/jksr.2023.0075. PMID: 37869115. PMCID: PMC10585085.

4. Muhammad H, Santhanam P, Russell JO, Kuo JH. 2021; RFA and benign thyroid nodules: review of the current literature. Laryngoscope Investig Otolaryngol. 6:155–65. DOI: 10.1002/lio2.517. PMID: 33614945. PMCID: PMC7883624.
5. Tufano RP, Pace-Asciak P, Russell JO, Suárez C, Randolph GW, López F, et al. 2021; Update of radiofrequency ablation for treating benign and malignant thyroid nodules. The future is now. Front Endocrinol (Lausanne). 12:698689. DOI: 10.3389/fendo.2021.698689. PMID: 34248853. PMCID: PMC8264548.

6. Dupuy DE, Monchik JM, Decrea C, Pisharodi L. 2001; Radio-frequency ablation of regional recurrence from well-differentiated thyroid malignancy. Surgery. 130:971–7. DOI: 10.1067/msy.2001.118708. PMID: 11742325.

7. Monchik JM, Donatini G, Iannuccilli J, Dupuy DE. 2006; Radiofrequency ablation and percutaneous ethanol injection treatment for recurrent local and distant well-differentiated thyroid carcinoma. Ann Surg. 244:296–304. DOI: 10.1097/01.sla.0000217685.85467.2d. PMID: 16858194. PMCID: PMC1602167.

8. Baek JH, Kim YS, Sung JY, Choi H, Lee JH. 2011; Locoregional control of metastatic well-differentiated thyroid cancer by ultrasound-guided radiofrequency ablation. AJR Am J Roentgenol. 197:W331–6. DOI: 10.2214/AJR.10.5345. PMID: 21785061.

9. Jeon EJ, Shon HS, Jung ED. 2015; Radiofrequency ablation for the papillary thyroid micro-carcinoma in the high risk surgical patient. Thyroid Disorders Ther. 4:1000167.
10. Zhang M, Luo Y, Zhang Y, Tang J. 2016; Efficacy and safety of ultrasound-guided radiofrequency ablation for treating low-risk papillary thyroid microcarcinoma: a prospective study. Thyroid. 26:1581–7. DOI: 10.1089/thy.2015.0471. PMID: 27445090.

11. Pace-Asciak P, Russell JO, Tufano RP. 2022; The treatment of thyroid cancer with radiofrequency ablation. Tech Vasc Interv Radiol. 25:100825. DOI: 10.1016/j.tvir.2022.100825. PMID: 35551804.

12. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. 2006; Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 16:109–42. DOI: 10.1089/thy.2006.16.109. PMID: 16420177.

13. Na DG, Lee JH, Jung SL, Kim JH, Sung JY, Shin JH, et al. 2012; Radiofrequency ablation of benign thyroid nodules and recurrent thyroid cancers: consensus statement and recommen-dations. Korean J Radiol. 13:117–25. DOI: 10.3348/kjr.2012.13.2.117. PMID: 22438678. PMCID: PMC3303894.

14. Kim JH, Baek JH, Lim HK, Ahn HS, Baek SM, Choi YJ, et al. 2018; 2017 thyroid radiofrequency ablation guideline: Korean Society of Thyroid Radiology. Korean J Radiol. 19:632–55. DOI: 10.3348/kjr.2018.19.4.632. PMID: 29962870. PMCID: PMC6005940.

15. Mauri G, Bandula S, Cazzato RL, Czarniecka A, Dudeck O, et al. Hegedüs L. 2021; European Thyroid Association and Cardiova-scular and Interventional Radiological Society of Europe 2021 clinical practice guideline for the use of minimally invasive treatments in malignant thyroid lesions. Eur Thyroid J. 10:185–97. DOI: 10.1159/000516469. PMID: 34178704. PMCID: PMC8215982.

16. Orloff LA, Noel JE, Stack BC Jr, Russell MD, Angelos P, Baek JH, et al. 2022; Radiofrequency ablation and related ultrasound-guided ablation technologies for treatment of benign and malignant thyroid disease: an international multidisciplinary consensus statement of the American Head and Neck Society Endocrine Surgery Section with the Asia Pacific Society of Thyroid Surgery, Associazione Medici Endocrinologi, British Asso-ciation of Endocrine and Thyroid Surgeons, European Thyroid Association, Italian Society of Endocrine Surgery Units, Korean Society of Thyroid Radiology, Latin American Thyroid Society, and Thyroid Nodules Therapies Association. Head Neck. 44:633–60. DOI: 10.1002/hed.26960. PMID: 34939714.
17. Mauri G, Pacella CM, Papini E, Solbiati L, Goldberg SN, Ahmed M, et al. 2019; Image-guided thyroid ablation: proposal for standardization of terminology and reporting criteria. Thyroid. 29:611–8. DOI: 10.1089/thy.2018.0604. PMID: 30803397.

18. Chung SR, Baek JH, Choi YJ, Lee JH. 2019; Management strategy for nerve damage during radiofrequency ablation of thyroid nodules. Int J Hyperthermia. 36:204–10. DOI: 10.1080/02656736.2018.1554826. PMID: 30638391.

19. Park HS, Baek JH, Park AW, Chung SR, Choi YJ, Lee JH. 2017; Thyroid radiofrequency ablation: updates on innovative devices and techniques. Korean J Radiol. 18:615–23. DOI: 10.3348/kjr.2017.18.4.615. PMID: 28670156. PMCID: PMC5447637.

20. Kim JH, Yoo WS, Park YJ, Park DJ, Yun TJ, Choi SH, et al. 2015; Efficacy and safety of radiofrequency ablation for treatment of locally recurrent thyroid cancers smaller than 2 cm. Radiology. 276:909–18. DOI: 10.1148/radiol.15140079. PMID: 25848897.

21. Choi Y, Jung SL, Bae JS, Lee SH, Jung CK, Jang J, et al. 2019; Comparison of efficacy and complications between radiofrequency ablation and repeat surgery in the treatment of locally recurrent thyroid cancers: a single-center propensity score matching study. Int J Hyperthermia. 36:359–67. DOI: 10.1080/02656736.2019.1571248. PMID: 30836037.

22. Chung SR, Baek JH, Choi YJ, Lee JH. 2019; Longer-term outcomes of radiofrequency ablation for locally recurrent papillary thyroid cancer. Eur Radiol. 29:4897–903. DOI: 10.1007/s00330-019-06063-5. PMID: 30805701.

23. Jeong SY, Baek JH, Choi YJ, Lee JH. 2017; Ethanol and thermal ablation for malignant thyroid tumours. Int J Hyperthermia. 33:938–45. DOI: 10.1080/02656736.2017.1361048. PMID: 28797186.

24. Zhao Q, Tian G, Kong D, Jiang T. 2016; Meta-analysis of radiofrequency ablation for treating the local recurrence of thyroid cancers. J Endocrinol Invest. 39:909–16. DOI: 10.1007/s40618-016-0450-8. PMID: 26980591.

25. Suh CH, Baek JH, Choi YJ, Lee JH. 2016; Efficacy and safety of radiofrequency and ethanol ablation for treating locally recurrent thyroid cancer: a systematic review and meta-analysis. Thyroid. 26:420–8. DOI: 10.1089/thy.2015.0545. PMID: 26782174.

26. Luigi Cazzato R, Auloge P, De Marini P, Rousseau C, Chiang JB, Koch G, et al. 2018; Percutaneous image-guided ablation of bone metastases: local tumor control in oligometastatic patients. Int J Hyperthermia. 35:493–9. DOI: 10.1080/02656736.2018.1508760. PMID: 30307346.

27. Yan L, Lan Y, Xiao J, Lin L, Jiang B, Luo Y. 2021; Long-term outcomes of radiofrequency ablation for unifocal low-risk papillary thyroid microcarcinoma: a large cohort study of 414 patients. Eur Radiol. 31:685–94. DOI: 10.1007/s00330-020-07128-6. PMID: 32813103.

28. Cho SJ, Baek SM, Lim HK, Lee KD, Son JM, Baek JH. 2020; Long-term follow-up results of ultrasound-guided radiofrequency ablation for low-risk papillary thyroid microcarcinoma: more than 5-year follow-up for 84 tumors. Thyroid. 30:1745–51. DOI: 10.1089/thy.2020.0106. PMID: 32375570.

29. Zhang M, Tufano RP, Russell JO, Zhang Y, Zhang Y, Qiao Z, et al. 2020; Ultrasound-guided radiofrequency ablation versus surgery for low-risk papillary thyroid microcarcinoma: results of over 5 years' follow-up. Thyroid. 30:408–17. DOI: 10.1089/thy.2019.0147. PMID: 31910107.

30. van Dijk SPJ, Coerts HI, Gunput STG, van Velsen EFS, Medici M, Moelker A, et al. 2022; Assessment of radiofrequency ablation for papillary microcarcinoma of the thyroid: a systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg. 148:317–25. DOI: 10.1001/jamaoto.2021.4381. PMID: 35142816. PMCID: PMC8832309.

31. Xiao J, Zhang M, Zhang Y, Yan L, Lan Y, Zhu Y, et al. 2020; Efficacy and safety of ultrasonography-guided radiofrequency ablation for the treatment of T1bN0M0 papillary thyroid carcinoma: a retrospective study. Int J Hyperthermia. 37:392–8. DOI: 10.1080/02656736.2020.1752945. PMID: 32340500.

32. Lin WC, Tung YC, Chang YH, Luo SD, Chiang PL, Huang SC, et al. 2021; Radiofrequency ablation for treatment of thyroid follicular neoplasm with low SUV in PET/CT study. Int J Hyperthermia. 38:963–9. DOI: 10.1080/02656736.2021.1912414. PMID: 34154505.

33. Tong MY, Li HS, Che Y. 2021; Recurrent medullary thyroid carcinoma treated with percutaneous ultrasound-guided radiofrequency ablation: a case report. World J Clin Cases. 9:864–70. DOI: 10.12998/wjcc.v9.i4.864. PMID: 33585633. PMCID: PMC7852637.

34. Jeong SY, Baek JH, Choi YJ, Chung SR, Sung TY, Kim WG, et al. 2018; Radiofrequency ablation of primary thyroid carcinoma: efficacy according to the types of thyroid carcinoma. Int J Hyperthermia. 34:611–6. DOI: 10.1080/02656736.2018.1427288. PMID: 29322881.

35. Chung SR, Suh CH, Baek JH, Park HS, Choi YJ, Lee JH. 2017; Safety of radiofrequency ablation of benign thyroid nodules and recurrent thyroid cancers: a systematic review and meta-analy-sis. Int J Hyperthermia. 33:920–30. DOI: 10.1080/02656736.2017.1337936. PMID: 28565997.

36. Kim BS. 2023; Ultrasound (US)-guided ablation of thyroid nodules. J Surg Ultrasound. 10:14–23. DOI: 10.46268/jsu.2023.10.1.14.

Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download