Abstract
Isolated myeloid sarcoma is a rare extramedullary manifestation, characterized by the presence of myeloid blasts in the body and occurring without bone marrow involvement. While the isolated myeloid sarcoma involvement in the nasal cavity of adults has been reported sparsely, there have been no documented cases involving children in South Korea. Given its rarity, diagnosing isolated myeloid sarcoma is challenging without resorting to a biopsy accompanied by a comprehensive panel of immunohistochemistry. In this context, we present a case of a 5-year-old child diagnosed with isolated myeloid sarcoma situated within the right nasal cavity. Notably, this case is unique as there is no evidence of bone marrow invasion or underlying hematological disorders.
골수성 육종(myeloid sarcoma)은 미성숙한 골수세포가 골수 외 조직으로 침윤, 증식하여 발생하는 희귀한 종양으로, 주로 급성 골수성 백혈병(acute myeloid leukemia)에 동반되지만 다른 혈액학적 악성 질환에서도 동반될 수 있다. 다만 혈액 질환 및 골수의 침범 없이 단독으로 발생하는 경우도 있는데 이를 고립성(isolated) 골수성 육종으로 칭하며, 소아에서는 굉장히 드물게 발견되어 국내에서는 이에 대한 보고가 거의 없다[1-5]. 골수성 육종은 몸의 어디에서나 발생할 수 있는데 주로 발견되는 위치는 피부, 림프절, 위장관계 등이며, 그중 비강 내에서의 발생은 드물다[2,6]. 치료는 발생 위치와는 관계없이 전신적 항암화학요법을 시행하게 되며, 필요시 동종조혈모세포이식, 수술, 방사선 치료 등을 같이 시행할 수 있다. 골수성 육종의 전반적인 예후는 좋지 않은 것으로 알려져 있어 치료 후에도 지속적인 경과 관찰이 필요하다[7].
국내에서의 비강에 발생한 골수성 육종에 대해 증례 보고는 급성 골수성 백혈병에 동반된 1예[8], 고립성으로 발생한 2예[9,10], 골수 이형성 증후군에 동반된 1예[3]로 4개의 증례를 찾을 수 있었다. 해당 증례들 모두 치료로 전신 항암화학요법을 시행하였고, 그중 2예에서는 치료 후 재발 없음을 확인하였다. 다만 이는 모두 성인에 발생한 증례였으며, 소아에서 골수성 육종이 비강 내 고립성으로 발생한 증례는 국내에서 보고된 바가 없다. 이에 5세 남자 환자에서 고립성으로 발견된 우측 비강의 골수성 육종에 대해 문헌 고찰과 함께 보고하는 바이다.
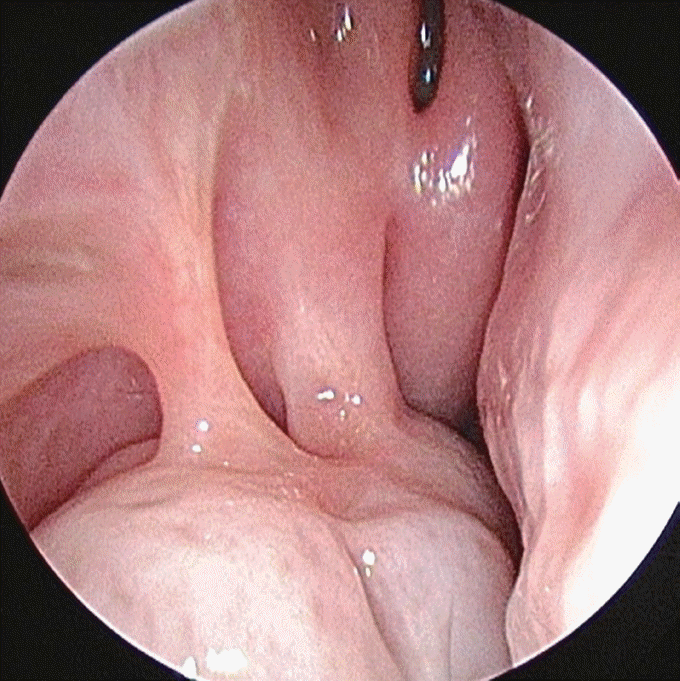
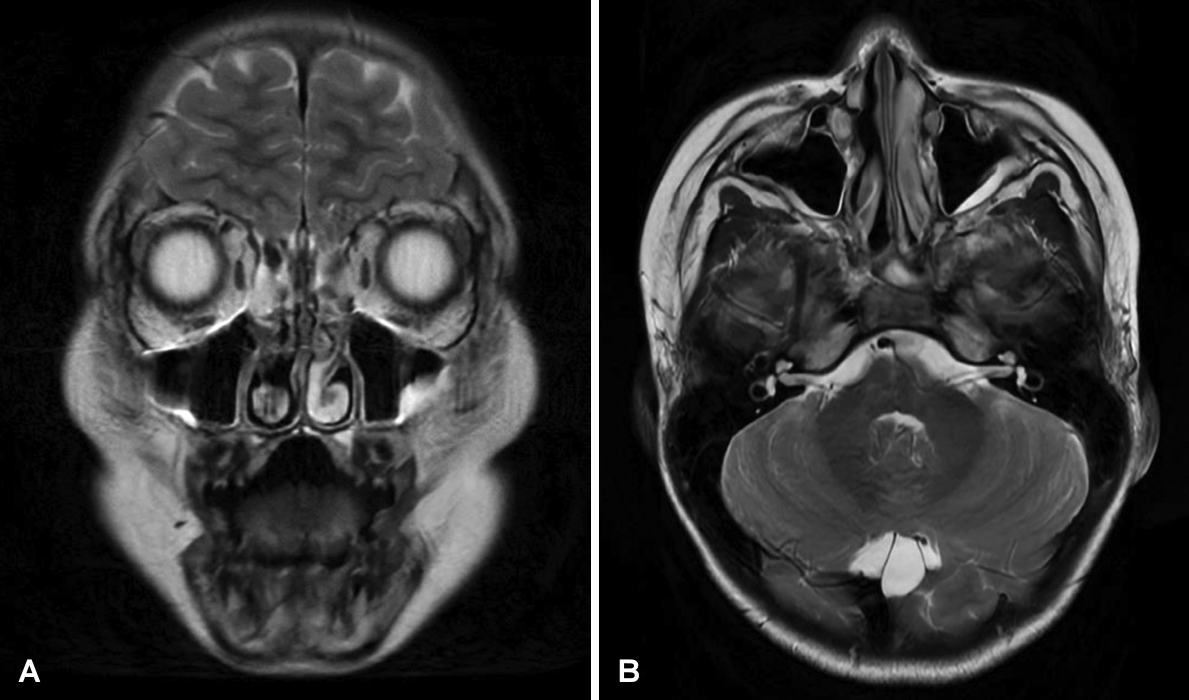
5세 남자 환자가 2020년 2월부터 시작된 우측 코막힘, 콧물, 눈물 흘림으로 내원하였다. 기저 특이 병력 및 가족력은 없었다. 외부 소아과 의원에서 부비동염 의심하에 항생제 복용하였으나 증상 호전이 없었고, 이에 외부 이비인후과 검진시 우측 비강 내 종양이 발견되어 부비동 전산화단층촬영 후 본원 이비인후과로 의뢰되었다. 고열이나 체중 감소 등의 전신적 증상은 호소하지 않았으며, 신체 검진상 특이소견은 없었다. 비강 내시경 검진 소견상 우측 전체 비강을 채운 종양이 관찰되었다(Fig. 1). 부비동 전산화단층촬영과 자기공명영상에서는 우측 내측 안각(medial canthus)부터 비루관(nasolacrimal duct)을 통해 우측 비강의 대부분을 채운 종양과 이로 인한 우측 안와내벽(medial orbital wall)을 비롯한 하비갑개와 중비갑개의 골용해성 변화가 보였으며, 이를 통해 림프종 등의 악성 종양을 감별진단으로 판단하였다(Figs. 2 and 3).
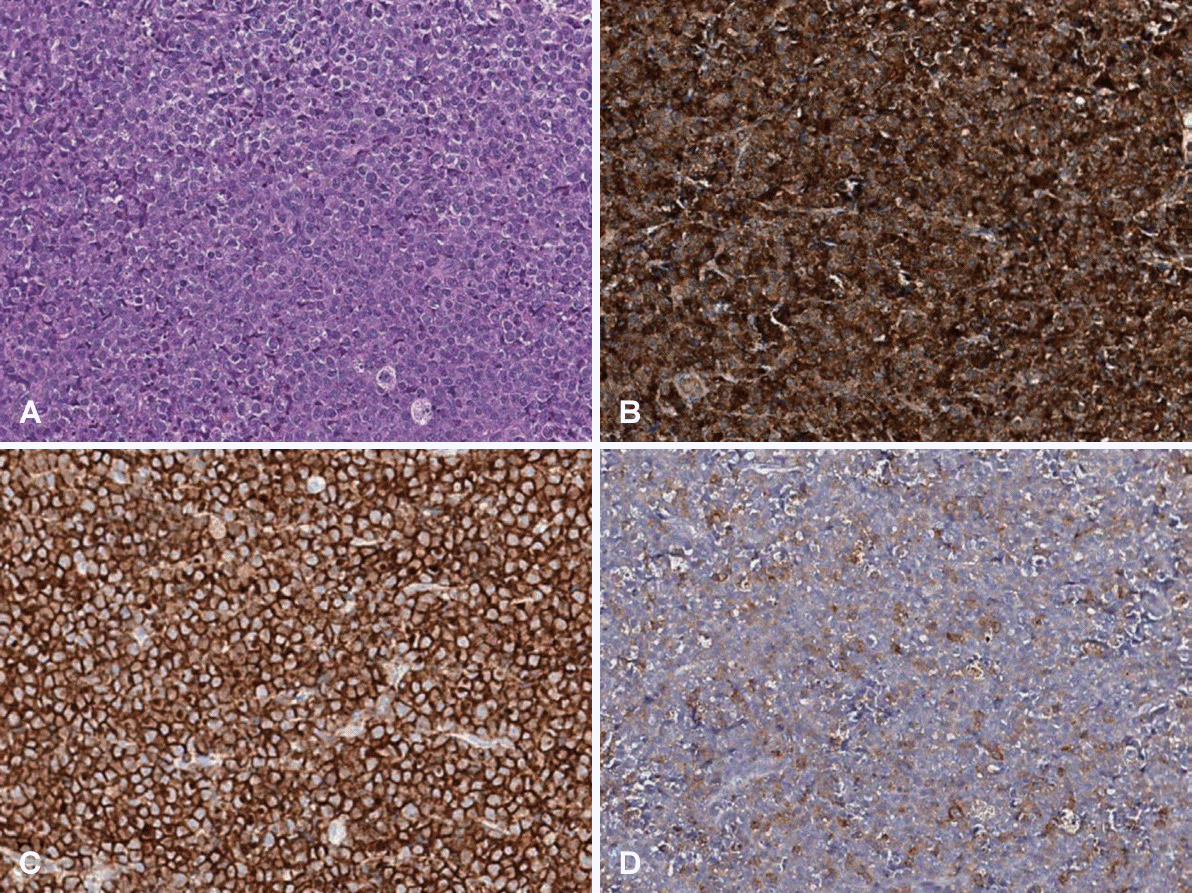
이에 병변의 조직 검사를 통한 정확한 진단을 위해 전신 마취하 우측 부비동 내시경 수술 및 비강 종양 절제술을 시행하였다. 수술 중 시행한 동결 절편 검사상 혈액학적 악성이 의심되는 소견이 나왔고, 최종 병리 결과에서도 같은 소견을 보여, 감별 진단을 위해 면역조직화학검사(immunohistochemistry)를 추가로 시행하였다. 해당 염색에서 CD3, CD20에 대해 음성 소견을 보였고 CD68, CD43, lysozyme 및 FLI-1, CD30, CD4, CD45에서 양성 소견이 보였다(Fig. 4). 이러한 결과들을 종합하여, 해당 종양에 대해 골수성 육종(myeloid sarcoma)이 진단되었다. 일반적으로 골수성 육종은 급성 골수성 백혈병에 동반되기 때문에, 혈액 질환의 확인을 위해 다양한 추가 검사를 시행하였다. 백혈구 감별계산(differential count)을 포함한 혈액 검사와 골수 생검에서 이상 소견 발견되지 않았고, 흉부 및 복부 전산화단층촬영, 전신 뼈스캔, 양전자방출단층촬영에서도 추가 전신 침범 소견은 없었다.
골수성 육종은 급성 골수성 백혈병에서 주로 동반되는 희귀한 골수 외 종양으로, 골수계(myeloid linage)의 모세포(blast)가 골수 외 부위에 침범하여 증식하는 병이다. 이 종양은 대부분 혈액학적 악성 질환과 함께 발생하지만, 전신적인 골수 침범이나 백혈병의 증거 없이 고립성으로 발견되는 경우도 보고되고 있다[2,3,7]. 고립성 골수성 육종은 드문 질환이기 때문에 발생 빈도를 정확히 추산하기는 어려우나, 성인에서는 10만 명당 0.2명, 소아에서는 10만 명당 0.07명의 빈도로 발생하는 것으로 알려져 있다[1-4,9,11]. 주요한 침범 위치로는 피부, 뼈, 골막, 림프절, 위장관계 등이 있으며, 두경부에서의 발생도 드물지는 않은 것으로 알려져 있으나 비강 내로의 침범은 드물다. 골수성 육종의 비강 내 발생에 대해 국내에서는 4건의 보고를 찾을 수 있었으며, 해외에서는 2000년부터 2018년까지 보고된 10건의 비강 및 부비동에 발생한 골수성 육종에 대한 사례를 분석한 문헌을 찾을 수 있었다[12].
골수성 육종은 통증과 출혈이 동반된 압박 증상을 주로 발생시키며. 비강에 발생한 경우 코막힘이 가장 흔하게 나타난다. 이외에도 콧물, 구호흡, 안면 부종 및 압박감, 안구 돌출, 시야 이상 등의 증상과 비용종과 부비동염도 동반될 수 있다[2-4,6,9,12]. 골수성 육종의 영상학적 소견은 대개 전산화단층촬영과 자기공명영상에서 조영 증강 및 고강도 신호 소견을 보이는 것으로 알려져 있다. 다만 그 양상이 비특이적이고 일정치 않아 영상만으로 진단하기에는 어려움이 있으며 이에 영상학적 자료들은 주로 종양의 위치, 크기와 침범 범위를 파악하는 데 사용된다[3,7,9]. 결국 최종적인 진단에 있어 가장 중요한 것은 조직 검사를 통한 병리학적 확인이며, 감별 진단으로는 림프종, 미분화암 등의 질환이 있다[7]. 다만 육안 현미경 검사 소견만으로는 감별에 한계가 있어 추가로 면역조직 화학검사가 반드시 필요하다[6,7]. 골수성 육종에서 나타날 수 있는 면역조직화학검사 양성 표지자에는 CD68, lysozyme, CD43, CD117 (c-kit), CD45, CD99, CD34, myeloperoxidase 등이 있고, CD3와 CD20 등 lymphoid lineage marker에서는 염색이 되지 않는 것을 추가로 확인하여 감별에 도움을 받을 수 있다[2,13,14]. 본 증례에서는 면역조직화학검사 결과에서 CD68, CD43, lysozyme, CD45, FLI-1에서 양성 소견이 나왔고, CD3, CD20에서 음성 소견이 나와 이를 종합하여 골수성 육종을 진단하였다.
고립성 골수성 육종은 드물게 발생하는 병의 특성상 치료법에 대한 명확한 합의가 없는데. 치료되지 않은 고립성 골수성 육종은 대부분 급성 골수성 백혈병으로 진행하기 때문에 고립성 골수성 육종에 대해 현재 권고되는 치료법은 급성 골수성 백혈병에 이용되는 전신 항암 요법이며, 보조적으로 수술적 절제, 방사선 치료 등의 국소적 치료도 고려할 수 있다. 다만 국소적 치료만을 시행한 경우 전신 항암 요법을 받은 환자들에 비해 혈액학적 악성으로의 진행 가능성이 높아, 항암 없이 이를 단독으로 시행하는 것은 바람직하지 않다[7]. 전신 항암 요법 후 공고 요법으로 동종조혈모세포이식을 추가로 고려할 수 있는데, 이는 골수성 육종 환자를 치료하고 생존율을 높이는 데 도움이 될 수 있다[7,12,15]. 본 증례에서도 환자는 급성 골수성 백혈병에 준한 전신 항암 치료와 동종 조혈모세포이식을 시행하였다. 고립성 골수성 육종의 예후에 대해서는 잘 알려져 있지 않은데, 급성 골수성 백혈병에 동반된 골수성 육종과 비교하였을 때 생존율은 더 높다고 보고된 바 있으나[7] 소아와 비강에 발생한 골수성 육종의 예후에 대한 연구는 없어 추후 이에 대한 추가적인 증례 보고, 경과 관찰 및 연구가 필요할 것으로 생각된다.
본 증례는 특이 병력 없이 소아 비강에 발생한 고립성 골수성 육종의 희귀한 증례로, 육안상 전형적이지 않은 비강 내 종양이 있을 경우 해당 질환을 비롯한 혈액 질환의 가능성에 대해 의심할 수 있어야 하며 정확한 진단을 위해 조직 검사 및 면역조직화학검사를 시행하는 것이 반드시 필요하다. 치료로는 급성 골수성 백혈병에 준한 항암 화학 요법을 시행해야 하며, 추가로 동종조혈모세포 이식을 고려할 수 있다.
Notes
Author Contribution
Conceptualization: Hyun Jik Kim. Data curation: Jeong Kyou Kim, Soo Min Kim. Formal analysis: Jeong Kyou Kim, Soo Min Kim. Methodology: Jeong Kyou Kim, Won Jun Noh. Project administration: Hyun Jik Kim. Supervision: Hyun Jik Kim. Visualization: Jeong Kyou Kim. Writing—original draft: Jeong Kyou Kim. Writing—review & editing: Hyun Jik Kim.
REFERENCES
1. Samborska M, Derwich K, Skalska-Sadowska J, Kurzawa P, Wachowiak J. Myeloid sarcoma in children - diagnostic and therapeutic difficulties. Contemp Oncol (Pozn). 2016; 20(6):444–8.

2. Siraj F, Kaur M, Dalal V, Khanna A, Khan AA. Myeloid sarcoma: a report of four cases at unusual sites. Ger Med Sci. 2017; 15:Doc03.
3. Lee DH, Park SY, Park HY, Park SK. A case of myeloid sarcoma in the nasal cavity occurred in the patient with leukemic transformation in myelodysplastic syndrome. Korean J Otorhinolaryngol-Head Neck Surg. 2020; 63(2):81–4.

4. Liu R, Du J, Gao L, Liu Y, Liu S. Myeloid sarcoma of the nasal cavity in a 15-month-old child: a case report. Medicine (Baltimore). 2020; 99(27):e21119.
5. Park HJ, Jeong DH, Song HG, Lee GK, Han GS, Cha SH, et al. Myeloid sarcoma of both kidneys, the brain, and multiple bones in a nonleukemic child. Yonsei Med J. 2003; 44(4):740–3.

6. Gupta AJ, Mandal S, Gupta R, Khurana N, Gulati A. Myeloid sarcoma presenting as nasal and orbital mass: an initial manifestation of an acute myeloid leukaemia. J Clin Diagn Res. 2017; 11(7):ED24–6.

7. Avni B, Koren-Michowitz M. Myeloid sarcoma: current approach and therapeutic options. Ther Adv Hematol. 2011; 2(5):309–16.

8. Yeon WK, Kang SB. A case of myeloid sarcoma in nasal cavity after infliximab and azathioprine combo therapy in Crohn’s disease. Inflamm Bowel Dis. 2014; 20(Suppl 1):S30–1.
9. Lee JY, Chung H, Cho H, Jang JE, Kim Y, Kim SJ, et al. Clinical characteristics and treatment outcomes of isolated myeloid sarcoma without bone marrow involvement: a single-institution experience. Blood Res. 2017; 52(3):184–92.

10. Hwang JI, Kim TY. Primary granulocytic sarcoma of the face. Ann Dermatol. 2011; 23(Suppl 2):S214–7.

11. Aslam HM, Veeraballi S, Saeed Z, Weil A, Chaudhary V. Isolated myeloid sarcoma: a diagnostic dilemma. Cureus. 2022; 14(1):e21200.

12. Suzuki J, Harazaki Y, Morita S, Kaga Y, Nomura K, Sugawara M, et al. Myeloid sarcoma of the paranasal sinuses in a patient with acute myeloid leukemia. Tohoku J Exp Med. 2018; 246(2):141–6.

13. Alexiev BA, Wang W, Ning Y, Chumsri S, Gojo I, Rodgers WH, et al. Myeloid sarcomas: a histologic, immunohistochemical, and cytogenetic study. Diagn Pathol. 2007; 2:42.

Fig. 1.
Endoscopic photography of right nasal cavity nearby inferior turbinate. A large irregularly shaped mass causing complete obstruction of the nasal cavity.
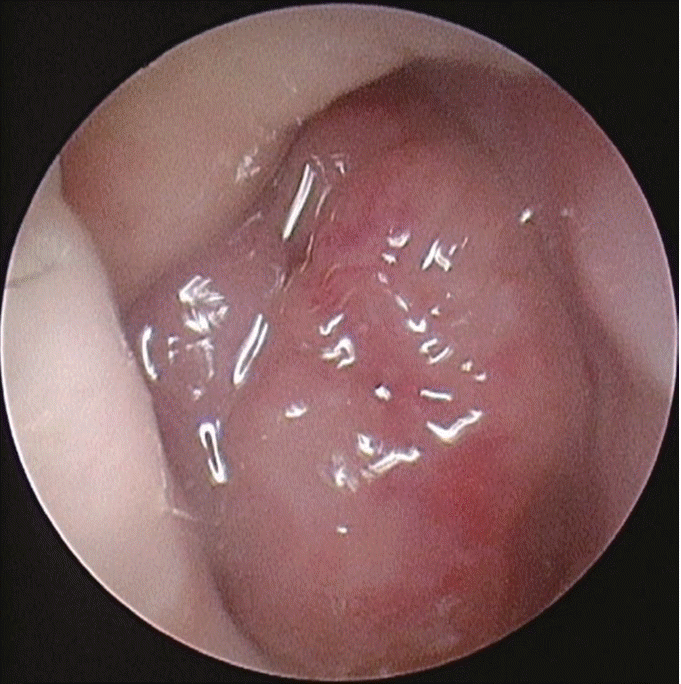
Fig. 2.
Contrast enhanced CT scan of paranasal sinuses. Lobular high density soft tissue lesion with mild enhancement at right nasal cavity to right medial canthus area with extension. Osteolytic change at right maxillary frontal process, lacrimal bone, medial orbital wall, and inferior and middle turbinates: coronal (A) and axial (B) images.
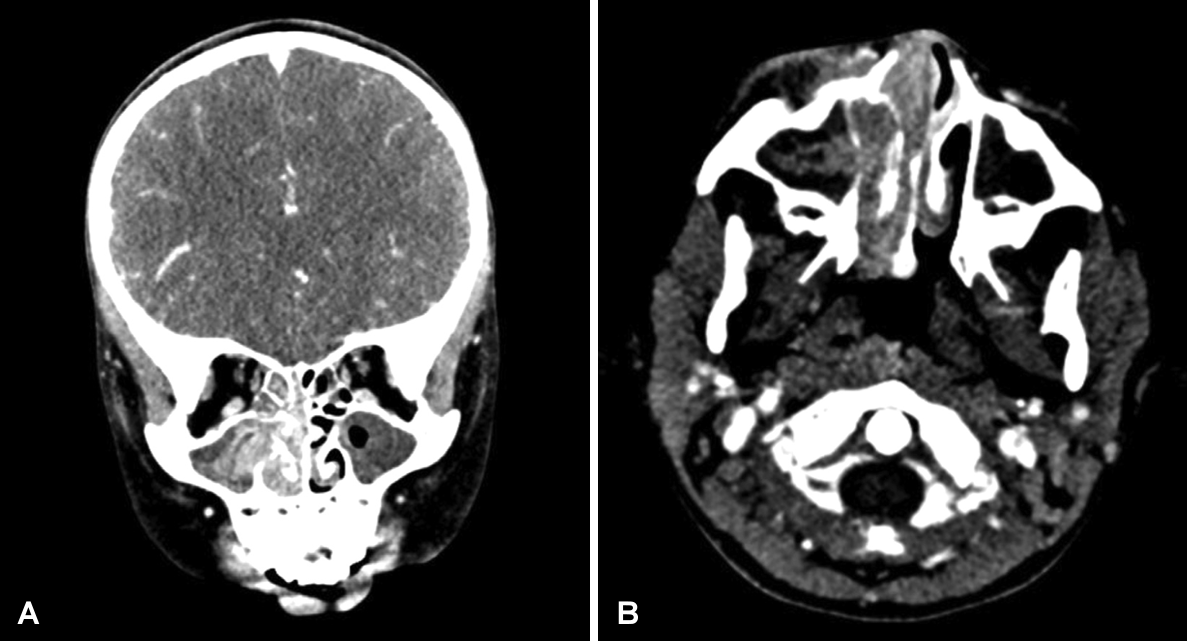
Fig. 3.
T2 images of MRI of paranasal sinuses. Lobulating contour masses involving inferior, medial portion of right orbit with wall destruction, including lacrimal sac and right nasal cavity with subtle enhancement: coronal (A) and axial (B) images.
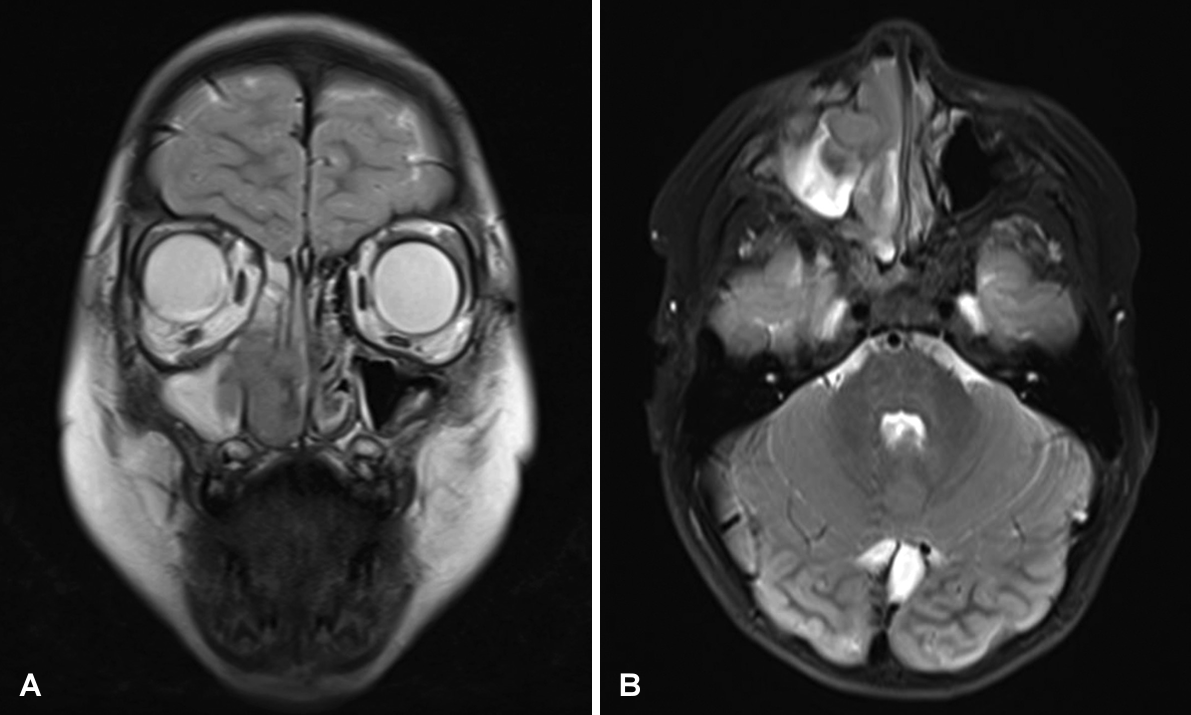
Fig. 4.
Biopsy and immunohistochemistry of isolated myeloid sarcoma (A: hematoxylin and eosin staining, ×400). Neoplastic cells are positive for CD68 (B: immunohistochemical staining, ×400), CD43 (C: immunohistochemical staining, ×400), and lysozyme (D: immunohistochemical staining, ×400).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download