Abstract
The presence of circulating donor-specific HLA antibodies (DSAs) in the transplant recipient is considered to be the primary driver of antibody-mediated rejection (AMR), a major concern in heart transplantation. However, recent studies have demonstrated that non-HLA antibodies may also play a significant role in AMR. In this report, we present the case of a 5-month-old infant who experienced graft rejection after heart and lung transplantation despite the absence of DSAs. Through non-HLA antibody testing, antibodies to alpha-enolase (ENO1), tubulin alpha-1B chain (TUBA1B), and vimentin (VM) (all reported to be involved in heart transplant rejection) as well as HLA-DP antibodies suspected to be potential DSAs were detected through epitope analysis. The patient was successfully treated using desensitization protocols, which included plasmapheresis and intravenous immunoglobulin therapy. This treatment reduced the mean fluorescence intensity levels of both class I and II panel reactive antibodies and decreased the titers of antibodies targeting ENO1, TUBA1B, and VM. This case highlights the importance of testing for non-HLA antibodies in transplant recipients who show positive results in flow cytometric crossmatch but no detectable DSAs and negative results in complement- dependent cytotoxicity testing.
항체매개 거부반응(antibody-mediated rejection, AMR)은 공여자 항원에 특이적으로 반응하는 공여자특이항체(donor-specific antibody, DSA)가 수혜자의 체내에서 일으키는 면역 반응이다[1]. AMR의 주된 원인은 HLA 항체이지만[2], 최근의 연구에 따르면 이식 수혜자들이 HLA 항체 외에 non-HLA 항원에 대한 항체를 생성하며, 이식거부반응에 있어서도 non-HLA 항체의 중요성이 대두되고 있다[3, 4]. 저자들은 HLA 항원에 대한 DSA가 없음에도 불구하고 심장 및 폐 이식 후 이식거부반응이 발생하여 추가 검사를 시행하고 성공적으로 치료된 소아 환자의 증례를 보고하고자 한다. 양산부산대학교병원 기관생명윤리위원회는 해당 연구를 승인하였으며, 사전동의의 필요성을 면제했다(IRB No. 05-2023-166).
생후 5개월 된 환아는 전폐정맥 환류 이상(total anomalous pulmonary venous return)으로 진단받아 심장 및 폐 이식 수술을 받았다. 환아는 수술 전 palivizumab과 총 43단위의 농축적혈구, 36단위의 신선동결혈장 및 15단위의 혈소판으로 치료를 받았다. 수술 한 달 전 시행한 패널반응항체(panel reactive antibody, PRA) 선별검사(One Lambda, Canoga Park, CA, USA) 결과에서 음성을 보였다. 수술 하루 전 시행한 보체의존세포독성법 교차시험(complement-dependent cytotoxicity crossmatch, CDC-XM)에서 음성, 유세포분석법 교차시험(flow cytometric crossmatch, FCXM)에서 T 림프구 양성(mean fluorescence intensity [MFI] ratio 1.45) 및 B 림프구 양성(MFI ratio 2.48) 결과를 보였다.
이식 수술 후 3일째, 환아의 심장 기능 저하와 이산화탄소 저류가 확인되어 이식거부반응을 의심하였고, 자세한 평가를 위해 진단검사의학과에 협진을 의뢰하였다. 수술 하루 전 검체로 시행한PRA 선별검사에서는 class I에서 MFI 626.69 (MFI ratio 3.25)로 양성, class II에서는 음성 결과를 나타내었다. 검체량이 부족하여 PRA 단일항원 검사를 시행하지 못하였다. 수술 후 3일째 검체로 시행한 PRA 선별검사에서는 class I에서 MFI 716.62 (MFI ratio 4.95), class II에서 MFI 982.44 (MFI ratio 13.3)로 양성이었다. 또한, PRA 단일항원 검사(PRA single antigen bead assay) (One Lambda)에서 DSA는 확인되지 않았다(Table 1). 차세대염기서열분석을 이용한 공여자 HLA typing 검사(One Lambda)와 non-HLA 항체 검사(One Lambda)도 시행하였다. 수술 후 3일째 18 종류의 non-HLA 항체가 양성이었다(Fig. 1). 환아의 HLA-A, B, C, DR, DQ 항체 중 잠재적 DSA를 확인하기 위하여 HLA Matchmaker를 이용하여 epitope 분석을 시행하였다. 또한, HLA epitope의 구성과 3차원 구조를 예측하기 위해, 온라인 데이터베이스인 pHLA3D (www.phla3d.com. br)를 이용하여 분석하였다(Fig. 2). 그 결과 A, B, C, DR, DQ에 대한 HLA 항체들과 공여자의 HLA epitope 간의 직접적인 상관성은 발견할 수 없었으나, 공여자의 DPB1*19:01 항원과 수혜자에서 확인된 HLA-DP5 항체에 대한 항원인 DPB1*05:01이 유사한 epitope 구조를 나타내는 것을 확인하였다. DPB1*19:01의 76I, 69E, 35FV epitope과 DPB1*05:01의 76M, 69K, 35LV epitope을 제외하고는 나머지 56A, 84DEAV, 96K, 8L, 11G, 55EA, 57E, 65I, 69K, 76M, 170I, 178L, 194R epitope을 두 항원이 공유하였다. 환아의 이식거부반응을 치료하기 위해 antithymocyte immunoglobulin (ATG), tacrolimus, prednisolone, 정주면역글로불린(intravenous immunoglob-ulin, IVIG), mycophenolate mofetil, basiliximab 투여와 함께 혈장교환술을 시행하였다. 치료 시작 후 수술 87일째 시행한 PRA 단일항원 검사에서 DSA는 음성, HLA class I 항체의 MFI는 1,958.46으로 감소하였으며, HLA class II 항체의 MFI는 0으로 감소하였다. 같은 날 시행한 non-HLA 항체 검사는 모든 항체에 대해 음성이었다. 환아의 심장 기능은 회복되었으며 이산화탄소 저류 상태도 완화되어 적용하던 산소요법을 점진적으로 줄였다. 수술 후 100일째에 환아는 퇴원하였으며 주기적인 외래 진료를 통해 추적관찰 중으로 수술 후 388일째 시행한 PRA 단일항원 검사 결과는 음성이었고, 수술 후 795일까지 이상 증상이나 특이 검사 결과는 발견되지 않았다.
Non-HLA 항체와 고형장기 이식거부반응과의 관련성을 연구한 보고들이 있었으나[5, 6], 지금까지는 대부분 성인 환자에서 보고되었으며, 소아 심장이식에서 non-HLA 항체로 인한 거부반응 발생에 대한 보고는 아직까지 없었다. 고형장기 이식거부반응과 관련성이 있다고 보고된 non-HLA 항체들 중에서 심장이식과 관련이 있는 대표적인 non-HLA 항체는 major histocompatibility complex class 1-related chain A (MICA), vimentin, alpha-enolase (ENO1), myosin, angiotensin II type 1 receptor (AT1R), endothelin type A receptor (ETAR) 등이다[7-9]. AT1R과 ETAR 항체는 신장이식 거부반응과의 관련성이 잘 밝혀져 있으며[5, 10]. Vimentin에 대한 자가면역 반응은 심장 및 신장이식 거부반응과 연관되며, 심장이식 후 관상동맥질환이 발생한 환자에서 vimetin 항체 역가가 높았다[11]. 또한, 심근경색과 같은 심근 손상이 발생하였을 때 ENO1의 증가가 관찰되었고[12], vimentin, tubulin, lamin A/C, 및 apolipoprotein 항체는 심장이식 후 AMR이 발생하였을 때 증가된 수치를 보였다[7]. 본 증례에서도 ENO1, tubulin alpha-1B chain (TUBA1B), vimentin에 대한 non-HLA 항체들이 검출되어, 이들이 심장이식 거부반응과 관련이 있을 가능성을 시사하였다[8, 13].
수혜자가 이식 전부터 DSA를 가지고 있었던 경우 AMR과 이식 실패의 위험이 증가하며, PRA 단일항원 검사에서 항체 MFI값이 5,000 이상이면 AMR 발생 위험이 더 높다[14]. 수술 3일째 시행한 PRA 단일항원 검사에서 검출된 DQ2는 DQA1*05:01 양성으로 인한 것으로 DSA가 아니었다. 본 증례에서는 epitope 분석을 통해 수혜자가 보유한 DPB1*05:01에 대한 HLA 항체가 DSA로 작용했을 가능성을 확인할 수 있었다. DPB1*05:01과 DPB1*19:01의 항원을 이루는 184개의 아미노산 중 3개의 아미노산만이 서로 불일치하는데, 이 3개의 epitope은 3차원 구조에서 노출되지 않고 내부에 숨겨져 있는 부위였다. 따라서 서로 다른 allele에서 발현된 유사한 epitope이 수혜자에서 HLA 항체 생성을 유도하여 이식거부반응에 영향을 미칠 수 있다. 본 증례와 같이 CDC-XM에서 음성 및 FCXM에서 양성 결과를 보일 수 있는 원인으로 non-HLA 항체, HLA-DP 항체가 있다[14, 15]. 이전의 한 연구는 HLA-DP에 대한 DSA가 단독으로 존재하는 환자 혈청을 이용하여 CDC-XM 55예, FCXM 35예를 분석하여, HLA-DP DSA의 MFI값이 2,000 미만이면 CDC-XM과 FCXM에서 모두 음성을 보이고, MFI값이 10,000 미만이면 CDC-XM에서 음성을 보인다고 보고하였다[15]. 본 증례의 경우, 잠재적 HLA-DP DSA가 약한 강도로 존재하여 CDC-XM 음성 및 FCXM 양성 결과와 이식거부반응이 HLA-DP DSA에 의해 일어났다고 단정짓기는 어렵다. 한편 non-HLA 항체와 HLA 항체가 동시에 존재할 경우 거부반응의 발생 위험이 더 높다는 보고가 있다[16]. 따라서 심장이식 거부반응과의 연관성에 대해 보고된 ENO1, TUBA1B, vimentin에 대한 non-HLA 항체와 HLA-DP epitope 유사성으로 인해 생성된 HLA 항체 두 가지 모두 본 증례의 이식거부반응 발생의 원인일 수 있다.
Non-HLA 항체의 탈감작 요법에 대해 현재 알려진 것은 많지 않다. Non-HLA 항체로 인해 발생한 AMR은 HLA 항체로 인한 AMR과 유사한 방법으로 치료되고 있는데. 이러한 탈감작 요법에는 antibody depletion, B-cell depletion, IVIG, proteasome inhibitors, complement inhibitors 등이 포함된다[17, 18]. 본 증례에서는 치료를 위해 ATG, tacrolimus, prednisolone, IVIG, mycophenolate mofetil, basiliximab 약제 사용과 혈장교환술을 시행하였다.
해당 증례는 몇 가지 한계점이 있었다. 첫째, AMR의 원인 확인을 위해서는 이식거부반응이 일어난 조직의 생검이 필요하다. 하지만 환아가 만 1세 미만의 영아이기 때문에 심장 생검을 수행할 수 없었다. 둘째, 현재는 AMR을 진단하기 위해 donor derived cell free DNA (dd-cfDNA) 분석이 유용하게 사용되나, 해당 증례가 발생한 당시에는 dd-cfDNA 분석이 기술적으로 가능하지 않아 시행하지 못하였다. CDC-XM 결과가 음성, FCXM 결과가 양성이면서, DSA가 음성인 경우, 이식거부반응의 원인을 확인하기 어렵다. 본 증례에서는 이식거부반응의 원인을 찾기 위해 추가적으로 non-HLA 항체와 HLA-DP epitope 분석을 수행하였다. 검사 결과 심장이식 거부반응에 관여한다고 보고된 바 있는 ENO1, TUBA1B과 vimentin에 대한 non-HLA 항체와 DP epitope의 유사성이 확인되어 DSA로 작용했을 것으로 의심되는 HLA-DPB 항체가 검출되었다. 이와 같이 교차시험과 PRA 단일항원 검사의 결과가 불일치하는 경우 이식거부반응 원인을 확인하는 데에 non-HLA 항체 검사 및 HLA epitope 분석을 시행하는 것이 유용할 수 있다.
REFERENCES
1. Wiebe C, Gibson IW, Blydt-Hansen TD, Karpinski M, Ho J, Storsley LJ, et al. 2012; Evolution and clinical pathologic correlations of de novo donorspecific HLA antibody post kidney transplant. Am J Transplant. 12:1157–67. DOI: 10.1111/j.1600-6143.2012.04013.x. PMID: 22429309.

2. Valenzuela NM, Reed EF. 2013; Antibodies in transplantation: the effects of HLA and non-HLA antibody binding and mechanisms of injury. Methods Mol Biol. 1034:41–70. DOI: 10.1007/978-1-62703-493-7_2. PMID: 23775730. PMCID: PMC3879955.

3. Sorohan BM, Baston C, Tacu D, Bucșa C, Țincu C, Vizireanu P, et al. 2022; Non-HLA antibodies in kidney transplantation: immunity and genetic insights. Biomedicines. 10:1506. DOI: 10.3390/biomedicines10071506. PMID: 35884811. PMCID: PMC9312985. PMID: 19fc99c6b664419e85ffa575af38a74f.

4. Tinckam KJ, Chandraker A. 2006; Mechanisms and role of HLA and non-HLA alloantibodies. Clin J Am Soc Nephrol. 1:404–14. DOI: 10.2215/CJN.00270106. PMID: 17699239.

5. Dragun D, Catar R, Philippe A. 2013; Non-HLA antibodies in solid organ transplantation: recent concepts and clinical relevance. Curr Opin Organ Transplant. 18:430–5. DOI: 10.1097/MOT.0b013e3283636e55. PMID: 23838648.
6. Jackson AM, Wiebe C, Hickey MJ. 2020; The role of non-HLA antibodies in solid organ transplantation: a complex deliberation. Curr Opin Organ Transplant. 25:536–42. DOI: 10.1097/MOT.0000000000000811. PMID: 33044346.

7. See SB, Mantell BS, Clerkin KJ, Ray B, Vasilescu ER, Marboe CC, et al. 2020; Profiling non-HLA antibody responses in antibody-mediated rejection following heart transplantation. Am J Transplant. 20:2571–80. DOI: 10.1111/ajt.15871. PMID: 32190967. PMCID: PMC8117249.

8. Shi J, Li Y, Yang X, Yang D, Zhang Y, Liu Y. 2014; Upregulation of α-enolase in acute rejection of cardiac transplant in rat model: implications for the secretion of interleukin-17. Pediatr Transplant. 18:575–85. DOI: 10.1111/petr.12306. PMID: 25041443.

9. Suárez-Alvarez B, López-Vázquez A, Gonzalez MZ, Fdez-Morera JL, Díaz-Molina B, Blanco-Gelaz MA, et al. 2007; The relationship of anti-MICA antibodies and MICA expression with heart allograft rejection. Am J Transplant. 7:1842–8. DOI: 10.1111/j.1600-6143.2007.01838.x. PMID: 17511763.

10. Lee HJ, Shin KH, Kim IY, Choi BH, Kim HH. 2023; Association between anti-endothelial antigen antibodies and allograft rejection in kidney transplantation. J Clin Lab Anal. 37:e24961. DOI: 10.1002/jcla.24961. PMID: 37694947. PMCID: PMC10561590.

11. Jurcevic S, Ainsworth ME, Pomerance A, Smith JD, Robinson DR, Dunn MJ, et al. 2001; Antivimentin antibodies are an independent predictor of transplant-associated coronary artery disease after cardiac transplantation. Transplantation. 71:886–92. DOI: 10.1097/00007890-200104150-00011. PMID: 11349721.

12. Díaz-Ramos A, Roig-Borrellas A, García-Melero A, López-Alemany R. 2012; α-Enolase, a multifunctional protein: its role on pathophysiological situations. J Biomed Biotechnol. 2012:156795. DOI: 10.1155/2012/156795. PMID: 23118496. PMCID: PMC3479624.
13. Rose ML. 2013; Role of anti-vimentin antibodies in allograft rejection. Hum Immunol. 74:1459–62. DOI: 10.1016/j.humimm.2013.06.006. PMID: 23777935. PMCID: PMC3820003.

14. Kang H, Yoo J, Lee SY, Oh EJ. 2021; Causes of positive pretransplant crossmatches in the absence of donor-specific anti-human leukocyte antigen antibodies: a single-center experience. Ann Lab Med. 41:429–35. DOI: 10.3343/alm.2021.41.4.429. PMID: 33536364. PMCID: PMC7884190.

15. Daniëls L, Claas FHJ, Kramer CSM, Senev A, Driessche M, Emonds MP, et al. 2021; The role of HLA-DP mismatches and donor specific HLA-DP antibodies in kidney transplantation: a case series. Transpl Immunol. 65:101287. DOI: 10.1016/j.trim.2020.101287. PMID: 32194154.

16. Butler CL, Hickey MJ, Jiang N, Zheng Y, Gjertson D, Zhang Q, et al. 2020; Discovery of non-HLA antibodies associated with cardiac allograft rejection and development and validation of a non-HLA antigen multiplex panel: from bench to bedside. Am J Transplant. 20:2768–80. DOI: 10.1111/ajt.15863. PMID: 32185871. PMCID: PMC7494540.

17. Schinstock C, Tambur A, Stegall M. 2021; Current approaches to desensitization in solid organ transplantation. Front Immunol. 12:686271. DOI: 10.3389/fimmu.2021.686271. PMID: 34046044. PMCID: PMC8144637. PMID: ac15c20398584ebf87407f8d76a7c253.

18. Shah KS, Patel J. 2019; Desensitization in heart transplant recipients: who, when, and how. Clin Transplant. 33:e13639. DOI: 10.1111/ctr.13639. PMID: 31206862.

Fig. 1
Follow-up results of non-HLA antibodies detected in this patient: at pretransplant and 3 and 84 days post-transplant. Of the 33 non-HLA antibodies tested, 18 were positive on postoperative day (POD) 3, and none were positive on POD 87. The dots plotted on the graph indicate the cutoff.
Abbreviations: AGT, angiotensinogen; ARHGDIB, rho GDP-dissociation inhibitor 2; AURKA, aurora kinase A-interacting protein; CD36, platelet glycoprotein 4; CHAF1B, chromatin assembly factor 1 subunit B; CXCL9, C-X-C motif chemokine 9; CXCL10, C-X-C motif chemokine 10; CXCL11, C-X-C motif chemokine 11; EIF2A, eukaryotic translation initiation factor 2A; ENO1, alpha-enolase; FLRT2, leucine-rich repeat transmembrane protein; GAPDH, glyceraldehyde 3-phosphate dehydrogenase; GDNF, glial cell line-derived neurotrophic factor; GSTT1, glutathione S-transferase theta-1; HNRNPK, heterogeneous nuclear ribonucleoprotein K; IFIH1, interferon-induced helicase C domain-containing protein 1; IFNG, interferon gamma; LG3, basement membrane-specific heparan sulfate proteoglycan core protein (aka perlecan); LMNA, prelamin-A/C; LMNB, lamin-B1; MYOSIN, myosin-binding protein C; NCL, nucleolin; PECR, peroxisomal trans-2-enoyl-CoA reductase; PLA2R, secretory phospholipase A2 receptor; PPIA, peptidylprolyl cis-trans isomerase A; PRKCH, protein kinase C eta type, cardiac type; PRKCZ, protein kinase C zeta type; PTPRN, receptor-type tyrosine-protein phosphatase-like N; REG3A, regenerating islet-derived protein 3-alpha; TNFA, tumor necrosis factor alpha; TUBA1B, tubulin alpha-1B chain; VM, vimentin.
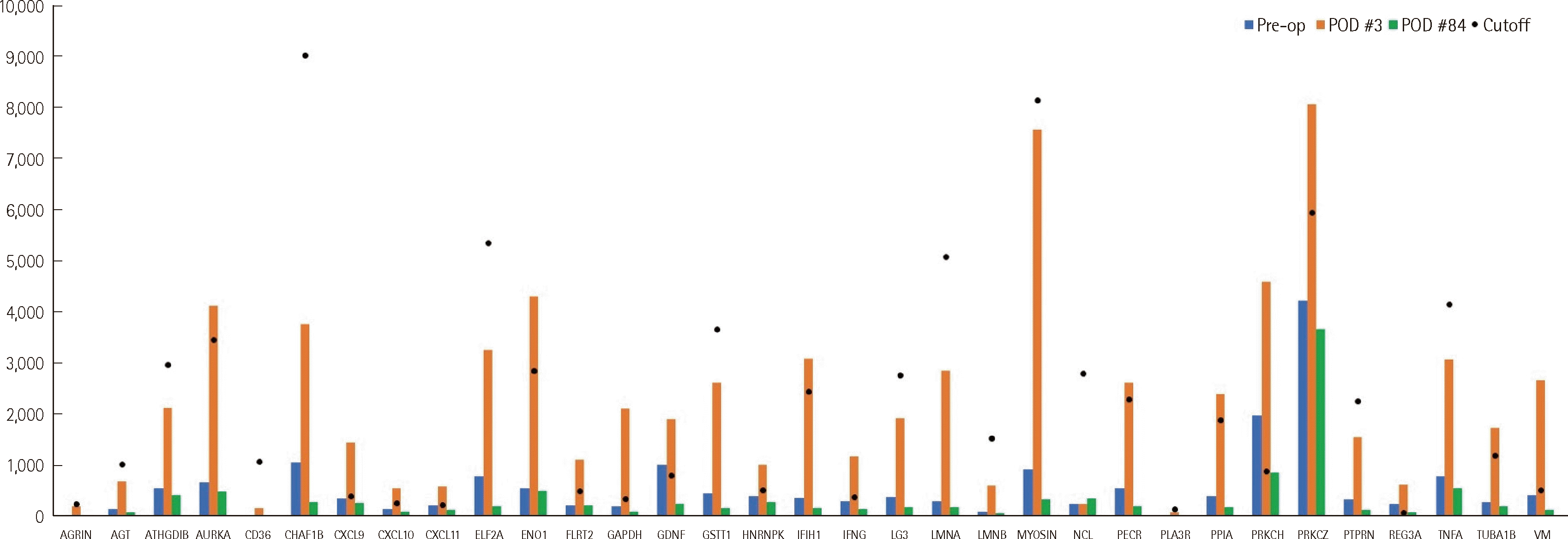
Fig. 2
Predicted epitopes for antibodies in the HLA DPB1*19:01 molecule. (A) Predicted three-dimensional structure of epitopes in the HLA DPB1*19:01 molecule. (B) The amino acid differences between DPB1*05:01 and DPB1*19:01 are shown in the alignment of different amino acids. The analysis was performed using the online database pHLA3D (https://www.phla3d.com.br).
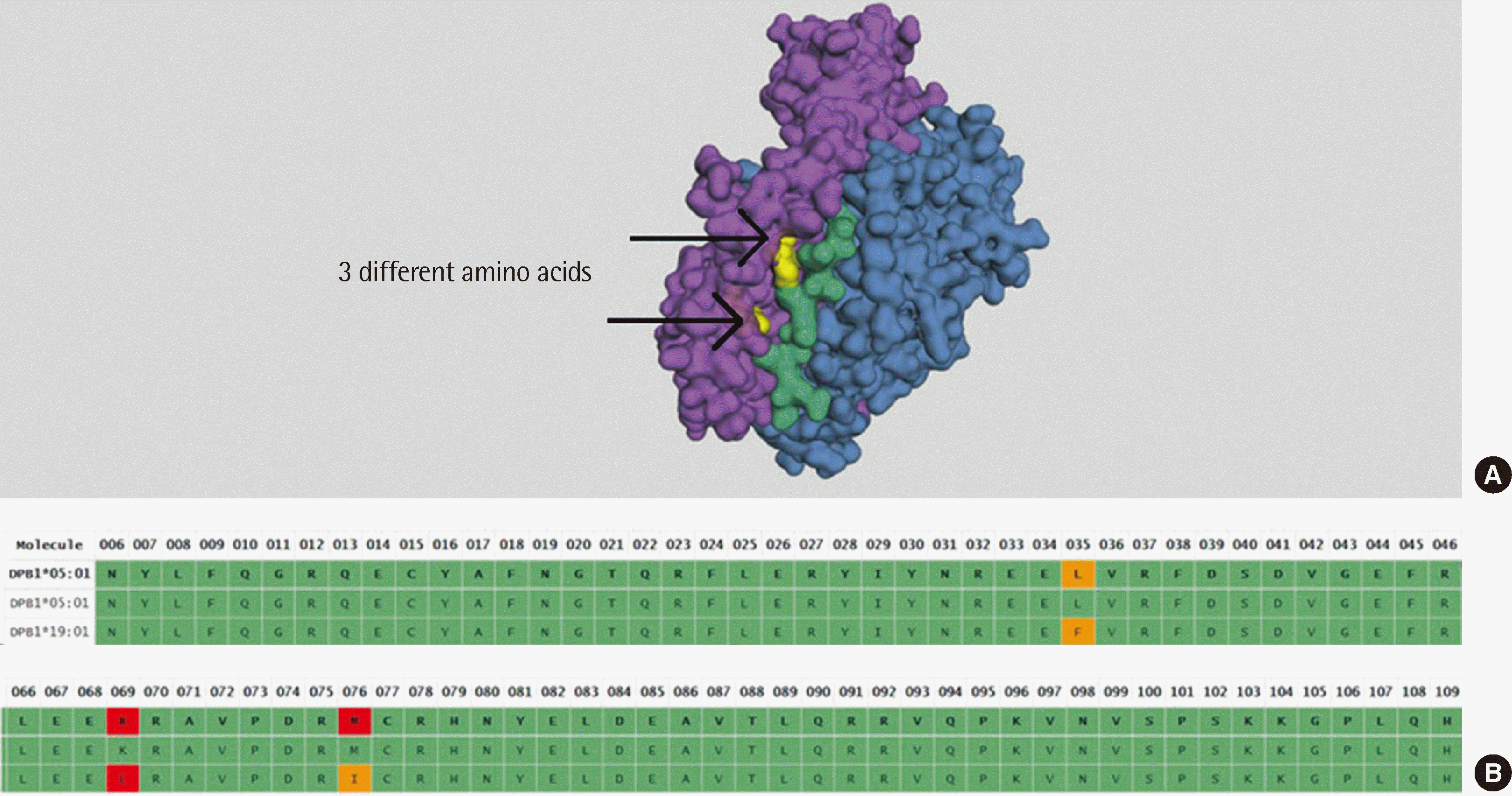
Table 1
Results of HLA typing of the donor and recipient and of the PRA single antigen bead assay
| HLA-A | HLA-B | HLA-C | HLA-DRB1 | HLA-DQB1 | HLA-DPB1 | |
|---|---|---|---|---|---|---|
| Donor HLA typing* |
A*11:01 A*30:01 |
B*35:01 B*46:01 |
C*01:02 C*03:03 |
DRB1*08:03 DRB1*08:03 |
DQB1*06:01 DQB1*06:01 |
DPB1*04:02 DPB1*19:01 |
| Recipient HLA typing |
A*02:01 A*33:03 |
B*27:05 B*44:03 |
C*01:02 C*14:03 |
DRB1*03:01 DRB1*13:02 |
DQB1*02:01 DQB1*06:04 |
DPB1*04:01 DPB1*04:01 |
| PRA single antigen POD #3 |
A29(MFI:1,126.51) A80(MFI:1,204.48) |
B8(MFI:1,079.99) B57(MFI:1,044.06) B67(MFI:1,434.39) B76(MFI:1,316.73) |
Cw17(MFI:3,194.24) | DR52(MFI:1,475.17) |
DQ2(MFI:1,064.21) DQ7(MFI:1,569.23) DQ8(MFI:1,272.86) DQ9(MFI:1,153.59) |
DP1(MFI:1,011.00) DP5(MFI:1,008.84) |
| PRA single antigen POD #87 | - | - | Cw17(MFI:1,958.46) | - | - | - |
| PRA single antigen POD #388 | - | - | - | - | - | - |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download