초록
연구배경
이 연구의 목적은 새로운 손상 평가 방법을 사용하여 류마티스 관절염 환자의 수부 방사선 손상의 분포적 특성을 확인하고, 새로운 손상 평가 방법의 효용성을 확인하는 것이다.
방법
총 127명의 류마티스 관절염 환자의 수부 방사선 영상을 평가하였다. 손상 정도를 평가하기 위해 기존에 사용되던 Van der Heijde modified total sharp score를 우리만의 방식으로 단순화하여 자체적으로 한쪽 수부에 18개 관절, 양 수부의 총 36개 관절을 관심 부위로 선정하였다. 127명의 류마티스 관절염 환자의 양 수부 36개 관절에 대해 골 미란 및 관절 공간 협착을 점수화하여 각 관절 부위에 대한 점수 합을 산출하였다.
Abstract
Background
The purpose of this study was to identify the distribution characteristics of radiological damage to the hand of rheumatoid arthritis patients and evaluate its effectiveness using a new damage assessment method.
Methods
Hand radiographs of a total of 127 rheumatoid arthritis patients were evaluated. We simplified the pre-existing van der Heijde modified total sharp score to assess the extent of bone damage. We selected 36 joints in both hands as regions of interest in our own way, and the erosion and joint space narrowing were scored.
Results
When the erosion and joint space narrowing score values of each joint of the hand were added together, the joint space narrowing score was higher than the overall erosion score. We can see that the scaphoid,lunate,radius and ulnar joints have higher erosion scores, and the 4th proximal interphalangeal (PIP), Scaphoid, Lunate, and Radius joints have higher joint space narrowing scores than other joints. These damage assessment results were similar to the results from the previous damage assessment model.
Conclusions
The joint space narrowing score is higher than the erosion score, suggesting that joint space narrowing precedes erosion. When checking the hand X-ray of rheumatoid arthritis patients, it is necessary to carefully check the scaphoid,lunate,radius and ulnar and 4th PIP joints, which relatively high radiographic damage scores. Also, the damage assessment model used in this study is relatively simple and does not show difference in analysis results from existing assessment models, so it can be considered for application in follow-up research.
류마티스 관절염은 성인 인구의 1%에서 이환되어 있는 관절의 염증성 질환이다. 대부분의 환자에서 만성적인 경과를 취하며 관절의 파괴 및 변형이 발생하고 이로 인한 기능 장애와 삶의 질의 감소 등을 초래한다[1-3]. 류마티스 관절염은 전신 관절의 침범이 가능하지만 주로 손가락, 손목 등 수부를 잘 침범하며 대칭적인 침범이 특징이다[4]. 수십년 동안 단순 방사선 촬영은 염증성 관절 병증 영상에서 진단, 질병의 진행 모니터링, 합병증 및 수술 후 변화 모니터링, 예후 예측을 위해 주로 사용되어 왔다[2,5]. 오늘날에는 초음파와 자기공명영상을 통해 조기 진단이 가능하지만, 초기 단계에서는 이러한 검사들의 특이성이 부족한 경우가 많다[6]. 단순 방사선 사진은 여전히 뼈 손상과 질병 진행을 감지하고 모니터링하는 데 사용되는 기본 이미징 기술이다[7].
류마티스 관절염의 첫 번째 방사선학적 징후는 관절 주위 연조직 부종과 관절 주위 골 감소증이며, 관절 공간 협착, 연골하 낭종 및 골 침식, '단추 구멍' 기형, '백조 목', 'Z 엄지' 또는 손가락의 척골 편위와 같은 기형이 그 뒤를 따른다[8]. 질병의 말기에는 진행성 골 파괴(예: 골 미란)와 강직증(특히 손목 및 수근관 관절)이 나타날 수 있다[9]. 류마티스 관절염이 침범하는 관절의 분포는 여러 문헌에서 "양측성 및 대칭성"으로 널리 설명되어 있지만[9,10], 일측성 및 비대칭성 관절염으로 시작될 수도 있다[8]. 관절의 손상은 발병 대개 6개월 이후부터 발생하므로 조기에 진단하여 골 손상을 막는 것이 치료에 매우 중요하다. 류마티스 관절염 환자에서 관절 손상 정도의 평가 척도는 치료의 적절성을 평가하거나 환자의 예후를 예측하는 데 매우 유용한 도구이다. 방사선학적인 손상을 평가하는 방법은 1949년 Steinbrocker가 처음으로 평가 체계를 제안한 이후 여러 그룹(Larsen, Van der Heijde, Genant)에서 제시하였지만, 1989년에 소개된 Van der Heijde modified total sharp score (mTSS) 방법이 타당성을 인정받아 온 상황이다[11]. mTSS 평가 체계는 류마티스 관절염 환자에서 거의 대부분이 침범되는 수부 관절의 단순 방사선 촬영을 통하여 근위지 관절과 중수지절 관절, 수근부 관절의 총 16개 관절의 골 미란 정도에 따라 최소 0점부터 최대 5점까지, 관절강 협착의 정도에 따라 총 15개 관절을 최소 0점부터 최대 4점까지 평가하고, 분류 및 점수화를 시행한다[12]. 이러한 평가 체계가 복잡하고 평가자 간의 편차가 있을 수 있어 평가 관절의 이상 유무만을 이분법적으로 평가하여(0점 or 1점) 간소화한 simple erosion narrowing score (SENS) 평가 체계도 제시되었다[11]. 이전 연구에 따르면 수근간 관절 및 근위지 관절의 골 손상이 흔한 것으로 알려져 있어[12], 이번 연구에는 평균 10년 이상의 경력을 가진 4명의 류마티스내과 전문가들의 논의를 거쳐 조금 더 간소화한 손상 평가 점수 체계를 도입하여 류마티스 관절염 환자의 수부 단순 방사선 영상을 분석하고, 기존 mTSS와 비교하여 효용성 정도를 확인하였다.
본 연구는 류마티스 관절염 환자의 수부 단순 방사선 검사에서 손상 정도를 평가하는 기존의 방법을 간소화한 새로운 방법으로 수부 손상 정도를 평가하여 손상의 분포적인 특성을 분석하고, 새로운 평가 방법의 효용성 여부를 알아보기 위한 연구이다.
2023년 1월부터 2023년 3월까지 원광대병원 류마티스내과에서 진료를 받은 2010년 미국/유럽 류마티스학회 분류 기준에 만족하는 류마티스 관절염 환자들 중에서 양 수부 단순 방사선 X-선 검사 이미지가 존재하는 총 127명을 대상으로 후향적인 분석을 시행하였다. 127명의 환자들을 2023년 4월에 후향적으로 검토를 하여 이들의 성별 비율, 나이, 흡연력, 유병 기간, 방사선학적 침범 관절의 손상 정도, 검사실 소견(적혈구 침강 속도 erythrocyte sedimentation rate [ESR], C-반응 단백 C-reactive protein [CRP], 류마티스 인자 rheumatoid factor [RF], 항 cyclic citrullinated peptide [CCP] 항체 [anti-CCP antibody])등에 대해 분석하였다.
127명의 류마티스 관절염 환자의 양 수부 전후방 단순 X-선촬영을 숙련된 3명의 류마티스내과 전문의가 판독을 하였으며, 기존의 mTSS 방법을 간소화하여 관절 손상의 정도를 평가하였다. 기존 mTSS 방법은 평가 관절마다 골 미란 정도를 정상의 0점부터 골 미란이 심한 5점(0, 1, 2, 3, 4, 5)까지, 관절강 협착 정도를 정상의 0점부터 협착이 심한 4점(0, 1, 2, 3, 4)까지 분류를 하는데, 골 미란을 평가하는 관절 부위(16개 관절)와 관절강 협착을 평가하는 관절 부위(15개 관절)가 약간의 차이가 있다. 평가하는 관절의 개수가 많고, 골 미란과 관절강 협착을 평가하는 관절 부위가 조금 다르기 때문에 평가하는 데 소요되는 시간이 길어지고 평가자 간의 점수 편차도 발생하는 어려움이 있다. 분류하기 애매하고 복잡한 점수 체계를 아주 단순화하여 평가하는 관절의 이상 유무만을 이분법적(normal을 0점, abnormal을 1점)으로 평가하는 SENS 평가 체계도 제시되었다. SENS 평가 체계는 아주 간단하고 평가 시간이 단축되기는 하지만 민감도가 떨어지는 단점이 있다(Table 1). 이러한 이유로 이번 연구에서는 평균 경력 10년 이상인 4명의 류마티스내과 전문가들의 논의를 거쳐 골 미란과 관절강 협착을 평가하는 관절 부위를 동일화시켜, 양 수부 관절에서 8개의 근위지절 관절(proximal inter-phalangeal joint [PIP joint]), 10개의 손허리손가락 관절(meta-carpo-phalangeal joint [MCP joint]), 2개의 엄지손가락뼈 사이 관절(thumb inter-phalangeal joint), 6개의 손허리손목 관절(carpo-meta-carpal joint [CMC joint]), 2개의 주상골(scaphoid), 2개의 대능형골(trapezium), 2개의 월상골(lunate), 2개의 요골(radius), 2개의 척골(ulnar) 관절면, 총 36개의 관절면의 골 미란과 관절강 협착의 정도를 점수화하였다(Table 2). 점수 분류도 기존의 골 미란(0-5), 관절강 협착(0-4)의 점수 분류를 골 미란, 관절강 협착 모두 0-3점으로 간소화하였다. 골 미란 점수는 정상을 0점, 미세하거나 관절면의 50.0% 미만의 미란을 1점, 관절면의 50.0% 이상의 미란이나 관절의 부분 함몰, 경상돌기(styloid process)의 소실을 2점, 관절의 전체 함몰을 3점으로 분류하였다. 관절강 협착 점수는 정상을 0점, 관절강이 50.0% 이상 남아 있는 경우 1점, 50.0% 미만으로 남아있거나, 관절의 불완전 탈구된 경우 2점, 진행이 되어 관절 유착 또는 완전 탈구된 경우, 관절강 내 가성 공간이 있는 경우 3점으로 분류하였다. 양 수부의 36개 관절의 총 골 미란 점수는 최저 0점에서 최고 108점까지, 총 관절강 협착 점수도 최저 0점에서 최고 108점까지 분포하였다.
그림 1에서 그림 1A와 1B는 mTSS와 SENS 평가 체계에서 관심 관절을 나타내는데 골 미란과 관절강 협착을 평가하는 관절이 동일하지 않고 약간 다르기 때문에 평가하는데 시간이 소요된다. 그림 1C는 우리 연구에서의 관심 관절을 나타낸 그림이고 골 미란과 관절강 협착을 평가하는 관절이 동일하여 평가 시간을 단축할 수 있는 장점이 있다. 각각의 관절 부위를 관심 부위 표시 도구를 이용하여 수작업으로 표시하면서, 양 수부 총 36개의 관절 부위를 숙련된 3명의 류마티스내과 전문의들이 서로 동의가 이루어진 골 미란 및 관절강 협착 정도를 나타내는 손상 점수를 산출하였다. 평가한 관절 손상 점수를 토대로 류마티스 관절염 환자의 수부 관절의 방사선학적 손상의 특성을 분석하고 그 효용성에 대해 평가하였다.
총 127명의 류마티스 관절염 환자가 연구에 포함되었다(Table 3). 남성은 27명(20.9%), 여성은 102명(79.1%)이었다. 평균 연령은 63.8세, 류마티스 관절염의 유병 기간 중앙값은 13.5년이었다. 전체 연구 대상자 중 14명(10.9%)이 흡연자였다.
혈액 검사 소견으로 자가 항체인 류마티스 인자(RF)는 168.4±12.1 (참고치 0-14), 항CCP항체(anti-CCP antibody)는 154.3±7.6 (참고치 <5), 염증의 정도를 반영하는 적혈구 침강 속도(ESR)는 39.4±2.2 (참고치 남성 0-10, 여성 0-20), C-반응 단백(CRP)은 18.4±0.6 (참고치 0-5)으로 관찰되었다. 항류마티스약제 중 가장 기본적이고 필수적인 methotrexate는 111명(87.4%)의 환자에서 사용 중이었고, 14명(10.9%)이 상위 단계의 약제인 생물학적 제제를 사용 중이었다.
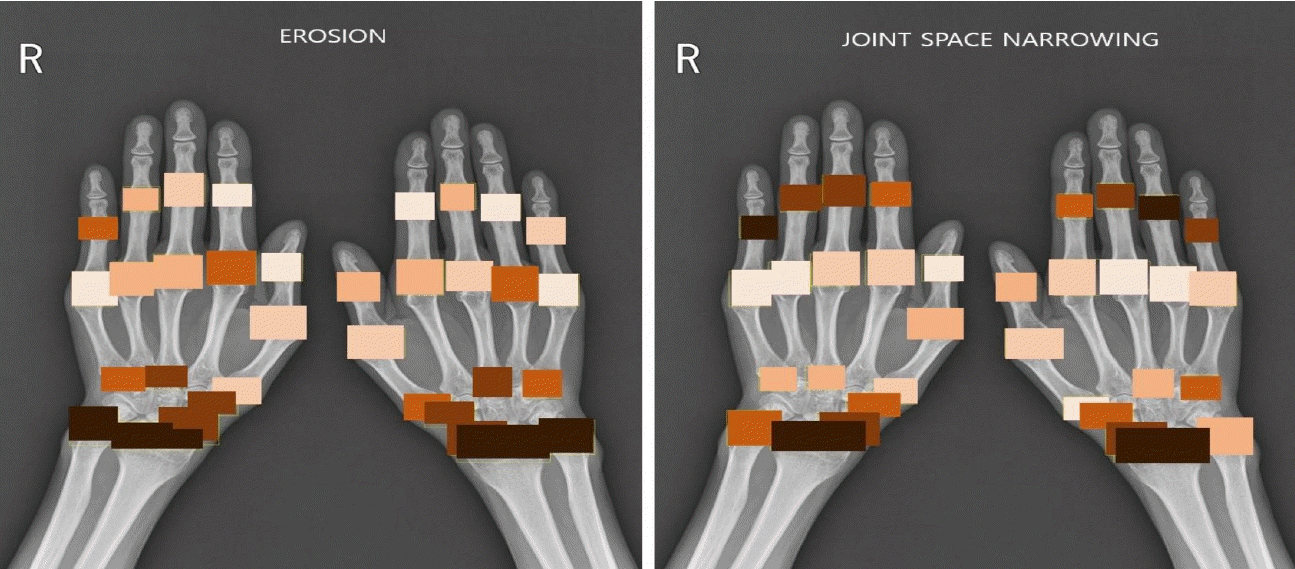
총 127명의 류마티스 관절염 환자의 각각의 수부 관절 부위별로 골 미란 및 관절강 협착 점수 값을 합산하여 비교하였다. 그림 2에서 파란색 점은 우측 수부 관절의 손상 점수, 주황색 점은 좌측 수부 관절의 손상 점수를 나타낸다. 우측 수부와 좌측 수부의 골 미란 점수와 관절강 협착 점수의 유의미한 차이는 관찰되지 않았다. 127명 환자의 수부 관절의 관절강 협착 전체 합산 점수는 미란 전체 합산 점수보다 높았다. 이러한 결과는 수부 관절의 손상이 관절강 협착이 발생한 이후 골 미란으로 진행하는 순서로 발생하기 때문으로 생각된다. 손목 관절을 이루는 주상골, 월상골, 요골, 척골 관절이 근위지절 관절이나 손허리손가락 관절에 비해 골 미란 점수가 높았고 2, 3, 4번째 근위지절 관절, 주상골, 월상골, 요골 관절이 다른 관절에 비해 관절강 협착 점수가 높은 것을 확인할 수 있다. 가장 낮은 골 미란 점수를 보인 관절은 5번째 손허리손가락 관절이었고, 가장 낮은 관절강 협착 점수를 보인 관절은 4번째 손허리손가락 관절이었다(Figure 2). 골 미란과 관절강 협착 정도를 짙은 색상을 나타낼수록 심한 관절 손상을 의미하는 히트맵(heatmap)을 통해 직관적으로 수부 관절 중 어느 관절이 높은 손상 점수를 보이는지 확인할 수 있었다(Figure 3). 우리 연구에서 사용한 평가 방법과 기존 mTSS을 사용한 방법에 의한 골 미란 점수(erosion score)와 관절강 협착 점수(joint space narrowing score)에서 서로 높은 상관관계가 있음을 확인하였다(Figure 4).
이 연구는 류마티스 관절염 환자의 수부 단순 방사선 검사에서 손상 정도를 평가하는 기존의 방법을 간소화한 새로운 방법으로 수부 손상 정도를 평가하여 손상의 분포적인 특성을 분석하고, 새로운 평가 방법의 효용성 여부를 알아보는 것이 목적이다.
류마티스 관절염은 수부, 주관절, 견관절, 슬관절, 발목 관절, 족관절 등의 전신의 소관절 및 대관절에 염증이 발생할 수 있는 질환으로 그 중 소관절인 수부 관절을 잘 침범하고, 수부의 여러 관절 중 손목 관절의 침범이 가장 흔하다[12]. 손가락 관절 중 원위지절 관절(distal inter-phalangeal joint)은 류마티스 관절염이 잘 침범하지 않아 평가 관절에서 제외하였다[13]. 원위지절 관절은 골관절염이 주로 관절강 협착과 골극(osteophyte)의 양상으로 잘 침범하는 관절이다. 골관절염과 류마티스 관절염 모두 단순 방사선 영상에서 관절강 협착을 나타낼 수 있지만 골 미란은 류마티스 관절염에서 나타나는 소견이고, 골관절염에서는 잘 나타나지 않는다. 드물지만 일부 미란성 골관절염에도 골 미란이 관찰될 수 있지만 류마티스 관절염에서 관찰되는 관절 모서리 부위 미란(marginal erosion)과는 양상이 다르게, 관절 중심 부위 미란(central erosion)의 형태로 나타난다[14]. 고령의 류마티스 관절염 환자는 수부 관절의 골관절염도 함께 동반되어 있을 가능성이 높다. 특히 엄지 손가락의 손허리손목 관절(CMC joint)은 류마티스 관절염과 골관절염이 잘 동반되는 관절이다. 이번 연구에서 관절강 협착 점수는 근위지절 관절(PIP joint)이 손허리손가락 관절(MCP joint)보다 높게 관찰되었다. 이러한 결과는 일상생활 활동 중 기계적인 스트레스가 손허리손가락 관절보다 근위지절 관절에 더 가해진다는 이전 연구 결과들과 연관성이 있을 것으로 보인다[15]. 근위지절 관절은 2, 3, 4, 5번째 손가락에서 거의 균등한 손상 점수를 보였고, 이전 연구들의 결과와 동일하게 손목 관절의 손상 점수가 수부 관절 중에서 가장 높았다. 류마티스 관절염은 관절의 구조물 중 활막(synovium)이라는 부위에 여러 면역 세포의 염증 반응으로 인한 관절염이 발생하는 질환으로 손목 관절의 경우 다른 관절에 비해 제한된 공간에 상대적으로 많은 뼈들이 관절을 이루고 있어 관절의 활막에 발생하는 염증이 다른 관절보다 더 일어날 수 있을 것으로 보여진다[16]. 류마티스 관절염 환자에서 평상시 주되게 사용하는 우측 수부가 좌측 수부보다 손상 점수가 높다는 이전 연구 결과가 있지만[17], 본 연구에서는 우측과 좌측의 유의미한 차이는 관찰되지 않았다. 이는 관찰한 환자 집단의 나이, 유병 기간 등의 기본 특성의 차이로 인한 것으로 보여진다.
이번 연구에서는 기존의 손상 정도를 평가하는 mTSS 방법을 여러 류마티스내과 전문의들의 논의를 통해 간소화한 새로운 방법으로 류마티스 관절염 환자의 수부 단순 방사선 영상을 평가하였다. 기존의 mTSS 방법으로 평가한 수부 방사선학적 손상의 특성과 새로운 방법을 통한 평가 결과가 유사한 결과를 보였다는 점에서 우리의 평가 방법이 보다 간결한 방법으로 결과를 얻어 평가의 편리성이 있다고 생각한다.
본 연구의 가장 큰 한계는 후향적 연구라는 점에서 수부 관절 손상에 영향을 줄 수 있는 환자의 직업이나 일상적인 손 사용 정도를 확인할 수 없었다. 또한 병원이 3차 의료 기관이고 데이터 부족으로 인해 많은 수의 환자가 제외되었기 때문에 이 연구는 선택 편향의 영향을 받을 수 있다. 두 번째 한계는 수부 관절 손상을 평가하기 위해 단순 방사선 검사를 사용했다는 점이다. 자기공명영상과 초음파가 점점 더 많은 역할을 하고 있으므로 이러한 영상 검사를 이용한 추가 연구를 수행하는 것이 필요하다. 세 번째 한계는 류마티스 관절염의 초기 방사선학적 변화인 관절 주위 골 감소증(peri-articular osteopenia)을 확인하지 못한 점이다. 수부의 골밀도 검사를 시행하여 2, 3, 4, 5번 수지의 관절 주위 골감소증을 분석한다면 초기 류마티스 관절염을 평가하는 측면에 있어서 이득이 있을 것이다.
최근 류마티스 질환과 연관된 여러 분야에서 축척된 데이터의 인공지능학습을 통한 자동화 모델 개발을 위한 여러 연구들이 진행되고 있다. 기존의 손상 평가 방법을 간소화하여 류마티스 관절염 환자의 수부 방사선 영상의 손상 정도를 평가하는 데 소요되는 시간과 노력을 아낄 수 있다면, 대량의 류마티스 관절염 환자 수부 방사선 영상 데이터를 축적하여 손상 평가의 자동화 시스템의 개발도 후속 연구로 적절할 것으로 생각한다.
REFERENCES
1. Pincus T, Callahan LF. What is the natural history of rheumatoid arthritis? Rheum Dis Clin North Am. 1993; 19(1):123–51.

2. Scott DL, Symmons DP, Coulton BL, Popert AJ. Long-term outcome of treating rheumatoid arthritis: results after 20 years. Lancet. 1987; 1(8542):1108–11.

3. Wolfe F. The determination and measurement of functional disability in rheumatoid arthritis. Arthritis Res. 2002; 4(Suppl 2):11–5.
4. Kanazawa T, Nishino J, Tohma S, Tanaka S. Analysis of the affected joints in rheumatoid arthritis patients in a large Japanese cohort. Mod Rheumatol. 2013; 23(1):44–9.

5. Plant MJ, Jones PW, Saklatvala J, Ollier WE, Dawes PT. Patterns of radiological progression in early rheumatoid arthritis: results of an 8 year prospective study. J Rheumatol. 1998; 25(3):417–26.
6. Braum LS, McGonagle D, Bruns A, Philipp S, Hermann S, Aupperle K, et al. Characterisation of hand small joints arthropathy using high-resolution MRI--limited discrimination between osteoarthritis and psoriatic arthritis. Eur Radiol. 2013; 23(6):1686–93.

7. Colebatch AN, Edwards CJ, Østergaard M, van der Heijde D, Balint PV, D'Agostino MA, et al. EULAR recommendations for the use of imaging of the joints in the clinical management of rheumatoid arthritis. Ann Rheum Dis. 2013; 72(6):804–14.

8. Sudoł-Szopińska I, Matuszewska G, Pracoń G. Radiographic atlas of inflammatory rheumatic diseases. Connective tissue diseases & spondyloarthritis. 1st ed. Warsaw: Medisfera;2022. p. 21–2.
9. Davies AM, Grainger AJ, James SJ. Imaging of the hand and wrist. Techniques and applications. 1st ed. Berlin: Springer;2013. p. 3–4.
10. Gadeholt O, Hausotter K, Eberle H, Klink T, Pfeil A. Differing X-ray patterns in seronegative and seropositive rheumatoid arthritis. Clin Rheumatol. 2019; 38(9):2403–10.

11. Ory PA. Interpreting radiographic data in rheumatoid arthritis. Ann Rheum Dis. 2003; 62(7):597–604.

12. van der Heijde D. How to read radiographs according to the Sharp/van der Heijde method. J Rheumatol. 2000; 27(1):261–3.
13. Song YH, Jun JB, Jung JH, Chang DK, Shim SC, Koh HK, et al. Radiological feature and significance of hand X-rayin early rheumatoid arthritis. Korean J Med. 1998; 55(6):1079–88.
14. Salaffi F, Carotti M, Beci G, Di Carlo M, Giovagnoni A. Radiographic scoring methods in rheumatoid arthritis and psoriatic arthritis. Radiol Med. 2019; 124(11):1071–86.

Figure 1.
(A-C) Region of interest (mTSS and SENS vs. our method). PIP, proximal inter-phalageal; MCP, meta-carpo-phalangeal; IP, inter-phalangeal; PMC, proximal metacarpal; CMC, carpometacarpal; CSL, capitate-scaphoid-lunate; RC, radiocarpal; mTSS, modified total sharp score; SENS, simple erosion narrowing score.
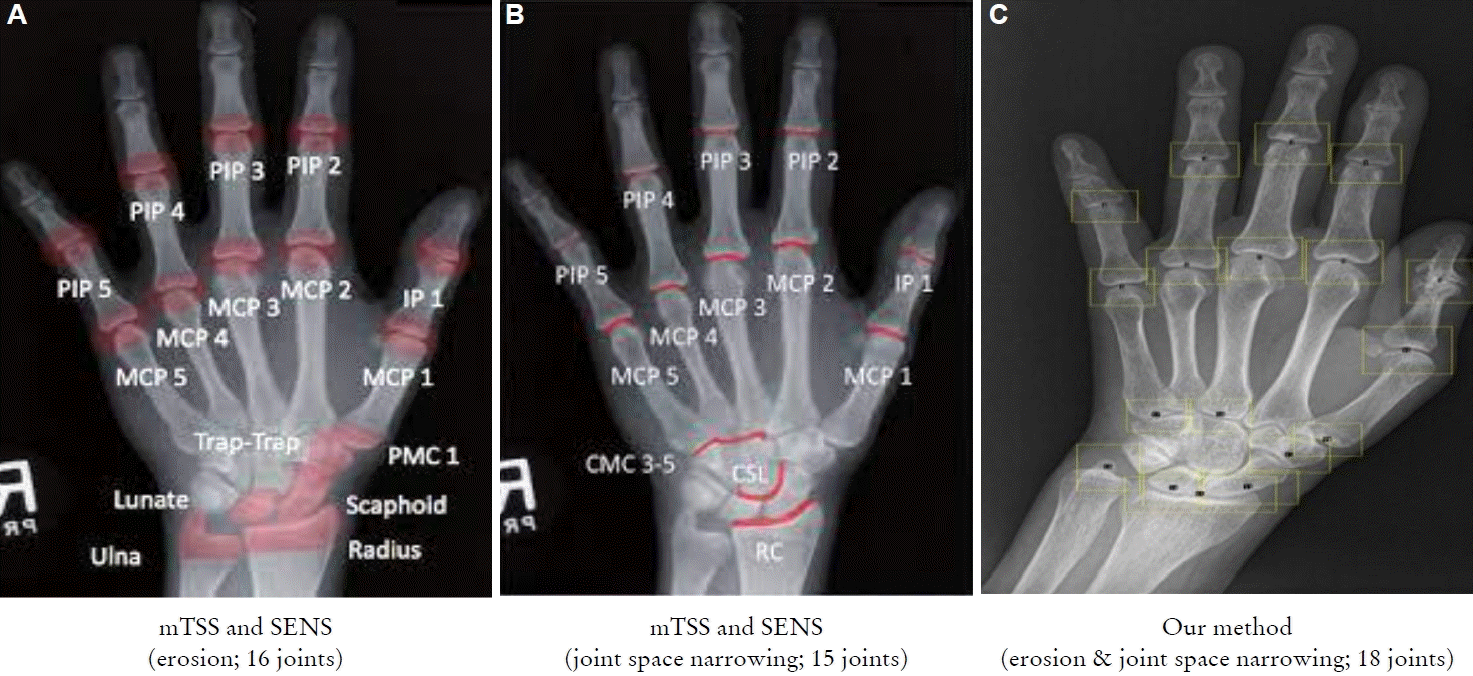
Figure 2.
(A) Total sum of each joint erosion score. (B) Total sum of each joint space narrowing score. PIP, proximal inter-phalangeal; MCP, meta-carop-phalangeal; IP, inter-phalangeal; CMC, carpo-meta-carpal; JSN_R, joint space narrowing_right; JSN_L, joint space narrowing_left.
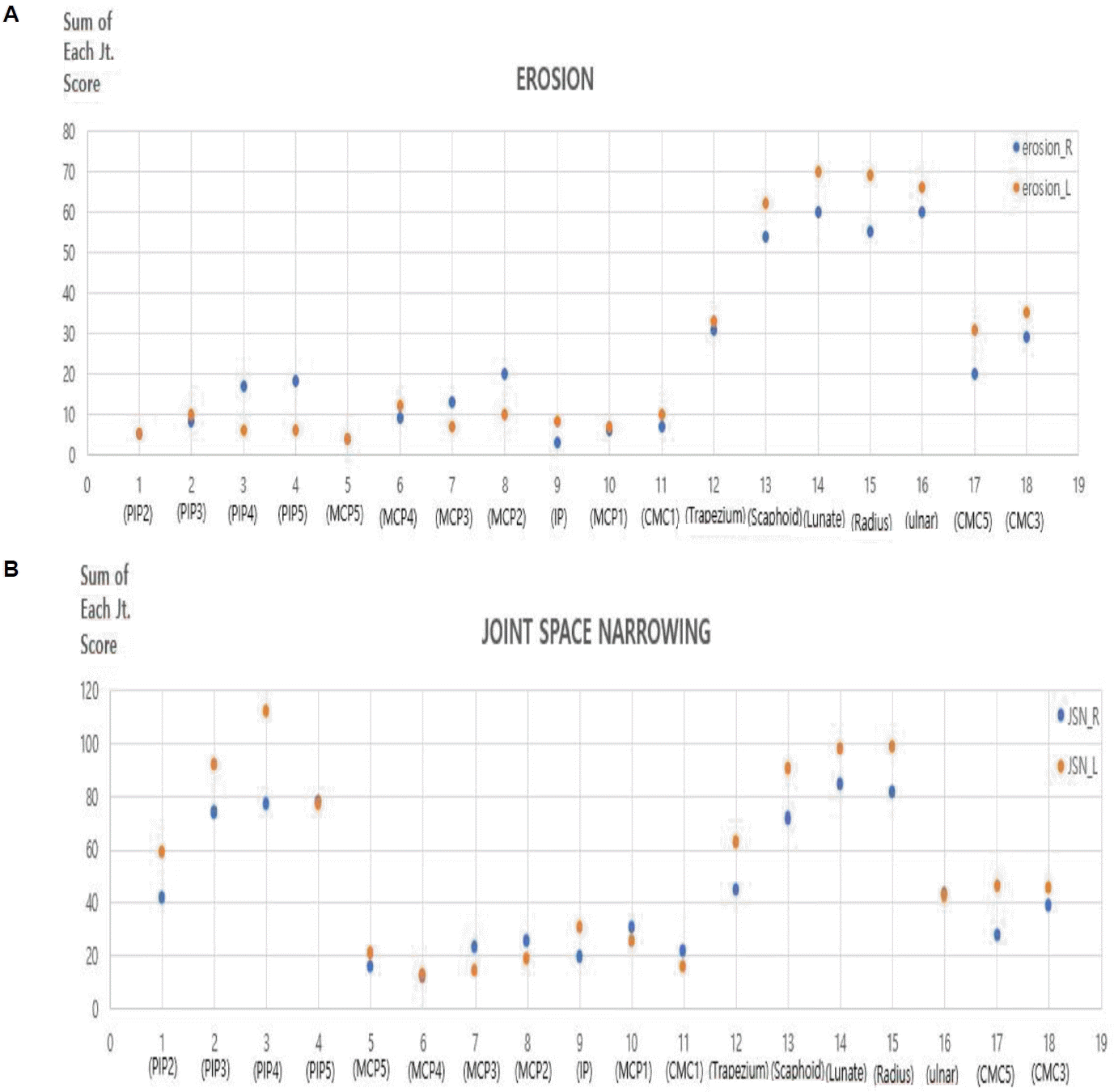
Figure 4.
(A-C) Pearson’s coefficient of correlation (r) between the values of mTSS and our method score. (A) Erosion score r=0.986 (P<0.01). (B) Joint space narrowing score r=0.978 (P<0.01). (C) Total score r=0.984 (P<0.01). TSSE, total sharp score erosion; TSSJSN, total sharp score joint space narrowing; TSS, total sharp score; mTSS, modified total sharp score by van der Heijde.
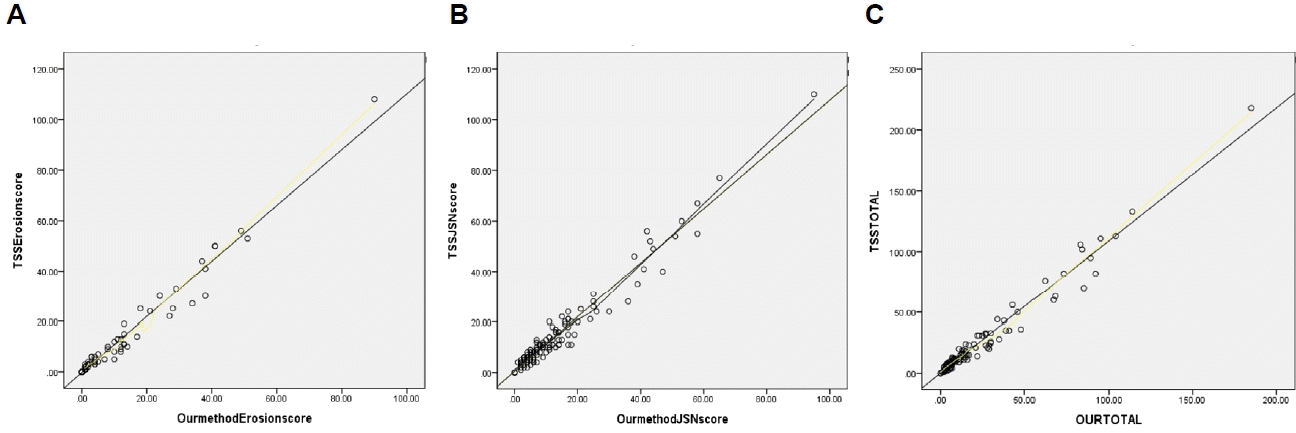
Table 1.
A comparison of the mTSS, SENS, and our radiographic scoring system used in rheumatoid arthritis (especially only hand radiographs were examined in this study)
Table 2.
Radiological analysis of hands (our method)
Table 3.
Baseline characteristics of the 127 patients with rheumatoid arthritis
| Characteristic | Value |
|---|---|
| Age, y | 63.8±1.0 |
| Female | 102 (79.1) |
| Smoking status at diagnosis | |
| Non-smoker | 113 (89.1) |
| Current smoker | 14 (10.9) |
| Rheumatoid factor,a IU/mL | 168.4±12.1 |
| Anti-CCP Ab,b U/mL | 154.3±7.6 |
| Baseline erythrocyte sediment rate, mm/hours | 39.4±2.2 |
| Baseline C-reactive protein,c mg/L | 18.4±0.6 |
| Treatment | |
| Methotrexate use | 111 (87.4) |
| Use of other conventional DMARDs | 98 (77.1) |
| Biologics use | 14 (10.9) |
| Follow-up duration, y | 13.5 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download