초록
연구배경
건선, 대사증후군을 비롯한 다양한 질환에서 혈청 요산 농도의 변화가 나타남이 알려져 있으나, 아토피피부염에서의 혈청 요산 농도에 대해서는 알려진 바가 거의 없다. 이에 본 연구에서는 성인 여성과 남성에서 아토피피부염이 혈청 요산 농도 및 고요산혈증과 연관이 있는지 조사하고자 한다.
방법
제7기 및 제8기 국민건강영양조사 자료를 이용하여, 19세 이상의 여성과 남성 각각에서 잠재적 교란요인을 보정할 때, 아토피피부염 진단 여부에 따라 평균 혈청 요산 농도 및 고요산혈증 빈도가 달라지는지를 각각 다중 선형 회귀분석 및 다중 로지스틱 회귀분석을 이용하여 확인하였다.
Abstract
Background
Serum uric acid levels have been reported to be associated with various conditions including psoriasis and metabolic syndrome, but their relationship with atopic dermatitis has not been studied adequately. This study aimed to investigate the association of atopic dermatitis with serum uric acid level and hyperuricemia in adult females and males.
Methods
Using data from the 7th and 8th Korea National Health and Nutrition Examination Survey, multiple linear and logistic regression analyses were performed to assess the association of atopic dermatitis with serum uric acid level and hyperuricemia respectively, with adjustment for potential confounding factors in females and males aged 19 years or older, respectively.
Results
The study population included 14,504 female and 12,147 male participants. When adjusting for potential confounding factors, females with atopic dermatitis had a mean serum uric acid level of 0.13 mg/dL (95% confidence interval [CI], 0.03-0.24) higher than those without atopic dermatitis (P=0.013), and hyperuricemia was also more frequent in females with atopic dermatitis than those without atopic dermatitis (adjusted odds ratio, 1.86; 95% CI, 1.27-2.72; P=0.002). On the other hand, there were no significant differences in mean serum uric acid level and frequency of hyperuricemia between males with and without atopic dermatitis when adjusting for potential confounding factors.
아토피피부염은 건선과 함께 대표적인 만성 염증성 피부 질환이다. 건선 환자에서 혈청 요산 농도가 높아진다는 사실은 잘 알려져 있는데[1], 이는 건선에서 나타나는 표피의 과증식 및 과도한 인설의 탈락으로 인해 퓨린의 분해대사가 촉진되고 그 결과 퓨린 분해대사의 최종 산화 생성물인 요산이 증가되기 때문일 것으로 보고 있다[2,3]. 아토피피부염 역시 만성적으로 피부의 염증이 반복되며 건선에서와 마찬가지로 표피의 과도한 증식 및 인설 탈락의 증가가 나타나게 된다[4]. 그러나 아토피피부염의 경우, 건선처럼 혈청 요산 농도 상승이 나타나는지에 대해 아직 명확히 알려진 바가 없는 상황이다. 이에 본 연구에서는 아토피피부염이 있는 경우에 없는 경우보다 혈청 요산 농도가 더 높은지, 그리고 아토피피부염과 고요산혈증 사이에 연관성이 존재하는지에 대해 조사하고자 한다.
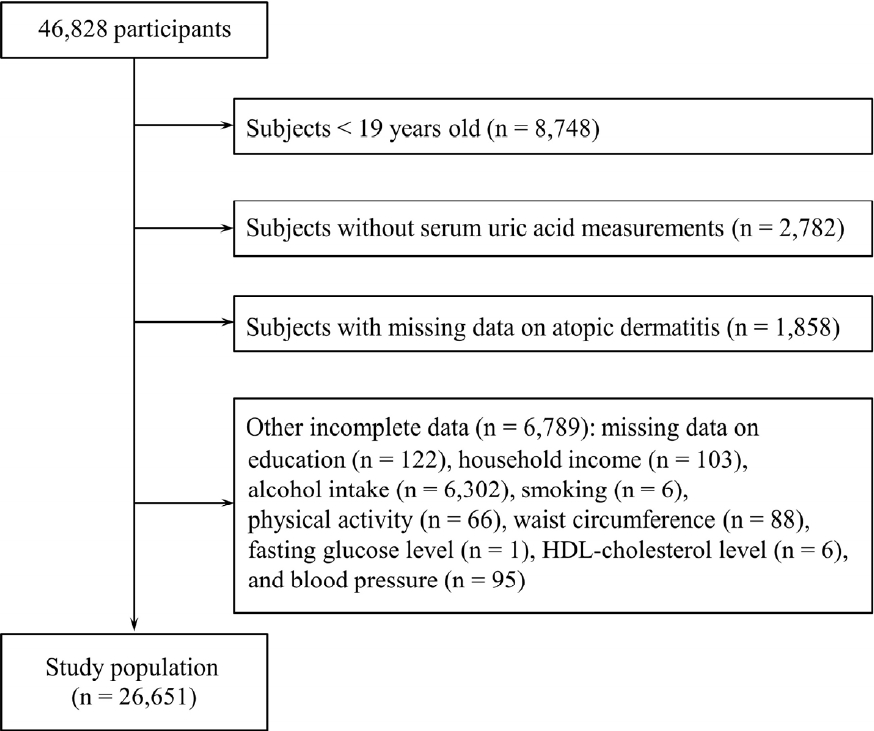
본 연구는 2016년부터 2018년까지 시행된 제7기 국민건강영양조사 및 2019년부터 2021년까지 시행된 제8기 국민건강영양조사 자료를 이용하였다. 국민건강영양조사는 1998년부터 시행되어 왔으나, 혈청 요산 농도는 제7기 및 제8기에 측정되었기 때문에 본 연구는 제7기 및 제8기 조사 결과를 대상으로 하였다. 또한 대사증후군과 혈청 요산 농도와의 관련성을 고려할 때, 대사증후군의 각 요소들이 잠재적인 교란요인으로 작용할 가능성이 있으므로[5], 이에 대한 보정을 위해 연령이 19세 이상인 성인을 연구의 대상으로 하였다. 그중 혈청 요산 농도, 아토피피부염 진단 여부, 기타 분석에 사용된 주요 변수들에 결측이 있었던 대상자를 제외한 나머지 26,651명이 최종적으로 분석 대상자가 되었다(Figure 1). 본 연구는 강원대학교병원 생명의학연구윤리심의위원회의 심의면제 승인(KNUH-2023-09-011)을 받았으며, 헬싱키 선언의 윤리 기준에 부합하게 시행되었다.
고요산혈증은 남성의 경우 혈청 요산 농도가 7.0 mg/dL 보다 높은 경우, 여성의 경우 6.0 mg/dL보다 높은 경우로 정의하였다[6]. 아토피피부염의 경우 설문 조사에서 “의사에게 진단을 받았음” 항목에 대한 답변에 의해 결정되었다[7]. 조사 대상자의 나이는 40세 미만, 40세 이상 60세 미만, 60세 이상 80세 미만, 80세 이상으로 나누었다[8]. 교육 수준은 초등학교 졸업 이하, 중학교 졸업, 고등학교 졸업, 대학교 졸업 이상으로 구분하였다. 가구소득은 소득 4분위수에 따라 나누어진 하, 중하, 중상, 상의 4개 군으로 분류하였다. 음주량의 경우 기존 연구에서와 같은 방식으로 음주 빈도와 한 번에 마시는 음주량을 곱하여 하루에 섭취하는 알코올의 양을 계산하였다[9]. 즉, 1년간 음주 빈도가 “최근 1년간 전혀 마시지 않았다”, “월 1회 미만”, “월 1회 정도”, “월 2-4회”, “주 2-3회 정도”, “주 4회 이상”인 경우, 각각 월 음주 횟수를 0, 0.5, 1, 3, 10, 16회로 두었다. 또한 한 번에 마시는 음주량이 “1-2잔”, “3-4잔”, “5-6잔”, “7-9잔”인 경우, 각각 15, 35, 55, 80 g/회로 두었으며, “10잔 이상”인 경우에는 구체적으로 몇 잔인지가 조사되었기 때문에 잔 수에 10 g을 곱하여 한 번에 마시는 음주량을 계산하였다. 이렇게 얻어진 월 음주 횟수와 한 번에 마시는 음주량을 곱한 뒤 30으로 나누어 하루당 알코올 섭취량을 계산하였다. 이와 같이 계산된 알코올 섭취량을 바탕으로 음주량은 하루 0 g, 0 g 초과 16 g 미만, 16 g 이상 40 g 이하, 40 g 초과로 분류하였다[10]. 흡연은 평생 동안 100개비 미만을 피운 경우 비흡연자, 과거엔 피웠으나 현재 피우지 않는 경우 과거 흡연자, 현재 담배를 피우는 경우 현재 흡연자로 정의하였다[11]. 신체활동의 경우 기존 연구에서와 같이 계산되었으며, 국제신체활동설문(International Physical Activity Questionnaire) 권고에 따라 주당 600 metabolic equivalent of task (MET)-분 미만, 600 MET-분 이상 3,000 MET-분 미만, 3,000 MET-분 이상으로 분류하였다[12]. 근력운동의 경우 기존 연구에서와 같이 1주일간 근력운동 일수를 기준으로 0회, 1회 이상 3회 이하, 4회 이상으로 나누었다[13]. 남성에서 허리둘레가 90 cm 이상인 경우 및 여성에서 허리둘레가 85 cm 이상 경우를 복부비만으로 정의하였다[5]. 공복 혈당이 100 mg/dL 이상인 경우 공복 혈당 상승, 혈청 중성지방이 150 mg/dL 이상인 경우 높은 중성지방으로 정의하였다[5]. 혈청 고밀도지단백콜레스테롤이 남성에서는 40 mg/dL 이하, 여성에서는 50 mg/dL 이하인 경우 낮은 고밀도지단백콜레스테롤로 정의하였다[5]. 수축기 혈압이 130 mmHg 이상이거나 이완기 혈압이 85 mmHg 이상인 경우 혈압 상승으로 정의하였다[5].
국민건강영양조사는 다단계 층화집락 확률추출법을 이용하여 추출된 표본에 대해 시행되는 조사이기 때문에, 자료 분석 시에도 이를 고려하여 가중치, 층화, 집락 정보를 반영한 복합표본 분석 방법을 사용하였다. 혈청 요산 농도가 성별에 따라 명확한 차이를 보이며, 대사증후군, 알코올 섭취, 비만 등의 교란요인과 혈청 요산 농도와의 연관 정도가 성별에 따라 다르다는 점을 고려하여[14,15], 본 연구에서 아토피피부염과 혈청 요산 수치, 고요산혈증과의 연관성 분석은 남성과 여성으로 나누어 시행되었다.
본 연구는 복합표본 분석 방법을 사용하였으므로 범주형 변수에 대해서는 각 범주별 추정 빈도를 백분율로 나타내고 그 표준오차를 구하였으며, 연속형 변수에 대해서는 평균 및 표준편차를 추정하고 각각의 표준오차를 함께 구하였다. 또한 남성과 여성 각각에서 고요산혈증 유무와의 연관성을 확인하기 위해 범주형 변수에 대해서는 Rao-Scott의 조정된 Pearson 카이제곱검정을, 연속형 변수에 대해서는 복합표본 조사 자료에 대한 설계기반 Wilcoxon 순위합 검정을 시행하였다.
여성과 남성 각각에서 평균 혈청 요산 농도와 관련 있는 요인들을 확인하기 위해, 혈청 요산 농도를 종속변수로 하고, 아토피피부염 진단 여부, 나이, 교육 수준, 가구소득, 음주량, 흡연, 신체활동, 근력운동, 복부비만, 공복 혈당 상승, 높은 중성지방, 낮은 고밀도지단백콜레스테롤, 혈압 상승, 혈청 크레아티닌 농도를 각각 독립변수로 하는 단순선형 회귀분석을 시행하고, 또한 이들 독립변수들을 모두 포함하는 다중선형 회귀분석을 시행하였다. 그리고 이 다중선형 회귀모형을 기반으로 남녀 각각에서 아토피피부염 진단 여부에 따라 혈청 요산 농도의 추정 주변 평균 값을 구하였다.
여성과 남성 각각에서 고요산혈증과 관련 있는 요인들을 확인하기 위해 고요산혈증 여부를 종속변수로 하고, 아토피피부염 진단 여부, 나이, 교육 수준, 가구소득, 음주량, 흡연, 신체활동, 근력운동, 복부비만, 공복 혈당 상승, 높은 중성지방, 낮은 고밀도지단백콜레스테롤, 혈압 상승, 혈청 크레아티닌 농도를 각각 독립변수로 하는 단순 로지스틱 회귀분석을 시행하고, 또한 이들 독립변수들을 모두 포함하는 다중 로지스틱 회귀분석을 시행하였다.
모든 통계 분석은 통계 소프트웨어 패키지인 R version 4.2.3 (The R Foundation for Statistical Computing, Vienna, Austria)을 사용하였으며, 유의확률 0.05 미만인 경우 통계적으로 유의한 것으로 판정하였다.
연구 대상자는 총 26,651명이었으며, 이들의 인구사회적, 임상적 특성은 표 1과 같았다. 고요산혈증이 있는 여성 중 6.0% (표준오차, 1.0%)가 아토피피부염을 진단받았던 반면, 고요산혈증이 없는 여성 중에서는 4.0% (표준오차, 0.2%)만이 아토피피부염을 진단받아서, 고요산혈증이 있는 여성에서 아토피피부염 진단이 더 빈번하였다(P=0.028). 반면, 고요산혈증이 있는 남성 중 4.6% (표준오차, 0.5%)가 아토피피부염을 진단받았고, 고요산혈증이 없는 남성 중에서는 3.8% (표준오차, 0.2%)가 아토피피부염을 진단받아서, 고요산혈증이 있는 남성과 없는 남성 사이에 아토피피부염 진단 빈도에는 유의한 차이가 없었다(P=0.136).
여성과 남성 각각에서 아토피피부염 진단 여부에 따라 혈청 요산 농도의 분포를 확인하기 위해 상자 그림을 그려 보면 여성과 남성 모두에서 아토피피부염을 진단받은 경우 혈청 요산 농도가 높은 경향을 확인할 수 있었다(Figure 2). 이는 혈청 요산 농도를 종속변수로 하는 단순선형 회귀분석에서도 확인되었는데(Table 2), 아토피피부염을 진단받은 여성의 경우 그렇지 않은 여성에 비해 평균 혈청 요산 농도가 0.13 mg/dL (95% 신뢰구간, 0.02-0.25) 더 높았으며(P=0.023), 아토피피부염을 진단받은 남성의 경우 그렇지 않은 남성에 비해 평균 혈청 요산 농도가 0.26 mg/dL (95% 신뢰구간, 0.12-0.39) 더 높았다(P<0.001).
그러나 잠재적 교란요인인 나이, 교육 수준, 가구소득, 음주량, 흡연, 신체활동, 근력운동, 복부비만, 공복 혈당 상승, 높은 중성지방, 낮은 고밀도지단백콜레스테롤, 혈압 상승, 혈청 크레아티닌 농도를 보정하여 혈청 요산 농도를 종속변수로 하는 다중선형 회귀분석을 시행할 경우, 여성과 남성에서 다른 결과가 얻어졌다(Table 2, Figure 3). 교란변수를 보정할 경우 혈청 요산 농도의 추정된 주변 평균은 아토피피부염을 진단받은 여성의 경우 4.60 mg/dL (95% 신뢰구간, 4.49-4.70)이고 그렇지 않은 여성의 경우 4.46 mg/dL (95% 신뢰구간, 4.44-4.48)로, 아토피피부염을 진단받은 여성이 그렇지 않은 여성보다 통계적으로 유의하게 높았다(보정된 평균 혈청 요산 농도 차이 0.13 mg/dL; 95% 신뢰구간, 0.03-0.24 mg/dL; P=0.013). 반면, 교란변수가 보정된 혈청 요산 농도의 추정된 주변 평균은 아토피피부염을 진단받은 남성의 경우 6.08 mg/dL (95% 신뢰구간, 5.96-6.21)이고 그렇지 않은 남성의 경우 6.04 mg/dL (95% 신뢰구간, 6.01-6.07)로, 아토피피부염을 진단받은 남성과 그렇지 않은 남성 사이에 유의한 차이가 없었다(보정된 평균 혈청 요산 농도 차이 0.04 mg/dL; 95% 신뢰구간, -0.08 to 0.17 mg/dL; P=0.515).
여성과 남성 각각에서 고요산혈증 여부를 종속변수로 하는 단순 로지스틱 회귀분석을 시(행해 보면(Table 3), 아토피피부염을 진단받은 여성의 경우 그렇지 않은 여성에 비해 고요산혈증의 오즈가 유의하게 더 높았던 반면(오즈비, 1.52; 95% 신뢰구간, 1.04-2.21; P=0.029), 아토피피부염을 진단받은 남성과 그렇지 않은 남성 사이에는 고요산혈증의 오즈에 유의한 차이가 없었다(오즈비, 1.21; 95% 신뢰구간, 0.94-1.57; P=0.136).
이러한 결과는 잠재적 교란요인인 나이, 교육 수준, 가구 소득, 음주량, 흡연, 신체활동, 근력운동, 복부비만, 공복 혈당 상승, 높은 중성지방, 낮은 고밀도지단백콜레스테롤, 혈압 상승, 혈청 크레아티닌 농도를 보정하며 고요산혈증 여부를 종속변수로 하는 다중 로지스틱 회귀분석을 시행할 경우에도 마찬가지로 나타났다(Table 3). 교란변수를 보정할 경우에도 아토피피부염을 진단받은 여성에서 그렇지 않은 여성에 비해 고요산혈증의 오즈가 유의하게 더 높았던 반면(보정된 오즈비, 1.86; 95% 신뢰구간, 1.27-2.72; P=0.002), 아토피피부염을 진단받은 남성과 그렇지 않은 남성 사이에는 고요산혈증의 오즈에 유의한 차이가 없었다(보정된 오즈비, 0.97; 95% 신뢰구간, 0.74-1.26; P=0.800).
이번 연구에서 성인 여성은 아토피피부염을 진단받은 경우에 그렇지 않은 경우보다 평균 혈청 요산 농도도 더 높았고 고요산혈증의 빈도도 더 높았으나, 성인 남성은 아토피피부염 진단이 혈청 요산 농도 증가나 고요산혈증과 관련이 없었다. 국민건강영양조사는 대한민국 국민을 대표하는 표본을 대상으로 시행되므로, 이번 연구 결과는 모집단인 우리나라 성인 남성 및 여성 전체에서 성립한다고 볼 수 있다. 이번 연구와 같이 대규모 인구 집단에서 아토피피부염과 혈청 요산 농도의 연관성을 보고한 과거 연구는 찾을 수 없었으며, 특히 남성과 여성 각각에서 아토피피부염과 혈청 요산 농도의 연관성을 연구한 결과도 찾을 수 없었다.
과거 아토피피부염과 요산과의 관계에 대한 연구는 거의 없었으며 그 결과도 일관되지 않았다. 1961년 Walton 등[16]은 건선과 혈청 요산 농도의 연관성을 연구하면서 다양한 피부 질환을 가진 다른 환자들의 혈청 요산을 함께 측정했다. 이 중 6명의 아토피피부염 환자가 포함되어 있었고, 이들 중 일부에서 혈청 요산 농도가 높은 경우가 있었음을 보고하였다. 그러나 정상 대조군과의 비교는 하지 않았다. Portugal-Cohen 등[17]은 아토피피부염 환자와 정상 대조군에 대해 혈청이 아닌 피부 표면에서의 요산수준을 측정했는 데 아토피피부염 환자의 경우 정상 대조군에 비해 병변 부위뿐만 아니라 비병변 부위까지 요산이 감소되어 있음을 보고하였다. 아토피피부염과 연관성이 높은 질환인 알레르기 비염 및 천식의 경우 혈청 요산 수치와 연관이 있음이 보고된 바가 있는데 알레르기 비염 환자에서 정상 대조군보다 혈청 요산 농도가 증가되어 있었으며[18], 높은 혈청 요산 농도가 천식 발생의 위험인자로 작용할 수 있음을 보고한 연구도 있었다[19].
요산은 대표적인 항산화 물질이다[20]. 산화 스트레스와 연관된 질환인 다발성 경화증 환자에서는 대조군에 비해 혈청 요산 농도가 현저히 낮으며[21], 다발성 경화증의 동물 모델에서 요산을 투여할 경우 강력한 치료 효과를 보이기도 한다[22]. 반면 역시 산화 스트레스와 연관된 질환인 비만, 대사증후군, 심혈관 질환 환자들에서는 혈청 요산 농도가 오히려 증가함이 잘 알려져 있다[23]. 만성 피부 질환 중 하나인 건선도 산화 스트레스와 연관이 깊지만 역시 고요산혈증과 관련되어 있다[24]. 이와 같이 정반대의 양상이 나타나는 이유는 아직 분명하지 않지만 상황에 따라 요산은 항산화 효과를 나타내기도 하고 반대로 산화 반응을 촉진하기도 하기 때문이라는 주장이 있다[20]. 요산은 혈장과 같은 친수성 환경에서는 항산화 효과를 나타내지만, 지질막 내부와 같은 소수성 환경에서는 항산화 효과를 나타내지 못하며 오히려 산화제와 반응하여 라디칼을 형성하고 세포 내 산화 스트레스를 유발하며 세포 손상을 일으킬 수도 있다[20]. 아토피피부염 역시 산화 스트레스와 깊은 연관이 있다는 점을 고려하면[25,26], 아토피피부염 환자에서의 혈청 요산 상승 역시 요산과 관련된 세포 내 산화 촉진에 의할 수 있을 것으로 추측된다.
이번 연구에서 아토피피부염과 혈청 요산 상승, 고요산혈증과의 관련성은 여성에서 뚜렷하게 나타났고, 남성에서는 유의하지 않았다. 대사증후군에 대해서도 이와 유사한 결과가 보고된 바 있는데 혈청 요산 농도와 대사증후군과의 관련성이 남성보다 여성에서 더 뚜렷하게 나타났다[14]. 이와 같은 남녀 간 차이의 명확한 원인은 불분명하지만, 일반적으로 성별에 따라 혈청 요산 농도 자체에 차이가 있으며 이로 인해 고요산혈증의 기준도 남녀 간에 서로 다르다는 점을 고려해야 한다. 또한 이번 연구에서 사용된 아토피피부염 의사 진단 여부에 대한 설문은 과거 의사에게 진단을 받은 적이 있는지를 물어본 것이며 현재 아토피피부염 유병 중인지를 물어본 것이 아니었다. 소아기에 아토피피부염을 진단받았던 사람 중 성인이 되어서까지 질환이 지속되는 경우는 남성보다 여성에서 현저히 더 많은 것으로 알려져 있다[27]. 성인 시기에 새로 시작되는 아토피피부염도 여성에서 더 흔하며, 성인 남성보다 성인 여성에서 아토피피부염 환자의 빈도도 더 높다[28]. 이러한 점들로 인해 남성보다 여성에서 혈청 요산 농도와의 연관성이 뚜렷하게 관찰되었을 가능성이 있다.
이번 연구에서는 몇 가지 한계점도 있었다. 첫째로 연구 대상이 되었던 국민건강영양조사 자료는 대한민국 국민을 대표하는 표본이며 다른 국가나 인종에 대해서 결과를 일반화하기 위해서는 추가적인 확인 연구가 필요하다. 둘째로 이번 연구에서 혈청 요산 농도 및 고요산혈증과의 관련성을 확인했던 것은 아토피피부염의 진단 여부였는데, 보다 의미 있는 결과를 얻기 위해서는 아토피피부염 증상의 중증도에 대한 분석이 필요하다. 셋째로 이번 연구를 통해 혈청 요산 농도와 아토피피부염 간의 연관성을 확인할 수 있었으나 이들 간의 직접적인 인과관계를 밝힌 것은 아니므로, 이에 대한 추가적인 연구가 필요하다.
결론적으로 이번 연구를 통해 우리나라 성인 여성에서 아토피피부염 진단과 혈청 요산 농도 상승 사이에 뚜렷한 연관성이 있음을 확인할 수 있었다. 향후 이러한 연관성이 다른 인구 집단에서도 일반적으로 관찰되는지, 이들 사이에 인과관계가 존재하는지 등에 대한 후속 연구가 필요할 것으로 보인다.
REFERENCES
1. Kwon HH, Kwon IH, Choi JW, Youn JI. Cross-sectional study on the correlation of serum uric acid with disease severity in Korean patients with psoriasis. Clin Exp Dermatol. 2011; 36(5):473–8.

2. Nicolae I, Tampa M, Ene CD, Mitran CI, Mitran MI, Sarbu MI, et al. Correlations between related-purine derivatives and renal disorders in patients with psoriasis vulgaris. Exp Ther Med. 2019; 17(2):1012–9.

3. Bazid HAS, Shoeib MA, El-Sayed S, Mostafa MI, Shoeib MM, Eldeen ES. Study of purine derivatives and their relation to renal disorders in patients with psoriasis. Int J Dermatol. 2023; 62(1):73–8.

4. Niehues H, Rikken G, van Vlijmen-Willems IMJJ, Rodijk-Olthuis D, van Erp PEJ, Zeeuwen PLJM, et al. Identification of keratinocyte mitogens: implications for hyperproliferation in psoriasis and atopic dermatitis. JID Innov. 2021; 2(1):100066.

5. Jeong J, Suh YJ. Association between serum uric acid and metabolic syndrome in Koreans. J Korean Med Sci. 2019; 34(48):e307.

6. Lee JW, Kwon BC, Choi HG. Analyses of the relationship between hyperuricemia and osteoporosis. Sci Rep. 2021; 11(1):12080.

7. Cheng HM, Kim S, Park GH, Chang SE, Bang S, Won CH, et al. Low vitamin D levels are associated with atopic dermatitis, but not allergic rhinitis, asthma, or IgE sensitization, in the adult Korean population. J Allergy Clin Immunol. 2014; 133(4):1048–55.

8. Sun Y, Zhang H, Tian W, Shi L, Chen L, Li J, et al. Association between serum uric acid levels and coronary artery disease in different age and gender: a cross-sectional study. Aging Clin Exp Res. 2019; 31(12):1783–90.

9. Lee B, Ha J. The effects of smoking and drinking on blood lead and cadmium levels: data from the fourth Korea national health and nutrition examination survey. Korean J Occup Environ Med. 2011; 23(1):31–41.

10. Lee MY, Kim MY, Kim SY, Kim JH, Kim BH, Shin JY, et al. Association between alcohol intake amount and prevalence of metabolic syndrome in Korean rural male population. Diabetes Res Clin Pract. 2010; 88(2):196–202.

11. Yuan H, Kim MK. Prevalence of metabolic syndrome and related factors based on smoking status and physical activity in Korean adult men. Korean J Health Promot. 2023; 23(2):75–84.

12. Kurtze N, Rangul V, Hustvedt BE. Reliability and validity of the international physical activity questionnaire in the Nord-Trøndelag health study (HUNT) population of men. BMC Med Res Methodol. 2008; 8:63.

13. Kim Y, Shin S, Hong N, Rhee Y. Low serum vitamin E level associated with low hand grip strength in community-dwelling adults: Korean National Health and Nutrition Examination Survey (KNHANES VII) 2016-2018. Nutrients. 2021; 13(5):1598.

14. Chiou WK, Wang MH, Huang DH, Chiu HT, Lee YJ, Lin JD. The relationship between serum uric acid level and metabolic syndrome: differences by sex and age in Taiwanese. J Epidemiol. 2010; 20(3):219–24.

15. Alatalo PI, Koivisto HM, Hietala JP, Bloigu RS, Niemelä OJ. Gender-dependent impacts of body mass index and moderate alcohol consumption on serum uric acid--an index of oxidant stress status? Free Radic Biol Med. 2009; 46(8):1233–8.

16. Walton R, Block WD, Heyde J. A comparative study of uric acid values of whole blood in patients with psoriasis and other dermatoses. J Invest Dermatol. 1961; 37:125–33.
17. Portugal-Cohen M, Horev L, Ruffer C, Schlippe G, Voss W, Ma'or Z, et al. Non-invasive skin biomarkers quantification of psoriasis and atopic dermatitis: cytokines, antioxidants and psoriatic skin auto-fluorescence. Biomed Pharmacother. 2012; 66(4):293–9.

18. Abbas WF, Hassan MB. Evaluation of the level of variables related to allergic rhinitis. African Journal of Advanced Pure and Applied Sciences (AJAPAS). 2023; 2(2):244–54.
19. Wang H, Jia Y, Yi M, Li Y, Chen O. High serum uric acid was a risk factor for incident asthma: an open cohort study. Risk Manag Healthc Policy. 2020; 13:2337–46.
20. Sautin YY, Johnson RJ. Uric acid: the oxidant-antioxidant paradox. Nucleosides Nucleotides Nucleic Acids. 2008; 27(6):608–19.

22. Hooper DC, Spitsin S, Kean RB, Champion JM, Dickson GM, Chaudhry I, et al. Uric acid, a natural scavenger of peroxynitrite, in experimental allergic encephalomyelitis and multiple sclerosis. Proc Natl Acad Sci U S A. 1998; 95(2):675–80.
23. Kanbay M, Jensen T, Solak Y, Le M, Roncal-Jimenez C, Rivard C, et al. Uric acid in metabolic syndrome: from an innocent bystander to a central player. Eur J Intern Med. 2016; 29:3–8.

24. Pleńkowska J, Gabig-Cimińska M, Mozolewski P. Oxidative stress as an important contributor to the pathogenesis of psoriasis. Int J Mol Sci. 2020; 21(17):6206.

25. Briganti S, Picardo M. Antioxidant activity, lipid peroxidation and skin diseases. What's new. J Eur Acad Dermatol Venereol. 2003; 17(6):663–9.

26. Bertino L, Guarneri F, Cannavò SP, Casciaro M, Pioggia G, Gangemi S. Oxidative stress and atopic dermatitis. Antioxidants (Basel). 2020; 9(3):196.

27. Rystedt I. Long term follow-up in atopic dermatitis. Acta Derm Venereol Suppl (Stockh). 1985; 114:117–20.
Figure 2.
Box plots showing the distributions of serum uric acid levels in adult females and males with and without atopic dermatitis.
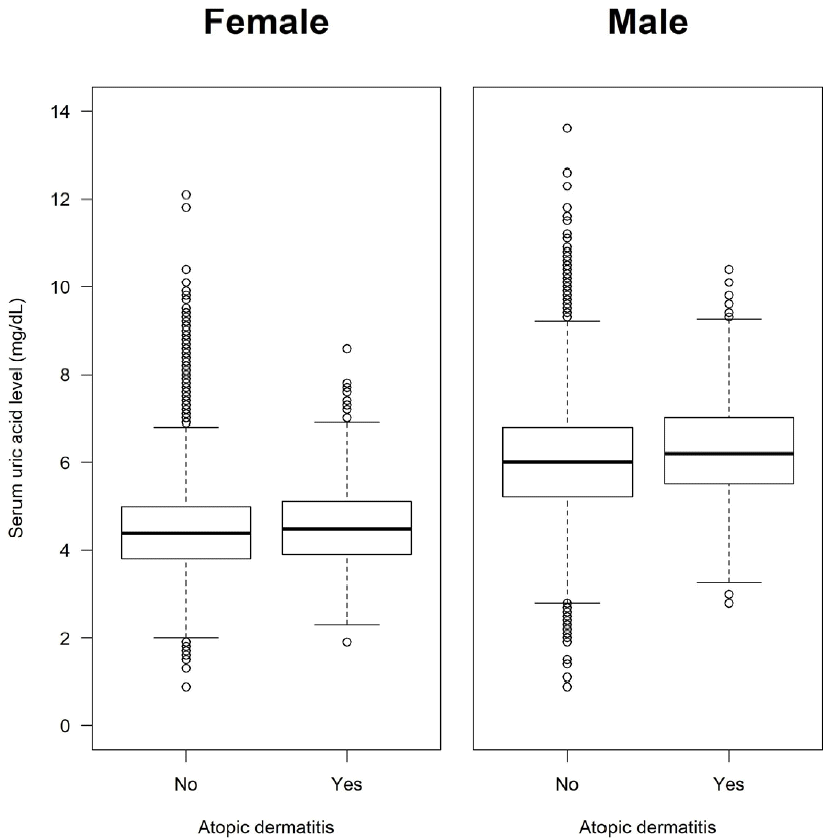
Figure 3.
Estimated marginal mean serum uric acid levels in adult females and males with and without atopic dermatitis. The error bars indicate 95% confidence intervals. The results were obtained by multiple linear regression analyses with adjustment for potential confounding factors including age, education, household income, alcohol intake, smoking, physical activity, resistance exercise, abdominal obesity, elevated fasting glucose, high triglycerides, low high-density lipoprotein-cholesterol, elevated blood pressure, and serum creatinine using generalized linear model for complex survey design.
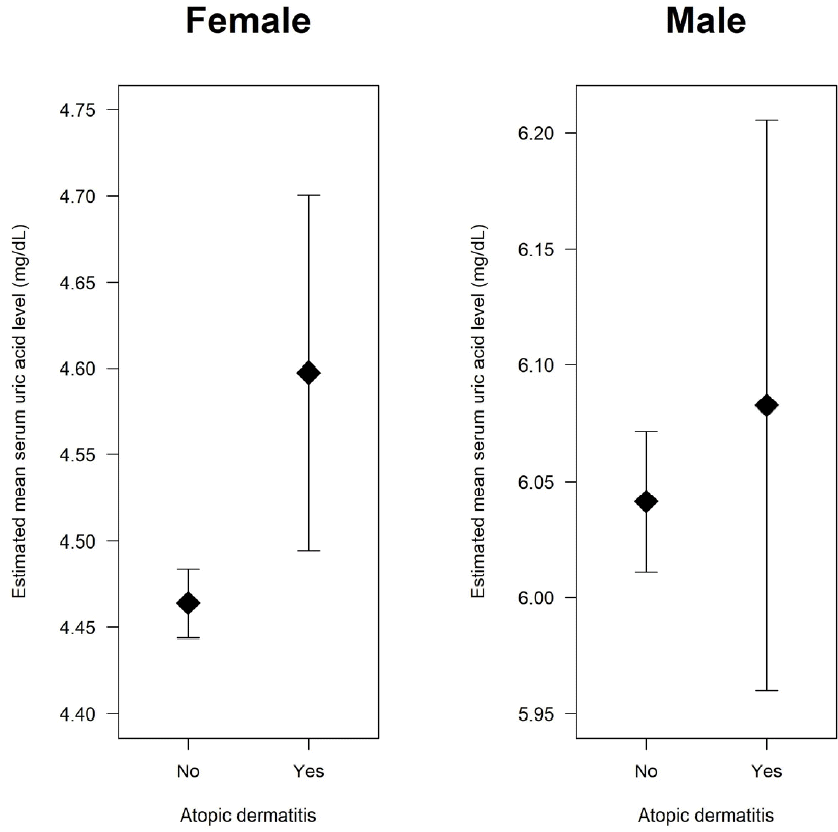
Table 1.
Characteristics of the study population
| Chracteristic | Total |
Female |
Pa |
Male |
Pa | ||
|---|---|---|---|---|---|---|---|
|
Hyperuricemia |
Hyperuricemia |
||||||
| No | Yes | No | Yes | ||||
| Total | |||||||
| N | 26,651 | 13,540 | 964 | 9,773 | 2,374 | ||
| Percent | 100.0 | 93.6±0.2 | 6.4±0.2 | 79.2±0.5 | 20.8±0.5 | ||
| Age, y | <0.001 | <0.001 | |||||
| <40 | 37.3±0.5 | 35.7±0.6 | 34.2±1.8 | 35.6±0.7 | 51.6±1.2 | ||
| 40 to <60 | 40.2±0.4 | 40.5±0.5 | 31.7±1.8 | 42.2±0.6 | 34.1±1.1 | ||
| 60 to <80 | 20.2±0.4 | 21.1±0.5 | 26.1±1.6 | 20.7±0.5 | 13.0±0.7 | ||
| ≥80 | 2.2±0.1 | 2.7±0.2 | 8.0±0.9 | 1.5±0.1 | 1.3±0.2 | ||
| Education | <0.001 | <0.001 | |||||
| Elementary school or less | 11.7±0.3 | 15.7±0.5 | 24.9±1.5 | 8.0±0.3 | 5.4±0.5 | ||
| Middle school | 7.7±0.2 | 8.1±0.3 | 11.1±1.2 | 7.5±0.3 | 6.1±0.5 | ||
| High school | 36.6±0.5 | 34.9±0.6 | 34.5±1.9 | 38.3±0.6 | 38.4±1.2 | ||
| College or above | 43.9±0.6 | 41.3±0.7 | 29.5±1.8 | 46.2±0.8 | 50.2±1.3 | ||
| Household income | <0.001 | 0.911 | |||||
| Low | 13.3±0.4 | 14.8±0.5 | 22.6±1.6 | 11.4±0.4 | 11.3±0.8 | ||
| Mid-low | 22.5±0.4 | 23.1±0.5 | 25.6±1.7 | 21.9±0.5 | 21.2±1.1 | ||
| Mid-high | 29.9±0.5 | 29.3±0.5 | 24.8±1.7 | 30.7±0.6 | 31.0±1.2 | ||
| High | 34.3±0.7 | 32.7±0.7 | 27.1±1.8 | 36.0±0.8 | 36.6±1.3 | ||
| Alcohol intake, g/day | <0.001 | <0.001 | |||||
| 0 | 10.1±0.2 | 16.2±0.4 | 21.8±1.5 | 4.3±0.2 | 2.9±0.4 | ||
| <16 | 69.7±0.4 | 76.2±0.5 | 64.4±1.8 | 64.7±0.5 | 62.2±1.1 | ||
| 16-40 | 12.7±0.2 | 5.6±0.2 | 9.4±1.2 | 19.1±0.4 | 18.9±0.9 | ||
| >40 | 7.6±0.2 | 1.9±0.2 | 4.5±0.8 | 11.9±0.4 | 16.0±0.9 | ||
| Smoking | <0.001 | 0.324 | |||||
| Never smoked | 55.4±0.4 | 87.1±0.4 | 81.3±1.6 | 25.6±0.5 | 27.2±1.1 | ||
| Ex-smoker | 22.0±0.3 | 6.6±0.3 | 7.0±1.1 | 36.8±0.6 | 35.2±1.1 | ||
| Current smoker | 22.6±0.3 | 6.4±0.3 | 11.7±1.3 | 37.6±0.6 | 37.6±1.2 | ||
| Physical activity, MET-min | 0.785 | 0.069 | |||||
| <600 | 43.6±0.4 | 47.1±0.5 | 46.7±1.9 | 40.3±0.6 | 40.2±1.2 | ||
| 600 to <3,000 | 45.9±0.4 | 45.3±0.6 | 45.0±1.9 | 46.9±0.6 | 45.0±1.2 | ||
| ≥3,000 | 10.5±0.3 | 7.6±0.3 | 8.3±1.1 | 12.8±0.4 | 14.8±0.9 | ||
| Resistance exercise, times/week | 0.476 | 0.360 | |||||
| 0 | 72.2±0.3 | 81.1±0.4 | 79.9±1.6 | 64.1±0.6 | 62.6±1.1 | ||
| 1-3 | 16.5±0.3 | 12.8±0.3 | 12.8±1.3 | 19.8±0.5 | 20.0±0.9 | ||
| ≥4 | 11.4±0.2 | 6.1±0.2 | 7.3±1.0 | 16.0±0.4 | 17.4±0.9 | ||
| Abdominal obesity | <0.001 | <0.001 | |||||
| No | 68.7±0.4 | 76.0±0.5 | 44.7±2.0 | 67.4±0.6 | 49.5±1.1 | ||
| Yes | 31.3±0.4 | 24.0±0.5 | 55.3±2.0 | 32.6±0.6 | 50.5±1.1 | ||
| Elevated fasting glucose | <0.001 | 0.918 | |||||
| No | 65.6±0.4 | 73.1±0.5 | 54.0±1.9 | 59.6±0.6 | 59.8±1.2 | ||
| Yes | 34.4±0.4 | 26.9±0.5 | 46.0±1.9 | 40.4±0.6 | 40.2±1.2 | ||
| High triglycerides | <0.001 | <0.001 | |||||
| No | 70.9±0.3 | 82.6±0.4 | 60.6±1.9 | 64.9±0.6 | 47.1±1.2 | ||
| Yes | 29.1±0.3 | 17.4±0.4 | 39.4±1.9 | 35.1±0.6 | 52.9±1.2 | ||
| Low HDL-cholesterol | <0.001 | <0.001 | |||||
| No | 70.3±0.4 | 66.6±0.5 | 46.3±1.8 | 77.0±0.5 | 67.2±1.1 | ||
| Yes | 29.7±0.4 | 33.4±0.5 | 53.7±1.8 | 23.0±0.5 | 32.8±1.1 | ||
| Elevated blood pressure | <0.001 | <0.001 | |||||
| No | 71.6±0.4 | 78.3±0.4 | 67.4±1.7 | 67.8±0.6 | 59.4±1.2 | ||
| Yes | 28.4±0.4 | 21.7±0.4 | 32.6±1.7 | 32.2±0.6 | 40.6±1.2 | ||
| Serum creatinine, mg/dL | <0.001 | <0.001 | |||||
| Mean | 0.823±0.002 | 0.686±0.001 | 0.811±0.012 | 0.930±0.002 | 0.997±0.005 | ||
| SD | 0.232±0.013 | 0.138±0.012 | 0.379±0.076 | 0.206±0.029 | 0.250±0.029 | ||
| Atopic dermatitis | 0.028 | 0.136 | |||||
| No | 95.9±0.2 | 96.0±0.2 | 94.0±1.0 | 96.2±0.2 | 95.4±0.5 | ||
| Yes | 4.1±0.2 | 4.0±0.2 | 6.0±1.0 | 3.8±0.2 | 4.6±0.5 | ||
Table 2.
Factors associated with serum uric acid level in adult females and males
Table 3.
Factors associated with hyperuricemia in adult females and males




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download