Abstract
Traditionally, arthroscopic microfracture and autologous osteochondral autograft transplantation have been the primary surgical treatments for osteochondral lesions of the talus. On the other hand, recent advancements have introduced alternative approaches, such as autologous chondrocyte transplantation, matrix-derived autologous chondrocyte transplantation, intra-articular injection of concentrated bone marrow aspirate concentrate, and the use of fibrin glue to address chondral defects. Furthermore, some studies have explored a combination of bone marrow aspirate and matrix-derived chondrogenesis. In light of these developments, this report presents a case study of a young male patient in his early twenties with a relatively large osteochondral lesion exceeding 1.5 cm2 on the medial talar dome. Instead of removing the osteochondral lesion, a surgical approach was employed to retain the lesion while addressing the unstable cartilage in the affected area. This approach involved a combination of bone marrow aspirate concentrate and matrix-derived chondrogenesis. The treatment yielded favorable clinical outcomes and ultimately successfully induced the bony union of osteochondral lesions. This paper reports the author’s experience with this innovative approach with a review of the relevant literature.
거골의 골연골병변에 대한 수술적 치료에는 일반적으로 관절경 하 미세골절술(arthroscopic microfracture)과 자가골연골 이식술(osteochondral autograft transfer system)이 주로 사용되고 있으며, 이 중 술기가 비교적 간단한 반면에 높은 치료성공률이 보고되고 있는 관절경 하 미세골절술이 보다 널리 시행되고 있다. 관절경 하 미세골절술은 주로 크기가 작은 골연골병변에 적응되는데(1.5 cm2),1) 이를 보완할 수 있는 자가골연골 이식술의 경우 슬관절 공여부의 이환이 발생하고 병변을 노출시키기 위하여 발목 내과 혹은 외과의 절골술이 필요한 경우가 많다는 단점을 가진다. 이외에 자가연골을 채취하여 배양한 후 골연골병변 부위에 이식하고 골막을 이용하여 덮어주는 자가 연골세포 이식술(autologous chondrocyte implantation)이 소개되어 있으며, 새롭게 시도되고 있는 방법들로는 자가 연골세포 이식없이 미세골절술 후 인공 기질(이종콜라겐지지체)만을 사용하는 기질 유래 자가연골세포 이식술(autologous matrix-induced chondrogenesis, AMIC)이 있다. 이 경우 삽입된 기질은 미세골절술 부위에서 생성되는 거골의 골수세포를 흡수하여 그 효과를 집중시키고 골수세포가 연골을 재생시키는 지지체의 역할을 한다.2) 또한 미세골절술 이후 생물학적 보조제인 골수 흡인물 농축액(bone marrow aspirate concentrate, BMAC)을 관절강 내 주사하거나 섬유질 아교(fibrin glue)를 이용하여 연골결손부를 메워주는 술식들이 소개된 바 있으며, BMAC와 AMIC를 혼합한 치료방법(BMAC and matrix-induced chondrogenesis, BMIC)도 시도되고 있다.3)
이에 저자들은 20대 초반의 젊은 남성환자에서 내측 거골원개에 발생한 1.5 cm2 이상의 비교적 크기가 큰 골연골병변에 대하여, 골연골병변을 제거하지 않고 유지시킨 채로 변연부의 불안정한 연골만을 제거하고 이 부분에 BMIC를 실시하였다. 이를 통하여 좋은 임상결과 및 궁극적으로 골연골병변의 골유합을 성공적으로 유도할 수 있었기에 관련된 연구문헌 고찰과 함께 이를 보고하고자 한다. 본 증례 보고는 저자들의 소속기관 윤리위원회의 심의를 통과하였다(IRB no. 2023-024).
과거력상 특이사항이 없던 22세 남자환자로, 내원 8개월 전 군대에서 산악훈련을 받던 도중 좌측 발목이 안쪽으로 꺾이며 수상하였다. 이전에 동측 발목에 유사한 형태의 내번 손상은 받은 적이 없었으며, 수상 이후 3주간의 단하지 석고 고정 및 목발 사용을 통한 보존적 치료를 받았음에도 불구하고 짧은 거리를 보행하더라도 유발되는 우측 발목 내측의 통증이 지속되었다. 수상 후 3주째 정확한 통증의 원인을 파악하기 위하여 좌측 족관절 자기공명영상 검사를 시행받았으며, T1 및 T2 강조 영상 모두에서 내측 거골원개 부위에 10×18 mm2의 골연골병변이 발생되어 있는 것이 확인되었다(Fig. 1). 병변은 거골 본체와 분리된 것으로 생각되었으나 경계부의 모양이 비교적 완만하고 주변부 골수부종이나 거골체부 내의 출혈을 의심할 만한 소견이 동반되지 않았기에 급성병변은 아닌 것으로 판단하였으며, 이후 3개월간 간헐적인 석고 고정과 진통제 투여를 지속하였으나 통증은 크게 경감되지 않았다.
수상일로부터 본원에 내원할 때까지 동측에 재수상을 당한 적은 없었으며, 본원 내원 시에 촬영한 체중 부하 발목관절 전후면 및 측면 방사선(Fig. 2A) 사진에서도 최초의 자기공명영상 검사에서 확인할 수 있었던 거골 내측의 골연골병변을 확인할 수 있었다. 최초영상과의 비교를 위하여 자기공명영상 검사를 다시 시행하였고, 골연골병변과 거골 본체와의 관계를 명확히 하기 위하여 컴퓨터 단층촬영 역시 추가적으로 실시하였다. 추시한 자기공명영상검사상(Fig. 2B) 골연골병변 내부에 약간의 신호강도 변화가 관찰되기는 하였으나 7개월 전 영상과 큰 차이를 보이지는 않았으며, 컴퓨터 단층촬영의 관상면과 축상면, 시상면에서 해당 골연골병변이 거골 본체와 완전히 분리되어 있고 분리된 면의 경화성 변화가 이미 발생하였음을 확인하였다(Fig. 2C). 더 이상의 보존적 치료는 의미가 없을 것으로 판단하여 수술적 치료를 결정하였으며, 처음에는 관절경 하 골연골병변 제거 및 미세골절술을 계획하였으나 골편의 크기가 비교적 크고 환자의 나이가 아직 어린 점을 고려하여 환자 및 보호자와의 긴 상의 끝에 BMIC를 하기로 결정하였다.
수술은 전신마취하에 앙와위로 진행되었으며, 본격적인 수술 이전에 관절경 검사를 시행하여 관절경을 통한 BMIC의 가능여부를 타진하였으나 골연골병변의 후방경계부위까지 관절경만으로 접근하기에는 제한이 발생함을 확인하여 내과의 전방 절반부위에 대한 부분절골술을 통하여 골연골병변을 노출시키기로 결정하였다. 우선 동측 골반의 전상장골극에서 50 mL의 골수를 흡인하고(Fig. 3A) 이를 원심분리하여(Fig. 3B) 6 mL의 골수흡인물 농축액을 확보하였다(Fig. 3C). 이후 내과 전방의 부분절골술을 통하여(Fig. 3D) 거골의 골연골병변 부위를 관찰하고 골연골편을 제거하지 않고 유지시킨 채로 변연부 연골 중 안정성이 매우 소실된 부위만 깨끗이 제거하였다(Fig. 3E). 연골이 제거된 결손부위의 모양과 유사하도록 템플릿(template)을 이용하여 재단하고(Fig. 3F), 콘드로가이드(Chondro-Gide; Geistlich Pharma AG, Wolhusen, Switzerland)를 템플릿의 모양과 동일하게 오려낸 뒤(Fig. 3G) 흡인된 골수흡인물 농축액을 이에 충분히 도포하였다(Fig. 3H). 골수흡인물 농축액이 도포된 콘드로가이드를 변연부 연골 제거부위에 안착시킨 후에(Fig. 3I) 섬유질 아교(fibrin glue)를 이용하여 고정시키고(Fig. 3J) 부분절골하였던 내과의 전방을 관절면이 어긋나지 않도록 주의하면서 4.0 mm 유관나사 한 개를 이용하여 고정시켰다.
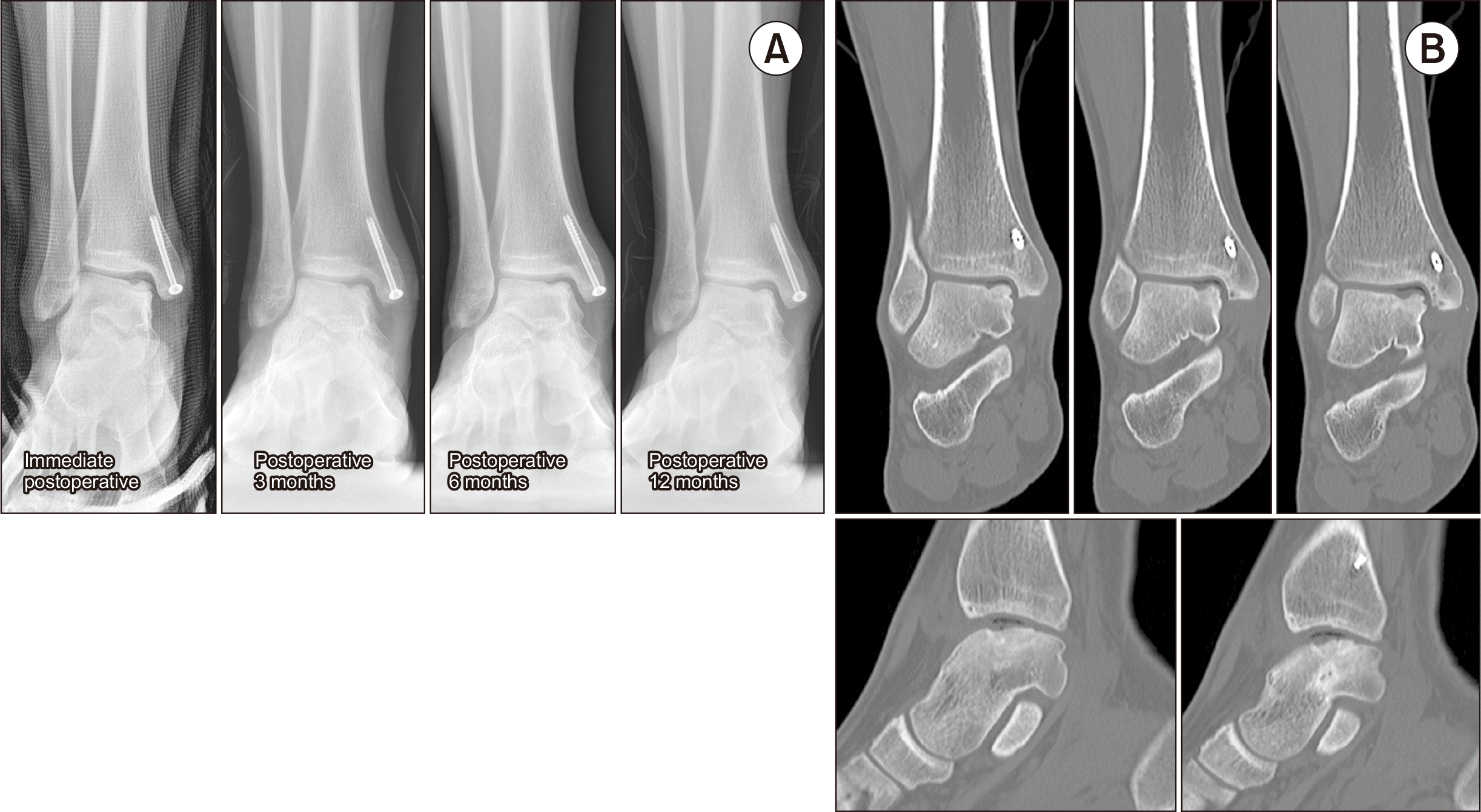
수술 이후 6주간 단하지 석고 고정을 유지한 채 비체중 부하를 실시하였으며 석고 제거 이후부터 부분 체중 부하를 즉시 허용하여 점진적으로 완전체중 부하까지 이행하였다. 술 후 3개월째부터는 스포츠 활동을 허용하였으며, 이 시기부터 술 전 호소하였던 보행 시 통증은 서서히 호전되었고 수술 후 6개월 이후부터는 거의 불편감 및 통증을 호소하지 않았다. 방사선학적으로 술 후 3개월째부터 분리되어 있던 거골의 골연골병변이 거골 본체에 서서히 유합되는 소견이 관찰되었으며, 술 후 12개월째에는 내과 부분절골술 부위와 더불어 거골의 골연골병변도 완전히 유합된 것이 확인되었다(Fig. 4A). 금속제거술을 위해 재입원하였을 당시 시행한 추시 컴퓨터 단층촬영상에서도 거골의 골연골병변이 거골 본체에 완전히 유합된 모습을 관찰할 수 있었다(Fig. 4B). 수술 후 14개월째 거의 모든 스포츠 활동에서 제한을 보이고 있지 않으며, 일상생활 가운데 통증을 전혀 호소하지 않는 상태로 지내고 있다.
본 증례를 통하여 저자들은 젊은 환자에서 발생한 골연골병변에 대하여 기존에 소개된 다양한 수술방법들에서 골연골편을 제거하고 추가적인 술식을 진행했던 것과는 다르게, 골연골편을 유지시킨 채로 변연부의 매우 불안정한 연골만을 제거하고 연골을 제거하는 과정에서 발생한 결손부에만 BMIC를 시행하여 분리된 골연골병변 전체의 골유합을 도모할 수 있었다. 과거의 연구들에서는 비교적 크기가 큰 거골의 골연골병변을 유합시키기 위하여 골연골편의 골편 쪽과 거골 쪽 접촉면의 섬유조직을 완전히 제거하고 원표면(raw surface)을 노출시킨 후에 골편을 정복하고 금속나사나 흡수성 나사 등으로 고정하는 방법이 사용되었다면 본 증례를 통하여 골연골병변 근처에 BMIC를 거치시키는 것만으로도 골유합의 효과를 기대해볼 수 있다는 가능성을 확인한 것이 가장 큰 의의라고 할 수 있을 것이다. 또한 거골에 발생한 골연골병변의 표준적인 치료방법으로 널리 사용되고 있는 관절경 하 미세골절술이나 다발성 천공술과 비교하였을 때에도 이 수술방법들이 비교적 간단하고 93%의 10년 생존율을 보이는 등 좋은 예후를 보이고 있다.4) 그러나 기대 수명 및 활동량이 많은 소아 청소년 환자에서 30년 이상의 초장기 추시에 대한 연구는 아직까지도 필요한 상황이다. 더불어 기존의 초자연골이 아닌 섬유연골로 결손부위가 대체되는 미세골절술 및 다발성 천공술의 특성을 고려할 때, 골편을 가능한 보존하는 방향으로 수술하는 저자들의 BMIC 방식은 새로운 치료의 방향으로 고려되어 볼 만하지 않을까 기대한다. 또한 연골병변의 위치가 거골의 어깨부위에 있는 uncontained형의 병변일 경우, 기존의 골편을 제거하지 않는 저자들의 방식이 골연골병변을 제거하는 기존의 방식들에 비해 거골어깨 부분의 곡면을 회복하는 데에 더욱 유리하지 않을까 생각된다.
골수흡인물 농축액의 회복효과에 대해서 살펴보면, 골수에서 추출한 중간엽 줄기세포는 다양한 조직으로 분화가 가능한 세포로 손상된 조직에서 케모카인(Chemokines) 등의 인자들에 의해 활성화된다. 활성화된 골수흡인물 농축액은 세포 사멸 및 섬유화와 염증을 감소시키고 세포 증식, 이동, 분화와 신생혈관 형성을 촉진시킴으로써 궁극적으로 조직 손상 부위의 회복 및 치료효과를 나타내는 것으로 알려져 있다.5) Murphy 등6)은 거골의 골연골병변에 대하여 미세골절술만 시행한 군보다 미세골절술 후 BMAC를 병변에 도포해준 경우가 재수술 시행률이 현저하게 낮았다고 보고한 바 있으며, 여러 수많은 선행 연구들에 의해서 효과가 입증되며 최근에는 국내에서도 더욱 활발히 시도되고 있다. 본 증례 환자의 경우 거골의 골연골병변 주위의 불안정한 연골 조직들을 제거하고 전상 장골극에서 추출한 BMAC와 콘드로가이드를 수상부위에 안착시킴으로써 중간엽 줄기세포의 활성을 유도하고, 이식물이 생착되며 골연골병변의 유합을 유도한 것이 아닐까 추정된다. 거골의 골연골병변에 대한 새로운 치료 방법 중 골수흡인물 농축액을 사용하도록 고안된 BMAC와 BMIC는 선행 연구들에서 미세골절술에 비해 치료 효과가 길게 유지된다는 장점이 주장된 바 있다.7,8) 그러나 골연골병변의 크기가 크거나 연골하골의 결손이 많은 경우 골연골편 제거 이후에 발생하는 결손부가 크기 때문에 골수를 흡인한 부위를 통하여 추가적으로 해면골을 채취하여 이를 이용한 골이식이 필요한 경우도 있다고 기술된 바 있다.3) 기존 연구들의 BMIC 방법은 크기가 큰 골연골병변이더라도 일단 골편을 제거하고 제거된 부위에 BMIC를 적용하는 방식이 사용되어왔다.9) 그러나 본 증례와 같이 기존의 골연골병변을 제거하지 않고 변연부의 연골 중 불안정한 부위만 제거하고 그곳에 BMIC를 안착시키는 것 만으로 골연골병변의 유합을 얻을 수 있다면 추후에도 골편을 유지한 채로 BMIC를 이식하는 방법을 표준치료방법으로 기대해볼 수도 있을 것이다.
한편 본 증례 환자의 치료과정을 이끌어가면서 가장 불확실하였던 부분은 환자의 병변이 발생시점을 불분명하게 모르는 채로 방치되어 온 거골의 골연골병변이 아니라 첫 수상 시점에 발생한 급성 골연골 골절이 간과되면서 지연유합된 형태로 남아있다가, 시간이 지남에 따라 저절로 유합된 것이 아닌가 하는 것이었다. 이 경우 증례에서 관찰되었던 골연골병변의 유합은 BMIC의 효과로 인한 것이 아니라고 생각할 수도 있다. 이를 정확히 감별하기 위하여 수술방법 결정 전에 수상 후 3주차에 외부에서 시행한 족관절 자기공명영상 검사에 주목하였으며, 이 검사에서 골연골병변 주변부의 골수부종이나 거골체부 내의 출혈 등 급성 골절 이후 3주차 정도에 확인할 수 있을 만한 소견들이 전혀 동반되지 않았다.10) 그러므로 지연유합중인 골연골 골절이라기보다는 발생시점을 알 수 없이 방치된 상태로 우연히 발견된 골연골병변의 가능성이 더 높다고 판단하였고, 젊은 남자환자임을 고려하여 조금 더 생물학적 치료방법인 BMIC를 결정하게 되었다.
요약하면 본 증례를 통하여 저자들은 거골 내측에 발생하였고 크기가 비교적 컸던 골연골병변에 대하여 내과의 부분절골술 이후 골연골병변 주변부의 매우 불안정한 연골만을 일부 제거하고 연골제거로 발생한 결손부위에 BMIC를 안착시킨 뒤에 골연골병변이 유합되는 현상을 관찰하였고, 유사한 사례에 대한 발표가 없었기에 이를 보고하는 바이다. 향후 현재와 동일한 BMIC 수술방법을 사용하더라도 최대한 관절연골을 보존시키는 치료방법으로의 전환을 고려해볼 수 있게 되기를 기대한다.
References
1. Choi WJ, Park KK, Kim BS, Lee JW. 2009; Osteochondral lesion of the talus: is there a critical defect size for poor outcome? Am J Sports Med. 37:1974–80. doi: 10.1177/0363546509335765. DOI: 10.1177/0363546509335765. PMID: 19654429.
2. Benthien JP, Behrens P. 2010; Autologous matrix-induced chondrogenesis (AMIC): combining microfracturing and a collagen I/III matrix for articular cartilage resurfacing. Cartilage. 1:65–8. doi: 10.1177/1947603509360044. DOI: 10.1177/1947603509360044. PMID: 26069536. PMCID: PMC4440611.
3. Kim BS, Na Y, Kwon WH. 2020; Operative treatment for osteochondral lesions of the talus: bone marrow aspirate concentrate and matrix-induced chondrogenesis. J Korean Foot Ankle Soc. 24:61–8. doi: 10.14193/jkfas.2020.24.2.61. DOI: 10.14193/jkfas.2020.24.2.61.

4. Corr D, Raikin J, O'Neil J, Raikin S. 2021; Long-term outcomes of microfracture for treatment of osteochondral lesions of the talus. Foot Ankle Int. 42:833–40. doi: 10.1177/1071100721995427. DOI: 10.1177/1071100721995427. PMID: 33719632. PMCID: PMC8772008.

5. Madry H, Gao L, Eichler H, Orth P, Cucchiarini M. 2017; Bone marrow aspirate concentrate-enhanced marrow stimulation of chondral defects. Stem Cells Int. 2017:1609685. doi: 10.1155/2017/1609685. DOI: 10.1155/2017/1609685. PMID: 28607559. PMCID: PMC5451778.

6. Murphy EP, McGoldrick NP, Curtin M, Kearns SR. 2019; A prospective evaluation of bone marrow aspirate concentrate and microfracture in the treatment of osteochondral lesions of the talus. Foot Ankle Surg. 25:441–8. doi: 10.1016/j.fas.2018.02.011. DOI: 10.1016/j.fas.2018.02.011. PMID: 30321966.

7. Volz M, Schaumburger J, Frick H, Grifka J, Anders S. 2017; A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop. 41:797–804. doi: 10.1007/s00264-016-3391-0. DOI: 10.1007/s00264-016-3391-0. PMID: 28108777.

8. Vannini F, Cavallo M, Ramponi L, Castagnini F, Massimi S, Giannini S, et al. 2017; Return to sports after bone marrow-derived cell transplantation for osteochondral lesions of the talus. Cartilage. 8:80–7. doi: 10.1177/1947603516642574. DOI: 10.1177/1947603516642574. PMID: 27994723. PMCID: PMC5154421.

9. Richter M, Zech S. 2019; Matrix-associated stem cell transplantation (MAST) in chondral lesions at the ankle as part of a complex surgical approach- 5-year-follow-up in 100 patients. Foot Ankle Surg. 25:264–71. doi: 10.1016/j.fas.2017.11.004. DOI: 10.1016/j.fas.2017.11.004. PMID: 29409182.

10. Sadineni RT, Pasumarthy A, Bellapa NC, Velicheti S. 2015; Imaging patterns in MRI in recent bone injuries following negative or inconclusive plain radiographs. J Clin Diagn Res. 9:TC10–3. doi: 10.7860/JCDR/2015/15451.6685. DOI: 10.7860/JCDR/2015/15451.6685. PMID: 26557590. PMCID: PMC4625309.

Figure 1
In order to identify the precise cause of pain three weeks after the injury, a left ankle magnetic resonance imaging examination was performed. Both T1 and T2-weighted images revealed the presence of an osteochondral lesion measuring 10×18 mm2 on the medial talar dome.
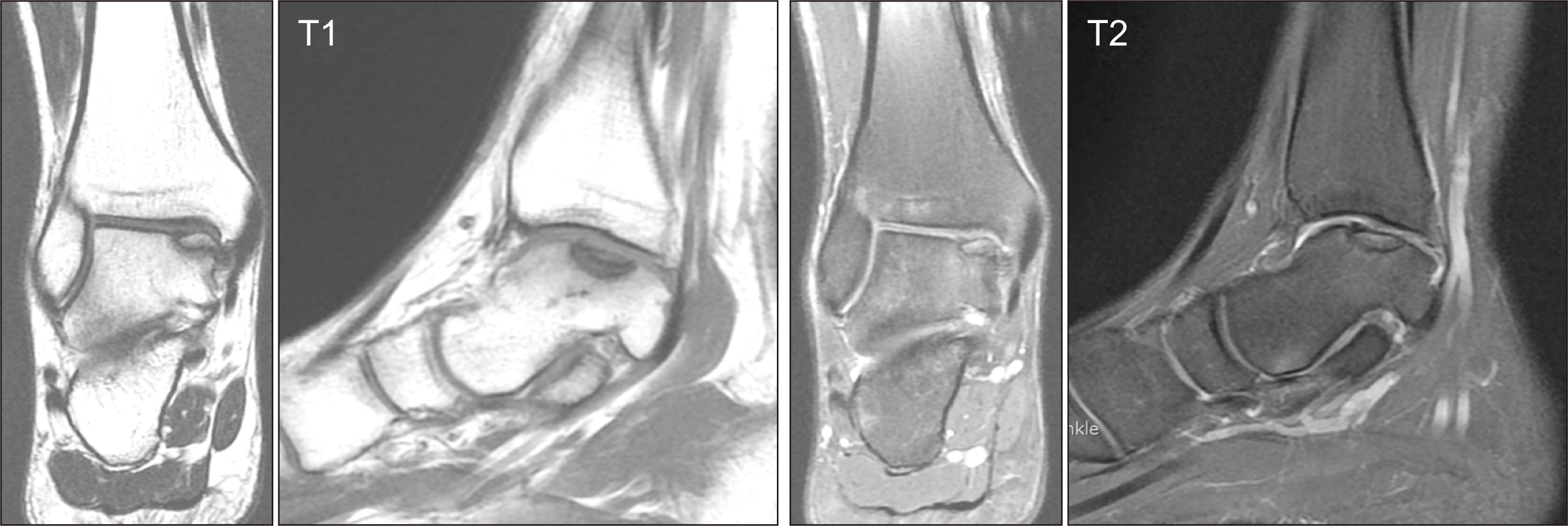
Figure 2
On the weight-bearing anteroposterior and lateral radiographs (A), the osteochondral lesion on the medial talar dome was confirmed. Follow-up magnetic resonance imaging showed slight signal intensity changes observed within the osteochondral lesion, but no significant difference compared to images obtained seven months earlier (B). Computed tomography scans in the coronal, sagittal, and axial planes also revealed that the osteochondral lesion was completely separated from the talar body, and there were signs of sclerosis in the separated interface (C).
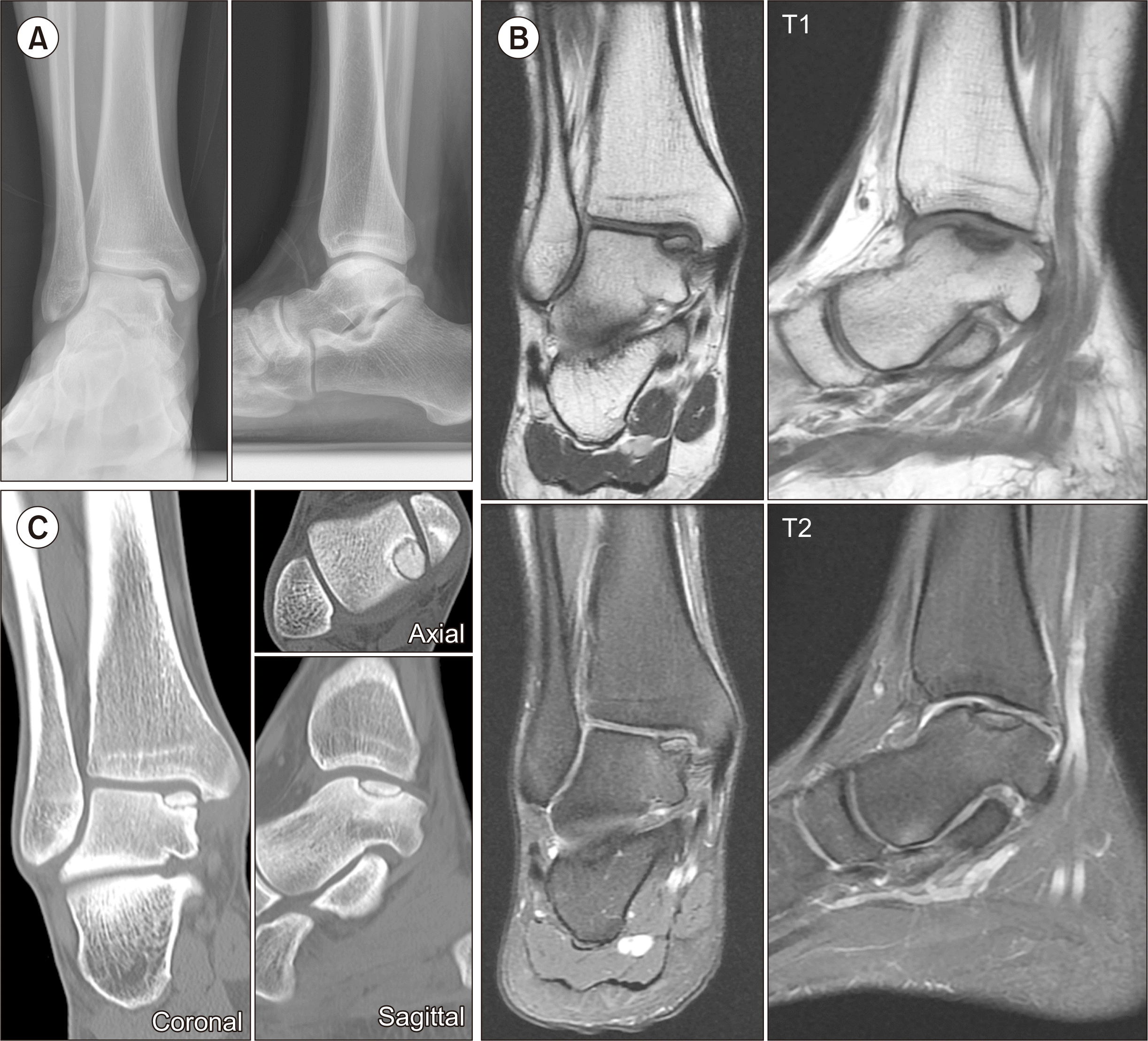
Figure 3
Initially, 50 mL of bone marrow was aspirated from the right anterosuperior iliac spine (A) and subsequently centrifuged to obtain 6 mL of concentrated bone marrow aspirate (B, C). Subsequently, partial medial malleolar osteotomy was performed (D) to access the osteochondral lesion on the medial talar dome. Without removing the osteochondral lesion, the severely unstable peripheral cartilage was meticulously debrided (E). Using a template to match the contour of the excised defect (F), a Chondro-Gide membrane (Geistlich Pharma AG, Wolhusen, Switzerland) was precisely cut to match the template shape (G). After that, the concentrated bone marrow aspirate was evenly applied to the Chondro-Gide membrane (H). The Chondro-Gide membrane, coated with bone marrow aspirate, was then securely affixed to the debrided subchondral area (I) and anchored using fibrin glue (J).

Figure 4
At the 12-month postoperative follow-up, radiographic images revealed complete union of the osteochondral lesion on the medial talar dome, in addition to the partial medial malleolar osteotomy site (A). Subsequent computed tomography scans also demonstrated the complete bony union of osteochondral lesion (B).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download