Abstract
As the number of anterior cruciate ligament (ACL) reconstructions has increased significantly, surgical techniques have also made a lot of progress, and clinical outcomes are improving accordingly. However, the authors still have different opinions on ACL anatomy, femoral tunnel position, how to make a femoral tunnel, and graft selection, and many parts are controversial. Major factors contributing to the failure of ACL reconstruction, such as technical errors and biological healing failures. To reduce technical errors, a comprehensive understanding of ACL anatomy and the ability to create a well-positioned femoral tunnel are crucial. This involves recognizing the advantages and disadvan-tages of three surgical techniques: modified transtibial, transanteromedial portal, and outside-in. To improve biological healing, the four principles of tissue engineering (cells, growth factors, scaffolds, and mechanical stimuli) have been increasingly explored in various methods of bioaugmentation. Residual rotational instability of the knee joint remains a significant concern. Since the rediscovery of the anterolateral ligament (ALL) in the knee joint, the role of anterolateral complex, including the ALL and the deep iliotibial band, as secondary stabilizers of anterolateral rotatory instability, has gained attention. In the quest to reinforce the anterolateral complex, there are two approaches: ALL reconstruction as anatomical reconstruction concept and lateral extraarticular tenodesis as a nonanatomical reinforcement concept.
전방십자인대 파열은 우리나라에서 발생하는 스포츠 손상 중 비교적 흔한 손상으로, 해마다 수술 건수가 증가하고 있다. 국내 보고에 의하면, 2008년부터 2016년 사이에 전방십자인대 재건술 건수는 10,248건에서 14,500건으로 약 34% 증가한 것으로 나타났다1. 이 부상이 운동선수 경력에 미치는 영향은 치명적일 수 있으며, 약 40%에서 60%의 선수만이 동일한 수준의 스포츠 경쟁으로 돌아갈 수 있다고 보고되었다2,3. 그러나, 수술 건수가 많이 증가한 만큼 수술 술기 또한 많은 발전을 해왔고, 이에 따라 수술 결과가 향상되고 있다4. 전방십자인대 재건술 후 3대 주요 실패 요인은 재부상, 술기의 오류, 생물학적 치유 실패 등인데 이중 술기의 오류, 생물학적 치유 실패는 우리가 노력하면 어느 정도 극복할 수 있는 요인들이다5. 술기의 오류를 줄이기 위해서는 전방십자인대 해부에 대한 정확한 이해, 수술 방법들의 장단점 파악, 이식물들의 장단점 파악 등이 필요하다. 생물학적 치유 실패를 줄이기 위해서는 관절 내 및 이식건-골터널에서 이식건의 생착을 높이기 위한 최신 기법들에 대한 이해가 필요하다. 본 종설에서는 (1) 전방십자인대의 해부학적 개념에 대한 이해, (2) 재건술 방법, (3) 이식물의 선택, (4) 생물학적 치유를 증가시키기 위한 방법, (5) 전외측 복합체의 보강술 순서로 최신의 문헌들을 정리해서 살펴보고자 한다.
전방십자인대는 슬관절 내에서 경골과 대퇴골을 연결해주는 구조물로 경골의 전방 전위와 내회전에 저항하는 역할을 하고 있으며, 경골의 과간 융기 사이 및 전방에서부터 외측 대퇴과의 대퇴과간절흔으로 20° 정도 비스듬히 주행한다. 전방십자인대의 길이는 27–38 mm, 너비는 10–12 mm, 단면적은 평균 44 mm2이며 형태는 모래시계 혹은 나비 넥타이 모양과 유사하다6. 젊은 연령에서 전방십자인대 파열 시의 최대 부하는 2,160±157 Newtons (N) 이고, 이는 나이가 변화함에 따라 감소하여 60세 이상에서는 658±129 N까지 떨어진다7.
전방십자인대는 2개의 다발로 이루어져 있다는 것이 널리 인정되어 왔는데, 경골 부착부의 상대적인 위치에 따라 전내측(anteromedial) 다발과 후외측(posterolateral) 다발로 나누어진다8 (Fig. 1). 경골 부착부의 면적은 100–160 mm2로 대퇴 부착부보다 넓으며, 외측 반월 연골판 전각에 인접한 잘 표시된 slip으로 이어진다. 경골 부착부의 모양은 타원형, 삼각형, C자 모양 순으로 흔한 것으로 알려져 있다9. 대퇴 부착부의 면적은 60–130 mm2로 대퇴과간절흔의 외측면에서 초승달 모양(crescent-shaped)을 이루고 있다. 전방부 경계는 외측 과간능선(lateral intercondylar ridge, resident’s ridge)이고, 후방부 경계는 외측 대퇴과의 후방 피질골에서 이어지는 후방 관절 연골이다. 대퇴 외측 이부능선(lateral bifurcate ridge)을 기준으로 후상방에 위치하는 전내측(anteromedial) 다발과 전하방에 위치하는 후외측(posterolateral) 다발로 나누어진다(Fig. 2). 슬관절 굴곡 시 후외측 다발은 전내측 다발보다 앞으로 이동하므로 느슨해지고, 반대로 전내측 다발은 팽팽하게 된다. 신전 시 후외측 다발은 굴곡 축의 뒤에 놓여 팽팽해진다. 전내측 다발은 굴곡 시 조금 더 팽팽해지지만, 전 굴곡 범위에 걸쳐 후외측 다발보다 큰 변화는 없다10. Amis11는 전내측 다발은 전방십자인대의 중요 기능인 경골의 전방 전위에 저항하는 역할을 하며, 후외측 다발은 슬관절이 신전할 때 긴장되어 경골의 회전 불안정성을 제어하는 역할을 한다고 보고하였다.
최근에는 대퇴골 부착부의 섬유 유형에 대한 개념이 소개되었다12,13. 이는 전방십자인대가 원통형 다발이 아닌 납작한 리본 모양(ribbon-like)을 띠고 있다는 개념이다. 대퇴골 부착부의 섬유들은 두 가지 유형으로 나눠지는데, 첫 번째는 ‘직접형(direct type)’으로 밀도가 높은 중앙 섬유들이 좁은 타원형 부위에 리본 모양으로 강하게 부착되어 힘을 점진적으로 분산시킬 수 있게 해준다(Fig. 3). 두 번째는 ‘간접형(indirect type)’으로, 콜라겐 섬유들이 전환 구간없이 외측대퇴과의 후외측부에 넓게 퍼지면서 부착하는 양상(fan-like extension)을 보인다(Fig. 3). 간접형은 직접형보다 뼈에 약한 결합을 가진다. 그러나 전방십자인대 대퇴골 부착부의 형태가 시간이 지남에 따라 변화한다고 보고한 연구도 있다14. 젊은 피실험자들(50세 미만)에서는 대퇴부착부가 크고 반원형의 모양이었던 반면에, 고령의 피실험자들(50세 이상)에서는 작고 납작한 리본 모양으로 바뀌었다. 다른 연구들에서도 젊은 층의 표본에 대한 추가 연구의 필요성을 강조하고 있다9,15. 장력을 많이 받는 직접형 섬유 부착부가 좁고 길기 때문에 기존의 원형 이식건이 아닌 리본 모양 혹은 판상형(flat) 이식건을 이용한 재건술이 필요하다는 주장이 있으나, 이에 대해서는 심도 있는 검토가 필요하다16-18.
여러 생역학 및 임상 연구에서 비해부학적 위치로의 전방십자인대 재건술은 경골의 전방 전위와 회전 불안정성을 회복시킬 수 없다는 것이 밝혀졌다9,19,20. 비해부학적 재건의 중요 개념은 굴곡과 신전 시 이식건의 길이 변화가 없는 등척점(isometric point)을 타겟으로 한 재건술이었는데, 이는 1990년대 후반까지 유행하였다. 전방십자인대 재건술 시 사용되는 이식물은 인대가 아닌 힘줄인데, 힘줄은 인대 조직보다 탄력성이 적어 반복적인 스트레스 하에서 변형되거나 파열될 가능성이 높다. 그래서 관절 운동 시 이식된 힘줄이 변형되거나 파열되지 않도록 길이 변화가 없는 등척점에 힘줄을 고정하는 방법을 고안한 것이다21. 그러나, 2000년대에 들어 자연 상태에서의 인대에는 등척점이 존재하지 않는다는 의견이 주를 이루게 되었고, 비해부학적 재건술에 흔히 이용되었던 경경골 술식의 특성상 이식건이 경골에서 수직 방향으로 대퇴골로 삽입되어 회전 불안정성이 남는 문제점 등이 있다는 것이 부각되면서 재건술 개념에 대한 전환이 있었다. 원래의 인대 부착점에 재건을 하여 인대의 기능을 복원한다는 해부학적 재건술로 흐름이 바뀐 것이다22,23.
해부학적 재건술의 핵심은 경골과 대퇴골의 해부학적 위치에 정확하게 터널을 뚫어 힘줄을 이식하는 것이며, 이전의 비해부학적 재건술보다 우수한 결과를 보여준다9,19,20. 해부학적 재건술을 시행함에 있어 생역학적으로 이중 다발 재건술이 보다 나은 안정성을 제공할 수 있다는 연구들도 있었고, 생역학적 차이를 보이지 않는다는 연구들도 있었다24-26. 임상 연구에서도 각각의 수술이 우수했다는 결과들이 혼재되어 발표되어 왔다27-29. 이중 다발 재건술이 단일 다발 재건술과 비교 시 더 우수한 임상 결과를 보장한다는 근거가 미약하고, 이중 다발 재건술 후 2개의 터널 형성에 의한 합병증 발생 등의 문제가 있기 때문에 현재는 단일 다발 재건술이 널리 사용되고 있다30,31. 단일 다발 재건술 방법으로는 크게 변형된 경경골 술식, 전내측 삽입구 술식, outside-in 술식 등 3가지가 있다.
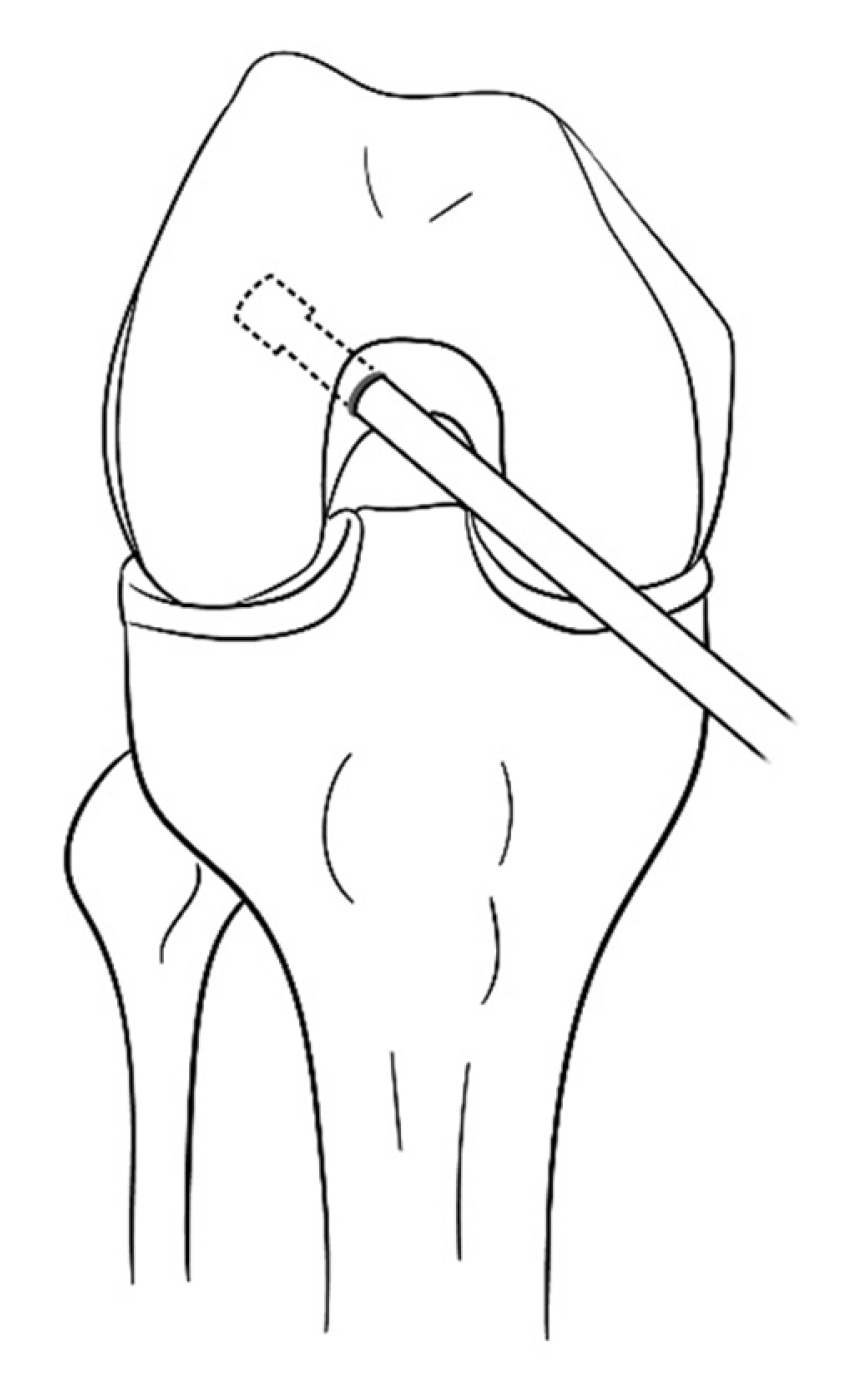
경경골 술식은 관절경 하 전방십자인대 재건술을 시행한 후 가장 널리 사용해 온 방법이다. 이 방법의 장점은 많은 수술자들에게 친숙하여 수술 시간이 적게 걸린다는 점, 충분한 길이의 대퇴 터널을 얻을 수 있다는 점, 대퇴부에서 이중 고정이 가능하다는 점, 이식건의 방향과 터널의 방향이 비교적 평행하여 이식건과 터널 사이의 충돌이 적다는 점 등이다. 그러나, 경골 터널에 의해 대퇴 터널 위치가 결정되기 때문에 다른 술식에 비해 대퇴 터널이 해부학적 위치보다 전방에 생성될 확률이 높다. 이를 극복하고자 여러 변형된 경경골 술식들이 소개되었다. Lee 등32,33은 대퇴 터널의 해부학적 부착부에 삼각형 모양의 홈을 만든 후, 이 홈에 유도핀이 휘어지게 들어가게 해서 해부하적 위치에 도달하게 하는 방법을 소개하였다. 휘어진 유도핀이 부러지지 않도록 확공기가 휘어진 부분을 통과할 때는 슬관절을 신전시키고, 통과 후에는 슬관절을 굴곡시키는 등 점진적으로 확공시키는 것이 중요하다(Fig. 4). Lee 등34은 경골을 앞쪽으로 밀면서 내반 및 외회전을 시켜서 유도핀이 해부학적 위치에 도달하게 하는 방법을 발표하였다. Youm 등35은 경골을 내반 및 내회전하여(Fig. 4 자세) 유도핀이 해부학적 위치에 도달하게 하는 방법을 발표하였다. 이들은 모두 3차원 전산화단층촬영(3-dimensional computed tomography; 3D CT) 검사를 하여 대퇴 터널이 해부학적 위치에 만들어지는 것을 입증하였다. 그러나, 외력으로 경골을 틀어서 터널을 만드는 방식들은 경골 터널의 확장이 일어날 위험성이 있다. 또한, 대퇴골 모양에 따라 가이드 핀이 도달하지 않는 경우가 발생할 수 있다는 단점이 있다. 무리하게 해부학적 위치로 대퇴 터널을 만들게 되면 유도핀이 대퇴골 후방으로 향하게 되면서 대퇴 터널이 짧아지고, blowout fracture 발생 가능성이 높아진다.
2023년 발표된 International Society of Arthroscopy, Knee Surgery and Orthopaedic Sports (ISAKOS) 회원들을 대상으로 한 설문 연구에 의하면, 전내측 삽입구 술식이 가장 많이 시행되는 술식인 것으로 나타났다23. 2,000명 이상의 응답자 중 78.5%가 전내측 삽입구 술식을 시행한다고 하였다. 이 술식은 전내측 삽입구를 이용하여 경골 터널과 독립적으로 대퇴 터널을 만들 수 있어 수술자가 원하는 위치로 대퇴 터널을 만들 수 있는 방법이다(Fig. 5)
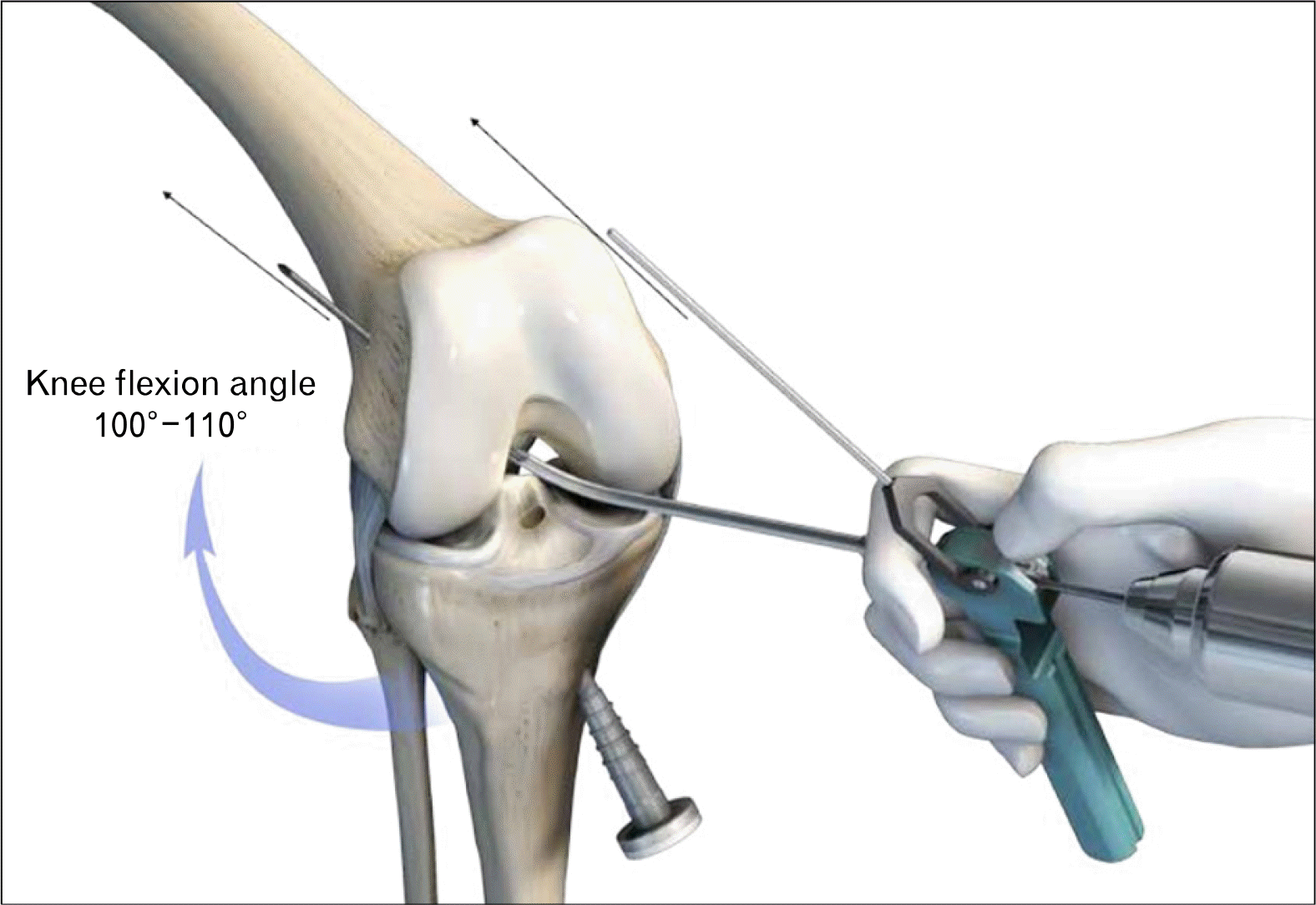
대퇴골의 해부학적 부착부로 확공기의 접근을 용이하게 하고, 충분한 터널 길이를 확보하기 위해 기존의 전내측 삽입구보다 내측 및 하방에 위치한 곳에 추가적 전내측 삽입구(accessory anteromedial portal)를 만든다. 대퇴골의 터널 시작 위치를 표시할 때에는 기존의 전내측 삽입구로 보면서 추가적 전내측 삽입구를 통해서 microfracture awl 등으로 구멍을 낸다. 슬관절을 과굴곡한 상태에서 추가적 전내측 삽입구를 통해서 유도핀을 표시한 구멍 안으로 삽입한 후 확공한다. 유도핀이 강성이기 때문에 대퇴 후벽쪽으로 향하게 되면 대퇴 터널 길이가 짧아질 뿐만 아니라 blowout fracture가 발생할 수 있기 때문에, 슬관절을 120° 정도 과굴곡한 상태로 터널을 만들어야 한다. 120° 정도 과굴곡한 상태로 수술을 하면 관절경 시야가 확보되지 않아, 확공 시 오류가 발생할 수 있다36,37.
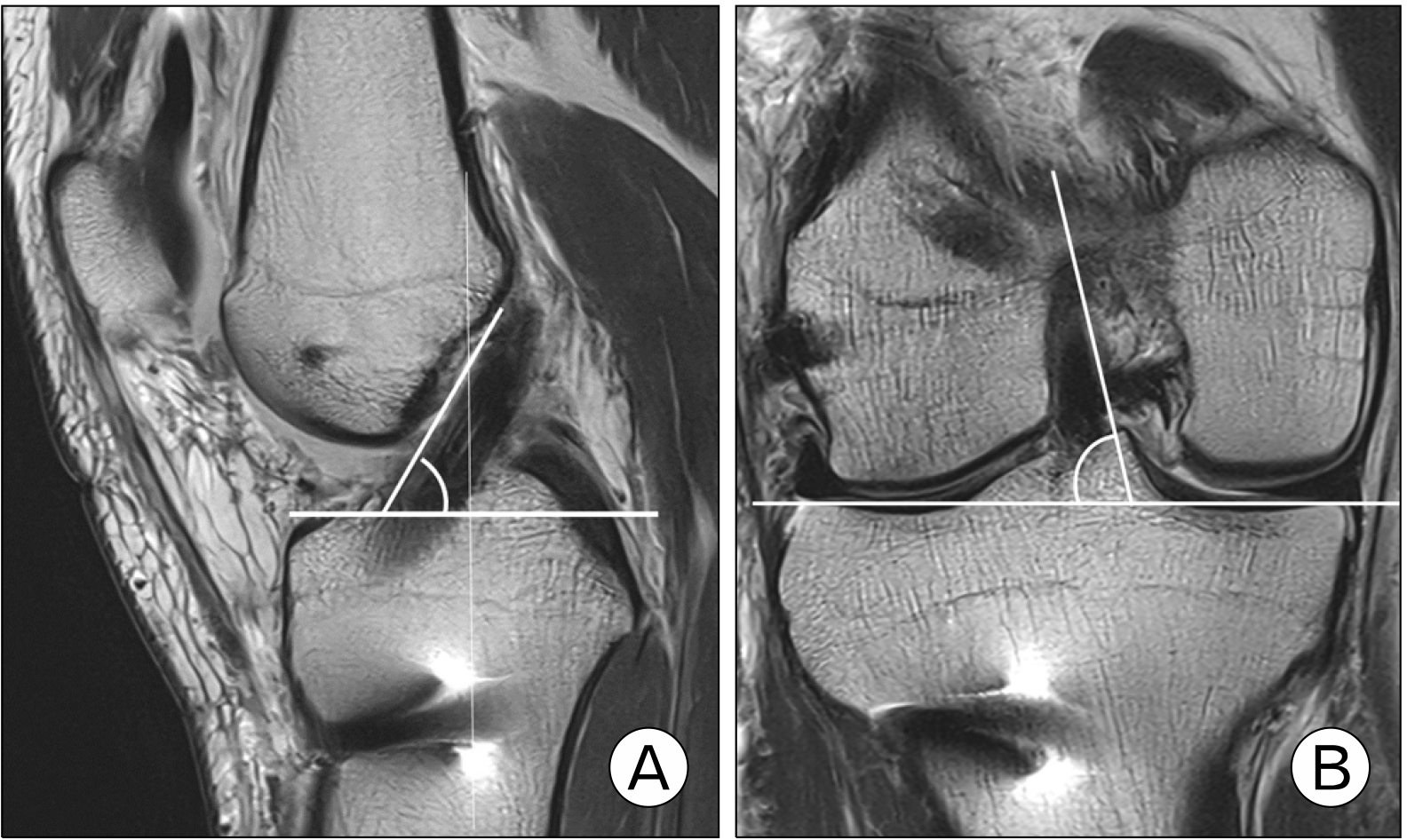
이러한 술기상의 한계점을 극복하기 위해 최근에는 유연한 유도핀 및 확공기(flexible reamer system, FRS)를 사용하고 있다(Fig. 6). 슬관절을 과굴곡하지 않아도 충분히 시야가 확보된 상태에서 대퇴 터널 가이드를 통해서 유연한 유도핀이 비교적 전방으로 향하게 할 수 있으며, 강성 유도핀보다 대퇴 터널 길이를 길게 확보할 수 있게 해준다(Fig. 7). 국내 술자들도 FRS를 사용하여 우수한 결과를 발표하였다. Lee 등38은 FRS를 60명에게 적용한 후 3D CT 및 자기공명영상 검사 결과를 분석하였을 때, 대퇴 터널은 해부학적 위치에 만들어졌고, 이식건의 경사도도 자연 상태의 전방십자인대와 비슷하였다고 보고하였다(Fig. 8). 평균 대퇴 터널 길이는 35.2±3.1 mm, 평균 이식건 꺾임 각도는 113.9°± 5.7°였고, 후방 벽 파손은 8.3%에서 발생하였다. Yoon 등39은 30명의 환자들을 대상으로 1개의 전내측 삽입구를 이용한 FRS를 적용한 결과, 3D CT에서 대퇴 터널이 해부학적 위치에 만들어진 것을 확인하였다. 평균 대퇴 터널 길이는 32.8±4.5 mm, 평균 이식건 꺾임 각도는 108.4°±6.9°였고, 후방 벽 파손은 6.6%에서 발생하였다.
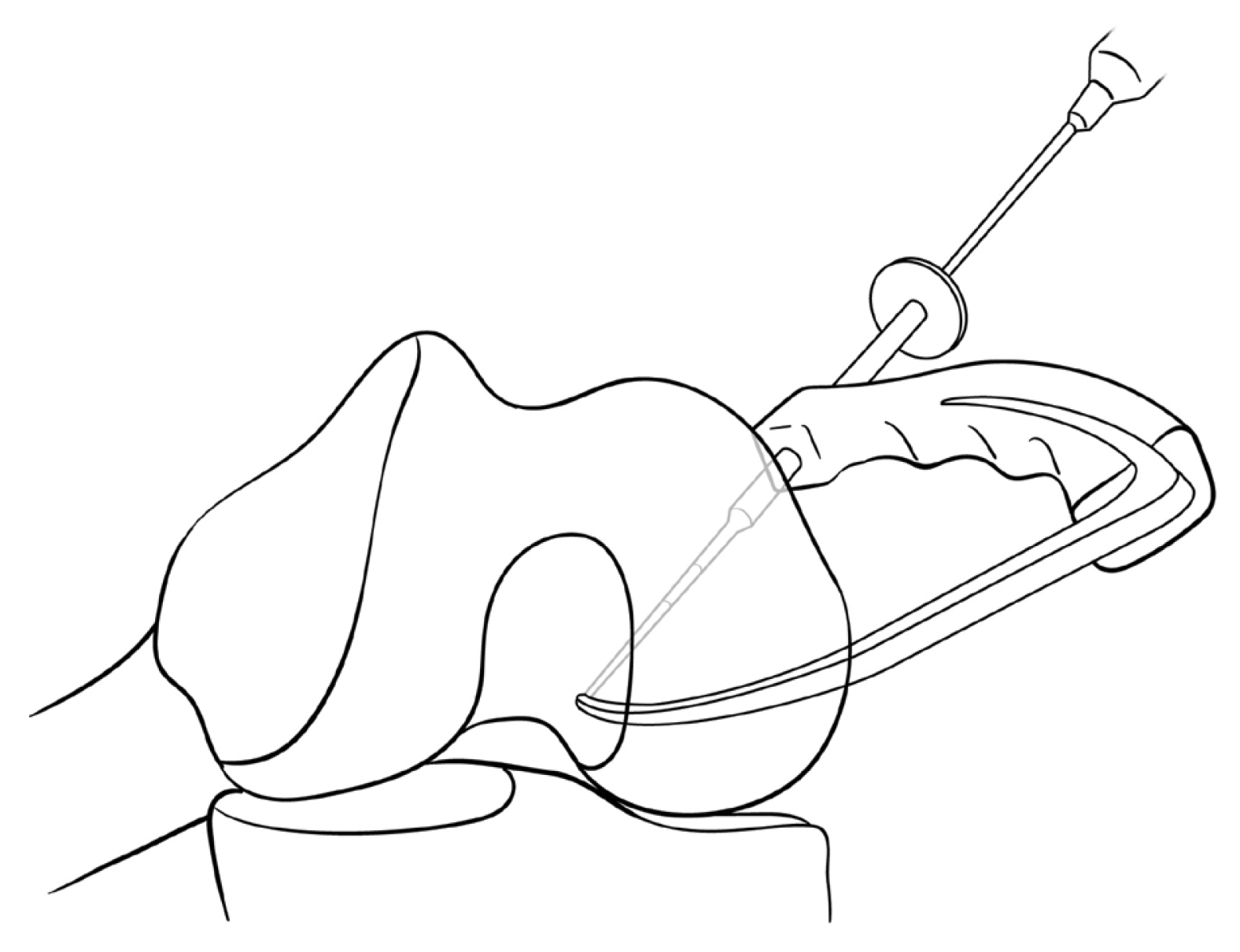
대퇴 터널을 밖에서 안으로 만들어 준다고 하여 outside-in 술식이라고 부른다. 대퇴 터널 가이드와 터널을 만드는 다양한 기구의 발달로 비교적 쉽게 대퇴 터널을 원하는 위치로 만들어 줄 수 있기에 2010년대에 각광을 받았었다. 대퇴 터널 가이드 tip을 관절 내의 해부학적 부착부에 위치시킨 후 관절 외부에 위치한 가이드의 sleeve를 따라 유도핀을 삽입해 준다. Retrograde로 확공하여 대퇴 터널을 socket 모양으로 만들어 준다(Fig. 9).
전내측 삽입구 술식과 유도핀을 삽입하는 방향은 다르지만, 마찬가지로 경골 터널과 독립적으로 대퇴 터널을 만들기 때문에 해부학적 위치로 대퇴 터널을 형성할 수 있다. 전내측 삽입구 술식과 다르게 슬관절을 과굴곡한 상태로 수술할 필요가 없으며 대퇴 터널 길이를 충분히 확보할 있다는 장점이 있다. 그러나, 관절 외부에 위치한 대퇴 터널 가이드의 방향이 관절면에 비교적 수평으로 향하는 경우가 많은데, 이러한 방향으로 대퇴 터널이 만들어지면 이식건의 마모를 일으킬 가능성이 높다33,40-42. 또한 대퇴 터널 가이드를 통해 유도핀을 삽입할 때 원하는 위치로 나오지 않는 경우가 있어 수술 시간이 길어지는 경우도 있다.
이 3가지 수술 방법은 각각의 장단점을 갖고 있기 때문에 술자가 환자의 상태에 맞게 적절하게 선택하는 것이 중요하다(Table 1).
전내측 삽입구 술식 혹은 outside-in 술식같이 경골 터널을 통하지 않고 독립적으로 대퇴 터널을 만들어 줄 수 있는 drilling 방식이 해부학적 전방십자인대 재건술을 확실히 보장해 주는 것은 아니기에 높은 평가자 간 신뢰도를 보이는 해부학적 전방십자인대 재건술 체크리스트가 유용하게 사용될 수 있다43. 이 체크리스트는 총 17개 항목으로 구성되어 있고, 19점 만점으로 한다(Table 2). 최소 8점 이상 획득 시, 해부학적 전방십자인대 재건술 시행한 것으로 판단할 수 있다. 본 저자의 경우, 해부학적 전방십자인대 재건술을 위해서는 수술 후 영상 검사를 통한 피드백(feedback)이 중요하다고 판단하여 3D CT를 통하여 대퇴 터널의 위치를 분석하고 있다(Fig. 10)44-47.
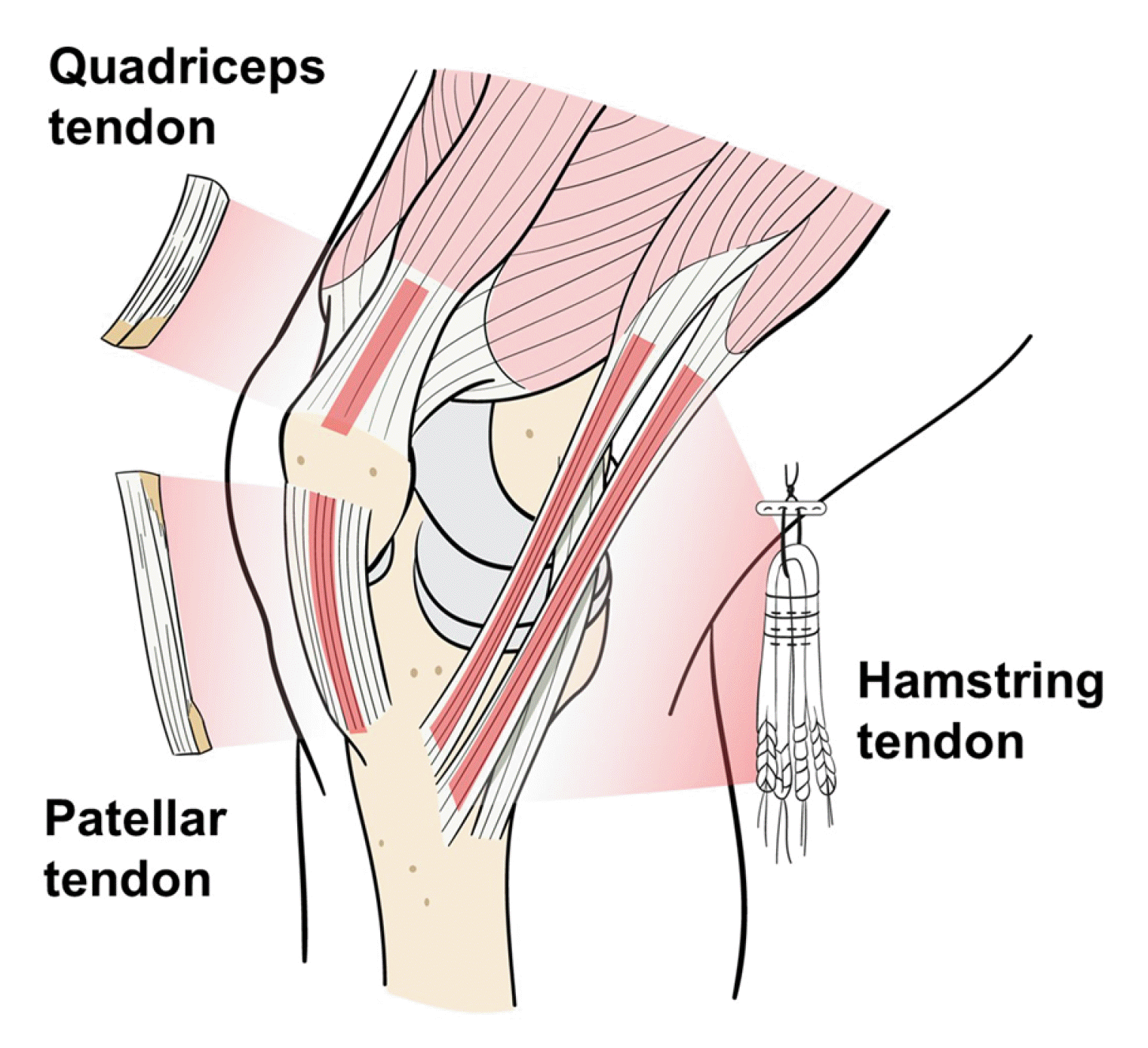
현재 사용되는 이식물은 자가이식물(autograft)과 동종이식물(allograft)로 나눌 수 있다. 자가 이식물에는 슬건(hamstring tendon), 슬개건(bone-patella tendon-bone), 대퇴사두건(quadriceps tendon) 등이 있다(Fig. 11). 동종 이식물에는 아킬레스건(achilles tendon), 전∙후 경골건(anterior and posterior tibialis tendon), 장비골건(peroneus longus tendon), 반건양건(semitendinosus tendon) 등이 있다. 2023년 ISAKOS 회원(아시아, 유럽, 남미, 북미, 아프리카)을 대상으로 한 설문 연구에 의하면 최초 전방십자인대 재건술 시 사용한 힘줄 분포는 자가 슬건 80.3%, 자가 슬개건 16.1%, 자가 대퇴사두건 2.4%, 동종건 1%, 자가건+동종건(혼합건) 0.2% 순이었다. 북미에서는 자가 슬개건 45.5%, 자가 슬건 40.9%로 유일하게 자가 슬개건 사용 빈도가 자가 슬건보다 높았다23.
(1) 자가 슬건
자가 슬건은 반건양건 단일 혹은 반건양건과 박건(gracilis)을 혼합(반건양건+박건)으로 사용한다. 네 겹의 슬건은 최대 인장강도(4,140 N)가 정상 전방십자인대 최대 인장강도(2,160 N)의 두 배 이상으로 다른 자가건들보다 크다48 (Fig. 12). 그러나, 슬개건 혹은 대퇴사두건처럼 골편이 붙어있지 않으므로 이식골과 골터널 사이의 유합이 아니고, 이식건과 골터널 사이의 유합이 이루어져야 한다. 즉, 초기 고정 강도가 자가 슬개건 혹은 대퇴사두건보다 약할 수 있다49. 최근에는 이식건의 성숙도와 이식물-골터널 사이의 움직임에 있어서 슬건과 골편이 붙은 이식건(슬개건 혹은 대퇴사두건)의 차이가 없다고 보고한 연구들도 있다50,51. 여러 동물 실험에서 이식물-골터널 사이의 접촉 면적과 이식물에 가해지는 역동적 변화가 초기 이식물-골 치유에 영향을 준다고 밝힌 바, 자가 슬건 사용 시에는 수술 후 관절 범위 운동을 점진적으로 시행하는 것이 도움이 될 수 있다52,53.
2017년 보고된 후향적 무작위 연구들을 대상으로 한 체계적 문헌 고찰-메타 분석 연구에 의하면, 자가 슬건은 자가 슬개건에 비해 슬개-대퇴 관절 통증 및 슬관절 신전력 저하의 위험을 줄일 수 있다고 하였다54. 슬건의 장점은 낮은 공여부의 이환(슬관절 신전력 저하에 대한 영향이 적음 등), 높은 재생력, 생역학적 우수성 등이다. 단점은 채취 시 슬건의 길이와 직경이 다양하여 8 mm 이상 직경의 이식건을 확보하지 못하는 경우가 있다는 점, 반건양건+박건 2가닥을 채취하였을 때 과굴곡력이 약해질 수 있다는 점 등이다55. Lee 등55은 반건양건 단독 그룹이 반건양건+박건 그룹보다 통계적으로 유의하게 적은 70° 이상의 과굴곡력 저하를 보였고, 반건양건 단독 그룹에서 6개월째 채취 부위에서 힘줄 재생을 보인 비율이 80% 정도라고 보고하였다. 과굴곡력 저하를 피하기 위해 반건양건 단독 사용 시, 직경이 8 mm 미만일 경우 동종 이식물을 혼합하게 되는데, 자가 이식물 단독보다 자가건의 비중이 줄어들게 되므로 이에 대한 장기 추적 결과가 필요하다. 최근 발표된 체계적 문헌 고찰에서는 자가 이식물 단독 사용과 자가 이식물과 동종 이식술 혼합 사용을 비교하였을 때, 두 그룹 간 슬관절 안정성, 주관적 기능 검사, 재파열률 등에는 유의한 차이가 없다고 하였다56.
(2) 자가 슬개건(patellar tendon)
최근 사용 빈도가 감소하긴 했지만, 1990년대 가장 많이 사용했던 자가 이식물이다. 양단에 골편이 부착되어 있기 때문에 대퇴골과 경골에서 빠른 이식물-골터널 사이의 유합을 얻을 수 있다는 장점이 있다. 그러나, 슬개골과 경골 두 곳의 뼈를 함께 채취하기 때문에 채취한 부위의 통증 및 신전력 저하 등 수술 후 합병증 발생 가능성이 높다49,57. 슬개건의 단축으로 인해 슬개골 저위가 발생할 수도 있다. 바닥에서 쪼그리는 자세, 무릎 꿇기 자세 등에서 앞무릎 통증 발생 빈도가 높기 때문에 국내에서는 사용 빈도가 낮은 편이다.
(3) 자가 대퇴 사두건(quadriceps tendon)
슬관절 신전력 저하 등의 문제가 있기 때문에 사용 빈도가 낮았으나, 최근 주목을 받고 있다. 최근 생역학적 연구에서 자가 대퇴사두건은 정상 전방십자인대와 유사한 실패 강도(failure load) 및 경도(stiffness)를 보이고 슬개건보다 20% 높은 콜라겐 함량을 가지고 있어 우수한 생역학적 특징을 보이는 것으로 밝혀졌다49. 충분한 두께의 건을 얻을 수 있고, 슬개골 상부의 골편을 포함하고 있어서 이식물-대퇴골 터널의 견고한 유합을 얻을 수 있다. 자가 슬개건보다 앞무릎 통증 발생이 적은 것으로 알려져 있으나, 대퇴사두건 채취 후 24개월까지 슬관절 신전력이 회복되지 않을 수 있다는 점은 고려해야 할 부분이다58. 저자의 경우 FRS를 사용한 전방십자인대 재건술 시, 대퇴골 후벽이 2–3 mm 남은 상태에서 골편 및 생체흡수성 나사를 삽입할 경우 후벽 파손의 가능성이 높다고 판단하여 재재건술 시 등에 제한적으로 사용하고 있다. 각각의 자가 이식물의 장단점은 Table 3에 정리하였다.
사체에서 채취한 이식물로 공여부 부작용이 없으며, 수술 시간이 짧은 장점이 있다. 수술 시 힘줄의 길이와 두께를 편하게 조절할 수 있고, 다양한 수술을 같이 할 수 있다는 것도 장점이다. 그러나 동종 이식물은 멸균, 가공하는 과정에서 방사선 조사 처리 등에 의해 기계적 강도가 약해지고, 자가 이식물보다 인대화 과정도 오래 걸린다. 이는 자가 이식물보다 높은 재파열률을 보이는 주된 이유이다59-61. 따라서 저자는 자가 힘줄을 채취할 수 없는 경우, 45세 이상에서 신체적 활동 정도가 낮은 경우, 내측 측부인대 손상으로 외반 불안정성이 있는 경우 등에서 제한적으로 사용하고 있다. Table 4에는 자가 이식물과 동종 이식물의 장단점을 정리하였다.
자연 상태의 전방십자인대는 점탄성(viscoelacity)이 있어서 슬관절의 굴곡-신전, 회전 등으로 부하되는 스트레스 하에서는 일부분 긴장되었다가 부하가 소실되면 원래 모양으로 되돌아가려는 탄력성을 보인다. 또한, 느슨해진 후에도 변형이 초래되지 않고 원래 상태의 길이 및 긴장도를 유지하는 특성을 보인다62,63. 그러나, 이식물로 사용되는 힘줄은 점탄성이 떨어지는 조직이기 때문에 길이 변화에 취약할 수 있어 조기에 인대화를 촉진할 수 있는 방법을 모색해야 한다.
생물학적 치유는 전방십자인대 재건술 후 결과에 영향을 미치는 중요한 요소이며, 생물학적 치유가 잘 되려면 힘줄 이식물이 정상 인대처럼 되는 인대화 과정이 잘 일어나야 한다. 인대화 과정은 무혈성 괴사(avascular necrosis)-재결합(repopulation)-혈관 재형성(revascularization)-재형성(remodeling) 과정을 거친다. 재형성까지 완료되는 데에는 약 9개월 정도의 기간이 소요되며, 동종 이식물의 치유 소요 시간은 1.5배 더 걸리는 것으로 알려져 있다62. 관절 내의 이식물 치유뿐만 아니라 이식물-골터널 치유도 중요한 부분이다. 이식골-골터널 유합은 6–8주, 이식건-골터널 유합은 12주 정도 소요되는 것으로 알려져 있다62.
생물학적 치유 촉진을 위해, 세포 치료(cellular elements), 성장인자(growth factors) 자극, 생체재료(scaffold 등) 등의 사용, 또는 기계적 자극(mechanical stimuli)과 같은 여러 방법들을 적용해 왔고, 여러 연구에서 이러한 생물학적 치유 전략의 결과를 발표하였다64. 이식건-골터널 치유에 관여하는 주요 생리학적 과정은 섬유연골과 골 형성이다. 이식건-골터널 치유 과정은 골터널을 따라 힘줄과 골 사이에서 섬유 조직 세포의 성장으로 시작하며, 서서히 콜라겐 섬유층을 형성한다. 콜라겐 섬유층이 성숙해짐에 따라 힘줄 주변의 골조직이 재구성되고, 이식건-골터널 접촉면의 강도가 증가한다65. 궁극적으로, 이식건-골터널 접합면의 강도는 골로의 침투, 미네랄화 및 성숙에 의해 결정된다. 결국 이 과정을 향상시키는 것이 전방십자인대 이식건의 생물학적 치유를 향상시키는 길이며 그 방법으로 여러 시도들이 행해져 왔다. 다만, 대부분의 연구가 이식물-골터널 치유를 촉진하기 위한 방법들에 치우쳐 있는데, 전방십자인대 재파열 호발 부위가 대퇴부-중간부 순이라는 것을 고려하면 관절 내 치유를 촉진시키기 위한 방법들에 대한 연구가 더 필요하다.
가장 많이 사용되는 세포 치료는 중간엽 줄기세포와 혈소판 풍부 혈장(platelet-rich plasma, PRP) 주입이다. 중간엽 줄기세포 중에는 골수 유래 줄기세포(bone marrow-derived mesenchymal stem cells)에 대한 연구가 가장 활발하게 진행되었는데, 아직 결과들이 혼재되어 있다66. 성장인자들(bone morphogenetic protein-2, 골 형성 단백질-2 혹은 basic fibroblast growth factor, 염기성 섬유아세포 성장인자) 발현 유전자 조작 골수 유래 중간엽 줄기세포를 이식건-골터널 접촉면에 주입하였을 때, 활발한 세포 증식, 새로운 골 형성, 높은 기계적 성질 발현 등 우수한 결과를 보였다는 보고들이 있다67,68. 세포 증식, 골 형성, 인대화 단계로 이어지는 과정 중에 초기 단계뿐만 아니라 증식기 단계에서 중간엽 줄기세포가 투여되어 역할을 할 수 있다면, 조금 더 좋은 결과를 기대해 볼 수 있을 것이다. PRP도 중간엽 줄기세포와 유사한 치유 기전을 가지고 있는데, 골터널에 힘줄을 이식하는 동안 PRP를 사용하면 초기에 섬유연골 형성을 유도하여 이식건-골터널 치유를 촉진할 수 있다69. Andriolo 등70이 전방십자인대 재건술 시 PRP가 인대화 및 염증 조절에 미치는 영향을 평가하기 위해 시행한 체계적 문헌 고찰에서 PRP는 이식건 성숙 및 이식물-뼈 치유를 촉진시키는 긍정적 영향을 미친다고 하였다. 다만, PRP 용량 및 농도에서는 연구자마다 프로토콜 차이를 보이고 있기에 결과를 일반화하기에는 한계가 있다.
다양한 생체 재료들은 골터널에서 새로운 골 형성을 촉진하여 이식건-골터널 치유를 촉진하는 데 기여할 수 있다. Scaffold는 세포 부착 및 이동, 생화학적 인자들의 이동, 세포 영양소 및 발현물의 확산 등을 가능하게 하면서 3차원적 조직 형성을 도와주는 인공 조직물이다. 이상적인 scaffold의 조건은 (1) 세포 성장 및 세포 영양소 및 노폐물의 흐름을 위한 상호 연결된 다공성 네트워크 형태의 3차원적 구조, (2) 적절한 생체적합성 및 생체흡수성, (3) 세포 부착, 증식, 분화 등을 위한 화학적으로 처리된 표면, (4) 이식부와 비슷한 기계적 특성 등이다. 생체 유래 혹은 합성 물질들을 이용한 다양한 scaffold들이 개발되어 있는데, 이는 다양한 생물학적, 기계적 특성을 보이고 있다. 생체 활성 scaffold는 정상 전방십자인대에서 발견되는 세포 외 기질 단백질을 기반으로 자가 혈소판을 활성화하여 혈소판 유래 성장 인자, 섬유아세포 성장 인자-2 및 변형 성장 인자-베타를 포함한 단백동화 성장 인자를 방출하게 해준다. 이는 이식건의 치유 과정을 가속화하고 재생된 조직의 기계적, 생물학적 특성을 향상시키는 등 좋은 결과를 보여준다71. 추가로 이러한 이식물에 인산 칼슘(calcium phosphate) 용액을 적시는 방법이 시도되고 있다. 이를 인산 칼슘하이브리드 건이라 말하는데, 이의 장점은 이식물의 미세 구조가 저결정성 apatite와 제1형 콜라겐을 포함하므로 뼈의 미세 구조와 유사하여 골터널에서 새로운 골 형성을 촉진할 수 있다는 것이다72.
전방십자인대 재건술 후에도 전외측 회전 불안정성이 잔존하는 경우가 있는데, 이를 해결하기 위한 많은 시도를 해왔다. 이런 과정에서 전외측인대(anterolateral ligament)에 대해 관심을 가지게 되었다. 2012년 Vincent 등75이 전외측인대라고 명명하였고, 2013년 Claes 등76이 전외측인대는 분명히 존재하는 인대 구조물이라는 것을 밝히면서 각종 매스컴을 통해 각광을 받게 되었다. 이 구조물이 슬관절의 회전 안정성에 기여한다는 것이 밝혀지면서 이후 전외측인대의 해부, 영상학적 검사, 임상 결과 등에 대한 연구가 활발하게 이루어지고 있다77-83. 그러나 아직 전외측 인대, 전외측 복합체(anterolateral complex) 등의 해부학적 구조 및 생역학적 역할 등에 대해서는 저자마다 의견이 분분한 상태이다. 전외측 복합체의 보강술은 전방십자인대 재건술 후 회전 불안정성을 줄여주고 재파열 위험을 낮추기 위해 발달한 수술법으로, 대표적으로 전외측인대 재건술과 외측 관절 외 건고정술(lateral extraarticular tenodesis)이 있다84,85. 전외측 복합체는 슬관절의 회전 안정성을 제공하는 2차 구조물로, 1차 구조물인 전방십자인대의 제대로 된 재건술 없이 전외측 복합체 보강술만 시행하는 것에 대해서는 신중하게 접근해야 한다86.
전외측인대는 초기에 단일 인대 구조물로 여겨졌으나 최근에는 전외측인대, 장경인대(iliotibial band), 외측 측부인대(lateral collateral ligament), 외측 반월연골판(lateral meniscus) 등으로 이루어진 복잡한 복합체의 일부라고 보고 있다(Fig. 13). 2021년 발표된 체계적 문헌 고찰 논문이 2017년 2월부터 2020년 5월까지 발표된 논문들을 분석하였는데, 전외측인대는 분명히 존재하고, 길이는 34–59 mm, 두께는 1–2.5 mm, 너비는 대퇴부 4–11 mm, 중간부 4–8 mm, 경골부 11–12 mm 등의 해부학적 특징을 갖는다고 하였다87. 경골부에서는 Gerdy 결절과 비골두 사이에서 부채 모양으로 퍼지면서 부착한다는 데에 이견이 없으나, 대퇴부에서는 외측 대퇴 상과를 기준으로 해서 다양한 기원을 갖고 있다고 하였다. 대퇴 부착부에 대한 해부학적 연구에서 외측 대퇴상과에서 약간 떨어진 후방 및 근위부에 부착하는 비율이 58%, 외측 대퇴 상과에 직접 부착하는 비율이 23%, 외측 대퇴 상과에서 완전히 떨어진 후방 및 근위에 부착하는 비율이 19%라고 보고하였다88. 전외측인대는 경골의 내회전 및 슬관절 굴곡-신전 시 길이 변화를 보이는 비등척성 구조로, 경골 내회전과 전방 전위시에 저항하면서 긴장되는 양상을 보인다87.
이러한 해부학적 구조에 대한 이해를 기반으로 전외측인대 재건술을 시행하고 있는데, 터널 위치, 이식건의 종류, 이식건 고정 방법 등은 저자마다 다양하다. 본 연구자들의 경우, 대퇴 터널은 외측 대퇴 상과의 바로 근위 및 후방에 만들고, 6 mm 직경의 동종 이식건을 삽입하고 동일한 직경의 생체 흡수성 나사를 삽입한 후, 장경인대의 심층 및 외측 측부인대 표층으로 통과시켜 경골 터널에 고정해 준다. 경골 터널은 관절면 하방 1 cm 지점에서 Gerdy 결절과 비골 골두의 중간에 만들며, 이식건 고정은 6 mm 직경의 생체흡수성 나사를 이용하여 슬관절 30° 굴곡 위에서 시행한다. 실제적으로 경골 부착부는 부채꼴 형태로 넓게 퍼져 있으나 경골에 이중 터널을 만들 때 피질골 골절 위험성이 있기에 해부학적 중심부에 터널을 만들고 있다(Fig. 14).
전외측인대 재건술의 적응증은 수술 전 고도의 회전 불안정성을 보이는 경우(pivot shift grade 2 or 3), 전신적 관절 이완증(generalized laxity)이 있는 경우, 슬관절이 과신전되는 경향을 보이는 경우(후외측 복합체의 손상은 제외), 전방십자인대 재-재건술을 시행하는 경우, 전방십자인대가 만성적으로 파열되는 경우, 수술 후 고강도 스포츠활동으로 복귀를 원하는 경우 등이다83. 최근 임상 연구들에서 슬관절이 과신전되는 경향을 보이는 운동 선수 및 만성 전방십자인대 파열 환자들을 대상으로 한 전방십자인대 재건술 시 전외측인대 재건술을 동시에 시행해 주었을 때, 단독 전방십자인대 재건술을 시행한 군보다 주관적 기능 점수, 재파열률, 회전 안정성 등에서 우수한 결과를 보였다고 보고하였다89-91. Sonnery-Cottet 등92은 잔존 회전 불안정성 고위험군 환자들을 대상으로 시행한 전향적 연구에서 자가 슬건을 이용한 전방십자인대 재건술과 전외측인대 재건술을 시행한 군의 재파열 위험도가 단독 슬개건 이용 전방십자인대 재건술 군, 단독 슬건 이용 전방십자인대 재건술 군보다 각각 2.5배, 3.1배 적었다고 보고하였다. Lee 등93은 전방십자인대 재-재건술 시, 전외측인대 재건술을 동시에 시행한 군이 시행하지 않은 군보다 주관적 기능 점수, 재파열률, 운동 복귀 등에서 더 좋은 결과를 보였고, 회전 불안정성 발생 빈도도 유의하게 낮았다고 하였다.
최근에는 전외측인대보다 전외측 복합체의 개념을 부각시킨 연구도 많이 보고되고 있다. 전외측 복합체는 슬관절 외측에 회전 안정성을 제공하는 연부 조직 구조물들의 집합이다. 복합체는 장경인대의 천부 구조물, Kaplan fiber를 포함한 장경인대의 심부 구조물, 장경인대의 관절막-대퇴골 층(the capsulo-osseous layer), 전외측 관절막 등으로 구성된다(Fig. 13). 외측 관절 외 건고정술은 장경인대의 역할을 보다 강조하는 전외측 복합체 개념을 선호하는 군에서 많이 시행하고 있는 것으로 보인다82. 외측 관절 외 건고정술의 적응증은 전외측인대 재건술의 적응증과 유사하다82. 외측 관절 외 건고정술은 장경인대의 일부를 근위의 외측 대퇴골로 이전하여 고정하는 술식인데, 저자에 따라 외측 측부인대의 심부 혹은 천부를 지나도록 하고 있다(Fig. 15). Kittl 등94이 보고한 생역학적 연구에 따르면, 외측 측부인대의 심부를 지나면서 대퇴골 외상과의 근위부에 고정하는 것이 이상적인 이식건의 특징(슬관절 운동 시, 지나치게 긴장되거나 느슨해지는 현상이 적음)을 보인다고 하였다. 최근의 체계적 문헌 고찰 및 메타 분석 연구들은 단독 전방십자인대 군과 비교하였을 때 외측 관절 외 건고정술을 동시에 시행한 군이 회전 안정성 면에서 우수한 결과를 보인다고 하였으나, 환자의 주관적 기능 점수, 전방 전위 등에서는 차이가 없다고 하였다95-97. 그러나, 외측 관절 외 건고정술은 장경인대에 의존하는 방식의 비-해부학적인 재건술이라는 점에서 전외측 인대 재건술과 차이가 있다. 장경인대를 고정하는 방식은 슬관절의 과도한 구속으로 이어질 수 있고, 이로 인해 운동 범위가 감소하고 관절 경직이 증가할 위험성이 높기 때문에 외측 측부인대 심부보다는 표층으로 통과시키는 것이 이러한 위험성을 줄일 수 있다고 판단한다98.
REFERENCES
1. Chung KS, Kim JH, Kong DH, Park I, Kim JG, Ha JK. 2022; An increasing trend in the number of anterior cruciate ligament reconstruction in Korea: a nationwide epidemiologic study. Clin Orthop Surg. 14:220–6. DOI: 10.4055/cios20276. PMID: 35685966. PMCID: PMC9152897.

2. Risberg MA, Grindem H, Øiestad BE. 2016; We need to implement current evidence in early rehabilitation programs to improve long-term outcome after anterior cruciate ligament injury. J Orthop Sports Phys Ther. 46:710–3. DOI: 10.2519/jospt.2016.0608. PMID: 27581178.

3. Golberg E, Sommerfeldt M, Pinkoski A, Dennett L, Beaupre L. Anterior cruciate ligament reconstruction return-to-sport decision-making: a scoping review. Sports Health. 2023; Jan. 27. [Epub]. https://doi.org/10.1177/19417381221147524. DOI: 10.1177/19417381221147524. PMID: 36707977.

4. Niederer D, Behringer M, Stein T. 2023; Functional outcomes after anterior cruciate ligament reconstruction: unravelling the role of time between injury and surgery, time since reconstruction, age, gender, pain, graft type, and concomitant injuries. BMC Sports Sci Med Rehabil. 15:49. DOI: 10.1186/s13102-023-00663-x. PMID: 37005699. PMCID: PMC10068137.

5. Cohen D, Yao PF, Uddandam A, de Sa D, Arakgi ME. 2022; Etiology of failed anterior cruciate ligament reconstruction: a scoping review. Curr Rev Musculoskelet Med. 15:394–401. DOI: 10.1007/s12178-022-09776-1. PMID: 35852699. PMCID: PMC9463419.

6. Morales-Avalos R, Torres-González EM, Padilla-Medina JR, Monllau JC. ACL anatomy: is there still something to learn? Rev Esp Cir Ortop Traumatol. 2023; Feb. 12. [Epub]. https://doi.org/10.1016/j.recot.2023.02.005. DOI: 10.1016/j.recot.2023.02.005. PMID: 36787832.

7. Woo SL, Hollis JM, Adams DJ, Lyon RM, Takai S. 1991; Tensile properties of the human femur-anterior cruciate ligament-tibia complex: the effects of specimen age and orientation. Am J Sports Med. 19:217–25. DOI: 10.1177/036354659101900303. PMID: 1867330.

8. Cone SG, Howe D, Fisher MB. 2019; Size and shape of the human anterior cruciate ligament and the impact of sex and skeletal growth: a systematic review. JBJS Rev. 7:e8. DOI: 10.2106/JBJS.RVW.18.00145. PMID: 31246862. PMCID: PMC7771555.
9. Musahl V, Nazzal EM, Lucidi GA, et al. 2022; Current trends in the anterior cruciate ligament part 1: biology and biomechanics. Knee Surg Sports Traumatol Arthrosc. 30:20–33. DOI: 10.1007/s00167-021-06826-y. PMID: 34927221.

10. Kondo E, Merican AM, Yasuda K, Amis AA. 2014; Biomechanical analysis of knee laxity with isolated anteromedial or posterolateral bundle-deficient anterior cruciate ligament. Arthroscopy. 30:335–43. DOI: 10.1016/j.arthro.2013.12.003. PMID: 24581258.

11. Amis AA. 2012; The functions of the fibre bundles of the anterior cruciate ligament in anterior drawer, rotational laxity and the pivot shift. Knee Surg Sports Traumatol Arthrosc. 20:613–20. DOI: 10.1007/s00167-011-1864-7. PMID: 22278656.

12. Sabzevari S, Shaikh H, Marshall B, et al. 2020; The femoral posterior fan-like extension of the ACL insertion increases the failure load. Knee Surg Sports Traumatol Arthrosc. 28:1113–8. DOI: 10.1007/s00167-019-05753-3. PMID: 31642946.

13. Śmigielski R, Zdanowicz U, Drwięga M, Ciszek B, Williams A. 2016; The anatomy of the anterior cruciate ligament and its relevance to the technique of reconstruction. Bone Joint J. 98-B:1020–6. DOI: 10.1302/0301-620X.98B8.37117. PMID: 27482012.

14. Morales-Avalos R, Perelli S, Vilchez-Cavazos F, et al. 2022; The morphology of the femoral footprint of the anterior cruciate ligament changes with aging from a large semicircular shape to a small flat ribbon-like shape. Knee Surg Sports Traumatol Arthrosc. 30:3402–13. DOI: 10.1007/s00167-022-06935-2. PMID: 35318508. PMCID: PMC9464138.

15. Costa GG, Grassi A, Perelli S, et al. 2019; Age over 50 years is not a contraindication for anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 27:3679–91. DOI: 10.1007/s00167-019-05450-1. PMID: 30944945.

16. Hiramatsu K, Mae T, Tachibana Y, Nakagawa S, Shino K. 2018; Contact area between femoral tunnel and interference screw in anatomic rectangular tunnel ACL reconstruction: a comparison of outside-in and trans-portal inside-out techniques. Knee Surg Sports Traumatol Arthrosc. 26:519–25. DOI: 10.1007/s00167-017-4732-2. PMID: 29058021.

17. Fink C, Lawton R, Förschner F, Gföller P, Herbort M, Hoser C. 2018; Minimally invasive quadriceps tendon single-bundle, arthroscopic, anatomic anterior cruciate ligament reconstruction with rectangular bone tunnels. Arthrosc Tech. 7:e1045–56. DOI: 10.1016/j.eats.2018.06.012. PMID: 30377585. PMCID: PMC6203691.

18. Takata Y, Nakase J, Oshima T, Shimozaki K, Asai K, Tsuchiya H. 2018; No difference in the graft shift between a round and a rounded rectangular femoral tunnel for anterior cruciate ligament reconstruction: an experimental study. Arch Orthop Trauma Surg. 138:1249–55. DOI: 10.1007/s00402-018-2958-1. PMID: 29770879.

19. Lim HC, Yoon YC, Wang JH, Bae JH. 2012; Anatomical versus non-anatomical single bundle anterior cruciate ligament reconstruction: a cadaveric study of comparison of knee stability. Clin Orthop Surg. 4:249–55. DOI: 10.4055/cios.2012.4.4.249. PMID: 23205233. PMCID: PMC3504688.

20. Byrne KJ, Hughes JD, Gibbs C, et al. 2022; Non-anatomic tunnel position increases the risk of revision anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 30:1388–95. DOI: 10.1007/s00167-021-06607-7. PMID: 33983487.

21. Wan F, Chen T, Ge Y, Zhang P, Chen S. 2019; Effect of nearly isometric ACL reconstruction on graft-tunnel motion: a quantitative clinical study. Orthop J Sports Med. 7:2325967119890382. DOI: 10.1177/2325967119890382. PMID: 32656282. PMCID: PMC7333503.

22. Musahl V, Engler ID, Nazzal EM, et al. 2022; Current trends in the anterior cruciate ligament part II: evaluation, surgical technique, prevention, and rehabilitation. Knee Surg Sports Traumatol Arthrosc. 30:34–51. DOI: 10.1007/s00167-021-06825-z. PMID: 34865182.

23. Tuca M, Valderrama I, Eriksson K, Tapasvi S. 2023; Current trends in anterior cruciate ligament surgery: a worldwide benchmark study. J ISAKOS. 8:2–10. DOI: 10.1016/j.jisako.2022.08.009. PMID: 36154898.

24. Oh JY, Kim KT, Park YJ, et al. 2020; Biomechanical comparison of single-bundle versus double-bundle anterior cruciate ligament reconstruction: a meta-analysis. Knee Surg Relat Res. 32:14. DOI: 10.1186/s43019-020-00033-8. PMID: 32660562. PMCID: PMC7219200.

25. Goldsmith MT, Jansson KS, Smith SD, Engebretsen L, LaPrade RF, Wijdicks CA. 2013; Biomechanical comparison of anatomic single- and double-bundle anterior cruciate ligament reconstructions: an in vitro study. Am J Sports Med. 41:1595–604. DOI: 10.1177/0363546513487065. PMID: 23696212.

26. Kondo E, Merican AM, Yasuda K, Amis AA. 2011; Biomechanical comparison of anatomic double-bundle, anatomic single-bundle, and nonanatomic single-bundle anterior cruciate ligament reconstructions. Am J Sports Med. 39:279–88. DOI: 10.1177/0363546510392350. PMID: 21239692.

27. Torkaman A, Yazdi H, Hosseini MG. 2016; The results of single bundle versus double bundle ACL reconstruction surgery, a retrospective study and review of literature. Med Arch. 70:351–3. DOI: 10.5455/medarh.2016.70.351-353. PMID: 27994295. PMCID: PMC5136424.

28. Alomari MS, Ghaddaf AA, Abdulhamid AS, Alshehri MS, Ashraf M, Alharbi HH. 2022; Single bundle versus double bundle anterior cruciate ligament reconstruction: a systematic review and meta-analysis. Indian J Orthop. 56:1669–84. DOI: 10.1007/s43465-022-00718-0. PMID: 36187591. PMCID: PMC9485407.

29. Björnsson H, Desai N, Musahl V, et al. 2015; Is double-bundle anterior cruciate ligament reconstruction superior to single-bundle?: a comprehensive systematic review. Knee Surg Sports Traumatol Arthrosc. 23:696–739. DOI: 10.1007/s00167-013-2666-x.

30. Sherman SL, Calcei J, Ray T, et al. 2021; ACL Study Group presents the global trends in ACL reconstruction: biennial survey of the ACL Study Group. J ISAKOS. 6:322–8. DOI: 10.1136/jisakos-2020-000567. PMID: 34272329.

31. Lee YH, Kuroda R, Chan KM. 2015; Anterior cruciate ligament reconstruction: a 2015 global perspective of the Magellan Society. Asia Pac J Sports Med Arthrosc Rehabil Technol. 2:122–8. DOI: 10.1016/j.asmart.2015.08.003. PMID: 29264251. PMCID: PMC5730661.

32. Lee DW, Kim JG. 2017; Anatomic single-bundle anterior cruciate ligament reconstruction using the modified transtibial technique. Arthrosc Tech. 6:e227–32. DOI: 10.1016/j.eats.2016.09.028. PMID: 28409105. PMCID: PMC5382429.

33. Lee DW, Kim JG, Lee JH, Park JH, Kim DH. 2018; Comparison of modified transtibial and outside-in techniques in anatomic single-bundle anterior cruciate ligament reconstruction. Arthroscopy. 34:2857–70. DOI: 10.1016/j.arthro.2018.05.041. PMID: 30197202.

34. Lee JK, Lee S, Seong SC, Lee MC. 2014; Modified transtibial technique for anterior cruciate ligament reconstruction with quadriceps tendon autograft. JBJS Essent Surg Tech. 4:e15. DOI: 10.2106/JBJS.ST.N.00078. PMID: 30775122. PMCID: PMC6359920.

35. Youm YS, Cho SD, Lee SH, Youn CH. 2014; Modified transtibial versus anteromedial portal technique in anatomic single-bundle anterior cruciate ligament reconstruction: comparison of femoral tunnel position and clinical results. Am J Sports Med. 42:2941–7. DOI: 10.1177/0363546514551922. PMID: 25269655.

36. Silver AG, Kaar SG, Grisell MK, Reagan JM, Farrow LD. 2010; Comparison between rigid and flexible systems for drilling the femoral tunnel through an anteromedial portal in anterior cruciate ligament reconstruction. Arthroscopy. 26:790–5. DOI: 10.1016/j.arthro.2009.10.012. PMID: 20511037.

37. Steiner ME, Smart LR. 2012; Flexible instruments outperform rigid instruments to place anatomic anterior cruciate ligament femoral tunnels without hyperflexion. Arthroscopy. 28:835–43. DOI: 10.1016/j.arthro.2011.11.029. PMID: 22289428.

38. Lee DW, Lee DH, Moon SG, Kang JH, Woo YJ, Kim WJ. 2023; Femoral tunnel geometry and graft inclination angles in anterior cruciate ligament reconstruction using a flexible reamer system. Medicina (Kaunas). 59:1031. DOI: 10.3390/medicina59061031. PMID: 37374234. PMCID: PMC10302174.

39. Yoon KH, Kim JH, Kwon YB, Kim EJ, Lee SH, Kim SG. 2020; A two-portal technique using a flexible reamer system is a safe and effective method for transportal anterior cruciate ligament reconstruction. Arch Orthop Trauma Surg. 140:383–90. DOI: 10.1007/s00402-020-03343-4. PMID: 31970504.

40. Ahn JH, Jeong HJ, Lee YS, Park JH, Lee JH, Ko TS. 2016; Graft bending angle is correlated with femoral intraosseous graft signal intensity in anterior cruciate ligament reconstruction using the outside-in technique. Knee. 23:666–73. DOI: 10.1016/j.knee.2015.10.006. PMID: 26968485.

41. Kim JG, Wang JH, Lim HC, Ahn JH. 2012; Femoral graft bending angle and femoral tunnel geometry of transportal and outside-in techniques in anterior cruciate ligament reconstruction: an in vivo 3-dimensional computed tomography analysis. Arthroscopy. 28:1682–94. DOI: 10.1016/j.arthro.2012.05.884. PMID: 23107250.

42. Niki Y, Nagai K, Harato K, Suda Y, Nakamura M, Matsumoto M. 2017; Effects of femoral bone tunnel characteristics on graft-bending angle in double-bundle anterior cruciate ligament reconstruction: a comparison of the outside-in and transportal techniques. Knee Surg Sports Traumatol Arthrosc. 25:1191–8. DOI: 10.1007/s00167-015-3761-y. PMID: 26294057.

43. van Eck CF, Gravare-Silbernagel K, Samuelsson K, et al. 2013; Evidence to support the interpretation and use of the Anatomic Anterior Cruciate Ligament Reconstruction Checklist. J Bone Joint Surg Am. 95:e153. DOI: 10.2106/JBJS.L.01437. PMID: 24132368.

44. Inderhaug E, Larsen A, Strand T, Waaler PA, Solheim E. 2016; The effect of feedback from post-operative 3D CT on placement of femoral tunnels in single-bundle anatomic ACL reconstruction. Knee Surg Sports Traumatol Arthrosc. 24:154–60. DOI: 10.1007/s00167-014-3355-0. PMID: 25274095.

45. Sirleo L, Innocenti M, Innocenti M, Civinini R, Carulli C, Matassi F. 2018; Post-operative 3D CT feedback improves accuracy and precision in the learning curve of anatomic ACL femoral tunnel placement. Knee Surg Sports Traumatol Arthrosc. 26:468–77. DOI: 10.1007/s00167-017-4614-7. PMID: 28631143.

46. Mhaskar VA, Jain Y, Soni P, Fiske R, Maheshwari J. 2021; How important is the tunnel position in outcomes post-ACL reconstruction: a 3D CT-based study. Indian J Orthop. 56:312–8. DOI: 10.1007/s43465-021-00485-4. PMID: 35140863. PMCID: PMC8789976.

47. Bernard M, Hertel P, Hornung H, Cierpinski T. 1997; Femoral insertion of the ACL: radiographic quadrant method. Am J Knee Surg. 10:14–22.
48. Domnick C, Raschke MJ, Herbort M. 2016; Biomechanics of the anterior cruciate ligament: physiology, rupture and reconstruction techniques. World J Orthop. 7:82–93. DOI: 10.5312/wjo.v7.i2.82. PMID: 26925379. PMCID: PMC4757662.

49. Runer A, Keeling L, Wagala N, et al. 2023; Current trends in graft choice for anterior cruciate ligament reconstruction - part I: anatomy, biomechanics, graft incorporation and fixation. J Exp Orthop. 10:37. DOI: 10.1186/s40634-023-00600-4. PMID: 37005974. PMCID: PMC10067784.

50. Chu CR, Williams AA. 2019; Quantitative MRI UTE-T2* and T2* show progressive and continued graft maturation over 2 years in human patients after anterior cruciate ligament reconstruction. Orthop J Sports Med. 7:2325967119863056. DOI: 10.1177/2325967119863056. PMID: 31448301. PMCID: PMC6693027.

51. Irvine JN, Arner JW, Thorhauer E, et al. 2016; Is there a difference in graft motion for bone-tendon-bone and hamstring autograft ACL reconstruction at 6 weeks and 1 year? Am J Sports Med. 44:2599–607. DOI: 10.1177/0363546516651436. PMID: 27411358.

52. Ma R, Schär M, Chen T, et al. 2018; Effect of dynamic changes in anterior cruciate ligament in situ graft force on the biological healing response of the graft-tunnel interface. Am J Sports Med. 46:915–23. DOI: 10.1177/0363546517745624.

53. Biset A, Douiri A, Robinson JR, et al. 2023; Tibial tunnel expansion does not correlate with four-strand graft maturation after ACL reconstruction using adjustable cortical suspensory fixation. Knee Surg Sports Traumatol Arthrosc. 31:1761–70. DOI: 10.1007/s00167-022-07051-x. PMID: 35876906.

54. Chee MY, Chen Y, Pearce CJ, et al. 2017; Outcome of patellar tendon versus 4-strand hamstring tendon autografts for anterior cruciate ligament reconstruction: a systematic review and meta-analysis of prospective randomized trials. Arthroscopy. 33:450–63. DOI: 10.1016/j.arthro.2016.09.020. PMID: 28040335.

55. Lee DW, Shim JC, Yang SJ, Cho SI, Kim JG. 2019; Functional effects of single semitendinosus tendon harvesting in anatomic anterior cruciate ligament reconstruction: comparison of single versus dual hamstring harvesting. Clin Orthop Surg. 11:60–72. DOI: 10.4055/cios.2019.11.1.60. PMID: 30838109. PMCID: PMC6389538.

56. Wang HD, Gao SJ, Zhang YZ. 2020; Hamstring autograft versus hybrid graft for anterior cruciate ligament reconstruction: a systematic review. Am J Sports Med. 48:1014–22. DOI: 10.1177/0363546519849483. PMID: 31166113.

57. Marques FD, Barbosa PH, Alves PR, et al. 2020; Anterior knee pain after anterior cruciate ligament reconstruction. Orthop J Sports Med. 8:2325967120961082. DOI: 10.1177/2325967120961082. PMID: 33195725. PMCID: PMC7605008.

58. Johnston PT, McClelland JA, Feller JA, Webster KE. 2021; Knee muscle strength after quadriceps tendon autograft anterior cruciate ligament reconstruction: systematic review and meta-analysis. Knee Surg Sports Traumatol Arthrosc. 29:2918–33. DOI: 10.1007/s00167-020-06311-y. PMID: 33026536.

59. Cruz AI Jr, Beck JJ, Ellington MD, et al. 2020; Failure rates of autograft and allograft ACL reconstruction in patients 19 years of age and younger: a systematic review and meta-analysis. JB JS Open Access. 5:e20.00106. DOI: 10.2106/JBJS.OA.20.00106. PMID: 34322650. PMCID: PMC8312832.
60. Yao LW, Wang Q, Zhang L, et al. 2015; Patellar tendon autograft versus patellar tendon allograft in anterior cruciate ligament reconstruction: a systematic review and meta-analysis. Eur J Orthop Surg Traumatol. 25:355–65. DOI: 10.1007/s00590-014-1481-5. PMID: 24831306.

61. Cvetanovich GL, Mascarenhas R, Saccomanno MF, et al. 2014; Hamstring autograft versus soft-tissue allograft in anterior cruciate ligament reconstruction: a systematic review and meta-analysis of randomized controlled trials. Arthroscopy. 30:1616–24. DOI: 10.1016/j.arthro.2014.05.040. PMID: 25108904.

62. Yao S, Fu BS, Yung PS. 2021; Graft healing after anterior cruciate ligament reconstruction (ACLR). Asia Pac J Sports Med Arthrosc Rehabil Technol. 25:8–15. DOI: 10.1016/j.asmart.2021.03.003. PMID: 34094881. PMCID: PMC8134949.

63. Ristaniemi A, Stenroth L, Mikkonen S, Korhonen RK. 2018; Comparison of elastic, viscoelastic and failure tensile material properties of knee ligaments and patellar tendon. J Biomech. 79:31–8. DOI: 10.1016/j.jbiomech.2018.07.031. PMID: 30082085.

64. Looney AM, Leider JD, Horn AR, Bodendorfer BM. 2020; Bioaugmentation in the surgical treatment of anterior cruciate ligament injuries: a review of current concepts and emerging tech-niques. SAGE Open Med. 8:2050312120921057. DOI: 10.1177/2050312120921057. PMID: 32435488. PMCID: PMC7222656.

65. Rodeo SA, Arnoczky SP, Torzilli PA, Hidaka C, Warren RF. 1993; Tendon-healing in a bone tunnel: a biomechanical and histological study in the dog. J Bone Joint Surg Am. 75:1795–803. DOI: 10.2106/00004623-199312000-00009. PMID: 8258550.

66. Wang C, Hu Y, Zhang S, et al. 2021; Application of stem cell therapy for ACL graft regeneration. Stem Cells Int. 2021:6641818. DOI: 10.1155/2021/6641818. PMID: 34381504. PMCID: PMC8352687.

67. Chen B, Li B, Qi YJ, et al. 2016; Enhancement of tendon-to-bone healing after anterior cruciate ligament reconstruction using bone marrow-derived mesenchymal stem cells genetically modified with bFGF/BMP2. Sci Rep. 6:25940. DOI: 10.1038/srep25940. PMID: 27173013. PMCID: PMC4865959.

68. Dong Y, Zhang Q, Li Y, Jiang J, Chen S. 2012; Enhancement of tendon-bone healing for anterior cruciate ligament (ACL) reconstruction using bone marrow-derived mesenchymal stem cells infected with BMP-2. Int J Mol Sci. 13:13605–20. DOI: 10.3390/ijms131013605. PMID: 23202970. PMCID: PMC3497344.

69. Bessa PC, Casal M, Reis RL. 2008; Bone morphogenetic proteins in tissue engineering: the road from laboratory to clinic, part II (BMP delivery). J Tissue Eng Regen Med. 2:81–96. DOI: 10.1002/term.74. PMID: 18383454.

70. Andriolo L, Di Matteo B, Kon E, Filardo G, Venieri G, Marcacci M. 2015; PRP augmentation for ACL reconstruction. Biomed Res Int. 2015:371746. DOI: 10.1155/2015/371746. PMID: 26064903. PMCID: PMC4430629.

71. Murray MM, Fleming BC. 2013; Use of a bioactive scaffold to stimulate anterior cruciate ligament healing also minimizes post-traumatic osteoarthritis after surgery. Am J Sports Med. 41:1762–70. DOI: 10.1177/0363546513483446. PMID: 23857883. PMCID: PMC3735821.

72. Mutsuzaki H, Nakajima H, Nomura S, Sakane M. 2017; Differences in placement of calcium phosphate-hybridized tendon grafts within the femoral bone tunnel during ACL reconstruction do not influence tendon-to-bone healing. J Orthop Surg Res. 12:80. DOI: 10.1186/s13018-017-0583-2. PMID: 28577573. PMCID: PMC5455123.

73. Leong NL, Petrigliano FA, McAllister DR. 2014; Current tissue engineering strategies in anterior cruciate ligament reconstruction. J Biomed Mater Res A. 102:1614–24. DOI: 10.1002/jbm.a.34820. PMID: 23737190.

74. Moreau JE, Bramono DS, Horan RL, Kaplan DL, Altman GH. 2008; Sequential biochemical and mechanical stimulation in the development of tissue-engineered ligaments. Tissue Eng Part A. 14:1161–72. DOI: 10.1089/ten.tea.2007.0147. PMID: 18380592.

75. Vincent JP, Magnussen RA, Gezmez F, et al. 2012; The anterolateral ligament of the human knee: an anatomic and histologic study. Knee Surg Sports Traumatol Arthrosc. 20:147–52. DOI: 10.1007/s00167-011-1580-3. PMID: 21717216.

76. Claes S, Vereecke E, Maes M, Victor J, Verdonk P, Bellemans J. 2013; Anatomy of the anterolateral ligament of the knee. J Anat. 223:321–8. DOI: 10.1111/joa.12087. PMID: 23906341. PMCID: PMC3791125.

77. Pomajzl R, Maerz T, Shams C, Guettler J, Bicos J. 2015; A review of the anterolateral ligament of the knee: current knowledge regarding its incidence, anatomy, biomechanics, and surgical dissection. Arthroscopy. 31:583–91. DOI: 10.1016/j.arthro.2014.09.010. PMID: 25447415.

78. Roessler PP, Schüttler KF, Heyse TJ, Wirtz DC, Efe T. 2016; The anterolateral ligament (ALL) and its role in rotational extra-articular stability of the knee joint: a review of anatomy and surgical concepts. Arch Orthop Trauma Surg. 136:305–13. DOI: 10.1007/s00402-015-2395-3. PMID: 26714471.

79. DePhillipo NN, Cinque ME, Chahla J, Geeslin AG, LaPrade RF. 2017; Anterolateral ligament reconstruction techniques, biomechanics, and clinical outcomes: a systematic review. Arthroscopy. 33:1575–83. DOI: 10.1016/j.arthro.2017.03.009. PMID: 28502387.

80. Van der Watt L, Khan M, Rothrauff BB, et al. 2015; The structure and function of the anterolateral ligament of the knee: a systematic review. Arthroscopy. 31:569–82. DOI: 10.1016/j.arthro.2014.12.015. PMID: 25744324.

81. Kraeutler MJ, Welton KL, Chahla J, LaPrade RF, McCarty EC. 2018; Current concepts of the anterolateral ligament of the knee: anatomy, biomechanics, and reconstruction. Am J Sports Med. 46:1235–42. DOI: 10.1177/0363546517701920. PMID: 28426251.

82. Getgood A, Brown C, Lording T, et al. 2019; The anterolateral complex of the knee: results from the International ALC Consensus Group Meeting. Knee Surg Sports Traumatol Arthrosc. 27:166–76. DOI: 10.1007/s00167-018-5072-6. PMID: 30046994.

83. Sonnery-Cottet B, Daggett M, Fayard JM, et al. 2017; Anterolateral Ligament Expert Group consensus paper on the management of internal rotation and instability of the anterior cruciate ligament - deficient knee. J Orthop Traumatol. 18:91–106. DOI: 10.1007/s10195-017-0449-8. PMID: 28220268. PMCID: PMC5429259.

84. Devitt BM, Neri T, Fritsch BA. 2023; Combined anterolateral complex and anterior cruciate ligament injury: anatomy, biomechanics, and management-State-of-the-art. J ISAKOS. 8:37–46. DOI: 10.1016/j.jisako.2022.10.004. PMID: 36368633.

85. Nazzal EM, Keeling LE, Ryan PM, Herman ZJ, Hughes JD. 2023; The role of lateral extra-articular tenodesis in anterior cruciate ligament reconstruction and treatment of rotatory knee instability: a scoping review. Curr Rev Musculoskelet Med. 16:235–45. DOI: 10.1007/s12178-023-09832-4. PMID: 36995532. PMCID: PMC10234940.

86. Inderhaug E, Stephen JM, Williams A, Amis AA. 2017; Biomechanical comparison of anterolateral procedures combined with anterior cruciate ligament reconstruction. Am J Sports Med. 45:347–54. DOI: 10.1177/0363546516681555. PMID: 28027653.

87. Littlefield CP, Belk JW, Houck DA, et al. 2021; The anterolateral ligament of the knee: an updated systematic review of anatomy, biomechanics, and clinical outcomes. Arthroscopy. 37:1654–66. DOI: 10.1016/j.arthro.2020.12.190. PMID: 33340678.

88. Daggett M, Ockuly AC, Cullen M, et al. 2016; Femoral origin of the anterolateral ligament: an anatomic analysis. Arthroscopy. 32:835–41. DOI: 10.1016/j.arthro.2015.10.006. PMID: 26725451.
89. Helito CP, Camargo DB, Sobrado MF, et al. 2018; Combined reconstruction of the anterolateral ligament in chronic ACL injuries leads to better clinical outcomes than isolated ACL reconstruction. Knee Surg Sports Traumatol Arthrosc. 26:3652–9. DOI: 10.1007/s00167-018-4934-2. PMID: 29610972.

90. Helito CP, Sobrado MF, Giglio PN, et al. 2019; Combined reconstruction of the anterolateral ligament in patients with anterior cruciate ligament injury and ligamentous hyperlaxity leads to better clinical stability and a lower failure rate than isolated anterior cruciate ligament reconstruction. Arthroscopy. 35:2648–54. DOI: 10.1016/j.arthro.2019.03.059. PMID: 31421960.
91. Abouljoud MM, Everhart JS, Sigman BO, Flanigan DC, Magnussen RA. 2018; Risk of retear following anterior cruciate ligament reconstruction using a hybrid graft of autograft augmented with allograft tissue: a systematic review and meta-analysis. Arthroscopy. 34:2927–35. DOI: 10.1016/j.arthro.2018.06.044. PMID: 30195958.

92. Sonnery-Cottet B, Saithna A, Cavalier M, et al. 2017; Anterolateral ligament reconstruction is associated with significantly reduced ACL graft rupture rates at a minimum follow-up of 2 years: a prospective comparative study of 502 patients from the SANTI Study Group. Am J Sports Med. 45:1547–57. DOI: 10.1177/0363546516686057. PMID: 28151693.

93. Lee DW, Kim JG, Cho SI, Kim DH. 2019; Clinical outcomes of isolated revision anterior cruciate ligament reconstruction or in combination with anatomic anterolateral ligament reconstruction. Am J Sports Med. 47:324–33. DOI: 10.1177/0363546518815888. PMID: 30640514.

94. Kittl C, Halewood C, Stephen JM, et al. 2015; Length change patterns in the lateral extra-articular structures of the knee and related reconstructions. Am J Sports Med. 43:354–62. DOI: 10.1177/0363546514560993. PMID: 25540293.

95. Devitt BM, Bell SW, Ardern CL, et al. 2017; The role of lateral extra-articular tenodesis in primary anterior cruciate ligament reconstruction: a systematic review with meta-analysis and best-evidence synthesis. Orthop J Sports Med. 5:2325967117731767. DOI: 10.1177/2325967117731767. PMID: 29124075. PMCID: PMC5661757.

96. Hewison CE, Tran MN, Kaniki N, Remtulla A, Bryant D, Getgood AM. 2015; Lateral extra-articular tenodesis reduces rotational laxity when combined with anterior cruciate ligament reconstruction: a systematic review of the literature. Arthroscopy. 31:2022–34. DOI: 10.1016/j.arthro.2015.04.089. PMID: 26116497.

97. Song GY, Hong L, Zhang H, Zhang J, Li Y, Feng H. 2016; Clinical outcomes of combined lateral extra-articular tenodesis and intra-articular anterior cruciate ligament reconstruction in add-ressing high-grade pivot-shift phenomenon. Arthroscopy. 32:898–905. DOI: 10.1016/j.arthro.2015.08.038. PMID: 26524939.

98. Xu J, Han K, Lee TQ, et al. 2022; Anterolateral structure reconstruction similarly improves the stability and causes less over-constraint in anterior cruciate ligament-reconstructed knees compared with modified Lemaire lateral extra-articular tenodesis: a biomechanical study. Arthroscopy. 38:911–24. DOI: 10.1016/j.arthro.2021.06.023. PMID: 34358641.

Fig. 1
Anterior cruciate ligament consists of anteromedial (AM) and posterolateral (PL) bundles. (A) Sagittal view. (B) Coronal view.
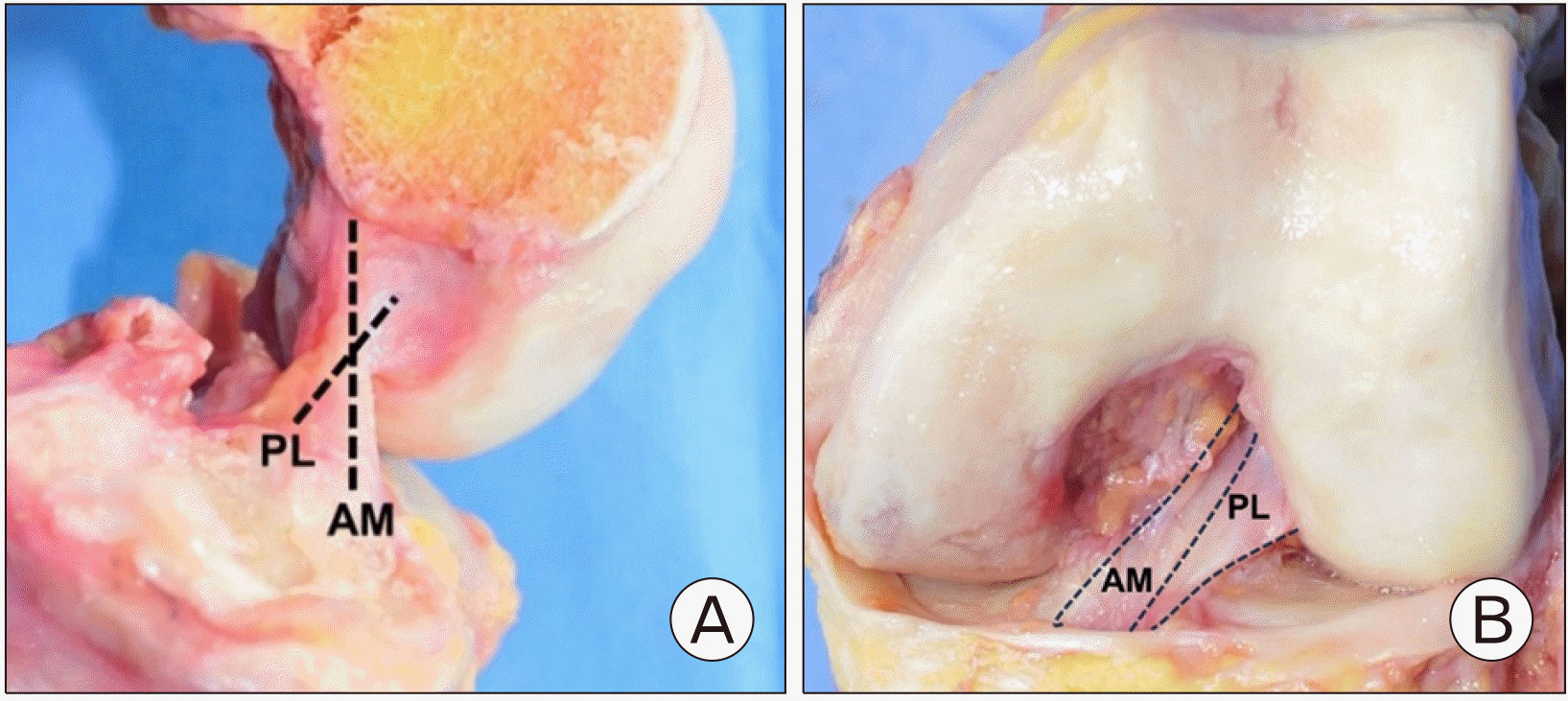
Fig. 2
Lateral wall of intercondylar notch showing lateral intercondylar ridge and lateral bifurcate ridge together with origins of anteromedial (AM) and posterolateral (PL) bundles.
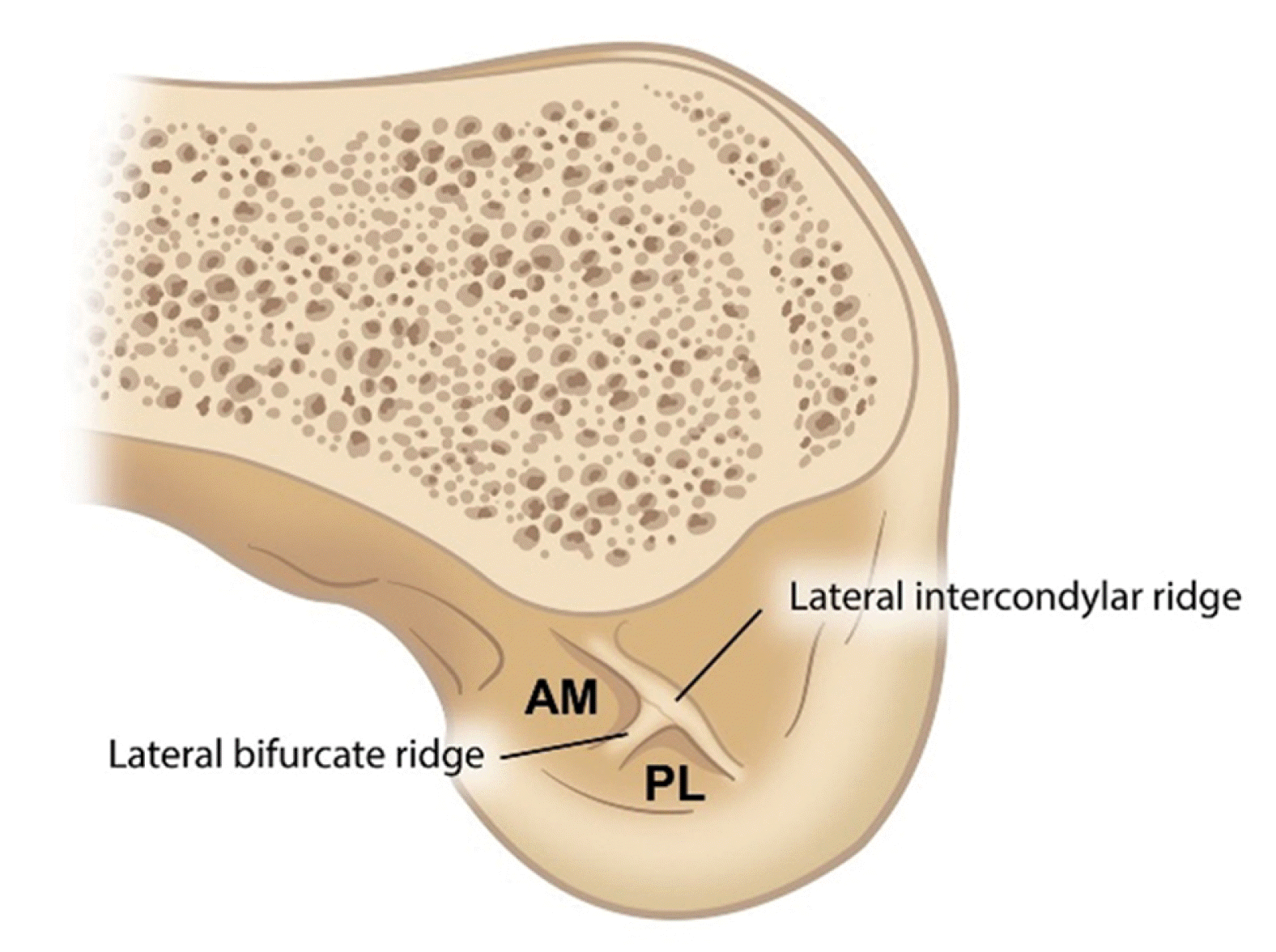
Fig. 3
Anterior cruciate ligament femoral footprint is divided into direct (shaded area) and indirect (dotted area) fibers.
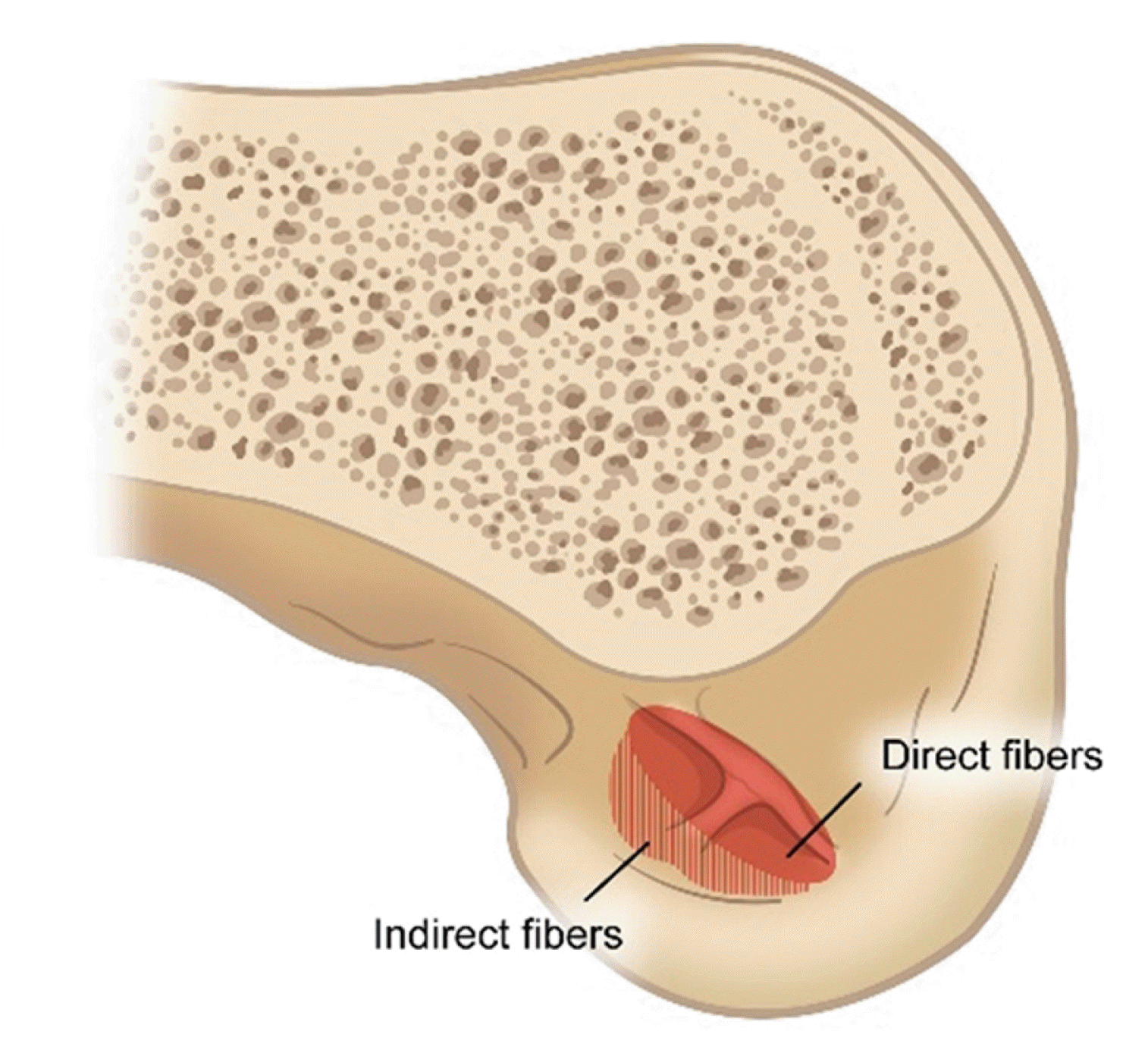
Fig. 4
(A) When the reamer passes over the bending point of the guide pin, the knee should be moved to extension. (B) After the reamer passes through the bending point of the guide pin, the knee is returned to a flexion position in order to avoid posterior wall blowout. Reprinted from Lee et al.32 (Arthrosc Tech 2017;6:e227-32) according to the Creative Commons License.
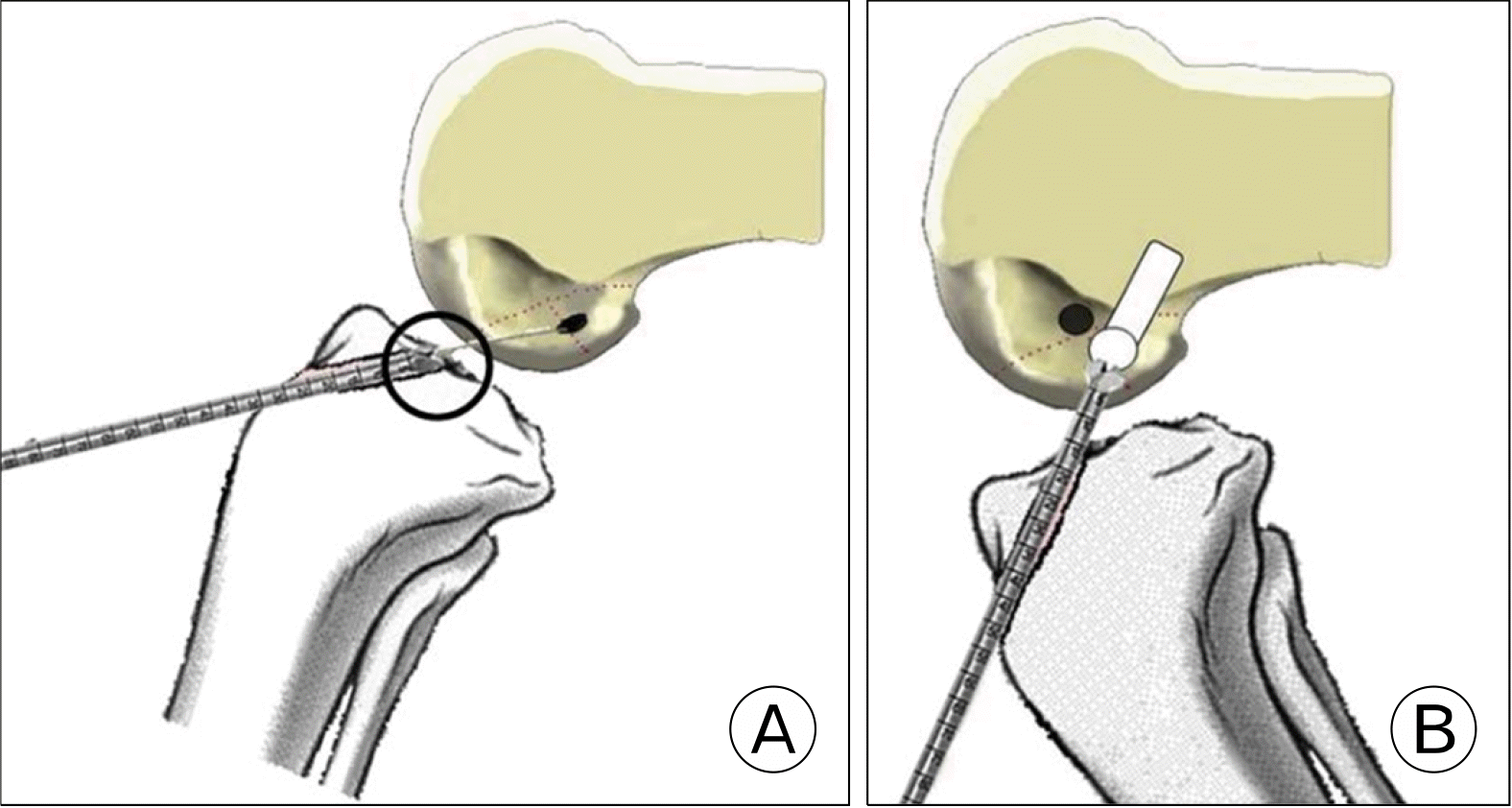
Fig. 6
(A) Flexible reamer (VersiTomic; Stryke). Reprinted with permission from Stryker. (B) Schematic illustration of transanteromedial portal method using flexible reamer system.

Fig. 10
The femoral tunnel position is presented using the quadrant method described by Bernard et al.47 (Am J Knee Surg 1997;10:14-22).
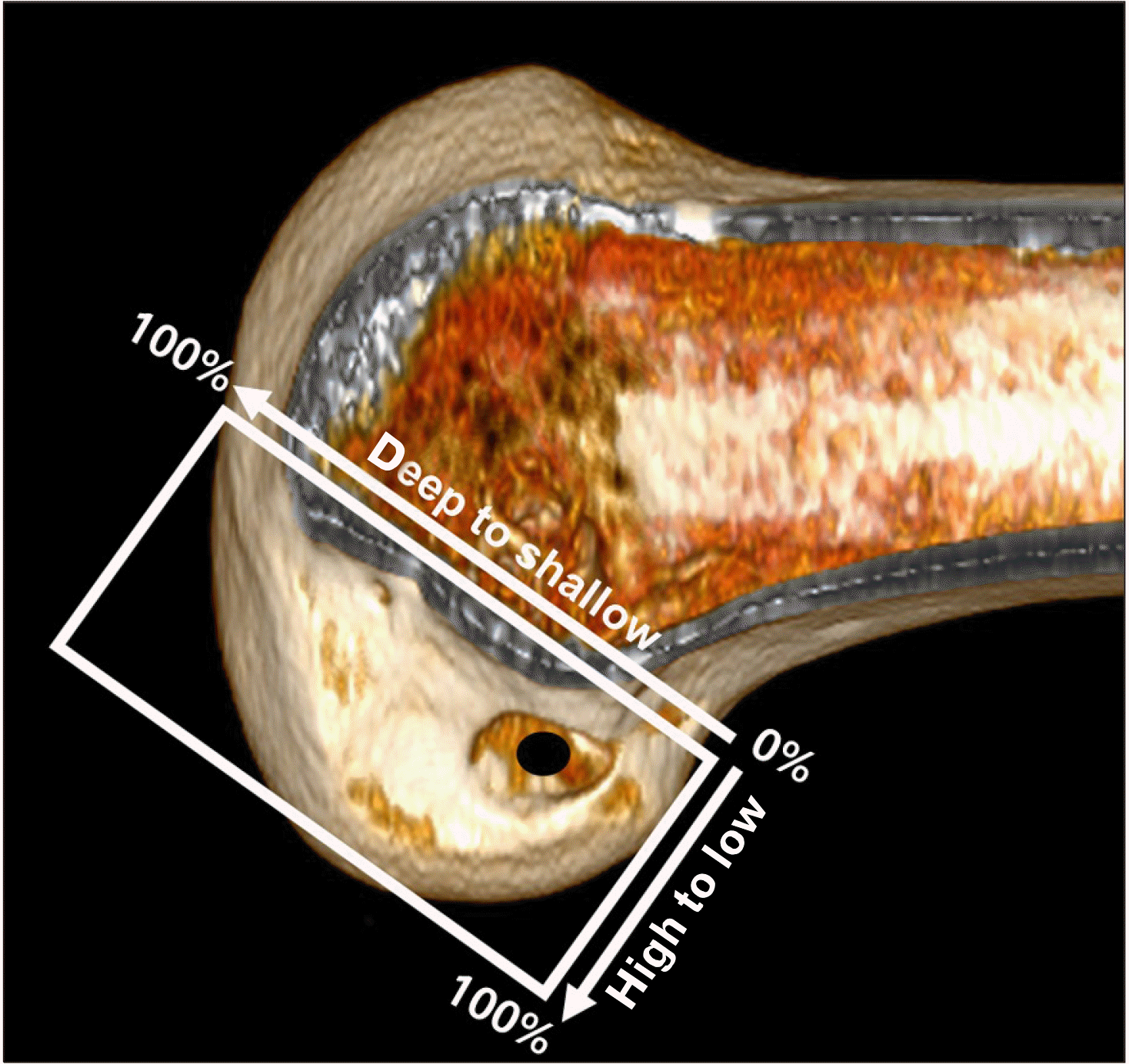
Fig. 13
Anatomical configuration of the anterolateral complex including anterolateral ligament (ALL) and superficial and deep layers of iliotibial band.
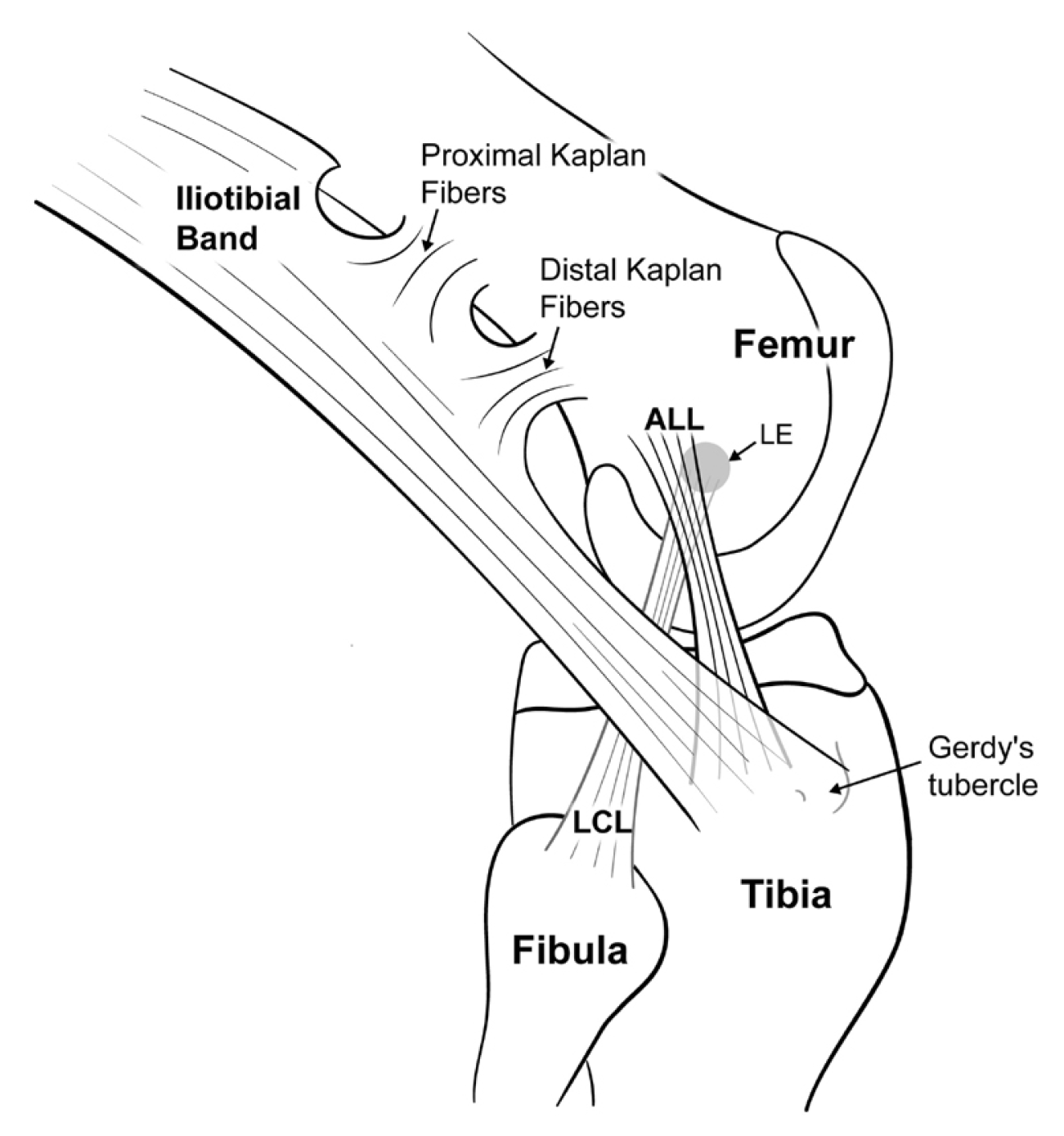
Fig. 14
Schematic illustration of the anterolateral ligament reconstruction. LCL, lateral collateral ligament.
Fig. 15
Lateral extraarticular tenodesis. (A) The iliotibial (IT) band is stripped and left attached distally to Gerdy’s tubercle. (B) Lemaire technique: the proximal strip of IT band is passed beneath the lateral collateral ligament (LCL). (C) Modified Andrews technique: the proximal strip of IT band is passed over the LCL.
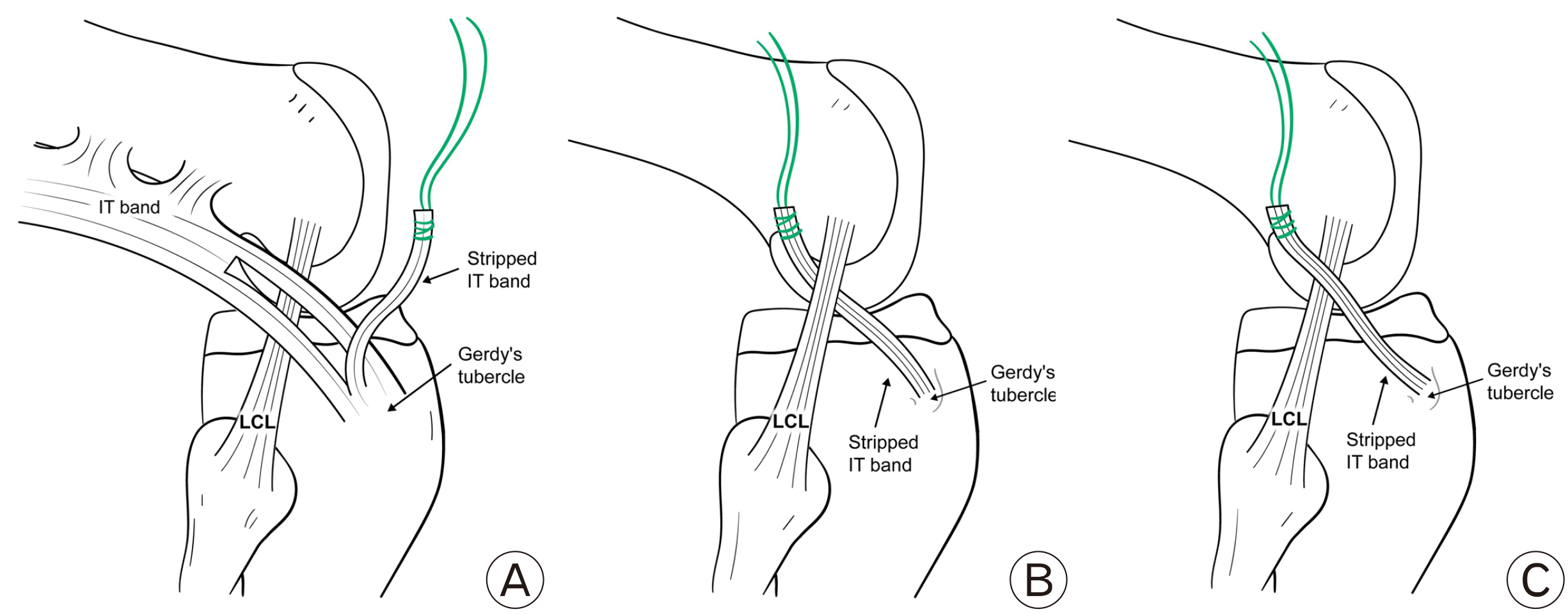
Table 1
Advantages and disadvantages of three techniques
Table 2
Anatomic anterior cruciate ligament (ACL) reconstruction scoring checklist
Reprinted from Fox et al.43 (J ISAKOS 2023;8:15-22) according to the Creative Commons License.
Table 3
Advantages and disadvantages of autografts
Table 4
Comparison of main characteristics of allografts and autografts




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download