서 론
제2형 당뇨병은 심혈관질환의 위험요소로, 이를 관리하기 위해 국제적으로 심각한 재정 손실을 야기하고 있다
1. 현재 미국의 경우 당뇨병 유병률이 10.5%에 달하며, 이 중 제2형 당뇨병이 90%에서 95%를 차지하고 있다
2. 국내에서 보고된 연구 결과에 따르면 당뇨병 유병률은 남자 12.8%, 여자 7.8%였으며, 만 19세 이상의 당뇨병 유병률은 13.6%로 2012년(9.7%)부터 점차 증가하고 있는 추세이다. 특히 65세 이상 노인의 경우 3명 중 1명이 당뇨병을 진단받았다. 당뇨병에 대한 치료율은 62.4%로, 과거에 비해 치료율이 개선되었음을 보고하였다
3. 이렇듯 당뇨병은 전 세계적으로 만연한 상태이며, 전 세계적으로 총 63만 명에 달하는 사람이 당뇨병으로 인해 관리가 필요한 상황이다
4.
당뇨병 관리 방법 중 하나로 규칙적인 근력운동 수행은 높은 근력을 유지시키는 것으로 알려져 있는데
5, 근력은 나이, 비만, 낮은 신체활동, 신장질환, 염증성 사이토카인 등과 연관하여 당뇨를 포함한 대사성 질환 발생과 밀접한 연관성을 가지고 있음을 보고하였다
6. 실제로 상지 근력을 대표하는 악력은 현재 체력 상태를 반영하며 반복적인 운동 참여 시 당뇨병 위험 정도를 확인할 수 있는 마커로 사용되어 왔고
7, 절대 악력에 신체 비중을 보정한 상대 악력(relative grip strength, RGS)의 경우 절대 악력보다 질병 상태를 예측하는 데에 탁월하다고 보고된 바 있다
8. 선행 연구에 따르면 절대 악력은 대상자의 체중과 정적 상관관계가 있어 절대 악력의 증가로 인해 대사성 질환의 위험이 오히려 증가할 수 있고, 반면 절대 악력을 체질량으로 나눈 RGS는 비만과 부적 상관관계를 갖기 때문에 RGS의 증가가 당뇨와 같은 대사질환의 위험 감소와 밀접한 연관성을 가지고 있음을 확인할 수 있었다
9.
현재까지 근력과 당뇨병의 연관성에 대한 연구는 다수 진행되어 왔다. 최근 국내에서 진행된 안정시 심박수(resting heart rate, RHR), RGS와 당뇨병 유병률의 연관성을 확인한 연구에서 높은 RHR과 낮은 RGS가 당뇨병 위험을 높인다는 것을 확인하였으나, 연구가 65세 이상 노인을 대상으로 하였고 횡단 연구로 진행되었기 때문에 RHR, RGS와 당뇨병 위험 간의 인과관계를 확인할 수 없었음을 제한점으로 시사하였다
10. 또한 22개의 당뇨병과 심폐체력 관련 연구와 13개의 당뇨병과 근력 관련 메타 분석연구 결과에 따르면, 미래의 연구 주제로서 당뇨병 위험과 연관된 심폐체력과 근력의 시너지 효과를 확인해야 함을 강조하였다
11. 따라서 본 연구에서는 종단 데이터를 통해 RGS 수준과 당뇨병 발생위험의 독립적인 연관성을 확인하고, RGS와 RHR의 상호작용이 당뇨병 발생에 어떠한 연관성을 가지는지 확인하고자 한다.
Go to :

결 과
본 연구에서의 인구통계적 특성은
Table 1에 제시하였다. RGS가 낮은 군의 경우 RGS가 높은 군에 비해 제지방량, 사구체여과율, 현재 음주 비율, 규칙적인 운동 참여 비율, BMI가 낮았고 연령, hs-CRP 수준, 저소득 비율이 높은 것으로 확인할 수 있었다. 하지만 현재 흡연 비율, RHR에 대한 군 간 차이는 통계적으로 유의한 결과를 확인할 수 없었다.
Table 1
Baseline characteristics of study participants
|
Characteristic |
RGS |
p-value |
|
Low |
Middle |
High |
|
No. of patients |
634 |
641 |
660 |
|
|
RGS range (kg/BMI) |
|
|
|
|
|
Male |
0.63−1.34 |
1.34−1.65 |
1.65−2.69 |
- |
|
Female |
0.20−0.73 |
0.73−0.90 |
0.90−1.80 |
- |
|
Age (yr) |
69.53±7.58 |
65.27±7.70 |
60.92±6.95 |
<0.001 |
|
Lean body mass (kg) |
38.88±7.46 |
40.45±7.93 |
41.58±8.01 |
<0.001 |
|
Income status, <1 million KRW |
65.62 |
47.27 |
30.61 |
<0.001 |
|
eGFR (mL/min/1.73m2) |
92.35±22.72 |
96.99±20.73 |
96.79±20.22 |
<0.001 |
|
hs-CRP (mg/dL) |
1.91±3.71 |
1.30±3.39 |
1.33±4.25 |
0.007 |
|
HOMA-IR |
2.10±1.19 |
1.97±0.93 |
1.72±0.71 |
<0.001 |
|
Alcohol consumption (%) |
|
|
|
|
|
None |
54.10 |
52.42 |
49.85 |
0.011 |
|
Former |
9.78 |
8.27 |
4.85 |
|
Current |
36.12 |
39.31 |
45.30 |
|
Smoking status (%) |
|
|
|
|
|
None |
65.93 |
67.55 |
67.27 |
0.204 |
|
Former |
24.45 |
20.90 |
16.82 |
|
Current |
9.62 |
11.54 |
15.91 |
|
Exercise participation (%) |
|
|
|
|
|
None |
77.29 |
70.83 |
61.97 |
<0.001 |
|
Regular |
22.71 |
29.17 |
38.03 |
|
Body mass index (kg/m2) |
25.39±3.40 |
24.24±2.92 |
22.89±2.67 |
<0.001 |
|
Waist circumference (cm) |
91.92±8.86 |
88.73±8.03 |
84.98±7.77 |
<0.001 |
|
Resting heart rate (%) |
61.12±7.79 |
61.12±7.04 |
60.96±7.30 |
0.682 |

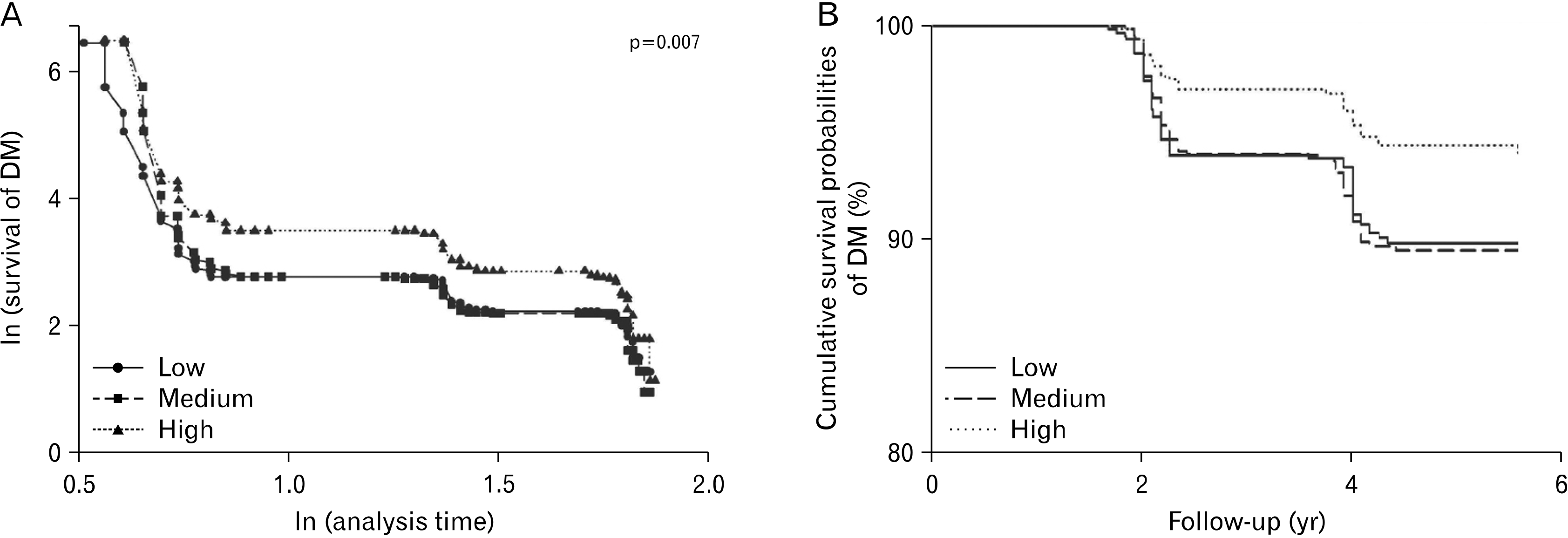
RGS 수준별 당뇨병 발생의 비례위험 가정을 위한 로그 순위 검정 결과와 Kaplan-Meier 생존 곡선 결과는
Fig. 1에 제시하였다. 먼저
Fig. 1A에서 RGS가 높은 군은 시점에 상관없이 당뇨병 발생에 대한 곡선이 다른 군들과 교차하지 않는 것을 확인할 수 있었다(p=0.007).
Fig. 1B에서 RGS가 중간이거나 낮은 군은 4년 후 당뇨병이 발생하지 않는 비율이 90% 미만으로 떨어졌으나, RGS가 높은 군은 RGS가 중간이거나 낮은 군에 비해 당뇨병이 발생하지 않는 비율이 여전히 높은 것을 확인할 수 있었다.
RGS와 당뇨병 발생의 연관성에 대한 결과는
Table 2에 제시하였다. RGS 수준별 1,000명당 발생률은 낮은 RGS군은 23.12명, 중간 RGS군은 23.96명, 높은 RGS군은 14.96명으로, 높은 RGS 수준은 낮거나 중간 수준에 비해 1,000명당 발생률이 낮음을 확인할 수 있었다. 또한 당뇨병 발생과 RGS에 영향을 미치는 다양한 혼란 변인을 보정한 model 1에서 RGS가 높은 군은 RGS가 낮은 군에 비해 당뇨병 발생위험이 46% 감소하였고(HR, 0.54; 95% CI, 0.36–0.80), model 1에 RHR을 추가 보정한 model 2에서도 같은 결과를 확인할 수 있었다(HR, 0.54; 95% CI, 0.36–0.80). 하지만 model 2에 허리둘레를 추가 보정한 model 3에서는 통계적으로 유의한 결과를 확인할 수 없었다.
Table 2
Incidence density and HR of DM according to RGS
|
Characteristic |
DM (n=1,935) |
Person-year |
Incidence density* (95% CI) |
HR (95% CI) |
|
Model 1 |
Model 2 |
Model 3 |
|
RGS (kg/BMI) |
|
|
|
|
|
|
|
Low |
71 |
3,069.97 |
23.12 (18.32−29.18) |
1.00 (Reference) |
1.00 (Reference) |
1.00 (Reference) |
|
Middle |
79 |
3,296.16 |
23.96 (19.22−29.88) |
0.96 (0.68−1.35) |
0.96 (0.68−1.35) |
1.16 (0.81−1.65) |
|
High |
53 |
3,541.86 |
14.96 (11.43−19.58) |
0.54 (0.36−0.80) |
0.54 (0.36−0.80) |
0.78 (0.51−1.20) |
|
p for trend |
|
|
|
0.002 |
0.002 |
0.282 |

RHR 수준에 따른 RGS와 당뇨병 발생의 연관성에 대한 결과는
Table 3에 제시하였다. 먼저 RHR이 낮은 군의 경우 당뇨병 발생과 RGS에 영향을 미치는 다양한 혼란 변인을 보정한 결과, 높은 RGS는 낮은 RGS에 비해 당뇨병 발생위험이 60% 감소하는 것을 확인할 수 있었다(HR, 0.40; 95% CI, 0.20–0.83). 하지만 RHR이 높은 군의 경우 RGS와 당뇨병 발생위험 사이의 통계적으로 유의한 연관성을 확인할 수 없었다.
Table 3
Association of RGS with DM by RHR level
|
Characteristic |
Total |
RHR (beats/min) |
|
Low (40−59) |
High (60−98) |
|
No. of patients |
1,935 |
662 |
1,273 |
|
RGS (kg/BMI) |
|
|
|
|
Low |
1.00 (Reference) |
1.00 (Reference) |
1.00 (Reference) |
|
Middle |
0.96 (0.68−1.35) |
1.15 (0.65−2.03) |
0.91 (0.59−1.39) |
|
High |
0.54 (0.36−0.80) |
0.40 (0.20−0.83) |
0.62 (0.38−1.00) |
|
p for trend |
0.002 |
0.014 |
0.050 |

RGS와 RHR의 상호작용에 대한 당뇨병 발생위험과의 연관성은
Fig. 2에 제시하였다. RHR이 높고 RGS가 낮은 군과 비교했을 때, RHR이 낮고 RGS가 낮은 군과 RHR이 낮고 RGS가 높은 군에서 당뇨병 발생위험이 각각 36% (HR, 0.64; 95% CI, 0.45–0.92), 40% (HR, 0.60; 95% CI, 0.39–0.94) 감소하는 결과를 확인할 수 있었다. 특히 RHR이 낮은 군에서 높은 RGS는 낮은 RGS보다 당뇨병 발생위험이 더 크게 감소하였다.
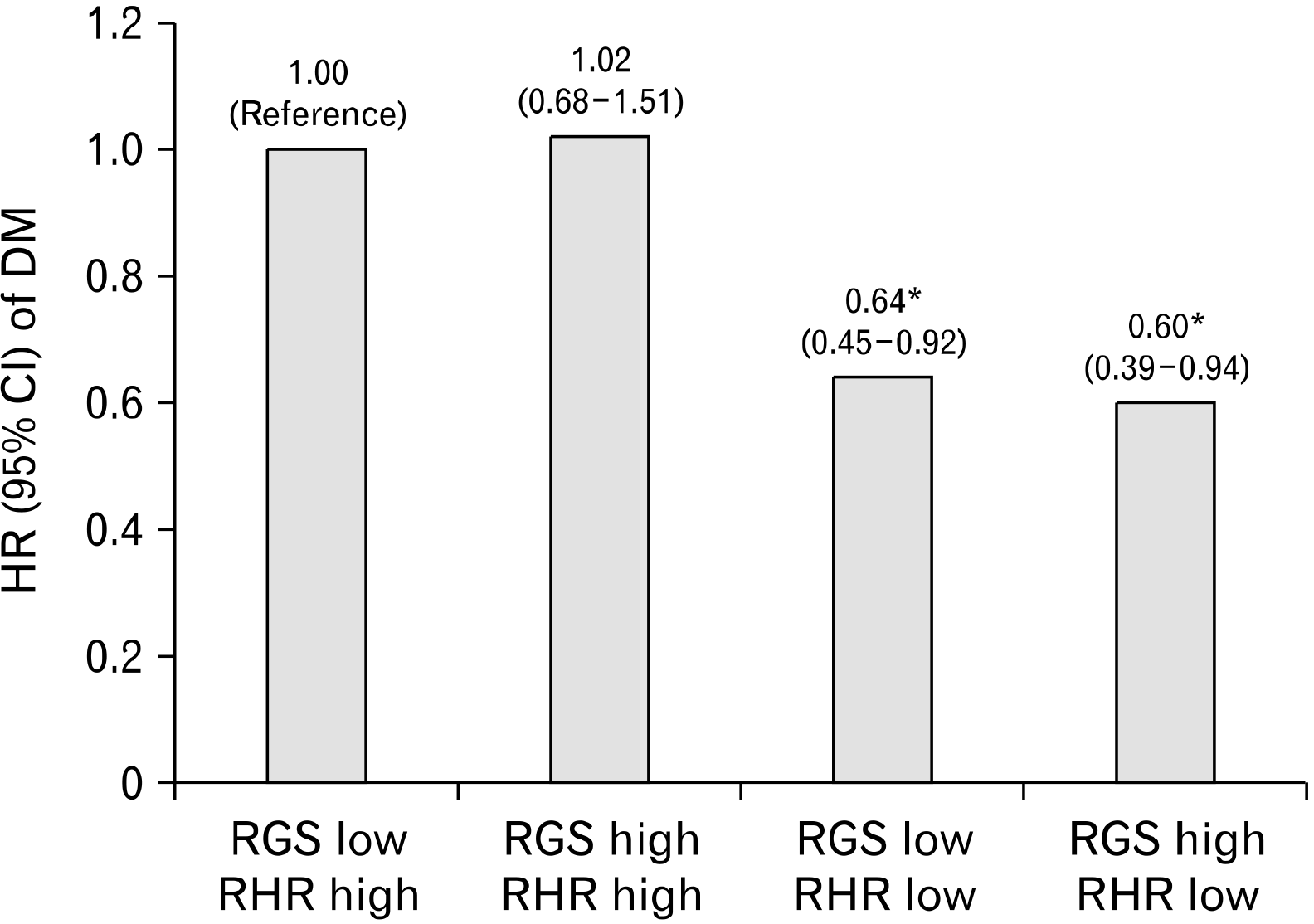 | Fig. 2
Multivariable-adjusted hazard ratios (HRs) for developing diabetes mellitus (DM) for joint association between relative grip strength (RGS) and resting heart rate (RHR). Multivariable adjusted age, sex, estimated glomerular filtration rate, high-sensitivity C-reactive protein, lean body mass, alcohol intake, smoking status, income status, HOMA-IR, and exercise participation. HOMA-IR, homeostatic model assessment for insulin resistance.
*p<0.05.

|
Go to :

고 찰
본 연구에서는 RGS와 당뇨병 발생에 미치는 여러 요인들과 RHR을 보정했음에도 불구하고, 높은 RGS는 당뇨병 발생위험을 감소시켰으나, 추가적으로 허리둘레를 보정했을 때 RGS와 당뇨병 발생위험의 유의한 연관성이 나타나지 않는 것을 확인하였다. RHR이 낮은 군에서 높은 RGS는 당뇨병 발생위험을 감소시켰고, 추가적으로 RGS 수준과 관계없이 낮은 RHR은 당뇨병 발생위험 감소와 밀접하게 연관되어 있었으며, RHR이 낮은 군 내에서 높은 RGS는 낮은 RGS보다 당뇨병 발생위험을 더 크게 감소시키는 것을 확인할 수 있었다.
근육량과 독립적으로, 근력은 이동성, 기능적 상태, 사망률과 밀접한 연관이 있음을 보고한 바 있으며 따라서 상대 근력과 같은 근육의 기능적 능력이 노화로 인한 근감소증을 예측할 수 있는 지표로 고려되고 있다
15. 특히 근력의 감소는 노인에 있어서 중요한 건강지표로 근감소증, 관상동맥질환, 낙상, 사망률을 증가시키며, 나이가 증가함에 따라 계속 감소하기 때문에 노인을 위한 표준화된 근력 측정을 권고하고 있다
16. 높은 악력 수준은 허리둘레, 체지방량, 심장질환으로 인한 사망위험을 줄이는 것으로 보고한 바 있다. 특히 신체 밀도를 보정한 RGS는 대사질환과 연관되어 있었으며
17, 이러한 RGS의 증가는 혈당 조절과 연관된 인슐린 저항성을 줄여, 제2형 당뇨병, 대사증후군, 심혈관질환의 발생을 감소시킬 수 있음을 시사하였다
18. 현재까지 진행된 근력과 당뇨병의 연관성에 대한 연구 결과에 따르면, 반복적인 저항운동을 통한 근육의 질(muscle quality, MQ) 개선은 근육내 혈당 대사를 향상시키며
19, 5개의 당뇨병 관련 연구를 메타 분석한 선행연구에서는 근력을 증진하는 활동에 주 2회 이상 참여할 경우 전혀 참여하지 않았을 때보다 당뇨병 발생률이 17% 감소하는 것을 확인할 수 있었다(relative risk, 0.83; 95% CI, 0.77–0.89; p<0.001). 또 다른 연구에서는 근력을 증진하는 활동이 주당 10분 증가할 때마다 당뇨병 발생위험이 점차 감소하였으며, 주당 60분 이후부터 조금 더딘 감소를 확인할 수 있었다
20. RGS, RHR과 당뇨병과의 연관성에 대한 선행연구에서는 RHR이 가장 높고 RGS가 가장 낮은 군이 RHR이 가장 낮고 RGS가 가장 높은 군보다 당뇨병 유병 위험이 남성의 경우 4.23배(odds ratio [OR], 4.23; 95% CI, 2.74–6.54), 여성의 경우 2.90배(OR, 2.90; 95% CI, 1.98–4.23) 증가한 것을 확인할 수 있었다
10.
RGS와 당뇨병 발생 억제에 관한 기전은 명확하지 않으나, 높은 근력 수준을 가진 사람은 신체적으로 활동적인 상태를 가지고 있기 때문에
21 높은 활동 수준에 따른 근수축 빈도 증가는 당뇨병과 밀접한 연관성을 가진 인슐린 저항성을 개선하고, 혈당 운반 능력 향상에 중요한 역할을 담당하고 있는 것으로 보고한 바 있다
22. 본 연구에서도 높은 RGS군은 낮은 RGS군에 비해 규칙적인 운동에 15.32% 더 많이 참여하였고, 이는 높은 RGS 수준이 높은 활동수준을 의미하는 선행연구의 결과와 일치한다
22.
Table 2에서 높은 RGS 수준이 RHR과 독립적으로 당뇨병 발생위험을 감소시켰으나, 허리둘레를 보정했을 때 RGS와 당뇨병 발생위험의 연관성이 사라지는 이유는 근육내 지방 감소에 매개하여 높은 MQ가 인슐린 저항성을 개선할 수 있기 때문으로 생각된다. MQ는 근육량 단위당 근력을 의미하며, 주로 상대 근력을 통해 측정하여 스포츠 현장이나 실험실 내에서 수행을 평가하기에 적합함을 시사하였다
23. 선행연구에 따르면 좋은 MQ를 가진 군은 근육량이 적어도 좋은 근력을 생산할 수 있는 능력을 가지고 있음을 보고한 바 있고, 반대로 낮은 MQ를 가진 군의 경우 상대적으로 무거운 체중으로 인해 높은 제지방량을 가지고 있음에도 근육 내 지방이 과다하게 축적되어 있기 때문에 낮은 근력 및 인슐린 저항성 증가와 연관되어 있음을 시사하였다
23. 실제로 당뇨병 환자를 대상으로 16주간 고강도 상하지 근력 트레이닝을 실시했을 때 향상된 근육량과 MQ가 관찰되었으며, 이는 인슐린 민감성에 긍정적인 영향을 제공했음을 보고하였다
24. 허리둘레는 BMI나 체지방률과 같은 비만요소들보다 고혈압, 당뇨병, 고지혈증 등의 심혈관질환 위험요소 예측에 더 효과적이며, 근감소성 비만과 밀접한 연관성이 있음을 보고하였다
25.
본 연구에서의 RGS 수준별 HOMA-IR은 선행연구 결과와 같이 낮은 RGS군(2.10±1.19)보다 높은 RGS군(1.72±0.71)에서 더 낮은 것을 확인할 수 있었고
23, RHR은 RGS 수준별 유의한 차이가 나타나지 않았으나(p=0.682) 허리둘레에서는 통계적으로 유의한 차이(p<0.001)가 있었기 때문에, RGS 수준과 허리둘레는 근감소성 비만(sarcopenic obesity) 측면에서 밀접한 연관성이 있는 것을 확인할 수 있었다. 따라서 높은 MQ로 인한 RGS 증가는 근육내 지방 축적이 감소된 상태로서
23, 높은 MQ가 인슐린 저항성을 개선하여
24 혈당 감소에 긍정적인 영향을 미칠 것으로 생각된다
19.
Table 3에서 RHR이 낮은 군에서 RGS가 높으면 당뇨병 발생위험이 유의하게 감소했으나 RHR이 높은 군에서는 유의한 결과를 확인할 수 없었던 이유는 교감신경계의 활성화가 RGS 증가보다 당뇨병 발생위험에 더 큰 영향을 제공하기 때문으로 생각된다. 선행연구에 따르면 RHR은 교감신경계 활동에 대한 지표로 활용되고 있으며
26, 증가된 교감신경계 활동은 인슐린 저항성을 증가하는 원인이 된다고 하였다
27. 이는 교감신경 자극으로 인한 혈관 수축이 근육 혈류량 감소를 유발하며 그 결과 근육 내 혈당 유입 결손이 나타나는 것으로 보고하였다
28. 또한 다른 선행연구에 따르면 교감신경계의 활성화는 당뇨병 위험을 증가시키는 것으로 보고하였으며, 결국 높은 RHR은 교감신경계 활성화에 대한 지표로서 당뇨병 발생위험과 연관되어 있음을 시사하였다
27. 따라서 높은 RGS으로 인한 당뇨병 발생위험 감소 효과보다 교감신경계 활성화에 대한 지표로
26 높은 RHR이 당뇨병 발생위험 증가에 더 크게 작용하기 때문으로 생각된다
27.
Fig. 2에서 높은 RHR과 낮은 악력을 가진 군과 비교했을 때, 낮은 RHR과 낮은 RGS를 가진 군보다 낮은 RHR과 높은 RGS를 가진 군에서 더 큰 감소가 나타나는 이유는 심폐체력과 근력 증가의 상호작용 효과 때문으로 생각된다. 선행연구에서 제2형 당뇨병 환자를 대상으로 12주간 유산소 트레이닝, 저항성 트레이닝, 복합(유산소+저항) 트레이닝을 진행했을 때, 인슐린 민감성을 조절하는 omentin-1 수준은 복합 트레이닝을 진행했을 때에만 증가한 것을 확인하여, 유산소 트레이닝과 저항 트레이닝을 함께 진행하는 것이 단독 트레이닝보다 더 효율적으로 인슐린 민감성을 향상할 수 있음을 보고한 바 있다
29. 이러한 결과는 복합 트레이닝의 체지방 감소로 인한 효과가 단독으로 트레이닝을 진행한 것보다 더 크기 때문으로 보고하였으며
29, 다른 선행연구에서는 트레이닝 시 당뇨병을 유발하는 인슐린 저항성 감소에 내장지방의 감소가 매개되어 있음을 시사하였다
30. 따라서 근력의 지표로서 RGS 증가
7와 심폐체력의 지표로서 RHR의 감소
10는 각 체력 요소의 단독적인 증가보다 내장지방 감소와 매개된 인슐린 저항성 감소에 효과적이기 때문에 당뇨병 발생위험을 감소시킬 것으로 생각된다
29.
본 연구는 RGS 수준과 당뇨병 발생위험의 독립적인 연관성을 확인하고, RGS와 RHR의 상호작용에 대한 당뇨병 발생위험의 연관성을 비교 확인한 종단연구로서 의미가 있으나 몇 가지 한계점이 존재한다. 첫 번째, 당뇨병에 영향을 미치는 식이 변수를 보정할 수 없었다. 하지만 당뇨병에 영향을 미치는 흡연, 음주, 신체활동과 같은 생활습관과 HOMA-IR, hs-CRP, eGFR과 같은 혈액 변수를 보정함으로써 본 연구의 신뢰성을 높이고자 하였다. 추후 연구에서는 일일 음식섭취량, 신체활동 수준, 근육량 등 당뇨 발생에 원인이 되는 여러 혼란 변인들이 독립적으로 RGS와 당뇨병 발생에 대한 연관성에 어떠한 영향을 미치는지 확인이 필요하다. 두 번째, 본 연구에서는 대한민국 내 일부 지역에 거주하는 40세 이상의 성인을 대상자로 선정하였기 때문에, 본 연구의 결과로 대한민국을 대표하는 데에는 일반화의 오류가 존재한다. 추후 연구에서는 전 국민을 대상으로 한 코호트 연구에서 당뇨병과 RGS의 연관성을 비교 확인할 필요성이 있다. 세 번째, 상지 근력의 지표인 악력만으로 당뇨병과의 연관성을 확인했기 때문에 하지, 복부 등 다른 부위의 근력 수준과 당뇨병의 연관성을 확인할 수 없었다. 악력이 당뇨 발생에 영향을 주는 전체 골격근량을 대표하지는 못하기 때문에, 추후 연구에서는 하지, 상지, 몸통 근육 수준별로 당뇨병에 미치는 영향을 확인해 볼 필요가 있다. 네 번째, 당뇨병 발생위험을 확인하기 위한 기반조사에서 당뇨병 환자를 모두 제거하였기 때문에 대상자 선정에 편향성을 가지고 있고, RGS 수준별 당뇨 발생에 영향을 미치는 glucose, 당화혈색소의 연속적인 변화를 확인할 수 없었다. 따라서 추후 연구에서는 RGS 수준별 혈당, 당화혈색소와 같은 당뇨병 지표들의 시간에 따른 변화를 확인하는 것이 필요하다.
본 연구에서는 RGS가 체지방 축적에 매개하여 당뇨병 발생위험과 밀접한 연관성을 가지고 있으며, 낮은 RHR이 높은 RGS보다 당뇨병 발생위험 감소에 더 큰 영향을 미치는 것을 확인할 수 있었다. RGS는 절대 악력보다 질환을 더 잘 예측할 수 있는 지표로서, RHR과 함께 당뇨병 발생위험 예측에 유용한 척도들 중 하나가 될 수 있을 것으로 생각된다. 따라서 당뇨병 발생위험을 줄이기 위해 규칙적인 운동 참여를 통한 근력, 심폐체력의 증진을 독려하는 것이 중요하며, RGS 증가와 RHR 감소를 위한 국가 차원에서의 신체활동 프로그램을 장려할 필요성이 있다.
Go to :






 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download