Abstract
Background and Objectives
Recent guidelines from the Korean Thyroid Association have proposed a threshold of 6.8 mIU/L for diagnosing subclinical hypothyroidism based on local research findings. However, due to the lack of standardization/harmonization, thyroid-stimulating hormone (TSH) testing yields varying results across different reagent manufacturers. Hence, the use of uniform reference intervals is challenging. We aimed to establish assay-specific Korean reference interval for TSH.
Materials and Methods
We performed duplicate measurements on 100 serum samples with varying TSH concentrations (0-23 mIU/L) using eight different TSH reagents including Alinity I TSH (Abbott), Access TSH (Beckman Coulter), Elecsys TSH (Roche), TSH3UL (Siemens), TSH IRMA (Beckman Coulter), TSH1 RIA (Brahms), TSH IRMA TUBE II (Riakey), Turbo TSH IRMA (Izotop). Correlation and simple linear regression analyses were conducted among 8 reagents with Roche as the reference.
Results
The correlation coefficient for each reagent was notably high at 0.99. Through regression analysis, TSH values equivalent to the 6.8 mIU/L (Roche) were determined for each reagent as follows: Abbott 5.2 mIU/L, Beckman 6.5 mIU/L, Siemens 6.9 mIU/L, Beckman-Radioimmunoassay 7.4 mIU/L, Brahms 5.7 mIU/L, Riakey 5.3 mIU/L, Izotop 6.0 mIU/L.
TSH (thyroid stimulating hormone, 갑상선자극 호르몬)는 뇌하수체 호르몬으로, 인체의 갑상선기능을 유지하는 데 가장 중요한 역할을 한다.1) 대부분 임상권고안에서 갑상선기능을 평가하기 위해 첫 번째 시행해야 하는 검사로 TSH 측정을 권유하고 있으며, TSH 수치의 증가 또는 억제는 갑상선기능저하 및 항진증 진단의 중요한 단서가 된다.2-4) 혈중 TSH 결과는 기능성 갑상선질환 진단의 가장 중요한 지표이지만, 인종, 지역, 성별, 나이, 요오드 섭취량, 동반질환, 복용약물, 채취시간 및 측정시약의 차이(inter-assay difference) 등 다양한 인자에 따라 측정값이 차이 날 수 있다.5-7)
혈중 TSH의 참고구간은 일반적으로 해당 지역 내 기저 갑상선질환이 없는 건강인 집단에서 측정한 TSH 결과의 2.5th에서 97.5th 백분위수(percentile) 범위로 결정한다.2-4) 그간 우리나라에서 사용해온 TSH 참고구간(0.4-4.0 mIU/L)은 1990-2000년대 초반 미국과 유럽의 코호트 연구를 통해 제시된 기준이어서, 우리나라의 인종 및 높은 요오드섭취율을 반영하지 못한 제한점이 있었다. 이후 2017년 발표된 국민건강영양조사(이하 국건영) 연구에서 한국인의 TSH 참고구간을 0.6-6.8 mIU/L로 새롭게 제시하였고,8) 2023년 대한갑상선학회 무증상갑상선기능저하증 진료지침에서 이 기준을 새롭게 채택하였다.2)
2017년 국건영 연구는 6000명 이상이 포함된 대규모 코호트 연구로써 한국인의 TSH 결과 분포 특징과 정상 범위를 확인한 중요한 연구이다.8-10) 다만, 2017 국건영 연구에서 사용한 TSH 결과는 Roche diagnostics사의 TSH 시약만으로 측정된 것이었다. 다년 간의 국제적인 표준화 노력에도 불구하고,11-13) TSH 검사는 아직까지 검사방법이 완전히 표준화(standardization) 또는 일치화(harmonization)되지 않아서, 서로 다른 제조사의 시약으로 측정한 TSH 결과는 차이가 있다. 이에 2023 무증상갑상선기능저하증 진료지침에서도 새로운 한국인 TSH 참고구간을 제시함과 동시에, 검사 시약에 따라 TSH 결과가 다를 수 있음을 유의사항으로 언급한 바 있다.2,14) 특히 TSH 참고구간의 상한치(upper limit of reference interval)는 갑상선호르몬치료의 시작 여부를 결정하는 임상적으로 중요한 기준이므로 이번 연구를 통해서 시약별 한국인의 참고구간을 제시하여 임상현장에서 도움이 되고자 한다.
대한갑상선학회 진료지침제정위원회에서는 내분비내과, 진단검사의학과, 핵의학과 전문의가 포함된 “TSH 측정값 평가위원회”를 구성하였다. 회의를 통해, 2017년 국건영 연구에 사용된 Roche를 포함하여 국내에서 다빈도로 사용되고 있는 총 8개의 TSH 시약의 결과를 비교하기로 하였다(Table 1). 4개 시약은 화학발광면역측정법을 이용하여 측정하는 방식이며 Alinity I TSH (제조사 Abbott, 이하 Abbott), Access TSH (제조사 Beckman Coutler, 이하 Beckman), Elecsys TSH (제조사 Roche, 이하 Roche), TSH3UL (제조사 Siemens, 이하 Siemens)였다. 그 외 방사면역측정법을 이용하는 방식으로 TSH IRMA (제조사 Beckman Coulter, 이하 Beckman-RIA), TSH1 RIA (제조사 Brahms, 이하 Brahms), RIAKEY TSH IRMA TUBE II (제조사 신진메딕스, 이하 Riakey), Turbo TSH IRMA (제조사 Izotop, 이하 Izotop) 등 4개의 시약을 선정하였다. 공통비교대상이 되는 Roche 시약의 제조사에서 제시한 참고구간(reference interval)은 0.27-4.20 mIU/L이며, 측정가능범위(analytical measurement interval, AMI) 0.005-1000 mIU/L이다. Abbott와 Beckman의 제조사 참고구간은 0.38-5.33 mIU/L로 같았고, Siemens의 제조사 참고구간은 0.55-4.78 mIU/L, 그 외 Brahms, Izotop의 제조사 참고구간은 0.3-4.0 mIU/L였다. 시약들의 측정장비(instrument), 보정물질(calibrator), 측정가능범위 등은 Table 1에 제시하였다.
서울대학교병원에 임상진료 목적으로 TSH 검사가 의뢰되어 완료된 환자의 검체 가운데 보고된 결과값의 TSH 범위가 0-20 mIU/L인 잔여 혈액 검체 100개를 분석대상으로 하였다. 검체 이용에 대해서는 서울대학교병원 기관심의위원회로부터 심의면제 승인을 받았다. 검체를 Roche 시약을 이용하여 검사한 TSH 농도에 따라 분류해보면, TSH <1 mIU/L 미만의 검체는 10개, 1≤TSH<4 mIU/L 사이 구간의 검체는 28개, 4≤TSH<7 mIU/L는 24개, 7≤TSH<10 mIU/L는 14개, 10≤TSH<20 mIU/L는 23개, TSH≥20 이상의 검체는 1개였다. 가장 낮은 수치는 0.04 mIU/L, 가장 높은 수치는 23.4 mIU/L였다.
각 시약 간의 차이를 확인하기 위해 각기 다른 화학발광면역측정 시약을 사용하는 총 4개의 기관(서울대병원, 분당서울대병원, 은평성모병원, 강동성심병원)에 동일한 검체를 분주, 전달하여 검사를 시행하였으며 각 검체 당 2회씩 측정하고 평균값을 사용하였다. 운송 중 오류를 줄이기 위해 채혈한 검체를 냉매가 들어간 운송상자에 검체 rack holder를 설치하고 운송상자 안에 넣어 운송하였다.
화학발광면역측정은 서울대병원 진단검사의학과에서 Abbott 시약, 강동성심병원 진단검사의학과에서 Siemens 시약, 분당서울대병원 진단검사의학과에서 Roche 시약, 은평성모병원 진단검사의학과에서 Beckman 시약 검사를 시행하였다. 방사면역측정은 한 기관(서울대병원 핵의학검사실)에서 Beckman-RIA, Brahms, Riakey, Izotop에 대한 검사를 시행하였으며 각 시약을 사용하여 반응을 진행시킨 후, 동일한 감마카운터(Messiah Dream Gamma 10, 신진메딕스, 고양시, 대한민국)를 이용하여 방사선계수를 측정하였다.
Roche 시약과 비교하여 각각의 시약들에 대해서 상관분석과 단순선형 회귀분석을 실시하였다. 회귀분석은 Deming regression 방법을 적용하였다. 회귀분석을 통해 상관계수, 회귀방정식의 기울기와 절편 및 95% 신뢰구간을 구하였다. 국건영 연구의 Roche 시약으로 산출한 참고구간의 하한치 0.6, 상한치 6.8, 10.0 mIU/L를 의학적 의사결정점(medical decision point; MDP)으로 설정한 후 비교 대상 시약에서의 측정값 및 95% 신뢰구간을 추정하였다.
통계분석은 상용소프트웨어인 EP Evaluator (Colchester, VT, USA)를 이용하였다.
동일한 혈액에 대해 Roche를 비교대상으로 하여 나머지 7개의 시약에 대하여 상관분석을 실시하였으며 그 결과 상관계수(R)는 모두 0.99 이상을 보였다(Table 2). Roche로 측정한 TSH 값을 독립변수(x축)로, 각 시약들의 TSH 값을 종속변수(y축)로 Deming 회귀분석을 실시하였다(Fig. 1). Abbott로 측정한 결과값의 기울기가 0.748 (95% CI, 0.737-0.752)로 가장 낮았으며, Beckman-RIA의 기울기가 1.064 (95% CI, 1.044-1.083)로 가장 높았다. 그 외 시약들은 기울기 0.85에서 1.02의 범위에 있었으며 1에 근접한 결과를 보였다. 절편(Intercept)은 Riakey로 측정한 결과값에서 −0.3920 (95% CI, −0.4970 to −0.2869)으로 측정되었으나, 그 외 시약에서는 모두 −0.08에서 0.11 사이로 측정되어 0에 근접한 결과를 보였다(Table 2).
이러한 결과를 통해 Roche와 다른 시약들이 높은 상관관계를 보이고 일치도가 높음을 알 수 있었다. 그에 따라 각 시약들 간의 참고구간의 전이(transference)를 통하여 각 시약의 참고구간을 제시할 수 있을 것으로 생각되었다. Roche에서 TSH 1 mIU/L의 증가가 Abbott에서는 0.748, Beckman-RIA에서는 1.064 증가를 보였으므로, 각 시약들 간 참고구간의 전이를 계산할 때 Roche에 비해 Abbott의 TSH 결과값은 전반적으로 낮게, 반대로 Beckman-RIA 결과값은 전반적으로 높게 측정됨을 의미한다고 할 수 있다.
2017 국건영 연구에 근거하여, 2023 대한갑상선학회 무증상갑상선기능저하증 진료권고안에서 제시한 TSH 참고구간의 상한값은 6.8 mIU/L이다. 이에 따라 Roche 시약의 6.8 mIU/L에 해당하는 각 시약별 값을 추정하는 과정이 필요하였다. 또한 권고안에서 제시한 갑상선호르몬 치료가 필요한 중증 무증상갑상선기능저하증 진단 TSH 수치는 10.0 mIU/L이다. 임상적으로 치료를 결정하는 중요한 수치이므로 기준이 되는 Roche 시약과 다른 시약별 차이를 확인하는 과정도 필요하였다. 이에 따라 회귀 방정식을 적용하여 Roche에 6.8 mIU/L와 10 mIU/L에 해당하는 각 시약별 값을 추정하였다(Table 3).
무증상갑상선기능저하증의 진단기준인 6.8 mIU/L에 해당하는 각 시약별 추정치는 Abbott가 5.2 mIU/L, Riakey 5.3 mIU/L, Brahms 5.7 mIU/L로 낮게 측정되었다. 그에 반해 Beckman-RIA는 7.4 mIU/L로 가장 높게 측정되었으며, Siemens도 6.9 mIU/L로 높게 측정되었다. 무증상갑상선기능저하증의 치료에 기준으로 해당하는 TSH 10.0 mIU/L에 해당하는 각 시약별 추정치를 계산하였을 때, Abbott는 7.7 mIU/L, Beckman-RIA는 10.8 mIU/L로 측정되었다(Table 3). 권고안에서 제시한 TSH 하한 참고구간인 0.6 mIU/L에 해당하는 값의 각 시약별 추정치는 Abbott가 0.46 mIU/L로 다소 낮게 측정되었고, Beckman-RIA는 0.65 mIU/L로 측정되었다(Table 3). 하한값 기준치의 차이는 전체적으로 시약별 차이가 크지 않아 임상적 유의성은 적을 것으로 사료되었다.
이에 따라 Abbott, Beckman, Brahms, Riakey, Izotop 시약을 사용하는 기관에서는 무증상갑상선기능저하증 진단과 갑상선호르몬 치료를 결정하는 TSH 값을 더 낮게 설정해야 하며, Siemens, Beckman-RIA 시약을 사용하는 기관에서는 TSH 값을 더 높게 설정하여야 하겠다. 이러한 시약별 참고구간을 Table 3에 정리하였다.
이번 연구를 통하여 한국인의 TSH 참고구간을 서로 다른 제조사의 시약별로 제시할 수 있었다. 검사법의 참고구간은 해당 검사실에서 직접 설정하거나, 기존 연구 및 제조사의 참고구간을 검정하여 사용하거나, 또는 특정 시약으로 잘 설정된 참고구간을 전이하여 사용하는 세 가지 방법이 있다.15) 직접 설정법은 시간과 노력이 많이 필요하여 임상검사실에서 수행하기 어렵고 제조사의 참고구간을 검정해서 사용할 경우에는 해당 국가의 인종 차이를 반영하기 어렵다. 따라서 해당 국가의 인종에서 잘 설정된 참고구간을 임상검사실에서 사용하는 시약에 맞게 전이해서 사용하는 것이 좋은 대안이다. 참고구간 전이는 CALIPER (Canadian Laboratory Initiative on Pediatric Reference Intervals) 및 후속 연구를 통해서 잘 알려져 있다. CALIPER는 소아의 정확한 참고구간을 설정하기 위해 캐나다에서 이루어진 대규모 연구 프로젝트이다. 2012년 첫 연구 결과가 발표된 이후 현재까지 9700명 이상의 아동 및 청소년의 건강 정보와 혈액 검체를 수집하여 100개 이상의 검사항목에 대한 연령별 참고구간 데이터베이스를 구축하였다. 이후 Abbott, Beckman, Roche, Siemens 등 주요 제조사 시약으로 일련의 참고구간 전이 및 검증 연구를 수행하여 각 제조사별 참고구간 정보를 제공하고 있다.16-18) 우리는 Roche 시약으로 측정한 TSH 결과를 기반으로 CLSI (The Clinical and Laboratory Standards Institute) 가이드라인에 따라 잘 설정된 참고구간을 위 CALIPER 후속 연구들과 같이 시약간 회귀분석을 이용하여 한국에서 다수 사용되는 여러 제조사의 참고구간을 제시할 수 있었다.19)
그에 따라 임상적으로 중요한 검사 결과인 TSH 6.8 mIU/L와 10.0 mIU/L는 Abbott, Beckman-CLIA, Siemens, Beckman-RIA, Brahms, Riakey, Izotop에서 각각 5.2/7.7, 6.5/9.7, 6.9/10.2, 7.4/10.8, 5.7/8.3, 5.3/7.9, 6.0/8.9을 보였다. 이를 달리 해석하면 Abbott로 측정한 TSH 값이 6.8 mIU/L인 경우에는 무증상갑상선기능저하증 상태로 판단해야 하지만, Siemens로 측정한 값이 6.8 mIU/L인 경우에는 정상 갑상선상태로 판단해야 함을 의미한다. 또한 무증상갑상선기능저하증에서 갑상선호르몬 치료 결정 시 임상적으로 가장 먼저 염두에 두어야 할 점은 환자의 연령이나 TSH 변화 추이, 갑상선 자가항체 양성여부 등이지만, TSH 수치를 근거할 때는 각 제조사별로 차이를 고려할 필요가 있다. 즉, Abbott로 측정한 TSH 값이 10.0 mIU/L인 경우에는 갑상선호르몬치료를 적극적으로 계획할 수 있으나, Siemens나 Beckman-RIA로 측정한 결과가 10.0 mIU/L인 경우에는 투약을 서두르기보다 일단 추이를 관찰하는 것도 가능하다. 따라서 임상의사는 자신의 기관이 어떤 시약을 사용하여 TSH를 검사하는지 알고 있는 것이 좋고, 검사실에서는 시약별로 적절한 참고구간을 제공해야 한다. 이와 같은 시약별 측정값 차이는 기존의 TSH 참고구간인 0.4-4.0 mIU/L를 사용하던 때에도 마찬가지로 적용되었어야 하는 사안인데, 이번에 새로운 TSH 참고구간 제시와 함께 재고되었다고 볼 수 있다.
제조회사와 시약에 따른 TSH 차이는 이미 잘 알려져 있다.7,20,21) 영국의 연구진은 가장 많이 사용되는 시약으로 Roche와 Abbott의 TSH 수치를 비교하며, Roche의 TSH가 30±13%가 높다고 보고하였고,22) 다른 연구진도 Roche 시약을 사용하여 검사였을 때 Abbott로 검사했을 때보다 TSH가 40±15% 높기 때문에, Roche로 검사하였을 때 무증상갑상선기능저하증이 24.5% 더 진단될 수 있다고 강조하였다.23) 아시아에서도 TSH 결과값을 비교하고 분석한 연구들이 있다. 최근 일본에서는 갑상선질환이 없던 23,500명의 TSH 결과를 연령, 성별, 시약에 따라 분석하였다. TSH 수치는 여성이 전반적으로 높았으며, 연령에 따라 증가하는 양상을 보였다. Abbott, Siemens, Tosoh의 3가지 시약이 분석에 사용되었는데, 30대 여성을 기준으로 하였을 때 Siemens 시약의 TSH 중앙값은 1.5 mIU/L, 참고구간(2.5-97.5%)은 0.5-4.6 mIU/L였고, Abbott 시약의 TSH 중앙값은 1.27 mIU/L, 참고구간 0.39-3.81 mIU/L, Tosoh 시약의 TSH 중앙값은 1.46 mIU/L, 참고구간 0.48-3.68이었다.24) 이 연구에서도 시약종류에 따라 크게는 1.0 mIU/L까지 차이가 나는 것으로 보고하며 표준화가 시급하다고 하였다. 본 연구에서도 시약간 TSH의 참고범위는 TSH 상한치를 기준으로 하였을 때 Beckman-RIA, Siemens, Roche, Beckman-CLIA, Izotop, Riakey, Brahms, Abbott 순으로 낮아진다. 기존 보고들에서도 Abbott는 다른 시약에 비해 전반적으로 낮게 측정되고 있는데, 본 연구에서도 Abbott는 Roche에 비해 25.2% 낮게 측정되어 기존 보고들과 유사한 결과를 보였다. 가장 보편적으로 많이 사용되는 시약이 Roche와 Abbott인 것을 고려하면 두 시약의 TSH 차이는 큰 임상적인 의미를 가진다. 무증상갑상선기능저하증의 진단율에도 차이를 가져올 수 있으며, 갑상선호르몬 치료에도 차이가 발생할 수 있다. 최근에 영국에서 국가보건데이터를 이용하여 111개의 TSH 검사기관의 수치를 비교하면서 각 기관에 따른 갑상선호르몬 치료비율을 분석한 연구를 발표하였는데, 놀랍게도 같은 지역임에도 불구하고 TSH의 참고구간이 달랐고, 그에 따라 갑상선호르몬 치료비율이 달랐다. 즉 Roche를 사용하는 기관에서는 TSH가 높게 측정되어 Abbott를 사용하는 기관보다 더 많은 갑상선기능저하증을 진단하고 더 많은 갑상선호르몬 치료를 하고 있었다.25) 이는 시약 간의 차이가 실제 임상적인 진단과 치료에서도 영향을 주고 있음이 증명된 것으로 검사의 표준화가 시급하다고 생각된다.
TSH 검사 결과가 제조사 간 또는 시약 간에 차이가 나는 이유는 그간 많은 노력에도 불구하고 검사법이 아직 표준화 또는 일치화되지 못했기 때문이다.13,26,27) 앞으로도 지속적으로 검사법의 일치화 노력을 해야겠지만 완전히 일치화 되기 전까지는 assay-specific 참고구간을 사용하는 것이 필요하며, 검사법 간 차이에 대해서도 잘 알고 있는 것이 필요하다. 또한 향후 일치화된 검사 결과를 위해서 검사실에서 표준물질(reference material)을 기반으로 한 시약을 사용하는 노력도 기울여야 하겠다.
본 연구는 몇 가지 제한점을 가지고 있다. 연구의 검체 수가 적기 때문에 이 결과만으로 시약 간의 변환값을 정확히 예측한다고 할 수 없다. 또한 같은 제조사 내에서도 제조번호에 따라서도 값이 달라질 수 있는데, 이번 연구에서는 각 검사법별로 한 개의 제조번호만을 이용하였기에 제조번호 간 차이를 반영하지 못하였다. 또한 이번 연구에 사용한 방법이 해당 제조사의 검사법을 대표한다고 볼 수도 없다. 그러나, 각 기관 간에 검사 결과를 불가피하게 비교하여야 할 경우 유효한 참고자료로 활용할 수 있을 것이다. 다만 각 기관 간 검사값의 차이는 시약의 고유 특성에 의해 영향을 받기도 하지만 제조단위 및 검사실 특성과 같은 다른 여러 요인에 의해서도 영향을 받을 수 있으므로, 각 기관의 정도관리 자료를 지속적으로 모니터링할 필요가 있다. 그 이외에도 검체 환자들의 임상적 정보가 부족하여 갑상선 자가면역 항체 여부 등에 대해 반영하지 못했다는 점도 있고, 갑상선기능검사 중 TSH만 다뤘다는 점도 제한점이다. TSH 뿐 아니라 free T4, free T3, thyroglobulin 검사들도 TSH와 마찬가지로 검사법이 표준화되어 있지 않아서 제조사 간 또는 시약 간 결과에 차이가 있을 수 있다.28) 향후에는 이들 검사에 대해서도 assay-specific 한국인 참고구간을 제시할 수 있도록 추가 연구가 필요하겠다.
이러한 문제점들을 극복하기 위해 전 세계적으로 갑상선기능 표준화 위원회(IFCC committee for Standardization of Thyroid Function Tests, C-STFT)가 조직되어 있으며 위원회에서는 TSH의 표준화를 위한 참조 시스템을 구축하기 위해 노력하고 있다. 이러한 시스템이 정립되도록 각 나라들과 협력하고 있는데, 미국 질병통제 예방센터는 공식 표준화 프로그램을 시작하였으며, 일본에서도 국가 기관이 TSH의 표준화를 위해 직접 나서고 있다. 우리나라도 이러한 일련의 노력들이 같이 필요할 것으로 보인다.11-13)
결론적으로, 본 연구를 통하여 국내에서 사용되는 여러 시약 간의 차이값이 존재함을 확인하고 이를 고려하여 한국인의 참고구간을 제시하였다. TSH 값은 갑상선기능질환 치료에 매우 중요하게 사용되는 지표이므로 임상적으로 중요한 판단을 할 때에는 환자 개개인의 상황과 검사법의 종류 및 한계 등을 종합적으로 고려해야 한다.
중심 단어: 갑상선자극 호르몬, 검사 시약, 무증상갑상선기능저하증, 참고구간.
References
1. Braverman LE, Kopp PA. 2021. Werner & Ingbar's the thyroid. Wolters Kluwer;Philadelphia, PA, USA:
2. Chung HK, Ku EJ, Yoo WS, Kang YE, Kim KJ, Kim BH, et al. 2023; 2023 Korean Thyroid Association management guidelines for patients with subclinical hypothyroidism. Int J Thyroidol. 16(1):32–50. DOI: 10.11106/ijt.2023.16.1.32.

3. Jonklaas J, Bianco AC, Bauer AJ, Burman KD, Cappola AR, Celi FS, et al. 2014; Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 24(12):1670–751. DOI: 10.1089/thy.2014.0028. PMID: 25266247. PMCID: PMC4267409.

4. Pearce SH, Brabant G, Duntas LH, Monzani F, Peeters RP, Razvi S, et al. 2013; 2013 ETA guideline: management of subclinical hypothyroidism. Eur Thyroid J. 2(4):215–28. DOI: 10.1159/000356507. PMID: 24783053. PMCID: PMC3923601.

5. Asvold BO, Bjoro T, Vatten LJ. 2009; Association of serum TSH with high body mass differs between smokers and never-smokers. J Clin Endocrinol Metab. 94(12):5023–7. DOI: 10.1210/jc.2009-1180. PMID: 19846737.

6. Joung JY, Cho YY, Park SM, Kim TH, Kim NK, Sohn SY, et al. 2014; Effect of iodine restriction on thyroid function in subclinical hypothyroid patients in an iodine-replete area: a long period observation in a large-scale cohort. Thyroid. 24(9):1361–8. DOI: 10.1089/thy.2014.0046. PMID: 24892764.

7. Zou Y, Wang D, Cheng X, Ma C, Lin S, Hu Y, et al. 2021; Reference intervals for thyroid-associated hormones and the prevalence of thyroid diseases in the Chinese population. Ann Lab Med. 41(1):77–85. DOI: 10.3343/alm.2021.41.1.77. PMCID: PMC7443523. PMID: 32829582.

8. Kim WG, Kim WB, Woo G, Kim H, Cho Y, Kim TY, et al. 2017; Thyroid stimulating hormone reference range and prevalence of thyroid dysfunction in the Korean population: Korea National Health and Nutrition Examination Survey 2013 to 2015. Endocrinol Metab (Seoul). 32(1):106–14. DOI: 10.3803/EnM.2017.32.1.106. PMID: 28116874. PMCID: PMC5368108.

9. Jeon MJ, Kim WG, Kwon H, Kim M, Park S, Oh HS, et al. 2017; Excessive iodine intake and thyrotropin reference interval: data from the Korean National Health and Nutrition Examination Survey. Thyroid. 27(7):967–72. DOI: 10.1089/thy.2017.0078. PMID: 28471294.

10. Park SY, Kim HI, Oh HK, Kim TH, Jang HW, Chung JH, et al. 2018; Age- and gender-specific reference intervals of TSH and free T4 in an iodine-replete area: data from Korean National Health and Nutrition Examination Survey IV (2013-2015). PLoS One. 13(2):e0190738. DOI: 10.1371/journal.pone.0190738. PMID: 29390008. PMCID: PMC5794073.

11. Padoan A, Clerico A, Zaninotto M, Trenti T, Tozzoli R, Aloe R, et al. 2020; Percentile transformation and recalibration functions allow harmonization of thyroid-stimulating hormone (TSH) immunoassay results. Clin Chem Lab Med. 58(10):1663–72. DOI: 10.1515/cclm-2019-1167. PMID: 31927515.

12. Thienpont LM, Van Uytfanghe K, De Grande LAC, Reynders D, Das B, Faix JD, et al. 2017; Harmonization of serum thyroid-stimulating hormone measurements paves the way for the adoption of a more uniform reference interval. Clin Chem. 63(7):1248–60. DOI: 10.1373/clinchem.2016.269456. PMID: 28522444.

13. Vesper HW, Van Uytfanghe K, Hishinuma A, Raverot V, Patru MM, Danilenko U, et al. 2021; Implementing reference systems for thyroid function tests - a collaborative effort. Clin Chim Acta. 519:183–6. DOI: 10.1016/j.cca.2021.04.019. PMID: 33933427.

14. Chung HK, Ku EJ, Yoo WS, Kang YE, Kim KJ, Kim BH, et al. 2023; Erratum: 2023 Korean thyroid association management guidelines for patients with subclinical hypothyroidism. Int J Thyroidol. 16(2):214–5. DOI: 10.11106/ijt.2023.16.2.214.

15. CLSI guideline EP28-ED3. Defining, establishing, and verifying reference intervals in the clinical laboratory, 3rd Edition. https://clsi.org/standards/products/method-evaluation/documents/ep28/. cited Nov 14, 2023.
16. Adeli K, Higgins V, Trajcevski K, White-Al Habeeb N. 2017; The Canadian laboratory initiative on pediatric reference intervals: a CALIPER white paper. Crit Rev Clin Lab Sci. 54(6):358–413. DOI: 10.1080/10408363.2017.1379945. PMID: 29017389.

17. Estey MP, Cohen AH, Colantonio DA, Chan MK, Marvasti TB, Randell E, et al. CLSI-based transference of the CALIPER database of pediatric reference intervals from Abbott to Beckman, Ortho, Roche and Siemens Clinical Chemistry Assays: direct validation using reference samples from the CALIPER cohort. Clin Biochem. 2013; 46(13-14):1197–219. DOI: 10.1016/j.clinbiochem.2013.04.001. PMID: 23578738.

18. Higgins V, Chan MK, Nieuwesteeg M, Hoffman BR, Bromberg IL, Gornall D, et al. Transference of CALIPER pediatric reference intervals to biochemical assays on the Roche cobas 6000 and the Roche Modular P. Clin Biochem. 2016; 49(1-2):139–49. DOI: 10.1016/j.clinbiochem.2015.08.018. PMID: 26297116.
19. Mu R, Yun K, Yu X, Cheng S, Ma M, Zhang X, et al. 2019; A study on reference interval transference via linear regression. Clin Chem Lab Med. 58(1):116–29. DOI: 10.1515/cclm-2019-0055. PMID: 31352428.
20. Kalaria TR, Sanders A, Ford C, Buch H, Fenn JS, Ashby HL, et al. 2022; Biochemical assessment of adequate levothyroxine replacement in primary hypothyroidism differs with different TSH assays: potential clinical implications. J Clin Pathol. 75(6):379–82. DOI: 10.1136/jclinpath-2020-207316. PMID: 33990368.
21. Ursem SR, Boelen A, Hillebrand JJ, den Elzen WPJ, Heijboer AC. 2023; How low can we (reliably) go? A method comparison of thyroid-stimulating hormone assays with a focus on low concentrations. Eur Thyroid J. 12(5):e230123. DOI: 10.1530/ETJ-23-0123. PMID: 37552779. PMCID: PMC10503215.

22. Kalaria T, Fenn J, Sanders A, Ford C, Gama R. 2022; Clinical concordance assessment should be an integral component of laboratory method comparison studies: a regression transference of routine clinical data approach. Clin Biochem. 103:25–8. DOI: 10.1016/j.clinbiochem.2022.02.008. PMID: 35183526.

23. Kalaria T, Sanders A, Fenn J, Ashby HL, Mohammed P, Buch HN, et al. 2021; The diagnosis and management of subclinical hypothyroidism is assay-dependent-implications for clinical practice. Clin Endocrinol (Oxf). 94(6):1012–6. DOI: 10.1111/cen.14423. PMID: 33475154.
24. Yamada S, Horiguchi K, Akuzawa M, Sakamaki K, Yamada E, Ozawa A, et al. 2023; The impact of age- and sex-specific reference ranges for serum thyrotropin and free thyroxine on the diagnosis of subclinical thyroid dysfunction: a multicenter study from Japan. Thyroid. 33(4):428–39. DOI: 10.1089/thy.2022.0567. PMID: 36772798. PMCID: PMC10620437.

25. Razvi S, Jabbar A, Addison C, Vernazza J, Syed A, Soran H, et al. 2023; Variation in the reference range limits of thyroid function tests and association with the prevalence of levothyroxine treatment. Eur J Endocrinol. 188(2):lvad016. DOI: 10.1093/ejendo/lvad016. PMID: 36751726.

26. Clerico A, Ripoli A, Fortunato A, Alfano A, Carrozza C, Correale M, et al. 2017; Harmonization protocols for TSH immunoassays: a multicenter study in Italy. Clin Chem Lab Med. 55(11):1722–33. DOI: 10.1515/cclm-2016-0899. PMID: 28245185.

27. Thienpont LM, Faix JD, Beastall G. 2015; Standardization of FT4 and harmonization of TSH measurements - a request for input from endocrinologists and other physicians. Endocr J. 62(10):855–6. DOI: 10.1507/endocrj.EJ15-0382. PMID: 26211473.

28. Wheeler E, Choy KW, Chin LK, Wijeratne N, McNeil A, Yen T, et al. 2019; Routine free thyroxine reference intervals are suboptimal for monitoring children on thyroxine replacement therapy and target intervals need to be assay-specific. Sci Rep. 9(1):19080. DOI: 10.1038/s41598-019-55690-x. PMID: 31836869. PMCID: PMC6910984.

Fig. 1
Deming regression analysis results for TSH values of each reagent compared to Roche (X=Roche, Y=other reagents).
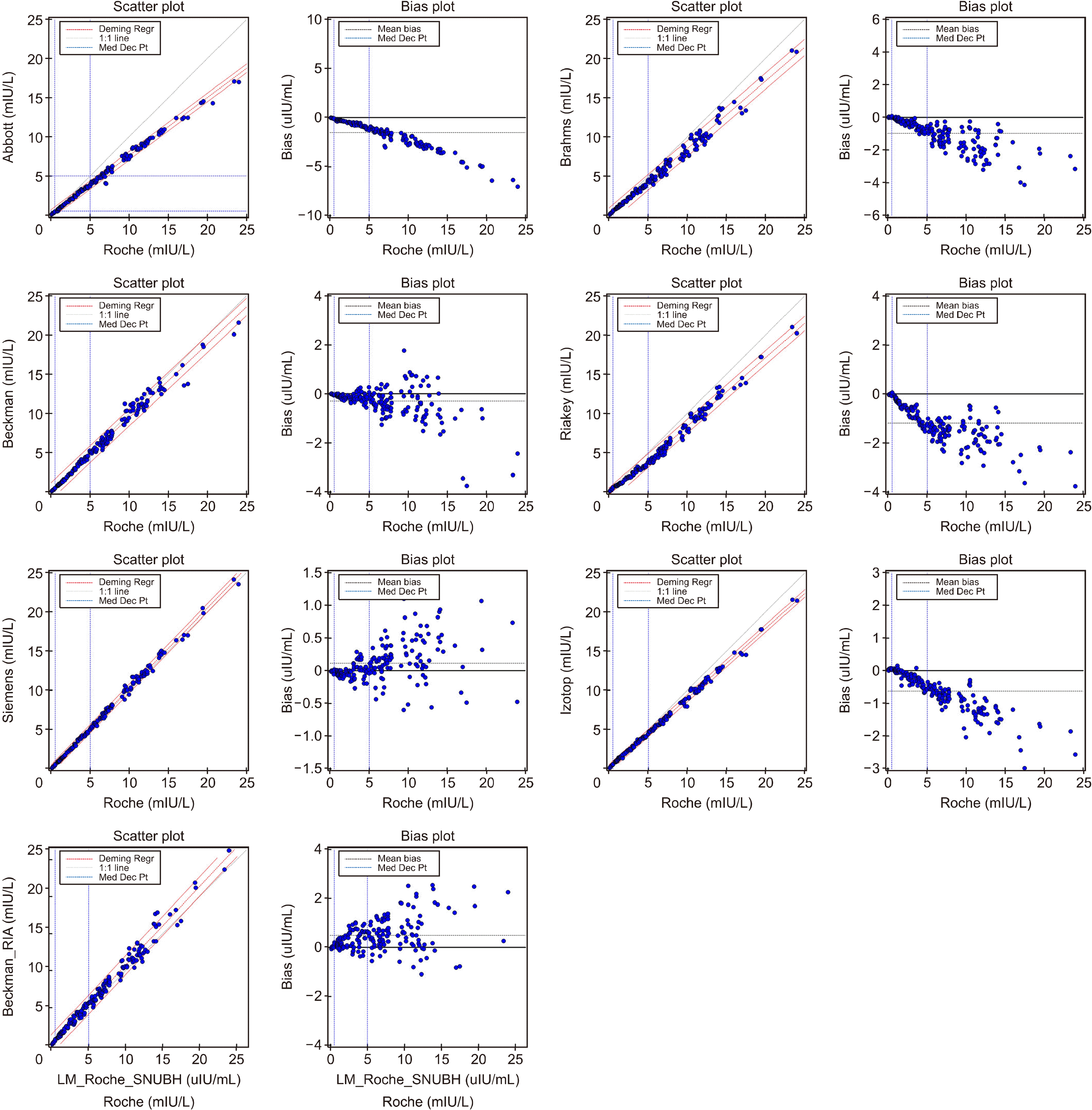
Table 1
Information on TSH tests provided by manufacturers
Table 2
Comparison of TSH value differences among reagents: simple linear correlation and regression analysis with Roche as reference
Table 3
Estimated TSH medical decision points for each reagent in comparison with Roche results




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download