Abstract
The indications for total elbow arthroplasty have been expanded beyond severe arthritis to include acute comminuted fractures. Advances in implant manufacturing and surgical techniques in recent decades have led to increasingly better results. Semiconstrained implants are most commonly used, followed by conversion-type and unlinked implants. However, the results are still worse than those of arthroplasty in the knee or hip joint, and various complications such as aseptic loosening, infection, bushing wear, and periprosthetic fractures still occur. As aging adults are increasingly indicated for surgery, we inevitably face complications that are not easy to control. In this review, we discuss intraoperative and late complications, their prevention, and treatment options.
주관절 전치환술은 생체역학, 치환물, 그리고 수술방법의 발전으로 점점 보편화되고 있다. 하지만 여전히 합병증의 발생은 피할 수 없다. 우리나라에서는 1984년 Pritchard elbow resurfacing system (ERS) [1]가 최초로 알려진 이후, 1991년 Kudo와 Iwano [2], 1997년 Pritchard Mark II형 [3], 그리고 최근 2001년 이후 Coonrad-Morrey형[4] 인공 주관절이 시술되고 있으나, 아직 이에 대한 장기적인 임상 추적 결과에 대해서는 국내에 보고된 바가 없으며 주관절 전치환술 후 기구 유형에 따른 주관절 기능, 합병증 및 재치환율에 대해서도 보고가 많지 않다. 인공 주관절은 반구속형과 비구속형의 두 가지로 나뉘는데, 반구속형인 Pritchard Mark II형과 Coonrad-Morrey형 등은 심한 주관절 주위 골 결손과 인대 결손을 동반한 불안정 주관절에 주로 적용되는 반면 Pritchard ERS나 Kudo형과 같은 비구속형은 골 및 인대 손상이 경한 안정성 주관절 병변에 주로 사용된다[4-6]. 하지만 대부분 인공 주관절 전치환술은 류마티스 관절염이나 분쇄 골절과 같이 심하게 이환된 주관절에 시행하므로 골조직 및 주변 연부 조직이 손상되어 있어 비구속형보다는 반구속형 주관절 치환이 요구된다[7]. 그로 인하여 최근에는 류마티스 관절염으로 인한 주관절 전치환술의 빈도는 줄어드는 대신 2차적인 관절염과 외상으로 인한 사용이 증가하였고, 필연적으로 높은 합병증 발생률 및 재치환율이 중요한 문제로 대두되었다[8-10]. 외상과 관련된 주관절 전치환술을 시행한 경우가 그렇지 않은 경우보다 재수술률이 약 4배 높다고 알려졌으며[11], 최근의 한 연구에서는 주관절 전치환술 때 축관 마모, 치환물 실패 등의 발생 위험도가 4.72배 높은 것으로 보고하였다[12]. 본 종설에서는 주관절 전치환술 시 발생할 수 있는 합병증에 대한 고찰과 함께 이에 대한 예방 및 치료에 대해 기술하고자 한다.
Ethics statement: This study was reviewed and approved by the Institutional Review Board of Chungnam National University Hospital (No. CNUH 2020-05-045). Informed consent for the publication of this report and the accompanying images was obtained from all individual participants included in the study.
경첩(hinge)이 없는 것이 연결형 치환물과의 가장 큰 차이이다. Pritchard ERS (DePuy, New Brunswick, NJ, USA)이나 Kudo type 3 (Biomet, Warsaw, IN, USA) 등이 있으며, 술 후 주관절의 안정성은 전적으로 치환물이 지니는 고유의 형태, 측부 인대의 손상 여부, 주관절 주변 근육의 근력 등에 의해 결정되기 때문에 골성 구조물이나 주변 인대 손상이 상대적으로 적어서 비교적 안정성이 유지된 상태에서 적응이 된다. 또한, 근육과 관절막 등의 주관절 주변의 연부 조직들이 이차적인 안정성을 제공하므로 수술 시 주의해야한다. 이처럼 비연결형 치환물에 가해지는 부하는 골-치환물 표면과 보존된 주변 연부 조직에 의해서 흡수되게 된다. 특히, 주관절 회전축의 정확한 복원이 필요하며, 치환물의 부정확한 정렬이나 상완-척골 관절면의 불일치가 발생하는 경우 수술 실패 확률이 높아지게 된다[13].
핀이나 snap fit으로 연결되어, 반구속형 경첩 형태의 구조를 이루게 되고, 힘의 분산을 위해 정상 관절의 운동에서 이루어지는 약 7°의 내반-외반 각형성 또는 이완을 허용하게 된다[14,15]. 많은 연구에서 우수한 결과를 보고하였고, ‘연결형’이기 때문에 탈구의 위험성이 없으므로 연부 조직에 대한 의존도가 낮아 연부 조직을 충분히 박리할 수 있다는 장점이 있어 수술 후 관절 운동 범위가 좋다고 알려져 있다. 최근에는 상완골에 대한 척골의 어느 정도의 회전뿐만 아니라 약 8°에서 10° 정도의 외전-내전도 허용함으로써 치환물에 가해지는 힘을 주위 연부 조직으로 분산하기 때문에 골-시멘트 사이 경계면에 가해지는 힘을 경감할 수 있게 되었다. 1973년에 초기 Coonrad 주관절 전치환물(type I; Zimmer, Warsaw, IN, USA)이 2°에서 3° 정도의 이완을 가진 고밀도 폴리에틸렌 축관(bushing)을 적용하였다. 그러나 초기 모델은 정상 주관절이 굴곡을 진행할수록 점점 내반이 발생하는 것을 고려하지 못했다[16]. 1978년에 약 7°의 이완이 허용되는 반구속형 치환물이 개발되었고(type II), 이는 비교적 느슨한 형태의 경첩으로 상완골 및 척골 치환물 사이에 내반-외반 및 약간의 회전이 가능하게 된다. 또한 원위 상완골 치환물에 전방 flange를 추가함으로써 상완골 전방 피질골과 flange 사이에 이식 골을 삽입하여 최대 스트레스가 가해질 것으로 보이는 지점에 금속-골 접촉 부하를 최소화하고 고정을 극대화하였다. 이러한 전방 flange는 주관절 주변의 원위 상완골의 치환물이 안정성을 가질 수 있도록 하며 골-시멘트 간 접촉면에 가해지는 염전력(torsional force)도 감소시킨다. 여기에 플라즈마 스프레이로 치환물 표면을 다공성 처리하면서, 해리를 더욱 감소시킨 현재의 주관절 전치환물(type-III, Coonrad-Morrey)이 되었다[4,17]. 그 외, 현재 사용되는 반구속형 치환물로는 Discovery (Biomet), Latitude (Tournier, Bloomington, MN, USA), Nexel (Zimmer) 등이 있다. Latitude는 상황에 따라 연결형 또는 비연결형으로 선택할 수 있는 전환형 치환물이다. 현재까지는 어느 치환물이 우월한지 충분한 연구의 증거가 없는 상태이며, 술자의 선호도나 환자의 개별적인 상태에 맞게 적절히 선택해야 할 것이다[15].
결론적으로 현재 삽입되는 국내외 거의 대부분의 치환물이 반구속형이라 해도 과언이 아닐 것이다. 염증 및 감염 등의 몇 가지 합병증을 제외한 대부분의 합병증이 현존하는 치환물이 정상 주관절의 생역학을 구현하지 못하는 한계에 기인한다. 비연결형 치환물에 비해 힘의 분산을 위해 고유의 외전 및 내전 이완을 허용하기 때문에 관절에 대한 안정성을 제공하고 골-시멘트 사이에 부하 전달을 최소화할 수 있으나, 이러한 장점으로 인해 편심성 점접촉이 유발되고 이로 인한 폴리에틸렌의 마모가 불가피하다. 폴리에틸렌의 마모, 이차적 불안정성, 비정상적 부하의 증가, 이는 특히 삽입물의 수명을 고려해야 하는 건강한 젊은 성인에게 특히 중요한 점이다. 따라서 이런 경우 가급적 반구속형 치환물의 삽입 시기를 미루고 다른 수술법을 강구해야 한다.
기존의 척골 변형을 간과하거나 부정확한 방향으로 확공(reaming)을 시도할 때 발생할 수 있다. 과도한 힘으로 단번에 확공을 하기보다는 약한 힘으로 여러 번 두드림(tapping)을 하여 확공기가 골수강 내에서 올바른 방향으로 스스로 진입하도록 하는 것이 유용하다(Fig. 1). 척골 변형이 있는 경우에 삽관 확공기(cannulated reamer)를 사용하는 것이 척골 천공을 줄일 수 있는 방법이다. 대개 척골 배측면(dorsal cortex)에 발생하므로, 천공이 조금이라도 의심되는 경우 적절한 굵기의 가이드 핀을 척골 확공부를 통해 삽입하여 배측면의 골수강 부위를 접촉하여 확인할 수 있다. 저자의 경우 최근 다양한 크기의 골 대체제(tricalcium phosphate)를 이용해 시멘트 삽입 전 천공부를 밀봉하는 방법을 사용한다. 단기 추시에서 천공 부위 주변의 추가 골절이나 비감염성 해리, 시멘트 유출 등의 소견은 보이지 않았으나 아직 문헌으로 보고된 수준은 아니다. 일부 술자들은 일괄적으로 확공기의 방향을 방사선 조영 장치로 확인하기도 한다. 천공을 간과하는 경우, 시멘트 유출은 척골 천공 후 흔히 동반되는 연쇄적 결과로, 손가락으로 천공 부위를 막아서 유출을 막거나 유출된 시멘트를 제거해야 한다.
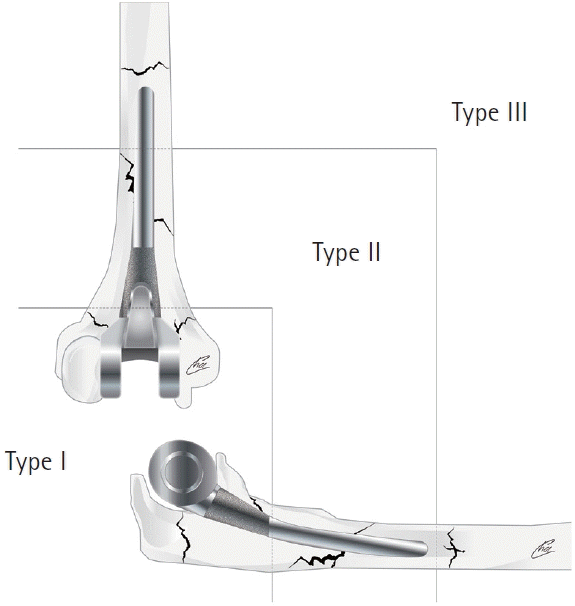
류마티스 관절염이나 고령의 원위 상완 분쇄 골절에서 치환술을 시도하는 경우 심한 골다공증 가능성을 염두해야 한다. 매우 얇아진 상완 및 척골 간부의 피질골을 간과하고 확공하거나 원위 상완 관절 내 골절과 연결된 골절선을 간과했을 때 발생하기도 한다. 과도하게 힘을 주거나 중심에서 어긋난 확공을 하지 않도록 주의해야 하며, 톱날(saw blade)의 정확한 진입 방향을 잘 확인하여 부정확한 절골 후 임플란트 삽입 시에 술자의 힘에 의해 골절되지 않도록 주의해야 한다. 또한 충분히 확공을 하지 않고 치환물을 삽입할 때는 상완골의 과상부에 골절이 발생할 수 있다(Figs. 2–4). 치료 방침 결정에 도움이 되는 분류로 많이 사용하는 것은 Mayo classification으로, O’Driscoll과 Morrey [18], Sanchez-Sotelo 등[19]은 1) 골절의 위치, 2) 치환물의 고정 정도, 3) 치환물 주변 골 소실 정도의 세 가지 요소에 따라 주관절 전치환술 후 치환물 주위 골절을 분류하였다 (Fig. 5, Table 1). 이 분류는 수술 중 발생한 골절 및 지연성으로 관찰되는 골절 모두에 동일하게 적용할 수 있다.
Type I 골절은 주관절 주위(상완골 과, 척골 주두), type II 골절은 치환물 주위, type III 골절은 상완골 치환물 첨부의 근위부 또는 척골 치환물 첨부의 원위부에 위치한다.
• Type I: 수술 중에는 특히 내과 골절이 잘 발생하는데, 골절편이 크다면 금속판이나 장력대 강선 고정술 등을 통하여 고정할 수도 있지만(Fig. 3), 골절편이 작다면 골절편을 제거하고 주변 연부 조직을 상완삼두근막에 봉합하기도 한다(Fig. 2) [18,20,21]. 수술 중 발생한 주두 골절은 주관절 신전 기전을 보존하기 위해 반드시 내고정술이 필요하다[20].
• Type II: 수술 중 골절은 주관절 전치환술 후 감염으로 재치환술을 시행할 때 상완골 치환물을 제거하는 과정에서 가장 흔하게 발생하며, 감염으로 인한 골의 반응 및 소실이 치환물의 불안정성을 유발하므로 상완골 치환물의 해리를 동반한 것에 준해서 치료해야 한다. 이 분류의 수술 중 척골 골절은 흔치 않으며 대개 천공을 잘 치료하면 더 이상의 골절로의 진행을 막을 수 있다(Fig. 4).
• Type III: 수술 중 골절은 상완, 척골의 골절은 보고된 바가 없다.
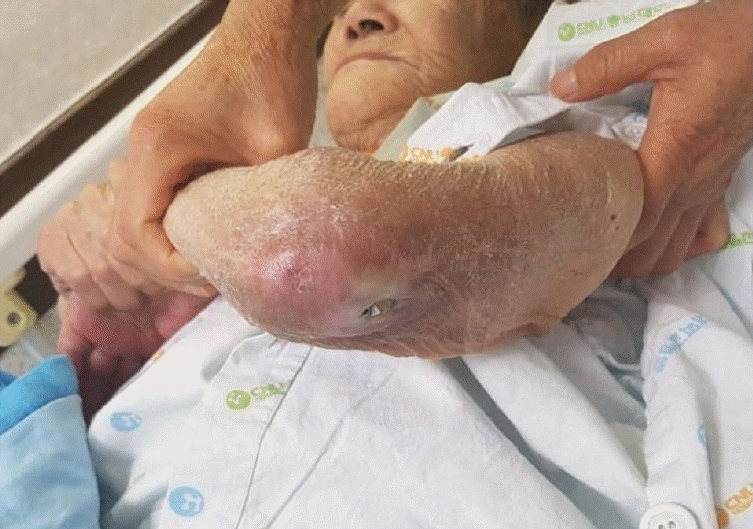
비감염성 해리는 재치환술의 가장 흔한 원인이다(Figs. 6, 7). 1996년도 Gschwend 등[22]은 6.4%, 2011년 Voloshin 등[23]은 5.1%, 2017년 Welsink 등[24]은 6.9%에서 비감염성 해리로 재치환술을 했다고 보고하였다. 특히 척골 치환물에서 해리가 흔하고[25,26] 외상 후 전치환술을 받은 군이 염증성 질환 연관군보다 2배 정도 빈도가 높았으며, 재치환술이 필요한 경우 역시 염증성 질환군은 2.6%, 외상 후 전치환술 군에서는 17.5%로 외상과 관련된 군에서 높게 보고되었다[25]. 이는 환자의 수술 전 일상생활 능력 및 상지 사용에 대한 요구가 높기 때문으로 해석되며 수술 전 고려해야 할 중요한 요소이다. Discovery 사용군에서 영상학적 비감염성 해리가 60% 정도로 가장 흔하였고, Coonrad-Morrey군에서 11.9%로 가장 낮았다. 임상적으로 재치환술이 필요한 해리는 Discovery군에서 2.2%로 가장 낮고, Coonrad-Morrey군에서 6.8%로 가장 높았으며, 평균 6.3% 정도로 재치환술이 필요했다. 다만 추시 시간과 총 환자 수에서 차이가 있기 때문에 해석에 주의를 요한다. Latitude를 사용한 군에서는 요골 치환물 주위에서 가장 흔하게 해리가 관찰되었다[25]. 다른 체계적 문헌 고찰에서도 영상의학적 비감염성 해리의 발생률은 약 15% 정도였고, 임상적으로 문제되는 경우는 5%였다[23]. 류마티스 관절염 환자만을 대상으로 한 2020년 체계적 문헌 고찰에서 재수술이 필요한 비감염성 해리의 발생률은 9.5%였고, 여성, 비연결형 치환물이 비감염성 해리의 위험인자로 보고하였다[27]. 치환물 형태에 따른 분석에서는, 연결형 치환물이 비연결형 치환물보다 통계적으로 유의하게 비감염성 해리의 발생이 낮았다[28]. 이는, 연결형 치환물은 결합된 치환물 사이의 자체 안정성 내에서 폴리에틸렌 마모와 저등급의 탈구가 문제가 되나 비연결형은 순수하게 주관절 자체의 연부 조직에 안정성이 유지되어 주관절 굴곡 시 해당 각도마다 골-시멘트 면(surface) 및 시멘트-치환물 면에 지속적으로 각기 다른 축성 부하(multiaxial forces)가 상완골 치환물, 척골 치환물에 가해져 해리 및 고등급의 탈구를 유발했기 때문으로 설명된다. 그러나 염증성 질환으로 수술한 경우에, 연결형과 비연결형 치환물에 따른 비감염성 해리로 인한 재치환율은 차이가 없다는 일부 보고도 있다[29,30].
비연결형 치환물의 불안정성을 극복하기 위해 반구속형(semiconstrained) 연결형 치환물이 고안되었으며, 이는 약간의 움직임을 허용하는 경첩 관절을 구현한다. 필연적으로 관절 접촉면의 마모를 피할 수 없으며, 심하게 마모되면 불안정과 폴리에틸렌 입자에 의한 활막염 및 치환물 주변 골 용해가 나타나게 된다. 연결형 치환물에서 재수술이 필요한 폴리에틸렌 축관 마모는 2.3%에서 나타나고, 분리율은 1.7%로 보고된다[24]. Parker 등[25]은 Coonrad-Morrey군에서 18.2%까지 흔한 것으로 보고하였다. 또한 류마티스 관절염 환자군에 비해 외상 후 관절염 환자군에서 축관 마모와 치환물 실패의 위험도가 4.7배 높다고 보고했다[12]. 적절한 때 치료하지 않으면 금속증(metallosis)이 나타날 수 있어[31] 불안정성이 있는 비연결형 치환물의 경우 재치환술을 통해 연결형 치환물로 바꿔야 하고(Figs. 7-9), 반구속형 치환물의 분리의 경우 축관 교체 외 나머지 치환물 교체는 필요하지 않는다. 축관 마모 분류는 세 단계로 나눌 수 있다. Grade 1은 폴리에틸렌의 두께의 감소가 50% 이하인 경우, grade 2는 50%–99% 사이인 경우, grade 3는 전층 폴리에틸렌이 마모된 경우이며, 금속 마모가 없으면 grade 3a, 금속 마모가 동반되면 grade 3b로 나눈다(Fig. 10) [32].
주관절 전치환술에서 치환물 주위 골절은 2.2%에서 12%라고 보고되고 있다[24,25,28]. 보통 수술 중에 발생하거나 뒤늦게 비감염성 해리로 인하여 발생하며[22], 다른 관절의 치환물 주위 골절과 발생률은 비슷하다[25]. 축관 다방향의 마모가 골 용해, 비감염성 해리, 치환물 실패 또는 치환물 주위 골절을 일으킬 수도 있다. 폴리에틸렌 마모와 금속-금속 간 마모가 치환물 주위 미립자 양을 증가시켜, 만성 염증 반응을 통해 불안정과 비감염성 해리를 야기한다[33]. 이는 보통 치환물이 해리된 곳과 안정성이 있는 곳 사이에서 발생한다. 재수술은 합병증의 발생 위험성이 더 높아지지만, 일반적으로 통증을 줄이고, 시멘트 내 시멘트 재삽입술(reimplantation)로 기능을 회복시킬 수 있다. 치환물 주위 골절은 골절 부위, 치환물의 해리 여부, 골의 상태를 고려해서 수술 계획을 세워야 한다. 치환물 스템의 안정성이 유지되는 상태의 골절은 부목 고정 또는 내고정만 시행하여 유합을 얻을 수 있다.
• Type I: 지연성으로 발생하는 상완골 골절의 경우는 대개 증상이 없으며, 상완골 치환물의 해리나 주관절 기능 저하가 없다면 장상지 부목 고정을 비롯한 보존적 치료를 시행한다. 상완골 치환물의 해리가 동반되었거나 주관절 기능 저하 등의 증상이 있는 경우[20], 골절의 전위가 심할 경우에는 비흡수성 봉합사를 이용한 고정이나 장력대 강선 고정술을 통하여 내고정을 시도할 수 있으며[34], 만약 고정력이 약할 경우 불유합에 의한 통증이 생길 수 있기 때문에 골절편을 제거하는 것이 더 낫다. 주두 골절은 전위가 심하지 않고 주관절 신전 기전의 손상이 심하지 않다면 부목 고정을 통해 골 유합을 얻을 수 있다(Fig. 11). 주두의 전위가 심한 예는 곧 신전 기전의 약화를 의미하므로 수술을 요한다. 큰 골편의 경우 잠김 금속판이나 장력대 강선 고정술을 사용하고 작은 경우 비흡수성 봉합사를 이용한 경골 봉합(transosseous suture)을 시도할 수 있다.
• Type II: 골 용해나 치환물 주위 해리가 이미 존재하기 때문에 대부분 수술적 치료가 필요하고[19], 상완골 치환물의 해리여부 및 골 결손의 정도에 따라 수술 방법이 결정된다. 상완골 치환물이 잘 고정되어 있는 경우에는 주로 치환물의 첨부 근처에서 골절이 발생하며, 이에 관혈적 정복 및 내고정만으로도 치료가 가능하다. 그러나 실제 내고정 과정에서 치환물 주변의 해리 소견을 발견하는 경우가 있기 때문에 영상에서 저명한 해리 소견이 없더라도 재치환술을 동시에 준비해야 한다[35]. 상완골 치환물의 해리가 동반된 경우 내고정 및 재치환술을 동시에 요하며 잠김 금속판 고정 후 환형 강선(cerclage wiring) 방법을 주로 이용한다. 재치환술 시 상완골 치환물의 길이는 골절 부위에서부터 최소 상완골 직경 2배 길이 이상이어야 한다. 상완골 원위부 골 결손이 큰 경우 치환물 및 치환물의 전방 flange가 충분히 길어야 상완골 전방 피질골을 안정적으로 고정할 수 있다[19]. 대개 상완 스템의 길이가 길수록 flange가 비례하여 길게 제작되어 있으므로 적절한 치환물을 선택하면 된다.
• Type III: 치환물의 해리가 없는 상완의 비전위 골절에서는 부목 고정 등의 보존적 치료를 고려할 수 있으나[17], 해리가 동반된 골절은 type II와 같이 재치환술도 함께 고려할 수 있다(Fig. 12). 동측 견관절에 기존의 금속(근위 상완 골절로 인한 금속판 또는 인공 견관절 치환물)이 존재하는 경우 치료가 쉽지 않은데, Mavrogenis 등[36]은 동측에 역행성 견관절 전치환술과 주관절 전치환술을 시행한 환자에게 발생한 두 치환물 사이의 주위 골절에 대하여 동종 지주골 이식과 금속판 및 환형 강선을 이용한 내고정으로 유합을 얻었다고 보고하였다. 척골 치환물보다 원위부에 발생한 골절은 일반적인 척골 간부 골절에 준해서 관혈적 정복 및 내고정술이 권장되며, 척골 치환물의 해리가 동반되면 역시 type II와 같이 재치환술도 동시에 시행하는 것을 추천한다.
골 결손은 치환물 주위 골절, 해리 등과 동반되거나 치료가 지연될 경우 필연적으로 발생하며 대부분 수술적 치료를 요하게 된다. Rhee 등 [37]은 골 결손이 동반된 재치환술 시의 전략을 제시했는데, 1) 골 결손으로 치환물과 느슨하게 고정될 것이 예상되면 맞춤 제작형 치환물을 사용하거나 2) 자가골, 동종골 등을 이용하여 골 결손 부위를 회복시킨 뒤 일반적 치환물을 사용하는 방법이다(Figs. 13, 14). 지주 동종골 또는 동종골 치환물 복합체 등은 재치환술 시 골 결손을 보완하기 위해 사용할 수 있지만 결과가 일관되지는 않는다[38-42].
치환물 실패의 발생률은 1%에서 5% 정도로 보고되고 있다[17,41,43,44]. Athwal 등[43]은 평균 추시 8.2년에서 상완 치환물 실패가 0.65%, 평균 추시 4.6년에서 척골 치환물 실패가 1.2% 발생한다고 보고했다. Lee 등[32]은 축관 마모 grade I에서 8%, grade II에서 5%, grade 3에서 87%에서 치환물의 실패가 발생했다고 보고했다. 류마티스 환자에 대한 한 체계적 문헌 고찰에서는 젊을수록 실패 위험성이 증가하고, 비연결형 치환물이 더 위험성이 높다고 보고하였다[27]. 또한 외상과 관련된 환자군이 류마티스 관절염 환자군에 비해 실패 위험도가 높았다는 보고도 있다[12]. 치환물 실패는 모두 골 결손을 동반하며, 치환물과 골 표면 사이의 스트레스 증가로 발생하는데, 치환물의 안정성이 있는 곳과 해리된 곳 사이에서 발생한다. 안정성 있게 삽입된 스템 길이를 총 스템의 길이로 나눈 뒤 퍼센트로 환산하였을 때 평균 63% (29%–86%)에서 실패가 발생하였다[32]. 치환물 실패가 발생하였을 때 그대로 놔두면 주변의 골 흡수가 진행되어 불안정해지고 재치환도 더 어려워진다. 그러므로 부러진 치환물을 제거하고 재치환술을 시행해야 한다. 수술 시 남아있는 스템을 제거하는 것이 쉽지 않은데, 스템의 끝부분 피질골에 창(window)을 내고 시멘트를 일부 제거한 뒤 제거한다. 새 치환물은 이전 치환물보다 긴 스템을 삽입한다. 골 흡수가 심한 환자의 경우 골 이식을 추가로 보강하거나, 피질골이 아주 약한 경우 피질골 지주 동종골(cortical strut allograft)로 보강할 수 있다[19,37].
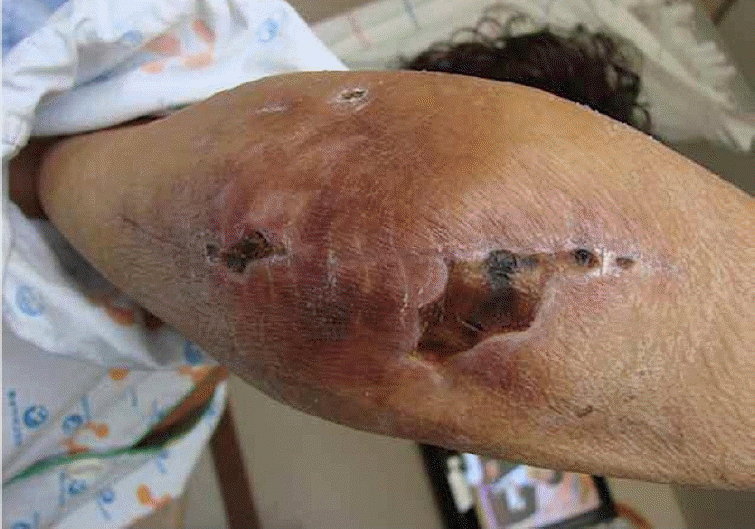
조기 관절운동으로 인해 발생할 수 있다. 수술 후 2주간 관절운동을 제한하는 것이 상처 치유와 연관된 합병증을 감소할 수 있다[45]. 장기간 스테로이드 제제를 복용한 환자들은 상처 문제가 더 쉽게 발생한다[46]. 상당 수가 피부에 국한된 병변의 문제가 아닌 치환물 주변의 심부 감염으로 진행된다(Figs. 15,16). Jeon 등[47]은 5.5%에서 상처 치유 문제가 발생했으며, 그 중 23%는 2차 심부 감염으로 이어졌다고 보고했다. 류마티스 환자의 치환술 시 외측 접근법이 피부 미세 혈류 순환을 고려하였을 때 피부 상처 치유에 유리하다고 보고되었다[45]. 저자들은 피부 절개 후 30분 이내 1, 2세대 세파계(cephalosporin) 또는 vancomycin 주입을 시작하고 24시간 유지하는 지침을 따르고 있다[48].
치환물 주위 감염은 환자의 사망률을 높일 수 있으며, 사회적 비용을 증가시킨다. 대부분 Staphylococcus aureus나 coagulase-negative Staphylococcus species이며[49], 특히 Staphylococcus epidermidis는 치환물에 생물막(biofilm)을 형성하면서 단단하게 유착되어 변연 절제술로 치료가 어려우므로 2단계 재치환술이 권장된다[20]. 주관절 전치환술 후 심부 감염률은 1980년대에는 8.1%로 높았으며[22], 1998년 Yamaguchi 등[50]은 3.3%로 보고하였다. 최근 체계적 문헌 고찰에서는 약 6.5%로 보고하였다[25]. 과거에 비해 감염률이 낮아지긴 했지만, 슬관절과 고관절의 치환물 주위 감염 발생률이 각각 0.69%–1.26%, 0.61%–1.18%임을 고려할 때[51] 주관절에서 여전히 높은 편이다. 감염률을 낮추는 데 가장 큰 기여를 한 것은 항생제 혼합 시멘트(antibiotic impregnated cement)의 사용으로 추정된다[52,53]. 이전 주관절 부위 수술력, 주관절 후방부의 압력을 높이는 환자의 습관은 주관절 후방부위 연부 조직의 피복을 어렵게 만들고, 이는 감염률 증가로 이어질 수 있다[23]. 류마티스 관절염의 경우 면역력의 감소와 연부 조직의 취약성으로 감염률이 증가할 것으로 추정되지만 통계적으로 차이가 없다는 일부 보고도 있으나[34], 최근 체계적 문헌 고찰에서는 류마티스 관절염 환자군이 외상 후 관절염 환자군에 비해 감염성 해리의 위험도가 약 4배 정도 높다고 보고하였다[12]. 감염의 치료는, 다른 관절과 마찬가지로, 급성기에는 항생제를 투여하고 변연 절제술을 철저히 하여 가능한 치환물을 보존하지만, 만성화된 감염에서는 치환물과 시멘트를 제거하고 항생제 혼합 시멘트를 넣은 뒤 감염이 완전히 조절되면 재치환술을 하는 것이다(Fig. 17). 감염의 재발은 수술 방법에 따라 달라지는데, 단순 변연 절제술만 했을 경우 19%–89%, 2단계 재치환술을 하였을 경우 0%–33%, 절제 관절 성형술의 경우 0%–13%로 보고되었다[49]. 최근의 체계적 문헌 고찰 연구에서는 변연 절제술만 시행 시 성공률은 57.7%, 1단계 재치환술 시에는 66.7%, 절제 관절 성형술 시에는 71%, 2단계 재치환술 시에는 76%로 나타났으며, 절제 관절 성형술이 높은 성공률을 보였으나 수술 후 임상적 예후가 좋지 않음을 기술하였다[54]. 최근에는 수술 후 3개월 이내에 감염이 발생하거나 3개월 이후라도 증상이 시작된 지 10일 이내이면 치환물 보존이 가능한 것으로 지침이 변경되었고[55,56], 그보다 시간이 지난 환자들은 치환물을 제거하고 감염이 조절된 후 다시 치환물을 삽입하는 2단계 재치환술을 하는 것이 원칙이다[57]. 환자가 고령이고 건강이 좋지 못하다면 무리하게 재치환술을 시도하지 말고, 치환물만 제거하여 감염을 조절하고 그냥 두는 절제 관절 성형술을 하는 것이 현명하다[58,59].
전치환술 후 수부 척측의 저림과 감각 저하 등의 비교적 경미한 척골 신경 증상은 흔하게 관찰된다. 수술 중 적절하게 척골 신경을 유리하였다면 경과 관찰을 통해 호전을 기대할 수 있다. 최근 체계적 문헌 고찰에서 척골 신경병증 발생률은 3.4%–4.4% 정도로 보고되었다[25]. 1990년대 Gschwend 등[22]의 증상 있는 척골 신경에 대해 “이전술 없는 in situ 감압”만으로도 효과가 있었다는 보고 후 20여 년간 이렇다 할 보고는 없었다. 주관절 전치환술에 대한 체계적 고찰에서는 보고된 문헌들의 15%에서만 수술 전 척골 증상의 존재를 보고하였고 20%의 문헌에서는 치환술 과정 중 척골 신경 처리(manipulation)에 대한 보고가 없었다[9,23,25]. 심지어는 40%의 문헌에서 치환술 후 발생한 척골 신경 증상에 대한 언급 자체가 없는 등, 현재까지도 치환술과 연관된 척골 신경 증상에 대한 연구가 빈약한 수준이라고 볼 수 있다. 즉, 치환술 과정에서의 전방 이전 또한 개인 술자의 선호도에 따라 달라질 수 있다. Dachs 등[60]은 술 전 평가에서 주관절 굴곡 제한이 있거나 수술 중 평가에서 척골 신경 이전술이 필요하다고 판단되는 경우에만 시행할 것을 권장하였다. 전방 이전술을 선호하는 술자의 경우 이전된 신경이 더 안전한 위치에 놓이게 되고, 수술 중 조작으로부터 보호받을 수 있으며, 신연될 가능성이 거의 없고 술 후에도 어떠한 압박(compression)의 환경에서 자유로울 수 있다는 근거를 제시한다. 한편, 이전 과정에서 요하는 불필요한 박리, 척골 신경 자체로 가는 혈류의 손상, 수술 시간의 증가, 이전술 자체가 신경에 주는 손상은 저자들이 이전술을 선호하지 않는 근거이다. 신경 이전을 위한 내측 피부의 절개-피판 생성 역시 술 후 연부 조직 피복에 불리하다는 주장이다[61,62]. 즉, 치환술 과정 중의 신경 전방 이전술의 효과 및 그 필요성에 대해서는 아직 더 많은 연구가 필요하다.
주관절 전치환술 후 상완 삼두건 손상은 1%에서 29%로 보고되며[61,63,64], 이는 수술 시 삼두건 부착부를 주두에서 박리할 때 부착부가 약해져서 발생했을 가능성이 높다. 최근 체계적 문헌 고찰에서 삼두건 분리 접근법 시, 상완 삼두건 손상의 발생률이 0.4%에서 3.2% 정도로 보고되었다[23-25,27]. 이러한 이유로 삼두건 부착부를 보존하는 접근법이 소개되었다(Fig. 18) [64-66]. 그러나 많은 경험을 통해 익숙해지지 않으면 삼두근의 주두 연결을 유지한 상태로 전치환술을 하는 것은 기술적으로 매우 어렵다. 저자들의 경우 고령의 원위 상완 관절 내 골절로 절제할 상완골이 많은 경우 치환물 삽입 공간을 쉽게 확보할 수 있어 주로 사용한다. 삼두건 부착부의 박리가 불가피할 때, 파열의 위험성이 높다고 판단되면 처음부터 주근(anconeus)을 이용한 보강술을 시행할 것이 권장된다. 외상으로 주관절 전치환술을 받은 환자와 류마티스 관절염으로 수술받은 환자들의 삼두건 부전 발생을 비교하였을 때, 류마티스 관절염 환자들의 연부 조직이 좋지 않음에도 불구하고 차이는 없었다. 반면, 주관절에 여러 번 수술을 받았던 환자들은 삼두건 부전이 발생할 가능성이 크다[67]. 삼두건 손상의 치료는 건의 상태에 따라 다른데, 건이 충분히 튼튼하다면 주두에 일차 봉합을 통해 치료할 수 있다. 만약 건의 상태가 좋지 못하다면, 주근 회전 피판술을 시도할 수 있다. 만일 주근의 회전 피판술이 여의치 않거나 삼두근의 건 손상이 심하다면 아킬레스 동종건을 이용한 재건술을 해야 한다. 주두에도 결손이 있을 때는, 아킬레스 부착부의 종골을 같이 사용해서 주두에 고정해야 한다[67].
최근 체계적 문헌 고찰에서 이소성 골화의 영상학적 발생은 10%였으며, 임상적으로 문제되는 경우는 3%로 보고되었다. 이소성 골화는 염증성 관절염보다 강직증, 원발성 관절염, 외상 후 관절염 환자에서 흔하게 발생한다. 특히 유합된 관절에 대한 전치환술 후 발생 빈도가 높은 것으로 알려졌다[68]. 이소성 골화에 대한 치료는 외상 후 발생하는 이소성 골화의 치료와 동일하며, 예방적으로 치료를 시작하는 것은 권고되지 않는다. 골화가 관찰되는 경우 경구약 복용을 사용해 볼 수 있으며, 기능 제한이 심한 환자에 대해서는 방사선학적으로 골화가 완전히 진행된 후 관절운동을 제한하는 이소성 골을 수술적으로 제거한다. 수술은 일반적으로 6–8개월 정도 후에 시행하며 이소성 골화가 다시 생기지 않는다면 좋은 결과를 기대할 수 있다[69].
ACKNOWLEDGMENTS
We would like to thank Professor Joo-Yeop Lee of the Catholic University of Korea for providing rare case photos.
References
1. Pritchard RW. Anatomic surface elbow arthroplasty: a preliminary report. Clin Orthop Relat Res. 1983; (179):223–30.

2. Kudo H, Iwano K. Total elbow arthroplasty with a non-constrained surface-replacement prosthesis in patients who have rheumatoid arthritis: a long-term follow-up study. J Bone Joint Surg Am. 1990; 72:355–62.

3. Madsen F, Gudmundson GH, Søjbjerg JO, Sneppen O. The Pritchard Mark II elbow prosthesis in rheumatoid arthritis. Acta Orthop Scand. 1989; 60:249–53.

4. O’Driscoll SW, An KN, Korinek S, Morrey BF. Kinematics of semi-constrained total elbow arthroplasty. J Bone Joint Surg Br. 1992; 74:297–9.
5. Ring D, Koris M, Jupiter JB. Instability after total elbow arthroplasty. Orthop Clin North Am. 2001; 32:671–7.

6. O’Driscoll SW, King GJ. Treatment of instability after total elbow arthroplasty. Orthop Clin North Am. 2001; 32:679–95.

7. Kholinne E, Altamimi LA, Aldayel A, et al. Primary linked total elbow arthroplasty for acute distal humerus fracture management: a systematic review of clinical outcome. Clin Orthop Surg. 2020; 12:503–13.

8. Mäkelä KT, Matilainen M, Pulkkinen P, et al. Countrywise results of total hip replacement: an analysis of 438,733 hips based on the Nordic Arthroplasty Register Association database. Acta Orthop. 2014; 85:107–16.
9. Little CP, Graham AJ, Carr AJ. Total elbow arthroplasty: a systematic review of the literature in the English language until the end of 2003. J Bone Joint Surg Br. 2005; 87:437–44.
10. Labek G, Thaler M, Janda W, Agreiter M, Stöckl B. Revision rates after total joint replacement: cumulative results from worldwide joint register datasets. J Bone Joint Surg Br. 2011; 93:293–7.
11. Perretta D, van Leeuwen WF, Dyer G, Ring D, Chen N. Risk factors for reoperation after total elbow arthroplasty. J Shoulder Elbow Surg. 2017; 26:824–9.

12. Wang JH, Ma HH, Chou TA, et al. Outcomes following total elbow arthroplasty for rheumatoid arthritis versus post-traumatic conditions: a systematic review and meta-analysis. Bone Joint J. 2019; 101-B:1489–97.
13. van Riet RP, Morrey BF, O’Driscoll SW. The Pritchard ERS total elbow prosthesis: lessons to be learned from failure. J Shoulder Elbow Surg. 2009; 18:791–5.

14. Hastings H 2nd, Theng CS. Total elbow replacement for distal humerus fractures and traumatic deformity: results and complications of semiconstrained implants and design rationale for the Discovery Elbow System. Am J Orthop (Belle Mead NJ). 2003; 32(9 Suppl):20–8.
15. Morrey BF. Elbow arthroplasty: historical perspective and emerging concepts. In : Morrey BF, Sanchez-Sotelo J, Morrey ME, editors. Morrey’s the elbow and its disorders. 15th ed. Philadelphia: Elsevier;2018. p. 807–17.
17. Aldridge JM 3rd, Lightdale NR, Mallon WJ, Coonrad RW. Total elbow arthroplasty with the Coonrad/Coonrad-Morrey prosthesis: a 10- to 31-year survival analysis. J Bone Joint Surg Br. 2006; 88:509–14.
18. O’Driscoll SW, Morrey BF. Periprosthetic fractures about the elbow. Orthop Clin North Am. 1999; 30:319–25.

19. Sanchez-Sotelo J, O’Driscoll S, Morrey BF. Periprosthetic humeral fractures after total elbow arthroplasty: treatment with implant revision and strut allograft augmentation. J Bone Joint Surg Am. 2002; 84:1642–50.
20. Ramirez MA, Cheung EV, Murthi AM. Revision total elbow arthroplasty. J Am Acad Orthop Surg. 2017; 25:e166–74.

21. Ito H, Matsumoto T, Yoshitomi H, Kakinoki R, Nakamura T. The outcome of peri-operative humeral condylar fractures after total elbow replacement in patients with rheumatoid arthritis. J Bone Joint Surg Br. 2007; 89:62–5.

22. Gschwend N, Simmen BR, Matejovsky Z. Late complications in elbow arthroplasty. J Shoulder Elbow Surg. 1996; 5(2 Pt 1):86–96.

23. Voloshin I, Schippert DW, Kakar S, Kaye EK, Morrey BF. Complications of total elbow replacement: a systematic review. J Shoulder Elbow Surg. 2011; 20:158–68.

24. Welsink CL, Lambers KT, van Deurzen DF, Eygendaal D, van den Bekerom MP. Total elbow arthroplasty: a systematic review. JBJS Rev. 2017; 5:e4.
25. Parker P, Furness ND, Evans JP, Batten T, White WJ, Smith CD. A systematic review of the complications of contemporary total elbow arthroplasty. Shoulder Elbow. 2021; 13:544–51.

26. Brinkman JM, de Vos MJ, Eygendaal D. Failure mechanisms in uncemented Kudo type 5 elbow prosthesis in patients with rheumatoid arthritis: 7 of 49 ulnar components revised because of loosening after 2-10 years. Acta Orthop. 2007; 78:263–70.

27. Chou TA, Ma HH, Wang JH, et al. Total elbow arthroplasty in patients with rheumatoid arthritis. Bone Joint J. 2020; 102-B:967–80.

28. Prkic A, Welsink C, The B, van den Bekerom MP, Eygendaal D. Why does total elbow arthroplasty fail today?: a systematic review of recent literature. Arch Orthop Trauma Surg. 2017; 137:761–9.

29. Skyttä ET, Eskelinen A, Paavolainen P, Ikävalko M, Remes V. Total elbow arthroplasty in rheumatoid arthritis: a population-based study from the Finnish Arthroplasty Register. Acta Orthop. 2009; 80:472–7.
30. Ibrahim EF, Rashid A, Thomas M. Linked semiconstrained and unlinked total elbow replacement in juvenile idiopathic arthritis: a case comparison series with mean 11.7-year follow-up. J Shoulder Elbow Surg. 2017; 26:305–13.

31. Wouthuyzen-Bakker M, Boerboom AL. Black pus from a worn-out elbow arthroplasty. J Bone Jt Infect. 2022; 7:33–4.

32. Lee H, Vaichinger AM, O’Driscoll SW. Component fracture after total elbow arthroplasty. J Shoulder Elbow Surg. 2019; 28:1449–56.

33. Goldberg SH, Urban RM, Jacobs JJ, King GJ, O’Driscoll SW, Cohen MS. Modes of wear after semiconstrained total elbow arthroplasty. J Bone Joint Surg Am. 2008; 90:609–19.

34. Kim JM, Mudgal CS, Konopka JF, Jupiter JB. Complications of total elbow arthroplasty. J Am Acad Orthop Surg. 2011; 19:328–39.

35. Lee SM, Park JC, Song SW, et al. Periprosthetic fractures after total elbow replacement. J Korean Soc Surg Hand. 2010; 15:107–11.
36. Mavrogenis AF, Angelini A, Guerra E, Rotini R. Humeral fracture between a total elbow and total shoulder arthroplasty. Orthopedics. 2011; 34:01477447–20110228-21.

37. Rhee YG, Cho NS, Parke CS. Impaction grafting in revision total elbow arthroplasty due to aseptic loosening and bone loss. J Bone Joint Surg Am. 2013; 95:e741–7.

38. Dean GS, Holliger EH 4th, Urbaniak JR. Elbow allograft for reconstruction of the elbow with massive bone loss. Long term results. Clin Orthop Relat Res. 1997; (341):12–22.
39. Figgie HE 3rd, Inglis AE, Ranawat CS, Rosenberg GM. Results of total elbow arthroplasty as a salvage procedure for failed elbow reconstructive operations. Clin Orthop Relat Res. 1987; (219):185–93.
40. Kamineni S, Morrey BF. Proximal ulnar reconstruction with strut allograft in revision total elbow arthroplasty. J Bone Joint Surg Am. 2004; 86:1223–9.

41. Mansat P, Adams RA, Morrey BF. Allograft-prosthesis composite for revision of catastrophic failure of total elbow arthroplasty. J Bone Joint Surg Am. 2004; 86:724–35.

42. Laumonerie P, Granjou J, Tibbo ME, Massin V, Bonnevialle N, Mansat P. Midterm outcomes allograft prosthetic composite reconstruction for massive bone loss at the elbow. Orthop Traumatol Surg Res. 2023; 109:103517.

43. Athwal GS, Morrey BF. Revision total elbow arthroplasty for prosthetic fractures. J Bone Joint Surg Am. 2006; 88:2017–26.

44. Toulemonde J, Ancelin D, Azoulay V, Bonnevialle N, Rongières M, Mansat P. Complications and revisions after semi-constrained total elbow arthroplasty: a mono-centre analysis of one hundred cases. Int Orthop. 2016; 40:73–80.

45. Ljung P, Bornmyr S, Svensson H. Wound healing after total elbow replacement in rheumatoid arthritis: wound complications in 50 cases and laser-Doppler imaging of skin microcirculation. Acta Orthop Scand. 1995; 66:59–63.

46. Escalante A, Beardmore TD. Risk factors for early wound complications after orthopedic surgery for rheumatoid arthritis. J Rheumatol. 1995; 22:1844–51.
47. Jeon IH, Morrey BF, Anakwenze OA, Tran NV. Incidence and implications of early postoperative wound complications after total elbow arthroplasty. J Shoulder Elbow Surg. 2011; 20:857–65.

48. Spangehl M. Preoperative prophylactic antibiotics in total hip and knee arthroplasty: what, when, and how. J Arthroplasty. 2022; 37:1432–4.
49. Goyal N, Luchetti TJ, Wysocki RW, Cohen MS. Management of periprosthetic joint infection in total elbow arthroplasty. J Hand Surg Am. 2020; 45:957–70.

50. Yamaguchi K, Adams RA, Morrey BF. Infection after total elbow arthroplasty. J Bone Joint Surg Am. 1998; 80:481–91.

51. Kurtz SM, Lau E, Schmier J, Ong KL, Zhao K, Parvizi J. Infection burden for hip and knee arthroplasty in the United States. J Arthroplasty. 2008; 23:984–91.

52. Block JE, Stubbs HA. Reducing the risk of deep wound infection in primary joint arthroplasty with antibiotic bone cement. Orthopedics. 2005; 28:1334–45.

53. Leong JW, Cook MJ, O’Neill TW, Board TN. Is the use of antibiotic-loaded bone cement associated with a lower risk of revision after primary total hip arthroplasty? Bone Joint J. 2020; 102-B:997–1002.
54. Mercurio M, Castioni D, Cosentino O, et al. Revision surgery for periprosthetic elbow infection: eradication rate, complications, and functional outcomes: a systematic review. Arch Orthop Trauma Surg. 2023; 143:1117–31.

55. Spormann C, Achermann Y, Simmen BR, et al. Treatment strategies for periprosthetic infections after primary elbow arthroplasty. J Shoulder Elbow Surg. 2012; 21:992–1000.

56. Somerson JS, Morrey ME, Sanchez-Sotelo J, Morrey BF. Diagnosis and management of periprosthetic elbow infection. J Bone Joint Surg Am. 2015; 97:1962–71.

57. Peach CA, Nicoletti S, Lawrence TM, Stanley D. Two-stage revision for the treatment of the infected total elbow arthroplasty. Bone Joint J. 2013; 95-B:1681–6.

58. Wolfe SW, Figgie MP, Inglis AE, Bohn WW, Ranawat CS. Management of infection about total elbow prostheses. J Bone Joint Surg Am. 1990; 72:198–212.

59. Rhee YG, Cho NS, Park JG, Song JH. Resection arthroplasty for periprosthetic infection after total elbow arthroplasty. J Shoulder Elbow Surg. 2016; 25:105–11.

60. Dachs RP, Vrettos BC, Chivers DA, Du Plessis JP, Roche SJ. Outcomes after ulnar nerve in situ release during total elbow arthroplasty. J Hand Surg Am. 2015; 40:1832–7.

61. Gill DR, Morrey BF. The Coonrad-Morrey total elbow arthroplasty in patients who have rheumatoid arthritis: a ten to fifteen-year follow-up study. J Bone Joint Surg Am. 1998; 80:1327–35.

62. Kelly EW, Coghlan J, Bell S. Five- to thirteen-year follow-up of the GSB III total elbow arthroplasty. J Shoulder Elbow Surg. 2004; 13:434–40.

63. Pierce TD, Herndon JH. The triceps preserving approach to total elbow arthroplasty. Clin Orthop Relat Res. 1998; (354):144–52.

64. Hildebrand KA, Patterson SD, Regan WD, MacDermid JC, King GJ. Functional outcome of semiconstrained total elbow arthroplasty. J Bone Joint Surg Am. 2000; 82:1379–86.

65. Studer A, Athwal GS, MacDermid JC, Faber KJ, King GJ. The lateral para-olecranon approach for total elbow arthroplasty. J Hand Surg Am. 2013; 38:2219–26.

66. Dachs RP, Fleming MA, Chivers DA, et al. Total elbow arthroplasty: outcomes after triceps-detaching and triceps-sparing approaches. J Shoulder Elbow Surg. 2015; 24:339–47.

67. Celli A, Arash A, Adams RA, Morrey BF. Triceps insufficiency following total elbow arthroplasty. J Bone Joint Surg Am. 2005; 87:1957–64.

Fig. 2.
The medial condyle was broken during implant insertion. Overall stability was maintained; thus, further procedures were not needed (triceps preservation approach, type I).
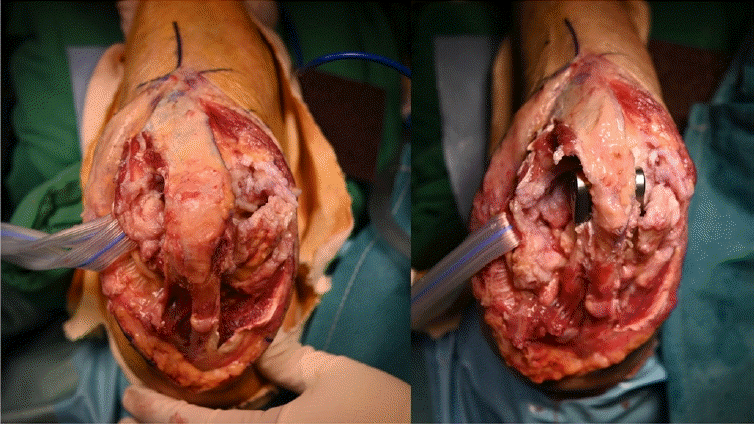
Fig. 3.
(A) The medial condyle was broken during the insertion of the implant. The overall stability was not good; thus, wiring was added. (B) At the 2-year follow-up, radiographic bony union was confirmed, with no loosening (type I).
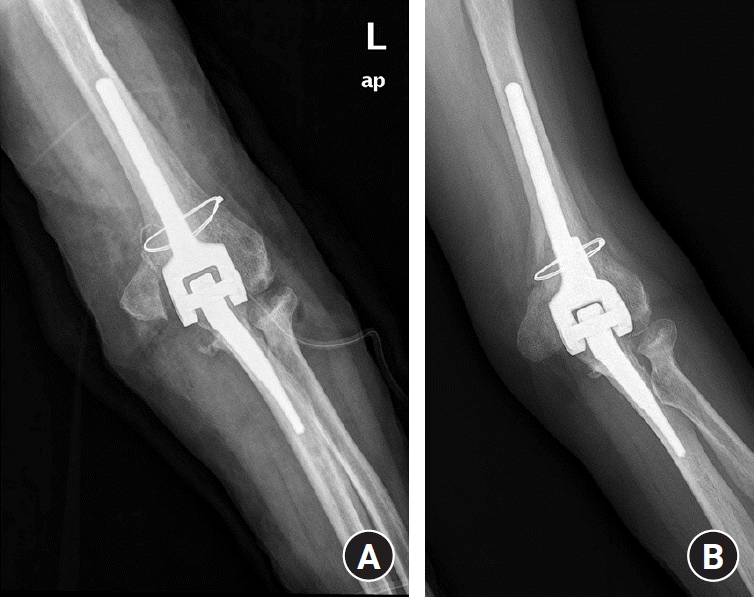
Fig. 4.
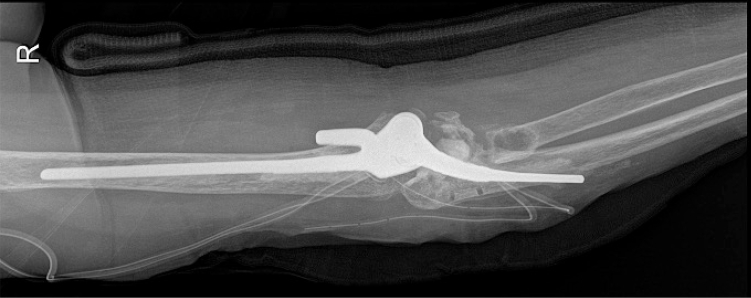
(A) The dorsal cortex of the ulna was broken during revision arthroplasty with a long stem (type II). (B) At the 1-year follow-up, stem stability is maintained.
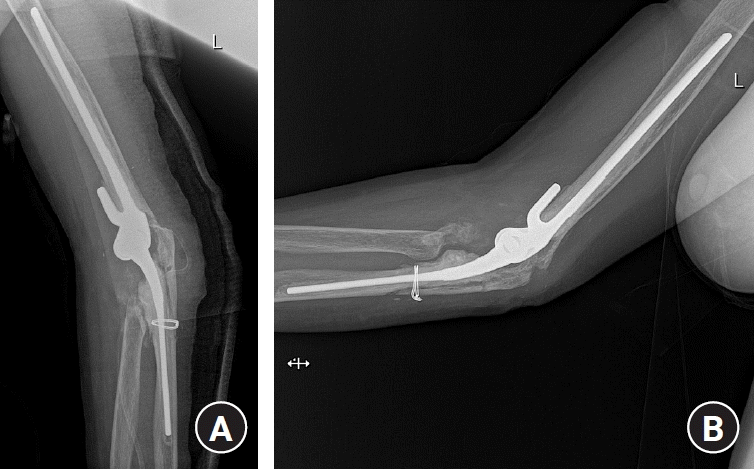
Fig. 6.
(A) Aseptic loosening resulted in fenestration of the anterior cortex of the ulna. (B) Revision surgery was performed using a fibular allograft.
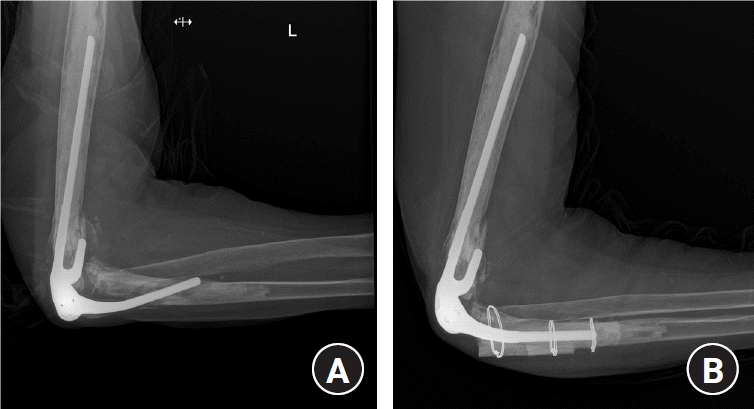
Fig. 8.
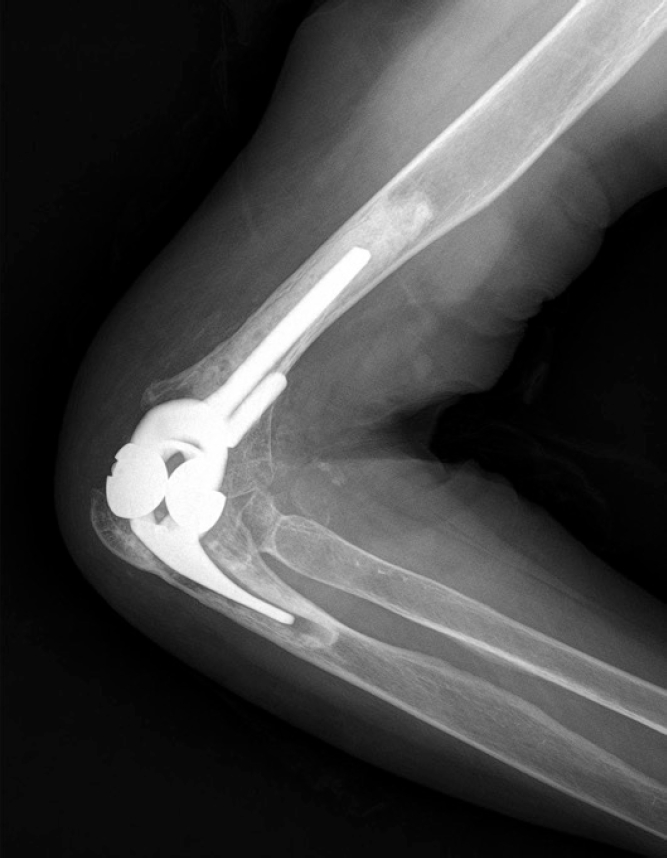
(A, B) Failed unlinked prosthesis. (C, D) Severe metallosis and wear were identified. (E, F) The unstable prothesis (unlinked) was replaced with a semiconstrained model.
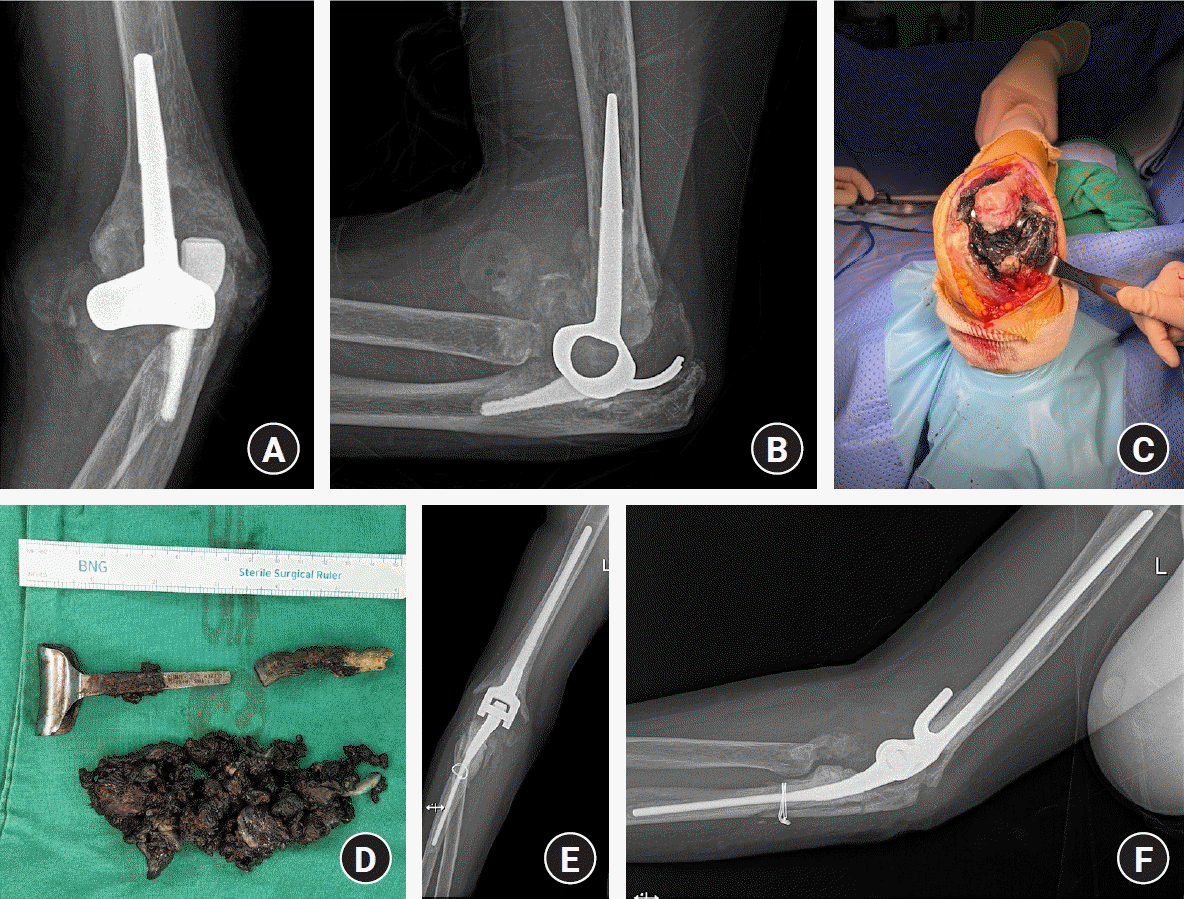
Fig. 9.
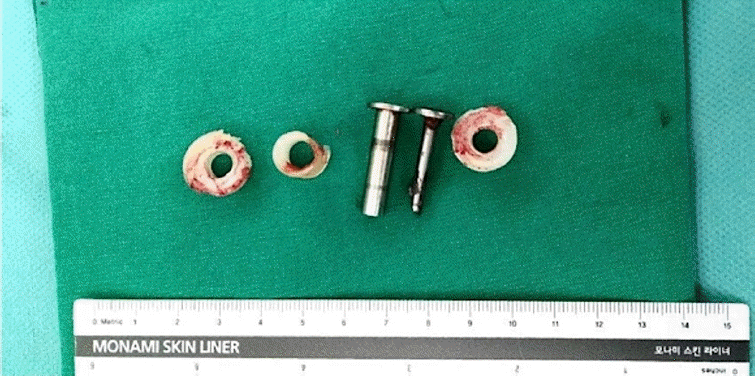
Only polyethylene and bushing were changed. Both stems were strongly fixed in the humerus and ulna.
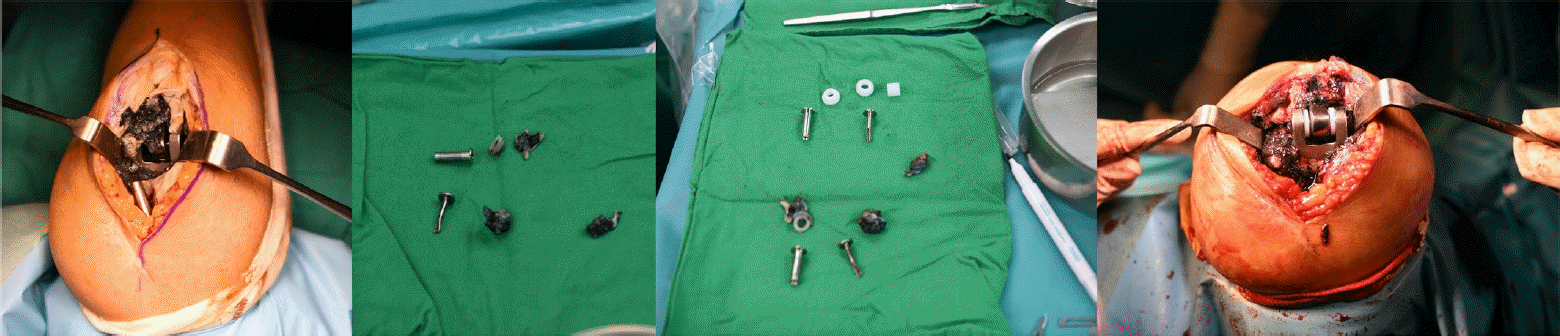
Fig. 11.
(A) Periprosthetic fracture of the ulna (type I). (B) Proper healing was seen by conservative management at 1-year follow-up.
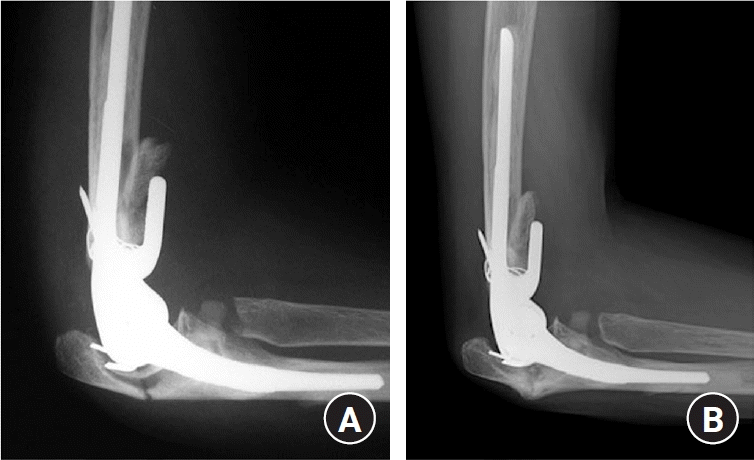
Fig. 12.
(A) Periprosthetic fracture (type III). (B, C) Plating and wiring on the stable humerus stem was performed. (D, E)
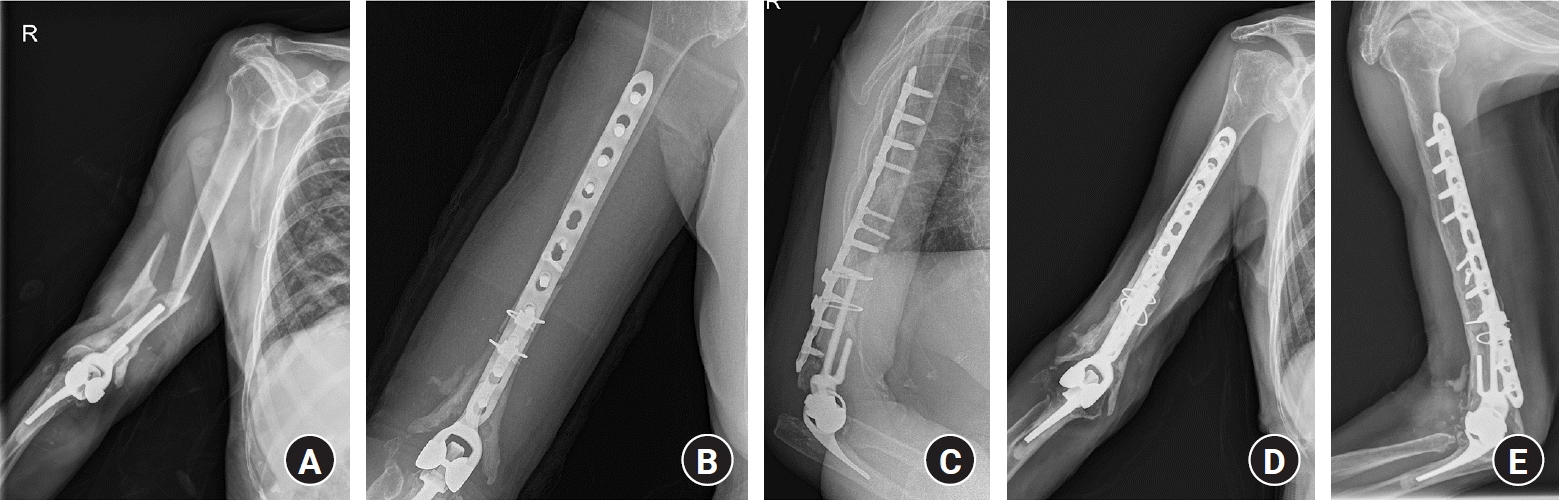
Fig. 13.
Bone defects due to comminuted periprosthetic fractures were managed using an allograft-prosthesis composite with a long humeral stem. The stability of the ulna stem was maintained.
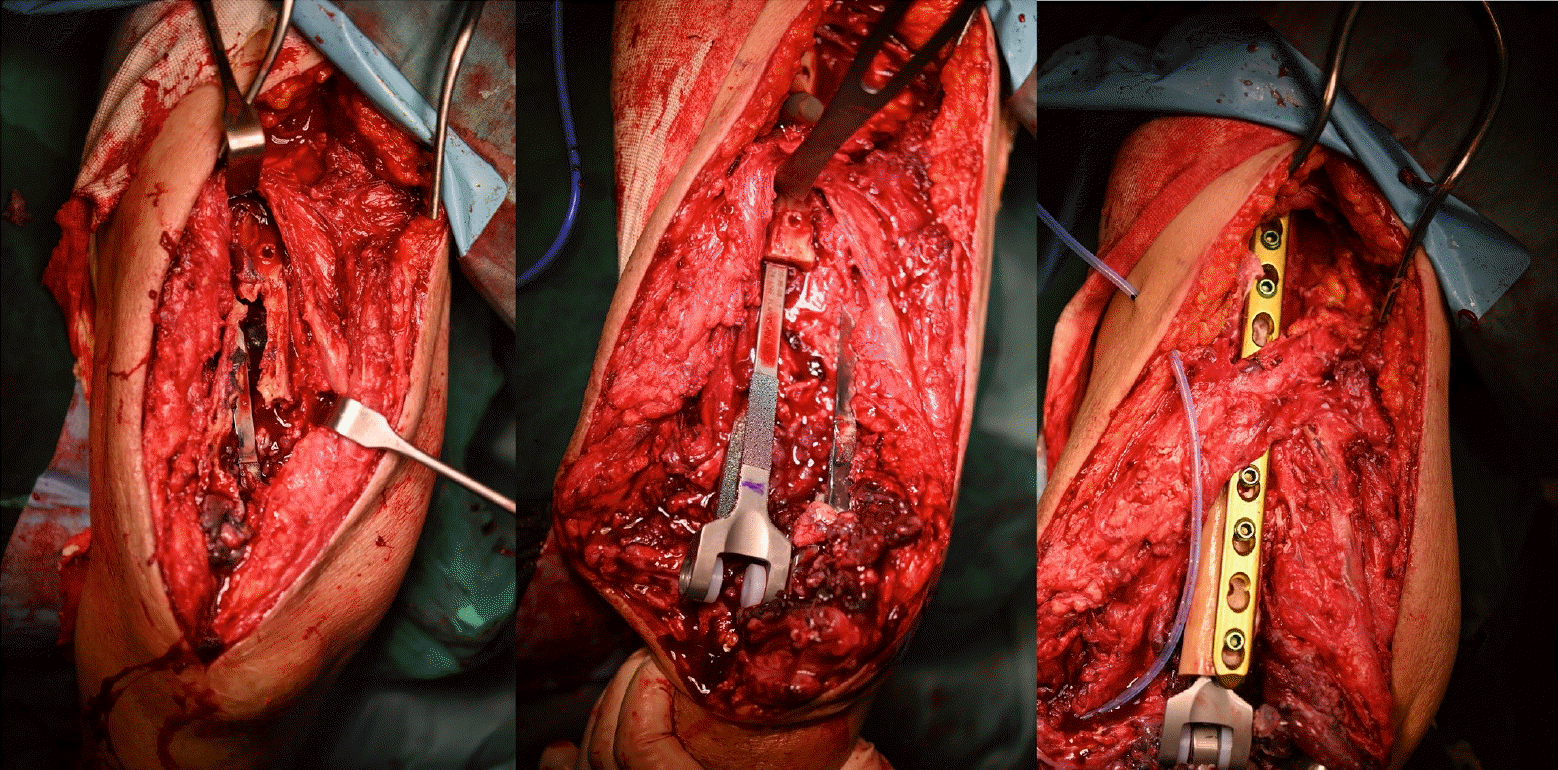
Fig. 14.
Bone defects due to comminuted periprosthetic fractures were managed using an allograft-prosthesis composite (type III). Courtesy from Prof. Joo Yup Lee.
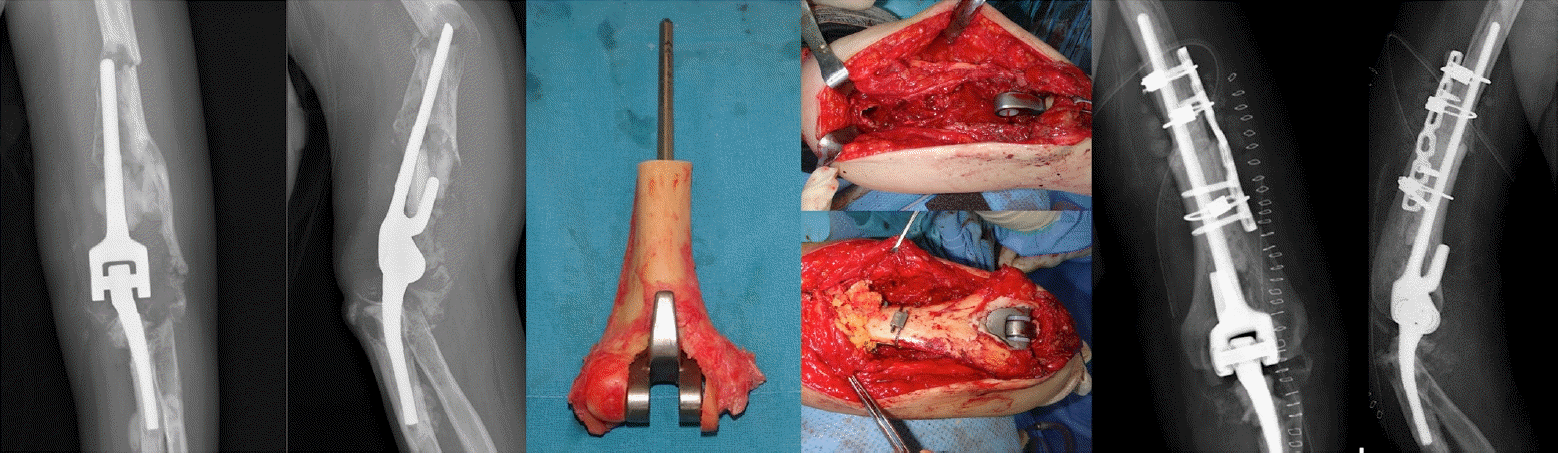
Fig. 17.
(A) A case of infected total elbow arthroplasty was referred for treatment 4 years after the index surgery. The symptoms began 2 months prior. (B) All prostheses were pulled out, and antibiotic beads were inserted. During removal, cement and bone were inevitably broken. (C) Three months later, revision surgery was performed with a new prosthesis, and there were no symptoms of infection during 3 years of follow-up.
Fig. 18.
(A) Through either a midline incision or the radial border of the triceps, a humeral or ulnar stem was inserted. (B) In comminuted distal humeral fractures, the triceps-preserving method was easily used after resection of comminuted fragments.
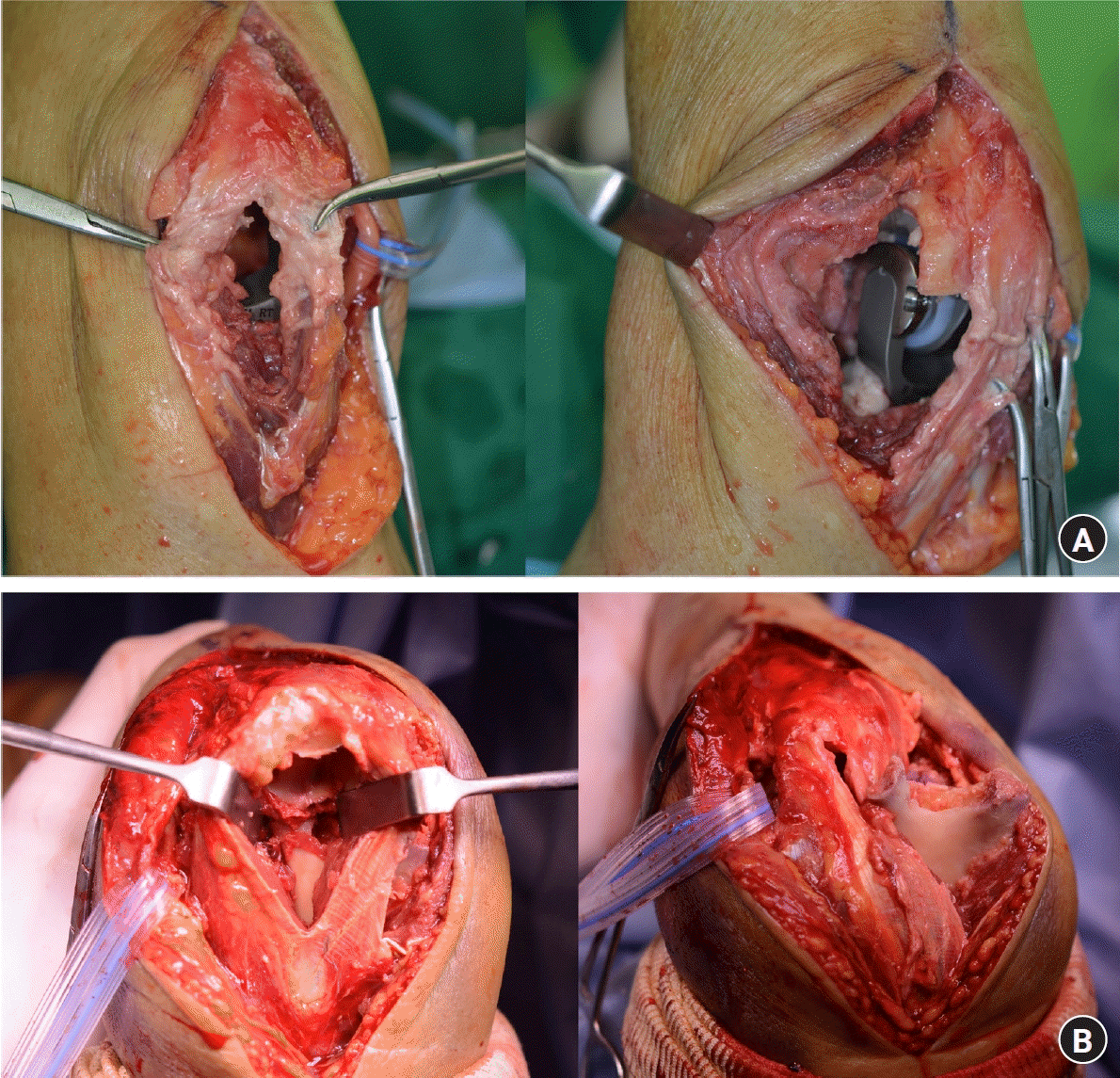
Table 1.
Mayo classification of periprosthetic fractures
Adapted from O’Driscoll and Morrey [18] with permission of Elsevier and Mayo foundation.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download