Abstract
Objectives
Some reports suggest that the concentration-to-dosage ratio (C/D ratio) of clozapine (CZP) in Asian treatment-resistant schizophrenia (TRS) patients differs from that of Caucasian TRS patients. However, there is insufficient research on the differences in C/D ratio between Korean TRS patients and Caucasian TRS patients. Therefore, this study aimed to investigate prescribed CZP dosage, CZP concentration and C/D ratio in Korean TRS patients.
Methods
The study included TRS patients aged 18 years or older who were prescribed CZP for at least 12 weeks at a psychiatric hospital in Korea. We collected demographic information, smoking status, hospitalization status, CZP serum concentration, total CZP dosage, and norclozapine (NCZP) serum concentration and analyzed their statistical correlations.
Results
The study found that the average daily CZP dosage was 266.1 mg, and the average CZP concentration was 568.0 ng/mL. There was a significant correlation between CZP serum concentration and smoking status, as well as sex. CZP dosage was not significantly associated with age, weight, BMI, or metabolic rate. The study also found a significant difference in C/D ratio between groups based on CZP serum concentration.
Conclusion
Our study suggests that recommended CZP dosages for Caucasians may not be suitable for Koreans due to C/D ratio differences. We found a relationship between CZP serum concentration and C/D ratio in Korean TRS patients. Therefore, it is crucial to confirm CZP serum concentration to avoid side effects and to find optimal dosage.
클로자핀(clozapine, CZP)은 비정형 항정신병약물의 원형으로 치료 저항성 조현병(Treatment resistent schizophrenia, TRS) 환자에서 양성증상과 음성증상에 모두 효과가 있으며, 추체외로 증상(extrapyramidal symptom, EPS)의 발생률도 더 적은 것으로도 알려져 있다[1,2]. 그러나 이러한 이점에도 불구하고, 조현병의 1차 선택약제로는 권장되지 않고 있는데, 이는 CZP가 대사 부작용부터 무과립구혈증까지 다양한 부작용 발생 가능성이 있기 때문이다. 이러한 이유로 각국의 조현병 치료 가이드라인에서는 초발 환자의 1차 선택약제가 아닌 TRS 환자에서의 1차 선택약제로 추천되고 있다[3,4].
Therapeutic drug monitoring (TDM)에 관한 Arbeitsgemeinschaft für Neuropsycho-pharmakologie und Pharmakopsychiatrie (AGNP) 합의 지침서에 따르면, 제시된 CZP 치료 참고범위(therapeutic reference level)는 350에서 600 ng/mL였고, 경련을 일으킬 수 있는 실험실 경고 수준(laboratory alert level)은 1,000 ng/mL 이상이었다[5]. 또한 여러 연구에서 CZP 혈중농도를 치료범위인 350 ng/mL 이상으로 유지하기 위한 경구 투여량을 300에서 600 mg/day를 제시하고 있었는데[6], 이와 같은 수치는 코카시안을 대상으로 한 연구를 기반으로 하기 때문에 다른 인종과의 차이점에 대한 고려는 충분히 이루어지지 않았다[7-9].
최근 동아시아 환자들을 대상으로 한 체계적 문헌 고찰에서 CZP 혈중농도 대 용량 비(concentration-to-dose ratio, C/D ratio)가 코카시안에 비해 1.5배 높은 것으로 나타났다[10]. 추가적으로 코카시안과 아시아인을 대상으로 한 CZP 치료용량에 관한 연구에서 코카시안이 CZP 하루 평균 처방용량이 433 mg 임에 반해, 아시아인은 176 mg였으나 혈중농도는 유사한 수치를 보인다는 결과도 있었다[11]. 추가적으로 최근 발표된 CZP의 국내 처방 패턴에 관한 연구에서 하루평균 처방 용량이 281 mg으로 보고되어 코카시안과 차이를 보이고 있었다[12].
코카시안과 유전적 차이점을 가지는 동아시아인, 특히 한국인을 대상으로 임상적인 상황에서 CZP 혈중농도와 처방용량, 변인들 간의 관계를 확인할 수 있다면, 불필요하게 높은 용량을 처방하여 발생할 수 있는 부작용 가능성을 낮출 수 있을 것이다. 본 연구는 한국인 TRS 환자의 CZP 처방용량과 혈중농도 및 이에 관련된 다양한 변인들을 평가하여 이전에 발표된 해외 여러 논문에서의 처방용량과 혈중농도를 비교하기 위해 고안된 연구이다.
전라북도 마음사랑병원 정신건강의학과 외래 또는 입원 환자 중 미국정신장애의 진단 및 통계편람 제5판(Diagnostic and Statistical Manual of Mental Disorder, 5th edition, DSM-5)의 조현병 진단 기준을 만족시키고 CZP 사용기간이 12주 이상인 만 18세 이상의 성인 환자들 중에서 2020년 8월부터 2022년 8월까지 CZP 혈중 농도를 검사했던 환자들을 대상으로 하였다. 포함기준은 1) DSM-5를 기준으로 조현병 진단받은 환자 중 만 18세 이상의 성인, 2) 채혈 당시 12주 이상 CZP 복용 중인 환자, 3) CZP 농도 측정을 1회 이상 시행한 환자로 하였고, 배제기준은 1) 흡연여부, 키, 몸무게 등의 연구변인 정보가 누락되어 있는 환자, 2) 용량 조절 중 CZP 부작용으로 인해 복용 중단된 환자, 3) 복약 순응도를 확인할 수 없어 항정상태에 도달했다고 볼 수 없는 환자로 하였다. 선정기준에 부합하는 환자는 총 41명이었으며, 제외 기준에 해당하여 연구대상자에서 제외된 환자는 3명이었다. 총 연구대상은 38명으로 남성 19명, 여성 19명이었다. 치료기간 동안 CZP 용량은 임상의에 의해 부작용, 효과 등을 고려하여 조절되었다. 환자들 중 당뇨, 고지혈증, 간질환 등의 기저질환을 가진 자는 없었다. 일반혈액검사(complete blood count, CBC), 간기능검사(liver function test, LFT) 상에서도 정상범위 내에 해당했다.
본 연구는 후향적으로 의무기록 조사만을 통해 자료를 수집하여 진행된 연구로 개인 식별이 가능한 정보가 배제되어 연구 대상자에게 동의서를 취득하지 않고 진행되었고, 공용기관생명윤리위원회의 승인을 받아 진행하였다(P01-202302-01-034).
입원 또는 외래 환자 기록지를 통하여 임상 변인들을 조사하였다. 조사 변인은 나이, 성별, 입원여부, 몸무게, 키, BMI, 흡연여부, CZP 일 복용량, 혈중 CZP 농도(Clozapine blood concentration), 혈중 노르클로자핀(norclozapine, NCZP) 농도, CZP 복용량과 혈중 CZP 농도의 비(Concentration to dose ratio, C/D ratio), 혈중 CZP과 혈중 NCZP의 비(Clozapine to norclozapine ratio; metabolic rate, MR), 백혈구수 (White blood cell, WBC), 호중구비율(Neutrophil, %), 절대호중구수(Absolute neutrophil count, ANC), 치료기간(Month)이었다.
외부기관인 GClabs를 통해 진행되었으며, 검체는 체취 후 3,000 RPM에서 5분동안 원심분리 후 상층액(serum)을 채취하여 냉장 보관하였다. 검사기관 도착 후 검체 전처리를 위해 이중바탕시료(double blank sample), 검정곡선바탕시료(calibrator sample), 정도관리시료(quality control sample), 환자 검체를 볼텍스 믹서를 이용하여 잘 섞어준 후, 균일화된 시료 10 μL를 마이크로 튜브에 넣었다. 내부표준물질 용액 10 μL와 100% 메탄올 1 mL를 넣고 뚜껑을 닫은 후 1분간 볼텍스 믹서를 이용하여 섞어주고, 13,200 rpm에서 10분간 원심분리하였다. 96 홈판(well plate)에 180 μL씩 넣고 시료가 증발하지 않도록 알루미늄 호일로 홈판을 잘 감싸 자동채취기(auto-sampler)에 넣어 LC/MS/MS에 2 μL씩 주입하였다. 이중바탕시료, 검정곡선바탕시료, 정도관리시료, 검체, 정도관리 시료의 순서로 배치분석을 시행하고 SCIEX사의 AnalystⓇ 1.6.3을 이용하여 자동으로 계산된 농도 값을 채택하였다.
자료의 분석은 R studio (version 4.2 for windows) 프로그램을 이용하였다. 변인들의 정규성을 확인하기 위하여 Shapiro-Wilk test를 시행하였고, 정규성을 만족하는 인자들 중에서 각 그룹 사이의 평균을 비교하기 위해 성별, 흡연, 입원 여부에 따라 각각 두 그룹으로 나누었다. 각 그룹에 대하여 CZP 혈중농도, C/D ratio, MR, ANC의 그룹 간 차이를 확인하기 위하여 t-test를 시행하였다. 추가적으로 각각의 인자들 간의 상관관계를 확인하기 위하여 Pearson 상관계수를 측정하였고 유의 수준은 p-value<0.05로 하였다. CZP 혈중농도를 350 ng/mL, 600 ng/mL를 기준으로 세 구간으로 나누어 각각의 등분산을 확인하기 위하여 Bartlett 검정을 시행하였고, ANOVA 시행 후 사후검정을 진행하였다. 분석 결과를 바탕으로 연령, 성별, 흡연여부 등의 다양한 변인이 미치는 영향을 보정하기 위해 후진 단계별 회귀분석(Backward stepwise regression analysis)을 시행하였다.
표 1에 연구대상의 일반적 특징을 요약하였다. 연구 대상의 남녀비율은 각각 19명으로 같았고, 흡연자의 비율은 38명 중 11명으로 29%이었다. 평균 연령±표준편차(SD)는 45.6±12.4세였다. 환자들의 총 치료기간은 201.8±112.5개월이었다. 평균 CZP 하루 총 복용량은 266.1±86.5 mg이었고, CZP과 NCZP 평균 혈중농도는 각각 568.0±321.0 ng/mL, 289.1±162.3 ng/mL이었다. C/D ratio는 2.16±1.08이었다. MR은 평균 2.06±0.61이었다.
성별에 따라 C/D ratio는 통계적으로 유의미한 차이를 보였으나(p=0.0178), 혈중 CZP 농도, 하루 총 복용량, MR, ANC에서는 통계적인 차이를 보이지 않았다. 흡연 여부에 따른 CZP 혈중 농도는 통계적으로 유의한 차이를 보였다(p=0.0344). 또한 C/D ratio도 흡연여부에 따라 통계적으로 유의미한 차이를 보였다(p=0.0235). 입원 여부는 그룹 간에 통계적으로 유의미한 차이를 나타내지 않았다(표 2).
Pearson’s 상관분석에서 CZP 혈중농도와 NCZP 혈중농도, C/D ratio가 높은 상관계수를 가짐을 확인하였고(r=0.842, 0.838, p<0.001), CZP 하루 총 복용량과도 연관성이 있음을 확인하였다(r=0.395, p=0.014). 그리고 C/D ratio와 NCZP의 혈중농도가 연관되어 있음이 확인되었다(r=0.674, p<0.001). 그러나 나이, 체중, BMI, MR은 CZP, NCZP, CZP 총 복용량과 연관관계를 확인할 수 없었다(표 3).
연구 대상을 CZP 혈중농도에 따라 350 ng/mL, 600 ng/mL을 기준으로 세 구간으로 나누었고 그룹에 따른 C/D ratio를 확인한 결과 각각의 그룹의 평균은 1.05, 1.80, 3.04로 통계적으로 유의한 차이를 보였다(p<0.001) (그림 1).
본 연구에서 평균 C/D ratio는 2.16±1.08로 이전에 서양권에서 보고되었던 연구들에 비해 높은 수준을 보였다[7-9,13]. 이전 코카시안과 동아시아인의 C/D ratio를 비교한 연구에서의 결과 값과 유사한 것으로 볼 수 있다[10,14]. C/D ratio는 CZP 청소율과 연관이 있는 것으로 알려져 있고 CZP는 일차적으로 CYP1A2에 의해 대사된다[15,16]. 동아시아인에서 CYP1A2의 유도능을 감소시키는 1C 유전자 비율이 21%-26.7%로 코카시안에서 0.8%-4%보다 크게 높다[17]. 따라서 이는 동아시아인의 유전적 특성과의 연관성도 고려해볼 수 있을 것이다.
CZP 혈중농도에 따른 C/D ratio에서도 통계적인 차이를 확인할 수 있었다(그림 1). 이는 CZP 혈중농도가 부작용을 일으킬 위험성이 높아지는 1,000 ng/mL 이상으로 높아지거나 치료 농도인 350 ng/mL 이하로 떨어지는 경우라면, 해당 환자의 C/D ratio가 극단적으로 높아지거나 낮아질 수 있음을 의미한다. 따라서 이에 따른 면밀한 CZP 혈중농도의 모니터링이 중요하다고 할 수 있을 것이다.
성별과 흡연 여부에 따라 C/D ratio의 차이도 확인할 수 있었는데, 흡연자에서 1.55, 비흡연자에서 2.41로 확인되었고, 성별에 따라서는 남성에서 1.75, 여성에서 2.56으로 확인되었다(표 2). 이러한 결과는 CZP의 대사에 관한 이전 논문들과도 일치하는 결과이다[18,19]. 본 연구 대상자중 흡연자는 성별에 따라 각각 여성환자의 5.3%, 남성환자의 52.6%로 확인되었는데, 연구 대상자들의 흡연 여부가 성별에 따라 차이를 보이고 있어 여성에서의 C/D ratio가 높은 이유와의 연관성도 고려할 수 있을 것이다[18,20-22]. 이러한 C/D ratio의 차이로 인해 적은 용량으로도 치료농도에 쉽게 도달할 수 있다는 점에서 여성과 비흡연자의 경우에는 CZP의 총 복용량을 조절하는 것이 필요할 것으로 생각된다.
상기 결과를 바탕으로 성별, 흡연여부 등의 다양한 혼란변인이 미치는 영향을 보정하기 위해 후진 단계별 회귀분석(Backward stepwise regression analysis)을 시행하였고, 입원여부, 흡연여부, 성별을 변수로 하는 최종모델을 선택하였으나(AIC=2.2353, p=0.02482) 통계적으로 설명력이 낮아(Adjusted R2=0.1706) 적용할 수 없었다.
이전 연구에서 무과립구혈증과 관련된 인자로 NCZP의 혈중농도를 들기도 하였는데[23], 본 연구에서는 NCZP와 ANC의 의미있는 상관관계를 확인할 수 없었다. 이러한 결과에는 CZP 사용 가이드라인과 연관성을 생각해볼 수 있는데, CZP 사용시 18주간 일주일마다 CBC 검사를 통해 무과립구혈증의 발생여부를 감시하게 되고 이로 인해 ANC 감소가 확인되는 환자에서는 CZP 사용을 중단하므로, 지속적으로 CZP 사용이 불가능하여 본 연구대상에 포함되지 않았을 것으로 생각된다.
본 연구에서는 MR과 CZP 혈중농도 간의 통계적 연관성을 확인할 수 없었다. 그러나 이전 연구결과들에 따르면 MR도 임상적으로 저대사자(poor metabolizer, PM)를 확인할 수 있는 좋은 지표로 활용될 수 있는데, CZP 혈중농도를 다중회귀분석한 결과 MR 1.32를 기준으로 0.1 증가할 때마다 CZP 혈중농도가 8% 가량 증가하는 것으로 나타났다[19]. 또 다른 리뷰 연구에서는 평균 MR을 1.73으로 보고 있으며, 그 범위를 1.19에서 3.37로 보고하였다[24]. MR 수치를 기반으로 하여 환자 개인의 대사속도 및 이에 영향을 미치는 인자들에 대하여 추측해볼 수 있는데, MR 0.5 이하에서는 고대사자(ultra-metabolizer, UM)로 분류되어 NCZP에 비해 CZP 혈중농도가 낮아지며, 3 이상에서는 CZP 대사를 저해하는 요인으로 인해 CZP 혈중농도가 과도하게 상승할 가능성이 있다[25].
본 연구에서는 나이와 체중, BMI와 CZP 혈중농도 간의 연관성을 확인할 수 없었으나 몇몇 연구에서는 나이의 증가나 BMI에 따라 CZP 혈중농도에 영향을 미치는 결과를 보고하기도 하였다[26-30]. 이러한 원인에 대해서는 아직 불분명하나 향후 대상환자의 나이 및 BMI를 통제하여 추가적인 연구가 필요할 것으로 생각된다.
본 연구는 후향적 연구로 CZP 복용량과 복용일수가 통제되지 않았다. 이 때문에 환자들 간의 개인적 특성의 차이를 통제할 수 없었다. 추가적인 한계점으로는 치료 효과 및 부작용, 채혈시점 및 CZP 처방 시점, 다른 항정신병 약물 사용에 대한 정보가 반영되어 있지 않아 CZP 혈중농도와 치료효과 및 부작용 간의 상관관계에 대해서는 확인할 수 없었다. 또한 적은 연구대상자수로 인해 결과를 일반화하기 어려운 점도 큰 한계점이라고 할 수 있다. 이러한 한계점에도 불구하고 임상적 상황에서 CZP 복용량과 CZP 혈중농도, C/D ratio 간의 통계적 연관성을 확인한 점에서 의미가 있다고 할 수 있겠다.
본 연구에서는 환자군 모집의 한계로 코카시안과 한국인 간의 직접적인 비교가 불가능하였는데, 추후 연구 대상자 모집을 통해 선행적 실험 비교연구를 진행한다면 결론을 좀 더 명확히 할 수 있을 것이다.
REFERENCES
1. Lewis SW, Barnes TRE, Davies L, Murray RM, Dunn G, Hayhurst KP, et al. Randomized controlled trial of effect of prescription of clozapine versus other second-generation antipsychotic drugs in resistant schizophrenia. Schizophr Bull. 2006; 32:715–723.

2. McEvoy JP, Lieberman JA, Stroup TS, Davis SM, Meltzer HY, Rosenheck RA, et al. Effectiveness of clozapine versus olanzapine, quetiapine, and risperidone in patients with chronic schizophrenia who did not respond to prior atypical antipsychotic treatment. Am J Psychiatry. 2006; 163:600–610.

3. Keepers GA, Fochtmann LJ, Anzia JM, Benjamin S, Lyness JM, Mojtabai R, et al. The American Psychiatric Association Practice Guideline for the Treatment of Patients With Schizophrenia. AJP. 2020; 177:868–872.

4. Barnes TR, Drake R, Paton C, Cooper SJ, Deakin B, Ferrier IN, et al. Evidence-based guidelines for the pharmacological treatment of schizophrenia: Updated recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2020; 34:3–78.

5. Hiemke C, Baumann P, Bergemann N, Conca A, Dietmaier O, Egberts K, et al. AGNP Consensus Guidelines for Therapeutic Drug Monitoring in Psychiatry: Update 2011. Pharmacopsychiatry. 2011; 44:195–235.

6. Spina E, de Leon J. Clinical applications of CYP genotyping in psychiatry. J Neural Transm (Vienna). 2015; 122:5–28.

7. Perry PJ, Miller DD, Arndt SV, Cadoret RJ. Clozapine and norclozapine plasma concentrations and clinical response of treatment-refractory schizophrenic patients. Am J Psychiatry. 1991; 148:231–235.
8. Hasegawa M, Gutierrez-Esteinou R, Way L, Meltzer HY. Relationship between clinical efficacy and clozapine concentrations in plasma in schizophrenia: effect of smoking. J Clin Psychopharmacol. 1993; 13:383–390.
9. Wetzel H, Anghelescu I, Szegedi A, Wiesner J, Weigmann H, Härter S, et al. Pharmacokinetic interactions of clozapine with selective serotonin reuptake inhibitors: differential effects of fluvoxamine and paroxetine in a prospective study. J Clin Psychopharmacol. 1998; 18:2–9.

10. Ruan CJ, Zang YN, Wang CY, Cheng YH, Sun C, Spina E, et al. Clozapine Metabolism in East Asians and Caucasians: a Pilot Exploration of the Prevalence of Poor Metabolizers and a Systematic Review. Journal of Clinical Psychopharmacology. 2019; 39:135.
11. Ng CH, Chong SA, Lambert T, Fan A, Peter Hackett L, Mahendran R, et al. An inter-ethnic comparison study of clozapine dosage, clinical response and plasma levels. International Clinical Psychopharmacology. 2005; 20:163–168.

12. Kang SH, Lee HW. Prescribing Pattern of Clozapine and Clinical Factors associated with Discontinuation of Clozapine. Korean J Schizophr Res. 2019; 22:1.

13. Iglesias García C, Iglesias Alonso A, Bobes J. Concentrations in plasma clozapine levels in schizophrenic and schizoaffective patients. Rev Psiquiatr Salud Ment. 2017; 10:192–196.

14. Reeves S, Bertrand J, Obee SJ, Hunter S, Howard R, Flanagan RJ. A population pharmacokinetic model to guide clozapine dose selection, based on age, sex, ethnicity, body weight and smoking status. Br J Clin Pharmacol. 2023; 1–11.

15. Albitar O, Harun SN, Zainal H, Ibrahim B, Sheikh Ghadzi SM. Population Pharmacokinetics of Clozapine: A Systematic Review. Biomed Res Int. 2020; 2020:9872936.

16. Smith RL, O’Connell K, Athanasiu L, Djurovic S, Kringen MK, Andreassen OA, et al. Identification of a novel polymorphism associated with reduced clozapine concentration in schizophrenia patients—a genome-wide association study adjusting for smoking habits. Transl Psychiatry. 2020; 10:1–10.

17. McGraw J, Waller D. Cytochrome P450 variations in different ethnic populations. Expert Opin Drug Metab Toxicol. 2012; 8:371–382.

18. Qurashi I, Stephenson P, Nagaraj C, Chu S, Drake R, Couchman L, et al. Changes in smoking status, mental state and plasma clozapine concentration: retrospective cohort evaluation. BJPsych Bull. 2019; 43:271–274.

19. Rostami-Hodjegan A, Amin AM, Spencer EP, Lennard MS, Tucker GT, Flanagan RJ. Influence of Dose, Cigarette Smoking, Age, Sex, and Metabolic Activity on Plasma Clozapine Concentrations: A Predictive Model and Nomograms to Aid Clozapine Dose Adjustment and to Assess Compliance in Individual Patients. Journal of Clinical Psychopharmacology. 2004; 24:70–78.

20. Tsai YW, Tsai TI, Yang CL, Kuo KN. Gender Differences in Smoking Behaviors in an Asian Population. J Womens Health (Larchmt). 2008; 17:971–978.

21. Cao XL, Li Y, Zhong BL, Chiu HFK, Ungvari GS, Ng CH, et al. Current cigarette smoking in Chinese female patients with schizophrenia: A meta-analysis. Psychiatry Research. 2016; 235:203–205.

22. Xu YM, Chen HH, Li F, Deng F, Liu XB, Yang HC, et al. Prevalence and Correlates of Cigarette Smoking among Chinese Schizophrenia Inpatients Receiving Antipsychotic Mono-Therapy. PLOS ONE. 2014; 9:e88478.

23. Willcocks IR, Legge SE, Nalmpanti M, Mazzeo L, King A, Jansen J, et al. Clozapine Metabolism is Associated With Absolute Neutrophil Count in Individuals With Treatment-Resistant Schizophrenia. Front Pharmacol. 2021; 12:658734.

24. Schoretsanitis G, Kane JM, Ruan CJ, Spina E, Hiemke C, de Leon J. A comprehensive review of the clinical utility of and a combined analysis of the clozapine/norclozapine ratio in therapeutic drug monitoring for adult patients. Expert Rev Clin Pharmacol. 2019; 12:603–621.

25. Couchman L, Bowskill SVJ, Handley S, Patel MX, Flanagan RJ. Plasma clozapine and norclozapine in relation to prescribed dose and other factors in patients aged <18 years: data from a therapeutic drug monitoring service, 1994-2010: Plasma clozapine: patients aged <18 years. Early Intervention in Psychiatry. 2013; 7:122–130.

26. Kuzin M, Haen E, Hiemke C, Bochon B, Bochon K, Gründer G, et al. Body mass index as a determinant of clozapine plasma concentrations: A pharmacokinetic-based hypothesis. J Psychopharmacol. 2021; 35:273–278.

27. Ismail Z, Wessels AM, Uchida H, Ng W, Mamo DC, Rajji TK, et al. Age and sex impact clozapine plasma concentrations in inpatients and outpatients with schizophrenia. Am J Geriatr Psychiatry. 2012; 20:53–60.

28. Castberg I, Westin AA, Skogvoll E, Spigset O. Effects of age and gender on the serum levels of clozapine, olanzapine, risperidone, and quetiapine. Acta Psychiatr Scand. 2017; 136:455–464.

Fig. 1.
Concentration-to-Dose Ratio (C/D ratio) by Clozapine (CZP) Blood Concentration Groups. The study participants were classified into three groups based on their clozapine blood concentration: below 350 ng/mL (CZP low), 350-600 ng/mL (CZP mid), and above 600 ng/mL (CZP high). Upon analyzing the C/D ratios within each group, significant differences in the average ratios were confirmed (p<0.001).
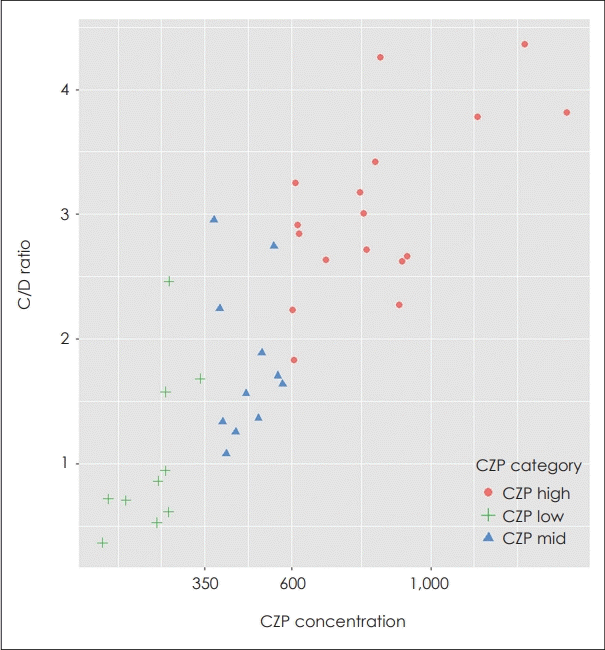
Table 1.
Clinical baseline characteristics (n=38)
Table 2.
Summary of mean values by sex, smoking, admission
|
Sex |
Smoking |
Admission |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| M | F | p | S | N | p | I | O | p | |
| CZP | 501.51 | 634.44 | 0.2061 | 397.19 | 637.55 | 0.0344* | 589.85 | 497.48 | 0.4584 |
| Total clozapine dosage | 285.27 | 246.93 | 0.1754 | 253.90 | 271.07 | 0.5862 | 273.11 | 243.52 | 0.3775 |
| C/D ratio | 1.75 | 2.56 | 0.0178* | 1.55 | 2.41 | 0.0235* | 2.210 | 1.992 | 0.6026 |
| MR | 2.08 | 2.03 | 0.8358 | 1.86 | 2.14 | 0.205 | 2.152 | 1.746 | 0.0805 |
| ANC | 3,633 | 3,846 | 0.5915 | 3,677 | 3,765 | 0.8422 | 3,798 | 3,549 | 0.5941 |
M, male; F, female; S, smoker; N, nonsmoker; I, inpatient; O, outpatient; CZP, clozapine blood concentration; C/D ratio, clozapine blood concentration to total clozapine dosage ratio; MR, clozapine blood concentration to norclozapine blood concentration ratio, metabolic rate; ANC, absolute neutrophil count
Table 3.
Pearson’s correlations among Clozapine blood concentration, C/D ratio, MR, ANC
| Age | Weight | BMI | Total CZP dosage | NCZP | CZP | C/D ratio | MR | |
|---|---|---|---|---|---|---|---|---|
| CZP | 0.120 | -0.112 | -0.104 | 0.395* | 0.842† | 1 | 0.838† | 0.236 |
| C/D ratio | 0.132 | -0.112 | 0.019 | -0.085 | 0.674† | - | 1 | 0.257 |
| MR | -0.077 | -0.109 | -0.153 | 0.088 | -0.224 | - | - | 1 |
| ANC | 0.090 | 0.100 | 0.107 | 0.091 | 0.237 | 0.058 | -0.073 | -0.253 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download