요약: Pembrolizumab과 Nivolumab과 같은 면역 치료제가 도입된 이래로 암 환자에게 새로운 치료 가능성을 보여주고 있지만, 실제 치료 반응률은 매우 다양하게 나타나며 면역 치료제가 전혀 효과가 없는 경우도 여전히 존재한다. 이 연구는1 대장암의 면역 치료와 관련된 장내 미생물군의 기전을 밝히고 면역 치료 저항을 극복하기 위한 타겟을 찾는 것을 목표로 하였다. 연구진은 MC38 세포(마우스 대장암 세포)를 germ-free (GF), specific pathogen free (SPF) 및 항생제를 투여한 마우스의 피하에 이식한 후 anti-programmed death ligand 1 (anti-PD-L1) 항체로 치료하여 각 그룹의 종양 크기를 비교하였고, 또한 건강인에게서 공여된 분변(healthy human microbiome, 장내 미생물군)을 각 그룹에 추가로 투여하여 종양의 크기 변화를 확인하였다. SPF 마우스에서는 anti-PD-L1 항체 치료 후 종양의 크기가 감소되었으나, GF 마우스 및 항생제를 투여한 마우스에서는 종양의 크기가 감소되지 않았다. 그러나 GF 마우스와 항생제를 투여한 마우스에서 장내 미생물군을 추가로 투여하고 anti-PD-L1 또는 anti-PD-1 항체 치료를 했을 때 종양의 크기가 감소하였다. 이러한 결과는 장내 미생물군이 면역 치료에 필요함을 시사한다.
장내 미생물군과 anti-PD-L1 항체를 같이 투여하게 되면, 종양 주변의 림프절에서 CD45+ 면역 세포, CD8+ T 세포, CD4+ T 세포, MHCII+CD11b+ 세포 및 MHCII+CD11c+ 세포의 수가 증가되며(MHCII+CD11b+ 세포와 MHCII+CD11c+ 세포는 수지상 세포를 의미함), 각 세포의 효능도 또한 증대되었다 이러한 결과는 장내 미생물군이 anti-PD-L1 항체와 같이 투여될 때, CD8+ 및 CD4+ T 세포 및 항원 제시 세포(antigen presenting cells)의 효능을 촉진시킬 수 있음을 시사한다. 연구진은 장내 미생물군이 PD-L1 외에 다른 체크포인트 분자의 발현도 조절할 것이라 가정하고 면역 세포의 여러 체크포인트 분자 발현을 비교하였는데, 항생제가 투여된 마우스에 장내 미생물군을 추가로 준 경우 종양 주변 림프절의 CD11c+ 및 CD11b+ 세포에서 PD-L1의 발현이 유의하게 증가되었으나 CD80, CD86 및 ICOSL의 발현은 유의한 차이를 보이지 않았다. 반면에, PD-L2의 발현은 종양 주변 림프절의 CD11c+ 및 CD11b+ 세포에서 유의하게 감소되었다. 즉, 장내 미생물군이 종양 주변 림프절에 존재하는 항원 제시 세포의 PD-L2 발현을 억제할 수 있다는 것이다.
이 결과를 바탕으로 연구진은 장내 미생물군이 없으면 항원 제시 세포의 PD-L2 발현이 증가되고 이로 인해 T 세포의 효능이 억제되는 것으로 가정하였고, 증가된 PD-L2를 차단하면 어떠한 변화가 나타나는지 확인하고자 하였다. GF 마우스 및 항생제가 투여된 마우스를 anti-PD-L1 항체에 anti-PD-L2 항체를 추가하여 치료하였을 때 종양의 크기가 감소되었다. 즉, 추가로 PD-L2를 차단하는 것이 기존의 치료에 반응이 없었던 마우스의 종양 크기 감소에 효과적으로 작용한 것이다. 하지만, SPF 마우스에서 anti-PD-L2 항체를 단독으로 투여했을 때는 종양의 크기가 감소되지 않았다. 흑색종 치료 후 완전 관해 반응을 보인 환자에게서 얻은 대변 샘플을 GF 마우스에 투여하였을 때에도, anti-PD-L2 항체 단독 치료 후에는 종양의 크기가 감소되지 않았다. 즉, PD-L2를 단독으로 차단하는 것은 종양 크기 감소에 효과적이지 않았다.
이어서 연구진은 단계적 항생제 테스트를 통해 항원 제시 세포에서 PD-L2의 발현을 억제하는 특정 균주를 찾고자 하였고, C. cateniformis가 CD11c+ 세포에서 PD-L2 발현을 감소시키는 것을 확인하였다. 흥미롭게도 C. cateniformis는 CD8+ T 세포에서 interferon-gamma (IFN-γ) 및 tumor necrosis factor (TNF)의 발현을 증가시켰지만, PD-L2의 발현이 증가된 상태에서는 C. cateniformis의 효과가 나타나지 않았다. 한편 PD-L2를 선택적으로 제거한 마우스에서는 C. cateniformis의 추가 투여 여부에 관계없이 종양의 크기가 감소되는 결과가 나타났다. 즉, 항원 제시 세포에서의 PD-L2 발현 억제가 면역 치료 효과 증진에 있어 중요한 역할을 한다고 할 수 있겠다.
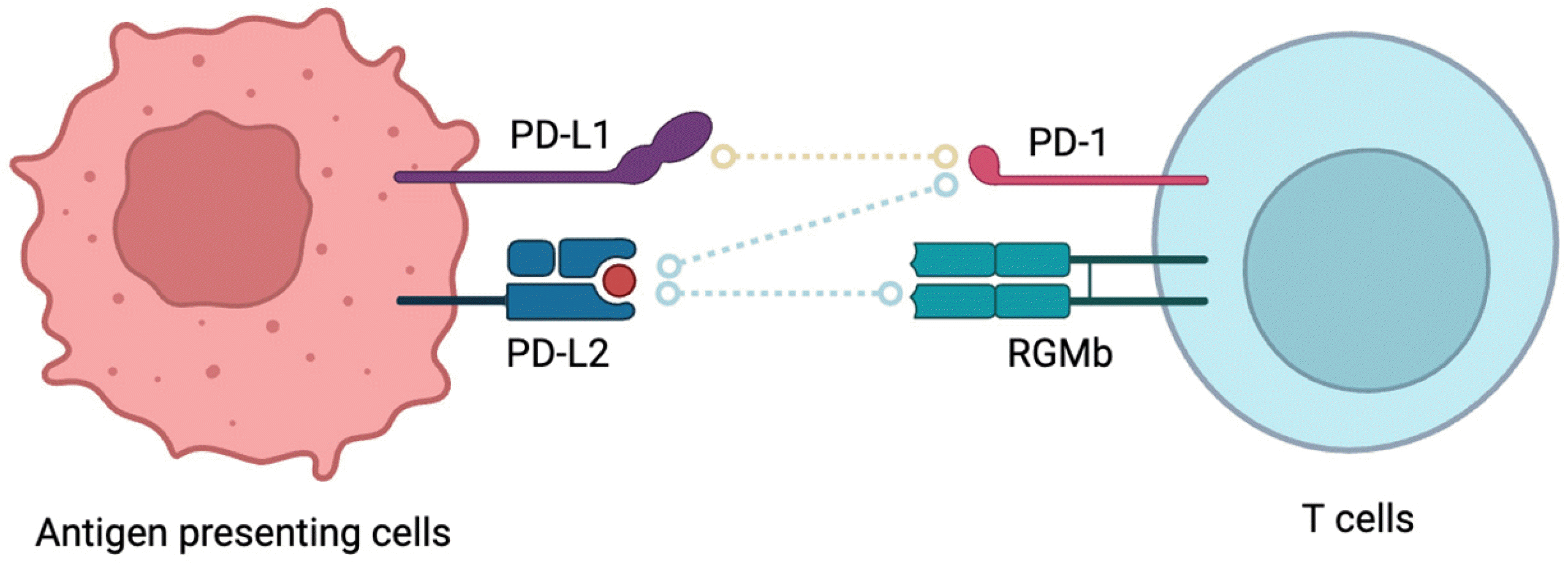
항원 제시 세포 표면에 발현되는 PD-L1은 T 세포 표면의 PD-1과만 결합하나, PD-L2는 PD-1 뿐만 아니라 repulsive guidance molecule b (RGMb)와도 결합할 수 있다(Fig. 1). 연구진은 PD-L2와 T 세포의 결합을 억제하기 위해 anti-PD-L2 및 anti-RGMb 항체를 anti-PD-L1 또는 anti-PD-1 항체에 추가하였고, GF 마우스에서 종양 크기가 감소되는 것을 확인하였다. GF 마우스의 CD8+ 종양 유입 T 세포(tumor infiltrating T cells)에서 RGMb mRNA 및 단백질 레벨이 SPF 마우스보다 증가된 것으로 미루어 볼 때, 장내 미생물군이 CD8+ T 세포에서 RGMb 발현을 감소시키는 것으로 보인다. 마지막으로 연구진은 GF 마우스에서 anti-PD-L1 및 anti-RGMb 항체를 같이 투여한 후 종양 내 CD8+ 및 CD4+ T 세포 수가 유의하게 증가되고, 마우스의 T 세포에서 Rgmb를 선택적으로 제거한 마우스(항생제가 투여된 마우스)에 anti-PD-L1 항체를 투여한 후 CD8+ 세포 수가 증가되며 CD8+ T 세포에서 IFN-γ 및 TNF의 발현이 증가되는 것을 확인하였다.
요약하면, 이 연구는 anti-PD-L1 항체와 anti-PD-L2 항체의 병용 치료가 종양 치료 효과를 향상시키고, 특히 PD-L2-RGMb 경로의 차단 또는 T 세포에서 RGMb의 선택적 제거가 an-ti-PD-1/anti-PD-L1 항체의 종양 치료 효과를 증진시키는 결과를 보여주었다.
해설: 약 20년 전에 anti-cytotoxic T lymphocyte associated antigen-4 (anti-CTLA-4) 항체인 ipilimumab가 도입된 후, anti-PD-1 및 anti-PD-L1 항체를 포함한 다수의 면역 억제제들이 개발되었고, 다양한 암 환자 치료에 적용되고 있다.2 암세포는 IFN-γ 감지를 통해 자신들이 T 세포의 공격을 받고 있다는 것을 인지하게 되면, 그에 대응하기 위하여 암세포 표면에 PD-L1을 발현시켜 T세포 표면의 PD-1과 결합시킴으로 T 세포의 공격을 억제하게 된다.3 즉, PD-L1과 PD-1의 결합은 T 세포로 하여금 암세포를 정상 세포로 착각하게 만들어 주는 역할을 한다. 하지만 anti-PD-L1 또는 anti-PD-1 항체로 이 결합을 차단하게 되면, T 세포는 암세포를 공격 대상으로 인지하여 암세포 내로 침투해서 암 세포를 파괴하게 된다. 이러한 면역 치료제는 암 환자에게 새로운 치료 가능성을 보여주고 있지만, 실제 치료 반응률은 15%에서 87%로 다양하게 나타나고 있다.4 최근에 보고된 연구에 따르면 장내 미생물군이 이러한 치료 반응률의 차이에 영향을 미칠 수 있는데, 실제로 대변이식(fecal microbiota transplantation)이 특정 환자에서 면역 치료 효과를 향상시켰지만, 또다른 환자에서는 면역 치료 효과를 향상시키지 못했다.5,6
이 연구에서 연구진은 장내 미생물군의 차이로 인해 개별 환자의 면역 치료 반응의 차이가 나타나는 결과를 보여주었다. 또한 항원 제시 세포에서 PD-L2의 발현 억제가 면역 치료 효과 증진의 핵심 요소임을 제시하였다. 기존의 anti-PD-L1 치료로 효과가 없는 환자에서 anti-PD-L2항체를 추가하여 PD-L2와 T 세포의 RGMb와의 결합을 차단하는 방법, 그리고 선택적으로 T 세포의 RGMb를 제거하는 방법이 기존의 면역 치료에 반응하지 않는 환자들을 위한 새로운 치료 전략으로 제시될 수 있을 것으로 기대된다.
Notes
Article
Targeting PD-L2-RGMb overcomes microbiome-related immunotherapy resistance. (Nature 2023;617:377-385)
REFERENCES
1. Park JS, Gazzaniga FS, Wu M, et al. 2023; Targeting PD-L2-RGMb overcomes microbiome-related immunotherapy resistance. Nature. 617:377–385. DOI: 10.1038/s41586-023-06026-3. PMID: 37138075.

2. Ribas A, Wolchok JD. 2018; Cancer immunotherapy using checkpoint blockade. Science. 359:1350–1355. DOI: 10.1126/science.aar4060. PMID: 29567705. PMCID: PMC7391259.

3. Sun C, Mezzadra R, Schumacher TN. 2018; Regulation and function of the PD-L1 checkpoint. Immunity. 48:434–452. DOI: 10.1016/j.immuni.2018.03.014. PMID: 29562194. PMCID: PMC7116507.

4. Chen S, Zhang Z, Zheng X, et al. 2021; Response efficacy of PD-1 and PD-L1 inhibitors in clinical trials: A systematic review and meta-analysis. Front Oncol. 11:562315. DOI: 10.3389/fonc.2021.562315. PMID: 33937012. PMCID: PMC8085334.

5. Davar D, Dzutsev AK, McCulloch JA, et al. 2021; Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science. 371:595–602. DOI: 10.1126/science.abf3363. PMID: 33542131. PMCID: PMC8097968.

6. Baruch EN, Youngster I, Ben-Betzalel G, et al. 2021; Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science. 371:602–609. DOI: 10.1126/science.abb5920. PMID: 33303685.





 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download