서 론
대상 및 방법
1. 연구 대상
2. 연구 방법
3. 통계 분석
결 과
1. 1차 의료기관에서 위식도역류질환의 진단
Table 1
| Total | GERD diagnosed with endoscopy | GERD diagnosed without endoscopy | p-valuea | p-valueb | ||
|---|---|---|---|---|---|---|
| ERD | NERD | |||||
| Clinical department | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | <0.0001C | <0.0001C |
| Internal medicine (IM) | 7,723 (42.88) | 629 (46.63) | 780 (50.26) | 6,314 (41.79) | ||
| Gastroenterology | 4,287(23.80) | 631 (46.78) | 606 (39.05) | 3,050 (20.19) | ||
| Family medicine | 2,482 (13.78) | 77 (5.71) | 97 (6.25) | 2,308 (15.28) | ||
| Others | 3,518 (19.53) | 12 (0.89) | 69 (4.45) | 3,437 (22.75) | ||
| Diagnosis of GERD | ||||||
| Total | 18,010 | 1,349 (7.49) | 1,552 (8.62) | 15,109 (83.89) | ||
| Internal medicine (IM) | 7,723 | 629 (8.14) | 780 (10.10) | 6,314 (81.76) | ||
| Gastroenterology | 4,287 | 631 (14.72) | 606 (14.14) | 3,050 (71.15) | ||
| Family medicine | 2,482 | 77 (3.10) | 97 (3.91) | 2,308 (92.99) | ||
| Others | 3,518 | 12 (0.34) | 69 (1.96) | 3,437 (97.70) | ||
| p-valued | <0.0001 | <0.0001 | <0.0001 | |||
2. 위식도역류질환 환자의 인구학적 특성
Table 2
| Total | GERD diagnosed with endoscopy | GERD diagnosed without endoscopy | p-valuea | p-valueb | ||
|---|---|---|---|---|---|---|
| ERD | NERD | |||||
| Age (yr) | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | 0.0287c | <0.0001d |
| Mean±SD | 53.15±14.83 | 51.50±13.03 | 50.37±13.23 | 53.59±15.10 | ||
| Median | 54.00 | 52.00 | 50.00 | 54.00 | ||
| Min, Max | 19.00, 97.00 | 19.00, 88.00 | 19.00, 87.00 | 19.00, 97.00 | ||
| Gender, n (%) | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | 0.0350e | <0.0001f |
| Male | 8,016 (44.51) | 717 (53.15) | 764 (49.23) | 6,535 (43.25) | ||
| Female | 9,994 (55.49) | 632 (46.85) | 788 (50.77) | 8,574 (56.75) | ||
| Alcohol intake, n (%) | ||||||
| Total | 5,456 | 624 | 701 | 4,131 | 0.0992e | 0.1874f |
| Yes | 3,094 (56.71) | 345 (55.29) | 419 (59.77) | 2,330 (56.40) | ||
| No | 2,362 (43.29) | 279 (44.71) | 282 (40.23) | 1,801 (43.60) | ||
| Smoker, n (%) | ||||||
| Total | 5,409 | 616 | 705 | 4,088 | 0.2054e | 0.4360f |
| Yes | 1,817 (33.59) | 216 (35.06) | 224 (31.77) | 1,377 (33.68) | ||
| No | 3,592 (66.41) | 400 (64.94) | 481 (68.23) | 2,711 (66.32) | ||
| Frequency of GERD exacerbated food intake (days/week) | ||||||
| Total | 1,778 | 203 | 145 | 1,430 | 0.6584c | 0.6716d |
| Mean±SD | 3.19±1.74 | 3.10±1.79 | 3.27±1.99 | 3.19±1.70 | ||
| Median | 3.00 | 3.00 | 3.00 | 3.00 | ||
| Min, Max | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | ||
| Frequency of heartburn-inducing food intake (days/week) | ||||||
| Total | 1,778 | 203 | 145 | 1,430 | 0.1687c | 0.0015d |
| Mean±SD | 2.23±1.40 | 2.13±1.48 | 1.96±1.57 | 2.28±1.37 | ||
| Median | 2.00 | 2.00 | 2.00 | 2.00 | ||
| Min, Max | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | ||
| Frequency of eating 2–3 hours before bedtime (days/week) | ||||||
| Total | 1,778 | 203 | 145 | 1,430 | 0.0754c | <0.0001d |
| Mean±SD | 1.88±1.40 | 1.72±1.59 | 1.47±1.59 | 1.94±1.35 | ||
| Median | 2.00 | 1.00 | 1.00 | 2.00 | ||
| Min, Max | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | 0.00, 7.00 | ||
| BMI (kg/cm2) | ||||||
| Total | 1,192 | 222 | 165 | 805 | 0.0109c | 0.0068d |
| Mean±SD | 24.15±3.38 | 24.82±3.62 | 23.84±3.08 | 24.04±3.34 | ||
| Median | 23.95 | 24.60 | 23.60 | 23.80 | ||
| Min, Max | 15.10, 45.90 | 16.80, 45.90 | 16.70, 33.00 | 15.10, 40.40 | ||
| BMI Groupg, n (%) | ||||||
| Total | 1,192 | 222 | 165 | 805 | 0.0745e | 0.0714f |
| Normal | 439 (36.83) | 68 (30.63) | 63 (38.18) | 308 (38.26) | 0.6622h | <0.0001i |
| Pre-obese stage (overweight) | 318 (26.68) | 53 (23.87) | 48 (29.09) | 217 (26.96) | 0.6188h | <0.0001i |
| Stage 1 obese | 375 (31.46) | 87 (39.19) | 49 (29.70) | 239 (29.69) | 0.0011h | <0.0001i |
| Stage 2 obese | 51 (4.28) | 10 (4.50) | 5 (3.03) | 36 (4.47) | 0.1967h | <0.0001i |
| Stage 3 obese (severely obese) | 9 (0.76) | 4 (1.80) | 0 (0.00) | 5 (0.62) | 0.0455h | 0.1024i |
| BMI Group, n (%) | ||||||
| Number | 1,192 | 222 | 165 | 805 | 0.0112e | 0.0075f |
| <25 kg/m2 | 757 (63.51) | 121 (54.50) | 111 (67.27) | 525 (65.22) | 0.511h | <0.0001i |
| ≥25 kg/m2 | 435 (36.49) | 101 (45.50) | 54 (32.73) | 280 (34.78) | 0.0002h | <0.0001i |
ERD, erosive reflux disease; NERD, nonerosive reflux disease; GERD, gastroesophageal reflux disease; BMI, body mass index; SD, standard deviation; Min, minimum; Max, maximum; n (%), number of subjects (percentage of subjects).
aERD vs. NERD: Wilcoxon's rank sum testc, Pearson's chi-square teste, Pearson's chi-square test for goodness of fith; bERD vs. NERD vs. GERD diagnosed with symptoms only: Kruskal–Wallis testd, Pearson's chi-square testf, Pearson's chi-square test for goodness of fiti. gGuidelines of the Korean Society for the study of obesity6: Normal: <23, Pre-obese stage (overweight): 23≤ <25, Stage 1 obese: 25≤ <30, Stage 2 obese: 30≤ <35, Stage 3 obese(severely obese): 35≤.
3. 임상적 특성
Table 3
| Total | GERD diagnosed with endoscopy | GERD diagnosed without endoscopy | ||||
|---|---|---|---|---|---|---|
| ERD | NERD | |||||
| Severity (LA grade) | ||||||
| Total | 1,349 | 1,349 | 0 | 0 | ||
| Grade A | 975 (72.28) | 975 (72.28) | 0 (0.00) | 0 (0.00) | ||
| Grade B | 277 (20.53) | 277 (20.53) | 0 (0.00) | 0 (0.00) | ||
| Grade C | 73 (5.41) | 73 (5.41) | 0 (0.00) | 0 (0.00) | ||
| Grade D | 24 (1.78) | 24 (1.78) | 0 (0.00) | 0 (0.00) | ||
| Symptoma | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | ||
| Typical symptoms | 15,308 (85.00) | 1,228 (91.03) | 1,330 (85.70) | 12,750 (84.39) | ||
| Heartburn | 11,393 (63.26) | 987 (73.17) | 957 (61.66) | 9,449 (62.54) | ||
| Gastric acid reflux | 9,731 (54.03) | 794 (58.86) | 788 (50.77) | 8,149 (53.93) | ||
| Atypical symptoms | 7,523 (41.77) | 547 (40.55) | 661 (42.59) | 6,315 (41.80) | ||
| Chest pain | 4,945 (27.46) | 356 (26.39) | 456 (29.38) | 4,133 (27.35) | ||
| Foreign-body sensation in throat | 2,547 (14.14) | 171 (12.68) | 201 (12.95) | 2,175 (14.40) | ||
| Hoarse voice | 924 (5.13) | 42 (3.11) | 62 (3.99) | 820 (5.43) | ||
| Chronic cough | 794 (4.41) | 45 (3.34) | 54 (3.48) | 695 (4.60) | ||
| Asthma | 66 (0.37) | 4 (0.30) | 3 (0.19) | 59 (0.39) | ||
| Others | 197 (1.09) | 50 (3.71) | 45 (2.90) | 102 (0.68) | ||
| Asymptomatic | 23 (0.13) | 23 (1.70) | 0 (0.00) | 0 (0.00) | ||
4. 치료
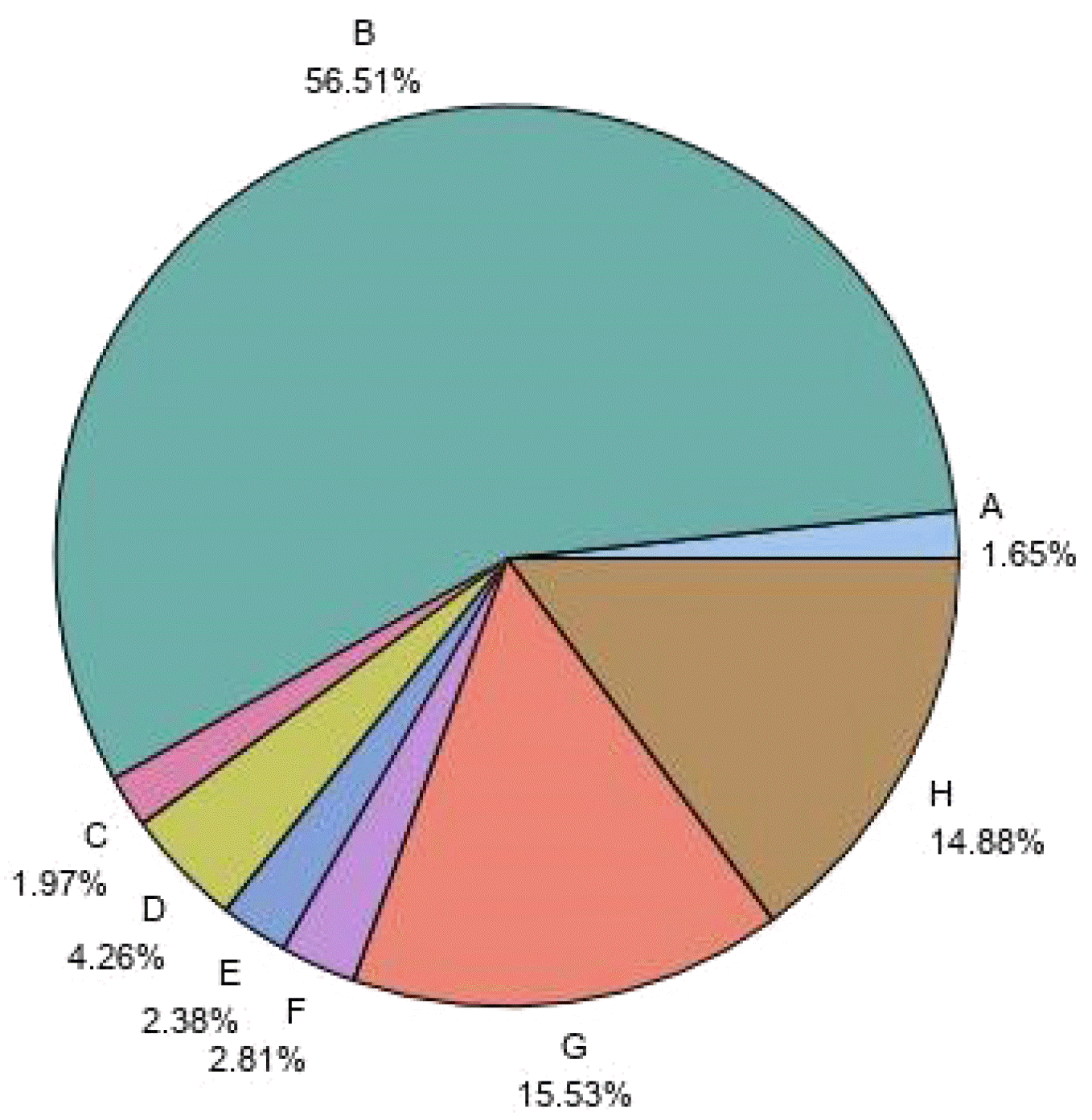 | Fig. 1Status of PPI use in patients with GERD. A: Dexlansoprazole, B: Esomeprazole, C: Ilaprazole, D: Lansoprazole, E: Omeprazole, F: Pantoprazole, G: Rabeprazole, H: Non-ppi. PPI, proton pump inhibitor; GERD, gastroesophageal reflux disease. |
Table 4
| Total | GERD diagnosed with endoscopy | GERD diagnosed without endoscopy | p-valuea | p-valueb | ||
|---|---|---|---|---|---|---|
| ERD | NERD | |||||
| Treatment, n (%) | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | 0.3916c | 0.0002d |
| Medication | 17,806 (98.87) | 1,327 (98.37) | 1,520 (97.94) | 14,959 (99.01) | ||
| Non medical treatment | 204 (1.13) | 22 (1.63) | 32 (2.06) | 150 (0.99) | ||
| Non medical treatment, n (%) | ||||||
| Total | 204 | 22 | 32 | 150 | 0.2882c | <0.0001d |
| Dietary habits for improvement | 171 (83.82) | 12 (54.55) | 22 (68.75) | 137 (91.33) | ||
| Antireflus surgery | 0 (0.00) | 0 (0.00) | 0 (0.00) | 0 (0.00) | ||
| Untreated | 33 (16.18) | 10 (45.45) | 10 (31.25) | 13 (8.67) | ||
| Treatment period (days)g | ||||||
| Total | 16,433 | 1,294 | 1,470 | 13,669 | 0.0206e | <0.0001f |
| Mean±SD | 79.85±183.28 | 88.36±171.67 | 93.66±203.50 | 77.55±181.97 | ||
| Median | 21.00 | 30.00 | 28.00 | 19.00 | ||
| Min, Max | 1.00, 1,460.00 | 1.00, 1,440.00 | 1.00, 1,419.00 | 1.00, 1,460.00 | ||
| Continuation of treatment, n (%) | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | 0.2940c | <0.0001d |
| Yes | 8,105 (45.00) | 774 (57.38) | 870 (56.06) | 6,461 (42.76) | ||
| No | 8,328 (46.24) | 520 (38.55) | 600 (38.66) | 7,208 (47.71) | ||
| Unverifiable | 1,577 (8.76) | 55 (4.08) | 82 (5.28) | 1,440 (9.53) | ||
| Pattern of symptom change, n (%) | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | 0.0058c | <0.0001d |
| Unchanged | 5,876 (32.63) | 287 (21.28) | 338 (21.78) | 5,251 (34.75) | ||
| Improvement | 11,831 (65.69) | 1,024 (75.91) | 1,154 (74.36) | 9,653 (63.89) | ||
| Symptom aggravation | 140 (0.78) | 15 (1.11) | 7 (0.45) | 118 (0.78) | ||
| New symptoms occurred | 163 (0.91) | 23 (1.70) | 53 (3.41) | 87 (0.58) | ||
ERD, erosive reflux disease; NERD, nonerosive reflux disease; GERD, gastroesophageal reflux disease; SD, standard deviation; Min, minimum; Max, maximum; n (%), number of subjects (percentage of subjects).
Table 5
| Total | GERD diagnosed with endoscopy | GERD diagnosed without endoscopy | p-valuea | p-valueb | ||
|---|---|---|---|---|---|---|
| ERD | NERD | |||||
| PPI prescription rate | ||||||
| Total | 17,806 | 1,327 | 1,520 | 14,959 | <0.0001c | <0.0001d |
| Dexlansoprazole | 294 (1.65) | 19 (1.43) | 28 (1.84) | 247 (1.65) | ||
| Esomeprazole | 10,063 (56.51) | 761 (57.35) | 885 (58.22) | 8,417 (56.27) | ||
| Ilaprazole | 350 (1.97) | 74 (5.58) | 22 (1.45) | 254 (1.70) | ||
| Lansoprazole | 759 (4.26) | 108 (8.14) | 60 (3.95) | 591 (3.95) | ||
| Omeprazole | 424 (2.38) | 28 (2.11) | 52 (3.42) | 344 (2.30) | ||
| Pantoprazole | 500 (2.81) | 59 (4.45) | 51 (3.36) | 390 (2.61) | ||
| Rabeprazole | 2,766 (15.53) | 227 (17.11) | 333 (21.91) | 2,206 (14.75) | ||
| Non-PPI | 2,650 (14.88) | 51 (3.84) | 89 (5.86) | 2,510 (16.78) | ||
| PPI prescription method | ||||||
| Total | 18,010 | 1,349 | 1,552 | 15,109 | <0.0001c | <0.0001d |
| PPI (single) | 13,869 (77.01) | 1,094 (81.10) | 1,143 (73.65) | 11,632 (76.99) | ||
| Prokinetics (single) | 411 (2.28) | 4 (0.30) | 5 (0.32) | 402 (2.66) | ||
| PPI+Prokinetics (combination) | 742 (4.12) | 72 (5.34) | 164 (10.57) | 506 (3.35) | ||
|
PPI+Prokinetics+ gastric mucosal protection (antacid) (combination) |
512 (2.84) | 80 (5.93) | 120 (7.73) | 312 (2.06) | ||
|
PPI+ gastric mucosal protection (antacid) (combination) |
215 (1.19) | 31 (2.30) | 36 (2.32) | 148 (0.98) | ||
| H2 receptor blocker (single) | 1,262 (7.01) | 17 (1.26) | 24 (1.55) | 1,221 (8.08) | ||
| Others | 999 (5.55) | 51 (3.78) | 60 (3.87) | 888 (5.88) | ||
고 찰
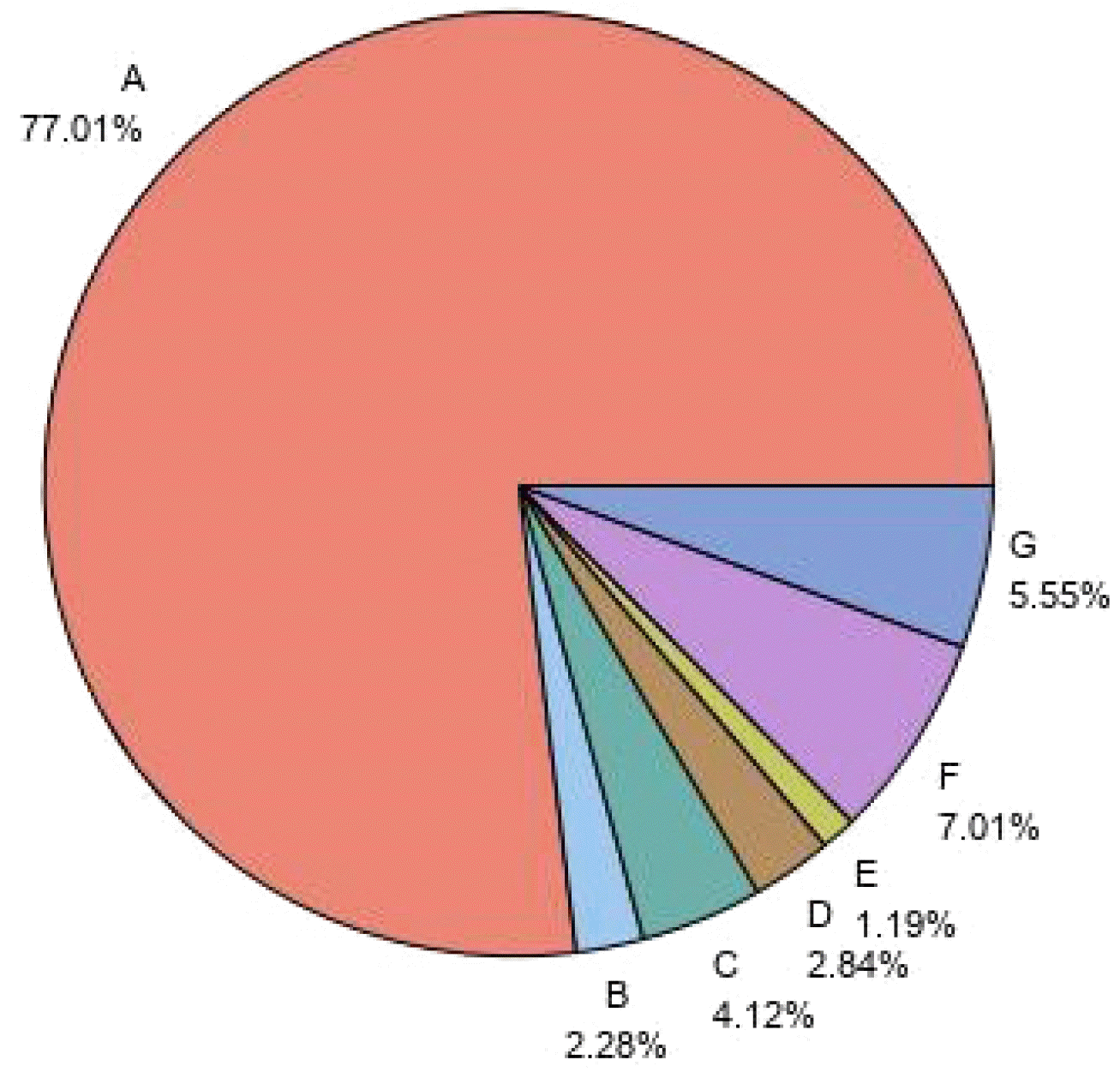 | Fig. 2PPI prescription method. A: PPI (single), B: Prokinetics (single), C: PPI+Prokinetics (combination), D: PPI+Prokinetics+gastric mucosal protection (antacid) (combination), E: PPI+ gastric mucosal protection (antacid) (combination), F: H2 receptor blocker (single), G: Others. PPI, proton pump inhibitor. |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download