Abstract
The prevalence of obesity has increased significantly worldwide, and this trend is likely to continue in the coming years. There is substantial evidence that obesity plays a crucial role in the development of colorectal cancer. Epidemiological data have consistently demonstrated a correlation between obesity and colorectal cancer. Insulin resistance, hyperinsulinemia, chronic inflammation, altered levels of growth factors, adipocytokines, and various hormones are plausible biological mechanisms. In addition, obesity has been shown to have an impact on recurrence, treatment success, and overall survival. There are some reports, although the evidence is not conclusive, that weight loss and lifestyle changes such as dietary modification and physical activity can reduce the risk of colorectal cancer. The understanding that obesity is a potentially modifiable risk factor that can affect the incidence and prognosis of colorectal cancer is crucial knowledge that can have an impact on the prevention and treatment of the condition.
Go to : 
세계보건기구(World Health Organization, WHO) 보고서에 따르면 비만 인구는 1975년 이후 전세계에서 거의 3배가량 증가했다. 우리나라에서도 건강보험심사평가원에서 보고한 최근 5년(2017–2021년) 간의 ‘영양결 및 비만 진료현황 분석자료’에 따르면 국내 비만 환자수는 2021년에 3만 170명으로 2017년 대비 101.6% (연평균 19.2%) 증가했다.1 비만인구(과체중, 비만)는 체질량지수(BMI)를 이용하여, 과체중(BMI≥25)과 비만(BMI≥30) 또는 허리둘레(비만 남성 ≥90 cm, 비만여성 ≥80 cm)로 정의할 수 있다. 비만은 2형당뇨, 비알코올성지방간질환, 심혈관질환, 폐쇄성수면무호흡증, 고혈압 같은 대사증후군뿐 아니라 위식도역류질환, 과민성장증후군, 셀리악병 등의 위장관질환과 관련성이 보고된 바 있고,2-4 또한 식도선암, 대장직장암, 담관암, 췌장암, 유방암, 자궁내막암, 난소암, 신장암 등 다양한 암과 관련이 있다.5,6
대장암은 전세계에서 세 번째로 흔히 발생하는 암으로 우리나라에서는 갑상선암을 제외하면 두 번째로 발생률이 높고, 2021년 통계청의 ‘주요 암종별 사망분율’에 따르면 폐암, 간암 다음으로 세 번째로 사망률도 높다.7 국내 대장암 환자 수는 꾸준히 증가하는 추세로 국민건강보험공단이 발표한 ‘2012–2021년 대장암의 건강보험 진료현황 자료’에 따르면, 국내 대장암 진료인원은 2017년 13만 9,184명에서 2021년 14만 8,410명으로 4년간 9,226명(6.6%) 증가했으며, 연평균 증가율은 1.6%에 이른다.8 최근 국내 대장암 환자가 느는 것은 식생활이 서구화되며 비만 환자의 증가와 무관하지 않다. 체중이 5 kg 증가하면 대장암 발생 위험이 약 5% 증가한다는 연구도 있으며,9 25세 이전의 비교적 이른 나이의 비만 환자는 34세 이상의 비만환자보다 대장암 발생할 위험이 남성의 경우 39%, 여성의 경우 19% 증가한다는 연구 결과도 있다.10
비만이 대장암에 미치는 영향들에 대해서는 비교적 명확하게 밝혀진 사실이 많지만, 일부 영역에 있어서는 아직까지도 근거가 부족하고 결론을 내릴 수 없는 부분들이 존재하고 있다. 특히 비만이 대장암 발생에 미치는 기전은 매우 다양하고 방대하며, 비만이 대장암 치료에 미치는 효과 및 예후에 대해서는 아직까지 논란의 여지가 존재한다. 이번 논문에서는 비만과 대장암 발생 위험에 관한 다양한 최근 연구 결과들을 정리하고, 비만이 대장암 발생에 미치는 기전, 대장암 치료에 미치는 영향 및 예후에 대해서 알아보고자 한다.
Go to : 
대장선종은 대표적인 대장암이 전구성 병변이며, 기존의여러 연구들에서 비만은 선종의 위험인자임을 지속적으로 제시하고 있다.11,12 Schlesinger 등13이 발표한 연구 결과에 따르면 성인에서 체중이 5 kg 증가할 때마다 정상인보다 선종의 발생 위험이 7% 증가한다고 보고했다. 또 다른 연구에서는 단순 체질량 지수(BMI)가 선종 및 목 없는 톱니병변 모두에 있어 독립적인 위험 요소임을 보고 하고 있다.14,15 최근 발표된 대규모 메타분석(17개의 연구, 168,201명 분석)에 따르면 정상체중(BMI<25 kg/m2)그룹과 비만(25 kg/m2<BMI<30 kg/m2) 그룹을 비교했을 때 비만에서 대장선종 발병률이 42–44% 증가하였다. 하위그룹분석에서는 비만인 경우 남성보다 여성이, 아프리카인보다 백인 또는 아시아인에서 대장선종 발생 위험이 유의하게 더 높은 것으로 나타났다.16 비만은 대장선종의 성장에도 영향을 미친다. 비만환자에서 진행성 대장선종의 위험도 유의하게 더 높게 나타났다(OR 1.52; 95% CI 1.32–1.73).16
현재까지 비만 환자에서 대장암 발생률이 증가한다는 사실은 이미 많은 연구들을 통해서 잘 입증되어 왔다. 특히 최근에는 BMI보다는 허리둘레가 암화 과정에 직접적인 영향을 미치는 내장 지방을 더 잘 반영하기 때문에, 비만의 측정 도구로서 중요하게 여겨지고 있다.17 몇몇 연구에서는 허리둘레가 대장암 발생의 상대 위험도를 증가시킨다는 것을 성별로 분석하였고, 허리둘레 크기가 큰 그룹이 작은 그룹에 비해 남성에서는 상대위험도를 1.477배 여성에서는 1.442배 증가시키는 것을 보여주었다.18,19 47개의 전향적 연구를 분석한 최근 메타 분석에 따르면 여러가지 측정도구들을 통해 체중 증가량이 커질수록 대장암 발생 위험도 또한 더 증가하는 것을 보여주었다 (relative risk [RR]: 1.02, per 5 kg increase in weight; RR: 1.06, per 5 kg/m2 increase in BMI; RR: 1.02, per 10 cm increase in waist circumference).20 또 다른 메타 분석에서도, BMI 간격을 5개로 나누었고(<23.0, 23.0–24.9, 25.0–27.4, 27.5–29.9, and >30.0 kg/m2), BMI가 커질수록 대장암 발생 위험도 역시 각각 1.0 (reference), 1.14 (95% CI 1.06–1.23), 1.19 (95% CI 1.13–1.25), 1.24 (95% CI 1.15–1.35), 1.41 (95% CI 1.30–1.53)로 증가하는 경향을 보여주었다.21 비록 일부 연구에서는 반대되는 결론이 나타나기도 하지만 최근 결과들에 따르면 비만 역시 조기 발병 대장암의 위험인자로 여겨지고 있다. 한 메타 분석 연구에 따르면, 비만인 경우 조기 발병 대장암이 상대 위험도가 1.54 (95% CI 1.01–2.35)로 증가하는 것을 입증하였다.22 85,000명의 여성을 대상으로 시행한 대규모 전향적 코호트 연구에 따르면, 비만을 동반한 여성의 경우 조기 발병 대장암의 상대 위험도가 1.93 (95% CI 1.15–3.25)로 증가하는 것을 보고하였다.23 이렇듯 다양한 역학 연구들에서 비만이 대장암 발생 위험도 증가는 잘 입증이 되었으며, 특히 조기 발병 대장암의 위험도 증가에도 비만이 영향을 끼치는 것을 확인할 수 있었다.
대사증후군은 인슐린저항성과 함께 발생하는 대사질환으로 복부비만, 고혈압, 고중성지방혈증, 저HDL콜레스테롤혈증, 당뇨 중 3가지 이상일 때 진단하는 질병 군이다. 비만과 마찬가지로 대사증후군도 대장암발생과 상관관계(RR 1.34, 95% CI 1.24–1.44)가 있는 것으로 알려져 있으며, 특히 대사증후군 진단 기준에 해당하는 질병을 많이 진단받을수록 대장암 누적 발생률이 증가하는 것으로 알려져 있다.24,25 또 다른 연구에서는 정상인군과 대사증후군 전 단계, 대사증후군 환자의 경우에서 대장암 누적 발생률을 비교했을 때 남성의 경우 1,000명당 누적발생률은 각각 2.6명, 3.9명, 5.5명으로 나타났으며, 여성의 경우 각각 2.1명, 2.9명, 4.5명으로 나타났음을 보고하였다.26 조기 발병 대장암의 위험성도 대사증후군의 유무에 따라 증가할 수 있으며, 환자 대조군 연구에 따르면 대사증후군 환자는 조기 발병 대장암 위험률이 정상인과 비교할 때 31%까지 증가하는 것으로 나타났다.27
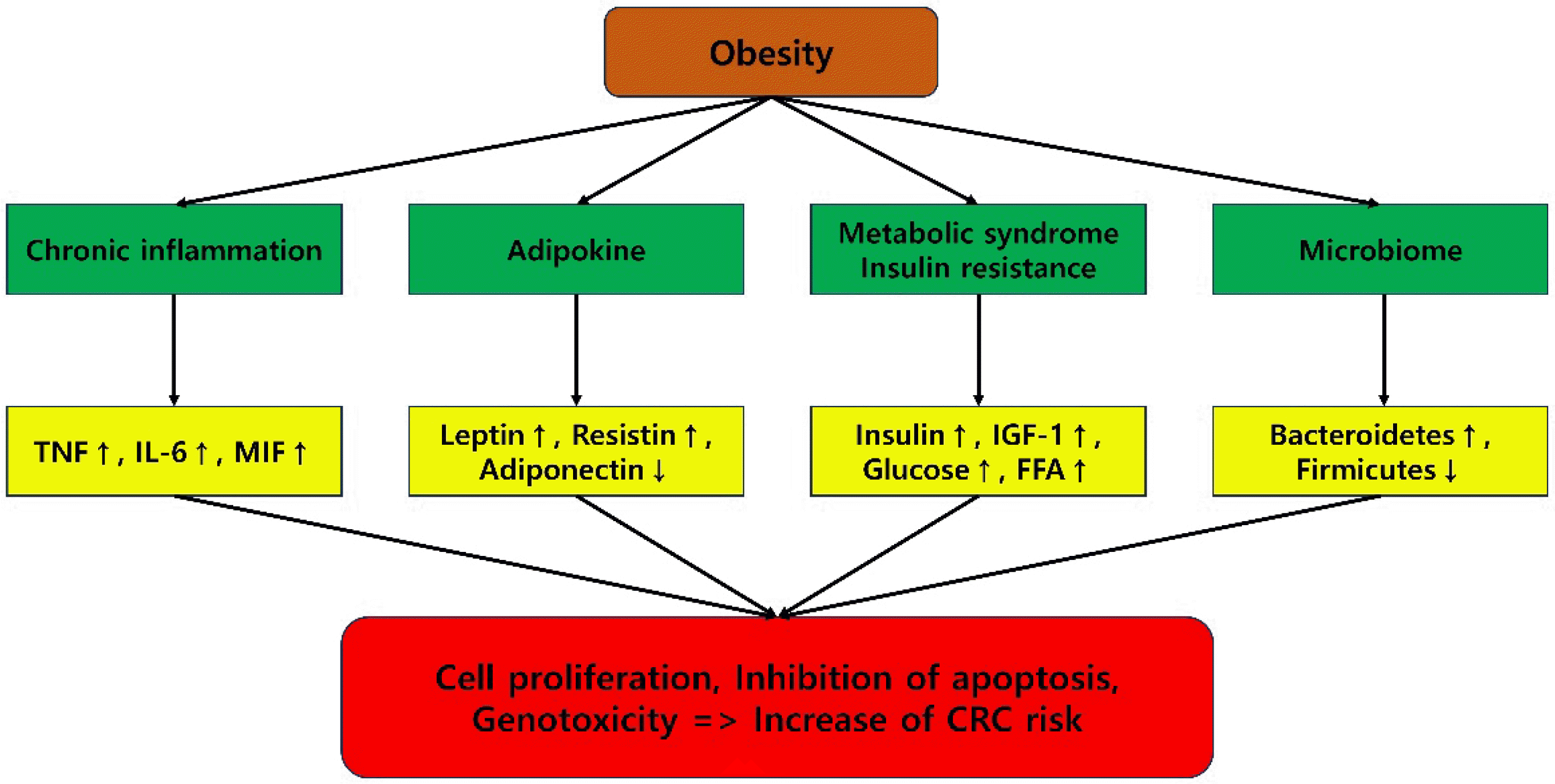
비만은 과도한 체지방(성숙한 지방세포인 백색지방)이 신체에 축적되는 것으로 정의할 수 있다. 백색지방세포는 에너지를 저장하고 필요할 때 방출하여,28 전신 및 국소 에너지대사 항상성을 조절한다. 근본적인 분자 메커니즘은 아직 완전히 밝혀지지 않았으나 비만으로 유발된 비정상적인 지질대사,아디포카인 및 호르몬 불균형, 만성 염증상태, 담즙산 항상성장애가 대장암 발생과 관련한 복잡한 대사 조절에 관여하는것으로 보이며, 현재까지 잘 알려진 대표적인 기전들에 대해 Fig. 1에 요약 기술하였다.
지방조직은 인슐린, 인슐린 유사 성장 인자(insulin-like growth factor, IGF), 아디포카인(렙틴[Leptin]과 아디포넥틴[Adiponectin]), 여러가지 염증성 사이토카인(TNF-α, CCL2,플라스미노겐 활성제 억제제-1 [PAI-1], IL-6)를 비롯한 다양한 인터루킨 분비에 영향을 미친다. 비만환자의 인슐린 저항성 증가는 대장암과 관련이 있으며,29 대장암에서 렙틴 수용체의 발현이 증가하며 혈중 렙틴 농도가 증가하면 불량한 예후와 관련이 있다.30,31 렙틴이 과발현된 군은 그렇지 않은 군에 비해 생존률이 낮았으며, 림프절 전이와 원격전이와 관련이 있었다.31 또한, 렙틴은 대장암 치료를 위한 항암제(5-FU)의 저항성을 일으키는 것으로도 알려져 있다.32 또한, 지방조직에서는 면역반응으로 인해 IL-6, TNF-α, CCL2, PAI-1 등 다양한 염증성 사이토카인과 급성기 단백질(acute phase protein)이 분비된다. 이로 인해 비만환자는 만성적인 염증상태에 있다고 보는 연구결과도 있다.33 대장암 환자의 혈중 CRP, IL-6 상승은 암 진행, 재발 및 생존율 악화와 관련이 있는 것으로 알려져 있다.34
담즙산은 지질대사에 중요역할을 하는 물질로 장에서 지방 흡수에 관여한다. 총 담즙산 분비량은 비만환자에서 BMI와 양의 상관관계가 있으며,35 비만환자에서 총 담즙산은 약간 증가한 반면 결합 담즙산(conjugated bile acid)과 2차 담즙산인 데옥시콜릭산(DCA)은 혈장과 간에서 크게 증가한다.36,37 DCA는 세포독성을 야기하며 대장상피세포를 손상시키고, 염증 반응을 자극하며, 활성산소종(ROS) 생성을 유도하고,38,39 게놈 불안정성을 촉진하며, 세포자살(apotosis) 저항을 통해 대장암 형성에 영향을 미치는 것으로 알려져 있다.40
비만은 인슐린 저항성을 일으키며, 비만환자에서 혈중 인슐린과 인슐린 유사 성장 호르몬(IGF)은 증가하며 IGFBP-1과 IGFBP-2는 감소하는 것으로 알려져 있다.41,42 인슐린과 IGF는 phosphoinositide 3-kinase (PI3K)/Akt 신호 전달 경로의 활성화를 통해 대장암세포의 증식을 촉진하는데,43-45 현재 PI3K/Akt 경로는 대장암 치료를 위한 중요한 치료표적으로 알려져 있다.46,47 티로신-단백질 키나아제 Src는 PI3K의 인산화를 통해 PI3K/Akt 경로를 조절하며, 대장암 세포의 변형 및 성장에 중요한 역할을 한다.48,49 Src를 억제할 경우 인간 암세포 SW48 및 HT-29에서 세포전이 및 증식을 억제하는 것으로 알려져있다.50 정상 대장점막세포와 비교할 때 대장암세포에서 IGF1과 IGF-1R의 발현 수준이 증가하는데. IGF1-R의 과발현 및 활성화는 Src를 자극하여 시험관 내에서 대장암의 증식 및 암세포 이동을 증가시킬 수 있는 것으로 알려지고 있다.51
렙틴은 시상하부에 작용하여 식욕을 억제하고 에너지소모를 촉진하고 섭식행동을 조절하는데, 통상적으로 비만인 사람은 렙틴 저항성 때문에 정상체중인 사람보다 혈중 렙틴 농도가 높게 나타난다.52 수용성 렙틴 수용체(sOB-R)는 렙틴 저항성의 잠재적 마커로, EPIC (European Prospective Investigation into Cancer and Nutrition) 코호트 연구에서는 혈중 sOB-R와 대장암 위험과 반비례 관계가 있음을 보고했다.53 실험쥐 모델(C57BL/KsJ-db/db)에서 렙틴이 아족시메탄(AOM) 유도 대장암의 성장을 촉진한다는 보고가 있었으며, 아족시메탄(AOM) 유도 쥐 대장암 모델에서 렙틴 결핍(ob/ob) 및 렙틴 수용체 결핍(db/db) 쥐에서 Wnt 신호 경로를 통해 암세포 성장이 억제된 것으로 나타났다.54 반면 아디포넥틴은 인슐린 감작을 조절하는 호르몬으로 비만환자에서 아디포넥틴은 감소해 있다.55,56 아디포넥틴은 AMPK를 활성화시키며 세포성장과 생존, 단백질 합성에 관여하는 mTOR를 억제해 대장암 세포 증식을 억제하며, 여러 연구에서 혈중 아디포넥틴이 줄면 대장암 위험이 증가하는 것으로 나타났다.57-59 아디포넥틴 결핍(APNKO) 쥐는 덱스트란 황산나트륨(DSS) 및 1,2-디메틸히드라진(DMH)에 의해 유도되는 대장암 모델 쥐에서 암의 크기와 면적이 증가하는 것으로 보고되었다. 한편 아디포넥틴을 투여하면 혈관신생을 억제하여 암성장을 감소시키는 것으로 나타났다.60
혈중 순환하는 IL-6의 약 30%는 지방 조직에서 분비되며,61,62 IL-6은 쥐와 인간 대장암의 종양미세환경에서 발견된다.63 IL-6은 간에서 C-반응성 단백질(CRP) 합성 및 분비를 자극하는 염증 인자로 작용한다. 지방조직에서의 TNF-α 분비정도는 비만정도와 제2형 당뇨병과 양의 상관관계가 있다.64 TNF-α의 생성은 inflammatory bowel disease (IBD) 환자에서 증가하며 IBD관련 대장암 발병에 관여한다.65.66 TNF-α는 NF-Κb를 활성화시키며 IKK/NF-κB 경로의 활성화는 대장염 및 대장암을 일으키는 것으로 알려져 있다.67,68
단핵구 화학유인 단백질 1 (MCP-1)로도 알려진 CCL2는 지방세포에서 분비되며 염증 반응에서 중요한 역할을 하며 CCL2는 종양 부위로의 대식세포 모집을 자극하는 케모카인이다.69,70 CCL2의 혈중 농도는 비만환자에서 증가하며,71 대식세포 유도에 의한 염증반응은 대장암의 불량한 예후와 관련이 있다.72 CCL2결핍 쥐 모델(ApcMin/+/CCL2-/-) 연구에서 대장암 세포의 성장 및 면역세포 침윤 정도가 감소함을 확인할수 있었으며,73 항체를 이용하여 CCL2를 차단하면 쥐의 암세포 성장이 감소하는 사실도 확인되었다.73
Nieman 등74은 복강 내 암세포는 주로 백색지방세포로 구성된 대망(Great omentum)에 증식할 가능성이 높다고 보고했다. 암세포를 둘러싼 지방세포는 암성장과 관련한 대사과정에서 단백질 동화작용을 위한 영양분을 제공하는 것으로 알려져 있다.75,76 대장암 조직과 정상 장조직을 비교할 때 대장암 조직 주변에서 지방세포가 더 많이 관찰되며, 지방세포와 암세포를 공동배양했을 때 암세포는 지방세포에서 지방분해를 유도하고 암세포에서 β-산화를 유도하여 암세포의 급속한 증식을 일으킨다. Xiao 등77은 체외실험(In vitro)에서 지방세포 조절배지에서 지질대사 관련 핵 수용체인 RORα (retinoic acid-related orphan α)를 통해 대장암세포(SW480 및 C26) 의 증식이 촉진된다는 사실을 보고했다. Amemori 등78은 1차 지방세포, 지방전구세포 및 지방조직이 대장암 세포(CACO-2, T84 및 HT29)의 성장을 촉진한다고 보고했다. 이처럼 지방세포는 종양미세환경의 일부로 대장암세포가 더 빠르게 성장하기 위한 영양분을 공급하며, 암세포는 유리지방산, 글루타민, 케톤 및 L-락테이트를 포함하여 에너지가 풍부한 대사산물을 지방세포로부터 공급받는다.79
국내 대장암 환자가 느는 것은 식생활이 서구화되며 비만환자가 증가하는 것과 무관하지 않다. 식이조절과 적절한 운동으로 체중을 조절하면 대장암 위험을 줄일 수 있을 것으로 기대할 수 있다. 식습관 및 생활 습관 요인에는 적색/가공육 식이, 저섬유질 및 고지방식이, 음주, 흡연, 좌식 및 낮은 신체 활동이 대장암 발병에 중요한 환경 요인으로 알려져 있다.80 고섬유질 식이는 위장관에 음식물이 머무는 시간을 줄이며 acetate, propionate, butyrate 같은 단쇄지방산 생성을 증가시킨다. 이런 물질은 쥐의 대장암 세포에서 세포자멸(apoptosis)을 유도하는 것으로 보고되었으며,81 섬유소는 항염증작용을 하여 TNF-α, IL-6의 생성을 낮추는 것으로 알려져 있다.82 25개의전향적 연구가 포함된 메타분석 결과에 따르면, 하루 10 g의 섬유질을 섭취하였을 때 대장암 발생 상대 위험도가 0.90 (95% CI 0.86–0.94), 규칙적인 통곡물을 섭취하였을 경우 대장암 발생 상대 위험도가 0.83 (95% CI 0.78–0.89)로 감소하는 것이 나타났다.83 10,948명을 대상으로 시행한 또 다른 메타분석 결과에서는 고섬유질 식이를 진행하였을 경우 대장 선종의 발생 상대 위험도가 0.72 (95% CI 0.63–0.83)로 감소하는 것을 보여주었다.84 과일 및 채소의 섭취도 포만감을 유발하여 과도한 식이를 억제하여 비만 치료에 주로 적용되는 식이로 잘 알려져 있다. 이러한 과일 및 채소는 비만 억제 역할뿐만 아니라 그 자체로서 다양한 anticarcinogenic/antimutagenic 요소들을 보유하고 있다.85 19개의 전향적 연구를 포함한 메타분석 결과에 따르면, 과일 및 채소를 다량으로 복용하는 그룹에서적게 복용하는 그룹에 비해 대장암 발생 상대 위험도를 0.92 (95% CI 0.86–0.99)로 감소시키는 것을 보여주었다.86
신체활동은 비만 환자 치료 전략에 있어 핵심적인 역할을 하며, 최근에는 대장암 발생 위험도를 감소시킬 수 있는 인자 중 하나로 점차 알려지고 있다. 적절한 신체 활동은 대사증후군의 감소, 장내 만성 염증도 감소 및 장내 미생물총의 변화를 야기시키는 다양한 기전을 통해 대장암 발생 위험도를 감소시키는데 기여한다.5 Asghar 등87은 쥐 모델에서 신체활동이 전사인자 Nrf2를 통해 글루타치온S 전달효소와 같은 항산화작용을 하는 해독물질을 촉진한다고 보고하였다. 또한, 중등도의 운동을 할 경우 혈중 렙틴농도가 감소하며,88 동물모델에서는 IGF-1/IGFBP3 발현을 차단하며, 종양생성에 영향을 미치는 c-myc이나 VEGF 발현을 유도하는 β-catenin 경로를 차단하는 효과도 있는 것으로 보고되었다.89 다양한 메타 분석에 대해 리뷰한 논문에서도 대장암 예방에 있어서 적절한 신체활동이 예방효과를 가지고 있음을 보고하였고, 144만명 및 75만명의 성인을 대상으로 분석한 대규모 메타분석에서도 신체 여가 활동이 대장암 발생 연관도를 8–14% 감소시킬 수 있음을 보고하였다.90-92 신체활동이 대장암 발생에 미치는 영향에 대해서는 성별에 차이가 있음을 보여주는데, 남성에는 예방효과가 있으나 여성에서는 이러한 효과가 뚜렷하게 나타나지는 않았다.92,93 이러한 현상이 나타난 이유로 여성에서의 대장암 발생 위험도가 남성에 비해 높지 않아, 신체활동이 미치는 긍정적인 효과를 입증하기가 어렵기 때문인 것으로 여겨지고 있다.
현재까지 비만 환자에서 대장암 수술 진행 시 수술 시간의증가, 수술 후 이환율 증가 같은 수술 후 합병증의 빈도가 증가하는 것으로 알려져 있다.94,95 또한, 외과 수술 방법과 독립적으로 비만 환자에서 수술 부위 감염률이 좀 더 증가하는 경향인 것을 보고하는 연구들도 있다.94,96 한 메타분석 결과에 따르면 BMI ≥30 kg/m2인 환자의 경우 BMI가 <30 kg/m2인 환자들에 비해 수술 부위 감염률이 2배 이상 증가하는 결과를 보고하였다(OR 2.13, 95% CI 1.66–2.72).97 특히 아시아 환자들에서는 이러한 BMI 적용이 좀 더 엄격하게 작용하여 BMI가 25 이상인 경우 25 미만인 그룹에 비해 수술 부위 감염위험도가 63% 증가하는 것을 보여주었다.97 13개의 관찰연구를 분석한 또 다른 메타 분석에서도, 비만 환자 그룹에서 대장암 수술 시 수술 후 이환율(OR 2.11, 95% CI 1.21–1.97), 수술 부위 감염(OR 2.43, 95% CI 1.46–4.03), 문합 부위 누출(OR 1.65, 95% CI 1.01–2.71)들이 모두 증가하는 것을 보고하였다.98 종합하면, 비만의 경우 대장암 수술에 있어 다양한수술 연관 합병증을 증가시키는 부정적인 효과를 보여주는 것을 확인할 수 있었다.
최근 연구에 따르면, 내장 지방 분포/피하 지방 분포의 비가 체내 순환하는 혈관 형성 인자 (proangiogenic)의 바이오마커인 VEGF-A와 연관이 있는 것을 보고하였다.99 이러한 이유로 비만 환자에서는 anti-VEGF (bevacizumab)가 포함된항암 표적 치료제에 대한 반응이 감소할 것으로 추측하고 있다. 120명의 전이성 대장암 환자를 대상으로 bevacizumab기반 치료와 전통적인 항암치료를 받은 군을 비교 분석하였을때, BMI가 높을수록 bevacizumab 기반 치료군의 반응율은감소하였으나, 항암치료군에는 별다른 영향을 미치지 않은 것을 확인할 수 있었다.100 특히 이 연구에서의 다변량 분석과정을 통해, 내장지방이 치료 반응(hazard ratio [HR] 7.18, 95%CI 1.69–30.6), 질병진행까지의 시간(HR 2.80, 95% CI 1.35–5.79), 그리고 전체적인 생존율(HR 2.88, 95% CI 1.13–7.32)에 악영향을 미치는 독립인자임을 확인할 수 있었다.100 563명의 전이성 대장암 환자를 기반으로 한 연구에서도 bevacizumab 기반 항암요법을 시행하였을 경우 비만이 있는 환자군에 비해 비만이 없는 환자군에서 무진행 질병 생존 기간(progression-free survival) 및 2년 생존율이 이 통계적으로 유의하게 더 길었다.101 하지만 Miyamoto 등102이 보고한 연구 결과에 따르면 내장지방이 적은 환자가 내장지방이 많은환자에 비해 통계적으로 유의하게 평균 생존 기간이 짧게 나타났다(21.1 vs. 38.9 months, p=0.03). 전이성 대장암 237명을 대상으로 한 후향적 연구에서도 2차 항암으로서 bevacizumab 기반 항암요법을 시행 시 BMI가 높을수록 무진행질병 생존 기간 및 생존율 향상에 긍정적인 영향을 미치는것으로 보고하였다.103 비만이 항암요법 결과에 미치는 영향에대해서는 이렇듯 연구마다 서로 다른 의견들을 개진하고 있으며, 이는 항암요법 효과 평가 시 영향을 미치는 변수가 많고,근거 수준이 높은 전향적 무작위 대조 연구 결과가 존재하지않기 때문인 것으로 여겨진다.
비만은 대장암을 일으키는 요인이 되기도 하며, 대장암 진단 이후의 환자 상태에도 영향을 미친다.104 이전의 여러 연구에서 비만 환자의 경우 대장암 전이, 항암치료 효과에 나쁜 영향을 미치는 것으로 보고되었으나 아직까지 밝혀지지 않은 부분이 많다. 역학 자료에 의하면 남성에서 비만은 대장암 위험이 30–70%까지 증가하는 것과 관련이 있으나 여성에서는 다소 일관성이 떨어지는 경향도 있다.104
16개의 전향적 연구들을 분석한 메타분석 결과에 따르면 전체적인 사망률 및 질병 특이 사망률에 있어서 대장암 진단 시 비만이었던 그룹이 그렇지 않은 경우에 비해 상대 위험도가 각각 1.25 (95% CI 1.14–1.36) 및 1.22 (95% CI 1.00–1.35)로 증가하는 것을 보고하였다.105 최근 발표된 607,266 대장암 환자들을 대상으로 한 대규모 메타분석 결과에서도 비만인 그룹이 정상 체중을 보유한 그룹에 비해 전체적인 사망률이 증가함을 보여주었다(OR 1.20, 95% CI 1.06–1.36).106 이렇듯 비만이대장암 사망률과 연관성이 있음을 많은 연구결과에서 보여주고 있으나, 이러한 점을 해석할 때는, 비만이 대장암 치료 방법에 있어 영향을 미칠 수 있다는 점을 고려해야 한다. 통상적으로 항암제의 용량은 환자의 체중이나 인체 표면적(body surface area)을 기준으로 결정이 되는데, 비만환자에서는 체중증가에 따른 항암제 용량의 증가에 의한 부작용이 우려되어실제 진료 현장에서 항암제를 권고 용량보다 적게 사용하는경우가 존재한다. 따라서 이러한 실제 진료 현장에 있어 적은항암제 용량의 사용은 치료 효과를 감소시키는 결과를 야기시킬 수 있다. 하지만 최근 진료지침 및 메타분석 결과들에 따르면 비만환자에서도 권고 용량에 맞게 항암제를 모두 사용할것을 권고하고 있으며, 이러한 권고 용량에 따른 부작용 역시실제 비만환자에서 유의미한 부작용 증가를 보여주고 있지 않음을 입증하였다.107,108 BMI≥30 kg/m2이면서 인체 표면적이 ≥2 m2인 3기 대장암 환자들에게 체중에 따른 권고 용량과 용량 감소에 따른 효과를 비교한 연구 결과에 따르면 권고 용량을 사용시 재발 없는 생존 기간(relapse-free survival)이 더 향상됨을 보여주었다(HR 0.48, 95% CI 0.27–0.85).109
체중 감소가 대장암 발생 위험에 어떠한 영향을 미치는지에 대해, 최근 다양한 연구 결과들이 보고되었다. 다기관 전향적 코호트 연구에 따르면 체중 감소를 통해 BMI를 낮출 경우 대장암 발생 위험도를 감소시키는 것을 보고하였고(HR 0.69, 95% CI 0.52–0.92),110 폐경 후 여성에서 체중 감소가 나타난 경우에도 대장암 발생 위험도가 유의하게 줄어드는 것을 확인할 수 있었다(HR 0.79, 95% CI 0.63–0.99).111 비만대사 수술의 경우 체중 감소의 효과를 유의하게 나타내지만 이것이 실제 대장암 발생 위험도를 감소시키는지에 대해서는 아직까지 논란의 여지가 존재한다. 최근 발표된 코호트 연구에 따르면 비만대사 수술의 한 종류인 Roux-en-Y gastric bypass를 받은 그룹에서 비만 그룹에 비해 대장암 발생에 대한 위험도가 53% 감소하는 것을 확인할 수 있었다(OR 0.47, 95% CI 0.30–0.75).112 그러나 스웨덴에서 시행한 전향적 무작위 임상시험에서는, 비만대사 수술을 받은 경우에도 대장암 발생 위험도가 유의하게 감소하지는 않는 것을 확인하였다(adjusted HR 0.89, 95% CI 0.62–1.29).113 연구결과마다 상이한 결과가 도출되는 되는 각 연구 디자인의 차이, 수술 방법의 차이, 그리고 체중 감소에 따른 장내 미생물총의 변화 및 호르몬 변화의제한적인 반영이 그 이유들로 생각할 수 있을 것이다.114,115요약하면, 현재까지 체중 감소가 대장암 발생 위험도를 낮추는 것으로 여겨지고 있으나, 비만대사 수술이 대장암 발생의위험을 감소시키는지에 대해서는 추가적인 연구들이 필요할것으로 여겨진다.
Go to : 
비만은 대장암 발생에 직접적이고 독립적으로 영향을 미치며 비만과 대장암 발병은 양의 상관관계를 가진다. 종양미세환경에서 지방세포는 대장암 성장을 위한 영양분을 제공하고 지방조직에서 분비하는 아디포카인 및 염증물질, 인슐린, IGF, 렙틴 및 염증성 사이토카인과 담즙산 불균형은 대장암 발병과 성장에 기여한다. 이처럼 비만은 다양한 경로로 대장암 형성을 촉진한다. 실제로 여러 임상 역학 연구에서도 비만이 대장암의 위험을 증가시키는 결과들은 이미 여러 연구를통해 다양하게 제시되고 있다. 또한, 비만은 대장암의 발생을증가시킬 뿐만 아니라 치료 결과에도 영향을 미칠 수 있다.국내의 경우 점차 서구화된 식생활 및 생활 습관으로 인해비만 환자의 인구가 점차 증가하고 있으며, 따라서 향후 비만이 대장암의 예방 및 치료에 미치는 영향이 사회적으로 더커질 것으로 예상한다. 현재까지 알려진 연구결과들을 고려할때 실제 임상에서 비만을 조절하여 대장암을 억제할 수 있을것으로 생각되며, 특히 소아 및 청소년기 비만에 대한 적극적인 관리는 향후 조기 발병 대장암을 포함하여 관련 인구의대장암 유병률을 감소시킬 수 있는 중요한 예방책으로 자리매김할 것으로 여겨진다. 또한, 성인에서도 대사증후군을 포함한 비만에 대한 치료를 적극적으로 함으로써 대장암 발생 위험도 감소 및 대장암 치료 효과를 상승시킬 수 있을 것으로기대할 수 있다. 하지만 비만 환자에 대한 대장암 예방 전략에대해서는 아직도 불충분한 부분들이 많이 남아있다. 비만이있는 사람에서 대장암 검진 시기를 정상체중 그룹과 동일하게할 것인지, 대장암 억제를 위한 비만 측정 평가 방법 및 다양한 비만 생물학적 예측인자들이 필요한지(leptin, adiponectin, 내장지방비율 평가 등), 비만대사 수술 또는 체중감량약제를 통한 체중 감소가 대장암 예방에 효과가 어느 정도있는지 등 다양한 추가 연구들이 필요하며 이러한 후속 연구들을 통해 비만과 대장암에 대한 다각적 접근이 이루어질 것으로 기대한다.
Go to : 
REFERENCES
1. Analysis of the status of malnutrition and obesity treatment in the last five years (2017-2021). [Internet]. The Health Insurance Review and Assessment Service;cited 2022 Apr 21. Available from: https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA020041000100&brdScnBltNo=4&brdBltNo=10575&pageIndex=1.
2. Chang P, Friedenberg F. 2014; Obesity and GERD. Gastroenterol Clin North Am. 43:161–173. DOI: 10.1016/j.gtc.2013.11.009. PMID: 24503366. PMCID: PMC3920303.

3. Lee CG, Lee JK, Kang YS, et al. 2015; Visceral abdominal obesity is associated with an increased risk of irritable bowel syndrome. Am J Gastroenterol. 110:310–319. DOI: 10.1038/ajg.2014.422. PMID: 25583325.

4. Agarwal A, Singh A, Mehtab W, et al. 2021; Patients with celiac disease are at high risk of developing metabolic syndrome and fatty liver. Intest Res. 19:106–114. DOI: 10.5217/ir.2019.00136. PMID: 32312034. PMCID: PMC7873403.

5. Friedenreich CM, Ryder-Burbidge C, McNeil J. 2021; Physical activity, obesity and sedentary behavior in cancer etiology: epidemiologic evidence and biologic mechanisms. Mol Oncol. 15:790–800. DOI: 10.1002/1878-0261.12772. PMID: 32741068. PMCID: PMC7931121.
6. Belladelli F, Montorsi F, Martini A. 2022; Metabolic syndrome, obesity and cancer risk. Curr Opin Urol. 32:594–597. DOI: 10.1097/MOU.0000000000001041. PMID: 36081396.

7. Death rates by major carcinoma in 2021. [Internet]. National Cancer Information Center;cited 2022 Sep 28. Available from: https://www.cancer.go.kr/lay1/S1T645C646/contents.do.
8. Data on health insurance treatment status for colorectal cancer from 2012 to 2021. [Internet]. National Health Insurance Service;cited 2022 Oct 20. Available from: https://www.nhis.or.kr/nhis/together/wbhaea01600m01.do?mode=view&articleNo=10828825&article.offset=0&articleLimit=10&srSearchVal=%EB%8C%80%EC%9E%A5%EC%95%94.
9. Chen Q, Wang J, Yang J, et al. 2015; Association between adult weight gain and colorectal cancer: a dose-response meta-analysis of observational studies. Int J Cancer. 136:2880–2889. DOI: 10.1002/ijc.29331. PMID: 25395274.

10. Garcia H, Song M. 2019; Early-life obesity and adulthood colorectal cancer risk: a meta-analysis. Rev Panam Salud Publica. 43:e3. DOI: 10.26633/RPSP.2019.3. PMID: 31093227. PMCID: PMC6393738.

11. Sninsky JA, Shore BM, Lupu GV, Crockett SD. 2022; Risk factors for colorectal polyps and cancer. Gastrointest Endosc Clin N Am. 32:195–213. DOI: 10.1016/j.giec.2021.12.008. PMID: 35361331.

12. Øines M, Helsingen LM, Bretthauer M, Emilsson L. 2017; Epidemiology and risk factors of colorectal polyps. Best Pract Res Clin Gastroenterol. 31:419–424. DOI: 10.1016/j.bpg.2017.06.004. PMID: 28842051.

13. Schlesinger S, Aleksandrova K, Abar L, et al. 2017; Adult weight gain and colorectal adenomas-a systematic review and meta-analysis. Ann Oncol. 28:1217–1229. DOI: 10.1093/annonc/mdx080. PMID: 28327995.

14. Anderson JC, Calderwood AH, Christensen BC, Robinson CM, Amos CI, Butterly L. 2018; Smoking and other risk factors in individuals with synchronous conventional high-risk adenomas and clinically significant serrated polyps. Am J Gastroenterol. 113:1828–1835. DOI: 10.1038/s41395-018-0393-0. PMID: 30385834. PMCID: PMC6768665.

15. Bailie L, Loughrey MB, Coleman HG. 2017; Lifestyle risk factors for serrated colorectal polyps: A systematic review and meta-analysis. Gastroenterology. 152:92–104. DOI: 10.1053/j.gastro.2016.09.003. PMID: 27639804.

16. Wong MC, Chan CH, Cheung W, et al. 2018; Association between investigator-measured body-mass index and colorectal adenoma: a systematic review and meta-analysis of 168,201 subjects. Eur J Epidemiol. 33:15–26. DOI: 10.1007/s10654-017-0336-x. PMID: 29288474. PMCID: PMC5803281.
17. Gathirua-Mwangi WG, Monahan P, Song Y, et al. 2017; Changes in adult BMI and waist circumference are associated with increased risk of advanced colorectal neoplasia. Dig Dis Sci. 62:3177–3185. DOI: 10.1007/s10620-017-4778-5. PMID: 28983748. PMCID: PMC5653429.

18. Lauby-Secretan B, Scoccianti C, Loomis D, Grosse Y, Bianchini F, Straif K. 2016; Body fatness and cancer--viewpoint of the IARC working group. N Engl J Med. 375:794–798. DOI: 10.1056/NEJMsr1606602. PMID: 27557308. PMCID: PMC6754861.

19. Ma Y, Yang Y, Wang F, et al. 2013; Obesity and risk of colorectal cancer: a systematic review of prospective studies. PLoS One. 8:e53916. DOI: 10.1371/journal.pone.0053916. PMID: 23349764. PMCID: PMC3547959.

20. Abar L, Vieira AR, Aune D, et al. 2018; Height and body fatness and colorectal cancer risk: an update of the WCRF-AICR systematic review of published prospective studies. Eur J Nutr. 57:1701–1720. DOI: 10.1007/s00394-017-1557-1. PMID: 29080978. PMCID: PMC6060816.

21. Ning Y, Wang L, Giovannucci EL. 2010; A quantitative analysis of body mass index and colorectal cancer: findings from 56 observational studies. Obes Rev. 11:19–30. DOI: 10.1111/j.1467-789X.2009.00613.x. PMID: 19538439.

22. O'Sullivan DE, Sutherland RL, Town S, et al. 2022; Risk factors for early-onset colorectal cancer: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 20:1229–1240.e5. DOI: 10.1016/j.cgh.2021.01.037. PMID: 33524598.
23. Liu PH, Wu K, Ng K, et al. 2019; Association of obesity with risk of early-onset colorectal cancer among women. JAMA Oncol. 5:37–44. DOI: 10.1001/jamaoncol.2018.4280. PMID: 30326010. PMCID: PMC6382547.

24. Mili N, Paschou SA, Goulis DG, Dimopoulos MA, Lambrinoudaki I, Psaltopoulou T. 2021; Obesity, metabolic syndrome, and cancer: pathophysiological and therapeutic associations. Endocrine. 74:478–497. DOI: 10.1007/s12020-021-02884-x. PMID: 34625915.

25. Jin EH, Han K, Lee DH, et al. 2022; Association between metabolic syndrome and the risk of colorectal cancer diagnosed before age 50 years according to tumor location. Gastroenterology. 163:637–648.e2. DOI: 10.1053/j.gastro.2022.05.032. PMID: 35643169.
26. Lee J, Lee KS, Kim H, et al. 2020; The relationship between metabolic syndrome and the incidence of colorectal cancer. Environ Health Prev Med. 25:6. DOI: 10.1186/s12199-020-00845-w. PMID: 32075578. PMCID: PMC7031951.
27. Chen H, Zheng X, Zong X, et al. 2021; Metabolic syndrome, metabolic comorbid conditions and risk of early-onset colorectal cancer. Gut. 70:1147–1154. DOI: 10.1136/gutjnl-2020-321661. PMID: 33037055. PMCID: PMC8032822.
28. Xu P, Li J, Liu J, Wang J, Wu Z, Zhang X, Zhai Y. 2017; Mature adipocytes observed to undergo reproliferation and polyploidy. FEBS Open Bio. 7:652–658. DOI: 10.1002/2211-5463.12207. PMID: 28469978. PMCID: PMC5407891.
29. Cirillo F, Catellani C, Sartori C, Lazzeroni P, Amarri S, Street ME. 2019; Obesity, insulin resistance, and colorectal cancer: could miRNA dysregulation play A role? Int J Mol Sci. 20:2922. DOI: 10.3390/ijms20122922. PMID: 31207998. PMCID: PMC6628223.

30. Kobayashi H, Gieniec KA, Lannagan TRM, et al. 2022; The origin and contribution of cancer-associated fibroblasts in colorectal carcinogenesis. Gastroenterology. 162:890–906. DOI: 10.1053/j.gastro.2021.11.037. PMID: 34883119. PMCID: PMC8881386.

31. Li C, Quan J, Wei R, et al. 2020; Leptin overexpression as a poor prognostic factor for colorectal cancer. Biomed Res Int. 2020:7532514. DOI: 10.1155/2020/7532514. PMID: 32596369. PMCID: PMC7292990.

32. Chen YC, Chien CY, Hsu CC, et al. 2021; Obesity-associated leptin promotes chemoresistance in colorectal cancer through YAP-dependent AXL upregulation. Am J Cancer Res. 11:4220–4240.
33. Lee H, Lee IS, Choue R. 2013; Obesity, inflammation and diet. Pediatr Gastroenterol Hepatol Nutr. 16:143–152. DOI: 10.5223/pghn.2013.16.3.143. PMID: 24224147. PMCID: PMC3819692.

34. Rasic I, Rebic V, Rasic A, Aksamija G, Radovic S. 2018; The association of simultaneous increase in interleukin-6, C reactive protein, and matrix metalloproteinase-9 serum levels with increasing stages of colorectal cancer. J Oncol. 2018:2830503. DOI: 10.1155/2018/2830503. PMID: 30154846. PMCID: PMC6091449.

35. Chávez-Talavera O, Tailleux A, Lefebvre P, Staels B. 2017; Bile acid control of metabolism and inflammation in obesity, type 2 diabetes, dyslipidemia, and nonalcoholic fatty liver disease. Gastroenterology. 152:1679–1694.e3. DOI: 10.1053/j.gastro.2017.01.055. PMID: 28214524.

36. La Frano MR, Hernandez-Carretero A, Weber N, et al. 2017; Diet-induced obesity and weight loss alter bile acid concentrations and bile acid-sensitive gene expression in insulin target tissues of C57BL/6J mice. Nutr Res. 46:11–21. DOI: 10.1016/j.nutres.2017.07.006. PMID: 29173647.

37. Lin H, An Y, Tang H, Wang Y. 2019; Alterations of bile acids and gut microbiota in obesity induced by high fat diet in rat model. J Agric Food Chem. 67:3624–3632. DOI: 10.1021/acs.jafc.9b00249. PMID: 30832480.

38. Centuori SM, Gomes CJ, Trujillo J, et al. 2016; Deoxycholic acid mediates non-canonical EGFR-MAPK activation through the induction of calcium signaling in colon cancer cells. Biochim Biophys Acta. 1861:663–670. DOI: 10.1016/j.bbalip.2016.04.006. PMID: 27086143. PMCID: PMC4900466.

39. Ochsenkühn T, Bayerdörffer E, Meining A, et al. 1999; Colonic mucosal proliferation is related to serum deoxycholic acid levels. Cancer. 85:1664–1669. DOI: 10.1002/(SICI)1097-0142(19990415)85:8<1664::AID-CNCR4>3.0.CO;2-O.

40. Nguyen TT, Ung TT, Kim NH, Jung YD. 2018; Role of bile acids in colon carcinogenesis. World J Clin Cases. 6:577–588. DOI: 10.12998/wjcc.v6.i13.577. PMID: 30430113. PMCID: PMC6232560.

41. Kim DS, Scherer PE. 2021; Obesity, diabetes, and increased cancer progression. Diabetes Metab J. 45:799–812. DOI: 10.4093/dmj.2021.0077. PMID: 34847640. PMCID: PMC8640143.

42. Renehan AG, Frystyk J, Flyvbjerg A. 2006; Obesity and cancer risk: the role of the insulin-IGF axis. Trends Endocrinol Metab. 17:328–336. DOI: 10.1016/j.tem.2006.08.006. PMID: 16956771.

43. Chen J, Katsifis A, Hu C, Huang XF. 2011; Insulin decreases therapeutic efficacy in colon cancer cell line HT29 via the activation of the PI3K/Akt pathway. Curr Drug Discov Technol. 8:119–125. DOI: 10.2174/157016311795563820. PMID: 21513489.

44. Stefani C, Miricescu D, Stanescu-Spinu II, et al. 2021; Growth factors, PI3K/AKT/mTOR and MAPK signaling pathways in colorectal cancer pathogenesis: Where are we now? Int J Mol Sci. 22:10260. DOI: 10.3390/ijms221910260. PMID: 34638601. PMCID: PMC8508474.

45. Kasprzak A. 2021; Insulin-like growth factor 1 (IGF-1) signaling in glucose metabolism in colorectal cancer. Int J Mol Sci. 22:6434. DOI: 10.3390/ijms22126434. PMID: 34208601. PMCID: PMC8234711.

46. Narayanankutty A. 2019; PI3K/Akt/mTOR pathway as a therapeutic target for colorectal cancer: A review of preclinical and clinical evidence. Curr Drug Targets. 20:1217–1226. DOI: 10.2174/1389450120666190618123846. PMID: 31215384.

47. Wang L, Li S, Luo H, Lu Q, Yu S. 2022; PCSK9 promotes the progression and metastasis of colon cancer cells through regulation of EMT and PI3K/AKT signaling in tumor cells and phenotypic polarization of macrophages. J Exp Clin Cancer Res. 41:303. DOI: 10.1186/s13046-022-02477-0. PMID: 36242053. PMCID: PMC9563506.

48. Zhao Y, Scott A, Zhang P, et al. 2017; Regulation of paxillin-p130-PI3K-AKT signaling axis by Src and PTPRT impacts colon tumorigenesis. Oncotarget. 8:48782–48793. DOI: 10.18632/oncotarget.10654. PMID: 27447856. PMCID: PMC5564724.

49. Chen J, Elfiky A, Han M, Chen C, Saif MW. 2014; The role of Src in colon cancer and its therapeutic implications. Clin Colorectal Cancer. 13:5–13. DOI: 10.1016/j.clcc.2013.10.003. PMID: 24361441.

50. Zhu S, Bjorge JD, Fujita DJ. 2007; PTP1B contributes to the oncogenic properties of colon cancer cells through Src activation. Cancer Res. 67:10129–10137. DOI: 10.1158/0008-5472.CAN-06-4338. PMID: 17974954.

51. Sekharam M, Nasir A, Kaiser HE, Coppola D. 2003; Insulin-like growth factor 1 receptor activates c-SRC and modifies transformation and motility of colon cancer in vitro. Anticancer Res. 23:1517–1524.
52. Engin A. 2017; Diet-Induced obesity and the mechanism of leptin resistance. Adv Exp Med Biol. 960:381–397. DOI: 10.1007/978-3-319-48382-5_16. PMID: 28585208.

53. Aleksandrova K, Schlesinger S, Fedirko V, et al. 2017; Metabolic mediators of the association between adult weight gain and colorectal cancer: Data from the european prospective investigation into cancer and nutrition (EPIC) cohort. Am J Epidemiol. 185:751–764. DOI: 10.1093/aje/kww194. PMID: 28387787. PMCID: PMC5860400.

54. Endo H, Hosono K, Uchiyama T, et al. 2011; Leptin acts as a growth factor for colorectal tumours at stages subsequent to tumour initiation in murine colon carcinogenesis. Gut. 60:1363–1371. DOI: 10.1136/gut.2010.235754. PMID: 21406387.

55. Nigro E, Scudiero O, Monaco ML, et al. 2014; New insight into adiponectin role in obesity and obesity-related diseases. Biomed Res Int. 2014:658913. DOI: 10.1155/2014/658913. PMID: 25110685. PMCID: PMC4109424.

56. Duraiyarasan S, Adefuye M, Manjunatha N, Ganduri V, Rajasekaran K. 2022; Colon cancer and obesity: A narrative review. Cureus. 14:e27589. DOI: 10.7759/cureus.27589.

57. Sugiyama M, Takahashi H, Hosono K, et al. 2009; Adiponectin inhibits colorectal cancer cell growth through the AMPK/mTOR pathway. Int J Oncol. 34:339–344.

58. Fujisawa T, Endo H, Tomimoto A, et al. 2008; Adiponectin suppresses colorectal carcinogenesis under the high-fat diet condition. Gut. 57:1531–1538. DOI: 10.1136/gut.2008.159293. PMID: 18676419. PMCID: PMC2582344.

59. Wei EK, Giovannucci E, Fuchs CS, Willett WC, Mantzoros CS. 2005; Low plasma adiponectin levels and risk of colorectal cancer in men: a prospective study. J Natl Cancer Inst. 97:1688–1694. DOI: 10.1093/jnci/dji376. PMID: 16288122.

60. Moon HS, Liu X, Nagel JM, et al. 2013; Salutary effects of adiponectin on colon cancer: in vivo and in vitro studies in mice. Gut. 62:561–570. DOI: 10.1136/gutjnl-2012-302092. PMID: 22735569.

61. Ellulu MS, Patimah I, Khaza'ai H, Rahmat A, Abed Y. 2017; Obesity and inflammation: the linking mechanism and the complications. Arch Med Sci. 13:851–863. DOI: 10.5114/aoms.2016.58928. PMID: 28721154. PMCID: PMC5507106.

62. Fontana L, Eagon JC, Trujillo ME, Scherer PE, Klein S. 2007; Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes. 56:1010–1013. DOI: 10.2337/db06-1656. PMID: 17287468.

63. Nagasaki T, Hara M, Nakanishi H, Takahashi H, Sato M, Takeyama H. 2014; Interleukin-6 released by colon cancer-associated fibroblasts is critical for tumour angiogenesis: anti-interleukin-6 receptor antibody suppressed angiogenesis and inhibited tumour-stroma interaction. Br J Cancer. 110:469–478. DOI: 10.1038/bjc.2013.748. PMID: 24346288. PMCID: PMC3899773.

64. Rodrigues KF, Pietrani NT, Bosco AA, Campos FMF, Sandrim VC, Gomes KB. 2017; IL-6, TNF-α, and IL-10 levels/polymorphisms and their association with type 2 diabetes mellitus and obesity in Brazilian individuals. Arch Endocrinol Metab. 61:438–446. DOI: 10.1590/2359-3997000000254. PMID: 28225860.

65. Wei X, Li X, Kong F, et al. 2018; [TNF-α activates Wnt signaling pathway to promote the invasion of human colon cancer stem cells]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 34:982–988. Chinese.
66. Kern L, Mittenbühler MJ, Vesting AJ, et al. 2018; Obesity-induced TNFα and IL-6 signaling: The missing link between obesity and inflammation-driven liver and colorectal cancers. Cancers (Basel). 11:24. DOI: 10.3390/cancers11010024. PMID: 30591653. PMCID: PMC6356226.

67. Kaltschmidt C, Banz-Jansen C, Benhidjeb T, et al. 2019; A role for NF-κB in organ specific cancer and cancer stem cells. Cancers (Basel). 11:655. DOI: 10.3390/cancers11050655. PMID: 31083587. PMCID: PMC6563002.

68. Pikarsky E, Porat RM, Stein I, et al. 2004; NF-kappaB functions as a tumour promoter in inflammation-associated cancer. Nature. 431:461–466. DOI: 10.1038/nature02924. PMID: 15329734.

69. Kwaifa IK, Bahari H, Yong YK, Noor SM. 2020; Endothelial dysfunction in obesity-induced inflammation: Molecular mechanisms and clinical implications. Biomolecules. 10:291. DOI: 10.3390/biom10020291. PMID: 32069832. PMCID: PMC7072669.

70. Yoshimura T. 2018; The chemokine MCP-1 (CCL2) in the host interaction with cancer: a foe or ally? Cell Mol Immunol. 15:335–345. DOI: 10.1038/cmi.2017.135. PMID: 29375123. PMCID: PMC6052833.

71. Molnár I. 2020; Interactions among thyroid hormone (FT4), chemokine (MCP-1) and neurotrophin (NGF-β) levels studied in Hungarian postmenopausal and obese women. Cytokine. 127:154948. DOI: 10.1016/j.cyto.2019.154948. PMID: 31901598.

72. Wang H, Tian T, Zhang J. 2021; Tumor-associated macrophages (TAMs) in colorectal cancer (CRC): From mechanism to therapy and prognosis. Int J Mol Sci. 22:8470. DOI: 10.3390/ijms22168470. PMID: 34445193. PMCID: PMC8395168.

73. McClellan JL, Davis JM, Steiner JL, et al. 2012; Linking tumor-associated macrophages, inflammation, and intestinal tumorigenesis: role of MCP-1. Am J Physiol Gastrointest Liver Physiol. 303:G1087–G1095. DOI: 10.1152/ajpgi.00252.2012. PMID: 23019193. PMCID: PMC3517651.

74. Nieman KM, Kenny HA, Penicka CV, et al. 2011; Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth. Nat Med. 17:1498–1503. DOI: 10.1038/nm.2492. PMID: 22037646. PMCID: PMC4157349.

75. Martin-Padura I, Gregato G, Marighetti P, et al. 2012; The white adipose tissue used in lipotransfer procedures is a rich reservoir of CD34+ progenitors able to promote cancer progression. Cancer Res. 72:325–334. DOI: 10.1158/0008-5472.CAN-11-1739. PMID: 22052460.

76. Mukherjee A, Bilecz AJ, Lengyel E. 2022; The adipocyte microenvironment and cancer. Cancer Metastasis Rev. 41:575–587. DOI: 10.1007/s10555-022-10059-x. PMID: 35941408.

77. Xiao L, Wang J, Li J, et al. 2015; RORα inhibits adipocyte-conditioned medium-induced colorectal cancer cell proliferation and migration and chick embryo chorioallantoic membrane angiopoiesis. Am J Physiol Cell Physiol. 308:C385–C396. DOI: 10.1152/ajpcell.00091.2014. PMID: 25500738.

78. Amemori S, Ootani A, Aoki S, et al. 2007; Adipocytes and preadipocytes promote the proliferation of colon cancer cells in vitro. Am J Physiol Gastrointest Liver Physiol. 292:G923–G929. DOI: 10.1152/ajpgi.00145.2006. PMID: 17170030.

79. Martinez-Outschoorn UE, Sotgia F, Lisanti MP. 2012; Power surge: supporting cells "fuel" cancer cell mitochondria. Cell Metab. 15:4–5. DOI: 10.1016/j.cmet.2011.12.011. PMID: 22225869.

80. Murphy N, Moreno V, Hughes DJ, et al. 2019; Lifestyle and dietary environmental factors in colorectal cancer susceptibility. Mol Aspects Med. 69:2–9. DOI: 10.1016/j.mam.2019.06.005. PMID: 31233770.

81. Vergara-Castañeda HA, Guevara-González RG, Ramos-Gómez M, et al. 2010; Non-digestible fraction of cooked bean (Phaseolus vulgaris L.) cultivar Bayo Madero suppresses colonic aberrant crypt foci in azoxymethane-induced rats. Food Funct. 1:294–300. DOI: 10.1039/c0fo00130a. PMID: 21776479.

82. Reddy BS, Hirose Y, Cohen LA, Simi B, Cooma I, Rao CV. 2000; Preventive potential of wheat bran fractions against experimental colon carcinogenesis: implications for human colon cancer prevention. Cancer Res. 60:4792–4797.
83. Aune D, Chan DS, Lau R, et al. 2011; Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ. 343:d6617. DOI: 10.1136/bmj.d6617. PMID: 22074852. PMCID: PMC3213242.

84. Ben Q, Sun Y, Chai R, Qian A, Xu B, Yuan Y. 2014; Dietary fiber intake reduces risk for colorectal adenoma: a meta-analysis. Gastroenterology. 146:689–699.e6. DOI: 10.1053/j.gastro.2013.11.003. PMID: 24216326.

85. Zhang S, Jia Z, Yan Z, Yang J. 2017; Consumption of fruits and vegetables and risk of renal cell carcinoma: a meta-analysis of observational studies. Oncotarget. 8:27892–27903. DOI: 10.18632/oncotarget.15841. PMID: 28427188. PMCID: PMC5438616.

86. Aune D, Lau R, Chan DS, et al. 2011; Nonlinear reduction in risk for colorectal cancer by fruit and vegetable intake based on meta-analysis of prospective studies. Gastroenterology. 141:106–118. DOI: 10.1053/j.gastro.2011.04.013. PMID: 21600207.

87. Asghar M, George L, Lokhandwala MF. 2007; Exercise decreases oxidative stress and inflammation and restores renal dopamine D1 receptor function in old rats. Am J Physiol Renal Physiol. 293:F914–F919. DOI: 10.1152/ajprenal.00272.2007. PMID: 17634393.

88. Cirillo D, Rachiglio AM, la Montagna R, Giordano A, Normanno N. 2008; Leptin signaling in breast cancer: an overview. J Cell Biochem. 105:956–964. DOI: 10.1002/jcb.21911. PMID: 18821585.

89. Ju J, Nolan B, Cheh M, et al. 2008; Voluntary exercise inhibits intestinal tumorigenesis in Apc(Min/+) mice and azoxymethane/dextran sulfate sodium-treated mice. BMC Cancer. 8:316. DOI: 10.1186/1471-2407-8-316. PMID: 18976499. PMCID: PMC2635383.
90. Rezende LFM, Sá TH, Markozannes G, et al. 2018; Physical activity and cancer: an umbrella review of the literature including 22 major anatomical sites and 770000 cancer cases. Br J Sports Med. 52:826–833. DOI: 10.1136/bjsports-2017-098391. PMID: 29146752.

91. Moore SC, Lee IM, Weiderpass E, et al. 2016; Association of leisure-time physical activity with risk of 26 types of cancer in 1.44 million adults. JAMA Intern Med. 176:816–825. DOI: 10.1001/jamainternmed.2016.1548. PMID: 27183032. PMCID: PMC5812009.

92. Matthews CE, Moore SC, Arem H, et al. 2020; Amount and intensity of leisure-time physical activity and lower cancer risk. J Clin Oncol. 38:686–697. DOI: 10.1200/JCO.19.02407. PMID: 31877085. PMCID: PMC7048166.

93. Wolin KY, Yan Y, Colditz GA. 2011; Physical activity and risk of colon adenoma: a meta-analysis. Br J Cancer. 104:882–885. DOI: 10.1038/sj.bjc.6606045. PMID: 21304525. PMCID: PMC3048199.

94. Zhou Y, Wu L, Li X, Wu X, Li B. 2012; Outcome of laparoscopic colorectal surgery in obese and nonobese patients: a meta-analysis. Surg Endosc. 26:783–789. DOI: 10.1007/s00464-011-1952-2. PMID: 22011944.

95. Makino T, Shukla PJ, Rubino F, Milsom JW. 2012; The impact of obesity on perioperative outcomes after laparoscopic colorectal resection. Ann Surg. 255:228–236. DOI: 10.1097/SLA.0b013e31823dcbf7. PMID: 22190113.

96. Qiu Y, Liu Q, Chen G, et al. 2016; Outcome of rectal cancer surgery in obese and nonobese patients: a meta-analysis. World J Surg Oncol. 14:23. DOI: 10.1186/s12957-016-0775-y. PMID: 26810563. PMCID: PMC4727287.

97. Almasaudi AS, McSorley ST, Edwards CA, McMillan DC. 2018; The relationship between body mass index and short term postoperative outcomes in patients undergoing potentially curative surgery for colorectal cancer: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 121:68–73. DOI: 10.1016/j.critrevonc.2017.12.004. PMID: 29279101.

98. Fung A, Trabulsi N, Morris M, et al. 2017; Laparoscopic colorectal cancer resections in the obese: a systematic review. Surg Endosc. 31:2072–2088. DOI: 10.1007/s00464-016-5209-y. PMID: 27778169.

99. Himbert C, Ose J, Nattenmüller J, et al. 2019; Body fatness, adipose tissue compartments, and biomarkers of inflammation and angiogenesis in colorectal cancer: The ColoCare study. Cancer Epidemiol Biomarkers Prev. 28:76–82. DOI: 10.1158/1055-9965.EPI-18-0654. PMID: 30333223. PMCID: PMC6324954.

100. Guiu B, Petit JM, Bonnetain F, et al. 2010; Visceral fat area is an independent predictive biomarker of outcome after first-line bevacizumab-based treatment in metastatic colorectal cancer. Gut. 59:341–347. DOI: 10.1136/gut.2009.188946. PMID: 19837679.

101. Artaç M, Korkmaz L, Coşkun HŞ, et al. 2019; Bevacuzimab may be less effective in obese metastatic colorectal cancer patients. J Gastrointest Cancer. 50:214–220. DOI: 10.1007/s12029-017-0047-2. PMID: 29302856.

102. Miyamoto Y, Oki E, Emi Y, et al. 2018; Low visceral fat content is a negative predictive marker for bevacizumab in metastatic colorectal cancer. Anticancer Res. 38:491–499. DOI: 10.21873/anticanres.12249.
103. Cybulska-Stopa B, Ługowska I, Wiśniowski R, et al. 2020; Overweight is associated with better prognosis in metastatic colorectal cancer patients treated with bevacizumab plus FOLFOX chemotherapy. Contemp Oncol (Pozn). 24:34–41. DOI: 10.5114/wo.2020.94728. PMID: 32514236. PMCID: PMC7265962.
104. Bardou M, Barkun AN, Martel M. 2013; Obesity and colorectal cancer. Gut. 62:933–947. DOI: 10.1136/gutjnl-2013-304701. PMID: 23481261.
105. Lee J, Meyerhardt JA, Giovannucci E, Jeon JY. 2015; Association between body mass index and prognosis of colorectal cancer: a meta-analysis of prospective cohort studies. PLoS One. 10:e0120706. DOI: 10.1371/journal.pone.0120706. PMID: 25811460. PMCID: PMC4374868.
106. Jaspan V, Lin K, Popov V. 2021; The impact of anthropometric parameters on colorectal cancer prognosis: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 159:103232. DOI: 10.1016/j.critrevonc.2021.103232. PMID: 33497759.
107. Griggs JJ, Bohlke K, Balaban EP, et al. 2021; Appropriate systemic therapy dosing for obese adult patients with cancer: ASCO guideline update. J Clin Oncol. 39:2037–2048. DOI: 10.1200/JCO.21.00471. PMID: 33939491.

108. Hourdequin KC, Schpero WL, McKenna DR, Piazik BL, Larson RJ. 2013; Toxic effect of chemotherapy dosing using actual body weight in obese versus normal-weight patients: a systematic review and meta-analysis. Ann Oncol. 24:2952–2962. DOI: 10.1093/annonc/mdt294. PMID: 23965736.

109. Stocker G, Hacker UT, Fiteni F, et al. 2018; Clinical consequences of chemotherapy dose reduction in obese patients with stage III colon cancer: A retrospective analysis from the PETACC 3 study. Eur J Cancer. 99:49–57. DOI: 10.1016/j.ejca.2018.05.004. PMID: 29906734.

110. Christakoudi S, Pagoni P, Ferrari P, et al. 2021; Weight change in middle adulthood and risk of cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC) cohort. Int J Cancer. 148:1637–1651. DOI: 10.1002/ijc.33339. PMID: 33038275.

111. Luo J, Hendryx M, Manson JE, et al. 2019; Intentional weight loss and obesity-related cancer risk. JNCI Cancer Spectr. 3:pkz054. DOI: 10.1093/jncics/pkz054. PMID: 31737862. PMCID: PMC6795232.

112. Khalid SI, Maasarani S, Wiegmann J, et al. 2022; Association of bariatric surgery and risk of cancer in patients with morbid obesity. Ann Surg. 275:1–6. DOI: 10.1097/SLA.0000000000005035. PMID: 34183506.

113. Taube M, Peltonen M, Sjöholm K, et al. 2021; Long-term incidence of colorectal cancer after bariatric surgery or usual care in the Swedish Obese Subjects study. PLoS One. 16:e0248550. DOI: 10.1371/journal.pone.0248550. PMID: 33764991. PMCID: PMC7993847.

114. Mackenzie H, Markar SR, Askari A, et al. 2018; Obesity surgery and risk of cancer. Br J Surg. 105:1650–1657. DOI: 10.1002/bjs.10914. PMID: 30003539.

115. Murphy R, Tsai P, Jüllig M, Liu A, Plank L, Booth M. 2017; Differential changes in gut microbiota after gastric bypass and sleeve gastrectomy bariatric surgery vary according to diabetes remission. Obes Surg. 27:917–925. DOI: 10.1007/s11695-016-2399-2. PMID: 27738970.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download