Abstract
Background and Objectives
Obstructive sleep apnea (OSA) is a complex sleep-related respiratory disorder with various pathophysiology and clinical manifestations. Diagnosis and treatment considering only the number of respiratory events, such as sleep duration, may have limitations. The purpose of this study is to analyze the clinical and polysomnography (PSG) characteristics of patients with severe OSA in whom slow wave sleep (SWS) was well-maintained.
Subjects and Method
This study retrospectively analyzed 203 patients who underwent PSG due to suspected OSA. Severe OSA patients were classified into a SWS maintained group (SWS≥15%) and a SWS reduced group (SWS<15%), and their clinical records, PSG results, and heart rate variability (HRV) were compared.
Results
The SWS maintained group (n=27), compared to the SWS reduced group (n=58), had a significantly longer total sleep time (p=0.027) and lower wake after sleep onset (p=0.001), rapid eye movoement (REM) latency (p=0.007), non-supine apnea-hypopnea index (AHI, p=0.006), non-REM AHI (p<0.001), arousal index (p<0.001) and Epworth Sleepiness Scale (p=0.048). In addition, the SWS maintained group had a significantly low value in very low frequency in HRV than that of the SWS reduced group (p=0.046).
폐쇄성 수면무호흡증의 중증도는 수면다원검사를 통해서 구한 시간당 무호흡-저호흡 수치(apnea-hypopnea index, AHI)로 구하며, 경증은 시간당 5≤AHI<15, 중등도는 15≤ AHI<30, 그리고 중증은 AHI≥30으로 정하고 있다. 중증도가 올라갈수록 심혈관질환 이환율과 사망률이 높아진다고 알려져 있다[1,2]. 아울러 수면 중 잦은 각성 등으로 인해 주간 졸림증과 만성피로함을 호소할 수도 있다[3]. 그런데 중증 수면무호흡증은 AHI 값이 30부터 100까지 모두 한 그룹으로 포함될 수 있기 때문에 경증이나 중등도에 비해 그룹 내 특성이 이질적(heterogenous)일 수 있다. 다른 연구에서는 AHI 값을 55, 또는 100을 기준으로 하여 ‘매우 중증’, ‘극심히 중중’ 그룹으로 나누어 분류하려는 시도도 있었다[4,5]. 중증도에 따른 그룹화를 보다 정밀하게 할 수 있다면, 양압기 치료에 대한 반응이나, 구강내장치의 적용범위, 합병증 발생률, 그리고 주간 임상양상까지도 보다 세분화 할 수 있기 때문에 임상에 좀 더 도움이 될 수 있을 것으로 사료된다.
서파수면(slow wave sleep)은 회복력 있는 수면으로, 피로 회복, 기억력, 성장이나 조직재생, 면역력 등에 중요한 역할을 한다고 알려져 있다[6,7]. 폐쇄성 수면무호흡증의 중증도가 높아질수록 서파수면도 줄어드는 경향을 보여[8], 수면무호흡증의 주간졸림증이나 피로함과 같은 임상증상과 서파수면의 양이 관련있는 것으로 보인다. 경증이나 중등도 수면무호흡증에서는 서파수면이 비교적 잘 유지되고 있기 때문에 서파수면의 비율을 가지고 세분화하는 것은 큰 의미가 없을 수 있다. 그러나 서파수면이 감소하는 중증도가 높은 그룹 내에서는 서파수면이 유지되는 군과 유지되지 않는 군 사이에는 여러 임상적 그리고 수면다원검사상 차이가 있을 수 있다. 이 연구의 목적은 중증 수면무호흡증 환자에서 서파수면이 비교적 유지되는 환자군의 임상 및 수면다원검사상 특성을 분석하는 것이다.
2021년 7월부터 2022년 12월까지 코골이와 수면무호흡증을 주소로 본원 수면센터를 찾아 수면다원검사를 시행한 환자들의 의무기록을 후향적으로 분석하였다. 포함기준으로는 1) 19세 이상의 성인 환자, 2) 수면무호흡증으로 진단된 환자(AHI≥5/h), 제외 기준으로는 1) 총 수면시간이 240분 미만인 경우, 2) 폐쇄성 수면무호흡증과 동반된 기면증(복합수면장애)이 있는 경우, 3) 조절되지 않는 급성 호흡기 질환, 심한 빈혈, 항암치료 중인 경우, 급성 심혈관 질환과 같은 중증 내과적 질환 또는, 외과적 수술 후에 3개월이 지나지 않았거나, 후유증이나 합병증으로 치료를 계속 요하는 자는 제외하였다. 환자들의 수면의 질과 주관적 졸음을 평가하기 위해 Pittsburgh Sleep Quality Index (PSQI)와 Epworth Sleepiness Scale (ESS)을 이용하여 평가하였다. 서파수면의 비율은 본 연구의 평균연령대를 고려하여 전체 수면시간의 15%를 기준으로 하였다[9]. 본 연구는 의학연구윤리심의위원회(IRB No. 2023-01-002)의 심의 및 승인하에 시행되었다.
수면기사가 상주하는 수면검사실에서 Embla N7000 (Natus, Kanata, Canada)을 사용하여 야간 수면다원검사를 시행하였다. 사용된 센서는 뇌파전극(F3, F4, C3, C4, O1, O2), 안구전위도, 턱과 하지 근전도, 심전도, 흉부 및 복부 운동 벨트, 비강 기류, 구강 기류, 맥박 산소측정기 및 신체 위치측정기를 부착하였다. 미국수면의학회(American Academy of Sleep Medicine) 권장 지침에 따라 수면전문의가 결과를 판독하였다. 무호흡은 구강 기류센서를 통해 최소 10초 동안 기류의 최소 90% 이상의 기류 감소로, 저호흡은 비강 기류센서를 통해 최소 10초 동안 기류의 30% 감소와 뇌파상 각성 또는 산소 불포화와 관련하여 3% 이상의 산소포화도 감소로 정의하였다[10].
심박변이도 분석은 Embla N7000에 내장된 분석프로그램으로, 야간 총 수면시간 동안 심전도(electrocardiogram) 신호에서 피크를 검출한 후 R-R interval (RR 또는 NN) 간격을 구하여 자동 산출하였다. 심전도 신호는 250 Hz로 샘플링되었으며, 주파수 영역 지표인 총전력(total power, TP), 초저주파수 대역(very low frequency, VLF), 저주파수 대역(low frequency, LF), 고주파수 대역(high frequency, HF), 그리고 저주파수 대 고주파수 비율(LF/HF ratio)을 분석하였다.
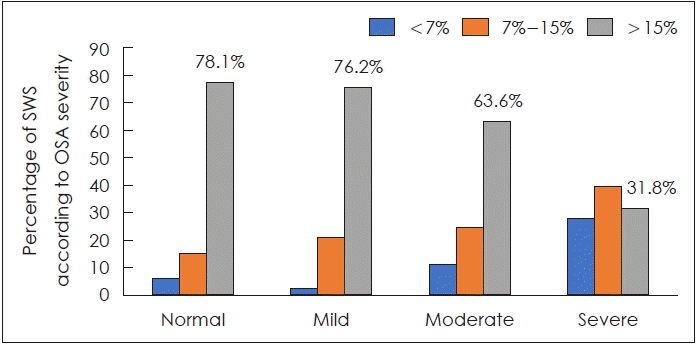
총 203명의 환자가 연구에 등록되었으며 평균연령은 46.3±14.4세이며, 남성 152명, 여성 51명이 포함되었다. 위의 환자를 시간당 AHI 지수에 따라 수면무호흡증 중증도에 따라 분류하였으며, 정상군 32명(15.8%), 경증 42명(20.7%), 중등도 44명(21.7%), 중증 85명(41.9%)으로 구성하였다. 중증도에 따라 서파수면이 15% 이상 유지되는 비율은 정상, 경증, 중등도, 중증에서 각각 78.1%, 76.2%, 63.6%, 31.8%로 나왔다(Fig. 1).
이 중에서 수면무호흡증 중증군을 서파수면비율에 따라 전체 수면시간의 15% 이상을 유지하는 환자 수는 27명(31.8%)으로 ’서파유지군’으로, 서파수면비율이 15% 미만인 경우는 58명(68.2%)으로 중증 ’서파부족군’으로 분류하였다(Table 1). 두 군 간에는 나이, 성별, 과거력, 목 둘레지수, 허리 대 엉덩이 비율, 체질량지수 등에서는 유의한 차이를 보이지 않았다(Table 1). 그러나 수면검사 전 설문지조사 중, 주간졸림증상 ESS 점수에서는 서파부족군이 10.3±4.5, 서파유지군 8.3±3.8로 서파부족군에서 유의하게 높게 나타났으며(p=0.048), 수면의 질 설문지 PSQI에서는 두 군에서 유의한 차이를 보이지 않았다(p=0.129) (Table 1).
수면다원검사상 서파부족군은 서파유지군에 비해 총수면 시간(p=0.027), 수면효율(p=0.017), 렘수면 비율(p=0.014)은 유의하게 낮게 측정되었으며, 입면 후 각성시간(p=0.001), 렘수면 잠복기(p=0.007), N1 얕은수면 비율(p<0.001), 전체 AHI 지수(p=0.001), 무호흡지수 (p=0.008), 비렘수면 AHI 지수(p<0.001), 반듯이 눕지 않은(nonsupine) AHI 지수(p=0.006), 각성지수(p<0.001)에서는 유의하게 높게 측정되었다(Table 2). N2 얕은수면 비율, 저호흡지수, 렘수면 AHI 지수, 앙와위 AHI 지수, 산소불포화 지수(Oxygen Desaturation Index), 평균 산소포화도, 최저산소포화도, 산소포화도 90% 미만 시간, 자발적 각성지수에서는 두 군 간에 유의한 차이를 보이지는 않았다(Table 2).
이번 연구를 통해서 서파수면이 비교적 유지되는 중증 서파유지군의 특성을 알아볼 수 있었다. 첫 번째로, 중증 서파유지군은 전체 AHI 구성요소 중에서 저호흡 비중이 상당한 것으로 나타났다. 무호흡 대 저호흡의 비율을 살펴보면, 중증 서파유지군 1.1±1.8, 중증 서파부족군 2.3±4.5으로 비록 통계적으로는 유의하지는 않았지만 중증 서파유지군에서 저호흡의 비율이 비교적 높은 것으로 나타났다(p=0.186) (Fig. 2). 무호흡은 상기도의 완전폐쇄를 초래하므로 깊은 수면으로 진행을 방해할 수 있는 반면에, 저호흡은 완전폐쇄로까지 진행하지 않아 보다 깊은 수면을 유지할 수 있었던 것이 아닌가 추정해본다. 저호흡의 American Academy of Sleep Medicin 기준으로는 기류가 10초 이상 최소 30% 이상 감소하면서 동시에 혈중 산소포화도 수치가 3% 또는 4% 감소하거나, 뇌파상 각성을 동반할 경우이다[10,11]. 따라서 뇌파상 각성을 동반하지 않고 산소포화도 수치만 감소하는 저호흡일 경우에는 깊은 수면으로의 진행을 덜 방해할 수 있다. 두 번째로 중증 서파유지군은 nonsupine 자세에서 수면관련 호흡장애가 덜 발생하는 것으로 나타났다. 수면 중 nonsupine 자세의 비율은 두 군간에 유의한 차이가 나지 않았으나, nonsupine AHI 지수는 시간당 21.2±22.7로 중증 서파부족군 39.2±25.3보다 유의하게 낮게 나타났다. 이는 중증 서파유지군이 nonsupine 자세에서 해부학적으로 기도유지에 좀 더 유리한 구조를 가질 수 있음을 시사한다. 세 번째로 중증 서파유지군은 주간졸림증상이 중증 서파부족군에 비해 유의하게 낮은 값을 보였다. 첫 번째와 두 번째 특성은 수면다원검사 분석으로 이루어졌으며, 세 번째는 임상증상 분석으로 이루어졌다. 이를 종합하면, 중증 서파유지군은 중증 서파부족군에 비해 전체 AHI 구성요소 중에 저호흡의 비중이 높으며, nonsupine 자세에서 AHI 값이 상당히 줄어들어 수면 중 각성이 덜 발생하고 수면의 구조를 비교적 잘 유지하여 주간졸림증상이 덜한 것으로 추정할 수 있다.
폐쇄성 수면무호흡증은 다양한 발생기전과 임상양상을 갖는 복잡한 수면관련 호흡장애 질환이다[12]. 그러나 최근까지도 폐쇄성 수면무호흡증을 진단 및 관리를 위한 중심 패러다임은 오직 AHI와 같은 수면 중 호흡사건의 수에만 초점이 맞추어져 왔다. 일부 폐쇄성 수면무호흡증 환자에서 임상증상으로 주간졸음증을 호소하기도 하지만, 최소한의 증상만 보이는 경우도 있으며, 불면증을 호소하는 경우도 있다[13,14]. 최근에는 폐쇄성 수면무호흡증의 병태생리학 및 다양한 임상적 표현형(phenotypes)에 대한 개념이 제기되어 더 나은 이해와 개별화된 치료를 위한 모델을 제시하고 있다[15].
이번 연구에서는 야간 심박변이도(HRV)도 수면다원검사와 더불어 진행되었다. 심장박동 간격(RR 간격)을 분석하여 건강한 사람일수록 박동 간 간격의 불규칙성이 커진다는 이론에 근거하며[16], 수면의 단계에 따라 깊은 수면이나 안정적인 수면은 고주파수 대역(HF)과 관련이 있으며, 불안정한 수면은 저주파수 대역(LF) 및 초저주파수 대역(VLF)과 관련 있다고 알려져 있다[17]. 우리 연구에서도 중증 서파부족군에서 중증 서파유지군에 비해 유의하게 초저주파수 대역 값이 높게 나와 불안정한 수면, 즉 수면 중 깨어남이나 각성 비율의 증가를 초저주파수 대역이 반영하고 있음을 알 수 있었다. 17명의 중증 폐쇄성 수면무호흡증 환자 연구에서는, 수면다원검사 후 다음날 bilevel positive airway pressure (BiPAP)로 하루 치료한 결과, 3, 4단계의 깊은 수면의 비율이 치료 전후로 증가하였고, 심박변이지표인 저주파 대역(LF)과 초저주파 대역(VLF) 값을 유의하게 감소시켰다[18]. BiPAP 치료 중 VLF 진폭의 차이는 1단계 수면과 3, 4단계 수면의 백분율 차이와 유의한 상관관계를 보여, VLF는 수면무호흡증 환자의 치료효과를 반영하는 수면구조에 대한 정보를 제공함을 보여주었다[18]. 이전 우리 연구에서 35명의 중증 및 중등도 수면무호흡증 환자를 하룻밤 동안 양압기 적정압력측정 시 VLF와 LF 값이 유의하게 감소함을 보였으며, 특히 VLF 값은 LF 값보다 빠르게 양압기 하루 착용만으로도 정상대조군과 비슷한 정도로 감소함을 보여 비슷한 결과를 보여주었다[19].
수면뇌파 중에서도 1-4 Hz의 느린 델타진동이 한 epoch의 20%를 차지할 때 서파수면이라고 한다. 서파수면은 기억이나 학습과 밀접하게 관련되어 있다고 알려져 있으며[20], 서파수면이 적은 불면증 환자는 연령이 일치하는 대조군에 비해 선언적 기억강화가 감소하는 것으로 나타났다[21]. 수면의 질과 지속 시간은 적절한 인지기능과 전반적인 웰빙에 필수적인 것으로 간주된다[22]. 폐쇄성 수면무호흡증 환자는 수면 단편화와 비정상적인 수면 구조를 특징으로 하여 수면의 질이 좋지 않은 것으로 알려져 있다. 1118명의 단순코골이 환자와 7107명의 폐쇄성 수면무호흡증 환자를 서파수면의 비율에 따라 분류한 후 고혈압 유병률을 비교한 연구에서, 단순코골이가 아닌 폐쇄성 수면무호흡증 환자에서만 서파수면비율이 4.9% 미만일 경우에는 용량의존성으로 고혈압의 위험도를 높이는 것으로 나타났다[23]. 또한, 폐쇄성 수면무호흡증 환자를 중증도에 따라 층화분석한 결과, 중등도와 중증군에서만 서파수면의 비율과 고혈압비율이 유의한 상관관계가 있음을 보여주었다[23]. 우리 연구에서도 대조군과 경증군에서는 15% 이상의 서파수면비율을 갖는 비율이 70%를 상회하고 있으며, 중등도군에서 63.6%, 중증군에서 31.8%로 감소하여, 서파수면이 확연이 감소하는 층화된 구조에서 서파수면의 비율에 따라, 주간졸림증 같은 임상양상이나 고혈압과 같은 합병증의 위험률에 영향을 미치는 것으로 보인다. 폐쇄성 수면무호흡증은 널리 알려진 고혈압의 위험인자이다[22]. 하지만 서파수면의 비율에 따라 특히, 서파수면의 비율이 낮은 수면무호흡증 환자에서 고혈압의 위험도가 더 높게 나와 서파수면이 고혈압과 수면무호흡증 사이의 매개변수로 작동할 수 있음을 보여주었다[23].
이번 연구의 한계점으로는 후향적 설계와 모집인구가 비교적 크지 않다는 점이다. 또한 수면다원검사 1회만으로는 서파수면비율을 확정하기에는 논란이 있을 수 있다. 수면다원 검사 전날 수면박탈이나 피로함 등이 영향을 미칠수도 있기 때문이다. 이는 추후 대규모 연구설계나 전향적 설계 등으로 극복해야 할 점으로 생각한다.
이번 연구를 통해서, AHI 지수에 따른 중증 수면무호흡증 그룹 내에서도 서파수면의 비율에 따라 수면다원검사의 무호흡 대 저호흡 비율이나 nonsupine 자세에서 AHI와 같은 지표들에서 차이가 발생할 수 있음을 알았으며, 주간졸림증상같은 임상양상에도 영향을 미칠 수 있어, 중증 수면무호흡증 환자에서 서파수면의 비율은 유용한 수면매개변수가 될 수 있을 것으로 사료된다.
REFERENCES
1. Bristow JD, Honour AJ, Pickering TG, Sleight P. Cardiovascular and respiratory changes during sleep in normal and hypertensive subjects. Cardiovasc Res. 1969; 3(4):476–85.

2. Partinen M, Jamieson A, Guilleminault C. Long-term outcome for obstructive sleep apnea syndrome patients: Mortality. Chest. 1988; 94(6):1200–4.
3. Stansbury RC, Strollo PJ. Clinical manifestations of sleep apnea. J Thorac Dis. 2015; 7(9):E298–310.
4. Rey de Castro J, Huamaní C, Escobar-Córdoba F, Liendo C. Clinical factors associated with extreme sleep apnoea [AHI>100 events per hour] in Peruvian patients: A case-control study-a preliminary report. Sleep Sci. 2015; 8(1):31–5.

5. Hamaoka T, Murai H, Takata S, Hirai T, Sugimoto H, Mukai Y, et al. Different prognosis between severe and very severe obstructive sleep apnea patients; five year outcomes. J Cardiol. 2020; 76(6):573–9.

6. Spiegel R, Köberle S, Allen SR. Significance of slow wave sleep: Considerations from a clinical viewpoint. Sleep. 1986; 9(1):66–79.
7. Raison CL, Rye DB, Woolwine BJ, Vogt GJ, Bautista BM, Spivey JR, et al. Chronic interferon-alpha administration disrupts sleep continuity and depth in patients with hepatitis C: Association with fatigue, motor slowing, and increased evening cortisol. Biol Psychiatry. 2010; 68(10):942–9.

8. Redline S, Kirchner HL, Quan SF, Gottlieb DJ, Kapur V, Newman A. The effects of age, sex, ethnicity, and sleep-disordered breathing on sleep architecture. Arch Intern Med. 2004; 164(4):406–18.

9. Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Metaanalysis of quantitative sleep parameters from childhood to old age in healthy individuals: Developing normative sleep values across the human lifespan. Sleep. 2004; 27(7):1255–73.

10. Berry RB, Budhiraja R, Gottlieb DJ, Gozal D, Iber C, Kapur VK, et al. Rules for scoring respiratory events in sleep: Update of the 2007 AASM manual for the scoring of sleep and associated events. Deliberations of the sleep apnea definitions task force of the American Academy of Sleep Medicine. J Clin Sleep Med. 2012; 8(5):597–619.
11. Berry RB, Abreu AR, Krishnan V, Quan SF, Strollo PJ, Malhotra RK. A transition to the American Academy of Sleep Medicinerecommended hypopnea definition in adults: Initiatives of the hypopnea scoring rule task sorce. J Clin Sleep Med. 2022; 18(5):1419–25.
12. Ayas NT, Owens RL, Kheirandish-Gozal L. Update in sleep medicine 2014. Am J Respir Crit Care Med. 2015; 192(4):415–20.

13. Ye L, Pien GW, Ratcliffe SJ, Björnsdottir E, Arnardottir ES, Pack AI, et al. The different clinical faces of obstructive sleep apnoea: A cluster analysis. Eur Respir J. 2014; 44(6):1600–7.

14. Antonaglia C, Passuti G. Obstructive sleep apnea syndrome in non-obese patients. Sleep Breath. 2022; 26(2):513–8.

15. Zinchuk AV, Gentry MJ, Concato J, Yaggi HK. Phenotypes in obstructive sleep apnea: A definition, examples and evolution of approaches. Sleep Med Rev. 2017; 35:113–123.

17. Thomas R J, Mietus JE, Peng CK, Goldberger AL. A n electrocardiogram-based technique to assess cardiopulmonary coupling during sleep. Sleep. 2005; 28(9):1151–61.
18. Noda A, Hayano J, Ito N, Miyata S, Yasuma F, Yasuda Y. Very low frequency component of heart rate variability as a marker for therapeutic efficacy in patients with obstructive sleep apnea: Preliminary study. J Res Med Sci. 2019; 24:84.

19. Kim MW, Choi MS. Analysis of heart rate and heart rate variability immediately after continuous positive airway pressure titration in patients with moderate to severe obstructive sleep apnea. Korean J Otorhinolaryngol-Head Neck Surg. 2022; 65(10):594–601.
20. Walker MP. The role of slow wave sleep in memory processing. J Clin Sleep Med. 2009; 5(2 Suppl):S20–6.

21. Backhaus J, Junghanns K, Born J, Hohaus K, Faasch F, Hohagen F. Impaired declarative memory consolidation during sleep in patients with primary insomnia: Influence of sleep architecture and nocturnal cortisol release. Biol Psychiatry. 2006; 60(12):1324–30.

Fig. 2.
Apnea to hypopnea ratio between slow wave sleep (SWS) maintained group and SWS reduced group in patients with severe obstructive sleep apnea.
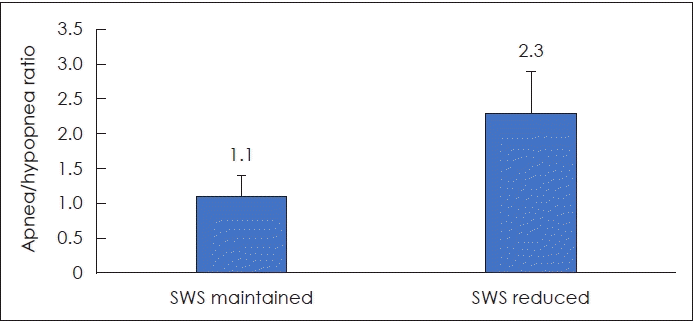
Table 1.
Comparison of demographics between SWS maintained group and SWS reduced group in patients with severe OSA
| SWS maintained (n=27) | SWS reduced (n=58) | p-value | |
|---|---|---|---|
| Age (year) | 45.9±15.7 | 49.9±11.7 | 0.243 |
| Male:female | 22:5 | 50:8 | 0.747 |
| HTN | 12 (46.2) | 16 (29.1) | 0.132 |
| DM | 7 (26.9) | 15 (27.3) | 0.974 |
| CVD | 0 (0) | 2 (3.6) | > 0.999 |
| Heart diseases | 3 (11.5) | 2 (4.9) | 0.369 |
| Insomnia | 1 (3.8) | 5 (9.1) | 0.658 |
| PSQI | 10.6±6.3 | 13.1±7.0 | 0.129 |
| ESS | 8.3±3.8 | 10.3±4.5 | 0.048* |
| STOP-BANG | 4.9±1.0 | 4.8±1.1 | 0.797 |
| Neck circumference (cm) | 41.6±3.4 | 41.0±3.8 | 0.482 |
| BMI (kg/m2) | 31.1±7.0 | 29.0±5.6 | 0.143 |
Table 2.
Comparison of polysomnographic findings between SWS maintained group and SWS reduced group in patients with severe OSA
| SWS maintained | SWS reduced | p-value | |
|---|---|---|---|
| TST (min) | 337.5±38.3 | 313.9±56.6 | 0.027* |
| Sleep efficiency (%) | 82.7±12.0 | 85.1±14.9 | 0.017* |
| WASO (min) | 39.9±29.7 | 67.6±45.0 | 0.001† |
| R_latency (min) | 113.6±54.1 | 155.6±69.7 | 0.007* |
| N1 (%) | 6.6±3.9 | 14.6±9.2 | <0.001† |
| N2 (%) | 43.8±7.1 | 47.3±11.5 | 0.085 |
| N3 (%) | 22.9±5.7 | 7.5±4.9 | <0.001† |
| R (%) | 16.4±6.6 | 12.7±6.1 | 0.014* |
| AHI_total | 41.8±10.7 | 55.5±24.4 | 0.001† |
| Apnea index | 13.9±13.8 | 24.7±21.9 | 0.008† |
| Hypopnea index | 27.7±11.9 | 29.1±20.8 | 0.739 |
| Rem_AHI | 43.9±19.8 | 46.8±20.6 | 0.544 |
| Nrem_AHI | 41.0±11.9 | 56.1±26.2 | <0.001† |
| Supine_AHI | 54.8±15.8 | 64.2±25.3 | 0.082 |
| Nonsupine_AHI | 21.2±22.7 | 39.2±25.3 | 0.006† |
| Supine percentage | 65.7±25.2 | 64.9±25.6 | 0.892 |
| Nonsupine percentage | 34.2±25.3 | 35.1±25.6 | 0.885 |
| SaO2_mean (%) | 91.9±1.7 | 90.9±4.9 | 0.154 |
| SaO2_nadir (%) | 74.6±6.6 | 73.6±10.8 | 0.592 |
| AI | 38.2±11.8 | 55.9±28.1 | <0.001† |
| Resp AI | 25.0±8.9 | 42.7±26.9 | <0.001† |
| Spont AI | 12.6±7.5 | 11.9±11.8 | 0.720 |
Table 3.
Comparison of heart rate variability between SWS maintained group and SWS reduced group in patients with severe OSA
| Parameters (unit) | SWS maintained | SWS reduced | p-value |
|---|---|---|---|
| TP (ms2) | 75002.9±133107.3 | 88468.8±147464.7 | 0.687 |
| VLF (ms2) | 26887.9±17192.0 | 38813.9±37064.9 | 0.046* |
| LF (ms2) | 16943.4±13607.2 | 22027.7±16387.8 | 0.165 |
| HF (ms2) | 6872.3±3031.2 | 6510.4±3102.4 | 0.615 |
| LF/HF | 2.9±2.4 | 4.3±6.0 | 0.240 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download