Abstract
A young child’s larynx was formerly believed to be narrowest at the cricoid level, circular in section, and funnel shaped. This supported the routine use of uncuffed endotracheal tubes in young children despite the benefits of cuffed tubes, such as lower risk for air leakage and aspiration. In the late 1990s, evidence supporting the pediatric use of cuffed tubes emerged largely from anesthesiology studies, while some technical flaws of the tubes remained a concern. Since the 2000s, imaging-based studies have clarified laryngeal anatomy, revealing that it is narrowest at the glottis, elliptical in section, and cylindrical in shape. The update was contemporaneous with technical advances in the design, size, and material of cuffed tubes. The American Heart Association currently recommends the pediatric use of cuffed tubes. In this review, we present the rationale for using cuffed tubes in young children based on our updated knowledge of pediatric anatomy and technical advances.
최근까지 8세 미만 소아(어린 소아)의 후두는 해부학적으로 반지연골 높이에서 가장 좁고 단면이 원형이며 전체적으로 깔때기 모양이라고 알려졌다. 또한, 기낭(氣囊, cuff) 없는 기관내관(uncuffed endotracheal tube, UETT)이 기도압 20 cmH2O에서 관 주위로 공기가 약간 누출되더라도 반지연골 안쪽에 딱 들어맞는다고 믿었다(Fig. 1A). 반면, 기낭 있는 기관내관(cuffed endotracheal tube, CETT)을 삽입하면 기낭이 반지연골 안쪽 점막에 압력을 가한다고 여겼다(Fig. 1B). 이 압력은 발관 후 협착음을 유발하고 잠재적으로 성문밑협착증을 초래한다고 생각하여, 어린 소아의 기관내삽관에 UETT를 사용하는 것이 일반적이었다1-3).
2003년 이후, 영상 연구를 통해 소아 후두가 성인과 마찬가지로 성문에서 가장 좁고 단면이 타원형이며 전체적으로 원통 모양이라는 점이 밝혀졌다. 1990년대 후반부터 마취통증의학과에서 UETT보다 CETT를 선호하게 됐고, 이 변화는 상기 최신 지견이 나온 시점에도 이어졌다(Fig. 1). 이 변화의 초반 흐름을 뒷받침한 것은 최근 밝혀진 CETT의 이점이다(Table 1)1,2,4-7). 대표적으로, CETT는 기낭 부피를 조절함으로써 기도를 밀봉하여 기관내관 교체 빈도를 줄일 수 있다. 나아가, 고용적-저압력(high volume-low pressure) 폴리우레탄 재질 기낭과 같은 최신 기술이 변화를 가속화했다8). 현재, 미국심장협회(American Heart Association, AHA) 및 유럽소생협회(European Resuscitation Council, ERC)는 어린 소아에게 CETT를 사용하도록 권고한다9,10).
PubMed 및 Scopus에서 세 중심단어(“intubation”, “cuffed”, “child”)를 모두 만족하면서 1997-2022년에 출판된 영문 문헌을 검색한 결과 중에서 CETT의 소아 적용에 관한 체계적문헌연구, 종설, 원저, 사설을 우선 채택했다. 응급실 기반 연구 부족으로 인해 마취과학 논문이 다수 포함됐다. 어린 소아에서 CETT의 이점 또는 후두 해부학 최신 지견과 관련이 적은 문헌은 제외했다. 후두 해부학 최신 지견에 관한 논문, 기타 논문, 교과서, 지침을 추가로 검색했다. 결과적으로 총 66편의 문헌이 포함됐는데(Appendix 1, https://doi.org/10.22470/pemj.2023.00675), 구체적으로 체계적문헌연구 3편, 지침 2편, 교과서 4종, 종설 13편, 무작위대조시험 7편, 실험연구 12편, 관찰연구 14편, 설문연구 4편, 사설 5편, 서신 1편, 증례보고 1편이다.
소아 후두가 반지연골-원형-깔때기 모양이라는 다수설을 진료에 적용한 전통적 근거는 1897년에 발표된 소아(4개월-14세) 15명을 부검한 결과 영아 후두에서 가장 좁은 부위가 반지연골로 밝혀진 사실이다14,15). 시체의 후두는 죽은 조직이 이완되는 성질에다가 후두 속을 밀랍 또는 석고로 채우는 연구 방법으로 인해, 생존 시보다 쉽게 늘어난다. 이 때문에, 전술한 부검에서 성문의 크기가 반지연골(둘레가 고정)의 크기보다 과대평가 됐을 것이다.
한편, 소아 86-401명에게 시행된 일련의 영상 연구를 통해, 후두 형태가 반지연골-원형-깔때기가 아니라 성문-타원-원통임이 밝혀졌다(Table 2)16-20). Litman 등16)은 자기공명영상에서 후두를 실측함으로써, 반지연골-원형-깔때기 설을 최초로 반박했다. 이 연구에 따르면, 가로 지름이 앞뒤 지름보다 짧고(타원) 꼬리 쪽으로 갈수록 길어졌으며, 모든 높이에서 지름-나이가 선형 연관을 보였다. 요컨대, 후두에서 가장 좁은 부위는 성문이고, 모양이 깔때기에서 원통으로 바뀌는 것이 아니라 원통 모양을 유지한 채 나이에 비례하여 후두가 성장한다. Litman 등16)의 연구의 의의는 나중에 일반방사선영상, 컴퓨터단층촬영, 기관지내시경을 통해서도 확인됐다17-20). 특히, 단층촬영에서 후두의 단면이 머리 쪽으로 갈수록 더 뚜렷한 타원이라는 점이 입증됐다(Fig. 2)18-20).
Holzki 등21,22)은 해부학 최신 지견을 반박하며, 반지연골 안쪽이 내시경으로 확인된 기도손상에 가장 취약하다고 주장했다. 구체적으로 성대가 열리면 성문 지름이 커지므로, 고정된 반지연골이 후두에서 기능적으로 가장 좁은(functionally narrowest) 부위라는 것이다. 하지만 이 주장은 다음 근거로 반박할 수 있다. 첫째, 부검에서 성문이 가장 좁다21,23). 둘째, 성문밑(subglottis)은 성문(바로 위)보다 덜 늘어나면서도(반지연골처럼), 반지연골(바로 아래)보다 단면적이 좁고 부피가 작다20,24). 셋째, 손상은 대개 성문-성문밑의 뒤가쪽에 발생하고, 반지연골 부위는 상대적으로 덜 손상된다25-28). 넷째, 탄력원뿔(conus elasticus)은 성대 아래쪽 경계에서 반지연골 위쪽 경계까지 느슨하게 부착된 연조직으로, 삽관 또는 크루프에 의해 쉽게 붓는다20,28,29). 성문밑이 기도폐쇄에 취약한 것은 이 때문이다. 다섯째, 빛간섭단층촬영에서 삽관 기간과 기도 벽의 두께가 성문-성문밑에서는 상관관계가 있지만, 상부 기관에서는 그렇지 않았다27). 그러므로, 성문과 성문밑 사이의 어느 지점이 후두에서 기능적으로 가장 좁은 부위라고 추론할 수 있다.
요약하면, 어린 소아의 후두는 성인 후두의 축소판이고 성문 또는 성문밑이 손상에 가장 취약하다. 이 최신 지견은 어린 소아에서 UETT를 사용하는 오랜 관행을 논리적으로 반박한다.
CETT의 이점으로 기낭 주위를 통한 공기 누출 및 흡인 위험이 적다는 점은 잘 알려졌고, 이 때문에 연장아 및 성인 삽관에서 선호된다(Table 1)1,2). 반면 어린 소아에서는 주로 UETT가 쓰였고, CETT는 폐 유순도가 감소한 경우에 국한하여 드물게 쓰였다30). 오랫동안 UETT를 사용한 관행의 단적인 예로, 1999년 프랑스 마취과 의사 대상으로 시행한 설문에서 응답자의 25.4%만 CETT를 소아 삽관 중 80% 이상 사용한다고 답했다31). 당시 응급실에서는 사용 빈도가 이보다 낮았을 것이다. 후두 형태를 잘못 이해한 데에서 나온 다음 두 가지 믿음이 UETT를 선호하는 경향에 영향을 미쳤다.
이 믿음은 후두의 단면이 타원이라는 최신 지견 및 기도손상 발생률이 예상과 달리 CETT에서 더 낮다는 사실로 인해 설득력을 잃었다.
믿음1과 달리, 딱 맞는 UETT는 뒤가쪽 점막을 압박하여 허혈을 초래하고, 기관내관 앞쪽 공간을 통해 공기가 누출된다(Fig. 1C)32). 이 압박을 줄이려면 관이 딱 맞는 치수보다 작아야 한다32). 이 문제는 UETT보다 안쪽 지름이 0.5 mm 작은 CETT를 사용함으로써 해결할 수 있다(Fig. 1D; Appendix 2, https://doi.org/10.22470/pemj.2023.00675). CETT가 적절하게 삽입되면, 관의 몸통(shaft)은 성문-성문밑 점막에, 기낭은 기관 점막에 각각 접촉하게 된다. 따라서, 몸통이 가늘면 후두에 가하는 압박도 줄어든다.
믿음2와 달리, 크루프의 증상(예: 협착음)이 CETT 및 UETT에서 비슷하게 발생한다(CETT, 2.4%-4.4% 대 UETT, 3.0%-4.7%)33,34). 기도손상은 기낭 자체가 아닌, 삽관 기간, 기관내관 치수, 삽관 관련 외상, 기낭 내 압력(intracuff pressure, Pcuff), 잘못된 설계 또는 치수가 안 맞는 관, 관의 움직임, 저체중 출생, 감염, 쇼크와 연관된다5,11,30,35). 인두통이 UETT 삽관 후 더 흔한 점(CETT, 7.7%-19.4% 대 UETT, 32.4%-36.6%)을 통해, UETT가 CETT보다 경증 손상을 잘 유발함을 알 수 있다36-38). 인두통 빈도의 차이는 뒤가쪽 압박과 잦은 관 교체, 추가로 관 끝이 기관 벽에 접촉하는 것과 관련된 듯하다(Fig. 1C)2,34,39,40). 이 손상은 환기 중 관 끝이 움직이면 악화한다35,39,40). 반면, CETT의 기낭은 관 끝과 기관 벽을 서로 떨어뜨린다(Fig. 1D)32-34,39,40).
기타 CETT의 이점은 다음과 같다(Fig. 1D). 마취된 환자 488명(≤ 8세) 및 2,246명(≤ 5세) 대상의 무작위대조시험 2건에서 UETT의 기관내관 교체 빈도가 더 높았다(CETT, 1.2%-2.1% 대 UETT, 22.8%-30.8%)33,34). 게다가, CETT가 교체 필요성이 떨어지는 사실은 상대위험도 0.17(95% 신뢰구간, 0.07-0.41)로 입증된다4). 이는 기도압, 진정, 근긴장도 또는 환자 자세에 따라 기관 지름이 달라져도, 기낭 부피를 조절함으로써 밀봉할 수 있기 때문이다30,40). 이 조절 기능은 UETT의 지름이 고정된 점과 대조를 이룬다.
기낭에 의한 기관 손상을 예방하려면 Pcuff을 20-25 cmH2O 미만으로 제한해야 하는데, 이는 기관 점막의 모세혈관 관류압이 20 cmH2O로 추정되기 때문이다9,41). 이론적으로 기관의 후방 팽창성이 손상을 예방할 수 있다(Fig. 1D). Krishna 등42)에 따르면, 둘레가 고정된 지름 10 mm의 기관 모형에서 안쪽 지름 5.0, 4.5, 4.0 mm의 CETT를 삽입했을 때 평균 Pcuff이 각각 14, 23, 45 cmH2O였다(31 cmH2O 증가). 반면, 4-8세 소아의 기관에 안쪽 지름 5.0, 4.5, 4.0 mm의 CETT를 삽입했을 때 평균 Pcuff은 각각 27, 25, 31 cmH2O였다(4 cmH2O 증가)42). 이처럼 생체 내에서 Pcuff가 작은 폭으로 증가한 사실은 기관의 후방 팽창성이 Pcuff 상승을 완충함을 시사한다.
전술한 이점에도 불구하고, CETT는 2000년대 초반까지 설계, 치수, 재료 면에서 결함이 있었다. CETT는 기낭이 후두에 위치하거나 기관내관 끝이 기관지 내에 위치하는 것에 대한 안전마진(margin of safety)은 UETT의 22%-52%로 추정된다43). 즉 기낭으로 인해 관이 너무 얕거나 깊게 삽입되기 쉽다. 2002년 당시 구할 수 있던 CETT 11종 중, 3.0-5.0 mm 관은 모두 관 끝이 기관 중앙에 위치한 상태에서 기낭이 후두에 위치했다44). 이처럼 기낭이 너무 높게 삽입되는 것은 기낭이 위아래로 길쭉한 모양이라는 점 또는 기낭 원위부에 위치한 Murphy eye와 관련된다(Fig. 1B). 상기 11종 중 5종만이 깊이 표시가 있어, 이 표시를 성문에 맞춤으로써 기낭을 반지연골 아래에 위치시킬 수 있었다. 3.0 mm 관의 깊이 표시를 성문에 맞추면, 5종 중 3종의 관 끝이 기관 용골에 닿았다44). 깊이 표시가 지나치게 높게 설정된 것이다. 1900년대까지는 5.0 mm 미만의 CETT를 구하기 어려웠다40).
높은 Pcuff과 기도손상의 연관으로 인해, 1990년대 중반부터 고용적-저압력 기낭이 기존의 고압력 기낭을 대체하는 추세이다36). 이에 맞물려, Pcuff을 낮게 유지하면서 기낭을 얼마나 부풀려야 하는지에 관한 관심이 늘어났다. Pcuff이 20 cmH2O일 때, 기낭 단면적(또는 지름)이 같은 나이에서 가장 큰 기관 단면적(또는 지름)의 120%-150%가 돼야 하고1,45), 충분히 부피가 커지면 기낭 표면이 기관 벽에 커튼 드리우듯 닿으며 밀봉할 수 있다46). 하지만 2002년에는 대부분의 기낭이 단면적 조건을 충족하지 못했고44), 3.0-4.5 mm 및 5.0-7.0 mm CETT의 기낭 단면적이 기관 단면적의 71.4%-141.6% 및 114.5%-301.0%에 불과했다44). 즉 기낭이 5세 미만(3.0-4.5 mm)에게는 작고 5세 이상(5.0-7.0 mm)에게는 컸다(Appendix 2의 Duracher 공식). 폴리염화비닐 재질의 기낭은 기관 벽과의 접촉면에 주름(fold) 및 통로(channel)를 형성하여 공기 누출 또는 기도손상을 초래할 수 있다1). 어떤 3.5-6.0 mm 폴리염화비닐 CETT (Mallinckrodt HiLo™; Mallinckrodt Medical, Athlone, Ireland)는 Pcuff의 중앙값이 23 cmH2O (최댓값 120 cmH2O)였고, Pcuff이 20 cmH2O 미만인 환자는 40.8%에 불과했다47).
폴리우레탄이 고용적-저압력 기낭의 재질로 대두했다(기존의 폴리염화비닐도 여전히 쓰임). 설계, 치수, 재료 면에서 진보를 대표하는 예는 2004년 출시된 폴리우레탄 재질의 CETT인 Microcuff™ (Microcuff GmbH, Weinheim, Germany)이다. 이 제품의 특징은 기낭이 짧고 원통형이고 원위부에 위치하고, 기낭 두께가 10 µm이고(폴리염화비닐, 50-80 µm), Murphy eye가 없고, 깊이 표시가 적절하며, 3.0-7.0 mm 중 치수를 고를 수 있다는 점이다(3.0 kg 이상에 사용)1,8,48,49). 이러한 특징으로 인해, 폴리우레탄 기낭으로 기관을 밀봉할 때 평균 Pcuff이 9.7 cmH2O, 너무 큰 치수를 선택한 빈도가 1.6%, 협착음 발생 빈도가 1.8%라는 사실이 가능해졌다8).
기낭의 재료로서, 폴리우레탄은 고용적-저압력 기낭의 120%-150% 조건을 충족하고 Pcuff을 낮게 유지하는 면에서 폴리염화비닐보다 우수하다. Fischer 등50)은 3.0-7.0 mm CETT를 대상으로, 폴리우레탄 기낭 2종(Microcuff™과 Parker ThinCuff PTCL™) 및 폴리염화비닐 기낭 3종의 같은 나이에서 가장 큰 기관을 밀봉하는 정도를 비교했다(Pcuff 20 cmH2O). 그 결과, 폴리우레탄 및 폴리염화비닐 기낭의 지름은 각각 기관 지름의 110%-129% 및 68%-157%였다. 3.0-4.5 mm CETT의 폴리염화비닐 기낭이 밀봉하는 정도가 불충분한 것(68%-114%)은 의미심장하다. 2-4세 환자 80명에서 4.0 mm CETT 중 폴리우레탄 기낭 1종(Microcuff™)과 PVC 기낭 3종을 비교했더니, 전자에서는 Pcuff의 중앙값이 11 cmH2O, 후자에서는 21-36 cmH2O였다51). 폴리염화비닐 기낭과 비교하여 폴리우레탄 기낭의 지름은 실측치와 제조사가 제공한 수치의 차이가 작고 더 대칭적으로 팽창한다50). 또한, 폴리우레탄 기낭의 두께가 매우 얇아 주름 및 통로를 덜 만들고, 공기 누출 및 흡인도 적다49,52). CETT의 이점 및 해부학 최신 지견과 마찬가지로, 기술 발전은 어린 소아에게 CETT를 사용하도록 촉진하고 있다.
CETT는 마취 분야에서 선호된다. 마취과 의사 대상 설문에서 네덜란드 응답자의 70%-90% 및 영국 응답자의 50%-80%가 1개월-8세 환자에게 삽관할 때 CETT를 선호한다고 답했다53). 같은 상황에 관한 소아마취과학회(Society for Pediatric Anesthesia, SPA) 회원(88%가 미국인) 대상 설문에서는, 응답자의 74%-85%가 CETT를 50% 이상 쓴다고 답했다54). 이러한 결과는 전술한 1999년에 시행된 설문에서 보고한 25.4%와 대조된다31). 2019년 현재, 미국 메릴랜드의 한 대학병원은 수술실에서 UETT를 더 이상 사용하지 않기로 했다55).
현재 지침은 해부학 최신 지견 및 기술 발전과 발맞추어, 응급실에서 소아에게 CETT를 사용하도록 장려하고 있다. 2020년 AHA 지침에서 CETT 사용을 권고하는 것은 CETT 사용이 수술실에서 응급실로 확산하도록 촉진한다9). 2021년 ERC 지침도 “작은” 영아를 제외한 소아에게 CETT를 사용하도록 권고한다10). 최신 응급의학 교과서도 CETT를 권고하거나 그 이점을 강조하지만, 주요 소아과학 교과서에는 아직 관련 내용이 불충분하다(Appendix 3)56-59).
예정된 마취 시 시행하는 삽관과 달리, 응급 삽관은 시술의 긴급성, 금식이 보장되지 않는 점, 잦은 응급 기도 상황, 짧은 유도 시간, 긴 삽관 기간, 시술자의 숙련도 편차가 큰 점이 특징이다.
응급실에서 중증 환자의 상태를 안정시키려면, 한 번에 삽관에 성공하고 양압환기를 해야 한다. CETT는 기낭 크기를 조절할 수 있으므로 관 교체가 덜 필요하다. 설령 최적의 치수보다 작은 CETT를 삽입하여 Pcuff 20 cmH2O에서 공기가 지나치게 누출되더라도, 일시적으로 기낭을 과팽창시키고 높은 Pcuff을 허용하거나, 반대로 기낭 주위 누출을 어느 정도 허용하면서, 양압환기를 촉진할 수 있다12). 일시적으로 높은 Pcuff 또는 지나친 누출은 환자 상태 안정 후 더 큰 관으로 교체하면 해결할 수 있다. UETT보다 지름이 0.5 mm 작은 CETT는 불가피하게 기도저항이 빠르게 증가할 수 있는데42), 이 문제는 압력조절환기 또는 압력보조환기(자발환기가 가능하다면)를 적용하면 어느 정도 해결할 수 있다6). UETT는 CETT보다 자주 교체해야 하는 점을 상기해야 한다. 지나치게 작은 관을 삽입하면, UETT는 공기 누출 또는 흡인이 더 쉽게, 그것도 허용하기 어려운 정도로 발생하고, 이는 부정확한 일회호흡량 또는 환기기 연관 폐렴으로 이어진다7,37).
첫째, 기낭 압력계를 이용하여, Pcuff이 20-25 cmH2O 미만으로 유지되는지 감시해야 한다(Table 1). 이 방법으로 협착음 빈도를 21.8%에서 9.9%로 줄일 수 있지만60), 현실적으로 압력계를 응급실에 구비하기 어렵다. 차선책으로 기낭 주위로 공기 누출음이 안 들릴 때까지 천천히 팽창시킬 수 있지만, 이 방법은 신뢰하기 어렵다56). 손가락으로 기낭을 만져서 Pcuff을 예측하면 Pcuff이 전술한 방법보다도 더 높아진다61). 압력계를 사용하기 어렵다면 임시방편으로 1 mL 주사기로 공기 0.5 mL (최대 1 mL)를 누출음이 안 들릴 때까지 천천히 주입할 수 있다. 이 방편은 다음 근거로 뒷받침된다. 우선, 기관 모형에 삽입된 3.0 mm Microcuff™ 관의 Pcuff이 20 cmH2O까지 상승하는 데에는 공기 0.6 mL가 필요하다62). 또한, 환자 44명(나이 중앙값 3세)에서 공기량의 중앙값 0.9 mL와 Pcuff의 중앙값 12 cmH2O 사이의 연관이 확인됐다63).
둘째, 치수가 작은 CETT (예: < 5.0 mm)를 사용할 때, 기낭을 부풀리고 치수를 예측하는 과정에서 더 신중을 기하고 가급적 폴리우레탄 기낭을 선택해야 한다. 이 과정에 공식을 사용한다면, Duracher 공식이 Khine 공식보다 좋다(Appendix 2)62). 3.0 kg 이상 환자에서 UETT보다 본질적으로 작은 CETT를 사용하다 보면, 의도치 않게 너무 작은 기관내관을 삽입할 수 있고 이에 따라 불가피하게 기도 저항 및 Pcuff이 상승할 수 있다. 이 현상은 충분히 발생할 수 있는데, CETT 안쪽 지름이 0.5 mm 감소하면 평균 Pcuff이 더 높아지고(Khine 공식 예측치, 25 cmH2O 대 Khine 공식 예측치보다 0.5 mm 작은 관, 37 cmH2O)42), Duracher 공식으로 예측할 때보다 Khine 공식으로 예측할 때 협착음, 쉰소리, 인두통의 빈도가 더 높기 때문이다62). 너무 작은 관을 삽입하면, 점액마개로 관이 막히거나 기관지내시경을 위해 더 큰 관으로 교체해야 할 수 있다.
ACKNOWLEDGMENTS
본 저자는 Western Journal of Emergency Medicine: Integrating Emergency Care with Population Health에 게재된 종설(West J Emerg Med 2023;24:579-587 [https://doi.org/10.5811/westjem.59560])의 전문(全文) 한글판 이차출판을 허가한 Mark I. Langdorf 편집위원장님께 지면을 빌어 심심한 감사를 표한다. 또한, 그림 작업에 노고를 아끼지 않은 아주대학교 의과대학 의학문헌정보운영팀 메디컬 일러스트레이터 조우현 선생님께도 감사를 표한다.
References
1. Weiss M, Dullenkopf A. Cuffed tracheal tubes in children: past, present and future. Expert Rev Med Devices. 2007; 4:73–82.

2. Tobias JD. Pediatric airway anatomy may not be what we thought: implications for clinical practice and the use of cuffed endotracheal tubes. Paediatr Anaesth. 2015; 25:9–19.

3. De Orange FA, Andrade RG, Lemos A, Borges PS, Figueiroa JN, Kovatsis PG. Cuffed versus uncuffed endotracheal tubes for general anaesthesia in children aged eight years and under. Cochrane Database Syst Rev. 2017; 11:CD011954.

4. Shah A, Carlisle JB. Cuffed tracheal tubes: guilty now proven innocent. Anaesthesia. 2019; 74:1186–90.

6. Thomas J, Weiss M, Cannizzaro V, Both CP, Schmidt AR. Work of breathing for cuffed and uncuffed pediatric endotracheal tubes in an in vitro lung model setting. Paediatr Anaesth. 2018; 28:780–7.
7. Miller MA, Arndt JL, Konkle MA, Chenoweth CE, Iwashyna TJ, Flaherty KR, et al. A polyurethane cuffed endotracheal tube is associated with decreased rates of ventilator-associated pneumonia. J Crit Care. 2011; 26:280–6.

8. Dullenkopf A, Gerber AC, Weiss M. Fit and seal characteristics of a new paediatric tracheal tube with high volume-low pressure polyurethane cuff. Acta Anaesthesiol Scand. 2005; 49:232–7.

9. Topjian AA, Raymond TT, Atkins D, Chan M, Duff JP, Joyner BL Jr, et al. Part 4: Pediatric Basic And Advanced Life Support: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2020; 142(16 Suppl 2):S469–523.

10. Van de Voorde P, Turner NM, Djakow J, de Lucas N, Martinez-Mejias A, Biarent D, et al. European Resuscitation Council Guidelines 2021: Paediatric Life Support. Resuscitation. 2021; 161:327–87.

11. Klabusayova E, Klucka J, Kratochvil M, Musilova T, Vafek V, Skrisovska T, et al. Airway management in pediatric patients: cuff-solved problem? Children (Basel). 2022; 9:1490.

12. Clements RS, Steel AG, Bates AT, Mackenzie R. Cuffed endotracheal tube use in paediatric prehospital intubation: challenging the doctrine? Emerg Med J. 2007; 24:57–8.

13. Miller KA, Nagler J. Advances in emergent airway management in pediatrics. Emerg Med Clin North Am. 2019; 37:473–91.

14. Bayeux R. Laryngeal intubation in croup [Tubage du larynx dans le croup]. Presse Medicale. 1897; 6:29–33.
15. Eckenhoff JE. Some anatomic considerations of the infant larynx influencing endotracheal anesthesia. Anesthesiology. 1951; 12:401–10.

16. Litman RS, Weissend EE, Shibata D, Westesson PL. Developmental changes of laryngeal dimensions in unparalyzed, sedated children. Anesthesiology. 2003; 98:41–5.

17. Dalal PG, Murray D, Messner AH, Feng A, McAllister J, Molter D. Pediatric laryngeal dimensions: an age-based analysis. Anesth Analg. 2009; 108:1475–9.

18. Wani TM, Bissonnette B, Rafiq Malik M, Hayes D Jr, Ramesh AS, Al Sohaibani M, et al. Age-based analysis of pediatric upper airway dimensions using computed tomography imaging. Pediatr Pulmonol. 2016; 51:267–71.

19. Mizuguchi S, Motomura Y, Maki J, Baba R, Ichimiya Y, Tokuda K, et al. Tracheal size and morphology on the reconstructed CT imaging. Pediatr Crit Care Med. 2019; 20:e366–71.

20. Kim Y, Park JE, Kim JH. Plain radiographic analysis of laryngeal dimensions in young children: normal versus croup. Children (Basel). 2022; 9:1532.

21. Holzki J, Brown KA, Carroll RG, Cote CJ. The anatomy of the pediatric airway: has our knowledge changed in 120 years?: a review of historic and recent investigations of the anatomy of the pediatric larynx. Paediatr Anaesth. 2018; 28:13–22.

22. Holzki JF, Laschat M, Puder C. The pediatric larynx: a complicated organ. Anesth Analg. 2010; 110:1509–10.
23. Eckel HE, Koebke J, Sittel C, Sprinzl GM, Pototschnig C, Stennert E. Morphology of the human larynx during the first five years of life studied on whole organ serial sections. Ann Otol Rhinol Laryngol. 1999; 108:232–8.

24. Wani TM, Rafiq M, Talpur S, Soualmi L, Tobias JD. Pediatric upper airway dimensions using three-dimensional computed tomography imaging. Paediatr Anaesth. 2017; 27:604–8.
25. Benjamin B. Prolonged intubation injuries of the larynx: endoscopic diagnosis, classification, and treatment. Ann Otol Rhinol Laryngol Suppl. 1993; 160:1–15.

26. Reidenbach MM, Schmidt HM. Anatomical aspects of postintubational subglottic stenosis. Clin Anat. 1995; 8:273–80.

27. Sharma GK, Ahuja GS, Wiedmann M, Osann KE, Su E, Heidari AE, et al. Long-range optical coherence tomography of the neonatal upper airway for early diagnosis of intubation-related subglottic injury. Am J Respir Crit Care Med. 2015; 192:1504–13.

28. Lambercy K, Pincet L, Sandu K. Intubation related laryngeal injuries in pediatric population. Front Pediatr. 2021; 9:594832.

29. Darras KE, Roston AT, Yewchuk LK. Imaging acute airway obstruction in infants and children. Radiographics. 2015; 35:2064–79.

30. Fine GF, Borland LM. The future of the cuffed endotracheal tube. Paediatr Anaesth. 2004; 14:38–42.
31. Orliaguet GA, Renaud E, Lejay M, Meyer PG, Schmautz E, Telion C, et al. Postal survey of cuffed or uncuffed tracheal tubes used for paediatric tracheal intubation. Paediatr Anaesth. 2001; 11:277–81.

32. Motoyama EK. The shape of the pediatric larynx: cylindrical or funnel shaped? Anesth Analg. 2009; 108:1379–81.

33. Khine HH, Corddry DH, Kettrick RG, Martin TM, McCloskey JJ, Rose JB, et al. Comparison of cuffed and uncuffed endotracheal tubes in young children during general anesthesia. Anesthesiology. 1997; 86:627–31.

34. Weiss M, Dullenkopf A, Fischer JE, Keller C, Gerber AC; European Paediatric Endotracheal Intubation Study Group. Prospective randomized controlled multi-centre trial of cuffed or uncuffed endotracheal tubes in small children. Br J Anaesth. 2009; 103:867–73.

35. Taylor C, Subaiya L, Corsino D. Pediatric cuffed endotracheal tubes: an evolution of care. Ochsner J. 2011; 11:52–6.
36. Calder A, Hegarty M, Erb TO, von Ungern-Sternberg BS. Predictors of postoperative sore throat in intubated children. Paediatr Anaesth. 2012; 22:239–43.

37. Chambers NA, Ramgolam A, Sommerfield D, Zhang G, Ledowski T, Thurm M, et al. Cuffed vs. uncuffed tracheal tubes in children: a randomised controlled trial comparing leak, tidal volume and complications. Anaesthesia. 2018; 73:160–8.

38. El-Boghdadly K, Bailey CR, Wiles MD. Postoperative sore throat: a systematic review. Anaesthesia. 2016; 71:706–17.

39. Flynn PE, Black AE, Mitchell V. The use of cuffed tracheal tubes for paediatric tracheal intubation, a survey of specialist practice in the United Kingdom. Eur J Anaesthesiol. 2008; 25:685–8.

41. Thomas R, Rao S, Minutillo C. Cuffed endotracheal tubes for neonates and young infants: a comprehensive review. Arch Dis Child Fetal Neonatal Ed. 2016; 101:F168–74.

42. Krishna SG, Hakim M, Sebastian R, Dellinger HL, Tumin D, Tobias JD. Cuffed endotracheal tubes in children: the effect of the size of the cuffed endotracheal tube on intracuff pressure. Paediatr Anaesth. 2017; 27:494–500.

43. Ho AM, Aun CS, Karmakar MK. The margin of safety associated with the use of cuffed paediatric tracheal tubes. Anaesthesia. 2002; 57:173–5.

44. Weiss M, Dullenkopf A, Gysin C, Dillier CM, Gerber AC. Shortcomings of cuffed paediatric tracheal tubes. Br J Anaesth. 2004; 92:78–88.
45. Dave MH, Frotzler A, Spielmann N, Madjdpour C, Weiss M. Effect of tracheal tube cuff shape on fluid leakage across the cuff: an in vitro study. Br J Anaesth. 2010; 105:538–43.

46. Guyton D, Banner MJ, Kirby RR. High-volume, low-pressure cuffs: are they always low pressure? Chest. 1991; 100:1076–81.
47. Felten ML, Schmautz E, Delaporte-Cerceau S, Orliaguet GA, Carli PA. Endotracheal tube cuff pressure is unpredictable in children. Anesth Analg. 2003; 97:1612–6.

48. Cox RG. Should cuffed endotracheal tubes be used routinely in children? Can J Anaesth. 2005; 52:669–74.

49. Dullenkopf A, Gerber A, Weiss M. Fluid leakage past tracheal tube cuffs: evaluation of the new Microcuff endotracheal tube. Intensive Care Med. 2003; 29:1849–53.

50. Fischer M, Grass B, Kemper M, Weiss M, Dave MH. Cuffed pediatric endotracheal tubes: outer cuff diameters compared to age-related airway dimensions. Paediatr Anaesth. 2020; 30:424–34.
51. Dullenkopf A, Schmitz A, Gerber AC, Weiss M. Tracheal sealing characteristics of pediatric cuffed tracheal tubes. Paediatr Anaesth. 2004; 14:825–30.

52. Mariyaselvam MZ, Marsh LL, Bamford S, Smith A, Wise MP, Williams DW. Endotracheal tubes and fluid aspiration: an in vitro evaluation of new cuff technologies. BMC Anesthesiol. 2017; 17:36.

53. Boerboom SL, Muthukrishnan SM, de Graaff JC, Jonker G. Cuffed or uncuffed endotracheal tubes in pediatric anesthesia: a survey of current practice in the United Kingdom and The Netherlands. Paediatr Anaesth. 2015; 25:431–2.

54. Sathyamoorthy M, Lerman J, Okhomina VI, Penman AD. Use of cuffed tracheal tubes in neonates, infants and children: a practice survey of members of the Society of Pediatric Anesthesia. J Clin Anesth. 2016; 33:266–72.

55. Shaffner DH, McCloskey JJ, Schwartz JM. Cuffed endotracheal tube use in children: times (and minds) are ‘a changing. Pediatr Crit Care Med. 2019; 20:789–90.
56. Hansen ML, Eriksson C. Intubation and ventilation of infants and children. In : Tintinalli JE, Ma OJ, Yealy DM, Meckler GD, Stapczynski JS, Cline DM, editors. Tintinalli's emergency medicine: a comprehensive study guide. 9th ed. New York: McGraw-Hill Education;2020. p. 710–9.
57. Nagler J, Mick NW. Airway management for the pediatric patient. In : Walls RM, Hockberger RS, Gausche-Hill M, Bakes K, Baren JM, Erickson TB, editors. Rosen's emergency medicine: cencepts and clinical practice. 9th ed. Philadelphia (PA): Elsevier;2018. p. 1994–2004.
58. Nagler J, Donoghue AJ, Yamamoto LG. Airway. In : Shaw KN, Bachur RG, Chamberlain J, Lavelle J, Nagler J, Shook JE, editors. Fleisher and Ludwig’s textbook of pediatric emergency medicine. 8th ed. Philadelphia (PA): Wolters Kluwer;2021. p. 34–42.
59. Hartman ME, Cheifetz IM. Pediatric emergencies and resuscitation. In : Kliegman RM, St Geme III JW, Blum NJ, Shah SS, Tasker RC, Wilson KM, editors. Nelson textbook of pediatrics. 21th ed. Philadelphia (PA): Elsevier;2020. p. 530–47.
60. Schneider J, Mulale U, Yamout S, Pollard S, Silver P. Impact of monitoring endotracheal tube cuff leak pressure on postextubation stridor in children. J Crit Care. 2016; 36:173–7.

61. Al-Metwalli RR, Al-Ghamdi AA, Mowafi HA, Sadek S, Abdulshafi M, Mousa WF. Is sealing cuff pressure, easy, reliable and safe technique for endotracheal tube cuff inflation?: a comparative study. Saudi J Anaesth. 2011; 5:185–9.

62. Manimalethu R, Krishna S, Shafy SZ, Hakim M, Tobias JD. Choosing endotracheal tube size in children: which formula is best? Int J Pediatr Otorhinolaryngol. 2020; 134:110016.

63. Bernet V, Dullenkopf A, Maino P, Weiss M. Outer diameter and shape of paediatric tracheal tube cuffs at higher inflation pressures. Anaesthesia. 2005; 60:1123–8.

64. Sathyamoorthy M, Lerman J, Asariparampil R, Penman AD, Lakshminrusimha S. Stridor in neonates after using the microcuff(R) and uncuffed tracheal tubes: a retrospective review. Anesth Analg. 2015; 121:1321–4.
65. Sathyamoorthy M, Lerman J, Lakshminrusimha S, Feldman D. Inspiratory stridor after tracheal intubation with a MicroCuff(R) tracheal tube in three young infants. Anesthesiology. 2013; 118:748–50.
66. Zander D, Grass B, Weiss M, Buehler PK, Schmitz A. Cuffed endotracheal tubes in neonates and infants of less than 3 kg body weight: a retrospective audit. Paediatr Anaesth. 2021; 31:604–10.
Fig. 1.
Schematic representation of shifts from uncuffed (A and C) to cuffed (B and D) endotracheal tubes, and from cricoid-circular-funnel (A and B) to glottis-elliptical-cylinder (C and D) laryngeal configuration. In addition, this schema depicts the myths 1 (A) and 2 (B) and recently discovered features (C and D). Each inset shows a transverse section with a tube shaft inserted at each level (marked in black). The cricoid cartilage is drawn as a blue-gray ring (insets in A and B) or V-shaped lamina (insets in C and D [upper]). B exemplifies an erroneously high cuff location caused by a Murphy eye (asterisks). C illustrates the posterolateral compression by the tube shaft. The compression is considered stronger than previously expected, given the shift in laryngeal configuration. C also shows that the tip of movable, uncuffed tube can injure the tracheal wall, which can be minimized by the added stability provided by a cuff. D depicts a high volume-low pressure cuff without a Murphy eye placed at an appropriate location, which results in stabilization of the tip by the cuff, less leak through the cuff, less pressure on the subglottis by the tube shaft (upper inset) and on the trachea by the cuff (lower inset). Airway injury may be further prevented by the posterior trachea, which distends when intracuff pressure increases. Numbers in millimeters indicate the inner diameters of the tubes.
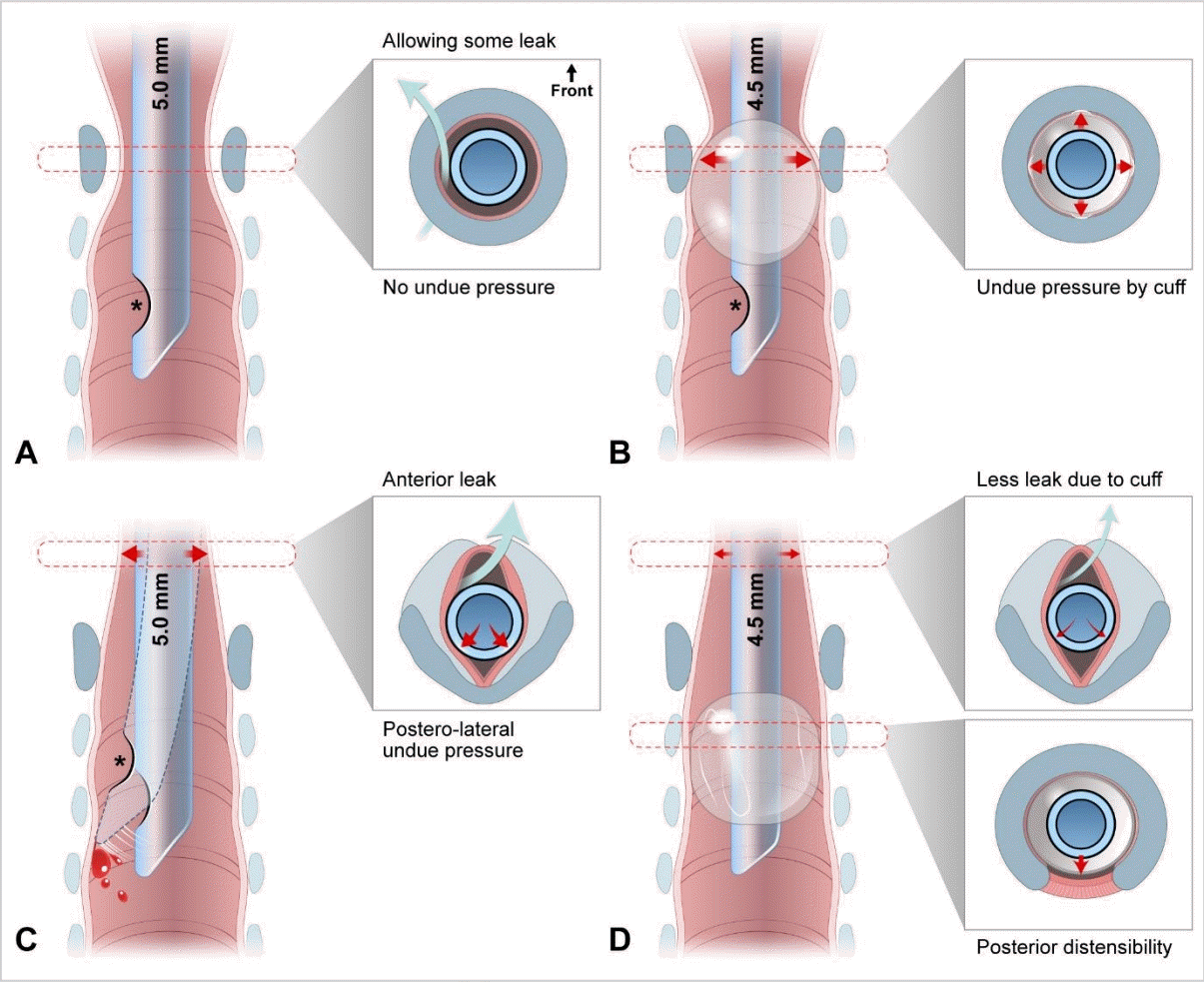
Fig. 2.
A laryngeal configuration based on the computed tomography-measured transverse diameters on AP view (A) and AP (i.e., sagittal) diameters on lateral view (B)18). It is narrowest in the transverse diameter at the glottis (A). Looking down the larynx at 45° from above, elliptical section is noted at the glottis (C). The ellipticity means a potential for uncuffed tube-induced posterolateral compression (Fig. 1C). AP: anteroposterior. Modified from Kim et al.20) (Children [Basel] 2022;9:1532) according to the Creative Commons License.
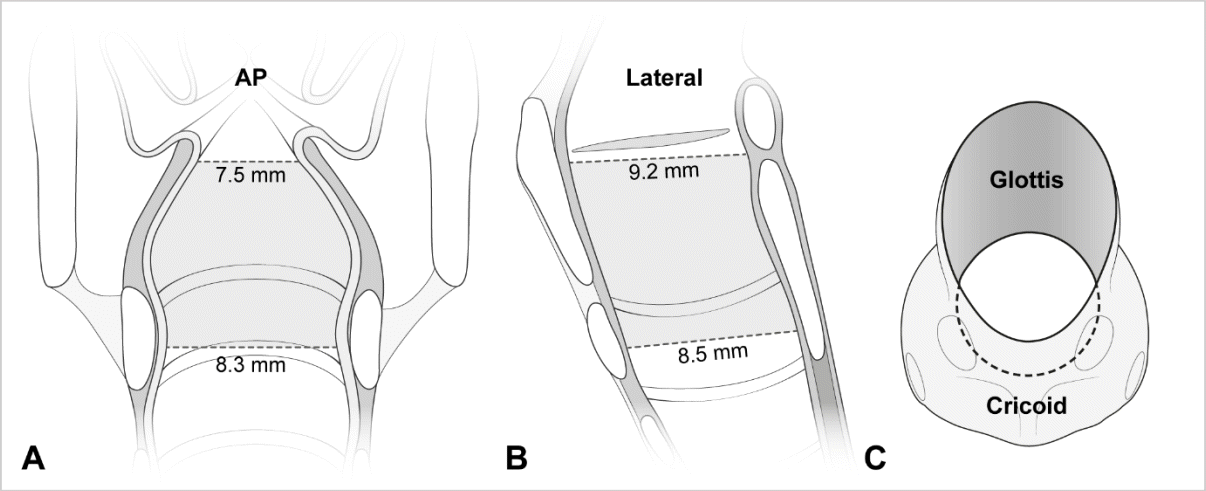
Table 1.
| Variable | Feature* | Remark |
|---|---|---|
| Emerging benefits† | Improved seal and less need for tube change | Cuff size is adjustable to variable tracheal sizes at same age |
| Adjustable fit | Lower rate of oversized intubation | |
| Similar incidence of severe injury (e.g., PES) | Cuffed, 2.4%-4.4% vs. uncuffed, 3.0%-4.7% | |
| Lower incidence of minor injury (e.g., sore throat)‡ | Tube shaft-induced posterolateral compression of the glottis-subglottis | |
| Cuff-induced separation of tube tip and the trachea prevents tracheal injury | ||
| Established benefits§ | Less leak | More reliable delivery/monitoring of tidal volume/capnography |
| Less consumption of/pollution by anesthetics | ||
| Less aspiration | Lower rate of ventilator-associated pneumonia | |
| Limitations | Need for intracuff pressure monitoring† | Safe range: < 20-25 cmH2O (ideally, using cuff manometer) |
| 0.5-1.0 mL of air may be sufficient to inflate cuffs of 3.0-5.0 mm ID tubes | ||
| Available down to size 3.0 mm ID | Still recommended to use uncuffed tubes in < 3 kg neonates | |
| Higher airway resistance due to 0.5 mm-smaller ID | Compensated by pressure-support ventilation | |
| Difficult suctioning | ||
| Higher cost | Compensated by less need for tube change and more reliable ventilation |
† The benefits have become known since mid-1990s. Although the benefits are of cuffed tubes per se, they have been reinforced and a lower intracuff pressure is enabled by the use of high volume-low pressure, polyurethane cuffs.
‡ Refer to Fig. 1C.
Table 2.
| Author | Study design and setting | Narrowest dimension | AP-to-transverse ratio | Association/correlation of diameter with age |
|---|---|---|---|---|
| Litman et al. (2003)16) | N = 99, 2 mo-13 y (mean, 61.6 mo), MRI under PSA, and 1 center in the United States | Transverse glottic diameter* | > 1 at all levels† | Linear association in all diameters at all levels |
| Dalal et al. (2009)17) | N = 128, 6 mo-13 y (mean, 70.8 mo), bronchoscopy under anesthesia/paralysis, and 2 centers in the U.S. | Transverse glottic diameter | > 1 at all levels† | Linear association in CSA at all levels |
| CSA: 30.0 mm2 (glottis) vs. 48.9 mm2 (cricoid) | ||||
| Wani et al. (2016)18) | N = 130, 1 mo-10 y (mean, 47.4 mo), CT under PSA, and 1 center in Saudi Arabia | Transverse glottic diameter | 1.2 at the subglottis‡ | Correlation in all diameters at all levels |
| CSA: 55.9 mm2 (subglottis) vs. 57.1 mm2 (cricoid) | 1.0 at the cricoid‡ | |||
| Mizuguchi et al. (2019)19) | N = 86, 1 mo-15 y (median, 53 mo), CT ± PSA, and 1 center in Japan | Transverse subglottic diameter | 1.5 at the subglottis§ | Correlation in transverse glottic diameter |
| 1.1 at the cricoid§ | ||||
| Kim et al. (2022)20) | N = 401, 1 mo-4 y (median, 26.0 mo), plain radiography, and 1 center in Korea | Transverse glottic diameter* | 2.9 at the glottis‡ | Correlation in all diameters at all levels |
| CSA: 26.5 mm2 (glottis) vs. 40.5 mm2 (cricoid) | 1.1 at the cricoid‡ |




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download