Abstract
Metofluthrin is a volatile pyrethroid insecticide. Despite being widely used as a safe household insecticide, it could cause severe systemic symptoms. A 19-month-old girl was taken to the emergency department after ingesting 1 mL of a mosquito repellent containing metofluthrin. After the arrival, the girl developed respiratory distress, which worsened progressively despite the administration of oxygen with nebulized salbutamol and budesonide. Additionally, she underwent application of high-flow nasal cannula, and administration of activated charcoal and systemic steroids. Her dyspnea gradually improved, and she was thus discharged on day 4 with oral prednisolone. All medications were discontinued 10 days after the discharge without any complication. Respiratory distress can develop after the ingestion of even a small amount of metofluthrin. Symptomatic and adjunctive steroid therapies can be effective therapeutic options.
특별한 과거력 및 기저질환이 없는 19개월 여아가 1시간 전 metofluthrin이 0.253% 함유된 액체 모기약(HomeMat Mosquito Liquid Alpha; Henkel Homecare Korea, Ansan, Korea) 1 mL (Metofluthrin 2.53 mg, 0.2 mg/kg)를 섭취하고 본원 응급실을 방문했다. 보호자에 따르면, 환아는 섭취 직후 뱉었고 보호자가 환아 입에 손을 넣었지만 토하지 않았다. 환아는 방문 2일 전부터 지속한 가벼운 기침 및 콧물에 대해 방문 당일 chlorpheniramine maleate 및 levodropropizine을 복용했고, 과량 복용하지는 않았다. 응급실 방문 당시, 의식은 명료했고 상기 호흡기증상에 추가로 빈호흡을 보였지만 쉰소리, 구토, 복통은 동반하지 않았다.
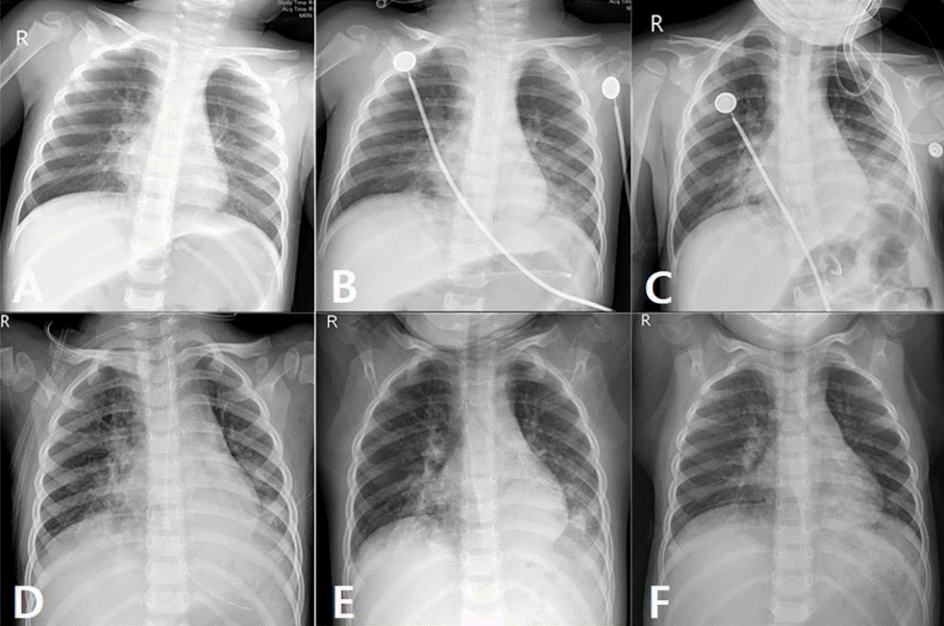
초기 활력징후는 혈압 141/65 mmHg (안정 후, 108/58 mmHg), 심박수 139회/분, 호흡수 60회/분, 체온 36.6°C, 산소포화도 94%였으며, 양쪽 폐 하부에서 천명과 수포음이 들렸다. 그 외 신체검사에서 이상소견은 없었다. 혈액검사에서 백혈구 19,320/μL, 혈색소 11.6 g/dL, 혈소판 508,000/μL, C반응단백질 0.2 mg/L (참고치: 0-8 mg/L), 적혈구침강속도 2 mm/h였고, 정맥혈기체분석에서 pH 7.27, 이산화탄소 분압 50.7 mmHg, 탄산수소염 23.9 mmol/L, 염기결핍 3.1 mmol/L, 젖산 1.5 mmol/L였고, 혈청 전해질 및 생화학 검사 결과는 정상 범위였다. 방문 직후 일반방사선영상(일반영상)에서 양쪽 폐문 주변 침윤이 보였다(Fig. 1A).
임상 및 영상 소견에서 상기도감염 또는 구토 후 흡인으로 인한 폐렴을 배제할 수 없었다. 그러나, 살충제 섭취 후 방문 과정에서 점점 심해진 빈호흡 및 천명을 근거로, 살충제 노출 후 발생한 기관지수축 또는 과민폐렴증(hypersensitivity pneumonitis)을 염두에 두고 산소를 투여하고(코삽입관 2 L/분), 방문 30분 후 salbutamol 및 budesonide 연무치료를 시행했다. 그러나 산소포화도가 91%로 떨어지고 기침과 천명이 악화하여, 방문 1시간 후 산소 투여 속도를 3 L/분으로 올렸다. 심한 복부팽만에 관하여 빈호흡으로 인한 공기삼킴증을 의심하고, 코위관 삽입 및 배액을 시작했다. 곧이어 같은 약으로 연무치료를 다시 시행하고 산소포화도는 95%로 상승했다. 방문 1시간 15분 후 시행한 일반영상에서 코위관은 위 내에 위치했으나, 방문 당시보다 양쪽 폐문 주변 침윤 및 폐 하부 경화가 증가했다(Fig. 1B).
전술한 폐 경화 증가 소견과 산소포화도 상승에도 지속하는 호흡곤란 및 천명을 근거로 과민폐렴증을 진단으로 추정하고, 방문 1시간 20분 후 dexamethasone (0.3 mg/kg/일, 3회로 나누어)을 정맥투여하고, 방문 1시간 30분 후 고유량 코삽입관(AIRVO 2 [Fisher & Paykel Healthcare, Panmure, New Zealand])을 적용했다(15 L/분, 흡입산소분율 30%).
상기 조치 후에도 산소포화도가 88%-95% 범위에서 변하고 호흡곤란도 지속하여 흡입산소분율을 40%로 올리고, 응급실 방문 2시간 20분 후 활성탄을 코위관으로 투여했다. 투여 직전 열(38.0°C)을 처음으로 확인하여 ibuprofen을 정맥투여했다. 활성탄은 원래 12 g (1 g/kg)을 투여하려고 했으나, 투여 도중 발생한 구역으로 인해 7.5 g 투여 후 중단했다. 활성탄 투여 30분 후 다시 시행한 일반영상에서 양쪽 폐 하부 경화가 다소 증가했으나(Fig. 1C), 호흡곤란이 점차 호전되어 흡입산소분율을 30%로 낮췄다. 이후 추가 조치 없이 관찰했고, 산소포화도 100%로 유지되고 기타 활력징후도 안정적이었다. 방문 6시간 후 salbutamol 연무치료를 1회 추가 시행했고, 방문 7시간 후 일반병실에 입원했다.
입원 후 연무치료(salbutamol 및 budesonide)와 함께 methylprednisolone (1.5 mg/kg/일, 3회로 나누어) 및 ampicillin-sulbactam 정맥투여를 유지하며 점차 증상이 호전됐다. 이에 제3병일에 산소 투여를 중단하고(Fig. 1D), 코위관을 제거하고 경구 영양을 시작했고, 스테로이드를 경구 제제(prednisolone [1 mg/kg/일, 3 회로 나누어])로 바꿨다. 입원 후 열은 호전됐으나, 제3병일 밤에 열이 재발하고 제4병일에 C반응단백질 농도가 22.5 mg/L로 증가했다. 추적 일반영상에서 양쪽 폐에 간유리음영 및 경화가 약간 남았으나, 응급실 방문 당시 가장 심했던 소견보다 호전됐다(Fig. 1E). 방문 당시 시행한 혈액배양 및 방문 3시간 후 시행한 중증급성호흡증후군 코로나바이러스-2 중합효소사슬반응(코인두 및 가래)은 모두 음성이었으나, 제4병일에 시행한 중합효소사슬반응에서 리노바이러스가, 가래배양에서 폐렴알균이 각각 검출됐다. 같은 날 저녁, 열이 지속하는 상태에서 보호자가 환아의 병실 적응 어려움을 이유로 퇴원을 요청하여, amoxicillin-clavulanate 및 prednisolone (1 mg/kg/일, 3회로 나누어)을 처방하고 퇴원시켰다.
퇴원 3일 후, 외래에서 환아의 발열이 호전되어(1-2회/일) 스테로이드를 절반으로 감량했다. 퇴원 10일 후, 호소하는 증상 없이 일반영상에서 양쪽 폐 경화가 호전됐고(Fig. 1F) C반응단백질 농도가 1.2 mg/L로 감소하여, 항생제 및 스테로이드 요법을 중단했다. 현재 환아는 합병증 없이 추적조사 중이다.
피레스로이드는 피레스린(pyrethrin)의 합성 유사물질로, 피레스린보다 효능 및 환경 잔류성 면에서 우수하다고 알려졌다5). Metofluthrin은 피레스로이드계 살충제로서 포유류보다 곤충에서 약 2,000배의 독성을 보이며 기존 유기인 살충제보다 인체에 안전하다고 간주한다2,4,5,6). Metofluthrin 경구 노출 용량 및 인체 독성의 상관관계에 대해서는 아직 구체적으로 밝혀진 바 없다. 쥐 대상 연구에서 최대 100 mg/kg 경구 투여에도 중간치사용량에 못 미치고, 1년간 진행한 개 대상 연구에서는 반복 경구 노출 시 허용 노출 수준(acceptable exposure level)은 0.1 mg/kg/일, 독성이 관찰되지 않은 최대 용량(no observed adverse effect level)은 10 mg/kg/일로 각각 보고됐다7).
피레스로이드는 나트륨 통로의 폐쇄를 지연시켜 나트륨 이온 유입을 늘리고 지속적 탈분극을 유발하여 신경전도 장애를 일으킨다4,6,8,9). 또한 일부 피레스로이드 계열은 염화물 통로 및 감마아미노뷰티르산 개폐 염화물 통로에도 영향을 주어 작용을 나타낼 수 있다4,8). 피레스로이드는 일반적으로 지방 조직에 축적되지 않고 간에서 빠르게 비독성 물질로 대사된다고 알려졌으나, 중독 증상으로 두통, 피로, 어지럼 등이 나타날 수 있고, 섭취 수 분 이내에 구역, 구토, 복통, 분비물 증가, 인두통 등을 일으킬 수 있다4,6,8,10,11). 비정형 증상으로, 인공호흡기 보조가 필요한 호흡부전, 저혈압, 폐렴, 급성콩팥손상, 의식저하, 발작 등이 발생할 수 있다6,12).
소아 연구는 드물지만, Cha 등6)의 성인 대상 연구에서 피레스로이드 중독 환자 중 39.3%에서 비정형 증상을 보였고, 이 중 인공호흡기 보조가 필요한 호흡부전이 가장 흔했다(17.9%). 또한 미국에서 5년간 피레스린 및 피레스로이드 살충제의 급성 중독 사례(총 407례)를 조사한 연구에서도 가장 흔한 증상은 호흡기 증상이었고(52%), 구체적으로 기침(28%), 호흡곤란(22%), 천식 악화(11%), 천명(8%) 등이었다11). 피레스로이드 중독은 대부분 6일 이내에 회복되며 사망률은 낮다고 알려졌으나, 비정형 증상이 발생하면 중대한 이환 및 사망으로 이어질 수 있다4,12). 1983-1988년에 중국에서 보고된 급성 피레스로이드 중독 573례 중 사망은 7례였고, 사인은 경련발작(4례), 비심장성 폐부종(1례), 유기인살충제 및 피레스로이드 혼합 중독(1례), atropine 중독(1례)이었다3,4).
피레스로이드에 대한 해독제는 없고, 눈 또는 피부 노출 즉시 세척하거나 섭취 후 위장관 오염제거가 권장되며 대증요법을 시행한다4,5,8,13). 위세척은 흡인을 초래할 수 있어 피해야 하지만4,5), 피레스로이드계 살충제가 숯에 흡착된다는 실험적 근거가 있어, 활성탄은 흡인 위험을 고려하면서 신중히 투여할 수 있다4,5). 감각이상은 대개 12-24시간 이내에 호전되나, 세척 후 비타민 E 크림이 도움 될 수 있다4,13). 발작 시 diazepam과 같은 항경련제를 투여하며, 과도한 침 분비를 조절하는 데에 atropine이 도움 될 수 있지만 atropine 중독이 발생할 수 있다4,8).
과민폐렴증은 외인성 알레르기 폐포염(extrinsic allergic alveolitis)이라고도 불리며, 다양한 환경 항원에 의한 면역 매개 염증의 결과로 발생하는 증후군이다14,15). 임상적으로 열, 오한, 근육통 등 독감 유사 증상이 특징이고, 호흡곤란 및 기침 등이 나타날 수 있다14,15). 알레르기 항원 노출 6-24시간 이내에 증상이 최고조에 달하며 수 시간에서 수 일 동안 지속하는데, 백혈구 수, C반응단백질 농도, 적혈구침강속도가 증가하며, 흉부 일반영상은 급성기에 비특이적 또는 정상 소견을 보일 수 있지만, 다양한 간유리 또는 미세결절 음영의 조합을 보일 수 있다14-16). 또한, 고해상컴퓨터단층촬영에서는 정상 또는 간유리음영과 미만성 경화 소견 등을 보일 수 있다15).
아직 소아 과민폐렴증에 대한 진단기준이 존재하지 않지만, 노출력, 호흡기증상, 영상 소견이 중요한 초기 평가 기준이다15). 기관지폐포세척은 과민폐렴증 의심 시 폐포염을 확인할 수 있는 가장 민감한 검사이지만, 분명한 노출력, 영상 소견, 치료에 대한 반응을 보인다면 필요성이 떨어지고, 특히 소아에서는 진단 가치가 떨어진다15,17). 임상 진단이 어려운 경우를 제외하면, 폐 생검이 필요한 경우는 드물다15,17).
과민폐렴증은 유발 요인을 회피하면 대부분 치유되지만, 스테로이드 요법(예: 급성기, 경구 prednisone 0.5-1 mg/kg/일, 최대 60 mg/일, 1-2주 복용 후 서서히 감량)이 급성기 증상, 영상 소견, 폐기능 개선에 효과적이라고 알려졌다14-18). 또한, 증상이 지속하거나 폐기능 또는 고해상컴퓨터단층촬영에서 심각한 손상이 있다면, methylprednisolone 충격요법(pulse therapy)과 같이 스테로이드 정맥투여를 고려할 수 있다15). 그러나, 아직 소아 스테로이드 요법에 관한 지침 및 근거가 명확하지 않은 상태이다15,19).
George 등20)은 피레스로이드계 살충제 15 mL 섭취 이후 급성호흡곤란증후군이 발생한 30세 환자에서 methylprednisolone (2 mg/kg/일, 4회로 나누어)을 정맥투여하여 호전된 사례를 보고했다. 해당 저자는 피레스로이드가 나트륨 통로에 영향을 주어 폐포 상피의 삼투 경사(osmotic gradient)를 무너뜨려 폐포 침윤이 발생하고, 피레스로이드 과민반응으로 진행성 염증이 발생했다고 추정했다20).
본 증례에서도 살충제로 인한 과민폐렴증이 발생한 것으로 추정하며, 이는 스테로이드 및 지지요법이 도움 될 수 있음을 시사한다. 과민폐렴증을 조직학적으로 진단하지 못했으므로, 환아의 호흡곤란 및 영상 소견이 섭취 전 발생한 호흡기감염, 또는 보호자의 구토 유발, 코위관 삽입 또는 활성탄으로 인한 흡인에 기인했다고 생각할 수 있다. 그러나 방문 당시 및 상기 처치 전후 구토가 없었고 입원 후 가래 및 분비물에서 활성탄이 관찰됐다는 기록이 없어, 흡인과 호흡곤란 및 영상 소견 사이의 인과관계를 확인할 수 없었다. 입원 기간 중 호흡곤란, 활력징후, 일반영상이 계속 호전되고 제3병일에 열이 재발하고 제4병일에 C반응단백질 농도가 증가한 시점에서 리노바이러스 및 폐렴알균을 확인했으므로, 병원내감염도 배제할 수 없다. 그러나 평소 건강하던 환아가 가벼운 호흡기증상만 보이다가 살충제 섭취 후 응급실 방문 과정에서 급성 호흡곤란을 보였고, 수 시간 내 영상 소견이 급격히 악화한 점, 그리고 스테로이드 정맥투여와 더불어, 인과관계는 불분명하나 활성탄 투여 후 증상이 호전됐다. 따라서, 본 저자는 방문 당시 호흡곤란 및 영상 소견은 metofluthrin 섭취로 인한 과민폐렴증에 기인한 것으로 추정했다.
본 증례는 가정용 살충제로 쓰이는 피레스로이드계 metofluthrin을 소량 섭취한 소아에서도 호흡곤란이 유발될 수 있음을 보고함으로써, 소아 중독 환자를 진료하는 임상의사의 주의를 촉구한다. 치료 면에서, 스테로이드 요법, 적극적 대증요법이 도움 될 수 있으며, 활성탄은 흡인 위험으로 신중히 투여해야 한다.
References
1. Buhagiar TS, Devine GJ, Ritchie SA. Metofluthrin: investigations into the use of a volatile spatial pyrethroid in a global spread of dengue, chikungunya and Zika viruses. Parasit Vectors. 2017; 10:270.

2. He F. Synthetic pyrethroids. Toxicology. 1994; 91:43–9.
3. He F, Wang S, Liu L, Chen S, Zhang Z, Sun J. Clinical manifestations and diagnosis of acute pyrethroid poisoning. Arch Toxicol. 1989; 63:54–8.

4. Bradberry SM, Cage SA, Proudfoot AT, Vale JA. Poisoning due to pyrethroids. Toxicol Rev. 2005; 24:93–106.

5. Burillo-Putze G, Nogué-Xarau S. Pesticides. In : Tintinalli JE, Stapczynski JS, Ma OJ, Yealy DM, Meckler GD, Cline DM, editors. Tintinalli’s emergency medicine. 8th ed. New York (NY): McGraw-Hill;2016. p. 1318–26.
6. Cha YS, Kim H, Cho NH, Jung WJ, Kim YW, Kim TH, et al. Pyrethroid poisoning: features and predictors of atypical presentations. Emerg Med J. 2014; 31:899–903.

7. European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market [Internet]. The United Kingdom; c2010 [cited 2023 Apr 17]. Available from: http://dissemination.echa.europa.eu/Biocides/ActiveSubstances/0045-18/0045-18_Assessment_Report.pdf.
8. Panwar M, Usha G, Kumath M. Status epilepticus: an association with pyrethroid poisoning. Indian J Crit Care Med. 2013; 17:119–20.

9. Soderlund DM, Clark JM, Sheets LP, Mullin LS, Piccirillo VJ, Sargent D, et al. Mechanisms of pyrethroid neurotoxicity: implications for cumulative risk assessment. Toxicology. 2002; 171:3–59.

10. Roberts JR, Karr CJ CJ; Council on Environmental Health. Pesticide exposure in children. Pediatrics. 2012; 130:e1765–88.
11. Walters JK, Boswell LE, Green MK, Heumann MA, Karam LE, Morrissey BF, et al. Pyrethrin and pyrethroid illnesses in the Pacific northwest: a five-year review. Public Health Rep. 2009; 124:149–59.

12. Pallavidino M, Arango Uribe D, Baskaran S, Saqib A, Elmesserey M, Onsy A, et al. Accidental pyrethroid ingestion in toddler: near-fatal atypical presentation and successful recovery. Front Pediatr. 2020; 7:542.

13. Ray DE, Forshaw PJ. Pyrethroid insecticides: Poisoning syndromes, synergies, and therapy. J Toxicol Clin Toxicol. 2000; 38:95–101.

14. Spagnolo P, Rossi G, Cavazza A, Bonifazi M, Paladini I, Bonella F, et al. Hypersensitivity pneumonitis: a comprehensive review. J Investig Allergol Clin Immunol. 2015; 25:237–50.
15. Mastrorilli C, Pecoraro L, Arasi S, Barni S, Caminiti L, Castagnoli R, et al. Pediatric hypersensitivity pneumonitis: literature update and proposal of a diagnostic algorithm. Ital J Pediatr. 2022; 48:51.

17. Wawszczak M, Bielecka T, Szczukocki M. Hypersensitivity pneumonitis in children. Ann Agric Environ Med. 2021; 28:214–9.

19. Griese M, Stehling F, Schwerk N, Rosewich M, Jerkic PS, Rock H, et al. Hypersensitivity pneumonitis: lessons from a randomized controlled trial in children. Pediatr Pulmonol. 2021; 56:2627–33.

20. George J, Malik R, Gogna A. Hypersensitivity reaction and acute respiratory distress syndrome in pyrethroid poisoning and role of steroid therapy. Asia Pac J Med Toxicol. 2015; 4:91–3.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download