Abstract
Thyroid hormone plays an important role in the process of implantation of a fertilized egg in the endometrium, as well as in the division and development of the fertilized egg. In addition, maternal thyroid hormone is essential for the formation and development of the fetal brain, nervous system, and bones. Therefore, when maternal thyroid hormone is insufficient, complications such as miscarriage, stillbirth, low birth weight and preeclampsia increase. Guidelines for the diagnosis and treatment of thyroid dysfunction during pregnancy were established and published by the American Endocrine Society, the American Thyroid Association, and the European Thyroid Society. The Korean Thyroid Society also published recommendations for diagnosis and treatment of thyroid disease during pregnancy and postpartum in 2014. However, since the revised guidelines of the American Thyroid Association were published in 2017, many studies, including large-scale randomized controlled trials, have been published in relation to thyroid and pregnancy, and the need to revise the existing recommendations has emerged in Korea. The main revisions of this recommendation are changes in the normal range of TSH during pregnancy, detailed description of treatment policies according to pregnant women’s autoantibodies and thyroid function status. Also, a description of the effect of thyroid autoantibodies on assisted reproductive procedures has been added.
갑상선호르몬은 임신을 준비하는 과정부터 출산에 이르기까지 임신의 전 과정에 걸쳐 중요한 영향을 미친다. 갑상선호르몬은 수정란이 자궁내막에 착상하는 과정은 물론, 수정란의 분열 및 발달에 중요한 역할을 한다. 또한 모체의 갑상선호르몬은 태아의 뇌와 신경계 및 뼈의 형성 및 발달에 필수적이다. 따라서 모체의 갑상선호르몬이 부족하면 유산과 사산, 저체중아 출산 및 임신중독증과 같은 합병증이 증가한다.
반면, 임신도 갑상선호르몬의 분비 및 대사 작용에 영향을 미친다. 임신 중에는 모체의 갑상선호르몬 생산이 약 50% 정도 증가하게 된다. 이는 임신 2기에 태아의 갑상선이 형성되기 때문에, 뇌, 심장, 갑상선 등 중요한 기관의 형성 및 발달이 일어나는 임신 1기에 필요한 갑상선호르몬을 공급하기 위한 합목적적인 생리현상으로 설명한다. 때문에 자가면역성갑상선염 등의 기저 질환이 있는 임신부의 경우 임신 중에 갑상선기능저하증이 나타날 가능성이 높아져 갑상선호르몬(levothyroxine, LT4) 치료가 필요할 수 있고, 출산 후에는 산후갑상선염의 발생 위험이 있다. 한편, 임신 직후부터 증가되는 사람 융모성선자극호르몬(human chorionic gonadotropin, hCG)의 영향으로 임신 초기에 혈중 갑상선자극호르몬(thyroid stimulating hormone, TSH)치가 일반인의 정상 범위보다 낮아지는데, 심한 경우 갑상선기능항진증이 나타날 수 있으나 대부분 저절로 호전되므로 치료를 요하는 경우는 거의 없다.
임신 중 갑상선의 기능이상 질환의 진단 및 치료에 대해서 미국내분비학회, 미국갑상선학회 및 유럽갑상선학회 등에서 가이드라인을 제정하여 발표하였다. 대한갑상선학회에서도 2014년 임신 중 및 산후 갑상선질환의 진단 및 치료 권고안을 발표한 바 있다. 그러나 2017년에 미국갑상선학회의 개정된 가이드라인이 발표된 이후 갑상선과 임신에 관련하여 대규모 무작위 대조연구들을 포함한 많은 연구들이 발표되어 국내에서도 기존 권고안 개정의 필요성이 대두되었다. 이번 권고안의 주요 개정 내용은, 임신 중 TSH의 정상범위의 변경, 임신부의 자가항체와 갑상선기능 상태에 따른 치료방침에 대한 상세한 기술, 보조생식술에 대한 갑상선자가항체(thyroid autoantibodies, TAb)의 영향 및 의미의 추가 등이다.
대한갑상선학회에서는 진료지침제정위원회 산하에 ‘임신 중 및 산후 갑상선질환의 진단 및 치료 권고안 제정 Task Force (TF)’를 두고, 2017년 미국갑상선학회에서 발표한 개정된 가이드라인을 토대로 이후 발표된 관련 문헌들을 검토하여 수용 개작하는 방법으로 근거중심의 새로운 가이드라인을 제정하였다.
권고안의 핵심질문은 2017년 미국 갑상선학회 가이드라인을 참고하여 정하였고, PubMed와 Embase 등의 논문검색 데이터베이스에서 각 핵심질문에 대한 키워드들을 조합하여 2016년 1월부터 2021년 12월까지 발표된 논문들을 검색하였다. 검색된 문헌들은 핵심질문별 담당 위원들이 검토하여 권고문을 작성한 후 회의를 거쳐 가이드라인 초안을 작성하였다. 기존의 2014년 권고안은 2012년까지의 문헌을 근거로 작성되었는데, 이번 개정안에서는 총 119개의 새로운 문헌이 추가되었고, 그 중 75개의 문헌은 2016년 이후 발표된 문헌이었다. 권고수준은 American College of Physicians’ Grading System의 근거에 따른 권고 수준에 따라 표시하였다(Supplementary Table 1). 본 개정안은 2022년 8월 대한갑상선학회 추계학술대회에서 공청회를 통해 회원들의 의견을 수렴하여 완성하였다.
임신 중 갑상선은 임신이라는 특수한 상황에 맞게 갑상선호르몬의 생산과 대사, 그리고 시상하부-뇌하수체-갑상선 축을 조절하여 증가된 대사 요구를 충족시킨다.1-3) 그 결과 건강한 임신부의 갑상선기능검사 결과는 비임신부와 차이를 보인다. 때문에 임신 삼분기의 TSH와 유리 T4 (free T4; FT4)의 정상범위를 별도로 설정할 필요가 있다.
임신 중 갑상선기능은 임신의 각 시기에 따라 변화한다. 임신 중에는 에스트로겐이 증가하는데, 이로 인해 T4 결합글로불린(T4 binding globulin; TBG)의 대사가 지연되어 임신 6-8주부터 혈청 내 TBG의 농도가 증가된다. 그 결과 총 T4 (total T4; TT4)치가 올라가는데 16주에 최대로 증가한 후 이후 감소하지만, 임신 동안 내내 상승된 상태로 유지된다.4)
임신 중 혈중 TSH 농도는 임신 기간 내내 비임신 여성보다 낮게 유지되어 임신 중 TSH 정상 범위는 하한선은 0.2 mIU/L, 상한선은 1.0 mIU/L 정도 낮다.9-13) 임신 초기에는 임신 6주부터 혈중 TSH농도가 낮아지기 시작하여, 8-12주에 가장 낮아지므로14) 임신 6주 이전에 측정한 TSH치가 이상 결과를 보인 경우 8주 이후 재평가가 필요하다.15,16)
이후 임신 2분기, 3분기로 진행되면서 혈중 TSH치도 점차 상승되지만, 정상 범위는 비임신 정상 여성에 비해 낮은 수준으로 유지된다.13) 혈중 hCG농도는 단태임신(singletone pregnancy)에 비해 다태임신(multiple pregnancy) 시에 더 높아지므로 다태임신 시 TSH치의 저하 폭은 더 커지게 된다.17) 일부 임신부들은 혈중 TSH 농도가 0.01 mIU/L 미만까지 저하되기도 한다.
뿐만 아니라 임신 중 TSH치의 정상 범위는 요오드 섭취에 따른 지역별, 인종 간, 갑상선자가항체(TAb) 유무 등에 따라서도 차이가 있다. 이전 가이드라인은 임신 1분기 TSH의 정상 상한선을 2.5 mIU/L로 제시하였으나,18) 최근 TSH의 정상 범위를 상향 조정하는 연구결과들이 발표되었다. 아시아, 인도, 유럽, 미국 등에서 시행한 대규모 연구에서는 TSH의 정상 상한선을 2.6-4.6 mIU/L로,11,13,19-24) 우리나라 연구에서는 TSH의 하위 97.5%는 3.0–4.5 mIU/L 범위로 보고하였다.16,25-27) 또한, TSH 4.0 mIU/L 이하의 임신부에서 유산, 미숙아, 저체중아의 위험이 증가하지 않았다.24,28,29) Moon 등27)과 Kim 등16)은 건강한 한국인 임신부들을 대상으로 임신 분기별 TSH와 유리T4의 참고범위를 발표하였다(Table 1). 그에 따라 한국인의 정확한 TSH 상한선을 제시할 근거가 아직은 부족하지만, 임신 초기 TSH의 정상 상한선은 4.0 mIU/L로 제안한다.
유리 T4는 결합단백에 결합되어 있지 않은 T4를 의미하며, 체내 총 T4의 0.03%로 매우 낮은 비율로 존재한다. 그러므로 임신으로 인해 결합단백의 양이 증가되면 결합된 형태의 T4가 증가하게 되고, 따라서 극소량의 유리 T4를 정확하게 측정하는 것은 더욱 어렵게 된다.
화학발광 효소 또는 방사면역측정법은 호르몬 측정에 널리 사용되는 방법으로, 혈청 내 결합단백 농도의 영향을 받아 TBG가 증가하거나 알부민이 낮아지면 유리 T4는 낮게 측정된다.30) 또한 유리 T4의 정상 범위는 측정 방법 뿐 아니라 요오드 섭취량에 따라 차이가 나므로, 측정 방법별, 대상 집단별 정상 범위를 새로 설정하는 것이 권장된다. 그러나 진료실에서 별도 정상 갑상선기능을 가진 대조군을 모아 정상 범위를 설정하는 일은 쉽지 않으므로 대개 제조회사에서 권고하는 정상 범위를 그대로 사용한다. 다행히 최근 개발된 면역측정법은 비교적 정확하게 유리 T4치를 반영한다.31)
일부 연구자들은 임신 중 총 T4나 유리 T4 index (FT4 index=TT4×T3 uptake or TT4/TBG)가 TSH와 역상관관계를 보이므로 유리 T4 면역측정법보다 우월하고, 정상 범위는 비임신 시 정상 범위보다 50% 높은 수준으로 정해야 한다고 주장하기도 한다.32)
아울러 liquid chromatography/tandem mass spectrometry (LC/MS/MS)는 기존의 면역측정법에 비해 특이도가 높으면서, 고전적인 equilibrium dialysis를 이용한 유리 T4와 상관관계가 좋은 반면, 면역측정법과는 상관관계가 낮아, 향후 유리 T4 및 유리 T3를 측정하는 표준 방법이 될 가능성이 높다.7,33) 실제로 International Federation of Clinical Chemistry and Laboratory Medicine은 혈청 유리 T4를 측정하기 위해서는 혈청을 equilibrium dialysis 하여 얻은 투석액에서 isotope dilution-LC/MS/MS를 이용하도록 권고하고 있으나,34) 비용 문제로 인해 LC/MS/MS를 이용할 수 있는 검사실은 아직 소수에 불과하다.
임신부의 2-17%에서 anti-thyroid peroxidase antibody (TPOAb)나 anti-thyroglobulin antibody (TgAb)와 같은 갑상선자가항체(TAb)가 측정된다.35-43) 한 단면 연구에 따르면 임신으로 내원한 벨기에 여성에서 TPOAb와 TgAb 모두 양성은 8%였고, TgAb 단독 양성은 5%, 그리고 TPOAb 단독 양성은 4%였다.44) 자가면역갑상선염을 진단하기 위한 방법으로 TPOAb만을 검사할 경우 소규모의 TgAb 단독 양성인 여성이 누락될 수 있으나 갑상선 자가면역과 관련된 대부분의 연구들이 TPOAb만 검사되었다는 점을 고려해보면 갑상선 자가면역 평가에 TPOAb 검사가 우선적으로 이용될 수 있겠다.
Glinoer 등45)은 TAb+ 정상 갑상선기능 여성에서 시행한 전향적 연구에서 임신 중 TPOAb 역가가 감소하는데 40%에서 TSH >3.0 mIU/L, 16%에서 TSH >4.0 mIU/L로 상승됨을 보고하였다. Negro 등46)도 전향적 무작위 연구에서 유사한 결과를 발표하였는데, TPOAb+ 정상 갑상선기능 여성에서 임신이 진행되는 동안 TSH농도가 임신 12주에 평균 1.7 mIU/L에서 분만 시 평균 3.5 mIU/L로 점진적으로 높아졌고, 분만 시 정상보다 높은 TSH농도를 보이는 여성이 19%에 이른다고 보고하였다.
이러한 결과를 통해 임신기간 중에 갑상선호르몬의 요구량이 증가하여 TSH가 상승한다는 것을 확인할 수 있다. 그러나 TAb+인 여성은 임신 중 갑상선호르몬의 생산이 충분히 증가하지 못하여 무증상갑상선기능저하증, 더 나아가 현성 갑상선기능저하증이 발생할 수 있다. 즉, TAb+ 정상 갑상선기능 여성은 임신 중 TSH 상승 위험성이 높으므로 면밀한 추적관찰이 필요하다.
모체의 갑상선 자가면역 여부가 태아에 미치는 영향에 대해서는, 분만 시 제대혈 TPOAb 역가가 3분기 모체의 TPOAb 역가와 강한 상관관계를 보여 TPOAb 태반을 통과할 수 있다는 것이 확인되었다.47) 그러나 모체로부터의 TPOAb 또는 TgAb의 이행과 태아의 갑상선기능 이상 간의 연관성은 없었다.
임신하지 않은 여성을 대상으로 한 연구들에서 셀레늄 투여는 TPOAb 역가를 감소시켰으나,48-51) 상충되는 결과를 보고한 연구도 있었다.52) Negro 등53)은 TPOAb+ 정상 갑상선기능 임신부들에게 셀레늄을 1일 200 μg 투여한 경우 산후 갑상선기능이상의 빈도가 유의하게 감소되었을 뿐만 아니라, 치료받지 않은 여성에 비해 임신 중 TPOAb 역가가 낮음을 관찰하였다. 그러나 소변의 요오드 농도가 측정되지 않아 요오드 섭취량이 교란변수로 작용되었을 가능성이 있다. 실제로 경미한 요오드 부족이 있는 영국인 임신부에서 시행된 무작위대조연구에서 1일 60 μg의 셀레늄 투여는 TPOAb 역가 또는 TPOAb 양성 여부에 영향이 없었다.54) 이탈리아에서 갑상선염이 있는 45명의 임신부를 대상으로 시행된 무작위대조연구에서도 1일 83 μg의 L-selenomethionine 투여는 TPOAb 역가를 감소시키는 효과를 보였으나, 갑상선 크기 및 실질, 삶의 질, 그리고 임신부 및 태아의 합병증 발생에 차이는 없었다.55)
따라서 지역마다 요오드 및 셀레늄 섭취량이 다르다는 점을 고려할 때, 이와 같이 일관되지 않은 결과에 근거하여 셀레늄 치료를 권고하기는 어렵다. 또한, 셀레늄 치료 후 2형 당뇨병의 발생 위험이 증가되었다는 연구도 있으므로56) 현재까지는 TAb+ 여성에서 임신 중 일률적인 셀레늄 투여는 권장되지 않는다.
자연유산은 20주 미만에 임신이 자연적으로 종결되는 경우를 의미하며 전체 임신의 17-31%에서 발생한다.57,58) 자연유산의 위험도는 임신부의 연령, 가족력, 환경노출, 그리고 동반된 질환을 포함한 임상 요소들에 따라 달라진다.59) 유산은 환자에게 정서적으로 큰 부담이 되며 출혈, 감염, 통증으로 수술적 처치가 필요할 수도 있다.
당뇨나 갑상선질환 등의 내분비질환은 자연유산의 위험 인자 중 하나로 잘 알려져 있다. 조절되지 않는 당뇨병 환자에서 유산의 위험성은 50%에 이를 수 있으며,60) 갑상선기능이상 또한 자연유산의 발생을 증가시킨다.61,62) Stagnaro-Green 등63)은 전향적 관찰 연구를 통해 유산과 TAb와의 연관성에 대해 처음으로 보고하였는데, TAb+군의 유산 위험성이 정상 대조군의 두 배로 높았다(17% vs. 8.4%, p=0.011). 이후 여러 연구들이 비슷한 결과를 보고하였는데,64-66) 8개의 환자-대조군 연구를 종합한 메타분석에서 TAb+군에서 자연유산 위험성이 2.55배 높았고(pooled odds ratio [OR] 2.55 [95% CI 1.42–4.57]), 14개 코호트 연구들의 메타분석에서도 TAb+군에서 자연유산 위험성이 2.31배 높았다(OR 2.31 [95% CI 1.90–2.82]). 다만, TAb+인 여성이 TAb-인 여성에 비하여 연령이 유의하게 많았고(1.29년), TSH는 유의하게 높았다는 점(0.61 mIU/L)에 주의가 필요하다.67) 또 다른 메타분석은 TAb+인 여성이 대조군에 비하여 유산율이 코호트 연구에서는 3.9배, 환자-대조군 연구에서는 1.8배 높음을 보고 하였다(코호트 연구, OR 3.90 [95% CI 2.48–6.12]; 환자-대조군 연구, OR 1.80 [95% CI 1.25–2.60]).68) 2개의 무작위대조연구를 2차 분석한 결과 1468명의 불임 여성에서 TAb+은 1분기 유산 위험도를 2.17배 상승시켰다(OR 2.17 [95% CI 1.12-4.22]).69)
반복 자연유산은 두 번 연속으로 유산이 발생하거나 또는 총 세 번의 자연유산이 있는 경우로 정의되며 모든 여성의 1%에서 발생한다.74) 부모의 염색체 이상, 면역학적 교란, 자궁 병변 그리고 내분비계 이상 등이 그 원인으로 알려져 있다.75)
갑상선 자가항체의 존재가 반복적인 자연유산의 위험성을 높이는가에 대해서는 환자-대조군 비교와 메타분석을 통해 여러 연구에서 분석되었다. Iravani 등76)은 환자-대조군 연구를 통해 세 번 이상의 유산을 경험한 일차성 반복 유산 환자는 TAb+의 빈도가 2.24배 높았다고 보고하였다(OR 2.24, [95% CI 1.5-3.3]). Kutteh 등77)은 200명의 건강한 대조군과 비교하여 반복 유산을 경험한 700명의 여성에서 TAb+ 비율이 높다는 유사한 결과를 확인하였다(22.5% vs. 14.5%, p=0.01). Lata 등78)은 반복 유산을 경험한 여성에서 건강한 대조군보다 TPOAb+ 비율이 높음을 보여주었다(31% vs. 18%, p=0.031).
Pratt 등79)은 TAb+인 반복 유산 환자에서 다음 임신 시 유산율이 더 증가한다고 보고하였다. Bliddal 등80)은 반복 유산을 경험한 여성에서 TPOAb+이 생아출생률 감소와 연관성이 있음을 보여주었다. 8개의 연구를 메타분석한 연구에서도(TAb+ 여성: 460명, 대조군 1923명) TAb+과 반복 유산 사이에 유의한 연관관계가 있었다(OR 2.3 [95% CI 1.5-3.5]).81) 17개의 연구를 메타분석한 최근 연구에서는 TAb+과 반복 유산간의 유의한 연관성을 입증하였으나(OR 1.94 [95% CI 1.43-2.64]), 포함된 연구들의 대다수가 환자-대조군 연구이며 반복 유산 및 TAb+의 정의가 일관되지 않고, 갑상선호르몬 상태 또한 불분명하거나 정상 갑상선호르몬에 대한 정의가 일관되지 않았다.82)
이와 대조적으로 Esplin 등83)이 수행한 전향적 관찰 연구에서는 건강한 대조군과 반복 유산 환자 사이에 TAb+ 비율은 차이가 없었다. 규모가 더 큰 연구에서도 TAb+인 반복 유산 환자와 TAb-인 반복 유산 환자의 생아출생률(live birth rate)에는 의미 있는 차이가 보이지 않았다.84) 이처럼 TAb와 반복 유산 사이의 연관성에 대한 자료는 자연유산과 TAb 사이의 연관성에 비해 근거가 부족하고 다소 모순적인 면이 있다. 이것은 아마도 반복 유산의 원인이 확실하지 않고, 잠재적인 여러 원인이 있으며, 그 중 내분비계 이상은 전체의 15-20%만을 차지하고 있기 때문일 것으로 생각된다.75) 위에 언급된 많은 연구들도 반복 유산의 다른 잠재적 원인들을 보정 혹은 배제하지 못하였다.
Negro 등46)은 갑상선기능이 정상이지만 TPOAb+인 여성을 대상으로 LT4 치료에 대한 전향적 무작위 대조 연구를 시행하여 LT4 치료군에서 유산율이 의미 있게 감소함을 보고하였다(3.5% vs. 13.8%, p<0.05). 이 연구의 한계점은 LT4 투여를 시작한 평균 임신 주수가 10주였으나 한 예를 제외하고는 모두 임신 11주 이전에 유산이 발생하여 LT4 치료의 영향이 맞는가에 대한 설득력이 부족하다는 점이다. Lepoutre 등87)은 TPOAb+이고 TSH 1.0-3.5 mIU/L 인 여성 65명을 대상으로 한 후향적 연구에서 평균 임신 10주에 일일 50 μg의 LT4 치료를 한 34명의 여성에서는 유산이 발생하지 않았던 반면, 치료하지 않은 여성 31명 중에서는 5명(16%)이 유산을 경험하였다고 발표하였다.
최근 LT4 치료 효과에 대한 세 개의 대규모 무작위대조연구 결과가 발표되었다(Table 2). Pregnancy Outcomes Study in Euthyroid Women With Thyroid Autoimmunity After Levothyroxine (POSTAL) 연구88)에서 체외수정으로 임신한 TPOAb+ 정상 갑상선기능 여성에게 LT4 치료를 하였으나, 유산, 및 조산의 위험도를 유의하게 감소시키지 못했고, 생아출생률을 증가시키는 효과도 없었다. 이 연구에서 두 번 이상 유산한 여성은 제외되었고, LT4는 TSH ≥2.5 mIU/L시 50 μg, TSH <2.5 mIU/L시 25 μg으로 시작하여, 임신 분기별 TSH 상한치에 맞도록(1분기; 0.1-2.5, 2분기; 0.2-3.0, 3분기; 0.3-3.0 mIU/L) 용량을 조절하였다.
영국에서 한 번 이상 유산을 경험하거나 불임치료를 받은 TPOAb+ 정상 갑상선기능 여성을 대상으로 수정 1년 전부터 LT4를 투여한 The Thyroid AntiBodies and LEvoThyroxine study (TABLET) 연구89)에서 LT4 투여는 대조군에 비하여 생아출생률을 유의하게 높이지 못하였다(LT4군 37.4% vs. 대조군 37.9%, relative risk, 0.97 [95% CI 0.83-1.14]).
또 다른 Levothyroxine in euthyroid thyroid peroxidase antibody positive women with recurrent pregnancy loss (T4LIFE trial) 연구90)에서는 두 번 이상 유산을 경험한 TPOAb+ 정상 갑상선기능 여성에게 LT4를 TSH농도에 따라 TSH <1.0 mIU/L이면 0.5 μg/kg, 1.0-2.5 mIU/L이면 0.75 μg/kg, >2.5 mIU/L일 때 1.0 μg/kg로 수정 전부터 투여한 결과 생아출산율에 유의한 차이가 없었다.
임신 37주 이전의 분만으로 정의되는 조산은 주된 주산기 합병증 중 하나로, 신생아 사망의 가장 흔한 원인이고, 영아 사망의 두 번째 원인이다.94) 조산으로 인한 의료비 지출은 상당하나95) 감염, 외상, 자궁경부무력증, 조기양막파수 그리고 모체의 동반 질환 유무 등 다양한 원인이 존재하기 때문에 이를 예측하는 것은 물론, 예방 및 치료도 어렵다.96)
TAb+과 조산과의 연관성에 대해서 여러 연구들이 수행되었다. Glinoer 등65)이 수행한 전향적 코호트 연구에서 TPOAb+ 또는 TgAb+ 여성에서 조산의 유병률이 의미 있게 증가하였다(16% vs. 8%, p<0.005). Ghafoor 등97)은 1500명의 정상 갑상선기능 여성 중 TPOAb+인 여성에서 TPOAb-인 경우에 비해 조산율이 증가한다고 보고하였다(26.8% vs. 8.0%, p<0.01). 반면, Iijima 등64)은 다른 일곱 종류의 자가항체들과 TAb+인 여성에서 조산의 위험이 증가하지 않았다고 하였다. 다만 이 연구는 연구군과 대조군 모두에서 현저히 낮은 조산율을 보였다는 특이점이 있다(3% vs. 3.1%). Haddow 등98)은 TAb+인 여성에서 조기양막파수가 의미 있게 증가하였지만 임신 1분기 조산율은 증가하지 않았다고 발표하였다. 그 외에도 세 개의 대규모 전향적 코호트 연구들이 TAb+과 조산의 위험성 사이의 유의한 연관관계를 확인하는데 실패하였는데, 각 연구에서 조산율이 TAb+인 여성에서 TAb-인 여성보다 높았으나 통계적으로 유의하지는 않았다.98-100) Plowden 등101)은 전향적 코호트 연구의 2차 분석에서 1-2번의 유산력을 가진 여성에서 TPOAb+이 조산과 연관이 없다고 보고하였다.
메타분석 결과들은 TAb+과 조산의 연관성을 의미 있게 보고하였다. 2011년 23,000명을 포함한 7개 연구의 메타분석에서 TAb+은 조산의 위험성을 1.8배 높였다(OR 1.6 [95% CI 1.44–1.94]).102) 12,566명의 여성을 포함한 5개 코호트 연구의 메타분석 결과도 TAb+은 조산의 위험성을 2.9배 증가시켰다(OR 2.9 [95% CI 1.17–3.68]).68) 35,457명을 포함한 11개의 전향적 코호트 연구들의 메타분석에서 TgAb+ 또는 TPOAb+이거나, 둘 다 양성인 여성에서 37주 미만의 출산의 상대적 위험도는 1.4배(OR 1.4 [95% CI 1.08–1.84])였다.103) 흥미롭게도, 세부분석 결과에서 TgAb+가 아닌 TPOAb+만이 조산과 연관되었다. 11,212명이 포함된 3개의 전향적 출생 코호트 연구를 메타분석한 결과 TPOAb 항체수치가 높을수록 조산의 위험이 높았다.104)
정상 갑상선기능의 기준으로 혈중 TSH농도를 제시한 연구들의 결과도 비교적 비슷한 경향을 보였다. Karakosta 등105)은 임신초기에 TPOAb+ 또는 TgAb+ 이거나, 두 항체가 모두 양성인 정상 갑상선기능(TSH <2.5 mIU/L) 여성에서 조산의 위험도가 1.7배 증가하였다고(RR 1.7 [95% CI 1.1-2.8]) 보고하였다. 또 다른 395명의 임신한 여성을 대상으로 한 코호트 연구에서 37주 미만의 조산은 TPOAb+ 정상 갑상선기능 여성에서(TSH <2.6 mIU/L) 더 흔히 발생하였다(OR 2.5 [95% CI 1.06- 5.89]).106) Negro 등46)은 LT4를 투여하지 않은 TPOAb+ 여성이 TPOAb- 여성보다 조산의 위험도가 12배 높았다고 보고하였다(RR 12.18 [95% CI 7.93-18.7]).
임신 시기별로 분석한 연구 결과 TAb+은 비교적 초기의 조산과 연관되었다. Han 등107)은 2931명의 전향적 코호트 연구에서 1분기와 2분기에 TAb+이 지속되는 여성에서 조산의 위험도가 1.8배 높다고 보고하였다(OR 1.863 [95% CI 1.009-3.411]). 갑상선기능이상과 갑상선 자가면역의 조산과의 연관성을 확인하고자 한 19개의 연구들이 포함된 최근의 메타분석에서 세부 분석 결과 TPOAb+은 정상 갑상선기능 여성에서 37주 미만의 조산 위험도를 1.36배(OR 1.36 [95%CI 1.15-1.60])와 32주 미만(OR 2.86 [95% CI 2.10-3.89])의 조산 위험도를 2.86배 상승시켰다.108)
이러한 결과들을 종합해 볼 때 TAb+은 조산의 위험 증가와 연관이 있다고 할 수 있겠다.
Negro 등46)은 최초의 전향적 중재연구를 통해 정상 갑상선기능 여성에서 TPOAb-군에 비해 TPOAb+군에서 조산의 위험이 증가한다고 보고하였다(22.4% vs. 8.2%, p<0.01). 다시 TPOAb+군을 LT4 치료를 받는 군과 받지 않는 군으로 무작위배정하여 TSH목표치를 두고 LT4 용량을 조정하여 투여한 결과, LT4 치료군은 치료받지 않은 군에 비하여 의미 있게 낮은 조산율을 보였다(7% vs. 22.4%, p<0.05).
TAb+이 주산기 사망과 관련이 있다는 연구100)가 있으나 일관되지는 않는다.39,109) 두 임신 코호트 연구에서 현성 갑상선기능저하증이 없는 TAb+ 임신부에서 태반조기박리의 위험이 증가하였다.39,98) 임신부의 TAb+이 산후 우울증,110,111) 신생아 호흡곤란증후군109)과 연관된다는 보고가 있다.
임신부의 TAb+과 아이의 발달 사이의 연관성을 조사한 연구들은 대규모 무작위대조연구들이 아니고 결과가 일관되지 않아 그 연관성 및 인과관계는 명확하지 않다. Li 등112)은 코호트 내 환자-대조군 비교를 통해 TPOAb+ 정상 갑상선기능 여성의 아이가 TPOAb-인 여성의 아이에 비하여 생후 25-30개월에 조사한 운동 및 지적발달이 낮음을 보고하였다. Williams 등113)은 97명의 엄마와 아기를 추적하여 5.5세에 아기의 신경인지능을 평가하였을 때, TgAb+ 엄마의 아기에서 지각능력과 운동발달 점수가 낮았고, 제대혈에서 TgAb+로 측정된 아기에서 지각능력 점수가 낮게 관찰되었다. 그러나 엄마와 아기의 TPOAb 상태는 신경발달 평가지표와 연관성을 보이지 않았다.
Wasserman 등40)은 임신 중 TPOAb+ 엄마의 아이에서 TPOAb-에 비하여 8세 때 감각신경난청의 발생률이 높음을 보고하였다(22.7% vs. 4.3%, p=0.004). 이 연구에서는 엄마의 갑상선기능이 조사되지 않았고, 엄마의 갑상선기능저하증의 과거력을 보정한 이후에도 그 연관성은 유의하였다. 같은 코호트에서 4세와 7세 때 아이의 인지능력을 평가한 결과114) 엄마의 TPOAb+은 아이가 4세 때의 낮은 IQ (intelligence quotient)와 연관성이 있었으나 그 효과는 7세가 되면 상쇄되었다. 저자들은 4세 때 낮은 IQ 점수가 감각신경난청의 영향일 가능성을 제시하였다.
두 출생 코호트 연구(Generation R [네덜란드], Avon Longitudinal Study of Parents and Children [ALSPAC, 영국])에서 임신초기 엄마의 TPOAb+과 아이의 5-10세 IQ간의 연관성을 조사한 결과, Generation R 코호트에서만 TPOAb+과 아이의 낮은 IQ간에 연관성이 있었다. 이러한 인구간의 차이는 엄마의 요오드 상태 등이 교란인자로 작용되었을 가능성이 있어 이에 대한 추가적 연구가 요구된다.115)
Ghassabian 등116)은 3139명의 엄마-아기들의 코호트에서 2.5세때 아기의 인지기능과 3세 때 행동을 평가한 연구에서 엄마의 TPOAb 유무는 아이의 신경인지능과 관련이 없었으나 TPOAb+은 아이의 외현화 문제(exter-nalizing problem)를 1.6배 높였다(OR 1.64 [95% CI 1.17–2.29]). 특히, 주의력 결핍 및 과행동 문제가 1.77배 높았는데(OR 1.77 [95% CI 1.15–2.72]), 이러한 결과는 엄마의 TSH를 보정한 이후에도 유의하였다. 코호트 내 환자-대조군 연구에서 Brown 등117)은 자폐 스펙트럼 아이의 엄마가 대조군보다 임신중 TPOAb+ 비율이 더 높음을 보고하였다.
그 외에 핀란드의 전향적 출생 코호트 연구에서 16세 때 TAb와 심혈관질환 위험인자들의 연관성을 평가한 결과 TPOAb+ 엄마의 아이에서 대사증후군은 2.57배(OR 2.57 [95%, CI 1.26-5.25]), 과체중 또는 비만은 1.56배(OR 1.56 [95% CI 1.04-2.34])로 발생 위험도가 유의하게 높았다.118)
현성 갑상선기능이상 여성에서 생리불순이 발생할 수 있다. Krassas 등121)은 생리불순이 정상 갑상선기능 여성의 8%에서 나타나는데 반하여, 갑상선기능항진증 환자의 경우 22%에서 동반된다고 보고하였다. TSH >15 mIU/L인 갑상선기능저하증 여성 171명을 대상으로 한 연구에서 68%가 생리불순이 있다고 보고하였는데, 이 수치는 정상 갑상선기능 여성에서의 12%보다 월등히 높았다.122)
현성 갑상선기능이상과 불임에 관한 연구는 많지 않다. 한 단면조사 연구에서 불임 여성과 대조군 간 갑상선기능항진증(현성, 무증상)의 유병률에 차이가 없었다.123) 다른 단면연구에서는 129명의 불임 여성 중 5%가 갑상선기능저하증(TSH >4.5 mIU/L)이었다.124)
갑상선기능이상의 흔한 원인이 자가면역성 갑상선질환임에 착안, 여러 연구에서 자가면역질환을 가진 여성에서의 불임 위험을 조사하였다. 한 단면연구에서 18-50세 여성의 불임의 유병률을 조사한 결과, 그레이브스병을 가진 여성에서 52.3%, 하시모토 갑상선염을 가진 여성에서 47%였다. 그러나 연구 당시 갑상선기능 상태는 양쪽 군 모두에서 보고되지 않아 해석에 주의해야 한다.125) 2018년 74명의 터키 여성을 대상으로 시행된 전향적 연구에서 항뮬러관호르몬(anti-Müllerian hormone)으로 평가한 난소 예비력(ovarian reserve)은 현성 갑상선기능저하, 무증상갑상선기능저하, 그리고 대조군 간에 유의한 차이가 없었다.126)
이를 종합할 때, 현성 갑상선기능이상과 불임은 대부분의 연구에서 유의한 연관성을 보인다. 갑상선기능이상이 가역적이고, 치료가 일반적으로 안전하며, 치료 효과의 긍정적인 효과를 고려해 볼 때 현성 갑상선기능이상을 가진 불임 여성에서 정상 갑상선기능을 목표로 치료하는 것은 합리적이다.
무증상갑상선기능저하증과 불임의 연관성에 관한 연구들은 결과가 일관되지 않고, 무증상갑상선기능저하증의 정의 기준 또한 일관되지 않았다. 704명의 불임 여성에서 시행된 단면 연구에서 TSH 상승의 유병률은 2.3%로 일반인구와 비슷하였다.127) Poppe 등123)의 전향적 연구에서는 불임 여성의 무증상갑상선기능저하증 유병률이 증가하지는 않았으나 TSH 중간 값이 불임 여성에서 1.3 mIU/L로 대조군의 1.1 mIU/L에 비하여 약간 높았다. 한 후향적 연구에서는 무증상갑상선기능저하증의 유병률이 불임 여성에서 13.9%로 대조군의 3.9%에 비하여 높았다.128) 불임 여성의 TSH농도를 불임의 원인에 따라 비교하면, 난소 기능부전이 있거나 불임의 원인이 불명확한 여성에서 가장 높았고, 난관과 관련된 불임을 지닌 여성과 남성 요인의 불임 여성에서 낮았다.129) 반면, 중국에서 시행된 2568명을 대상으로 한 후향적 연구에서 무증상갑상선기능저하증은 35세 이상의 여성에서 낮은 난소 예비력(ovarian reserve)과 연관이 있었다.130) 이란에서 시행된 2108 명의 여성에 대한 단면연구에서 무증상갑상선기능저하증은 불임과 연관성이 없었다.131)
불임을 동반한 무증상갑상선기능저하증의 LT4 치료 효과에 대해서는 대조군 없이 시행된 한 연구에서 TSH >4.2 mIU/L인 불임 여성 94명이 LT4 치료(25–150 μg/day)를 받은 결과, 이 중 72명이 1년 이내에 자연임신을 하였다.132) Yoshioka 등133)은 후향적 연구에서, 무증상갑상선기능저하증(TSH >3.0 mIU/L)을 가진 불임 여성에서 LT4 치료 후, 84.1%가 임신에 성공하였고 불임 기간이 단축되었다고 보고하면서, 무증상갑상선기능저하증 환자에서 LT4 치료가 수태력을 향상시킬 수 있다고 제안하였다.
보조생식술을 받지 않는 무증상갑상선기능저하증 여성에서 LT4 치료가 수태력을 향상시킬지 여부에 관한 대조군 연구는 현재까지 없다. 따라서, 보조생식술이 아닌 자연임신을 시도하는 TAb- 무증상갑상선기능저하증 여성에서 일괄적으로 LT4 치료를 권유 또는 반대할 근거는 불충분하다.
불임의 원인이 여성에게 있는 경우 TPOAb+빈도는 18%로 동 연령 대조군의 8%에 비하여 높았다.123) 그러나 중국과 이란에서 시행된 단면연구에서는 TPOAb+은 불임과 연관성이 없었다.130,131) TAb는 갑상선 자가면역을 가진 여성의 난포액에서 측정되며 혈청 항체 역가와 상관관계를 보였으며 성숙한 난자의 수정률을 감소시켰으나 임신반응 양성률이나 유산율에는 영향이 없었다.134) 다낭난소증후군이 있는 불임 여성에서 TAb+은 클로미펜 시트레이트(clomiphene citrate) 치료에 의한 반응에서 난포 발생 촉진이 감소되었다.135)
무증상갑상선기능저하증이 보조생식술 결과에 미치는 영향에 대한 과거 연구들은 대부분 기존 가이드라인에 기초하여 TSH 2.5 mIU/L를 기준으로 분류하여 진행되었다. 인공 수정(intrauterine insemination, IUI)을 시행한 여성들을 대상으로 진행된 두 개의 전향적 코호트 연구 결과를 보면, 시술 전 TSH농도가 0.4-4.99 mIU/L인 경우에는 임신 성공률과 출생률에 영향이 없었고,136) TSH <2.5 mIU/L인 경우와 TSH 2.52-3.88 mIU/L인 경우를 비교하여도 인공 수정 결과에 차이가 없었다.137)
체외수정(in vitro fertilization, IVF)을 받은 여성들에 대한 후향적 연구에서 시술 전 TSH >2.5 mIU/L인 경우에, 임신 성공률이 낮고,138) 출생 시 낮은 재태 연령과 낮은 평균 출생 체중을 보였다.139) 그러나, 여러 후향적, 전향적, 환자-대조군 연구에서는 체외수정 전 모체의 TSH가 <2.5 mIU/L인 군과 2.5-4.5 mIU/L인 군에서 두 군 간 임신 성공률, 출산율, 유산율의 차이가 없었다.140-145) 또 다른 후향적 연구에서는 시술 전 모체의 TSH ≥4.5 mIU/L인 경우에도 체외수정의 결과에 차이가 없다고 보고하였다.146) 이러한 결과를 종합하면 TSH 상승 정도에 따른 체외 수정 후 임신 결과에 대하여 아직까지 결론을 내리기는 어렵다.
무증상갑상선기능저하증의 치료가 보조생식술의 치료 성적을 향상시킨다는 2개의 무작위대조연구 결과가 보고되었다. Abdel Rahman 등147)은 무증상갑상선기능저하증 여성(TSH>4.5 mIU/L, 정상 유리 T4)에서 LT4 치료군이 비치료군에 비해 임신 성공률과(35% vs. 26%) 분만율이(10% vs. 3%) 높고, 유산율이 낮음을 보고하였다(9% vs. 13%). Kim 등148)은 무증상갑상선기능저하증 여성(TSH>4.2 mIU/L, 정상 유리 T4)에서 체외수정/세포질내정자주입(intracytoplasmic sperm injection, ICSI) 시행 전에 LT4 치료를 받은 군에서 대조군에 비해 배아의 질과 임신 성공률이 향상된다고 발표하였다. 이 2가지 무작위대조연구와 불임을 동반한 TPOAb+인 정상 갑상선기능 여성에게 LT4 치료를 시행한 연구46)를 포함한 메타분석에서도 무증상갑상선기능저하증의 LT4 치료는 분만율을 증가시켰다.149) 특히 일부 후향적 연구에서는 보조생식술 전 TSH >2.5 mIU/L인 경우 LT4 치료를 하였을 때, 임신 성공률이 증가되었다고 보고하였다.150,151)
이러한 결과를 바탕으로 2017 미국 갑상선학회 가이드라인에서는 보조생식술을 시행하는 무증상갑상선기능저하증 여성에서 TSH <2.5 mIU/L를 목표로 LT4 치료를 권고하였고,152) 2021 유럽 갑상선학회 가이드라인에서도 과배란유도(controlled ovarian hyperstimulation) 전에 무증상 혹은 현성 갑상선기능저하증 여성에서 TSH <2.5 mIU/L를 목표로 LT4 치료를 권고하고 있다.153) 이처럼 무증상갑상선기능저하증 여성에서 보조생식술 시행 전 LT4 치료는 시술 결과에 긍정적인 효과가 있으나, 정확한 TSH 목표 범위에 대한 근거는 아직까지 명확하지 않다.
치료를 받고 있는 갑상선기능저하증 여성이 갑상선 질환이 없는 여성에 비해 보조생식술 결과가 더 나쁜지에 대해서는 결론을 내리기 어렵다. 한 후향적 연구에서 LT4 치료를 하면서 TSH 0.35-4.0 mIU/L로 조절되고 있는 갑상선기능저하증 여성은 갑상선 질환이 없는 여성에 비하여 체외수정의 결과 임신 성공률이 낮았다.154) 그러나, 다른 환자-대조군 연구에서 LT4 치료를 받아 갑상선호르몬이 정상 범위로 유지되고 있는 갑상선기능저하증 여성은(평균 TSH 1.6±0.7 mIU/L) 대조군과 비교하여 체외수정과 세포질내정자주입 결과에 차이가 없었다.155) 또 다른 연구에서는 과배란유도 전 TSH>2.5 mIU/L인 여성에서 LT4 치료를 시작하여 평균 TSH 1.43±0.69 mIU/L로 조절되고 있는 경우 정상 갑상선기능 환자와 비교 시 보조생식술 결과는 차이가 없었다.156)
TAb 유무가 보조생식술에 미치는 영향에 대한 연구 결과는 다양하다. Zhong 등157)은 TAb+ 여성이 보조생식술을 받으면 착상률과 임신성공률이 낮고, 유산위험은 더 높다고 발표하였다. 그러나 이 연구에서는 TSH를 포함한 갑상선기능을 측정하지 않아 결과 해석이 제한적이다.
Chai 등146)은 후향적으로 TAb 유무와 갑상선기능이 체외수정결과에 영향을 주는지 분석하였고, 그 결과 TAb 유무와 갑상선기능은 체외수정 후 임신성공률과 출산율, 그리고 유산율에 영향을 주지 않았다. 그 외에도 여러 연구에서 TAb+이면서 갑상선기능이 정상인 여성에서는 보조생식술의 결과에 차이가 없었다.158-160)
반면, 4개의 전향적 연구를 포함한 메타분석 결과에서는 갑상선기능이 정상인 여성에서 TAb+인 경우 보조생식술 시행 후 유산의 위험이 높다고 보고하였다(risk ratio 1.99, 95% CI 1.42-2.79).161) 특히 Inagaki 등162)은 세포질내 정자 직접 주입술을 시행한 경우에는 TPOAb+와 유산율은 연관성이 없고, 체외수정을 한 경우에는 TPOAb 역가가 높을수록 유산위험이 증가한다고 하였으나, 다양한 갑상선기능을 가진 환자들이 포함되어 있어서 해석에 주의해야 한다.162) 즉, TAb+인 여성의 보조생식술의 치료성적은 갑상선기능과 종합적으로 고려하여야 한다.
TAb+인 정상 갑상선기능을 가진 여성에서 LT4 복용이 보조생식술 결과를 향상시킨다는 근거는 아직까지 부족하다. 한 전향적 연구에서 TPOAb+인 정상 갑상선기능 여성에서 LT4 치료가 보조생식술 결과에 미치는 영향에 대해 분석한 결과, LT4 치료는 임신성공률과 유산율에 영향을 주지 않았다.163) 다른 후향적 연구에서는 TAb+인 정상 갑상선기능을 가진 여성에서 LT4 치료를 하였을 때, 치료를 하지 않은 경우에 비해 과배란유도는 더 좋은 반응을 보였으나, 체외수정 결과는 차이가 없었다. 그러나 LT4, acetylsalicylic acid, prednisolone을 모두 사용한 경우에는 보조생식술 결과가 향상되었다.164)
보조생식술에서 과배란유도는 중요한 과정으로, 생식선자극호르몬(gonadotrophins)과 생식선자극호르몬분비호르몬 유사체(gonadotrophin-releasing hormone analogue) 혹은 생식선자극호르몬분비호르몬 길항제(gonadotrophin- releasing hormone antagonists) 조합을 이용한다. 난포 성장을 초음파로 추적 관찰하다 난포가 충분히 커지면 성숙한 난모세포를 생산하기 위하여 hCG를 투여한다.
이와 같은 인위적인 과배란은 혈중 에스트라디올 농도를 생리학적 농도(4000-6000 ng/L) 이상으로 증가시키므로165) 갑상선기능을 변화시킬 수 있다. 에스트로겐이 증가되면 TBG가 증가되어166) 유리 T4 농도가 낮아지면서 2차적으로 TSH가 올라갈 수 있다. 반면 hCG는 TSH 수용체에 결합하여 유리 T4를 증가시키므로 TSH가 낮아질 수 있다. 그러나, 실제 연구들에서 과배란이 갑상선기능에 미치는 영향은 일치하는 결과를 보여주지 못하였다.166-171)
과배란유도 시, 갑상선기능저하증으로 치료를 받는 중이거나, TPOAb+인 여성에서 TSH 증가가 더 두드러지게 나타났다.166,172,173) 반면 갑상선기능이 정상이고, TPOAb-인 여성에서는 TSH 증가가 미약하였다.167,169) 이러한 연구 결과들을 근거로 2021년 발표된 유럽 갑상선학회 가이드라인에서는 갑상선기능저하증으로 LT4 치료 중이거나 TAb+인 여성에게 과배란유도를 하면 갑상선기능저하증으로 진행할 가능성이 높기 때문에, 과배란유도 후 갑상선기능검사를 하도록 권고한다. 반면에, TAb- 정상 갑상선기능 환자에서는 과배란유도 후 갑상선기능검사를 권고하지 않는다.
특히, 유럽 갑상선학회에서는 갑상선기능저하증으로 치료 중이거나, TAb+이면서 TSH 4.0 mIU/L 이상인 경우에는 과배란유도 전 TSH농도를 2.5 mIU/L 미만이 되도록 미리 LT4 치료를 하고, TAb+이면서 TSH 2.5-4.0 mIU/L인 경우는 저용량의 LT4 치료를 하도록 권고한다. TAb- 이면서 TSH 4.0 mIU/L 이상인 경우에도 LT4 치료를 권고하나 구체적인 TSH 목표범위를 제시하고 있지는 않다.153) 반면에, 미국 갑상선학회 가이드라인에서는 과배란유도 전 갑상선기능저하증 치료 병력, TAb 존재 유무, TSH 범위에 따른 구체적인 권고사항을 제시하고 있지 않다.152)
임신 중 현성 갑상선기능저하증은 TSH의 증가(>4.0 mIU/L)가 유리 T4의 감소와 동반된 경우로 정의한다. TSH가 4.0-10.0 mIU/L이지만 유리 T4가 정상인 경우에는 무증상갑상선기능저하증으로 분류하며, TSH가 10.0 mIU/L 이상이면 유리 T4 농도에 관계없이 현성 갑상선기능저하증으로 분류한다. 기관별 임신 분기별 TSH 참고 범위가 있다면, 이에 따라 진단할 수도 있다. 임신 분기별 TSH 참고 범위는 요오드 섭취가 적절히 이루어지고 갑상선 질환이 없는 건강한 TPOAb-임신부들을 대상으로 유사한 측정 방법을 이용하여 TSH를 측정한 결과를 바탕으로 정의하여야 한다.
저티록신혈증은 TSH는 정상범위이지만 유리 T4치가 정상 범위의 2.5 또는 5 퍼센타일(percentile)보다 낮은 경우로 정의된다. 임신 중 저티록신혈증이 중요한 이유는 생리적으로 TBG의 증가로 인해 유리 T4 농도가 감소되는데, 유리 T4의 감소가 주산기 문제와 연관될 수 있기 때문이다.
임신 중 갑상선기능저하증은 태아의 신경인지 발달에 나쁜 영향을 줄 뿐 아니라, 임신합병증의 증가와 관련성이 있다고 알려져 있다.174,175) 임신부의 갑상선기능저하증은 조산, 저체중아, 유산의 위험과 연관이 있고, 실제 갑상선기능저하증 임신부에서 태어난 신생아들이 신생아 중환자실에 입원하여 치료받는 경우가 많았다.176) Abalovich 등177)은 갑상선기능저하증이 적절하게 진단되거나 치료되지 않은 경우 60%에서 유산의 위험이 있다고 보고하였다. Leung 등178)은 갑상선기능저하증 임신부에서 임신성 고혈압의 위험성이 22%이며, 이는 정상 갑상선기능 또는 무증상갑상선기능저하증 여성에 비해 높음을 확인하였다. Allan 등179)도 갑상선기능저하증 임신부에서 태아 사망의 위험이 증가한다고 보고하였다. 즉, 갑상선기능저하증은 모체 및 태아에 위험을 초래할 수 있다.
현성 갑상선기능저하증과 달리, 무증상갑상선기능저하증이 유산, 조산, 임신합병증의 발생과 태아의 발달 과정 중 신경인지결손에 미치는 영향에 대한 연구결과는 다양하다. 특히 기존 연구들은 현성 갑상선기능저하증과 무증상갑상선기능저하증이 함께 포함되어 있거나, TSH 기준치가 달랐다.
Negro 등180)은 TSH 2.5 mIU/L를 기준으로 무증상갑상선기능저하증을 정의하고, TPOAb+이면서 TSH가 2.5 mIU/L보다 높은 임신부에서 LT4 치료군과 비치료군을 직접 비교한 결과 LT4 치료군에서 임신합병증이 유의하게 감소함을 확인하였다. 후속 연구에서는 TPOAb-인 임신부들도 TSH가 2.5-5.0 mIU/L이면 2.5 mIU/L 미만인 경우에 비하여 유산율이 높아짐을 보고하였다(6.1% vs. 3.6%, p=0.006).181) 다른 연구에서는 특정 TSH를 기준으로 제시하지 않았으나, 모체의 TSH가 높은 경우 임신 관련 합병증 및 유산의 위험성이 증가됨을 보고하였다.182-184) 그러나 일부 연구는 무증상갑상선기능저하증은 임신의 결과에 나쁜 영향을 미치지 않는다고 보고하고 있다.100,185,186) 그러나, 이 연구들은 전체 연구 대상 중 일부만 분석에 포함시켰기 때문에, 결과 해석에 제한점이 있다.
무증상갑상선기능저하증과 조산의 관련성을 조사한 Generation R 연구에서는, TSH>4.0 mIU/L일 때 37주 미만의 조산의 위험이 1.9배, 34주 미만의 조산 위험이 2.5배 증가하였다. 그러나 이 결과는 TPOAb+인 경우나 동반질환을 있는 여성을 제외하면 유의한 차이가 없었다.99) 또한 메타분석 결과, 각 연구의 연구 디자인, TSH 참고 범위, 평가변수가 달랐으나, 대부분의 연구에서 임신부의 혈청 TSH 농도가 높은 경우 임신 특이 합병증(조산, 태반박리, 유산 등)의 발생 위험이 높다고 보고하였다.187) 임신부의 TSH농도 상승과 자간전증 및 고혈압 질환 발생에 관해서는 무증상갑상선기능저하증이 자간전증 발생 위험을 증가시킨다는 결과188,189)와 연관이 없다는 결과가 상충되어179,185,186) 아직 결론을 내리기 어렵다.
무증상갑상선기능저하증이 태아의 인지발달에 나쁜 영향을 미치는지는 아직 확실하지 않다. 출생 코호트 연구들의 메타분석에서 임신 중 무증상갑상선기능저하증 여성에서 태어난 아이들은 지능저하, 주의력 결핍 과잉 행동 장애 및 자폐 스펙트럼 장애가 증가되는 결과를 보였다.190)
그러나 최근 발표된 Controlled Antenatal Thyroid Screening trials (CATS) 연구에서 무증상갑상선기능저하증이거나 저티록신혈증이면서 치료받지 않은 임신부에서 태어난 아이와 치료를 받은 임신부에서 태어난 아이들이 3세가 되었을 때의 IQ를 비교한 결과, 평균 IQ는 두 군 간 차이가 없었고(100.0 vs. 99.2, p=0.40), IQ가 85미만인 아이의 비율도 두 군 간 차이가 없었다(14.1% vs. 12.1%, p=0.39).191)
저티록신혈증이 태아성장에 나쁜 영향을 주는지에 대해서는 논란이 많다. Pop 등196)은 유리 T4지수가 10 percentile 미만이었으나 혈청 TSH는 정상인 여성에서 태어난 아이들은 정신운동(psychomotor) 검사 점수가 저하된다고 보고하였다. Li 등112)도 임신 1분기에 갑상선기능저하증이나 저티록신혈증이 있었던 임신부에서 태어난 아이들에서 비슷한 지능지수의 감소를 관찰하였다. 이후에 진행되었던 여러 전향적 비무작위연구에서도 저티록신혈증 임신부에서 태어난 아이들에서 낮은 IQ, 언어 지연, 운동기능 장애, 작은 머리 둘레, 그리고 자폐증 등의 위험이 더 높은 것으로 나타났다.99,106,185,197-201) 저티록신혈증이 임신의 결과에 미치는 영향에 대한 연구는 아직 부족한데, 현재까지 진행된 연구 결과로는 저티록신혈증 임신부에서 태어난 태아가 출생 체중이 더 크고,202) 조산의 위험이 높았다.99) 그러나 이 연구들은 인종 및 요오드 섭취량이 다양한 집단에서 이루어진 결과로, 일반화하기에는 제한점이 있다. 또한, 일부 연구에서는 임신 1,2 분기의 저티록신혈증은 임신에 부정적인 영향을 주지 않는다고 보고하기도 하였다.203-206)
임신 중 갑상선기능저하증에 의해 여러 합병증이 발생할 수 있으며, 이들 합병증을 예방하기 위해서는 LT4 치료로 갑상선기능을 정상화해야 한다. 치료의 이득이 명확하므로 이들에 대한 대규모 무작위배정연구는 시행되지 않았다.
다만 Turunen 등207)은 임신 중 갑상선기능저하증은 임신성 당뇨병, 임신성 고혈압, 심한 임신중독증, 제왕절개술, 조산, 거대아, 기형아 그리고 태아의 중환자실 입원의 위험성을 높이지만, 갑상선호르몬 보충치료가 임신성 당뇨병, 제왕절개, 거대아, 태아의 중환자실 입원을 제외한 나머지 합병증에 대해서는 위험을 감소시키는 효과가 있음을 보고하였다.
Maraka 등28)이 무증상갑상선기능저하증(TSH 2.5-10.0 mIU/L) 임신부 5405명을 LT4 치료 여부에 따라 후향적으로 분석한 결과, 중앙값 28.7주에 LT4 치료군에서 유산의 위험이 38% 낮았고(OR 0.62; 95% CI 0.48-0.82), 무증상갑상선기능저하 특히 TSH농도가 4.1-10.0 mIU/L인 경우 LT4 치료는 유산을 55% 감소시켰다. 반면 조산의 위험은 LT4 치료군에서 60% 높았고(OR 1.6; 05% CI: 1.14-2.24), 조기 진통이나 조기 양막 파열, 태반 조기 박리는 비치료군과 통계적 차이가 없었다. 임신성 당뇨병 위험은 LT4 치료군에서 37% 높았고(OR: 1.37, 95% CI: 1.05-1.79). 임신성 고혈압 위험에는 차이가 없었으나, LT4 치료군에서 자간전증 위험이 61% (OR 1.61; 95% CI 1.10-2.37), 심박수 증가 위험이 77% (OR 1.77, 95% CI 1.0-3.11) 더 높았다.
Nazarpour 등92)은 TPOAb+인 무증상갑상선기능저하증(TSH 2.5-10 mIU/L) 임신부 131명을 LT4 치료군과 비치료군으로 무작위 배정한 전향적 연구의 결과를 보고하였다. LT4 치료군의 66%에서 LT4 투여를 12주 내에 시작하였고, 나머지 34%도 20주 내에 시작하였다. LT4 치료군은 비치료군에 비해 조산의 위험은 70% 감소되었고(RR 0.3, 95% CI 0.1-0.85), 신생아실 입원 위험도는 83% 감소되었다(RR 0.17, 95% CI 0.04-0.73). 이 효과는 TSH 4.0 mIU/L 이상일 때 두드러졌다. 그러나 유산이나 태반 조기 박리, 사산의 위험에서는 통계적 차이를 보이지 않았고, 태아의 키, 체중, 머리 둘레의 차이도 없었다.
Nazarpour 등29)은 TPOAb- 이고 TSH 2.5 mIU/L 이상인 임신부 366명에 대한 또 다른 무작위배정 연구에서 LT4 치료의 효과를 비교하였는데, TSH의 기준을 2.5 mIU/L로 하였을 때에는 조산의 위험에 뚜렷한 차이를 보이지 않았으나, 4.0 mIU/L으로 하였을 때에는 LT4 치료가 조산의 위험을 61% 감소시켰다(RR 0.38, 95% CI 0.15-0.98).
반면, Casey 등192)은 TSH 4.0 mIU/L 이상인 무증상갑상선기능저하증 혹은 유리 T4 0.86 ng/dL 미만인 저티록신혈증 임신부들을 LT4군 혹은 대조군으로 무작위로 배정하여 LT4 치료가 임신 및 태아의 발달에 미치는 영향을 평가하였다. LT4 치료는 무증상갑상선기능저하증 임신부에서는 평균 16주에, 저티록신혈증 임신부에서는 17-18주에 시작되었다. 모체 및 태아에 대한 갑상선기능 이상으로 인한 부작용에 대하여 LT4 치료로 인한 차이가 나타나지 않았고, 태아의 지능 및 발달에 대한 지표를 생후 60개월까지 확인하였을 때에도 LT4 치료로 인한 차이는 나타나지 않았다(Table 3).
CATS 연구에서 무증상갑상선기능저하증 혹은 저티록신혈증이면서 치료받지 않은 임신부에서 태어난 아이와 LT4 치료를 받은 임신부에서 태어난 아이들의 3세 때 IQ를 비교한 결과, 평균 IQ는 두 군 간에 차이가 없었고(100.0 vs. 99.2, p=0.40), IQ가 85 미만인 아이의 비율도 두 군 간에 차이가 없었다(14.1% vs. 12.1%, p=0.39).191) 또한 최근 Casey 등192)이 시행한 연구에서도 저티록신혈증 임신부에서 LT4 치료가 임신 및 태아와 발달에 미치는 효과가 없는 것으로 나타났다.
저티록신혈증이 임신 결과 및 태아 성장에 미치는 영향에 대해 LT4 치료가 위험을 낮추어 줄 수 있는지에 대해서는 아직 논란이 있어서 권장되지 않는다.
LT4 + LT3 병용 요법은 생리적 비율 이상의 과도한 T3가 투여됨으로 인해 TSH농도가 정상범위로 맞춰지면 혈중 T4는 오히려 감소하게 된다. 이 때 태아의 중추신경 내의 T3는 모체의 T4에 의존하기 때문에, 모체의 낮은 T4는 태아의 지적 발달에 지연을 일으킬 위험성이 있다.152)
Glinoer 등45)은 TPOAb가 양성이면서 정상 갑상선기능 여성에서 임신 전과 임신 초기에 갑상선기능을 평가한 전향적인 연구에서, 임신 중 TPOAb 역가의 감소에도 불구하고, 40%가 TSH >3.0 mIU/L, 16%는 TSH >4.0 mIU/L으로 상승됨을 관찰하였다.
Negro 등46)도 전향적 연구에서 유사한 결과를 발표하였는데, TPOAb+인 정상 갑상선기능 여성에서 임신이 진행되는 동안 TSH농도가 임신 12주에 평균 1.7 mIU/L에서 분만 시 평균 3.5 mIU/L로 점진적으로 증가되며, 분만 시 정상보다 높은 TSH농도를 보이는 여성이 19%에 이르는 것을 관찰하였다. 이러한 결과는 임신기간 중에 갑상선호르몬의 요구량이 증가된다는 것을 확인한 것이다. TPOAb+인 여성은 임신 중 갑상선호르몬의 생산 증가에 문제가 발생하여 공급이 요구량을 따라가지 못하여 현성 및 무증상갑상선기능저하증이 발생할 수 있다.
요약하면, TAb+ 환자는 일부 잔여 갑상선기능이 남아 있어 임신 1분기에는 완충작용을 할 수 있으나, 임신말기에는 갑상선기능저하증이 될 가능성이 높아진다.
마찬가지로 갑상선 부분절제술을 받거나 그레이브스병으로 방사성요오드 치료를 받은 후 정상 갑상선기능으로 유지되던 여성의 경우에도 임신 후에는 갑상선기능저하증이 발생할 위험성이 있다. 그러므로 이러한 여성들은 정기적인 갑상선기능검사가 필요하다.
임신 중 체내에서 요구되는 T4의 총량은 고정되어 있지 않은데, 정상 갑상선 상태를 유지하기 위해서 체내 T4 pool은 40-50% 증가되어야 한다.208,209) 건강한 여성이 임신을 하면 시상하부-뇌하수체-갑상선 축은 모체와 태아를 위한 T4 pool을 높이기 위해 자가조절을 한다. 또한 임신 1분기에는 hCG가 모체의 갑상선호르몬의 자극에 중요한 역할을 한다. 태반 hCG와 뇌하수체 TSH는 정상 갑상선이 있을 때 체내에서 T4 (및 T3) 생산을 자극하고, 임신기간 동안 정상 갑상선기능 상태를 유지한다. 그러나 갑상선기능저하증 여성에서는 hCG와 TSH의 자극에 따라 T4 생산을 증가시키지 못한다. 따라서 외부에서 투여되는 LT4의 용량을 조절하지 않으면, 임신이 진행됨에 따라 증가되는 수요가 공급을 능가하여 갑상선기능저하증이 발생된다. LT4 요구량은 임신 초기 4-6주부터 증가되기 시작하여208) 임신 16-20주까지는 점차 증가하다가, 이후에는 더 이상 증가하지 않고 출산 시까지 유지된다. TSH와는 별도로, 모체의 에스트로겐 농도 변화가 임신 중 정상 갑상선기능을 유지하는 데 필요한 LT4의 증량 정도에 영향을 줄 수 있다.208)
LT4 치료를 받고 있던 갑상선기능저하증 여성의 50- 85%는 임신 중에 LT4 투여량을 증량해야 한다.177,208,209) LT4 증가량은 갑상선기능저하증의 원인에 따라 영향을 받는데, 하시모토 갑상선염 환자에 비하여 기능을 하는 정상 갑상선 조직이 없는 환자(방사성요오드 절제술[radioactive iodine ablation], 갑상선 전절제술 등을 받은 경우)에서 LT4 증가량이 더 크다.210,211)
임신 시 갑상선기능저하증이 될 위험을 줄이기 위해 임신이 확인되면 가능한 한 빨리 LT4 용량을 조절하여 임신 기간 동안 TSH를 정상으로 유지하여야 한다. 전향적인 무작위연구에서 LT4 치료 중에 임신한 여성에 대해 1회 용량(one dose) 조절 방법이 제안되었다.212) 즉 1일 1회 투여로 정상 갑상선기능이었던 여성에서 1주일에 2번 1회 용량을 더 추가하여 2배로 복용하는 것이다(즉, 매일 1알씩 복용하고 있었다면 1주일에 2일은 2알씩 복용하여 1주일에 총9알을 복용: 29% 증가). 이것은 임신 시 생리적인 갑상선호르몬 생산 증가량과 유사하여 임신 1분기에 갑상선기능저하증이 발생하는 것을 예방할 수 있다. 따라서 월경을 건너뛰거나 임신이 의심되면 이러한 방식의 용량증가가 즉시 이루어져야 하며, 갑상선기능검사도 동시에 이루어져야 한다. 다른 방법은 매일 복용하는 LT4의 용량을 약 25-30% 정도 증량하는 것이다.
임신 후 TSH를 빨리 정상화 시키는 것은 어려우므로 임신 전에 TSH를 조절하는 것이 권장된다. 임신을 계획 중인 여성에서 TSH 목표치는 1.2 mIU/L 미만부터 2.5 mIU/L 미만까지 다양한 주장이 있었다.213,214) 일부에서는 임신 전 TSH가 보다 낮아야 한다고 주장하는데, 이렇게 낮게 유지한 경우 오직 17%만이 임신 중에 LT4 용량 증가가 필요하였다는 연구가 있다.214) 이러한 결과들을 감안하더라도, LT4를 복용 중인 갑상선기능저하증 여성은 임신 전에 용량을 조절하여 혈청 TSH를 2.5 mIU/L 이하로 낮추는 것이 합리적이다. TSH농도를 비임신 정상 범위의 하한치까지 낮추는 치료는 TSH농도가 정상 하한치 아래로 낮아질 위험을 초래하고, 이런 경우 수태 또는 착상에 영향을 미칠 가능성이 있다.
임신 전 갑상선기능저하증이 있어 LT4를 복용하고 있었던 경우 임신 중 갑상선호르몬 요구량 증가로 LT4 용량을 증량했더라도 출산 후에는 임신 전 수준으로 감량하고, 6주 뒤 TSH를 측정하여 평가한다. 그러나, 최근 연구에서 하시모토 갑상선염 여성의 50% 이상에서 출산 후 LT4 투여량이 임신 전보다 증가되었는데, 이것은 산후 자가면역질환의 악화 때문으로 분석되었다.215)
무증상갑상선기능저하증으로 LT4 복용을 시작한 경우에는 출산 후에 LT4를 중단해 보고 출산 후 6주째에 갑상선기능 검사를 시행하여 LT4 처방 여부를 결정한다. 이때 정상 갑상선기능이더라도 6개월에서 1년 후에 갑상선기능 검사를 시행해 추적 관찰하는 것이 필요하다. 한 후향적 코호트 연구에서 TSH 4.0 mIU/L 이상의 무증상갑상선기능저하증으로 LT4치료를 시작한 임신부를 대상으로 산후에 LT4를 중단하고 관찰한 결과 6주째에 34.1%에서 갑상선기능저하증이 확인되었고, 13.4%의 임신부가 다시 LT4 복용을 시작하였다고 보고하였다.216)
갑상선중독증은 혈액 중에 갑상선호르몬(T4, T3)이 증가되어 대사항진과 과다활동 등의 임상증상을 나타내는 상태이다.217) 임신 중 갑상선중독증의 자가면역성 원인 질환으로 가장 흔한 것은 그레이브스병으로 발생빈도는 전체 임신의 0.1-1% (불현성 0.6%, 현성 0.4%)로 알려져 있다.218,219) 그레이브스병은 임신 중 처음 진단되기도 하고, 과거에 갑상선기능항진증의 병력을 가지고 있던 여성에서 임신 중 재발되기도 한다. 그레이브스병 외에 중독성 다발성결절 및 단일결절, 갑상선호르몬 과다투여로 인한 의인성 갑상선중독증, 갑상선암 전이에 의한 갑상선기능항진증 등 비자가면역성 질환들도 드문 원인이 될 수 있다. 아급성갑상선염이나 무통성갑상선염, 난소갑상선종(struma ovarii)은 드물다.
실제 임신 중 갑상선중독증의 가장 흔한 원인은 일과성 임신성 갑상선기능항진증(gestational transient hyper-thyroidism, GTT)이다. 이는 임신 전반기에 일과성으로 TSH 감소, 유리 T4증가를 보이면서 자가면역 질환과 연관된 혈액지표들은 나타나지 않는 상태를 일컫는다. 전체 임신의 1-3%에서 진단되는데, 임신 초기에 주로 나타나며 후기까지 지속되는 경우는 적고 임신 중 합병증을 일으키는 경우도 적다.220-222) 발생빈도는 지역적 요인 및 hCG의 자극 정도에 따라 다르며, 임신 초기에 나타나 극심한 구토를 동반하면서 심한 경우 체중감소, 탈수, 케톤뇨 등을 동반하는 임신입덧(hyperemesis gravidarum)과도 연관된 것으로 생각되고 있다.223) 임신입덧은 1000명의 임신부 중 0.5-10명꼴로 발생한다.224,225) 그 외에 hCG에 의해 유발된 갑상선중독증의 원인으로 다태아, 포상기태, 융모막암종 등이 있으며 TSH 수용체 변이와 연관된 hCG 과민성도 임신 중 갑상선중독증의 드문 원인 중 하나이다.226-228)
임신부에서 혈중 TSH의 농도가 저하되어 있고 유리 T4농도가 증가된 상태라면, 대개 원인질환은 그레이브스병 또는 GTT 중 하나이다.223,229) 두 질환 모두 심계항진, 불안, 손떨림, 더위를 못 참는 등 갑상선중독증의 증상을 보이므로, 감별을 위해서는 주의 깊은 병력 청취와 진찰이 중요하다.
과거에 갑상선질환을 앓은 병력이 없고, 그레이브스병의 임상소견(갑상선종, 그레이브스 안병증 등)이 없으면 GTT의 가능성이 높으며, 임상소견만으로 진단이 모호한 경우에는 항갑상선자극호르몬수용체항체(TRAb)의 역가를 측정하여 양성이면 그레이브스병으로 진단할 수 있다. 결절성 갑상선종이 동반되었다면 혈중 총 T3 농도의 증가를 확인함으로써 T3 갑상선중독증(T3 thyroto-xicosis) 여부를 확인할 수 있다. 그레이브스병으로 인한 T3 갑상선중독증의 진단에도 혈중 총 T3 농도를 측정하는 것이 유용하다. 갑상선초음파검사가 임신 중 갑상선항진증의 감별진단에 도움이 된다는 증거는 부족하나, 결절이 의심되는 경우에는 시행해 볼 수 있다.
GTT를 치료할 것인가의 여부는 증상의 심한 정도에 따라 결정한다. 임신입덧이 동반될 경우 구토증상을 완화시키고 수액공급을 통해 탈수를 교정하는 것이 일반적인 치료이다. 임신입덧이 심한 경우에는 자주 내원하여 탈수와 전해질 불균형을 교정하는 것이 필요하며, 때로 입원이 필요한 경우도 있다.
대개 항갑상선제는 처방하지 않는데, 그 이유는 대부분의 경우 임신 14-18주 경이면 혈중 갑상선호르몬이 정상으로 돌아오기 때문이다. GTT를 항갑상선제로 치료했던 증례에서 산과적 임상 경과가 호전되지 않았다는 보고가 있으며,230) 항갑상선제 치료와 지지요법을 비교한 연구는 아직 시행된 바 없다. 갑상선중독증의 증상에 대한 치료가 필요할 경우에는 소량의 베타차단제를 사용해볼 수 있으며, 처방 이후 주의 깊게 관찰하면서 원인을 감별하기 위한 검사를 시행한다.
그레이브스병으로 치료 중인 여성에서 임신의 적기는 갑상선기능이 정상으로 회복된 이후이다. 정상 갑상선기능은 적어도 1개월간 치료 방침의 변화 없이 갑상선기능이 2회 이상 정상범위 안에 있을 때를 말한다.152) 현재 갑상선기능항진증을 앓고 있거나 과거에 앓았던 병력을 가진 모든 여성에서 임신 전 상담이 필수적이며, 갑상선기능항진증이 조절되기 전까지는 피임을 권고한다. 임신 시도 전 갑상선기능의 정상화를 위해, 방사성요오드 치료, 수술 등의 갑상선제거술이나 항갑상선제 치료를 할 수 있다. 각 치료의 장단점을 환자에게 설명하고 의논한 이후에 환자가 선호하거나 적절하다고 판단되는 치료를 선택할 수 있다(Table 4).
1) 갑상선제거술(방사성요오드 치료 또는 수술)을 원할 때 주의점
첫째, 갑상선기능항진증이 심하거나 TRAb의 역가가 증가되어 있는데, 빠른 임신을 원하는 경우에는 수술이 바람직하다. 이유는, 방사성요오드 치료 후에도 TRAb의 역가가 증가하여 수개월간 지속되는 경향이 있기 때문이다.231) 또한, 심한 갑상선기능항진증 환자의 경우에는 방사성요오드 치료 후에도 지속적으로 항갑상선제 치료가 필요할 수 있다.232,233) 방사성요오드 치료 48시간 전에 임신반응검사를 실시하여, 혹시 모를 임신 상태에서 태아가 방사성요오드에 노출되는 일이 없도록 해야 한다. 방사성요오드 치료 후에는 6개월 동안 피임을 권하며, 정상 갑상선기능을 유지하기 위하여 갑상선호르몬 투여가 필요할 수도 있다.
2) 항갑상선제 치료를 원할 때 주의점
첫째, 프로필티오우라실(prophylthiouracil, PTU)과 메티마졸(methimazole, MMI)의 부작용에 관하여 반드시 설명하고 환자와 상의하도록 한다. 둘째, 소량의 항갑상선제로 갑상선기능이 정상적으로 유지되는 경우에는 가능한 임신 초기에 약제를 중단한다. 셋째, 임신 초기에 항갑상선제 치료가 필요한 경우에는 태아에 미치는 영향을 고려하여 PTU를 처방하도록 한다. 넷째, 임신이 확인되기 전에 미리 MMI를 PTU로 교체하는 것에 대해서는 아직 근거가 부족하다.
몇몇 연구에 의하면 임신 중 갑상선기능항진증의 조절 정도와 정상 갑상선기능으로 유지된 기간 등이 모체 및 태아의 각종 합병증과 연관이 있었다.234-236) 갑상선기능항진증이 제대로 조절되지 않았던 경우에는 유산, 임신고혈압, 미숙아, 저체중아, 자궁내 성장제한, 사산, 갑상선중독위기, 임신부의 울혈성 심부전 등의 위험이 있다.237,238) 또한, 임신부의 갑상선기능항진증이 조절되지 않을 경우 태아의 신경계 발달에도 영향을 주어 주의력결핍장애, 경련, 자폐증 등의 위험이 증가한다.239-241) 그렇기에 임신 중 갑상선기능항진증의 적절한 치료는 반드시 필요하다.
임신 중 갑상선기능항진증의 치료는 항갑상선제가 주축을 이룬다.242) 항갑상선제는 요오드의 유기화과정 및 요오드타이로신의 연결과정을 억제함으로써, 갑상선호르몬의 합성을 억제한다. 항갑상선제의 부작용은 약 3-5%의 환자에서 나타나는데, 대개는 피부발진 등의 알레르기 반응이다.242) 반면에 무과립증은 0.15%, 간부전은 0.1% 이하로 매우 낮으며 임신부에서도 높지 않다.243) 대부분 약물복용 초기 또는 중단했다가 다시 사용할 때 나타난다. 2010년 미국 FDA가 PTU에 의한 간독성에 대한 주의를 발표하면서, 임신 초기 외에는 PTU의 사용을 가능한 자제할 것을 권고하였다.244,245) 단, MMI에 알레르기성 부작용이 있거나 갑상선중독위기의 치료에서는 PTU를 사용할 수 있다. 실제로 PTU와 연관된 간독성은 사용기간 중 어느 때나 나타날 수 있으므로 정기적으로 간기능검사를 실시하여 정상 여부를 확인하는 것이 필요하다. 하지만 간효소치의 변화를 감시하는 것이 PTU에 의한 전격성간염을 예방하는데 얼마나 유용한 지에 대한 연구자료는 아직 없다.
임신 중 항갑상선제를 사용하는데 있어 가장 큰 우려는 이들 약제가 태아의 기형을 유발할 가능성이 있는지 여부이다. MMI를 복용한 임신부 중 일부에서 메티마졸 배아병증(MMI embryopathy), 즉, 피부무형성증(aplasia cutis), 식도 및 후비공 폐쇄(esophageal and choanal atresia), 안면 이형성증(dysmorphic facies) 등이 보고되었다.246-248) PTU는 임신기간에는 안전하게 사용할 수 있다고 알려져 있었으나 최근 연구에서는 PTU도 태아 기형을 증가시킬 수 있는 것으로 알려졌으며,249) 임신 초기 노출 시에는 정상 임신부에 비해 1000명 당 8건의 태아기형이 증가하는 것으로 보고되었다.250) 그러나 그레이브스병을 앓고 있는 임신부를 대조군으로 비교하였을 때에는 PTU의 사용이 태아기형을 증가시키지 않았고, MMI에 비해 기형의 빈도도 적고 중증도도 낮아 상대적으로 안전하였다.249,251-254) 갑상선기능항진증이 조절되지 않았을 때의 위험도를 고려하면, 임신 중 PTU의 사용을 주저할 필요는 없다.
저용량 항갑상선제(MMI <10 mg/day, PTU <100 mg/day)로 정상 갑상선기능을 유지하고 있는 환자에서 새롭게 임신이 확인되었을 경우, 재발 위험이 높지 않다고 판단된다면 항갑상선제를 중단하고 관찰할 수 있다.255,256) 항갑상선제 중단 후 갑상선기능항진증이 재발하거나 악화되는 위험인자는 환자마다 다양하다. 항갑상선제 치료 기간이 짧거나(6개월 미만), TSH가 지속적으로 억제되었던 경우, MMI 5-10 mg 이상 사용해야 정상 갑상선기능을 유지하는 경우, 갑상선안병증이 동반된 경우, 갑상선종이 큰 경우, TRAb가 높은 경우257) 등이 재발가능성이 높다고 알려져 있다. 항갑상선제의 중단은 가능하면 임신초기(6-10주)에 하는 것이 좋으며,255,256) 중단한 초기에는 2-4주마다 경과를 관찰하여 갑상선기능항진증의 재발 여부를 확인한다. 이후 재발 소견이 없으면 임신 중기 이후에는 4-8주로 관찰 간격을 늘릴 수 있다. 임신 초기(6-10주) 이내에 약물을 중단하는 것이 효과적이기 때문에 항갑상선제를 복용하던 여성이 예상 생리날짜를 지나게 되면 바로 임신 테스트기를 사용하는 것이 좋다.152) 임신 반응이 양성일 경우 담당 의료진과 항갑상선제의 중단 및 조절, 추후 방침에 대해 의논하여야 한다.
만약, 항갑상선제 치료가 지속적으로 필요하다면 MMI보다는 PTU를 선택하는 것이 좋다. 이유는 MMI가 더 중증의 태아기형을 유발하기 때문이다. MMI를 복용 중인 환자는 임신 초기에는 PTU로 전환하도록 한다. 임신 16주 이후에도 항갑상선제 사용이 필요한 경우 PTU를 계속 사용할지 MMI로 교체할 지에 대해서는 아직 분명하지 않다.
임신 중 항갑상선제 처방 시 초기 용량은 갑상선기능항진증의 심한 정도에 따라 결정하는데, 대체로 일일 용량 MMI 5-20 mg, carbimazole 5-15 mg, PTU 50-300 mg으로 시작하지만 일반적인 시작 용량 보다는 적게 필요할 수 있음을 고려하여야 한다.153) 동일 효과를 나타내기 위해서는 PTU와 MMI의 용량 비율을 20:1 (100 mg PTU= 5 mg MMI)로,258) carbimazole과 MMI는 10:8로 맞춘다.
대사항진에 따른 증상을 조절하기 위하여 베타차단제를 처방할 수 있으며(매 6-12시간마다 propranolol 10-40 mg), 증상이 좋아지는 대로 용량을 줄이면서 중단하도록 한다. 대개의 경우 2-6주 이내에 투약을 중단할 수 있으며, 베타차단제를 장기간 사용하는 경우에는 자궁내 성장제한, 태아 서맥, 신생아 저혈당 등을 초래될 수 있으므로 주의를 요한다.259) MMI와 베타차단제를 함께 복용한 경우, MMI만 단독으로 복용한 경우에 비해 유산될 위험이 높다는 연구결과가 보고된 바 있지만, 그것이 약제에 의한 것인지 질환 자체의 심한 정도에 의한 것인지는 뚜렷하지 않다.260)
임신 중 갑상선호르몬과 항갑상선제를 함께 복용하는 것은 산후 그레이브스병 재발을 막는데 유용하지도 않고,261) 혈중 갑상선호르몬 농도를 정상으로 유지하기 위해 보다 많은 용량의 항갑상선제를 사용하게 되어 결과적으로 태아의 갑상선기능저하증을 초래할 위험을 증가시킨다. 갑상선호르몬과 항갑상선제 동시 처방의 유일한 적응증은 태아의 갑상선기능항진증 치료이다.
MMI, PTU, carbimazole은 모두 태반을 통과한다. 그러므로 이들 약물이 태아에 미치는 영향을 최소화하기 위해서는 혈중 유리T4 농도를 정상 범위의 상한선 근처로 맞출 정도의 최소 용량만을 사용하는 것이 바람직하다. 치료를 시작한 후에는 2-4주 간격으로 유리T4 및 TSH 농도를 측정하고, 목표 수준에 도달한 이후에는 4-8주 간격으로 검사를 시행하도록 한다.262)
임신 시기에 따른 유리T4의 정상 기준치가 없다면 비임신 성인의 정상 범위에 준하도록 한다. 항갑상선제 용량이 과다하게 처방되면 태아의 갑상선기능저하증 및 갑상선종의 위험이 있으므로 주의를 요한다.263) 혈중 TSH 농도는 임신 기간 내내 정상 이하로 억제되어 있을 수 있다. 혈중 총 T3를 측정하는 것은 권장되지 않는데, 그 이유는 임신부의 총 T3를 정상화 시킬 경우 출생 시 태아의 TSH 증가의 원인이 될 수 있기 때문이다.264) 단, 갑상선종을 동반한 T3 갑상선중독증의 경우는 예외이다.
항갑상선제에 대한 부작용이 있거나 고용량의 항갑상선제가 요구되는 경우, 약물 복용의 순응도가 낮은 경우에는 갑상선절제술을 고려하여야 한다. 수술의 적절한 시기는 임신 중기이며, 혈중 TRAb 역가의 측정은 태아 갑상선기능항진증의 위험을 줄일 수 있는 최적의 수술 시기를 결정하는데 유용하다.266) 수술 후 TRAb의 감소는 점차적으로 나타나기 때문에, 수술 직후 항갑상선제를 중단하면 남아있는 TRAb의 영향으로 태아 단독 갑상선기능항진증을 유발할 수 있으므로 주의가 필요하다.231) 수술 전처치로 베타차단제나 단기간의 포타슘요오드 용액(KI solution 50-100 mg/day)을 사용할 수 있다.267)
그레이브스병으로 치료를 받은 임신부의 태아는 1) 태아 갑상선기능항진증, 2) 신생아 갑상선기능항진증, 3) 태아 갑상선기능저하증, 4) 신생아 갑상선기능저하증, 5) 중심성 갑상선기능저하증 등의 위험이 있다. 이와 같은 합병증의 발생여부는 아래 열거된 몇 가지 인자에 의해 결정된다. 1) 임신 전 기간에 걸쳐 갑상선기능항진증이 적절히 조절되지 않으면 일과성의 중심성 갑상선기능저하증이 발생할 수 있다;268,269) 2) 과용량의 항갑상선제 투여는 태아 및 신생아 갑상선기능저하증의 원인이 된다;270) 3) 임신 22-26주에 TRAb 역가가 높은 경우 태아 및 신생아 갑상선기능항진증의 위험이 높다.271,272)
TRAb는 그레이브스병 환자의 95%에서 발견되며, 갑상선제거술을 시행한 이후에도 상당기간 높게 지속된다. 임신 중 그레이브스병 환자에서 TRAb 역가 측정의 적응증은 1) 현성 갑상선기능항진증을 가지고 있는 경우, 2) 과거 방사성요오드 치료를 받았던 병력, 3) 과거 갑상선기능항진증 태아를 출산한 병력, 4) 임신 중 갑상선기능항진증 치료를 위해 갑상선절제술을 시행하는 경우 등이다.266)
대개의 경우 TRAb 역가는 임신기간 동안 서서히 감소한다. 태아 및 신생아의 갑상선기능항진증 빈도는 현성 또는 과거 그레이브스병 병력을 가진 전체 임신부의 약 1-5%이며, 미리 발견하여 조치하지 않는 경우 태아 및 신생아의 사망률 및 이환율 증가와 연관이 있는 것으로 알려져 있다.273)
임신초기 TRAb 역가 측정은 위험한 태아를 감별해 내는데 도움이 된다. 현재 질환을 앓고 있는 경우뿐 아니라 이전에 그레이브스병으로 갑상선제거술(방사성요오드 치료 포함)을 받았던 여성에서 TRAb의 역가가 정상상한선의 3배 이상 높을 경우 태아 단독의 갑상선기능항진증이 발생할 수 있다.274) 그레이브스병 과거력이 있다면 임신 초기에 갑상선기능검사와 함께 TRAb를 측정하도록 한다.152) 임신초기에 측정한 TRAb의 역가가 증가되어 있다면 임신 18-22주에 재측정하도록 하며, 만약 음성이라면 추가 검사는 필요하지 않다.
그레이브스병으로 항갑상선제 치료 도중 임신을 한 경우에도 임신 초기 TRAb 역가 측정이 필요하다. 이후 TRAb의 역가가 높고 항갑상선제 치료가 임신 중기까지 필요한 상황이라면 임신 18-22주에 재측정하여야 한다.152) 임신 18-22주의 TRAb 역가 측정은 신생아 갑상선 질환의 위험성을 감별해 내는데 도움이 되기 때문이다. TRAb 역가가 정상 상한선의 3배 이상 증가되어 있는 경우에는 태반을 통해 넘어간 항체가 태아의 갑상선을 자극하여 신생아 갑상선기능항진증의 위험이 높아지므로,275) 임신부와 의료진의 협조 하에 태아와 출산 후 신생아의 갑상선기능 이상에 대한 주의 깊은 관찰이 필요하다. 이와는 반대로 TRAb의 역가가 측정되지 않는다면 항갑상선제에 의한 태아 갑상선기능저하증을 예방하기 위해 약제 용량을 감량하거나 중단하는 것이 좋다.
출산 후에 발생하는 갑상선중독증의 가장 흔한 원인은 산후갑상선염이다. 산후갑상선염의 빈도는 4.1%로, 산후 그레이브스병의 0.2%보다 높다.3) 분만 후 6개월 이내에 갑상선중독증의 증상을 주소로 내원하는 경우가 많고, 이후 갑상선기능저하 시기를 거쳐 정상 갑상선기능으로 회복되는데, 대개 특별한 치료 없이 출산 후 1년까지 서서히 자연치유 되는 경과를 보인다.2,3) 일부 여성에서는 갑상선중독증의 증상으로 내원하여 일시적인 베타차단제 처방이 필요하기도 하다.
반면, 산후에는 갑상선 자가면역의 증가로 새로운 그레이브스병 발생 위험이 2-3배 높다. 산후 그레이브스병은 주로 과거에 그레이브스병으로 항갑상선제 치료를 받았던 여성이나 임신 초기에 갑상선중독기를 거쳤던 여성에서 빈도가 높다.276) 한 연구에 따르면 임신을 경험했던 여성에서 그레이브스병의 재발률은 84%로, 임신을 경험하지 않았던 여성의 56%에 비해 현저히 높았다.276) 또한 연관성이 뚜렷하지는 않지만,277) 분만 이후 특히 나이가 많을수록 그레이브스병 발병률이 증가한다는 연구결과도 있으나, 그렇지 않다는 보고도 있다.278)
산후갑상선염은 TAb, 림프구 이상, 보체 활성화 및 IgG1 증가, 자연세포독성세포(natural killer cell)의 활성도 증가 및 특정 HLA 일배체형과 연관이 있는 자가면역질환의 일종이다.285-287) 임신 초기에 TPOAb+인 산모 중 33-50%에서 산후갑상선염이 발생하며, 이는 TAb- 인 산모에 비하면 상대위험도가 10-59배에 달하는 것이다.288) 또한 임신 초기 TAb 역가가 높을수록 산후갑상선염이 발생할 위험도가 높아진다.281) 산후갑상선염의 발생은 임신 중 면역억제 상태에 있다가 분만 후 반동으로 면역반응이 증가되어 생기는 것으로 생각되고 있다.
산후갑상선염의 갑상선중독기와 그레이브스병은 치료방법과 임상경과가 완전히 다르므로 감별이 중요하다. 갑상선중독증 발생시기, TRAb 양성 여부, T4:T3 비율 등이 두 질환의 감별에 도움이 된다.
산후갑상선염의 갑상선중독기는 산후 1-6개월(대부분 3개월경)에 발생하여 대개 1-2개월정도 지속된다. 출산 후 갑상선중독증이 발생한 42명을 대상으로 한 일본 연구에서, 출산 후 3개월 이내 발생한 갑상선중독증의 86%는 산후갑상선염이었던 반면, 6.5개월 이후 발생한 갑상선중독증은 모두 그레이브스병이었다.289)
또한, 그레이브스병 환자의 경우 대부분 TRAb+이고 방사성요오드 섭취율이 증가된다. 산후갑상선염의 경우 전형적으로 TRAb-이며 T4:T3 비율이 증가되고, 방사성요오드 섭취율이 현저히 감소되는 것이 그레이브스병과의 감별점이다. 수유 중인 여성에서 진단을 위한 갑상선 스캔검사가 필요한 경우는 드물지만, 123I 또는 99mTechnetium 스캔 검사는 반감기가 짧기 때문에 스캔 검사 이후 며칠간 모유를 버린다면 사용해 볼 수 있다. 수유 중인 경우 반감기가 긴 131I 스캔은 금기이다.
산후갑상선염의 갑상선중독기에는 대부분의 환자에서 무증상이거나, 경미한 증상만을 보인다. 이는 갑상선호르몬의 상승 정도가 경미하고 대개 T3에 비해 T4치가 더 상승하기 때문이다. 그러나 연구들에 의하면, 산후갑상선염 환자의 갑상선중독기에는 정상 갑상선기능을 가진 산모에 비해 안절부절못함, 더위를 못 참음, 피로, 심계항진 등을 더 많이 호소하였다.281,300-302) 산후갑상선염의 갑상선기능저하기에는 정상 갑상선기능을 가진 산모에 비해 불편한 증상(추위를 못 참음, 피부 건조증, 피로, 집중력 저하 및 전신 통증 등)이 더 많이 나타난다.301,302)
산후갑상선염과 산후우울증과의 연관성을 조사한 연구들의 결과는 서로 달라서, 일부에서는 연관성이 있다고 하였으나,301,303-305) 그렇지 않다는 보고도 있었다.306) 갑상선자가항체와 산후우울증이 관련이 없다는 연구도 있으나307) 대부분의 연구들은 연관성이 있다고 보고하였다.111,308-311) 최근 메타분석에서 임신 중과 출산 후 TPOAb+인 산모에서 산후우울증의 위험이 유의하게 증가함을 보고하였다.312)
산후갑상선염의 치료시기와 치료방법에 대한 전향적인 연구는 없었다. 산후갑상선염의 갑상선중독기는 일과성이고 갑상선세포의 파괴로 인해 갑상선호르몬이 누출되어 나타나는 것이므로 자연적으로 치유된다. 즉, 갑상선호르몬의 생산이 증가된 상태가 아니므로, 항갑상선제(PTU나 MMI)는 사용하지 않는다. 증상은 대부분 경미하나, 드물게 갑상선중독증 증상이 나타나는 경우, 증상을 완화시킬 수 있는 가능한 최저 용량의 베타차단제(propranolol 등)를 사용한다. 베타차단제 치료는 보통 수 주간 요구된다.
산후갑상선염의 갑상선중독기는 대개 출산 후 2-6개월 사이에 발생하고, 갑상선기능저하기는 출산 후 3-12개월에 발생한다. 따라서, 갑상선중독기가 호전된 후 대략 4-12주 후(또는 새로운 증상이 발생하면) TSH의 측정이 필요하다.
산후갑상선염의 갑상선기능저하기에 증상이 있거나, 수유 중이거나, 임신 예정이라면, LT4 복용을 시작해야 한다.281) LT4 복용을 시작하지 않았다면 갑상선기능이 정상으로 회복될 때까지 4-12주마다 갑상선기능을 평가해야 하며, 회복 전까지는 피임을 하도록 권고한다.
산후갑상선염 환자에서 LT4 복용을 시작한 후 언제까지 유지해야 하는지에 대해 체계적으로 조사된 바는 없다. 단지 지침이 되는 원칙은 임신 예정이거나 임신 또는 수유 중인 여성에서는 정상 갑상선기능을 유지해야 한다는 것이다. 산후갑상선염에 따른 갑상선기능저하가 일시적인지 아니면 영구적인지를 평가하기 위해 산후 12개월에는 LT4 용량을 감량해 볼 수 있다. LT4 용량의 감량은 6-8주마다 갑상선기능을 평가하며 점차적으로 시도해야 한다.
산후갑상선염이 장기적으로 갑상선기능에 미치는 영향에 대한 연구결과에 의하면, 갑상선기능저하에서 정상 갑상선기능으로 회복된 여성 중 10-50%가 영구적인 갑상선기능저하증으로 진행하였다.283,315-318) 영구적 갑상선기능저하증의 위험인자로는 다분만력(multiparity), 갑상선초음파상 저에코성, 초기 갑상선기능저하증의 중증도, TPOAb의 역가, 산모 나이 및 유산력 등이 있다.318,319) 산후갑상선염의 갑상선기능저하기에서 호전된 여성에서 영구적 갑상선기능저하증으로의 진행 여부를 확인하기 위해 매년 TSH의 측정이 권장된다. Fig. 1은 산후갑상선염의 치료와 추적관찰에 대한 알고리즘이다.
갑상선자가항체 양성인 여성에서 임신 중 요오드 또는 LT4의 투여가 산후갑상선염의 발생을 예방할 수 있는지에 대한 전향적인 무작위대조연구 결과 두 가지 약제 모두 산후갑상선염의 빈도를 낮추지 못했다.318,320-322) 최근 보고된 전향적 연구에서 요오드 결핍 지역의 임신부에서 임신 중 하루 300 μg의 요오드 보충 시 임신 중 임신부의 소변 요오드농도는 증가시켰으나, 출산 후까지 산모와 유아의 요오드 농도를 적정 수준으로 유지시키지 못하였으며, 산모의 갑상선기능이 위약군과 다르지 않다고 보고하였다.321)
한편, TAb+인 정상 갑상선기능 임신부에서 셀레늄 투여가 산후갑상선염 발생에 미치는 영향에 대한 결과는 연구마다 다르게 보고되고 있다. Negro 등53)은 TPOAb+인 정상 갑상선기능 임신부에서 임신 기간 및 출산 후 지속적으로 셀레늄을 매일 200 μg을 보충한 군에서 임신 중 TPOAb가 더 현저하게 감소되고, 산후갑상선염 및 영구적인 갑상선기능저하증의 빈도가 현저하게 낮음을 보고하였다. 그러나, 이 연구에서는 소변 요오드 농도를 측정하지 않았고, 이는 셀레늄 효과에서 요오드의 영향을 배제할 수 없었다는 것이 제한점이 되었다.
반면 또 다른 연구에서는 경미하게 요오드가 부족한 지역에서, 셀레늄을 매일 60 μg을 보충한 임신부에서 TPOAb 역가나 양성률을 감소시키지 못했다.54) 최근 보고된 전향적인 무작위대조연구에서도 임신 중 및 출산 후 셀레늄을 매일 83 μg을 보충하는 것이 출산 후 TAb 역가는 감소시켰지만, 산후 갑상선기능에는 차이가 없었다.55) 한편 셀레늄 보충이 오히려 당뇨병의 위험을 증가시킬 수 있다는 보고56)가 있다. 현재까지 연구결과에서 임신 중 요오드 또는 LT4 투여는 산후갑상선염 발생을 예방하지 못하였고, 임신 중 셀레늄 보충이 산후갑상선염을 예방할 수 있는지에 대한 근거는 부족하다.
본 개정안은 2017년 미국갑상선학회 가이드라인을 바탕으로 하여 최근에 발표된 전향적 무작위대조연구들의 결과 등을 반영하여 수용 개작하여 작성하였다. 이번 개정안의 주요한 변화는 임신 1분기의 TSH의 상한선을 4.0 mIU/L로 제안한 점이며, 이에 따라 TSH 4.0-10.0 mIU/L이면서 free T4가 정상인 경우를 무증상갑상선기능저하증으로 정의하였다는 것이다. 무증상갑상선기능저하증이 있는 경우 자가항체 여부에 상관없이 갑상선호르몬 보충을 권고하였으나, 갑상선자가항체 양성인 정상 갑상선기능 임신부에서 유산 방지 목적의 갑상선호르몬 보충은 권고하지 않았다. 갑상선호르몬제, 요오드는 산후갑상선염의 예방효과가 없음이 확인되었고, 셀레늄의 산후갑상선염 예방 효과에 대하여서는 아직 충분한 연구가 이루어지지 않아 근거가 부족하여 권고하지 않았다.
우리나라는 요오드 섭취가 많고 특히 임신부 및 산모에서의 요오드 섭취량이 과도한 점을 고려한다면 우리나라 임산부들을 대상으로 한 전향적 무작위 대조 연구 또는 국민건강보험자료와 같은 큰 규모의 데이터를 이용한 역학 연구들이 필요할 것으로 생각된다.
References
1. Glinoer D. 1997; The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev. 18(3):404–33. DOI: 10.1210/edrv.18.3.0300. PMID: 9183570.
2. Azizi F. 2006; Treatment of post-partum thyrotoxicosis. J Endocrinol Invest. 29(3):244–7. DOI: 10.1007/BF03345547. PMID: 16682838.
3. Stagnaro-Green A. 2004; Postpartum thyroiditis. Best Pract Res Clin Endocrinol Metab. 18(2):303–16. DOI: 10.1016/j.beem.2004.03.008. PMID: 15157842.
4. Weeke J, Dybkjaer L, Granlie K, Eskjaer Jensen S, Kjaerulff E, Laurberg P, et al. 1982; A longitudinal study of serum TSH, and total and free iodothyronines during normal pregnancy. Acta Endocrinol (Copenh). 101(4):531–7. DOI: 10.1530/acta.0.1010531. PMID: 7158229.
5. Baloch Z, Carayon P, Conte-Devolx B, Demers LM, Feldt-Rasmussen U, Henry JF, et al. 2003; Laboratory medicine practice guidelines. Laboratory support for the diagnosis and monitoring of thyroid disease. Thyroid. 13(1):3–126. DOI: 10.1089/105072503321086962. PMID: 12625976.
6. Soldin OP, Tractenberg RE, Hollowell JG, Jonklaas J, Janicic N, Soldin SJ. 2004; Trimester-specific changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and associations across trimesters in iodine sufficiency. Thyroid. 14(12):1084–90. DOI: 10.1089/thy.2004.14.1084. PMID: 15650363. PMCID: PMC3625635.
7. Kahric-Janicic N, Soldin SJ, Soldin OP, West T, Gu J, Jonklaas J. 2007; Tandem mass spectrometry improves the accuracy of free thyroxine measurements during pregnancy. Thyroid. 17(4):303–11. DOI: 10.1089/thy.2006.0303. PMID: 17465859. PMCID: PMC3641793.

8. Sapin R, D'Herbomez M, Schlienger JL. Free thyroxine measured with equilibrium dialysis and nine immunoassays decreases in late pregnancy. Clin Lab. 2004; 50(9-10):581–4.
9. Stricker R, Echenard M, Eberhart R, Chevailler MC, Perez V, Quinn FA, et al. 2007; Evaluation of maternal thyroid function during pregnancy: the importance of using gestational age-specific reference intervals. Eur J Endocrinol. 157(4):509–14. DOI: 10.1530/EJE-07-0249. PMID: 17893266.
10. Bocos-Terraz JP, Izquierdo-Alvarez S, Bancalero-Flores JL, Alvarez-Lahuerta R, Aznar-Sauca A, Real-Lopez E, et al. 2009; Thyroid hormones according to gestational age in pregnant Spanish women. BMC Res Notes. 2:237. DOI: 10.1186/1756-0500-2-237. PMID: 19939287. PMCID: PMC2788578.

11. Derakhshan A, Shu H, Broeren MAC, de Poortere RA, Wikstrom S, Peeters RP, et al. 2018; Reference ranges and determinants of thyroid function during early pregnancy: the SELMA study. J Clin Endocrinol Metab. 103(9):3548–56. DOI: 10.1210/jc.2018-00890. PMID: 29982605.
12. Ollero MD, Toni M, Pineda JJ, Martinez JP, Espada M, Anda E. 2019; Thyroid function reference values in healthy iodine-sufficient pregnant women and influence of thyroid nodules on thyrotropin and free thyroxine values. Thyroid. 29(3):421–9. DOI: 10.1089/thy.2018.0324. PMID: 30693851.

13. Huang C, Wu Y, Chen L, Yuan Z, Yang S, Liu C. 2021; Establishment of assay method- and trimester-specific reference intervals for thyroid hormones during pregnancy in Chengdu, China. J Clin Lab Anal. 35(5):e23763. DOI: 10.1002/jcla.23763.

14. Andersen SL, Andersen S, Carle A, Christensen PA, Handberg A, Karmisholt J, et al. 2019; Pregnancy week-specific reference ranges for thyrotropin and free thyroxine in the North Denmark region pregnancy cohort. Thyroid. 29(3):430–8. DOI: 10.1089/thy.2018.0628. PMID: 30734656.

15. Choi HW, Han YJ, Kwak DW, Park SY, Kim SH, Yoon HK, et al. 2017; Maternal thyroid function during the first trimester of pregnancy in Korean women. Int J Thyroidol. 10(1):36–41. DOI: 10.11106/ijt.2017.10.1.36.

16. Kim HJ, Cho YY, Kim SW, Kim TH, Jang HW, Lee SY, et al. 2018; Reference intervals of thyroid hormones during pregnancy in Korea, an iodine-replete area. Korean J Intern Med. 33(3):552–60. DOI: 10.3904/kjim.2016.051. PMID: 28171716. PMCID: PMC5943647.

17. Dashe JS, Casey BM, Wells CE, McIntire DD, Byrd EW, Leveno KJ, et al. 2005; Thyroid-stimulating hormone in singleton and twin pregnancy: importance of gestational age-specific reference ranges. Obstet Gynecol. 106(4):753–7. DOI: 10.1097/01.AOG.0000175836.41390.73. PMID: 16199632.

18. Yi KH, Kim KW, Yim CH, Jung ED, Chung JH, Chung HK, et al. 2014; Guidelines for the diagnosis and management of thyroid disease during pregnancy and postpartum. Int J Thyroidol. 7(1):7–39. DOI: 10.11106/jkta.2014.7.1.7.

19. Lambert-Messerlian G, McClain M, Haddow JE, Palomaki GE, Canick JA, Cleary-Goldman J, et al. 2008; First- and second-trimester thyroid hormone reference data in pregnant women: a FaSTER (First- and Second-Trimester Evaluation of Risk for aneuploidy) research consortium study. Am J Obstet Gynecol. 199(1):62 e1-6. DOI: 10.1016/j.ajog.2007.12.003. PMID: 18585522. PMCID: PMC2529146.

20. Mannisto T, Surcel HM, Ruokonen A, Vaarasmaki M, Pouta A, Bloigu A, et al. 2011; Early pregnancy reference intervals of thyroid hormone concentrations in a thyroid antibody-negative pregnant population. Thyroid. 21(3):291–8. DOI: 10.1089/thy.2010.0337. PMID: 21254924.

21. Medici M, de Rijke YB, Peeters RP, Visser W, de Muinck Keizer-Schrama SM, Jaddoe VV, et al. 2012; Maternal early pregnancy and newborn thyroid hormone parameters: the generation R study. J Clin Endocrinol Metab. 97(2):646–52. DOI: 10.1210/jc.2011-2398. PMID: 22162477.

22. Bestwick JP, John R, Maina A, Guaraldo V, Joomun M, Wald NJ, et al. 2014; Thyroid stimulating hormone and free thyroxine in pregnancy: expressing concentrations as multiples of the median (MoMs). Clin Chim Acta. 430:33–7. DOI: 10.1016/j.cca.2013.12.030. PMID: 24380740.

23. Li C, Shan Z, Mao J, Wang W, Xie X, Zhou W, et al. 2014; Assessment of thyroid function during first-trimester pregnancy: what is the rational upper limit of serum TSH during the first trimester in Chinese pregnant women? J Clin Endocrinol Metab. 99(1):73–9. DOI: 10.1210/jc.2013-1674. PMID: 24276458.
24. Carty DM, Doogan F, Welsh P, Dominiczak AF, Delles C. 2017; Thyroid stimulating hormone (TSH) >/=2.5mU/l in early pregnancy: prevalence and subsequent outcomes. Eur J Obstet Gynecol Reprod Biol. 210:366–9. DOI: 10.1016/j.ejogrb.2017.01.048. PMID: 28153744.
25. Han SM, Han JH, Park JA, Quinn FA, Park J, Oh E. 2013; Longitudinal evaluation of thyroid autoimmunity and function in pregnant Korean women. Clin Chem Lab Med. 51(12):2295–301. DOI: 10.1515/cclm-2013-0598. PMID: 23979124.

26. Kim HJ, Cho YY, Kim SW, Kim TH, Jang HW, Lee SY, et al. 2018; Reference intervals of thyroid hormones during pregnancy in Korea, an iodine-replete area. Korean J Intern Med. 33(3):552–60. DOI: 10.3904/kjim.2016.051. PMID: 28171716. PMCID: PMC5943647.

27. Moon HW, Chung HJ, Park CM, Hur M, Yun YM. 2015; Establishment of trimester-specific reference intervals for thyroid hormones in Korean pregnant women. Ann Lab Med. 35(2):198–204. DOI: 10.3343/alm.2015.35.2.198. PMID: 25729721. PMCID: PMC4330169.

28. Maraka S, Mwangi R, McCoy RG, Yao X, Sangaralingham LR, Singh Ospina NM, et al. 2017; Thyroid hormone treatment among pregnant women with subclinical hypothyroidism: US national assessment. BMJ. 356:i6865. DOI: 10.1136/bmj.i6865. PMID: 28122781. PMCID: PMC5266622.

29. Nazarpour S, Ramezani Tehrani F, Simbar M, Tohidi M, Minooee S, Rahmati M, et al. 2018; Effects of levothyroxine on pregnant women with subclinical hypothyroidism, negative for thyroid peroxidase antibodies. J Clin Endocrinol Metab. 103(3):926–35. DOI: 10.1210/jc.2017-01850. PMID: 29126290.

30. Toft AD, Backett GJ. Braverman LE, Utiger RD, editors. 2005. Measuring serum thyrotropin and thyroid hormone and assessing thyroid hormone transport. Werner & Ingbar's the thyroid: a fundamental and clinical text. 9th ed. Lippincott, Williams & Wilkins;Philadelphia, PA: p. 329–44.
31. Anckaert E, Poppe K, Van Uytfanghe K, Schiettecatte J, Foulon W, Thienpont LM. FT4 immunoassays may display a pattern during pregnancy similar to the equilibrium dialysis ID-LC/tandem MS candidate reference measurement procedure in spite of susceptibility towards binding protein alterations. Clin Chim Acta. 2010; 411(17-18):1348–53. DOI: 10.1016/j.cca.2010.05.032. PMID: 20510682.
32. Lee RH, Spencer CA, Mestman JH, Miller EA, Petrovic I, Braverman LE, et al. 2009; Free T4 immunoassays are flawed during pregnancy. Am J Obstet Gynecol. 200(3):260 e1-6. DOI: 10.1016/j.ajog.2008.10.042. PMID: 19114271.

33. Stockigt J. 2003; Assessment of thyroid function: towards an integrated laboratory--clinical approach. Clin Biochem Rev. 24(4):109–22.
34. Thienpont LM, Van Uytfanghe K, Beastall G, Faix JD, Ieiri T, Miller WG, et al. 2010; Report of the IFCC Working Group for standardization of thyroid function tests; part 2: free thyroxine and free triiodothyronine. Clin Chem. 56(6):912–20. DOI: 10.1373/clinchem.2009.140194. PMID: 20395623.
35. Moreno-Reyes R, Glinoer D, Van Oyen H, Vandevijvere S. 2013; High prevalence of thyroid disorders in pregnant women in a mildly iodine-deficient country: a population-based study. J Clin Endocrinol Metab. 98(9):3694–701. DOI: 10.1210/jc.2013-2149. PMID: 23846819.
36. Ashoor G, Maiz N, Rotas M, Kametas NA, Nicolaides KH. 2010; Maternal thyroid function at 11 to 13 weeks of gestation and subsequent development of preeclampsia. Prenat Diagn. 30(11):1032–8. DOI: 10.1002/pd.2566. PMID: 20865794.
37. Benhadi N, Wiersinga WM, Reitsma JB, Vrijkotte TG, van der Wal MF, Bonsel GJ. 2007; Ethnic differences in TSH but not in free T4 concentrations or TPO antibodies during pregnancy. Clin Endocrinol (Oxf). 66(6):765–70. DOI: 10.1111/j.1365-2265.2007.02803.x. PMID: 17466012.
38. La'ulu SL, Roberts WL. 2007; Second-trimester reference intervals for thyroid tests: the role of ethnicity. Clin Chem. 53(9):1658–64. DOI: 10.1373/clinchem.2007.089680. PMID: 17712003.
39. Abbassi-Ghanavati M, Casey BM, Spong CY, McIntire DD, Halvorson LM, Cunningham FG. 2010; Pregnancy outcomes in women with thyroid peroxidase antibodies. Obstet Gynecol. 116(2 Pt 1):381–6. DOI: 10.1097/AOG.0b013e3181e904e5. PMID: 20664399.
40. Wasserman EE, Nelson K, Rose NR, Eaton W, Pillion JP, Seaberg E, et al. 2008; Maternal thyroid autoantibodies during the third trimester and hearing deficits in children: an epidemiologic assessment. Am J Epidemiol. 167(6):701–10. DOI: 10.1093/aje/kwm342. PMID: 18156602.

41. Pearce EN, Oken E, Gillman MW, Lee SL, Magnani B, Platek D, et al. 2008; Association of first-trimester thyroid function test values with thyroperoxidase antibody status, smoking, and multivitamin use. Endocr Pract. 14(1):33–9. DOI: 10.4158/EP.14.1.33. PMID: 18238739. PMCID: PMC2581507.
42. Moleti M, Lo Presti VP, Mattina F, Mancuso A, De Vivo A, Giorgianni G, et al. 2009; Gestational thyroid function abnormalities in conditions of mild iodine deficiency: early screening versus continuous monitoring of maternal thyroid status. Eur J Endocrinol. 160(4):611–7. DOI: 10.1530/EJE-08-0709. PMID: 19179457.
43. McElduff A, Morris J. 2008; Thyroid function tests and thyroid autoantibodies in an unselected population of women undergoing first trimester screening for aneuploidy. Aust N Z J Obstet Gynaecol. 48(5):478–80. DOI: 10.1111/j.1479-828X.2008.00903.x. PMID: 19032663.
44. Unuane D, Velkeniers B, Anckaert E, Schiettecatte J, Tournaye H, Haentjens P, et al. 2013; Thyroglobulin autoantibodies: is there any added value in the detection of thyroid autoimmunity in women consulting for fertility treatment? Thyroid. 23(8):1022–8. DOI: 10.1089/thy.2012.0562. PMID: 23405888. PMCID: PMC3752510.
45. Glinoer D, Riahi M, Grun JP, Kinthaert J. 1994; Risk of subclinical hypothyroidism in pregnant women with asymptomatic auto-immune thyroid disorders. J Clin Endocrinol Metab. 79(1):197–204. DOI: 10.1210/jcem.79.1.8027226. PMID: 8027226.
46. Negro R, Formoso G, Mangieri T, Pezzarossa A, Dazzi D, Hassan H. 2006; Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications. J Clin Endocrinol Metab. 91(7):2587–91. DOI: 10.1210/jc.2005-1603. PMID: 16621910.

47. Seror J, Amand G, Guibourdenche J, Ceccaldi PF, Luton D. 2014; Anti-TPO antibodies diffusion through the placental barrier during pregnancy. PLoS One. 9(1):e84647. DOI: 10.1371/journal.pone.0084647. PMID: 24497920. PMCID: PMC3908862.

48. Duntas LH, Mantzou E, Koutras DA. 2003; Effects of a six month treatment with selenomethionine in patients with autoimmune thyroiditis. Eur J Endocrinol. 148(4):389–93. DOI: 10.1530/eje.0.1480389. PMID: 12656658.

49. Gartner R, Gasnier BC, Dietrich JW, Krebs B, Angstwurm MW. 2002; Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations. J Clin Endocrinol Metab. 87(4):1687–91. DOI: 10.1210/jcem.87.4.8421. PMID: 11932302.

50. Mazokopakis EE, Papadakis JA, Papadomanolaki MG, Batistakis AG, Giannakopoulos TG, Protopapadakis EE, et al. 2007; Effects of 12 months treatment with L-selenomethionine on serum anti-TPO Levels in Patients with Hashimoto's thyroiditis. Thyroid. 17(7):609–12. DOI: 10.1089/thy.2007.0040. PMID: 17696828.

51. Fan Y, Xu S, Zhang H, Cao W, Wang K, Chen G, et al. 2014; Selenium supplementation for autoimmune thyroiditis: a systematic review and meta-analysis. Int J Endocrinol. 2014:904573. DOI: 10.1155/2014/904573. PMID: 25574167. PMCID: PMC4276677.

52. Karanikas G, Schuetz M, Kontur S, Duan H, Kommata S, Schoen R, et al. 2008; No immunological benefit of selenium in consecutive patients with autoimmune thyroiditis. Thyroid. 18(1):7–12. DOI: 10.1089/thy.2007.0127. PMID: 18302514.

53. Negro R, Greco G, Mangieri T, Pezzarossa A, Dazzi D, Hassan H. 2007; The influence of selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies. J Clin Endocrinol Metab. 92(4):1263–8. DOI: 10.1210/jc.2006-1821. PMID: 17284630.

54. Mao J, Pop VJ, Bath SC, Vader HL, Redman CW, Rayman MP. 2016; Effect of low-dose selenium on thyroid autoimmunity and thyroid function in UK pregnant women with mild-to-moderate iodine deficiency. Eur J Nutr. 55(1):55–61. DOI: 10.1007/s00394-014-0822-9. PMID: 25524327. PMCID: PMC4737786.

55. Mantovani G, Isidori AM, Moretti C, Di Dato C, Greco E, Ciolli P, et al. 2019; Selenium supplementation in the management of thyroid autoimmunity during pregnancy: results of the "SERENA study", a randomized, double-blind, placebo-controlled trial. Endocrine. 66(3):542–50. DOI: 10.1007/s12020-019-01958-1. PMID: 31129812.

56. Stranges S, Marshall JR, Natarajan R, Donahue RP, Trevisan M, Combs GF, et al. 2007; Effects of long-term selenium supplementation on the incidence of type 2 diabetes: a randomized trial. Ann Intern Med. 147(4):217–23. DOI: 10.7326/0003-4819-147-4-200708210-00175. PMID: 17620655.
57. Wilcox AJ, Weinberg CR, O'Connor JF, Baird DD, Schlatterer JP, Canfield RE, et al. 1988; Incidence of early loss of pregnancy. N Engl J Med. 319(4):189–94. DOI: 10.1056/NEJM198807283190401. PMID: 3393170.

58. Ellish NJ, Saboda K, O'Connor J, Nasca PC, Stanek EJ, Boyle C. 1996; A prospective study of early pregnancy loss. Hum Reprod. 11(2):406–12. DOI: 10.1093/HUMREP/11.2.406. PMID: 8671233.

59. Toth B, Jeschke U, Rogenhofer N, Scholz C, Wurfel W, Thaler CJ, et al. 2010; Recurrent miscarriage: current concepts in diagnosis and treatment. J Reprod Immunol. 85(1):25–32. DOI: 10.1016/j.jri.2009.12.006. PMID: 20185181.

60. Dudley DJ. 2007; Diabetic-associated stillbirth: incidence, pathophysiology, and prevention. Clin Perinatol. 34(4):611–26. viiDOI: 10.1016/j.clp.2007.09.003. PMID: 18063109.
61. De Vivo A, Mancuso A, Giacobbe A, Moleti M, Maggio Savasta L, De Dominici R, et al. 2010; Thyroid function in women found to have early pregnancy loss. Thyroid. 20(6):633–7. DOI: 10.1089/thy.2009.0323. PMID: 20470201.

62. Casey BM, Dashe JS, Wells CE, McIntire DD, Leveno KJ, Cunningham FG. 2006; Subclinical hyperthyroidism and pregnancy outcomes. Obstet Gynecol. 107(2 Pt 1):337–41. DOI: 10.1097/01.AOG.0000197991.64246.9a. PMID: 16449121.

63. Stagnaro-Green A, Roman SH, Cobin RH, el-Harazy E, Alvarez-Marfany M, Davies TF. 1990; Detection of at-risk pregnancy by means of highly sensitive assays for thyroid autoantibodies. JAMA. 264(11):1422–5. DOI: 10.1001/jama.1990.03450110068029. PMID: 2118190.

64. Iijima T, Tada H, Hidaka Y, Mitsuda N, Murata Y, Amino N. 1997; Effects of autoantibodies on the course of pregnancy and fetal growth. Obstet Gynecol. 90(3):364–9. DOI: 10.1016/S0029-7844(97)00283-4. PMID: 9277645.

65. Glinoer D, Soto MF, Bourdoux P, Lejeune B, Delange F, Lemone M, et al. 1991; Pregnancy in patients with mild thyroid abnormalities: maternal and neonatal repercussions. J Clin Endocrinol Metab. 73(2):421–7. DOI: 10.1210/jcem-73-2-421. PMID: 1906897.

66. Sezer K, Kamel N, Unlu C, Celik HK. 2009; Impact of first trimester and postpartum period thyroid autoantibodies on abortus incidence in Turkish pregnant women. Gynecol Endocrinol. 25(6):387–91. DOI: 10.1080/09513590902730812. PMID: 19903030.

67. Chen L, Hu R. 2011; Thyroid autoimmunity and miscarriage: a meta-analysis. Clin Endocrinol (Oxf). 74(4):513–9. DOI: 10.1111/j.1365-2265.2010.03974.x. PMID: 21198746.

68. Thangaratinam S, Tan A, Knox E, Kilby MD, Franklyn J, Coomarasamy A. 2011; Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence. BMJ. 342:d2616. DOI: 10.1136/bmj.d2616. PMID: 21558126. PMCID: PMC3089879.

69. Seungdamrong A, Steiner AZ, Gracia CR, Legro RS, Diamond MP, Coutifaris C, et al. 2017; Preconceptional antithyroid peroxidase antibodies, but not thyroid-stimulating hormone, are associated with decreased live birth rates in infertile women. Fertil Steril. 108(5):843–850. DOI: 10.1016/j.fertnstert.2017.08.026. PMID: 29102040. PMCID: PMC8129952.
70. Imaizumi M, Pritsker A, Kita M, Ahmad L, Unger P, Davies T. 2001; Pregnancy and murine thyroiditis: thyroglobulin immunization leads to fetal loss in specific allogeneic pregnancies. Endocrinology. 142(2):823–9. DOI: 10.1210/endo.142.2.7966. PMID: 11159855.
71. Lee YL, Ng HP, Lau KS, Liu WM, O WS, Yeung WS, et al. 2009; Increased fetal abortion rate in autoimmune thyroid disease is related to circulating TPO autoantibodies in an autoimmune thyroiditis animal model. Fertil Steril. 91(5 Suppl):2104–9. DOI: 10.1016/j.fertnstert.2008.07.1704. PMID: 18774556.

72. Matalon ST, Blank M, Levy Y, Carp HJ, Arad A, Burek L, et al. 2003; The pathogenic role of anti-thyroglobulin antibody on pregnancy: evidence from an active immunization model in mice. Hum Reprod. 18(5):1094–9. DOI: 10.1093/humrep/deg210. PMID: 12721190.

73. Twig G, Shina A, Amital H, Shoenfeld Y. Pathogenesis of infertility and recurrent pregnancy loss in thyroid autoimmunity. J Autoimmun. 2012; 38(2-3):J275–81. DOI: 10.1016/j.jaut.2011.11.014. PMID: 22218218.

74. Lee RM, Silver RM. 2000; Recurrent pregnancy loss: summary and clinical recommendations. Semin Reprod Med. 18(4):433–40. DOI: 10.1055/s-2000-13733. PMID: 11355802.

75. Baek KH, Lee EJ, Kim YS. 2007; Recurrent pregnancy loss: the key potential mechanisms. Trends Mol Med. 13(7):310–7. DOI: 10.1016/j.molmed.2007.05.005. PMID: 17574920.

76. Iravani AT, Saeedi MM, Pakravesh J, Hamidi S, Abbasi M. 2008; Thyroid autoimmunity and recurrent spontaneous abortion in Iran: a case-control study. Endocr Pract. 14(4):458–64. DOI: 10.4158/EP.14.4.458. PMID: 18558600.

77. Kutteh WH, Yetman DL, Carr AC, Beck LA, Scott RT Jr. 1999; Increased prevalence of antithyroid antibodies identified in women with recurrent pregnancy loss but not in women undergoing assisted reproduction. Fertil Steril. 71(5):843–8. DOI: 10.1016/S0015-0282(99)00091-6. PMID: 10231043.

78. Lata K, Dutta P, Sridhar S, Rohilla M, Srinivasan A, Prashad GR, et al. 2013; Thyroid autoimmunity and obstetric outcomes in women with recurrent miscarriage: a case-control study. Endocr Connect. 2(2):118–24. DOI: 10.1530/EC-13-0012. PMID: 23802061. PMCID: PMC3691574.

79. Pratt DE, Kaberlein G, Dudkiewicz A, Karande V, Gleicher N. 1993; The association of antithyroid antibodies in euthyroid nonpregnant women with recurrent first trimester abortions in the next pregnancy. Fertil Steril. 60(6):1001–5. DOI: 10.1016/S0015-0282(16)56400-0. PMID: 8243677.
80. Bliddal S, Feldt-Rasmussen U, Rasmussen AK, Kolte AM, Hilsted LM, Christiansen OB, et al. 2019; Thyroid peroxidase antibodies and prospective live birth rate: a cohort study of women with recurrent pregnancy loss. Thyroid. 29(10):1465–74. DOI: 10.1089/thy.2019.0077. PMID: 31407629.

81. van den Boogaard E, Vissenberg R, Land JA, van Wely M, van der Post JA, Goddijn M, et al. 2011; Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update. 17(5):605–19. DOI: 10.1093/humupd/dmr024. PMID: 21622978.

82. Dong AC, Morgan J, Kane M, Stagnaro-Green A, Stephenson MD. 2020; Subclinical hypothyroidism and thyroid autoimmunity in recurrent pregnancy loss: a systematic review and meta-analysis. Fertil Steril. 113(3):587–600 e1. DOI: 10.1016/j.fertnstert.2019.11.003. PMID: 32192591.
83. Esplin MS, Branch DW, Silver R, Stagnaro-Green A. 1998; Thyroid autoantibodies are not associated with recurrent pregnancy loss. Am J Obstet Gynecol. 179(6 Pt 1):1583–6. DOI: 10.1016/S0002-9378(98)70029-8. PMID: 9855601.

84. Rushworth FH, Backos M, Rai R, Chilcott IT, Baxter N, Regan L. 2000; Prospective pregnancy outcome in untreated recurrent miscarriers with thyroid autoantibodies. Hum Reprod. 15(7):1637–9. DOI: 10.1093/humrep/15.7.1637. PMID: 10875881.

85. De Carolis C, Greco E, Guarino MD, Perricone C, Dal Lago A, Giacomelli R, et al. 2004; Anti-thyroid antibodies and antiphospholipid syndrome: evidence of reduced fecundity and of poor pregnancy outcome in recurrent spontaneous aborters. Am J Reprod Immunol. 52(4):263–6. DOI: 10.1111/j.1600-0897.2004.00215.x. PMID: 15494047.

86. Kim NY, Cho HJ, Kim HY, Yang KM, Ahn HK, Thornton S, et al. 2011; Thyroid autoimmunity and its association with cellular and humoral immunity in women with reproductive failures. Am J Reprod Immunol. 65(1):78–87. DOI: 10.1111/j.1600-0897.2010.00911.x. PMID: 20712806.

87. Lepoutre T, Debieve F, Gruson D, Daumerie C. 2012; Reduction of miscarriages through universal screening and treatment of thyroid autoimmune diseases. Gynecol Obstet Invest. 74(4):265–73. DOI: 10.1159/000343759. PMID: 23147711.

88. Wang H, Gao H, Chi H, Zeng L, Xiao W, Wang Y, et al. 2017; Effect of levothyroxine on miscarriage among women with normal thyroid function and thyroid autoimmunity undergoing in vitro fertilization and embryo transfer: a randomized clinical trial. JAMA. 318(22):2190–8. DOI: 10.1001/jama.2017.18249. PMID: 29234808.
89. Dhillon-Smith RK, Middleton LJ, Sunner KK, Cheed V, Baker K, Farrell-Carver S, et al. 2019; Levothyroxine in women with thyroid peroxidase antibodies before conception. N Engl J Med. 380(14):1316–25. DOI: 10.1056/NEJMoa1812537. PMID: 30907987.

90. van Dijk MM, Vissenberg R, Fliers E, van der Post JAM, van der Hoorn MP, de Weerd S, et al. 2022; Levothyroxine in euthyroid thyroid peroxidase antibody positive women with recurrent pregnancy loss (T4LIFE trial): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol. 10(5):322–9. DOI: 10.1016/S2213-8587(22)00045-6. PMID: 35298917.

91. Negro R, Schwartz A, Stagnaro-Green A. 2016; Impact of levothyroxine in miscarriage and preterm delivery rates in first trimester thyroid antibody-positive women with TSH less than 2.5 mIU/L. J Clin Endocrinol Metab. 101(10):3685–90. DOI: 10.1210/jc.2016-1803. PMID: 27459527.

92. Nazarpour S, Ramezani Tehrani F, Simbar M, Tohidi M, Alavi Majd H, Azizi F. 2017; Effects of levothyroxine treatment on pregnancy outcomes in pregnant women with autoimmune thyroid disease. Eur J Endocrinol. 176(2):253–65. DOI: 10.1530/EJE-16-0548. PMID: 27879326.

93. Lau L, Benham JL, Lemieux P, Yamamoto J, Donovan LE. 2021; Impact of levothyroxine in women with positive thyroid antibodies on pregnancy outcomes: a systematic review and meta-analysis of randomised controlled trials. BMJ Open. 11(2):e043751. DOI: 10.1136/bmjopen-2020-043751. PMID: 33622947. PMCID: PMC7907864.

94. Mathews TJ, Menacker F, MacDorman MF. Centers for Disease Control and Prevention, National Center for Health Statistics. 2004; Infant mortality statistics from the 2002 period: linked birth/infant death data set. Natl Vital Stat Rep. 53(10):1–29. DOI: 10.1037/e558952006-001.
95. Petrou S. 2005; The economic consequences of preterm birth during the first 10 years of life. BJOG. 112 Suppl 1:10–5. DOI: 10.1111/j.1471-0528.2005.00577.x. PMID: 15715587.
96. Goldenberg RL, Culhane JF, Iams JD, Romero R. 2008; Epidemiology and causes of preterm birth. Lancet. 371(9606):75–84. DOI: 10.1016/S0140-6736(08)60074-4. PMID: 18177778.

97. Ghafoor F, Mansoor M, Malik T, Malik MS, Khan AU, Edwards R, et al. 2006; Role of thyroid peroxidase antibodies in the outcome of pregnancy. J Coll Physicians Surg Pak. 16(7):468–71.
98. Haddow JE, Cleary-Goldman J, McClain MR, Palomaki GE, Neveux LM, Lambert-Messerlian G, et al. 2010; Thyroperoxidase and thyroglobulin antibodies in early pregnancy and preterm delivery. Obstet Gynecol. 116(1):58–62. DOI: 10.1097/AOG.0b013e3181e10b30. PMID: 20567168.

99. Korevaar TI, Schalekamp-Timmermans S, de Rijke YB, Visser WE, Visser W, de Muinck Keizer-Schrama SM, et al. 2013; Hypothyroxinemia and TPO-antibody positivity are risk factors for premature delivery: the generation R study. J Clin Endocrinol Metab. 98(11):4382–90. DOI: 10.1210/jc.2013-2855. PMID: 24037884.

100. Mannisto T, Vaarasmaki M, Pouta A, Hartikainen AL, Ruokonen A, Surcel HM, et al. 2009; Perinatal outcome of children born to mothers with thyroid dysfunction or antibodies: a prospective population-based cohort study. J Clin Endocrinol Metab. 94(3):772–9. DOI: 10.1210/jc.2008-1520. PMID: 19106271.

101. Plowden TC, Schisterman EF, Sjaarda LA, Perkins NJ, Silver R, Radin R, et al. 2017; Thyroid-stimulating hormone, anti-thyroid antibodies, and pregnancy outcomes. Am J Obstet Gynecol. 217(6):697 e1-e7. DOI: 10.1016/j.ajog.2017.09.001. PMID: 28917612. PMCID: PMC5712235.

102. Negro R. 2011; Thyroid autoimmunity and pre-term delivery: brief review and meta-analysis. J Endocrinol Invest. 34(2):155–8. DOI: 10.1007/BF03347047. PMID: 21422804.

103. He X, Wang P, Wang Z, He X, Xu D, Wang B. 2012; Thyroid antibodies and risk of preterm delivery: a meta-analysis of prospective cohort studies. Eur J Endocrinol. 167(4):455–64. DOI: 10.1530/EJE-12-0379. PMID: 22826476.
104. Korevaar TIM, Pop VJ, Chaker L, Goddijn M, de Rijke YB, Bisschop PH, et al. 2018; Dose dependency and a functional cutoff for TPO-antibody positivity during pregnancy. J Clin Endocrinol Metab. 103(2):778–89. DOI: 10.1210/jc.2017-01560. PMID: 29240902.

105. Karakosta P, Alegakis D, Georgiou V, Roumeliotaki T, Fthenou E, Vassilaki M, et al. 2012; Thyroid dysfunction and autoantibodies in early pregnancy are associated with increased risk of gestational diabetes and adverse birth outcomes. J Clin Endocrinol Metab. 97(12):4464–72. DOI: 10.1210/jc.2012-2540. PMID: 23015651.

106. Kumru P, Erdogdu E, Arisoy R, Demirci O, Ozkoral A, Ardic C, et al. 2015; Effect of thyroid dysfunction and autoimmunity on pregnancy outcomes in low risk population. Arch Gynecol Obstet. 291(5):1047–54. DOI: 10.1007/s00404-014-3533-9. PMID: 25388918.

107. Han Y, Mao LJ, Ge X, Huang K, Yan SQ, Ren LL, et al. 2018; Impact of maternal thyroid autoantibodies positivity on the risk of early term birth: Ma'anshan birth cohort study. Endocrine. 60(2):329–38. DOI: 10.1007/s12020-018-1576-6. PMID: 29569122.

108. Korevaar TIM, Derakhshan A, Taylor PN, Meima M, Chen L, et al. Consortium on Thyroid and Pregnancy-Study Group on Preterm Birth. 2019; Association of thyroid function test abnormalities and thyroid autoimmunity with preterm birth: a systematic review and meta-analysis. JAMA. 322(7):632–41. DOI: 10.1001/jama.2019.10931. PMID: 31429897. PMCID: PMC6704759.

109. Negro R, Schwartz A, Gismondi R, Tinelli A, Mangieri T, Stagnaro-Green A. 2011; Thyroid antibody positivity in the first trimester of pregnancy is associated with negative pregnancy outcomes. J Clin Endocrinol Metab. 96(6):E920–4. DOI: 10.1210/jc.2011-0026. PMID: 21411559.

110. Groer MW, Vaughan JH. 2013; Positive thyroid peroxidase antibody titer is associated with dysphoric moods during pregnancy and postpartum. J Obstet Gynecol Neonatal Nurs. 42(1):E26–32. DOI: 10.1111/j.1552-6909.2012.01425.x. PMID: 23167615. PMCID: PMC3546200.

111. Kuijpens JL, Vader HL, Drexhage HA, Wiersinga WM, van Son MJ, Pop VJ. 2001; Thyroid peroxidase antibodies during gestation are a marker for subsequent depression postpartum. Eur J Endocrinol. 145(5):579–84. DOI: 10.1530/eje.0.1450579. PMID: 11720875.

112. Li Y, Shan Z, Teng W, Yu X, Li Y, Fan C, et al. 2010; Abnormalities of maternal thyroid function during pregnancy affect neuropsychological development of their children at 25-30 months. Clin Endocrinol (Oxf). 72(6):825–9. DOI: 10.1111/j.1365-2265.2009.03743.x. PMID: 19878506.
113. Williams FL, Watson J, Ogston SA, Visser TJ, Hume R, Willatts P. 2013; Maternal and umbilical cord levels of T4, FT4, TSH, TPOAb, and TgAb in term infants and neurodevelopmental outcome at 5.5 years. J Clin Endocrinol Metab. 98(2):829–38. DOI: 10.1210/jc.2012-3572. PMID: 23322817.
114. Wasserman EE, Pillion JP, Duggan A, Nelson K, Rohde C, Seaberg EC, et al. 2012; Childhood IQ, hearing loss, and maternal thyroid autoimmunity in the Baltimore collaborative perinatal project. Pediatr Res. 72(5):525–30. DOI: 10.1038/pr.2012.117. PMID: 22918523.

115. Derakhshan A, Korevaar TIM, Taylor PN, Levie D, Guxens M, Jaddoe VWV, et al. 2018; The association of maternal thyroid autoimmunity during pregnancy with Child IQ. J Clin Endocrinol Metab. 103(10):3729–36. DOI: 10.1210/jc.2018-00743. PMID: 30020468.

116. Ghassabian A, Bongers-Schokking JJ, de Rijke YB, van Mil N, Jaddoe VW, de Muinck Keizer-Schrama SM, et al. 2012; Maternal thyroid autoimmunity during pregnancy and the risk of attention deficit/hyperactivity problems in children: the generation R Study. Thyroid. 22(2):178–86. DOI: 10.1089/thy.2011.0318. PMID: 22175242. PMCID: PMC3271370.

117. Brown AS, Surcel HM, Hinkka-Yli-Salomaki S, Cheslack-Postava K, Bao Y, Sourander A. 2015; Maternal thyroid autoanti-body and elevated risk of autism in a national birth cohort. Prog Neuropsychopharmacol Biol Psychiatry. 57:86–92. DOI: 10.1016/j.pnpbp.2014.10.010. PMID: 25445476. PMCID: PMC4276336.

118. Heikkinen AL, Pakkila F, Hartikainen AL, Vaarasmaki M, Mannisto T, Suvanto E. 2017; Maternal thyroid antibodies associates with cardiometabolic risk factors in children at the age of 16. J Clin Endocrinol Metab. 102(11):4184–90. DOI: 10.1210/jc.2017-01137. PMID: 28945847.

119. Kent NL, Young SL, Akison LK, Cuffe JSM. 2021; Is the link between elevated TSH and gestational diabetes mellitus dependant on diagnostic criteria and thyroid antibody status: a systematic review and meta-analysis. Endocrine. 74(1):38–49. DOI: 10.1007/s12020-021-02733-x. PMID: 33991314.

120. Yang Y, Hou Y, Wang H, Gao X, Wang X, Li J, et al. 2020; Maternal thyroid dysfunction and gestational anemia risk: meta-analysis and new data. Front Endocrinol (Lausanne). 11:201. DOI: 10.3389/fendo.2020.00201. PMID: 32351449. PMCID: PMC7174567.

121. Krassas GE, Pontikides N, Kaltsas T, Papadopoulou P, Batrinos M. 1994; Menstrual disturbances in thyrotoxicosis. Clin Endocrinol (Oxf). 40(5):641–4. DOI: 10.1111/j.1365-2265.1994.tb03016.x. PMID: 8013145.

122. Krassas GE, Pontikides N, Kaltsas T, Papadopoulou P, Paunkovic J, Paunkovic N, et al. 1999; Disturbances of menstruation in hypothyroidism. Clin Endocrinol (Oxf). 50(5):655–9. DOI: 10.1046/j.1365-2265.1999.00719.x. PMID: 10468932.
123. Poppe K, Glinoer D, Van Steirteghem A, Tournaye H, Devroey P, Schiettecatte J, et al. 2002; Thyroid dysfunction and autoimmunity in infertile women. Thyroid. 12(11):997–1001. DOI: 10.1089/105072502320908330. PMID: 12490077.

124. Grassi G, Balsamo A, Ansaldi C, Balbo A, Massobrio M, Benedetto C. 2001; Thyroid autoimmunity and infertility. Gynecol Endocrinol. 15(5):389–96. DOI: 10.1080/gye.15.5.389.396. PMID: 11727362.

125. Quintino-Moro A, Zantut-Wittmann DE, Tambascia M, Machado Hda C, Fernandes A. 2014; High prevalence of infertility among women with Graves' disease and Hashimoto's thyroiditis. Int J Endocrinol. 2014:982705. DOI: 10.1155/2014/982705. PMID: 24678319. PMCID: PMC3942334.
126. Kucukler FK, Gorkem U, Simsek Y, Kocabas R, Guler S. 2018; Evaluation of ovarian reserve in women with overt or subclinical hypothyroidism. Arch Med Sci. 14(3):521–6. DOI: 10.5114/aoms.2016.58621. PMID: 29765437. PMCID: PMC5949893.

127. Lincoln SR, Ke RW, Kutteh WH. 1999; Screening for hypothyroidism in infertile women. J Reprod Med. 44(5):455–7.
128. Abalovich M, Mitelberg L, Allami C, Gutierrez S, Alcaraz G, Otero P, et al. 2007; Subclinical hypothyroidism and thyroid autoimmunity in women with infertility. Gynecol Endocrinol. 23(5):279–83. DOI: 10.1080/09513590701259542. PMID: 17558686.

129. Arojoki M, Jokimaa V, Juuti A, Koskinen P, Irjala K, Anttila L. 2000; Hypothyroidism among infertile women in Finland. Gynecol Endocrinol. 14(2):127–31. DOI: 10.3109/09513590009167671. PMID: 10836200.

130. Rao M, Wang H, Zhao S, Liu J, Wen Y, Wu Z, et al. 2020; Subclinical hypothyroidism is associated with lower ovarian reserve in women aged 35 years or older. Thyroid. 30(1):95–105. DOI: 10.1089/thy.2019.0031. PMID: 31650898.

131. Birjandi B, Ramezani Tehrani F, Amouzegar A, Tohidi M, Bidhendi Yarandi R, Azizi F. 2021; The association between subclinical hypothyroidism and TPOAb positivity with infertility in a population-based study: Tehran thyroid study (TTS). BMC Endocr Disord. 21(1):108. DOI: 10.1186/s12902-021-00773-y. PMID: 34034716. PMCID: PMC8152029.

132. Verma I, Sood R, Juneja S, Kaur S. 2012; Prevalence of hypothyroidism in infertile women and evaluation of response of treatment for hypothyroidism on infertility. Int J Appl Basic Med Res. 2(1):17–9. DOI: 10.4103/2229-516X.96795. PMID: 23776802. PMCID: PMC3657979.

133. Yoshioka W, Amino N, Ide A, Kang S, Kudo T, Nishihara E, et al. 2015; Thyroxine treatment may be useful for subclinical hypothyroidism in patients with female infertility. Endocr J. 62(1):87–92. DOI: 10.1507/endocrj.EJ14-0300. PMID: 25312747.

134. Monteleone P, Parrini D, Faviana P, Carletti E, Casarosa E, Uccelli A, et al. 2011; Female infertility related to thyroid autoimmunity: the ovarian follicle hypothesis. Am J Reprod Immunol. 66(2):108–14. DOI: 10.1111/j.1600-0897.2010.00961.x. PMID: 21241400.

135. Ott J, Aust S, Kurz C, Nouri K, Wirth S, Huber JC, et al. 2010; Elevated antithyroid peroxidase antibodies indicating Hashimoto's thyroiditis are associated with the treatment response in infertile women with polycystic ovary syndrome. Fertil Steril. 94(7):2895–7. DOI: 10.1016/j.fertnstert.2010.05.063. PMID: 20638057.

136. Karmon AE, Batsis M, Chavarro JE, Souter I. 2015; Preconcep-tional thyroid-stimulating hormone levels and outcomes of intrauterine insemination among euthyroid infertile women. Fertil Steril. 103(1):258–63 e1. DOI: 10.1016/j.fertnstert.2014.09.035. PMID: 25439842.

137. Pekcan MK, Ozgu-Erdinc AS, Yilmaz N. 2019; Impact of subclinical hypothyroidism and thyroid autoimmunity on clinical pregnancy rate after intrauterine insemination in euthyroid women. JBRA Assist Reprod. 23(2):137–42. DOI: 10.5935/1518-0557.20190027. PMID: 30951274. PMCID: PMC6501743.
138. Fumarola A, Grani G, Romanzi D, Del Sordo M, Bianchini M, Aragona A, et al. 2013; Thyroid function in infertile patients undergoing assisted reproduction. Am J Reprod Immunol. 70(4):336–41. DOI: 10.1111/aji.12113. PMID: 23521347.

139. Baker VL, Rone HM, Pasta DJ, Nelson HP, Gvakharia M, Adamson GD. 2006; Correlation of thyroid stimulating hormone (TSH) level with pregnancy outcome in women undergoing in vitro fertilization. Am J Obstet Gynecol. 194(6):1668–74. discussion 74–5. DOI: 10.1016/j.ajog.2006.03.040. PMID: 16731084.

140. Reh A, Grifo J, Danoff A. 2010; What is a normal thyroid-stimulating hormone (TSH) level? Effects of stricter TSH thresholds on pregnancy outcomes after in vitro fertilization. Fertil Steril. 94(7):2920–2. DOI: 10.1016/j.fertnstert.2010.06.041. PMID: 20655528.

141. Weghofer A, Himaya E, Kushnir VA, Barad DH, Gleicher N. 2015; The impact of thyroid function and thyroid autoimmunity on embryo quality in women with low functional ovarian reserve: a case-control study. Reprod Biol Endocrinol. 13:43. DOI: 10.1186/s12958-015-0041-0. PMID: 25975563. PMCID: PMC4443631.

142. Aghahosseini M, Asgharifard H, Aleyasin A, Tehrani Banihashemi A. 2014; Effects of thyroid stimulating hormone (TSH) level on clinical pregnancy rate via in vitro fertilization (IVF) procedure. Med J Islam Repub Iran. 28:46.
143. Green KA, Werner MD, Franasiak JM, Juneau CR, Hong KH, Scott RT Jr. 2015; Investigating the optimal preconception TSH range for patients undergoing IVF when controlling for embryo quality. J Assist Reprod Genet. 32(10):1469–76. DOI: 10.1007/s10815-015-0549-4. PMID: 26280527. PMCID: PMC4615921.

144. So S, Yamaguchi W, Murabayashi N, Miyano N, Tawara F. 2020; Effect of moderately increased thyroid-stimulating hormone levels and presence of thyroid antibodies on pregnancy among infertile women. Reprod Med Biol. 19(1):82–8. DOI: 10.1002/rmb2.12306. PMID: 31956289. PMCID: PMC6955587.

145. Karakis LS, Kiyak H, Okmen B, Ozdemir C, Turkgeldi E. 2021; Impact of preconceptional serum thyroid stimulating hormone values ranging between 2.5 and 4.5 mIU/L on live birth rates following ovulation induction and intrauterine insemination treatment for unexplained infertility. BMC Womens Health. 21(1):162. DOI: 10.1186/s12905-021-01299-0. PMID: 33874925. PMCID: PMC8056662.
146. Chai J, Yeung WY, Lee CY, Li HW, Ho PC, Ng HY. 2014; Live birth rates following in vitro fertilization in women with thyroid autoimmunity and/or subclinical hypothyroidism. Clin Endocrinol (Oxf). 80(1):122–7. DOI: 10.1111/cen.12220. PMID: 23566068.
147. Abdel Rahman AH, Aly Abbassy H, Abbassy AA. 2010; Improved in vitro fertilization outcomes after treatment of subclinical hypothyroidism in infertile women. Endocr Pract. 16(5):792–7. DOI: 10.4158/EP09365.OR. PMID: 20350920.

148. Kim CH, Ahn JW, Kang SP, Kim SH, Chae HD, Kang BM. 2011; Effect of levothyroxine treatment on in vitro fertilization and pregnancy outcome in infertile women with subclinical hypothyroidism undergoing in vitro fertilization/intracytoplasmic sperm injection. Fertil Steril. 95(5):1650–4. DOI: 10.1016/j.fertnstert.2010.12.004. PMID: 21193190.

149. Velkeniers B, Van Meerhaeghe A, Poppe K, Unuane D, Tournaye H, Haentjens P. 2013; Levothyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technologies: systematic review and meta-analysis of RCTs. Hum Reprod Update. 19(3):251–8. DOI: 10.1093/humupd/dms052. PMID: 23327883.
150. Arora H, Collazo I, Palmerola KL, Parmar M, Narasimman M, Hendon N, et al. 2022; Positive effects of thyroid replacement therapy on assisted reproductive technology outcomes in women with subclinical hypothyroidism with positive thyroid peroxidase autoantibodies. F S Rep. 3(1):32–8. DOI: 10.1016/j.xfre.2021.11.006. PMID: 35386496. PMCID: PMC8978068.

151. Jatzko B, Vytiska-Bistorfer E, Pawlik A, Promberger R, Mayerhofer K, Ott J. 2014; The impact of thyroid function on intrauterine insemination outcome--a retrospective analysis. Reprod Biol Endocrinol. 12:28. DOI: 10.1186/1477-7827-12-28. PMID: 24708845. PMCID: PMC3978130.
152. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017; 2017 guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid. 27(3):315–89. DOI: 10.1089/thy.2016.0457. PMID: 28056690.

153. Poppe K, Bisschop P, Fugazzola L, Minziori G, Unuane D, Weghofer A. 2021; 2021 European Thyroid Association guideline on thyroid disorders prior to and during assisted reproduction. Eur Thyroid J. 9(6):281–95. DOI: 10.1159/000512790. PMID: 33718252. PMCID: PMC7923920.

154. Scoccia B, Demir H, Kang Y, Fierro MA, Winston NJ. 2012; In vitro fertilization pregnancy rates in levothyroxine-treated women with hypothyroidism compared to women without thyroid dysfunction disorders. Thyroid. 22(6):631–6. DOI: 10.1089/thy.2011.0343. PMID: 22540326. PMCID: PMC3412578.

155. Busnelli A, Somigliana E, Benaglia L, Leonardi M, Ragni G, Fedele L. 2013; In vitro fertilization outcomes in treated hypothyroidism. Thyroid. 23(10):1319–25. DOI: 10.1089/thy.2013.0044. PMID: 23544891.
156. Pelliccione F, Lania A, Pizzocaro A, Cafaro L, Negri L, Morenghi E, et al. 2018; Levothyroxine supplementation on assisted reproduction technology (ART) outcomes in women with subtle hypothyroidism: a retrospective study. Gynecol Endocrinol. 34(12):1053–8. DOI: 10.1080/09513590.2018.1499087. PMID: 30129807.

157. Zhong YP, Ying Y, Wu HT, Zhou CQ, Xu YW, Wang Q, et al. 2012; Relationship between antithyroid antibody and pregnancy outcome following in vitro fertilization and embryo transfer. Int J Med Sci. 9(2):121–5. DOI: 10.7150/ijms.3467. PMID: 22253557. PMCID: PMC3258552.

158. Tan S, Dieterle S, Pechlavanis S, Janssen OE, Fuhrer D. 2014; Thyroid autoantibodies per se do not impair intracytoplasmic sperm injection outcome in euthyroid healthy women. Eur J Endocrinol. 170(4):495–500. DOI: 10.1530/EJE-13-0790. PMID: 24394727.

159. Lukaszuk K, Kunicki M, Kulwikowska P, Liss J, Pastuszek E, Jaszczolt M, et al. 2015; The impact of the presence of antithyroid antibodies on pregnancy outcome following intracytoplasmatic sperm injection-ICSI and embryo transfer in women with normal thyreotropine levels. J Endocrinol Invest. 38(12):1335–43. DOI: 10.1007/s40618-015-0377-5. PMID: 26280321.
160. Karacan M, Alwaeely F, Cebi Z, Berberoglugil M, Batukan M, Ulug M, et al. 2013; Effect of antithyroid antibodies on ICSI outcome in antiphospholipid antibody-negative euthyroid women. Reprod Biomed Online. 27(4):376–80. DOI: 10.1016/j.rbmo.2013.07.002. PMID: 23953066.
161. Toulis KA, Goulis DG, Venetis CA, Kolibianakis EM, Negro R, Tarlatzis BC, et al. 2010; Risk of spontaneous miscarriage in euthyroid women with thyroid autoimmunity undergoing IVF: a meta-analysis. Eur J Endocrinol. 162(4):643–52. DOI: 10.1530/EJE-09-0850. PMID: 19955261.

162. Inagaki Y, Takeshima K, Nishi M, Ariyasu H, Doi A, Kurimoto C, et al. 2020; The influence of thyroid autoimmunity on pregnancy outcome in infertile women: a prospective study. Endocr J. 67(8):859–68. DOI: 10.1507/endocrj.EJ19-0604. PMID: 32336697.

163. Negro R, Mangieri T, Coppola L, Presicce G, Casavola EC, Gismondi R, et al. 2005; Levothyroxine treatment in thyroid peroxidase antibody-positive women undergoing assisted reproduction technologies: a prospective study. Hum Reprod. 20(6):1529–33. DOI: 10.1093/humrep/deh843. PMID: 15878930.

164. Revelli A, Casano S, Piane LD, Grassi G, Gennarelli G, Guidetti D, et al. 2009; A retrospective study on IVF outcome in euthyroid patients with anti-thyroid antibodies: effects of levothyroxine, acetyl-salicylic acid and prednisolone adjuvant treatments. Reprod Biol Endocrinol. 7:137. DOI: 10.1186/1477-7827-7-137. PMID: 19941670. PMCID: PMC2788572.
165. Poppe K, Unuane D, D'Haeseleer M, Tournaye H, Schiettecatte J, Haentjens P, et al. 2011; Thyroid function after controlled ovarian hyperstimulation in women with and without the hyperstimulation syndrome. Fertil Steril. 96(1):241–5. DOI: 10.1016/j.fertnstert.2011.04.039. PMID: 21565336.
166. Poppe K, Glinoer D, Tournaye H, Schiettecatte J, Devroey P, van Steirteghem A, et al. 2004; Impact of ovarian hyperstimu-lation on thyroid function in women with and without thyroid autoimmunity. J Clin Endocrinol Metab. 89(8):3808–12. DOI: 10.1210/jc.2004-0105. PMID: 15292309.

167. Mintziori G, Goulis DG, Toulis KA, Venetis CA, Kolibianakis EM, Tarlatzis BC. 2011; Thyroid function during ovarian stimulation: a systematic review. Fertil Steril. 96(3):780–5. DOI: 10.1016/j.fertnstert.2011.06.020. PMID: 21742326.

168. Muller AF, Verhoeff A, Mantel MJ, De Jong FH, Berghout A. 2000; Decrease of free thyroxine levels after controlled ovarian hyperstimulation. J Clin Endocrinol Metab. 85(2):545–8. DOI: 10.1210/jc.85.2.545. PMID: 10690853.
169. Poppe K, Glinoer D, Tournaye H, Schiettecatte J, Haentjens P, Velkeniers B. 2005; Thyroid function after assisted reproductive technology in women free of thyroid disease. Fertil Steril. 83(6):1753–7. DOI: 10.1016/j.fertnstert.2004.12.036. PMID: 15950647.

170. Gracia CR, Morse CB, Chan G, Schilling S, Prewitt M, Sammel MD, et al. 2012; Thyroid function during controlled ovarian hyperstimulation as part of in vitro fertilization. Fertil Steril. 97(3):585–91. DOI: 10.1016/j.fertnstert.2011.12.023. PMID: 22260853. PMCID: PMC3477594.
171. Reinblatt S, Herrero B, Correa JA, Shalom-Paz E, Ata B, Wiser A, et al. 2013; Thyroid stimulating hormone levels rise after assisted reproductive technology. J Assist Reprod Genet. 30(10):1347–52. DOI: 10.1007/s10815-013-0081-3. PMID: 23955685. PMCID: PMC3824851.

172. Benaglia L, Busnelli A, Somigliana E, Leonardi M, Vannucchi G, De Leo S, et al. 2014; Incidence of elevation of serum thyroid-stimulating hormone during controlled ovarian hyper-stimulation for in vitro fertilization. Eur J Obstet Gynecol Reprod Biol. 173:53–7. DOI: 10.1016/j.ejogrb.2013.11.003. PMID: 24332278.

173. Busnelli A, Somigliana E, Benaglia L, Sarais V, Ragni G, Fedele L. 2014; Thyroid axis dysregulation during in vitro fertilization in hypothyroid-treated patients. Thyroid. 24(11):1650–5. DOI: 10.1089/thy.2014.0088. PMID: 25089619.
174. Haddow JE, Palomaki GE, Allan WC, Williams JR, Knight GJ, Gagnon J, et al. 1999; Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med. 341(8):549–55. DOI: 10.1056/NEJM199908193410801. PMID: 10451459.
175. van den Boogaard E, Vissenberg R, Land JA, van Wely M, Ven der Post JA, Goddijn M, et al. 2016; Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update. 22(4):532–3. DOI: 10.1093/humupd/dmw003. PMID: 26906092.
176. Turunen S, Vaarasmaki M, Marttila R, Leinonen MK, Gissler M, Mannisto T, et al. 2022; Indications for intensive care unit treatment among neonates born to mothers with thyroid disease: a population-based cohort study. Acta Obstet Gynecol Scand. 101(10):1093–101. DOI: 10.1111/aogs.14413. PMID: 35778835. PMCID: PMC9812201.

177. Abalovich M, Gutierrez S, Alcaraz G, Maccallini G, Garcia A, Levalle O. 2002; Overt and subclinical hypothyroidism complicating pregnancy. Thyroid. 12(1):63–8. DOI: 10.1089/105072502753451986. PMID: 11838732.
178. Leung AS, Millar LK, Koonings PP, Montoro M, Mestman JH. 1993; Perinatal outcome in hypothyroid pregnancies. Obstet Gynecol. 81(3):349–53. DOI: 10.1016/0020-7292(93)90343-U. PMID: 8437784.
179. Allan WC, Haddow JE, Palomaki GE, Williams JR, Mitchell ML, Hermos RJ, et al. 2000; Maternal thyroid deficiency and pregnancy complications: implications for population screening. J Med Screen. 7(3):127–30. DOI: 10.1136/jms.7.3.127. PMID: 11126160.
180. Negro R, Schwartz A, Gismondi R, Tinelli A, Mangieri T, Stagnaro-Green A. 2010; Universal screening versus case finding for detection and treatment of thyroid hormonal dysfunction during pregnancy. J Clin Endocrinol Metab. 95(4):1699–707. DOI: 10.1210/jc.2009-2009. PMID: 20130074.
181. Negro R, Schwartz A, Gismondi R, Tinelli A, Mangieri T, Stagnaro-Green A. 2010; Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy. J Clin Endocrinol Metab. 95(9):E44–8. DOI: 10.1210/jc.2010-0340. PMID: 20534758.
182. Casey BM, Dashe JS, Wells CE, McIntire DD, Byrd W, Leveno KJ, et al. 2005; Subclinical hypothyroidism and pregnancy outcomes. Obstet Gynecol. 105(2):239–45. DOI: 10.1097/01.AOG.0000152345.99421.22. PMID: 15684146.
183. Benhadi N, Wiersinga WM, Reitsma JB, Vrijkotte TG, Bonsel GJ. 2009; Higher maternal TSH levels in pregnancy are associated with increased risk for miscarriage, fetal or neonatal death. Eur J Endocrinol. 160(6):985–91. DOI: 10.1530/EJE-08-0953. PMID: 19273570.
184. Ashoor G, Maiz N, Rotas M, Jawdat F, Nicolaides KH. 2010; Maternal thyroid function at 11 to 13 weeks of gestation and subsequent fetal death. Thyroid. 20(9):989–93. DOI: 10.1089/thy.2010.0058. PMID: 20718684.
185. Cleary-Goldman J, Malone FD, Lambert-Messerlian G, Sullivan L, Canick J, Porter TF, et al. 2008; Maternal thyroid hypofunction and pregnancy outcome. Obstet Gynecol. 112(1):85–92. DOI: 10.1097/AOG.0b013e3181788dd7. PMID: 18591312. PMCID: PMC4949950.
186. Mannisto T, Vaarasmaki M, Pouta A, Hartikainen AL, Ruokonen A, Surcel HM, et al. 2010; Thyroid dysfunction and autoantibodies during pregnancy as predictive factors of pregnancy complications and maternal morbidity in later life. J Clin Endocrinol Metab. 95(3):1084–94. DOI: 10.1210/jc.2009-1904. PMID: 20080846.

187. Medici M, Korevaar TI, Visser WE, Visser TJ, Peeters RP. 2015; Thyroid function in pregnancy: what is normal? Clin Chem. 61(5):704–13. DOI: 10.1373/clinchem.2014.236646. PMID: 25829408.
188. Toloza FJK, Derakhshan A, Mannisto T, Bliddal S, Popova PV, Carty DM, et al. 2022; Association between maternal thyroid function and risk of gestational hypertension and pre-eclampsia: a systematic review and individual-participant data meta-analysis. Lancet Diabetes Endocrinol. 10(4):243–52. DOI: 10.1016/S2213-8587(22)00007-9. PMID: 35255260.
189. Wilson KL, Casey BM, McIntire DD, Halvorson LM, Cunningham FG. 2012; Subclinical thyroid disease and the incidence of hypertension in pregnancy. Obstet Gynecol. 119(2 Pt 1):315–20. DOI: 10.1097/AOG.0b013e318240de6a. PMID: 22270283.
190. Panagiotou G, Taylor PN, Rees DA, Okosieme OE. 2022; Late offspring effects of antenatal thyroid screening. Br Med Bull. 143(1):16–29. DOI: 10.1093/bmb/ldac018. PMID: 35868487.
191. Lazarus JH, Bestwick JP, Channon S, Paradice R, Maina A, Rees R, et al. 2012; Antenatal thyroid screening and childhood cognitive function. N Engl J Med. 366(6):493–501. DOI: 10.1056/NEJMoa1106104. PMID: 22316443. PMCID: PMC3814060.

192. Casey BM, Thom EA, Peaceman AM, Varner MW, Sorokin Y, Hirtz DG, et al. 2017; Treatment of subclinical hypothyroidism or hypothyroxinemia in pregnancy. N Engl J Med. 376(9):815–25. DOI: 10.1056/NEJMoa1606205. PMID: 28249134. PMCID: PMC5605129.
193. Downing S, Halpern L, Carswell J, Brown RS. 2012; Severe maternal hypothyroidism corrected prior to the third trimester is associated with normal cognitive outcome in the offspring. Thyroid. 22(6):625–30. DOI: 10.1089/thy.2011.0257. PMID: 22574629.
194. Momotani N, Iwama S, Momotani K. 2012; Neurodevelopment in children born to hypothyroid mothers restored to normal thyroxine (T(4)) concentration by late pregnancy in Japan: no apparent influence of maternal T(4) deficiency. J Clin Endocrinol Metab. 97(4):1104–8. DOI: 10.1210/jc.2011-2797. PMID: 22319040.
195. Liu H, Momotani N, Noh JY, Ishikawa N, Takebe K, Ito K. 1994; Maternal hypothyroidism during early pregnancy and intellectual development of the progeny. Arch Intern Med. 154(7):785–7. DOI: 10.1001/archinte.1994.00420070109012. PMID: 8147683.
196. Pop VJ, Brouwers EP, Vader HL, Vulsma T, van Baar AL, de Vijlder JJ. 2003; Maternal hypothyroxinaemia during early pregnancy and subsequent child development: a 3-year follow-up study. Clin Endocrinol (Oxf). 59(3):282–8. DOI: 10.1046/j.1365-2265.2003.01822.x. PMID: 12919150.
197. Sahu MT, Das V, Mittal S, Agarwal A, Sahu M. 2010; Overt and subclinical thyroid dysfunction among Indian pregnant women and its effect on maternal and fetal outcome. Arch Gynecol Obstet. 281(2):215–20. DOI: 10.1007/s00404-009-1105-1. PMID: 19437026.
198. Su PY, Huang K, Hao JH, Xu YQ, Yan SQ, Li T, et al. 2011; Maternal thyroid function in the first twenty weeks of pregnancy and subsequent fetal and infant development: a prospective population-based cohort study in China. J Clin Endocrinol Metab. 96(10):3234–41. DOI: 10.1210/jc.2011-0274. PMID: 21832110.
199. Henrichs J, Ghassabian A, Peeters RP, Tiemeier H. 2013; Maternal hypothyroxinemia and effects on cognitive functioning in childhood: how and why? Clin Endocrinol (Oxf). 79(2):152–62. DOI: 10.1111/cen.12227. PMID: 23600900.
200. Medici M, Timmermans S, Visser W, de Muinck Keizer-Schrama SM, Jaddoe VW, Hofman A, et al. 2013; Maternal thyroid hormone parameters during early pregnancy and birth weight: the generation R study. J Clin Endocrinol Metab. 98(1):59–66. DOI: 10.1210/jc.2012-2420. PMID: 23150694.
201. Nazarpour S, Ramezani Tehrani F, Rahmati M, Amiri M, Azizi F. 2022; Effects of isolated maternal hypothyroxinemia on adverse pregnancy outcomes. Arch Gynecol Obstet. 305(4):903–11. DOI: 10.1007/s00404-021-06226-0. PMID: 34482473.

202. Avramovska M, Karanfilski B, Dimitrov G, Dzikova E, Daneva Markova A, Hadzi Lega M, et al. 2021; Isolated maternal hypothyroxinemia and its perinatal outcome in North Macedonia. Acta Clin Croat. 60(2):246–53. DOI: 10.20471/acc.2021.60.02.10. PMID: 34744274. PMCID: PMC8564836.
203. Chen L, Yang H, Ye E, Lin Z, Peng M, Lin H, et al. 2020; Insignificant effect of isolated hypothyroxinemia on pregnancy outcomes during the first and second trimester of pregnancy. Front Endocrinol (Lausanne). 11:528146. DOI: 10.3389/fendo.2020.528146. PMID: 33178133. PMCID: PMC7596376.
204. Gong X, Liu A, Li Y, Sun H, Li Y, Li C, et al. 2019; The impact of isolated maternal hypothyroxinemia during the first and second trimester of gestation on pregnancy outcomes: an intervention and prospective cohort study in China. J Endocrinol Invest. 42(5):599–607. DOI: 10.1007/s40618-018-0960-7. PMID: 30334197. PMCID: PMC6476837.
205. Hamm MP, Cherry NM, Martin JW, Bamforth F, Burstyn I. 2009; The impact of isolated maternal hypothyroxinemia on perinatal morbidity. J Obstet Gynaecol Can. 31(11):1015–21. DOI: 10.1016/S1701-2163(16)34345-6. PMID: 20175339.
206. Casey BM, Dashe JS, Spong CY, McIntire DD, Leveno KJ, Cunningham GF. 2007; Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy. Obstet Gynecol. 109(5):1129–35. DOI: 10.1097/01.AOG.0000262054.03531.24. PMID: 17470594.
207. Turunen S, Vaarasmaki M, Mannisto T, Hartikainen AL, Lahesmaa-Korpinen AM, Gissler M, et al. 2019; Pregnancy and perinatal outcome among hypothyroid mothers: a population-based cohort study. Thyroid. 29(1):135–41. DOI: 10.1089/thy.2018.0311. PMID: 30417761.
208. Alexander EK, Marqusee E, Lawrence J, Jarolim P, Fischer GA, Larsen PR. 2004; Timing and magnitude of increases in levothyroxine requirements during pregnancy in women with hypothyroidism. N Engl J Med. 351(3):241–9. DOI: 10.1056/NEJMoa040079. PMID: 15254282.
209. Mandel SJ, Larsen PR, Seely EW, Brent GA. 1990; Increased need for thyroxine during pregnancy in women with primary hypothyroidism. N Engl J Med. 323(2):91–6. DOI: 10.1056/NEJM199007123230204. PMID: 2359428.
210. Kaplan MM. 1992; Monitoring thyroxine treatment during pregnancy. Thyroid. 2(2):147–52. DOI: 10.1089/thy.1992.2.147. PMID: 1525583.
211. Loh JA, Wartofsky L, Jonklaas J, Burman KD. 2009; The magnitude of increased levothyroxine requirements in hypothyroid pregnant women depends upon the etiology of the hypothyroidism. Thyroid. 19(3):269–75. DOI: 10.1089/thy.2008.0413. PMID: 19265498.
212. Yassa L, Marqusee E, Fawcett R, Alexander EK. 2010; Thyroid hormone early adjustment in pregnancy (the THERAPY) trial. J Clin Endocrinol Metab. 95(7):3234–41. DOI: 10.1210/jc.2010-0013. PMID: 20463094.
213. Rotondi M, Mazziotti G, Sorvillo F, Piscopo M, Cioffi M, Amato G, et al. 2004; Effects of increased thyroxine dosage pre-conception on thyroid function during early pregnancy. Eur J Endocrinol. 151(6):695–700. DOI: 10.1530/eje.0.1510695. PMID: 15588235.
214. Abalovich M, Alcaraz G, Kleiman-Rubinsztein J, Pavlove MM, Cornelio C, Levalle O, et al. 2010; The relationship of preconception thyrotropin levels to requirements for increasing the levothyroxine dose during pregnancy in women with primary hypothyroidism. Thyroid. 20(10):1175–8. DOI: 10.1089/thy.2009.0457. PMID: 20860419.
215. Galofré JC, Haber RS, Mitchell AA, Pessah R, Davies TF. 2010; Increased postpartum thyroxine replacement in Hashimoto's thyroiditis. Thyroid. 20(8):901–8. DOI: 10.1089/thy.2009.0391.
216. Li N, Yang J, Chen X, Huang J, Lai M, Fang F, et al. 2020; Postpartum follow-up of patients with subclinical hypothyroidism during pregnancy. Thyroid. 30(11):1566–73. DOI: 10.1089/thy.2019.0714. PMID: 32375594.
217. Braverman LE, Utiger RD. Braverman LE, Utiger RD, editors. 2005. Introduction to thyrotoxicosis. Werner & Ingbar's the thyroid: a fundamental and clinical text. 9th ed. Lippincott, Williams & Wilkins;Philadelphia, PA: p. 453–5.
218. Cooper DS, Laurberg P. 2013; Hyperthyroidism in pregnancy. Lancet Diabetes Endocrinol. 1(3):238–49. DOI: 10.1016/S2213-8587(13)70086-X. PMID: 24622372.
219. Dong AC, Stagnaro-Green A. 2019; Differences in diagnostic criteria mask the true prevalence of thyroid disease in pregnancy: a systematic review and meta-analysis. Thyroid. 29(2):278–89. DOI: 10.1089/thy.2018.0475. PMID: 30444186.
220. Fan J, Zhang Y, Zhang C, Barjaktarovic M, Yang X, Peeters RP, et al. 2019; Persistency of thyroid dysfunction from early to late pregnancy. Thyroid. 29(10):1475–84. DOI: 10.1089/thy.2019.0115. PMID: 31347461.
221. Kinomoto-Kondo S, Umehara N, Sato S, Ogawa K, Fujiwara T, Arata N, et al. 2017; The effects of gestational transient thyrotoxicosis on the perinatal outcomes: a case-control study. Arch Gynecol Obstet. 295(1):87–93. DOI: 10.1007/s00404-016-4219-2. PMID: 27766407.
222. Fraenkel M, Shafat T, Cahn A, Erez O, Novack V, Tsur A. 2018; Low thyroid-stimulating hormone and its persistence beyond the first trimester of pregnancy. Int J Gynaecol Obstet. 142(3):270–6. DOI: 10.1002/ijgo.12540. PMID: 29856070.
223. Tan JY, Loh KC, Yeo GS, Chee YC. 2002; Transient hyperthyroidism of hyperemesis gravidarum. BJOG. 109(6):683–8. DOI: 10.1111/j.1471-0528.2002.01223.x. PMID: 12118648.
224. Niebyl JR. 2010; Clinical practice. Nausea and vomiting in pregnancy. N Engl J Med. 363(16):1544–50. DOI: 10.1056/NEJMcp1003896. PMID: 20942670.
225. Verberg MF, Gillott DJ, Al-Fardan N, Grudzinskas JG. 2005; Hyperemesis gravidarum, a literature review. Hum Reprod Update. 11(5):527–39. DOI: 10.1093/humupd/dmi021. PMID: 16006438.
226. Grun JP, Meuris S, De Nayer P, Glinoer D. 1997; The thyrotrophic role of human chorionic gonadotrophin (hCG) in the early stages of twin (versus single) pregnancies. Clin Endocrinol (Oxf). 46(6):719–25. DOI: 10.1046/j.1365-2265.1997.2011011.x. PMID: 9274703.
227. Hershman JM. 1999; Human chorionic gonadotropin and the thyroid: hyperemesis gravidarum and trophoblastic tumors. Thyroid. 9(7):653–7. DOI: 10.1089/thy.1999.9.653. PMID: 10447009.
228. Rodien P, Bremont C, Sanson ML, Parma J, Van Sande J, Costagliola S, et al. 1998; Familial gestational hyperthyroidism caused by a mutant thyrotropin receptor hypersensitive to human chorionic gonadotropin. N Engl J Med. 339(25):1823–6. DOI: 10.1056/NEJM199812173392505. PMID: 9854118.
229. Goodwin TM, Montoro M, Mestman JH. 1992; Transient hyperthyroidism and hyperemesis gravidarum: clinical aspects. Am J Obstet Gynecol. 167(3):648–52. DOI: 10.1016/S0002-9378(11)91565-8. PMID: 1382389.
230. Bouillon R, Naesens M, Van Assche FA, De Keyser L, De Moor P, Renaer M, et al. 1982; Thyroid function in patients with hyperemesis gravidarum. Am J Obstet Gynecol. 143(8):922–6. DOI: 10.1016/0002-9378(82)90475-6. PMID: 7102767.
231. Laurberg P, Bournaud C, Karmisholt J, Orgiazzi J. 2009; Management of Graves' hyperthyroidism in pregnancy: focus on both maternal and foetal thyroid function, and caution against surgical thyroidectomy in pregnancy. Eur J Endocrinol. 160(1):1–8. DOI: 10.1530/EJE-08-0663. PMID: 18849306.
232. de Jong JA, Verkooijen HM, Valk GD, Zelissen PM, de Keizer B. 2013; High failure rates after (131)I therapy in Graves hyperthyroidism patients with large thyroid volumes, high iodine uptake, and high iodine turnover. Clin Nucl Med. 38(6):401–6. DOI: 10.1097/RLU.0b013e3182817c78. PMID: 23579983.
233. Schneider DF, Sonderman PE, Jones MF, Ojomo KA, Chen H, Jaume JC, et al. 2014; Failure of radioactive iodine in the treatment of hyperthyroidism. Ann Surg Oncol. 21(13):4174–80. DOI: 10.1245/s10434-014-3858-4. PMID: 25001092. PMCID: PMC4330099.
234. Millar LK, Wing DA, Leung AS, Koonings PP, Montoro MN, Mestman JH. 1994; Low birth weight and preeclampsia in pregnancies complicated by hyperthyroidism. Obstet Gynecol. 84(6):946–9.
235. Papendieck P, Chiesa A, Prieto L, Gruneiro-Papendieck L. 2009; Thyroid disorders of neonates born to mothers with Graves' disease. J Pediatr Endocrinol Metab. 22(6):547–53. DOI: 10.1515/JPEM.2009.22.6.547. PMID: 19694202.
236. Phoojaroenchanachai M, Sriussadaporn S, Peerapatdit T, Vannasaeng S, Nitiyanant W, Boonnamsiri V, et al. 2001; Effect of maternal hyperthyroidism during late pregnancy on the risk of neonatal low birth weight. Clin Endocrinol (Oxf). 54(3):365–70. DOI: 10.1046/j.1365-2265.2001.01224.x. PMID: 11298089.
237. Sheffield JS, Cunningham FG. 2004; Thyrotoxicosis and heart failure that complicate pregnancy. Am J Obstet Gynecol. 190(1):211–7. DOI: 10.1016/S0002-9378(03)00944-X. PMID: 14749662.
238. Turunen S, Vaarasmaki M, Lahesmaa-Korpinen AM, Leinonen MK, Gissler M, Mannisto T, et al. 2020; Maternal hyperthyroidism and pregnancy outcomes: a population-based cohort study. Clin Endocrinol (Oxf). 93(6):721–8. DOI: 10.1111/cen.14282. PMID: 32657434.
239. Andersen SL, Andersen S, Vestergaard P, Olsen J. 2018; Maternal thyroid function in early pregnancy and child neurodevelopmental disorders: a Danish nationwide case-cohort study. Thyroid. 28(4):537–46. DOI: 10.1089/thy.2017.0425. PMID: 29584590.
240. Levie D, Korevaar TIM, Mulder TA, Bath SC, Dineva M, Lopez-Espinosa MJ, et al. 2019; Maternal thyroid function in early pregnancy and child attention-deficit hyperactivity disorder: an individual-participant meta-analysis. Thyroid. 29(9):1316–26. DOI: 10.1089/thy.2018.0794. PMID: 31426724.
241. Ge GM, Leung MTY, Man KKC, Leung WC, Ip P, Li GHY, et al. 2020; Maternal thyroid dysfunction during pregnancy and the risk of adverse outcomes in the offspring: a systematic review and meta-analysis. J Clin Endocrinol Metab. 105(12):dgaa555. DOI: 10.1210/clinem/dgaa555. PMID: 32810262.
242. Mandel SJ, Cooper DS. 2001; The use of antithyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab. 86(6):2354–9. DOI: 10.1210/jcem.86.6.7573. PMID: 11397822.
243. Andersen SL, Olsen J, Laurberg P. 2016; Antithyroid drug side effects in the population and in pregnancy. J Clin Endocrinol Metab. 101(4):1606–14. DOI: 10.1210/jc.2015-4274. PMID: 26815881.
244. Bahn RS, Burch HS, Cooper DS, Garber JR, Greenlee CM, Klein IL, et al. 2009; The role of propylthiouracil in the management of Graves' disease in adults: report of a meeting jointly sponsored by the American Thyroid Association and the Food and Drug Administration. Thyroid. 19(7):673–4. DOI: 10.1089/thy.2009.0169. PMID: 19583480.
245. Rivkees SA, Mattison DR. 2009; Propylthiouracil (PTU) hepatoxicity in children and recommendations for discontinuation of use. Int J Pediatr Endocrinol. 2009:132041. DOI: 10.1186/1687-9856-2009-132041.
246. Clementi M, Di Gianantonio E, Pelo E, Mammi I, Basile RT, Tenconi R. 1999; Methimazole embryopathy: delineation of the phenotype. Am J Med Genet. 83(1):43–6. DOI: 10.1002/(SICI)1096-8628(19990305)83:1<43::AID-AJMG8>3.0.CO;2-C.
247. Clementi M, Di Gianantonio E, Cassina M, Leoncini E, Botto LD, Mastroiacovo P, et al. 2010; Treatment of hyperthyroidism in pregnancy and birth defects. J Clin Endocrinol Metab. 95(11):E337–41. DOI: 10.1210/jc.2010-0652. PMID: 20668039.
248. Barbero P, Valdez R, Rodriguez H, Tiscornia C, Mansilla E, Allons A, et al. 2008; Choanal atresia associated with maternal hyperthyroidism treated with methimazole: a case-control study. Am J Med Genet A. 146A(18):2390–5. DOI: 10.1002/ajmg.a.32497. PMID: 18698631.
249. Andersen SL, Olsen J, Wu CS, Laurberg P. 2013; Birth defects after early pregnancy use of antithyroid drugs: a Danish nationwide study. J Clin Endocrinol Metab. 98(11):4373–81. DOI: 10.1210/jc.2013-2831. PMID: 24151287.
250. Seo GH, Kim TH, Chung JH. 2018; Antithyroid drugs and congenital malformations: a nationwide Korean cohort study. Ann Intern Med. 168(6):405–13. DOI: 10.7326/M17-1398. PMID: 29357398.
251. Miao Y, Xu Y, Teng P, Wang A, Zhang Y, Zhou Y, et al. 2022; Efficacy of propylthiouracil in the treatment of pregnancy with hyperthyroidism and its effect on pregnancy outcomes: a meta-analysis. PLoS One. 17(3):e0265085. DOI: 10.1371/journal.pone.0265085. PMID: 35271661. PMCID: PMC8912150.
252. Morales DR, Fonkwen L, Nordeng HME. 2021; Antithyroid drug use during pregnancy and the risk of birth defects in offspring: systematic review and meta-analysis of observational studies with methodological considerations. Br J Clin Pharmacol. 87(10):3890–900. DOI: 10.1111/bcp.14805. PMID: 33783857.
253. Song R, Lin H, Chen Y, Zhang X, Feng W. 2017; Effects of methimazole and propylthiouracil exposure during pregnancy on the risk of neonatal congenital malformations: a meta-analysis. PLoS One. 12(7):e0180108. DOI: 10.1371/journal.pone.0180108. PMID: 28671971. PMCID: PMC5495385.
254. Yu W, Wu N, Li L, Wang J, OuYang H, Shen H. 2020; Side effects of PTU and MMI in the treatment of hyperthyroidism: a systematic review and meta-analysis. Endocr Pract. 26(2):207–17. DOI: 10.4158/EP-2019-0221. PMID: 31652102.
255. Laurberg P, Andersen SL. 2014; Therapy of endocrine disease: antithyroid drug use in early pregnancy and birth defects: time windows of relative safety and high risk? Eur J Endocrinol. 171(1):R13–20. DOI: 10.1530/EJE-14-0135. PMID: 24662319.
256. Andersen SL, Olsen J, Wu CS, Laurberg P. 2014; Severity of birth defects after propylthiouracil exposure in early pregnancy. Thyroid. 24(10):1533–40. DOI: 10.1089/thy.2014.0150. PMID: 24963758. PMCID: PMC4195247.
257. Laurberg P, Krejbjerg A, Andersen SL. 2014; Relapse following antithyroid drug therapy for Graves' hyperthyroidism. Curr Opin Endocrinol Diabetes Obes. 21(5):415–21. DOI: 10.1097/MED.0000000000000088. PMID: 25111942.

258. Cooper DS. 2003; Antithyroid drugs in the management of patients with Graves' disease: an evidence-based approach to therapeutic controversies. J Clin Endocrinol Metab. 88(8):3474–81. DOI: 10.1210/jc.2003-030185. PMID: 12915620.
259. Rubin PC. 1981; Current concepts: beta-blockers in pregnancy. N Engl J Med. 305(22):1323–6. DOI: 10.1056/NEJM198111263052205. PMID: 6117014.
260. Sherif IH, Oyan WT, Bosairi S, Carrascal SM. 1991; Treatment of hyperthyroidism in pregnancy. Acta Obstet Gynecol Scand. 70(6):461–3. DOI: 10.3109/00016349109007160. PMID: 1763610.
261. Abraham P, Avenell A, McGeoch SC, Clark LF, Bevan JS. 2010; Antithyroid drug regimen for treating Graves' hyperthyroidism. Cochrane Database Syst Rev. 2010(1):CD003420. DOI: 10.1002/14651858.CD003420.pub4. PMID: 20091544. PMCID: PMC6599817.

262. Patil-Sisodia K, Mestman JH. 2010; Graves hyperthyroidism and pregnancy: a clinical update. Endocr Pract. 16(1):118–29. DOI: 10.4158/EP09233.RA. PMID: 19833580.

263. Ochoa-Maya MR, Frates MC, Lee-Parritz A, Seely EW. 1999; Resolution of fetal goiter after discontinuation of propylthiouracil in a pregnant woman with Graves' hyperthyroidism. Thyroid. 9(11):1111–4. DOI: 10.1089/thy.1999.9.1111. PMID: 10595460.

264. Hamburger JI. 1992; Diagnosis and management of Graves' disease in pregnancy. Thyroid. 2(3):219–24. DOI: 10.1089/thy.1992.2.219. PMID: 1422234.
265. Amino N, Tanizawa O, Mori H, Iwatani Y, Yamada T, Kurachi K, et al. 1982; Aggravation of thyrotoxicosis in early pregnancy and after delivery in Graves' disease. J Clin Endocrinol Metab. 55(1):108–12. DOI: 10.1210/jcem-55-1-108. PMID: 6896207.

266. Laurberg P, Nygaard B, Glinoer D, Grussendorf M, Orgiazzi J. 1998; Guidelines for TSH-receptor antibody measurements in pregnancy: results of an evidence-based symposium organized by the European Thyroid Association. Eur J Endocrinol. 139(6):584–6. DOI: 10.1530/eje.0.1390584. PMID: 9916861.
267. Momotani N, Hisaoka T, Noh J, Ishikawa N, Ito K. 1992; Effects of iodine on thyroid status of fetus versus mother in treatment of Graves' disease complicated by pregnancy. J Clin Endocrinol Metab. 75(3):738–44. DOI: 10.1210/jcem.75.3.1517362. PMID: 1517362.
268. Zwaveling-Soonawala N, van Trotsenburg P, Vulsma T. 2009; Central hypothyroidism in an infant born to an adequately treated mother with Graves' disease: an effect of maternally derived thyrotrophin receptor antibodies? Thyroid. 19(6):661–2. DOI: 10.1089/thy.2008.0348. PMID: 19499992.
269. Kempers MJ, van Tijn DA, van Trotsenburg AS, de Vijlder JJ, Wiedijk BM, Vulsma T. 2003; Central congenital hypothyroidism due to gestational hyperthyroidism: detection where prevention failed. J Clin Endocrinol Metab. 88(12):5851–7. DOI: 10.1210/jc.2003-030665. PMID: 14671180.

270. Gruner C, Kollert A, Wildt L, Dorr HG, Beinder E, Lang N. 2001; Intrauterine treatment of fetal goitrous hypothyroidism controlled by determination of thyroid-stimulating hormone in fetal serum. A case report and review of the literature. Fetal Diagn Ther. 16(1):47–51. DOI: 10.1159/000053880. PMID: 11125252.

271. Peleg D, Cada S, Peleg A, Ben-Ami M. 2002; The relationship between maternal serum thyroid-stimulating immunoglobulin and fetal and neonatal thyrotoxicosis. Obstet Gynecol. 99(6):1040–3. DOI: 10.1097/00006250-200206000-00016. PMID: 12052596.
272. Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M, et al. 2005; Management of Graves' disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab. 90(11):6093–8. DOI: 10.1210/jc.2004-2555. PMID: 16118343.

273. Zimmerman D. 1999; Fetal and neonatal hyperthyroidism. Thyroid. 9(7):727–33. DOI: 10.1089/thy.1999.9.727. PMID: 10447021.

274. Yoshihara A, Iwaku K, Noh JY, Watanabe N, Kunii Y, Ohye H, et al. 2019; Incidence of neonatal hyperthyroidism among newborns of Graves' disease patients treated with radioiodine therapy. Thyroid. 29(1):128–34. DOI: 10.1089/thy.2018.0165. PMID: 30426886.

275. van Dijk MM, Smits IH, Fliers E, Bisschop PH. 2018; Maternal thyrotropin receptor antibody concentration and the risk of fetal and neonatal thyrotoxicosis: a systematic review. Thyroid. 28(2):257–64. DOI: 10.1089/thy.2017.0413. PMID: 29325496.

276. Rotondi M, Cappelli C, Pirali B, Pirola I, Magri F, Fonte R, et al. 2008; The effect of pregnancy on subsequent relapse from Graves' disease after a successful course of antithyroid drug therapy. J Clin Endocrinol Metab. 93(10):3985–8. DOI: 10.1210/jc.2008-0966. PMID: 18664537.

277. Benhaim Rochester D, Davies TF. 2005; Increased risk of Graves' disease after pregnancy. Thyroid. 15(11):1287–90. DOI: 10.1089/thy.2005.15.1287. PMID: 16356094.

278. Rotondi M, Pirali B, Lodigiani S, Bray S, Leporati P, Chytiris S, et al. 2008; The post partum period and the onset of Graves' disease: an overestimated risk factor. Eur J Endocrinol. 159(2):161–5. DOI: 10.1530/EJE-08-0236. PMID: 18483014.

279. Amino N, Mori H, Iwatani Y, Tanizawa O, Kawashima M, Tsuge I, et al. 1982; High prevalence of transient post-partum thyrotoxicosis and hypothyroidism. N Engl J Med. 306(14):849–52. DOI: 10.1056/NEJM198204083061405. PMID: 7062963.

280. Qaseem A, Snow V, Owens DK, Shekelle P. Clinical Guidelines Committee of the American College of Physicians. 2010; The development of clinical practice guidelines and guidance statements of the American College of Physicians: summary of methods. Ann Intern Med. 153(3):194–9. DOI: 10.7326/0003-4819-153-3-201008030-00010. PMID: 20679562.

281. Stagnaro-Green A. 2012; Approach to the patient with postpartum thyroiditis. J Clin Endocrinol Metab. 97(2):334–42. DOI: 10.1210/jc.2011-2576. PMID: 22312089.

282. Stagnaro-Green A. 2002; Clinical review 152: postpartum thyroiditis. J Clin Endocrinol Metab. 87(9):4042–7. DOI: 10.1210/jc.2002-020524. PMID: 12213841.
283. Stagnaro-Green A, Schwartz A, Gismondi R, Tinelli A, Mangieri T, Negro R. 2011; High rate of persistent hypothyroidism in a large-scale prospective study of postpartum thyroiditis in Southern Italy. J Clin Endocrinol Metab. 96(3):652–7. DOI: 10.1210/jc.2010-1980. PMID: 21190974.

284. Benvenga S, Di Bari F, Vita R, Le Donne M, Triolo O, Granese R, et al. 2019; Relatively high rate of postpartum thyroiditis in the Straits of Messina area. Predictivity of both postpartum thyroiditis and permanent hypothyroidism by performing, in the first trimester of gestation, thyroid ultrasonography and measurement of serum thyroperoxidase and thyroglobulin autoantibodies. J Clin Transl Endocrinol. 15:12–8. DOI: 10.1016/j.jcte.2018.11.004. PMID: 30555788. PMCID: PMC6275208.

285. Muller AF, Drexhage HA, Berghout A. 2001; Postpartum thyroiditis and autoimmune thyroiditis in women of childbearing age: recent insights and consequences for antenatal and postnatal care. Endocr Rev. 22(5):605–30. DOI: 10.1210/edrv.22.5.0441. PMID: 11588143.

286. Kuijpens JL, De Hann-Meulman M, Vader HL, Pop VJ, Wiersinga WM, Drexhage HA. 1998; Cell-mediated immunity and postpartum thyroid dysfunction: a possibility for the prediction of disease? J Clin Endocrinol Metab. 83(6):1959–66. DOI: 10.1210/jcem.83.6.4838. PMID: 9626126.
287. Stagnaro-Green A, Roman SH, Cobin RH, el-Harazy E, Wallenstein S, Davies TF. 1992; A prospective study of lymphocyte-initiated immunosuppression in normal pregnancy: evidence of a T-cell etiology for postpartum thyroid dysfunction. J Clin Endocrinol Metab. 74(3):645–53. DOI: 10.1210/jcem.74.3.1740500. PMID: 1740500.

288. Smallridge RC. 2000; Postpartum thyroid disease. A model of immunologic dysfunction. Clin Appl Immunol Rev. 1:89–103. DOI: 10.1016/S1529-1049(00)00008-8.

289. Ide A, Amino N, Kang S, Yoshioka W, Kudo T, Nishihara E, et al. 2014; Differentiation of postpartum Graves' thyrotoxicosis from postpartum destructive thyrotoxicosis using antithyrotropin receptor antibodies and thyroid blood flow. Thyroid. 24(6):1027–31. DOI: 10.1089/thy.2013.0585. PMID: 24400892.

290. Nicholson WK, Robinson KA, Smallridge RC, Ladenson PW, Powe NR. 2006; Prevalence of postpartum thyroid dysfunction: a quantitative review. Thyroid. 16(6):573–82. DOI: 10.1089/thy.2006.16.573. PMID: 16839259.

291. Gerstein HC. 1993; Incidence of postpartum thyroid dysfunction in patients with type I diabetes mellitus. Ann Intern Med. 118(6):419–23. DOI: 10.7326/0003-4819-118-6-199303150-00004. PMID: 8439115.

292. Alvarez-Marfany M, Roman SH, Drexler AJ, Robertson C, Stagnaro-Green A. 1994; Long-term prospective study of postpartum thyroid dysfunction in women with insulin dependent diabetes mellitus. J Clin Endocrinol Metab. 79(1):10–6. DOI: 10.1210/jcem.79.1.8027213. PMID: 8027213.
293. Elefsiniotis IS, Vezali E, Pantazis KD, Saroglou G. 2008; Post-partum thyroiditis in women with chronic viral hepatitis. J Clin Virol. 41(4):318–9. DOI: 10.1016/j.jcv.2007.12.010. PMID: 18243783.

294. Stagnaro-Green A, Akhter E, Yim C, Davies TF, Magder L, Petri M. 2011; Thyroid disease in pregnant women with systemic lupus erythematosus: increased preterm delivery. Lupus. 20(7):690–9. DOI: 10.1177/0961203310394894. PMID: 21436215.

295. Tagami T, Hagiwara H, Kimura T, Usui T, Shimatsu A, Naruse M. 2007; The incidence of gestational hyperthyroidism and postpartum thyroiditis in treated patients with Graves' disease. Thyroid. 17(8):767–72. DOI: 10.1089/thy.2007.0003. PMID: 17651013.

296. Manetti L, Parkes AB, Lupi I, Di Cianni G, Bogazzi F, Albertini S, et al. 2008; Serum pituitary antibodies in normal pregnancy and in patients with postpartum thyroiditis: a nested case-control study. Eur J Endocrinol. 159(6):805–9. DOI: 10.1530/EJE-08-0617. PMID: 18787047.

297. Lazarus JH, Ammari F, Oretti R, Parkes AB, Richards CJ, Harris B. 1997; Clinical aspects of recurrent postpartum thyroiditis. Br J Gen Pract. 47(418):305–8.
298. Caixas A, Albareda M, Garcia-Patterson A, Rodriguez-Espinosa J, de Leiva A, Corcoy R. 1999; Postpartum thyroiditis in women with hypothyroidism antedating pregnancy? J Clin Endocrinol Metab. 84(11):4000–5. DOI: 10.1210/jcem.84.11.6144. PMID: 10566640.

299. Marqusee E, Hill JA, Mandel SJ. 1997; Thyroiditis after pregnancy loss. J Clin Endocrinol Metab. 82(8):2455–7. DOI: 10.1210/jc.82.8.2455. PMID: 9253317.
300. Walfish PG, Meyerson J, Provias JP, Vargas MT, Papsin FR. 1992; Prevalence and characteristics of post-partum thyroid dysfunction: results of a survey from Toronto, Canada. J Endocrinol Invest. 15(4):265–72. DOI: 10.1007/BF03348726. PMID: 1512416.

301. Hayslip CC, Fein HG, O'Donnell VM, Friedman DS, Klein TA, Smallridge RC. 1988; The value of serum antimicrosomal antibody testing in screening for symptomatic postpartum thyroid dysfunction. Am J Obstet Gynecol. 159(1):203–9. DOI: 10.1016/0002-9378(88)90522-4. PMID: 3394739.

302. Lazarus JH. 1999; Clinical manifestations of postpartum thyroid disease. Thyroid. 9(7):685–9. DOI: 10.1089/thy.1999.9.685. PMID: 10447015.

303. Pop VJ, de Rooy HA, Vader HL, van der Heide D, van Son M, Komproe IH, et al. 1991; Postpartum thyroid dysfunction and depression in an unselected population. N Engl J Med. 324(25):1815–6. DOI: 10.1056/NEJM199106203242516. PMID: 2064682.

304. Le Donne M, Settineri S, Benvenga S. 2012; Early pospartum alexithymia and risk for depression: relationship with serum thyrotropin, free thyroid hormones and thyroid autoantibodies. Psychoneuroendocrinology. 37(4):519–33. DOI: 10.1016/j.psyneuen.2011.08.001. PMID: 22047958.
305. Bergink V, Pop VJM, Nielsen PR, Agerbo E, Munk-Olsen T, Liu X. 2018; Comorbidity of autoimmune thyroid disorders and psychiatric disorders during the postpartum period: a Danish nationwide register-based cohort study. Psychol Med. 48(8):1291–8. DOI: 10.1017/S0033291717002732. PMID: 28929982.

306. Lucas A, Pizarro E, Granada ML, Salinas I, Sanmarti A. 2001; Postpartum thyroid dysfunction and postpartum depression: are they two linked disorders? Clin Endocrinol (Oxf). 55(6):809–14. DOI: 10.1046/j.1365-2265.2001.01421.x. PMID: 11895224.
307. Pop VJ, de Rooy HA, Vader HL, van der Heide D, van Son MM, Komproe IH. 1993; Microsomal antibodies during gestation in relation to postpartum thyroid dysfunction and depression. Acta Endocrinol (Copenh). 129(1):26–30. DOI: 10.1530/acta.0.1290026. PMID: 8351955.

308. Harris B, Othman S, Davies JA, Weppner GJ, Richards CJ, Newcombe RG, et al. 1992; Association between postpartum thyroid dysfunction and thyroid antibodies and depression. BMJ. 305(6846):152–6. DOI: 10.1136/bmj.305.6846.152. PMID: 1515829. PMCID: PMC1883200.

309. Lazarus JH, Hall R, Othman S, Parkes AB, Richards CJ, McCulloch B, et al. 1996; The clinical spectrum of postpartum thyroid disease. QJM. 89(6):429–35. DOI: 10.1093/qjmed/89.6.429. PMID: 8758046.

310. Konstantakou P, Chalarakis N, Valsamakis G, Sakkas EG, Vousoura E, Gryparis A, et al. 2021; Associations of thyroid hormones profile during normal pregnancy and postpartum with anxiety, depression, and obsessive/compulsive disorder scores in euthyroid women. Front Neurosci. 15:663348. DOI: 10.3389/fnins.2021.663348. PMID: 34421508. PMCID: PMC8371251.

311. Wesseloo R, Kamperman AM, Bergink V, Pop VJM. 2018; Thyroid peroxidase antibodies during early gestation and the subsequent risk of first-onset postpartum depression: a prospective cohort study. J Affect Disord. 225:399–403. DOI: 10.1016/j.jad.2017.08.058. PMID: 28850854.

312. Minaldi E, D'Andrea S, Castellini C, Martorella A, Francavilla F, Francavilla S, et al. 2020; Thyroid autoimmunity and risk of post-partum depression: a systematic review and meta-analysis of longitudinal studies. J Endocrinol Invest. 43(3):271–7. DOI: 10.1007/s40618-019-01120-8. PMID: 31552596.
313. Harris B, Oretti R, Lazarus J, Parkes A, John R, Richards C, et al. 2002; Randomised trial of thyroxine to prevent postnatal depression in thyroid-antibody-positive women. Br J Psychiatry. 180:327–30. DOI: 10.1192/bjp.180.4.327. PMID: 11925355.

314. Costantine MM, Smith K, Thom EA, Casey BM, Peaceman AM, Varner MW, et al. 2020; Effect of thyroxine therapy on depressive symptoms among women with subclinical hypothyroidism. Obstet Gynecol. 135(4):812–20. DOI: 10.1097/AOG.0000000000003724. PMID: 32168208. PMCID: PMC7103482.

315. Fung HY, Kologlu M, Collison K, John R, Richards CJ, Hall R, et al. 1988; Postpartum thyroid dysfunction in Mid Glamorgan. Br Med J (Clin Res Ed). 296(6617):241–4. DOI: 10.1136/bmj.296.6617.241. PMID: 3124900. PMCID: PMC2544770.

316. Rasmussen NG, Hornnes PJ, Hoier-Madsen M, Feldt-Rasmussen U, Hegedus L. 1990; Thyroid size and function in healthy pregnant women with thyroid autoantibodies. Relation to development of postpartum thyroiditis. Acta Endocrinol (Copenh). 123(4):395–401. DOI: 10.1530/acta.0.1230395. PMID: 2239087.

317. Azizi F. 2005; The occurrence of permanent thyroid failure in patients with subclinical postpartum thyroiditis. Eur J Endocrinol. 153(3):367–71. DOI: 10.1530/eje.1.01976. PMID: 16131598.

318. Nohr SB, Jorgensen A, Pedersen KM, Laurberg P. 2000; Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-positive women living in an area with mild to moderate iodine deficiency: is iodine supplementation safe? J Clin Endocrinol Metab. 85(9):3191–8. DOI: 10.1210/jcem.85.9.6799. PMID: 10999807.
319. Gao X, Wang X, Han Y, Wang H, Li J, Hou Y, et al. 2021; Postpartum thyroid dysfunction in women with known and newly diagnosed hypothyroidism in early pregnancy. Front Endocrinol (Lausanne). 12:746329. DOI: 10.3389/fendo.2021.746329. PMID: 34899598. PMCID: PMC8662309.

320. Kampe O, Jansson R, Karlsson FA. 1990; Effects of L-thyroxine and iodide on the development of autoimmune postpartum thyroiditis. J Clin Endocrinol Metab. 70(4):1014–8. DOI: 10.1210/jcem-70-4-1014. PMID: 2318931.
321. Eriksen KG, Andersson M, Hunziker S, Zimmermann MB, Moore SE. 2020; Effects of an iodine-containing prenatal multiple micronutrient on maternal and infant iodine status and thyroid function: a randomized trial in the Gambia. Thyroid. 30(9):1355–65. DOI: 10.1089/thy.2019.0789. PMID: 32183608. PMCID: PMC7482118.

322. Mridha MK, Matias SL, Paul RR, Hussain S, Khan MSA, Siddiqui Z, et al. 2017; Daily consumption of lipid-based nutrient supplements containing 250 mug iodine does not increase urinary iodine concentrations in pregnant and postpartum women in Bangladesh. J Nutr. 147(8):1586–92. DOI: 10.3945/jn.117.248963. PMID: 28615379.
Table 1
Trimester-specific percentile values of TSH and fT4
| Trimester | Moon et al.27) | Kim et al.16) | |
|---|---|---|---|
|
|
|
||
| 2.5th-97.5th percentile | 2.5th-97.5th percentile | ||
| TSH (mIU/L) | |||
| First | 0.01-4.10 | 0.03-4.24 | |
| Second | 0.01-4.26 | 0.13-4.84 | |
| Third | 0.15-4.57 | 0.30-5.57 | |
| fT4 (ng/dL) | |||
| First | 0.83-1.65 | 0.84-1.43 | |
| Second | 0.71-1.22 | 0.68-1.21 | |
| Third | 0.65-1.13 | 0.67-1.13 |
Table 2
TPOAb+ 정상갑상선기능 여성에 임신 시 LT4치료 효과에 대한 대규모 무작위대조군 연구
| 연구 | POSTAL, 201788) | TABLET, 201989) | T4LIFE, 202290) |
|---|---|---|---|
| 국가 | 중국 | 영국 | 네덜란드 |
| 대상자수 | 600명 | 952명 | 187명 |
| 선정기준 | 체외수정을 하는 TPOAb+ 정상갑상선기능 여성(두번 이상 자연유산을 경험한 여성은 제외) | 12개월 이내에 임신(자연임신, 보조임신) 계획이 있는, 한번 이상의 유산력이 있거나 불임치료를 받은 TPOAb+ 정상갑상성기능 여성 | 두번 이상 반복유산을 경험한 TPOAb+ 정상갑상성기능 여성 |
| 평균연령 |
31.3±3.9세(LT4 치료군), 31.7±3.8세(대조군) |
32.5±4.9세(LT4 치료군), 32.7±4.9세(대조군) |
34.9±4.2세(LT4 치료군), 33.7±4.7세(대조군) |
| 정상갑상선기능 정의 중 TSH 범위 | 0.50-4.78 mIU/L | 0.44-3.63 mIU/L | 참여 기관의 참조치(최소 0.30, 최대 5 mIU/L) |
| LT4 치료용법 |
- 체외수정 전 LT4 치료 시작 - 시작용량TSH ≥2.5 mIU/L: 50 μg/일 시작TSH <2.5 mIU/L: 25 μg/일 시작(체중<50 kg: 시작용량을 50% 감량) - 임신분기에 따라 TSH 0.1-2.5 (1분기), 0.2-3.0 (2분기), 0.3-3.0 (3분기) 목표로 용량 조정 |
임신 전 부터 임신 종료 시점까지 LT4 50 μg/일 투여 |
임신 전 부터 임신 종료 시점까지 LT4 투여 - TSH <1.0 mIU/L: LT4 0.5 μg/kg - TSH 1-0-2.5 mIU/L: LT4 0.75 μg/kg - TSH >2.5 mIU/L: LT4 1.0 μg/kg |
| 결과 |
유산: RR 0.97 (95% CI 0.45-2.10) 생존출생률(≥24주): RR 0.98 (0.78-1.24) 조산: RR 1.13 (95% CI 0.65-1.96) |
생존출생률(≥34주): RR 0.97 (95% CI 0.83-1.14) 유산(24주): RR 0.95 (95% CI 0.73-1.23) |
생존출생률(≥24주): RR 1.03 (95% CI 0.77-1.38) 조산(34주 미만): RR 1.41 (95% CI 0.33–6.08) |
CI: confidence interval, LT4: levothyroxine, POSTAL: Pregnancy Outcomes Study in Euthyroid Women With Thyroid Autoimmunity After Levothyroxine, RR: relative risk, TABLET: Thyroid Antibodies and Levothyroxine, TPOAb: anti-thyroid peroxidase antibody, T4LIFE: Levothyroxine in euthyroid thyroid peroxidase antibody positive women with recurrent pregnancy loss
Table 3
임신 중 무증상 갑상선기능저하증의 갑상선호르몬 치료 관련 연구
| 연도, 저자 | 국가 |
연구 디자인 |
대상자 수 |
무증상기능 저하증 TSH범위 |
TPOAb 검사 여부 |
LT4 치료 시작 임신 주수 |
LT4 용량 |
연구 결과 | 통계적 의미가 있는 결과 |
|---|---|---|---|---|---|---|---|---|---|
|
2017 Maraka28) |
미국 | 후향적 | 5405 | 2.5-10 mIU/L | 검사 없음 | Median 28.7 | 임신 및 태아 관련 결과 |
유산 OR: 0.62; 95% CI: 0.48–0.82, 조산 OR: 1.6; 95% CI: 1.14–2.24, 임신성당뇨병 OR: 1.37; 95% CI: 1.05–1.79 |
|
|
2017 Nazapour92) |
이란 | 전향적 무작위대조 | 72 | >4 mIU/L | 모두 양성 | Mean 10.8 | 1 μg/kg/day | 임신 및 태아 관련 결과 |
LT4 vs. 치료없음 조산 5.3% vs. 29.4% (p=0.01), 신생아실 입원 0% vs. 29.4% (p<0.001) |
|
2018 Nazapour29) |
이란 | 전향적 무작위대조 | 354 | >4 mIU/L | 모두 음성 | 11.2-12.2 | 1 μg/kg/day | 임신 및 태아 관련 결과 | 조산 RR: 0.38, 95% CI: 0.15-0.98 (TSH ≥4.0) |
|
2017 Casey192) |
미국 | 전향적 무작위대조 | 677 | >4 mIU/L | 검사 없음 | Mean 16.6 | 100 μg/day | 임신 및 태아 관련 결과 5세 때의 뇌신경발달 | 통계적 의미 있는 결과 없음 |
Table 4
갑상선기능항진증 치료 방법의 장단점




 PDF
PDF Citation
Citation Print
Print



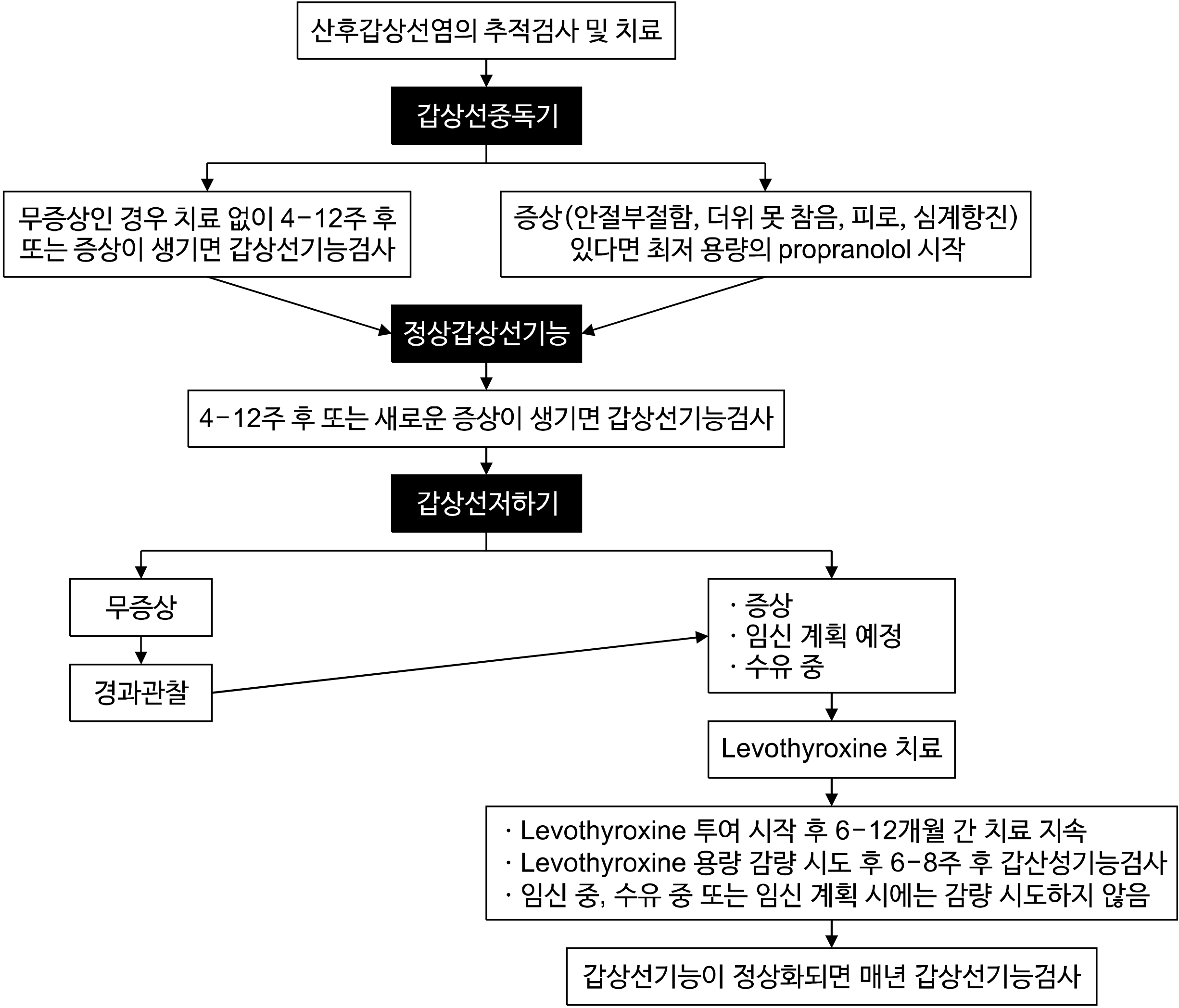
 XML Download
XML Download