This article has been corrected. See "Corrigendum: A Systematic Approach to Patients with Elevated Levels of Serum Amylase or Lipase" in Volume 81 on page 281.
Abstract
Serum amylase and lipase tests are routinely performed in patients presenting with abdominal pain or even during regular health screening. Elevated serum levels of these two enzymes are often encountered in clinical practice. The differential diagnosis is broad and includes acute pancreatitis, chronic pancreatitis, gastrointestinal tract obstruction, malignancies, and other disease conditions. In this article, we review the pathophysiology of elevated amylase and lipase, possible conditions that cause the increase, and diagnostic strategies for such patients. We conclude that a systematic approach to patients with elevated amylase and/or lipase is critical to making an accurate diagnosis and initiating appropriate treatment.
췌장은 복막 내 위 뒤쪽에 위치한 내분비 및 외분비 기능을 가진 장기로, 인슐린 분비를 통한 혈당 조절과 아밀라제 및 리파아제를 포함한 효소들을 십이지장으로 분비하여 음식 소화를 촉진하는 기능을 한다.1 췌장에서 발생하는 가장 흔한 질병 중에 하나인 급성췌장염은 특징적인 복통, 췌장효소의 상승 또는 복부 컴퓨터단층촬영(CT) 등의 영상검사에서 급성췌장염 증거의 총 3가지 양상 중 2가지 이상인 경우 진단하는데, 이러한 급성췌장염을 비롯한 췌장 질환에서 가장 흔한 혈액학적 이상 소견은 혈청 아밀라제와 리파아제의 상승소견이다.2 이에 따라 혈청 아밀라제와 리파아제 검사는 복통 및 오심, 구토 등의 복부 증상이 있는 환자에서 많이 시행되는 검사 중 하나일 뿐만 아니라 건강에 대한 관심이 높아지면서 그 시행이 점차 증가하고 있다. 하지만 췌장 이외의 원인들에서도 아밀라아제 또는 리파아제의 상승을 보일 수 있어 이러한 검사결과의 해석에는 주의가 필요하다. 본 종설에서는 혈청 아밀라아제 또는 리파아제의 상승 소견으로 내원한 환자에 대한 진단 및 접근 방법에 대해 살펴보고자 한다.
아밀라제는 가수분해를 통해 전분을 올리고당과 맥아당과같은 이당류로 분해하는 촉매 역할을 하는 효소로, 전분의 어떤 결합을 분해시키느냐에 따라 알파와 베타, 감마의 세 가지 유형으로 나뉜다.3 사람에서는 그 중 알파 아밀라제가 분비되는데 침샘과 췌장을 비롯하여 소장, 간, 난소, 폐 등 여러 기관들에서 분비된다. 알파 아밀라제는 전기영동을 통해 서로 다른 이성체로 분리될 수 있는데, 전체의 약 60%을 차지하는 S폼의 침샘 아밀라제는 타이알린이라고도 불리며 전분을 맥아당과 덱스트린으로 분해하는 역할을 하고, 알파아밀라제의 약 40%을 차지하는 P폼의 췌장 아밀라제는 소장으로 분비되어 아밀로스를 덱스트린 또는 맥아당, 말토트리오스로 분해하는 역할을 한다.4 아밀라제 검사는 리파아제 검사보다 더 간단하기 때문에 췌장염을 진단하거나 모니터링 하는데 더 우선하여 시행된다. 아밀라제는 간에서 분해되거나 신장을 통해 소변으로 배설되기 때문에 이 두 기관의 기능에 문제가 있는 경우 아밀라제의 제거가 원활하지 않아 혈청에서 높은 아밀라제 농도를 보이게 된다.
리파아제는 지방의 가수분해를 촉매하는 효소로서, 주로 중성지방이 유리 지방산과 글리세롤로 분해되는 과정을 촉진한다. 인체에서는 췌장, 간, 위, 침샘 등에서 분비되며, 그 중 췌장 리파아제는 췌장의 꽈리세포에서 합성되어 효소원과립에 저장된다. 섭취한 음식이 십이지장으로 들어가면 콜레시스토키닌이 분비되어 췌장을 자극하고, 췌장에서 소장으로 리파아제를 포함한 췌장액이 방출된다. 소장으로 분비된 리파아제는 다른 췌장 효소인 코리파아제에 의해 중성지방과의 결합이 활성화되어 촉매제로서 역할을 하게 된다. 리파아제 역시 아밀라제와 마찬가지로 간에서 분해되거나 신장을 통해 배설되지만 리파아제는 그 분자의 무게가 57 kDa로 48 kDa인 아밀라제보다 무겁고 배설 과정에서도 어느 정도 차이를 보인다.5 아밀라제는 세뇨관에서 일부 재흡수 되지만 리파아제는 대부분 재흡수 되기 때문에 리파아제가 더 긴 반감기를 갖는다(6.9시간 vs. 13.7시간).6
이렇게 아밀라제와 리파아제는 서로 다른 병태생리를 가지므로, 이러한 혈액 수치의 상승으로 내원한 환자의 진단 과정에서 서로 상호 보완적인 역할을 한다.7 다음에서는 아밀라제와 리파아제가 모두 상승하는 경우, 또는 아밀라제와 리파아제중 하나가 주로 상승하게 되는 경우에 의심해 볼 수 있는 질환들에 대해 기술하였다. 다만, 혈액검사를 시행하는 시기가 질병의 경과 중 언제냐에 따라 검사 결과가 달라질 수 있고, 동일한 질병에서도 검사결과가 상승되어 있거나 정상을보이는 경우들이 있으므로, 단순히 아밀라제 및 리파아제 검사결과만을 가지고 이를 해석하는 것은 바람직하지 않다.
아밀라제와 리파아제 모두 상승을 보이는 경우 췌장 질환을 가장 먼저 의심하며, 특히 급성췌장염이 가장 흔한 원인이다. 급성췌장염은 일반적으로 아밀라제와 리파아제 모두 정상상한치의 3배 이상의 상승소견을 보인다. 급성췌장염의 아밀라제와 리파아제 검사의 진단 민감도와 특이도는 임계값에 따라 다른데, 아밀라제 임계값을 1,000 IU/L로 하면 특이도는 95%까지 오르지만 민감도는 61%까지 떨어지고, 리파아제 임계값을 600 IU/L로 하면 특이도는 95% 이상이고 민감도는 55-100%를 보인다.8 일반적으로 급성췌장염의 진단에 사용되는 정상상한치의 3배 이상이라는 기준을 적용하면 아밀라제의 민감도는 50-78.6%, 특이도는 99-100%이며 리파아제의민감도는 64-100%, 특이도는 99-100%이다.9 리파아제는 아밀라제보다 급성췌장염 진단에 더 높은 민감도를 보이고, 따라서 더 좋은 검사로 간주된다.10 두 검사 결과는 시간이 지남에 따라 변화하는데, 아밀라제는 급성췌장염 증상이 발생 후 12시간 이내에 상승하고 리파아제는 상승은 약 24시간이 소요된다.11 급성췌장염의 중증도에 따라 혈액 수치 정상화 시간은 다양하고 아밀라제는 리파아제보다 더 빠른 제거율을 보이는데, 대개 아밀라제는 3-5일 후 85%의 환자에서 정상화를보이고 리파아제는 급성췌장염의 발병 8-14일 후에 정상화한다.7 시간이 경과한 췌장염이나 췌장의 실질이 거의 없는 만성췌장염에 동반된 급성췌장염 등에서는 이러한 췌장효소의 상승이 급성췌장염의 진단에 충분하지 않을 수 있다. 그 외에도췌장 외상이나 내시경 역행담췌관조영, 췌관석 등으로 인한췌관 폐쇄, 췌장 종양 등에서도 아밀라제와 리파아제 상승이나타날 수 있다.
아밀라제와 리파아제가 상승의 췌장 외 원인은 크게 위장관 관련 원인과 그 외 원인으로 구분할 수 있다(Table 1). 위장관 관련 원인으로는 위장관 궤양, 천공, 폐색 및 복강병 등이 있으며, 그외에도 간질환 및 담낭염 등에서도 두 혈액수치가 상승할 수 있다. 그 외에도 다양한 약물 복용으로 인해 아밀라제 및 리파아제가 상승을 보일 수 있다(Table 2).12 일반적으로 췌장 외 원인으로 인한 아밀라제와 리파아제가 상승이 정상의 3배 이상 증가하는 경우는 드물지만, 췌장 외 원인인 신부전, 악성 종양, 담낭염, 식도염 등에서 리파아제가 3배 이상으로 상승한 경우가 보고되기도 했다.13
혈청 아밀라제는 상승한 반면 리파아제는 정상인 경우 다양한 감별 질환에 대한 고려가 필요하다(Table 3). Lankisch 등14은 췌장 외의 원인으로 입원한 환자의 약 8%에서 혈청 아밀라제의 상승을 보고하였다. 두 효소는 모두 췌장에서 생성되지만, 아밀라제는 그 외에도 침샘, 난소, 나팔관, 고환 등 여러 조직에서 생성되기 때문에, 아밀라제가 상승소견을 보일 때 정상소견을 보이는 리파아제는 급성췌장염 등의 췌장질환을 감별하는데 도움이 된다. Gomez 등15의 연구에서는 급성췌장염일 때 아밀라제만 상승을 보이는 경우는 없었고 리파아제만 상승을 보이는 경우를 약 18%로 보고하였다.
(1) 침샘 질환
혈청 아밀라제는 상승한 반면 리파아제는 정상인 경우, 혈청내 동종효소 분획을 알아보기 위한 전기영동 검사를 고려하게 되고, 이 검사는 췌장에서 유래된 췌장 아밀라제와 췌장 외에서 유래된 침샘 아밀라제를 구분하는데 도움을 준다(Fig. 1).16 침샘 감염, 외상, 침샘 주변부 방사선, 침샘관 폐색 등의 침샘 질환은 침샘 아밀라제의 상승을 가져올 수 있으므로, 이에 대한 자세한 문진 및 염증이나 부종 등에 관한 자세한 관찰이 필요하다. 침샘 질환이 의심되는 경우 경부 초음파나 CT, 자기공명영상 등을 시행해 볼 수 있으며 악성질환이 의심되면 조직생검 등을 시행할 수 있다. 침샘 아밀라제가 높은 분획으로 나타나지만 침샘 질환이 배제된 경우, 다른 질환에 대한 추가 검사들이 고려될 수 있다.
(2) 위장관질환
위장관 질환에서는 아밀라제와 리파아제가 정상이거나 함께 상승하거나 아밀라제만 상승하는 등 다양한 결과를 보여, 혈액 검사 결과만으로 특정 위장관 질환을 의심 또는 감별하기는 매우 어렵다. 한 연구에서는 위장염에서 혈청 아밀라제 상승을 약 7.4%로 보고하였다.17 위장관 질환의 경우 증상이 경한 경우에는 경과를 관찰할 수 있지만 복통이 심한 경우에는 복부 방사선검사나 복부 CT를 통해 원인 감별이 필요하다. 위장관질환에서 아밀라제의 상승 기전이 명확하게 밝혀져 있지는 않지만, 염증으로 인해 손상된 위장관의 장상피세포에서 아밀라제가 분비되거나, 췌장과 가까운 거리에 위치한 위장관의 염증이 발생하고 염증에 취약한 췌장의 손상으로 주로 설명된다.17,18
(3) 부인과 질환
부인과 질환에서 아밀라제를 상승시키는 질환으로 자궁외 임신 파열, 난소/나팔관 낭종, 난소 염전, 나팔관염, 골반 염증성 질환, 난소 종양 등이 보고되었며 자궁근의 수축을 억제하는 리토드린이나 전신마취 시 저혈압을 예방하는 에페드린에 대한 반응으로 상승하거나 임산부에서 마크로아밀라제혈증을 보일 수 있다고 알려져 있다.19,20 높은 농도의 아밀라제는 난소암 초기나 자궁외 임신의 파열에서 관찰될 수 있으며 낮은 아밀라제는 임신 중독증의 예측 인자가 될 수 있다.21
(4) 악성종양
아밀라제를 생성하는 악성종양은 Weiss 등22에 의해 1951년 기관지유래암종에서 처음 소개되었는데, 혈청 아밀라제 상승 기전으로는 아밀라제를 생성하는 종양에 의한 부종양 증후군 또는 마크로아밀라아제혈증 등으로 설명된다.22 이러한 암종으로는 난소암, 전립선암, 폐암, 유방암, 식도암, 위암, 결장암, 복막암, 흉선종, 다발성 골수종, 골육종, 갈색세포종 등이 보고되었다.23,24 고아밀라제혈증을 보이는 다발성 골수종에서는 아밀라제와 관련된 유전자를 가진 1번 염색체의 전위가 공통적으로 발견되었고, 대부분은 침샘 아밀라제의 상승을 보였다.25 폐암에서 아밀라제의 상승을 보이는 경우는 약 1-3%를 보였으며 대부분은 마찬가지로 침샘 아밀라제의 상승을 보였다.26 이외에도 골육종, 갈색세포종 등에서 침샘 아밀라제의 상승을 보였으며, 자궁암, 유방암 등에서는 췌장 아밀라제의 상승이 보고되었다.27-29 이러한 종양의 아밀라제 분비는 종양의 이소성 분비보다는 혈관 수축과 장기 혈액 공급을 감소시키는 높은 카테콜아민 농도로 인한 이차적인 조직 저산소증 때문으로 생각된다.26
(5) 만성 비병인성 혈중췌장효소증가증
증상이 없고 6개월 이상 췌장 아밀라제의 지속적인 상승을 보이는 경우를 만성 비병인성 혈중췌장효소증가증(chronic non-pathological pancreatic hyperenzymemia, CNPH) 또는 Gullo 증후군이라고 정의한다.30 대부분 양성 소견에 동반되며, 약 8-68%에서 췌장의 구조적 또는 기능적 이상소견이 보고되었다.6 그 외에도 인종이나 가족력으로 인한 상승을 보이는 경우들도 있다.31 췌장과 관련된 모든 질병이 없어야 하며 추가적인 검사가 필요하지 않아야 하는 배제진단이므로, 이에 대한 진단을 내리기는 쉽지 않다.
(6) 마크로아밀라아제혈증
아밀라제가 면역글로불린이나 다당류와 같은 큰 분자와 결합하면 마크로아밀라제를 형성하게 되는데 분자 크기가 커 신장으로의 배설이 감소하고 혈류에 축적되어 혈중 아밀라제 수치가 상승을 보이게 된다. 마크로아밀라아제혈증은 일반적으로 무증상이지만 아밀라제 수치 상승을 통해 발견하게 되고, 드물게 복통이나 오심, 구토, 설사 등을 보일 수 있다. 2,900명의 아밀라제 수치 상승 환자를 대상으로 한 연구에서는 약 9.6%가 마크로아밀라제혈증이라고 보고되었다.32 이를 유발할 수 있는 질병으로는 전신홍반루푸스, 류마티스 관절염, 궤양성 대장염, 쇼그렌, 크론병, 선택적 면역글로불린A 결핍증 등의 자가면역질환 외에도 사람면역결핍바이러스, 복강병, 근무력증, 단클론감마병증 등에서 나타날 수 있다.33-40 정상인의 아밀라제 전기영동 검사에서는 침샘 아밀라제와 췌장 아밀라제의 밴드가 확연히 구분되나, 마크로아밀라제혈증에서는 smeared band 형태를 보이게 된다.41 아밀라제 대 크레아티닌 청소율(amylase to creatinine clearance ratio, ACCR) 측정을 통해 진단할 수 있는데, 24시간 소변에서 아밀라제와 크레아티닌 양을 측정하고 혈액 내의 아밀라제와 크레아티닌 수치와의 비율을 통해 아밀라제의 신장 여과량을 평가하게 되고, 이는 다음과 같은 계산식을 통해 구한다.
ACCR의 정상 레퍼런스 범위는 약 1.8-3.2%로, 5% 이상인 경우는 급성췌장염을, 1% 미만인 경우 마크로아밀라제혈증을 의미한다. 하지만 케논당뇨병증이나 화상 등의 경우에서도 ACCR의 상승이 보고되어 결과의 해석에 주의를 요한다.42
앞에서 언급한 것처럼, 리파아제가 정상 상한치의 3배 이상 상승되어 있는 경우 췌장염에 대한 진단특이도는 99% 이상이다. 따라서 리파아제만 증가되어 있거나 아밀라제에 비해 리파아제가 현저하게 증가되어 있는 경우 췌장의 손상이나 염증이 가장 먼저 고려되어야 한다.
(1) 급성췌장염 및 만성췌장염
아밀라제보다 리파아제가 오래 상승되어 있기 때문에 급성 췌장염이 발병한 이후 내원이 지연된 환자에서 아밀라제는 정상이지만 리파아제만 상승되어있는 소견을 보일 수 있어, 리파아제는 특히 급성췌장염 진단에 유용하다. 만성 알코올 남용, 만성췌장염, 췌장의 외분비 기능 부전 등과 동반된 급성췌장염의 경우, 혈청 아밀라아제 수치가 입원 당시 19-32%에서 정상을 보일 수 있다.43 하지만 췌장 리파아제 활성은 아밀라아제의 4배 이상이기 때문에 만성 췌장 기능 부전의 영향을 덜 받아 단독으로 상승한 소견을 보일 수 있다.44 Gumaste 등45은 급성췌장염 환자에서 리파아제 대 아밀라제의 비율이 2 초과 시 알코올성 췌장염의 민감도가 91%, 특이도가 78%로 보고하기도 하였다.
(2) 고중성지방혈증
고중성지방혈증은 급성췌장염의 원인이 되기도 하지만, 혈청중성지방이 500 mg/dL 이상으로 상승한 경우 혈청 혼탁으로 인해 아밀라제 활성도 측정에 영향을 미칠 수 있고, 이에 따라 급성췌장염에서 리파아제만 상승소견을 보일 수 있다. 임상적으로 아밀라제의 상승이 의심되나 정상으로 보이는 경우, 혈청을 생리식염수를 이용한 연속적인 희석을 통해 실제 아밀라제 활성도를 측정하여 실제 상승 여부를 판단할 수 있다.45
(3) 마크로리파아제혈증
마크로아밀라제혈증과 유사하게, 혈청 리파아제가 큰 분자량 단백질과 결합하여 잘 제거되지 않는 상태를 마크로리파아제혈증이라고 하며 이는 리파아제를 상승시키는 여러 질환들과의 감별이 필수적이다. 아밀라제의 상승 없이 리파아제만 상승하는 경우 큰 분자량의 단백질을 침전시키는 성질을 이용한 폴리에틸렌글라이콜(polyethylen glycol, PEG) 침전 검사를 통해 리파아제의 활성도를 검사할 수 있으며, PEG 회복율이 32% 이하면 마크로리파아제혈증을 의심할 수 있다.47 대개는 양성 질환으로 이에 대한 치료는 필요하지 않으나, 드물게자가면역 질환이나 다양한 종양으로 인해 발생할 수 있어, 다른 질환에 대한 감별 및 새로운 증상 발생여부에 대한 면밀한관찰이 필요하다.48
(4) 투석
아밀라제 및 리파아제 상승으로 내원한 환자에서 가장 먼저 고려해야 하는 질환은 급성췌장염이다. 이를 감별하기 위해 먼저 환자의 자세한 병력을 파악하고 신체 검진을 시행해야 한다. 환자의 병력에는 환자가 호소하는 증상의 시작 시간과 지속 기간, 복통, 오심, 구토 등과 같은 증상을 확인하여야 하며 췌장염을 포함한 과거 병력, 복부 수술이나 내시경역행담췌관조영 기왕력, 음주력, 복부 손상력, 사람면역결핍바이러스 병력, 복용약 및 췌장 질환의 가족력, 체중감소 등에 관한 철저한 확인이 필요하다. 신체 검진은 활력 징후를 포함한 상세한 복부검진이 포함되어야 하며 황달, 촉진되는 종괴, 복막염 증상 등이 포함되어야 한다. 상복부 혹은 배꼽 주위의 압통을 동반한 지속적인 심한 통증이 있는 경우 급성췌장염을 의심해 볼 수 있다. 또한, 기존에 시행되었던 아밀라제 및 리파아제의 상승 및 변동을 확인하기 위해 이를 재시행 하고 추가적으로 백혈구 증가 등을 확인하기 위한 전체혈구계산과 간 기능 검사, 신장 기능 검사, 혈당, 중성지방 등을 포함한 혈액검사가 시행되어야 한다. 추적 혈액검사에서 아밀라제 또는 리파아제가 지속적으로 높은 소견으로 나타난다면 간 및 신장기능 검사를 확인하여 아밀라제나 리파아제의 제거가 원활하게 되는지 판단이 필요하다.
병력 파악 및 신체 검진을 통해 가능한 원인들을 감별한 뒤, 급성췌장염으로 진단된 환자는 중증도 평가를 위해 발생 2-3일 뒤에 복부 CT 검사를 시행한다. 하지만 약 30-40%의급성췌장염 환자에서 비전형적인 증상을 호소하기 때문에 진단이 명확하지 않거나, 복통이 있으며 그 원인이 불분명한 환자에서는 진단을 위해 바로 복부 CT 검사 시행을 고려할 수있다. 복부 CT는 급성 및 만성췌장염뿐만 아니라 아밀라제및 리파아제 상승을 일으킬 수 있는 질환 중 췌장 질환, 위장관 질환, 부인과 질환, 복부 악성종양 등 복부에 발병하는 질환을 감별하는데 도움을 줄 수 있다. 복부 CT를 촬영 후 아밀라제 또는 리파아제를 상승시키는 질환이 진단된다면 이에 대한 적절한 관리 및 치료가 필요할 수 있다. 복부 CT는 췌장 등의 병변을 탐색하는데 가장 먼저 시행해 볼 수 있는 검사이지만 임상적으로 췌장염이 의심될 때도 높게는 25%에서 정상소견을 보일 수 있어, 진단이 명확하지 않은 경우 초음파 내시경 혹은 자기공명담췌관조영술(MRCP), 세크레틴-MRCP를 고려해 볼 수 있다. 특히 자기공명영상은 경미한 급성췌장염을 감지하는데 더 민감하며, 췌장과 담관에 대한 좀더 자세한 검사가 가능하다.51 만약 복부 외의 타 부위에 증상이 있다면 증상이 있는 부위에 맞추어 추가적인 검사가 필요할 수 있다. 복통이나 증상이 없어 특정한 질환이 먼저 의심되지 않는 경우 혈액검사를 추적하며 경과를 관찰해 볼 수 있으나 각각 7시간과 14시간의 아밀라제와 리파아제의 반감기를 고려해 보았을 때 이러한 혈액검사 결과가 지속적으로 상승을 보인다면 특히 악성종양을 포함한 다양한 질환의 조기 신호일 수 있어 복부 CT 검사 시행에 대해 고려해 볼 수 있다.9
아밀라제 단독으로 상승한 환자에서는 리파아제 단독 상승보다 더 다양한 감별진단이 가능하기 때문에 환자의 증상 유무에 따라, 또는 의심되는 질환 여부에 따라 이후에 검사들을 진행하게 된다. 아밀라제는 전기영동검사를 통해 침샘 아밀라제와 췌장 아밀라제로 구분하여 어떤 형태의 아밀라제가 정상에 비해 상승하였는지 파악할 수 있고, 또한, ACCR 측정을 통해 마크로아밀라제혈증이 감별 가능하다. 리파아제는 아밀라제와 달리 췌장, 위, 침샘 등 몇 개의 기관에서만 생성되기 때문에 진성 리파아제의 상승이 지속적으로 보이는 경우 복통 등의 증상이 없다고 하여도 복부 CT 검사을 통해 췌장의 질환을 감별하는 것이 필요할 수 있다. 환자가 지속적으로 호소하는 증상이 없고 6개월 이상 경과하여도 췌장효소수치의 상승을 보이지만 영상검사에서 지속적으로 음성을 보일 경우 CNPH 진단을 고려할 수 있다.
최근 건강에 대한 관심이 높아지면서, 또한 췌장 질환에 대한 이해가 높아지면서 대표적인 췌장효소인 아밀라제와 리파아제에 대한 검사가 많이 시행된다. 임상적으로 급성췌장염이 의심되는 경우에는 비교적 쉽게 진단을 내릴 수 있지만, 아밀라제와 리파아제는 췌장에서만 분비되지 않고 췌장에서 분비되었다고 하여도 급성췌장염 외의 다양한 췌장 질환에 대한 감별이 필요할 수 있다. 이에 따라 췌장효소의 상승으로 내원한 환자에서는 자세한 병력 청취와 신체 검진이 필요하며, 추가적인 혈액검사 등을 통해 약, 간이나 신장 기능 저하 등 췌장효소가 증가할 수 있는 원인들에 대한 감별이 필요하다. 복통이 있는 경우에는 가장 먼저 복부 CT를 시행해 볼 수 있으며 이를 통해 다양한 췌장 질환, 위장관 질환, 부인과 질환, 복부 악성 종양 등을 감별할 수 있다. 그외에도 환자가 다른 증상을 호소한다면 해당 부위에 대한 자세한 문진 및 추가적인 영상검사를 시행해 볼수 있다. 복통이 없고 의심되는 질환이 없다면 경과를 관찰해 볼 수 있지만 지속적인 췌장효소의상승을 보인다면 CT 등의 영상검사를 통해 증상 없이 췌장효소 상승을 유발하는 질환이 있는지 등을 검사해 볼 수 있다.또한, CT에서 관찰되지 않지만 췌장질환이 지속적으로 의심되는 경우에는 초음파 내시경이나 MRCP 등을 추가적으로 고려해 볼 수 있다. 이러한 검사 등에서도 이상소견이 진단되지않았지만 지속적으로 췌장효소의 상승을 보이는 경우에는 만성 CNPH의 진단도 고려해 보아야 한다.
REFERENCES
1. Le Huerou-Luron I, Lhoste E, Wicker-Planquart C, et al. 1993; Molecular aspects of enzyme synthesis in the exocrine pancreas with emphasis on development and nutritional regulation. Proc Nutr Soc. 52:301–313. DOI: 10.1079/PNS19930066. PMID: 8234352.

2. Crockett SD, Wani S, Gardner TB, Falck-Ytter Y, Barkun AN. American Gastroenterological Association Institute Clinical Guidelines Committee. 2018; American gastroenterological association institute guideline on initial management of acute pancreatitis. Gastroenterology. 154:1096–1101. DOI: 10.1053/j.gastro.2018.01.032. PMID: 29409760.

3. Akinfemiwa O, Zubair M, Muniraj T. 2023. Amylase. StatPearls. StatPearls Publishing;Treasure Island (FL):
4. Alhajj M, Babos M. 2023. Physiology, Salivation. StatPearls. StatPearls Publishing;Treasure Island (FL):
5. Lott JA. 1997. Clinical pathology of pancreatic disorders. Humana Press;Totowa (NJ):
6. Lee SH. 2017; Evaluation of asymptomatic hyperamylasemia and hyperlipasemia. Korean J Pancreas Biliary Tract. 22:103–113. DOI: 10.15279/kpba.2017.22.3.103.

7. Batra HS, Kumar A, Saha TK, Misra P, Ambade V. 2015; Comparative study of serum amylase and lipase in acute pancreatitis patients. Indian J Clin Biochem. 30:230–233. DOI: 10.1007/s12291-013-0416-y. PMID: 25883434. PMCID: PMC4393381.

8. Yadav D, Agarwal N, Pitchumoni CS. 2002; A critical evaluation of laboratory tests in acute pancreatitis. Am J Gastroenterol. 97:1309–1318. DOI: 10.1111/j.1572-0241.2002.05766.x. PMID: 12094843.

9. Hameed AM, Lam VW, Pleass HC. 2015; Significant elevations of serum lipase not caused by pancreatitis: a systematic review. HPB (Oxford). 17:99–112. DOI: 10.1111/hpb.12277. PMID: 24888393. PMCID: PMC4299384.

10. Working Party of the British Society of Gastroenterology; Association of Surgeons of Great Britain and Ireland; Pancreatic Society of Great Britain and Ireland; Association of Upper GI Surgeons of Great Britain and Ireland. 2005; UK guidelines for the management of acute pancreatitis. Gut. 54(Suppl 3):iii1–9. DOI: 10.1136/gut.2004.057059. PMID: 15888770. PMCID: PMC1867803.
11. Smotkin J, Tenner S. 2002; Laboratory diagnostic tests in acute pancreatitis. J Clin Gastroenterol. 34:459–462. DOI: 10.1097/00004836-200204000-00018. PMID: 11907364.

12. Vege SS. Approach to the patient with elevated serum amylase or lipase. [Internet]. UpToDate; 2022 Jul 14 [cited 2023 May 17]. Available from: http://www.uptodate.com.
13. Frank B, Gottlieb K. 1999; Amylase normal, lipase elevated: is it pancreatitis? A case series and review of the literature. Am J Gastroenterol. 94:463–469. DOI: 10.1111/j.1572-0241.1999.878_g.x. PMID: 10022647.

14. Lankisch PG, Doobe C, Finger T, et al. 2009; Hyperamylasaemia and/or hyperlipasaemia: incidence and underlying causes in hospitalized patients with non-pancreatic diseases. Scand J Gastroenterol. 44:237–241. DOI: 10.1080/00365520802400891. PMID: 18819039.

15. Gomez D, Addison A, De Rosa A, Brooks A, Cameron IC. 2012; Retrospective study of patients with acute pancreatitis: is serum amylase still required? BMJ Open. 2:e001471. DOI: 10.1136/bmjopen-2012-001471. PMID: 23002153. PMCID: PMC3467606.

16. Ko JH, Lee DH. 2009; Macroamylasemia in a 4-year-old girl with abdominal pain. Korean J Pediatr. 52:1283–1285. DOI: 10.3345/kjp.2009.52.11.1283.

17. Ben-Horin S, Farfel Z, Mouallem M. 2002; Gastroenteritis-associated hyperamylasemia: prevalence and clinical significance. Arch Intern Med. 162:689–692. DOI: 10.1001/archinte.162.6.689. PMID: 11911723.
18. Date K, Yamazaki T, Toyoda Y, Hoshi K, Ogawa H. 2020; α-Amylase expressed in human small intestinal epithelial cells is essential for cell proliferation and differentiation. J Cell Biochem. 121:1238–1249. DOI: 10.1002/jcb.29357. PMID: 31478242. PMCID: PMC6973164.

19. Takahashi T, Minakami H, Tamada T, Sato I. 1997; Hyperamylasemia in response to ritodrine or ephedrine administered to pregnant women. J Am Coll Surg. 184:31–36.
20. Headley AJ, Blechman AN. 2008; Diagnosis of macroamylasemia in a pregnant patient. J Natl Med Assoc. 100:1359–1361. DOI: 10.1016/S0027-9684(15)31516-9. PMID: 19024234.

21. Guo S, Lv H, Yan L, Rong F. 2018; Hyperamylasemia may indicate the presence of ovarian carcinoma: A case report. Medicine (Baltimore). 97:e13520. DOI: 10.1097/MD.0000000000013520. PMID: 30544453. PMCID: PMC6310503.
22. Weiss MJ, Edmondson HA, Wertman M. 1951; Elevated serum amylase associated with bronchogenic carcinoma; report of case. Am J Clin Pathol. 21:1057–1061. DOI: 10.1093/ajcp/21.11.1057. PMID: 14885124.

23. Lee MH, Ko SY, Park KW, et al. 2012; A case of hyperamylasemia associated with lung adenocarcinoma. Korean J Med. 82:507–511. DOI: 10.3904/kjm.2012.82.4.507.

24. Lee JW, Park SG. 2015; Amylase-producing primary peritoneal carcinoma. Korean J Med. 89:358–362. DOI: 10.3904/kjm.2015.89.3.358.

25. Shigemura M, Moriyama T, Shibuya H, et al. 2007; Multiple myeloma associated with sialyl salivary-type amylase. Clin Chim Acta. 376:121–125. DOI: 10.1016/j.cca.2006.08.002. PMID: 16979610.

26. Crook M. 2014; Hyperamylasaemia: don't forget undiagnosed carcinoma. Ann Clin Biochem. 51(Pt 1):5–7. DOI: 10.1177/0004563213510490. PMID: 24194585.

27. Matsuyama M, Inoue T, Ariyoshi Y, et al. 1979; Argyrophil cell carcinoma of the uterine cervix with ectopic production of ACTH, beta-MSH, serotonin, histamine, and amylase. Cancer. 44:1813–1823. DOI: 10.1002/1097-0142(197911)44:5<1813::AID-CNCR2820440541>3.0.CO;2-Q. PMID: 227579.
28. Weitzel JN, Pooler PA, Mohammed R, Levitt MD, Eckfeldt JH. 1988; A unique case of breast carcinoma producing pancreatic-type isoamylase. Gastroenterology. 94:519–520. DOI: 10.1016/0016-5085(88)90447-7. PMID: 2446952.

29. Mäsiar PJ. 1984; Serum amylase and isoamylases in malignant bone tumors. Neoplasma. 31:351–359.
30. Gullo L. 1996; Chronic nonpathological hyperamylasemia of pancreatic origin. Gastroenterology. 110:1905–1908. DOI: 10.1053/gast.1996.v110.pm8964417. PMID: 8964417.

31. Koda YK, Vidolin E. 2002; Familial hyperamylasemia. Rev Hosp Clin Fac Med Sao Paulo. 57:77–82. DOI: 10.1590/S0041-87812002000200006. PMID: 11981589.

32. Forsman RW. 1986; Macroamylase: prevalence, distribution of age, sex, amylase activity, and electrophoretic mobility. Clin Biochem. 19:250–253. DOI: 10.1016/S0009-9120(86)80036-4. PMID: 2428542.

33. de Almeida Menezes M, Ribeiro Cabral VL, Lorena SS, Nucci A, Andrade Santana P, Queiroz Silva C. 2016; Rare association of celiac disease with myasthenia gravis in a patient with other immune disorders: a case report. Rev Esp Enferm Dig. 108:586–588. DOI: 10.17235/reed.2016.3929/2015. PMID: 26785763.

34. Fujimura Y, Nishishita C, Uchida J, Iida M. 1995; Macroamylasemia associated with ulcerative colitis. J Mol Med (Berl). 73:95–97. DOI: 10.1007/BF00270584. PMID: 7542995.

35. Goto H, Wakui H, Komatsuda A, Imai H, Miura AB, Fujita K. 2000; Simultaneous macroamylasemia and macrolipasemia in a patient with systemic lupus erythematosus in remission. Intern Med. 39:1115–1118. DOI: 10.2169/internalmedicine.39.1115. PMID: 11197804.

36. Klonoff DC. 1980; Macroamylasemia and other immunoglobulin-complexed enzyme disorders. West J Med. 133:392–407.
37. Rabsztyn A, Green PH, Berti I, Fasano A, Perman JA, Horvath K. 2001; Macroamylasemia in patients with celiac disease. Am J Gastroenterol. 96:1096–1100. DOI: 10.1111/j.1572-0241.2001.03746.x. PMID: 11316153.

38. Szőke D, Ridolfo A, Valente C, Galli M, Panteghini M. 2016; Frequency of pancreatic hyperamylasemia in human immunodeficiency virus-positive patients in the highly active antiretroviral therapy era. Am J Clin Pathol. 145:128–133. Erratum in: Am J Clin Pathol 2016;145:288. DOI: 10.1093/ajcp/aqv020. PMID: 26712880.

39. Türkçapar N, Ozyüncü N, Idilman R, Ensari A, Soylu K, Ozden A. 2006; Macro-amylasemia in a patient with selective IgA deficiency and antiphospholipid antibodies. Turk J Gastroenterol. 17:140–143.
40. Venkataraman D, Howarth L, Beattie RM, Afzal NA. 2012; A very high amylase can be benign in paediatric Crohn's disease. BMJ Case Rep. 2012:bcr0220125917. DOI: 10.1136/bcr.02.2012.5917. PMID: 22783000. PMCID: PMC3417001.

41. Šimac DV, Špelić M, Devčić B, Rački S. 2017; Diagnosing macroamylasemia in unexplained hyperamylasemia. Acta Med Croatica. 71:63–66.
42. Levine RI, Glauser FL, Berk JE. 1975; Enhancement of the amylase-creatinine clearance ratio in disorders other than acute pancreatitis. N Engl J Med. 292:329–332. DOI: 10.1056/NEJM197502132920702. PMID: 804138.

43. Clavien PA, Robert J, Meyer P, et al. 1989; Acute pancreatitis and normoamylasemia. Not an uncommon combination. Ann Surg. 210:614–620. DOI: 10.1097/00000658-198911000-00008. PMID: 2479346. PMCID: PMC1357795.
44. Tietz NW, Shuey DF. 1993; Lipase in serum--the elusive enzyme: an overview. Clin Chem. 39:746–756. DOI: 10.1093/clinchem/39.5.746.

45. Gumaste VV, Dave PB, Weissman D, Messer J. 1991; Lipase/amylase ratio. A new index that distinguishes acute episodes of alcoholic from nonalcoholic acute pancreatitis. Gastroenterology. 101:1361–1366. DOI: 10.1016/0016-5085(91)90089-4. PMID: 1718808.
46. Fallat RW, Vester JW, Glueck CJ. 1973; Suppression of amylase activity by hypertriglyceridemia. JAMA. 225:1331–1334. DOI: 10.1001/jama.1973.03220390031007. PMID: 4740657.

47. Saracoglu H, Baskol G, Baskol M. 2021; Macrolipasemia secondary to colon cancer chemotherapy: a case report. Biochem Med (Zagreb). 31:030801. DOI: 10.11613/BM.2021.030801. PMID: 34658648. PMCID: PMC8495620.
48. Staege MS, Hesse M, Max D. 2010; Lipases and related molecules in cancer. Cancer Growth and Metastasis. 3:CGM.S2816. DOI: 10.4137/CGM.S2816.

49. Vaziri ND, Chang D, Malekpour A, Radaht S. 1988; Pancreatic enzymes in patients with end-stage renal disease maintained on hemodialysis. Am J Gastroenterol. 83:410–412.
50. Schoenicke G, Grabensee B, Plum J. 2002; Dialysis with icodextrin interferes with measurement of serum alpha-amylase activity. Nephrol Dial Transplant. 17:1988–1992. DOI: 10.1093/ndt/17.11.1988. PMID: 12401858.

51. Busireddy KK, AlObaidy M, Ramalho M, et al. 2014; Pancreatitis-imaging approach. World J Gastrointest Pathophysiol. 5:252–270. DOI: 10.4291/wjgp.v5.i3.252. PMID: 25133027. PMCID: PMC4133524.

Fig. 1
Electrophoresis of serum amylase showing clear separation of S-amylase and P-amylase in the control serum and the smeared band pattern in the serum of a patient with macroamylasemia.16
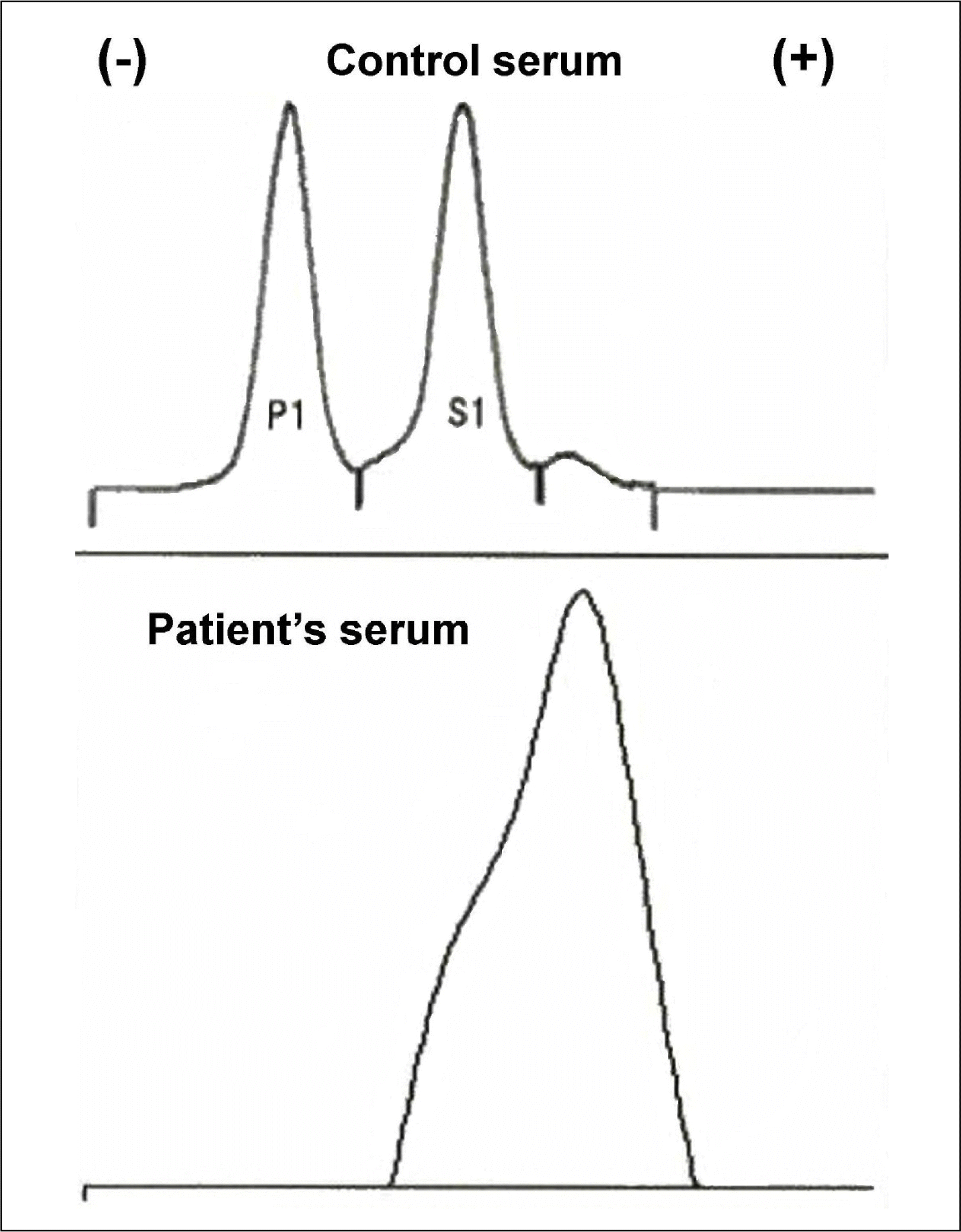
Fig. 2
Flowchart showing a step-by-step approach for patients with elevated serum amylase and/or lipase levels. ACCR, amylase to creatinine clearance ratio; EP, electrophoresis; PostOp, postoperative; CNPH, chronic non-pathological pancreatic hyperenzymemia. *Can be delayed 2-3 days if the diagnosis of acute pancreatitis is clear.
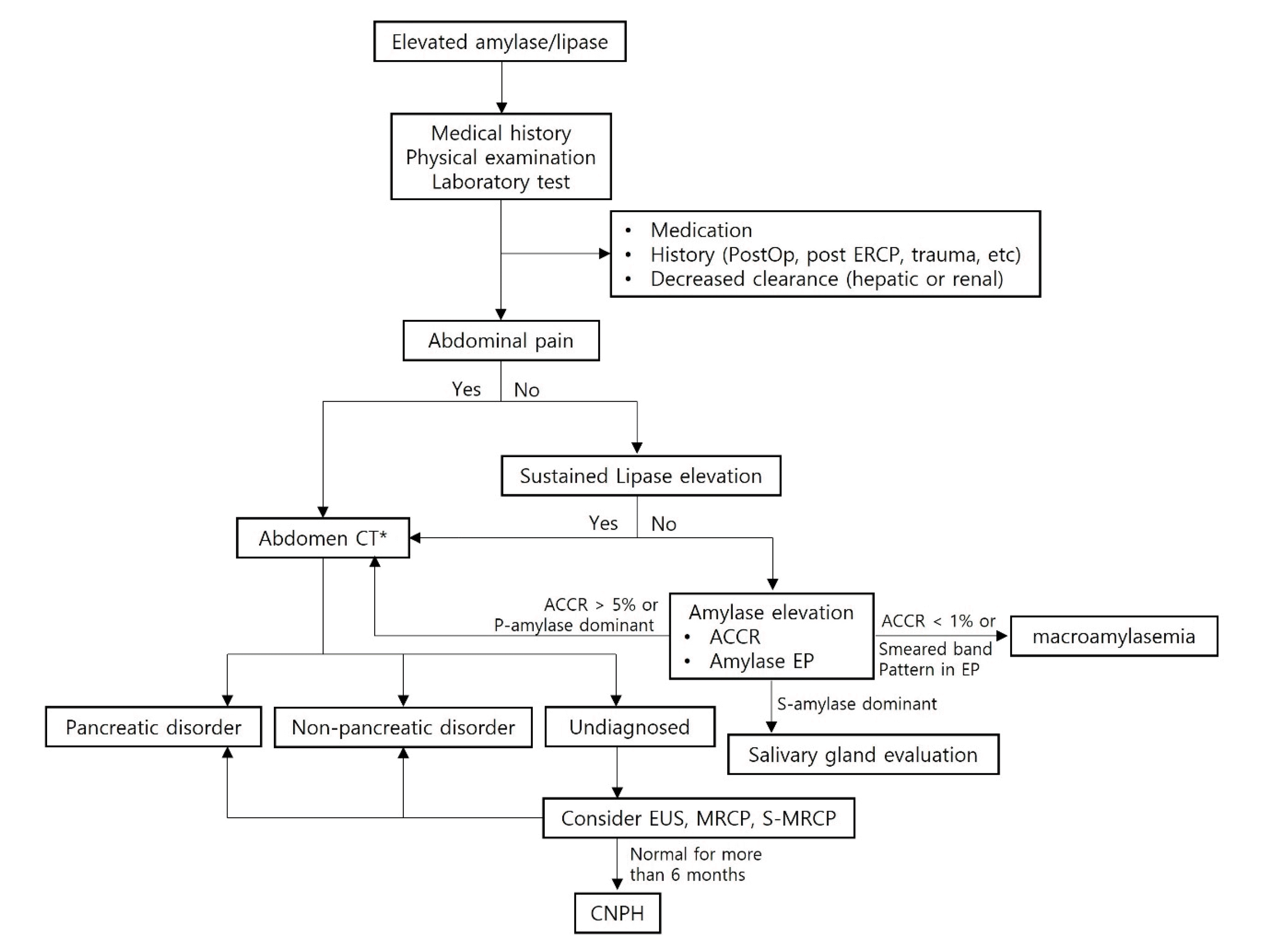
Table 1
Various Causes of Elevated Levels of Serum Amylase and Lipase
Table 2
Drugs that May Cause Elevations in Serum Amylase and Lipase Levels12
Table 3
Various Causes of Elevated Serum Amylase Levels When Lipase Levels are Normal




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download