Abstract
Gallbladder polyps are a common incidental finding. Although most of these are benign, differentiating non-neoplastic from neoplastic polyps is challenging. Trans-abdominal ultrasound is the primary imaging study for diagnosing and monitoring gallbladder polyps. In challenging cases, the use of endoscopic ultrasound or contrast-enhanced endoscopic ultrasound could assist in making decisions. According to current guidelines, a cholecystectomy is recommended in patients with polyps measuring 10 mm or larger and in symptomatic patients with polyps measuring less than 10 mm. A cholecystectomy is also recommended if one or more risk factors for malignancy are present in patients with polyps measuring 6-9 mm. These risk factors include age older than 60 years, primary sclerosing cholangitis, Asian ethnicity, and sessile polyps, including focal gallbladder wall thickening >4 mm. Follow-up ultrasound is recommended at six months, one year, and two years for polyps measuring 6-9 mm in patients without risk factors for malignancy, and for polyps less than 5 mm in patients with one or more risk factors for malignancy. Discontinuing the surveillance could be considered in the absence of growth. Follow-up is not required for polyps measuring less than 5 mm in patients without the risk factors for a malignancy. On the other hand, the evidence for the guidelines is still lacking and of low quality. The management of gallbladder polyps should be individualized based on the currently available guidelines.
Go to : 
담낭 용종은 담낭의 내강으로 돌출된 병변을 의미하며, 유병률은 연구마다 차이가 있으나 약 0.3-10% 정도로 보고되고 있다.1 최근 건강검진 복부 초음파의 시행이 늘어남에 따라, 담낭 용종의 발견 빈도 또한 증가하고 있다. 우리나라에서 건강한 성인을 대상으로 건강 검진 목적으로 복부 초음파 검사를 시행하였을 때, 담낭 용종의 유병률은 약 6-10% 정도로 보고된 바 있다.2,3
담낭의 용종은 크게 신생물 용종(진성용종, neoplastic polyp)과 비신생물 용종(가성용종, non-neoplastic polyp or pseudopolyp)으로 나눌 수 있다. 신생물 용종에는 선종, 선암종이 포함되며, 비신생물 용종에는 콜레스테롤 용종, 염증성 용종, 과형성 용종 등이 있다. 대부분의 담낭 용종은 비신생물 용종이며, Elmasry 등4에 의한 체계적 문헌고찰에 의하면 담낭 용종으로 수술을 받은 환자들의 약 70%는 비신생물 용종이었으며, 담낭 선종은 약 8%, 그리고 담낭 악성종양은 약 7%로 보고되었다. 비신생물 용종은 이론적으로는 추후 악성화 가능성이 거의 없기 때문에 치료를 필요로 하지 않는 병변이다. 하지만 담낭의 용종성 병변에 대해서는 현재까지 조직 검사의 시행이 어려우며, 복부 초음파(transabdominal ultrasonography, TAUS), 전산화단층촬영(CT), 내시경초음파(EUS) 등 다양한 영상 검사 소견으로도 신생물 용종과 비신생물 용종을 감별하는 것은 매우 어렵다. 일반적으로 담낭 용종의 크기가 10 mm 이상이거나, 다른 이유로 설명되지 않는 복통 등의 증상을 동반하는 경우에는 악성화 가능성을 고려하여 담낭 절제술을 권고하고 있다. 하지만 실제 임상에서는 증상을 동반하는 담낭 용종은 극히 드물고, 담낭 용종의 크기가 10 mm 이상 측정되어 담낭절제술을 시행하였을 때 최종 진단이 신생물 용종으로 보고되는 경우는 많지 않다. 따라서 담낭 용종의 적절한 진단과 치료 및 추적관찰은 매우 어려운 문제이다. 본고에서는 2022년에 발표된 유럽 진료지침5을 소개하고, 담낭 용종의 진단, 치료와 추적관찰에 대해 알아보고자 한다.
Go to : 
초음파 검사는 담낭 용종의 진단 및 추적관찰에 있어서 가장 기본적이고 중요한 검사 방법이다. 담낭 용종은 초음파 검사에서 담낭 벽에서 담낭 내강 쪽으로 융기해 있는 작은 에코 덩어리로 관찰된다. 담낭 용종은 일차적으로 담석과의 감별이 필요한 데, 후방음향음영(posterior acoustic shadowing)이 동반되지 않으며, 체위 변동에 따라 움직이지 않는 소견으로 감별이 가능하다. 초음파 검사의 담낭 용종 진단의 민감도는 50-90%, 특이도는 71-98% 정도로 보고되고 있으며, 담낭암진단에 대해서는 민감도는 47-67%, 특이도는 30-100% 정도로 보고되고 있다.6
초음파는 비침습적이며 비교적 간단하게 시행할 수 있는 검사로, 담낭 용종의 진단에 대해 비교적 높은 정확도를 보이나, 초음파 시행 의사의 경험, 숙련도 등에 따라 검사 결과에 영향을 받을 수 있으며, 위·장내 가스, 환자의 체형(특히 복부비만이 있는 경우), 및 호흡조절 등의 환자 요인에 의해서도 검사에 제한이 있을 수 있다. 또한, 신생물 용종을 감별하는데 있어 비교적 낮은 정확도를 나타낸다. 이에 2022년 유럽 진료지침에서 신생물 용종과 감별이 어렵거나 진단이 모호한 경우 내시경 초음파 등 다른 영상 검사 방법이 유용할 수 있다고 언급하였다. 하지만 담낭 용종의 진단과 추적 관찰에 있어 일차적인 검사로는 복부 초음파를 권고하였다.
담낭 용종의 진단에 있어 CT의 역할에 대한 연구는 많이 이루어지지 않았다. Furukawa 등7은 초음파에서 발견된 3 cm 이하의 담낭의 용종성 병변에서 신생물 용종 감별에 있어 CT의 진단 정확도가 약 87%임을 보고하였다. 그러나 이 연구는 31명의 환자를 대상으로 한 규모가 작은 연구였으며, 대부분 10 mm 이상의 용종이 포함되었으며, 10 mm 이하의 용종은 5례밖에 포함되지 않았다. Jang 등8은 144명의 1 cm 이상 담낭 용종 환자에서 담낭암 진단의 정확도에 대해 고해상도 초음파(high-resolution ultrasound), EUS, CT를 비교하였으며, 각 검사의 민감도는 약 90%, 86% 및 72%로, CT는 다른 검사에 비해 다소 낮은 민감도를 나타내었다.
내시경초음파는 내시경 선단에 초음파 탐촉자가 부착되어 있으며, 고주파수를 이용하여 고해상도의 영상 획득이 가능하다. 내시경초음파는 내시경을 위 및 십이지장의 벽에 밀착시킨 후 초음파로 인근 장기 및 구조물을 관찰하게 되므로, 담낭을 관찰할 때 복부초음파 검사에 비해 담낭에 근접하여 관찰이 가능하며, 복벽의 지방과 장관 내 공기 등의 영향을 받지않는 장점이 있다. 담낭 용종에서 악성종양을 감별하는 데 있어 내시경초음파 검사의 민감도는 67-86%, 특이도는 84-91%정도로 보고되고 있다.6 2018년 Wennmacker 등10은 담낭 용종의 진단에 있어 복부초음파와 내시경초음파를 비교하는 체계적 문헌고찰을 발표하였으며, 담낭 용종의 감별진단에 있어내시경초음파가 복부초음파보다 우월하다는 증거는 불충분하다고 결론을 내렸다. 내시경초음파는 일반적으로 의식하 진정상태로 시행을 하게 되며, 비교적 안전한 검사이지만 출혈 및천공의 위험성이 있을 수 있다.
조영증강 내시경초음파는 조영제 주입 후 조영제에 특화된 영상기법인 하모닉 영상을 얻는 방법으로 조직의 관류 및 미세순환의 탐색이 가능하다.11 이러한 CEUS는 담낭 용종의 보다 나은 감별 진단을 위해서 활용도가 증가하고 있다.
Zhang 등12은 105명의 담낭 병변이 있는 환자에 대해 CEUS와 TAUS를 시행하여, 양성과 악성 병변 감별의 진단 정확도를 비교하는 연구를 시행하였으며, CEUS (민감도 94.1%, 특이도 95.5%)가 TAUS (민감도 82.4%, 특이도 89.8%)에 비해 높은 정확도를 나타내었다. 한편 Dong 등13은 59명의 담낭 병변이 있는 환자에 대해 저해상도 TAUS, 고해상도 TAUS 및 CEUS를 시행하였으며, 고해상도 TAUS와 CEUS를 병합하여 사용하였을 때 저해상도 TAUS만 시행하는 것에 비하여 담낭암 감별의 보다 높은 진단 정확도를 보였음을 보고하였다(민감도 93.3%, 특이도 88.5%).
이와 같이 담낭 용종의 감별진단에 있어 CEUS는 비교적 높은 정확도를 나타낸다고 보고되고 있다. 하지만 대부분 소규모로 시행된 단일 기관의 연구들로 추후 더 많은 연구가 필요할 것으로 생각되며, 아직까지는 다른 검사 방법으로 감별이 어려운 경우 보조적인 검사 방법으로 사용될 수 있을 것으로 생각된다.
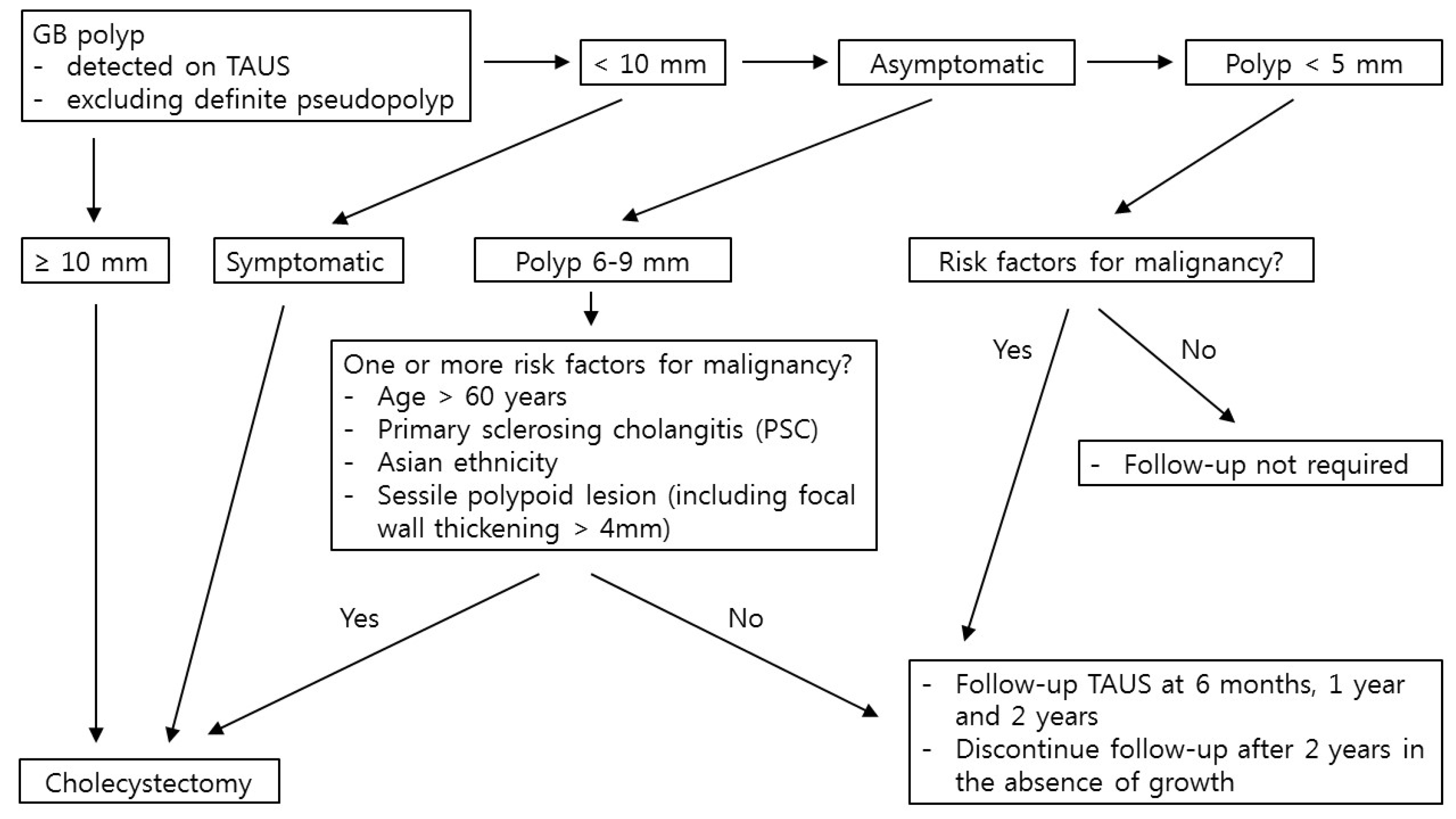
담낭 용종의 크기는 용종의 악성화를 예측할 수 있는 가장 중요한 위험인자이며, 용종의 크기가 10 mm 이상이면 담낭절제술 시행을 추천하였다. 하지만 담낭 용종의 크기 10 mm를 담낭절제술 시행의 기준으로 삼는 것은 근거가 다소 부족하며 논란이 있다. Wennmacker 등14은 10년간 조직병리학적으로 확인된 담낭 용종 환자 약 22만 명을 조사하였으며, 용종 크기 10 mm 이상이라는 기준으로만 담낭절제술 시행을 결정하는 것은 다소 불충분한 적응증이 될 수 있다고 하였다. 또한, 여러 연구에서 담낭 절제술 시행의 기준을 12 mm,15,16 13 mm,17,18 혹은 15 mm19-21 로 제시하기도 하였다. 하지만 그 근거수준은 다소 낮아 현재 담낭절제술 시행의 기준인 10 mm를 변경하는 데에는 무리가 있다. 따라서 2022년 유럽 진료지침에서도 여전히 담낭 용종의 크기 10 mm 이상을 담낭절제술 시행의 기준으로 제시하였으며, 다학제 통합진료를 통해 최선의 치료 방향을 결정하는 것도 가능할 것이라고 언급하였다.
다른 이유로 설명되지 않는 증상이 동반된 담낭 용종에 대해서는 크기가 10 mm 미만이더라도 담낭절제술 시행을 권고하였다. 담낭 용종은 일반적으로 복통 등의 증상을 유발하지는 않는 것으로 여겨지나, 일부 연구들에서는 증상이 담낭암의 주요 위험인자로 증상이 동반된 담낭 용종은 담낭절제술의 시행이 필요하다고 하였다.22,23 하지만 실제 임상에서 환자들이 호소하는 복통이 담낭의 문제로 인한 것인지 감별하는 것은 매우 어려우며, 담낭절제술 후에도 복통 등의 증상이 호전되지 않는 경우가 있을 수 있으므로 수술을 결정하기 전에수술의 유익성/위험성을 환자와 충분히 상의해야 한다.
2022년 유럽 진료지침에서는 담낭암의 위험인자들을 60세 이상, 원발성 경화성 담관염(primary sclerosing cholangitis, PSC), 아시아 인종, 4 mm 이상의 담낭벽 비후를 포함한 무경성(sessile) 용종으로 정하였다. 담낭 용종의 크기가 6-9 mm일 때, 앞의 4가지 위험인자 중 하나라도 해당이 되면 담낭절제술 시행을 권고하였다.
담낭암의 위험도는 다른 암종에서와 마찬가지로 나이가 많아질수록 높아진다고 알려져 있다. 담낭 용종에서도 환자의 나이는 악성 용종의 위험인자로 잘 알려져 있다. 하지만 정확히 어느 정도의 나이를 기점으로 악성 위험도가 높아지는지에 대해서는 논란이 있는데, 연구마다 50-65세로 다양하게 제시하고 있다. Elmasry 등4은 초음파에서 발견된 담낭 용종의 악성 위험도에 대해 체계적 문헌고찰을 시행하였으며, 이 연구에서 60세 이상일 때 담낭암의 위험도가 유의하게 높아진다고 밝혔다. 2017년 유럽 진료지침에서는 50세 이상을 담낭암의 위험인자로 하였는데, 앞의 연구 결과 등을 바탕으로 2022년 진료지침에서는 60세 이상을 담낭암의 위험인자로 정하였다.
PSC는 담낭암의 위험인자로 알려져 있으며, 미국 및 유럽 간학회에서는 PSC 환자에서 담낭 용종이 발견된 경우 크기에 관계없이 담낭절제술을 시행하도록 권고하고 있다.24,25 하지만 질환의 희소성으로 그 근거가 되는 연구는 많지 않은 실정이다. van Erp 등26은 453명의 PSC 환자에서 담낭 용종의 악성 위험인자에 대한 후향적 코호트연구를 시행하였으며, 71명(16%)의 환자에서 담낭 용종이 발견되었고, 이 중 17명의 환자들이 담낭절제술을 받았으며, 3명(18%)이 담낭암으로 최종 확진되었다. 이에 저자들은 PSC 환자에서 대부분의 담낭 용종은 양성으로, 모든 환자들에서 담낭절제술을 시행하기 보다는 영상 검사에서 고위험 요소(10 mm 이상의 크기, 용종 크기의 증가, 종양성 병변)가 있지 않다면 짧은 간격으로 추적 검사를 해볼 수 있겠다고 하였다. 하지만 다른 연구들에서는 용종의 크기가 10 mm 미만이더라도 담낭암이 발견되는 경우가 종종 있다고 보고하였다.27,28 이에 2022년 진료지침에서는용종이 6-9 mm일 때, PSC가 동반되어 있다면 담낭절제술을권고하였다.
인종의 경우 2017년 유럽 진료지침에서는 Elmasry 등4의 체계적 문헌고찰을 바탕으로 인도 인종을 담낭암의 위험인자라고 하였다.1 하지만 이후 Babu 등6의 체계적 문헌고찰에서 아시아 인종에서 담낭 용종의 악성화 위험도가 높다고 보고 하였으며, 2022년 진료지침에서는 인도인을 포함한 아시아 인종을 담낭암의 위험인자로 정하였다. 하지만 그 근거로 제시한 체계적 문헌고찰에 포함된 연구들은 대부분 근거 수준이 낮은 후향적 연구들이어서 해석에 다소 주의가 필요하다.
무경성(sessile) 용종과 담낭벽 비후는 담낭암의 위험인자로 보고되고 있으며, 2017년 유럽 진료지침에서는 4 mm 이상의 담낭벽 비후를 포함한 무경성(sessile) 용종을 담낭암의 위험인자라고 하였다. 이후에 시행된 여러 연구들에서도 무경성 용종은 담낭암의 위험인자라고 보고되었다.18,21,29,30 한편 여러 문헌에서 단일 용종 또한 담낭암의 위험인자로 제시되고 있으나, 2022년 진료지침에서는 단일 용종을 담낭암의 위험인자로 포함시키지는 않았으며, 기존의 4 mm 이상의 담낭벽 비후를 포함한 무경성 용종을 담낭암의 위험인자로 하였다. 하지만 앞의 4가지 담낭암의 위험인자가 있는 환자에서 단일 용종이 있는 경우에는 악성 가능성을 좀더 시사하는 소견일 수 있으며, 이러한 환자들에게는 담낭절제술 시행을 권고하였다.
한편 담낭 결석이 담낭 용종과 동반되어 있을 때, 담낭암 발생의 위험도가 높아지는지에 대해서는 여러 상반된 연구결과들이 있다. 일부 연구들에서는 담낭 결석이 담낭 용종에 동반되어 있으면 담낭암의 위험도가 높아진다고 보고하였으나,31,32 동반된 담낭 결석이 담낭암의 독립적인 위험인자는 아닌 것으로 보고한 연구들도 있다.3,33 2016년 유럽 간학회의 담낭 결석에 대한 진료지침에서는 무증상 담낭 결석이 6-10 mm의 담낭 용종과 동반되어 있고, 용종의 크기가 증가한다면 담낭절제술을 고려해야 한다고 하였다.34 반면 2017년 유럽 진료지침에서는 동반된 담낭 결석을 담낭암의 위험인자에 포함시키지 않았고, 2022년 유럽 진료지침에서는 이에 대해 따로 언급하지 않았다.1,5 결론적으로 담낭 용종에 담낭 결석이 동반되어 있을 때, 담낭암 발생의 위험도가 높아지는지에대해서는 아직까지 다양한 연구결과가 있으며, 명확한 근거는부족한 상태이다. 하지만 이러한 환자들에서 증상이 동반되어있다면 담낭절제술의 고려가 필요하다.
담낭 용종의 크기가 10 mm 이상이거나, 10 mm 미만이더라도 다른 이유로 설명되지 않는 증상이 동반되는 경우, 그리고 하나 이상의 담낭암의 위험인자가 있는 6-9 mm의 담낭 용종에 대해서는 담낭절제술 시행이 권고된다. 이러한 수술적 치료의 적응증에 해당되지 않는 담낭 용종에 대해서는 추적관찰이 필요하다.
2017년 유럽 진료지침에서는 담낭암의 위험인자가 없는 6-9 mm 크기의 용종과 위험인자가 있는 5 mm 이하의 용종에 대해서는 6개월, 1년째에 복부초음파를 시행하고 이후에는 1년마다 5년 동안 추적관찰을 시행할 것을 권고하였다. 그외 담낭암의 위험인자가 없는 5 mm 이하의 용종에 대해서는진단 후 1년, 3년, 5년째 복부초음파 검사 시행을 권고하였다.
하지만 이러한 권고의 근거는 다소 부족한 편이며, 담낭 용종의 자연 경과에 대해서는 아직 잘 알려져 있지 않다. Szpakowski와 Tucker35는 약 62만명을 20년 동안 추적관찰한 코호트 연구를 시행하였으며, 약 36,000명의 담낭 용종 환자와 365명의 담낭암 환자가 포함되었다. 담낭암 환자 코호트에서 초기 초음파에서 담낭 용종이 있었던 경우는 6%로, 일반 집단에서 담낭 용종 비율 5.8%와 비슷하였으며, 초기 초음파에서 담낭 용종이 있었던 경우와 없었던 경우에서 담낭암 발생 비율은 0.053%와 0.054%로 차이를 보이지 않았다. 이에 저자들은 담낭 용종은 우연히 발견된 것일 뿐이며, 담낭 용종이 담낭암으로 진행하는지에 대해서는 의문을 제기하였다. 한편 대부분의 담낭암은 추적관찰 첫 1년내에 발생하는 경우가 대부분이었고, 초기 용종의 크기가 10 mm 미만인 경우에는 담낭암이 거의 발생하지 않았으며, 10 mm 이상이더라도 추적관찰 1년째 이후에 발생하는 경우는 매우 드물었고, 추적관찰 4년째 이후에 발생하는 경우는 없다고 하였다. 이러한 결과들을 바탕으로 저자들은 담낭 용종이 발견되고 난 후 첫 1-2년 정도만 추적관찰 복부초음파 검사를 시행할 것을 제안하였다.
이러한 연구결과들을 바탕으로 2022년 유럽 진료지침에서는 담낭암의 위험인자가 없는 6-9 mm 크기의 용종 및 위험인자가 있는 5 mm 이하의 용종에 대해서 6개월, 1년, 2년째에 복부초음파를 시행하고, 용종 크기가 증가하는 소견이 없다면 이후에는 추적관찰을 중단할 것을 권고하였다.
그 외 담낭암의 위험인자가 없는 5 mm 이하의 용종에 대해서는 추적관찰이 필요하지 않다고 권고하였다. 담낭 용종의 크기가 5 mm 이하인 경우에서도 담낭암이 발생하였다는 소수의 보고가 있으나, 이는 대부분 담낭암의 위험인자가 동반된 경우였으며, Szpakowski와 Tucker35의 연구결과에 따르면 10 mm 미만의 담낭 용종 환자에서 한 명의 담낭암 환자를 발견하려면, 첫 1년 후 약 95,000건의 추적관찰 복부초음파 검사가 필요하다고 언급하였으며, 이는 너무 많은 의료자원이 투입되는 것일 수 있다고 하였다. 따라서 5 mm 이하의 크기가 작은 담낭 용종에 대해서는 추적관찰을 시행하지 않을 것을 권고하였으며, 이는 미국 영상의학전문의학회(American College of Radiology)36와 캐나다 영상의학협회(Canadian Association of Radiologists Incidental Findings Working Group)37의 크기가 7 mm 이하인 담낭 용종에 대해서는 추적관찰이 필요하지 않다는 권고와 유사한 맥락이라고 할 수 있겠다.
2년 동안의 추적관찰 기간 중 담낭 용종의 크기가 2 mm 이상 증가한다면, 현재 시점에서 담낭암의 위험인자가 동반되어 있는지 확인하고, 다학제 통합진료 등을 통해 지속적인 추적관찰 혹은 담낭절제술의 시행 여부를 결정할 수 있겠다고 권고하였다. 또한 추적관찰 기간 중 담낭 용종이 없어졌다면 더 이상의 추적관찰은 필요하지 않다고 권고하였다.
Go to : 
담낭 용종은 담낭의 내강으로 돌출된 병변으로 대부분은 악성화 가능성이 없는 비신생물 용종이지만, 신생물 용종과 감별하는 것은 어렵다. 담낭 용종의 진단과 추적관찰에 있어 기본적인 검사는 복부초음파 검사이며, 신생물 용종과 감별이 어렵거나 진단이 모호한 경우 내시경초음파나 조영증강 내시경초음파를 시행해볼 수 있다. 담낭 용종의 크기가 10 mm 이상이거나, 10 mm 미만이더라도 증상이 동반된 경우에는 담낭절제술 시행을 고려해야 한다. 6-9 mm 크기의 담낭 용종에서 담낭암의 위험인자(60세 이상, 원발성 경화성 담관염, 아시아인종, 4 mm 이상의 담낭벽 비후를 포함한 무경성 용종)가 하나라도 있는 경우 담낭절제술 시행을 고려할 필요가 있다. 담낭암의 위험인자가 없는 6-9 mm 크기의 용종과 위험인자가 있는 5 mm 이하의 용종에 대해서는 6개월, 1년, 2년째에 복부초음파 추적검사가 필요하며, 크기 증가 소견이 없다면 추적관찰의 중단을 고려할 필요가 있다. 담낭암의 위험인자가 없는 5 mm 이하의 용종에 대해서는 추적관찰을 요하지않는다. 하지만 아직까지 이러한 임상 진료지침 권고에 대한근거는 부족한 실정으로 추가 연구가 필요하며, 치료와 추적관찰에 있어 환자 개개인에 따라 유익성, 위해성을 평가하여적절한 진료를 제공해야 하겠다.
Go to : 
REFERENCES
1. Wiles R, Thoeni RF, Barbu ST, et al. 2017; Management and follow-up of gallbladder polyps: Joint guidelines between the European Society of Gastrointestinal and Abdominal Radiology (ESGAR), European Association for Endoscopic Surgery and other Interventional Techniques (EAES), International Society of Digestive Surgery - European Federation (EFISDS) and European Society of Gastrointestinal Endoscopy (ESGE). Eur Radiol. 27:3856–3866. DOI: 10.1007/s00330-017-4742-y. PMID: 28185005. PMCID: PMC5544788.
2. Choi YS, Do JH, Seo SW, et al. 2016; Prevalence and risk factors of gallbladder polypoid lesions in a healthy population. Yonsei Med J. 57:1370–1375. DOI: 10.3349/ymj.2016.57.6.1370. PMID: 27593864. PMCID: PMC5011268.

3. Park JK, Yoon YB, Kim YT, et al. 2008; Management strategies for gallbladder polyps: is it possible to predict malignant gallbladder polyps? Gut Liver. 2:88–94. DOI: 10.5009/gnl.2008.2.2.88. PMID: 20485616. PMCID: PMC2871589.

4. Elmasry M, Lindop D, Dunne DF, Malik H, Poston GJ, Fenwick SW. The risk of malignancy in ultrasound detected gallbladder polyps: A systematic review. Int J Surg. 2016; 33 Pt A:28–35. DOI: 10.1016/j.ijsu.2016.07.061. PMID: 27465099.

5. Foley KG, Lahaye MJ, Thoeni RF, et al. 2022; Management and follow-up of gallbladder polyps: updated joint guidelines between the ESGAR, EAES, EFISDS and ESGE. Eur Radiol. 32:3358–3368. DOI: 10.1007/s00330-021-08384-w. PMID: 34918177. PMCID: PMC9038818.

6. Babu BI, Dennison AR, Garcea G. 2015; Management and diagnosis of gallbladder polyps: a systematic review. Langenbecks Arch Surg. 400:455–462. DOI: 10.1007/s00423-015-1302-2. PMID: 25910600.

7. Furukawa H, Kosuge T, Shimada K, et al. 1998; Small polypoid lesions of the gallbladder: differential diagnosis and surgical indications by helical computed tomography. Arch Surg. 133:735–739. DOI: 10.1001/archsurg.133.7.735. PMID: 9688001.
8. Jang JY, Kim SW, Lee SE, et al. 2009; Differential diagnostic and staging accuracies of high resolution ultrasonography, endoscopic ultrasonography, and multidetector computed tomography for gallbladder polypoid lesions and gallbladder cancer. Ann Surg. 250:943–949. DOI: 10.1097/SLA.0b013e3181b5d5fc. PMID: 19855259.

9. Choi JH, Yun JW, Kim YS, et al. 2008; Pre-operative predictive factors for gallbladder cholesterol polyps using conventional diagnostic imaging. World J Gastroenterol. 14:6831–6834. DOI: 10.3748/wjg.14.6831. PMID: 19058309. PMCID: PMC2773878.
10. Wennmacker SZ, Lamberts MP, Di Martino M, Drenth JP, Gurusamy KS, van Laarhoven CJ. 2018; Transabdominal ultrasound and endoscopic ultrasound for diagnosis of gallbladder polyps. Cochrane Database Syst Rev. 8:CD012233. DOI: 10.1002/14651858.CD012233.pub2. PMID: 30109701. PMCID: PMC6513652.
11. Kitano M, Sakamoto H, Matsui U, et al. 2008; A novel perfusion imaging technique of the pancreas: contrast-enhanced harmonic EUS (with video). Gastrointest Endosc. 67:141–150. DOI: 10.1016/j.gie.2007.07.045. PMID: 18155437.
12. Zhang HP, Bai M, Gu JY, He YQ, Qiao XH, Du LF. 2018; Value of contrast-enhanced ultrasound in the differential diagnosis of gallbladder lesion. World J Gastroenterol. 24:744–751. DOI: 10.3748/wjg.v24.i6.744. PMID: 29456413. PMCID: PMC5807677.
13. Dong Y, Liu L, Cao Q, et al. 2020; Differential diagnosis of focal gallbladder lesions: The added value of contrast enhanced ultrasound with liner transducers. Clin Hemorheol Microcirc. 74:167–178. DOI: 10.3233/CH-190639. PMID: 31306115.

14. Wennmacker SZ, van Dijk AH, Raessens JHJ, et al. 2019; Polyp size of 1 cm is insufficient to discriminate neoplastic and non-neoplastic gallbladder polyps. Surg Endosc. 33:1564–1571. DOI: 10.1007/s00464-018-6444-1. PMID: 30203209. PMCID: PMC6484812.

15. Lee SR, Kim HO, Shin JH. 2019; Reasonable cholecystectomy of gallbladder polyp - 10 years of experience. Asian J Surg. 42:332–337. DOI: 10.1016/j.asjsur.2018.03.005. PMID: 29843968.

16. Sun Y, Yang Z, Lan X, Tan H. 2019; Neoplastic polyps in gallbladder: a retrospective study to determine risk factors and treatment strategy for gallbladder polyps. Hepatobiliary Surg Nutr. 8:219–227. DOI: 10.21037/hbsn.2018.12.15. PMID: 31245402. PMCID: PMC6561872.

17. Park HY, Oh SH, Lee KH, Lee JK, Lee KT. 2015; Is cholecystectomy a reasonable treatment option for simple gallbladder polyps larger than 10 mm? World J Gastroenterol. 21:4248–4254. DOI: 10.3748/wjg.v21.i14.4248. PMID: 25892875. PMCID: PMC4394086.

18. Onda S, Futagawa Y, Gocho T, et al. 2020; A Preoperative scoring system to predict carcinoma in patients with gallbladder polyps. Dig Surg. 37:275–281. DOI: 10.1159/000503100. PMID: 31722357.

19. Kim JS, Lee JK, Kim Y, Lee SM. 2016; US characteristics for the prediction of neoplasm in gallbladder polyps 10 mm or larger. Eur Radiol. 26:1134–1140. DOI: 10.1007/s00330-015-3910-1. PMID: 26188659.

20. Sarici IS, Duzgun O. 2017; Gallbladder polypoid lesions >15mm as indicators of T1b gallbladder cancer risk. Arab J Gastroenterol. 18:156–158. DOI: 10.1016/j.ajg.2017.09.003. PMID: 28958638.

21. Yang JI, Lee JK, Ahn DG, et al. 2018; Predictive model for neoplastic potential of gallbladder polyp. J Clin Gastroenterol. 52:273–276. DOI: 10.1097/MCG.0000000000000900. PMID: 28742730.

22. Guo J, Wu G, Zhou Z. 2015; Polypoid lesions of the gallbladder: report of 160 cases with special reference to diagnosis and treatment in China. Int J Clin Exp Pathol. 8:11569–11578.
23. Xu A, Zhang Y, Hu H, Zhao G, Cai J, Huang A. 2017; Gallbladder polypoid-lesions: What are they and how should they be treated? a single-center experience based on 1446 cholecystectomy patients. J Gastrointest Surg. 21:1804–1812. DOI: 10.1007/s11605-017-3476-0. PMID: 28695432.

24. European Association for the Study of the Liver. 2009; EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol. 51:237–267. DOI: 10.1016/j.jhep.2009.04.009. PMID: 19501929.
25. Chapman R, Fevery J, Kalloo A, et al. American Association for the Study of Liver Diseases. Diagnosis and management of primary sclerosing cholangitis. Hepatology. 2010; 51:660–678. DOI: 10.1002/hep.23294. PMID: 20101749.

26. van Erp LW, Cunningham M, Narasimman M, et al. 2020; Risk of gallbladder cancer in patients with primary sclerosing cholangitis and radiographically detected gallbladder polyps. Liver Int. 40:382–392. DOI: 10.1111/liv.14326. PMID: 31823479.

27. Said K, Glaumann H, Bergquist A. 2008; Gallbladder disease in patients with primary sclerosing cholangitis. J Hepatol. 48:598–605. DOI: 10.1016/j.jhep.2007.11.019. PMID: 18222013.

28. Torabi Sagvand B, Edwards K, Shen B. 2018; Frequency, risk factors, and outcome of gallbladder polyps in patients with primary sclerosing cholangitis: a case-control study. Hepatol Commun. 2:1440–1445. DOI: 10.1002/hep4.1276. PMID: 30556033. PMCID: PMC6287476.

29. Terzioğlu SG, Kılıç MÖ, Sapmaz A, Karaca AS. 2017; Predictive factors of neoplastic gallbladder polyps: Outcomes of 278 patients. Turk J Gastroenterol. 28:202–206. DOI: 10.5152/tjg.2017.16698. PMID: 28316322.

30. Choi TW, Kim JH, Park SJ, Ahn SJ, Joo I, Han JK. 2018; Risk stratification of gallbladder polyps larger than 10 mm using high-resolution ultrasonography and texture analysis. Eur Radiol. 28:196–205. DOI: 10.1007/s00330-017-4954-1. PMID: 28687913.

31. Aldouri AQ, Malik HZ, Waytt J, et al. 2009; The risk of gallbladder cancer from polyps in a large multiethnic series. Eur J Surg Oncol. 35:48–51. DOI: 10.1016/j.ejso.2008.01.036. PMID: 18339513.

32. Park JY, Hong SP, Kim YJ, et al. 2009; Long-term follow up of gallbladder polyps. J Gastroenterol Hepatol. 24:219–222. DOI: 10.1111/j.1440-1746.2008.05689.x. PMID: 19054258.

33. Kwon W, Jang JY, Lee SE, Hwang DW, Kim SW. 2009; Clinicopathologic features of polypoid lesions of the gallbladder and risk factors of gallbladder cancer. J Korean Med Sci. 24:481–487. DOI: 10.3346/jkms.2009.24.3.481. PMID: 19543513. PMCID: PMC2698196.

34. European Association for the Study of the Liver (EASL). 2016; EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones. J Hepatol. 65:146–181. DOI: 10.1016/j.jhep.2016.03.005. PMID: 27085810.
35. Szpakowski JL, Tucker LY. 2020; Outcomes of gallbladder polyps and their association with gallbladder cancer in a 20-year cohort. JAMA Netw Open. 3:e205143. DOI: 10.1001/jamanetworkopen.2020.5143. PMID: 32421183. PMCID: PMC7235691.

36. Sebastian S, Araujo C, Neitlich JD, Berland LL. 2013; Managing incidental findings on abdominal and pelvic CT and MRI, Part 4: white paper of the ACR Incidental Findings Committee II on gallbladder and biliary findings. J Am Coll Radiol. 10:953–956. DOI: 10.1016/j.jacr.2013.05.022. PMID: 24295947.

37. Bird JR, Brahm GL, Fung C, Sebastian S, Kirkpatrick IDC. 2020; Recommendations for the management of incidental hepatobiliary findings in adults: endorsement and adaptation of the 2017 and 2013 ACR incidental findings committee white papers by the canadian association of radiologists incidental findings working group. Can Assoc Radiol J. 71:437–447. DOI: 10.1177/0846537120928349. PMID: 32515993.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download