서 론
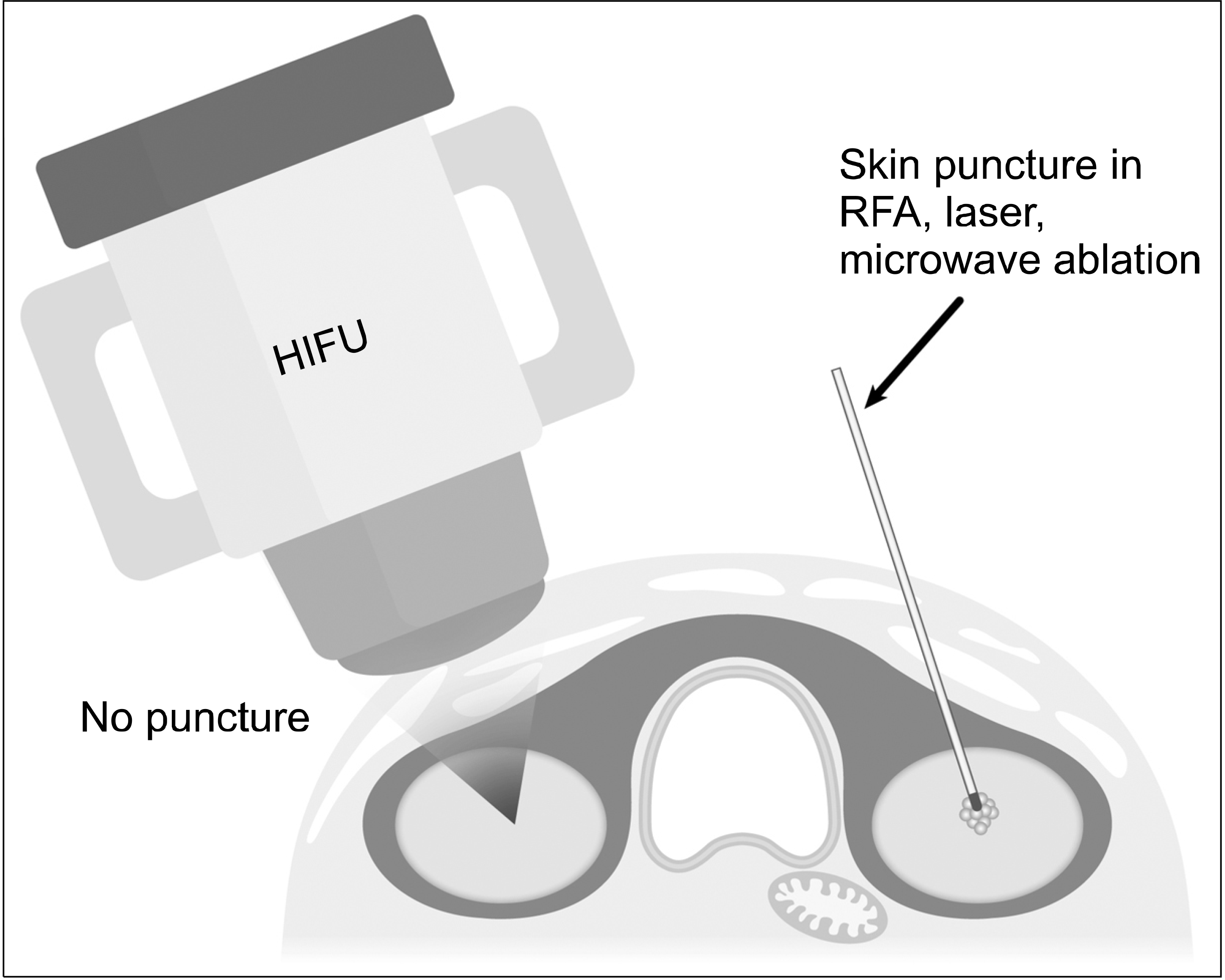
갑상선 결절은 증상이 없는 양성 결절인 경우에 추적관찰을 한다. Durante 등(1)은 무증상 양성 갑상선 결절을 5년 추적관찰 시 약 15%에서 5 mm 정도의 크기 증가가 있다고 하였다. 일부 양성 결절은 크기가 커지면서 압박증상, 음식 삼킬 때 불편감, 누워 있을 때 답답함을 유발할 수 있으며, 증상이 있는 경우에는 치료를 고려한다. 치료는 고전적으로 전신마취 하에 결절을 제거하는 수술이다. 수술을 받게 되면 흉터가 생기고, 회귀후두신경 마비(2%-5%), 저칼슘혈증, 출혈 등의 합병증 가능성이 있다. 양성 결절의 치료 목적은 증상 제거이다. 결절의 부피를 줄이는 것으로도 증상이 없어지기에, 전신 마취 하 수술 대신, 국소 마취 하에 결절 세포 파괴 방법을 사용할 수 있다. 세포 파괴 방법으로 거대 낭종에 대해서는 주로 에탄올을 사용하며, 고형 결절에 대해서는 열을 사용한다.(2) 열 발생 방법으로는 고주파(radiofrequency), 레이저(laser), 하이푸(HIFU, high intensity focused ultrasound), 마이크로파(microwave) 등이 있다. 열을 결절 세포에 전달하기 위해서는 바늘을 결절에 꽂는 방법을 사용하는데, 예외적으로 하이푸(HIFU)는 바늘을 사용하지 않고 피부 접촉 방식을 사용한다.(3)
본 논문에서는 각 시술 방법에 대한 설명 및 차이를 기술하고자 한다.
Go to : 
본 론
1. 에탄올 주입술
1) 원리
세포가 에탄올에 노출이 되면 세포막 용해, 단백질 변성, 혈관응고가 발생하여 세포 괴사가 유발된다. 괴사된 조직 주변으로 섬유모세포가 발달하여 육아종성 조직으로 바뀌게 된다. 최종적으로 낭종을 유발하는 세포가 괴사되어 더 이상 낭종이 생기지 않게 된다.(4)
3) 시술 방법
환자 자세는 앙와위(supine position) 후 베개를 어깨 밑으로 넣어서 머리를 뒤로 젖히는 자세로 한다. 피부에 1%-2% 리도카인으로 국소마취 후 초음파를 보면서 갑상선 협부를 통해서 낭종 안에 바늘을 넣는다. 바늘은 내용물의 점도에 따라서 18-24 G에서 선택한다. 갑상선 협부를 통해서 바늘을 넣는 것은 환자가 침을 삼키거나 말을 할 때 바늘의 위치 변화가 적고, 에탄올이 새서 주변에 자극을 주는 경우가 적은 장점이 있다. 이것을 trans-isthmic approach라고 한다.(4)
바늘이 낭종 뒷부분을 관통해서 밖으로 나가지 않도록 주의한다. 낭종 뒷부분을 관통 시 에탄올이 관통한 길로 새어 나가 부작용을 야기할 수 있다. 주사기에 음압을 걸어서 내용물을 뽑아내는데, 점도가 너무 높거나 부유물이 남아 있으면, 생리식염수를 넣어 희석한 다음에 흡입하기도 한다. 바늘은 그대로 놓아둔 채 흡입물이 들어있는 주사기를 분리하고, 95%-99%의 에탄올을 천천히 주입한다. 에탄올 주입 전에 바늘의 위치는 꼭 초음파를 보면서 확인한다(Fig. 1). 주입하는 총 에탄올 양은 흡인한 양의 10%-50% 정도로 시술자마다 선호도가 다르다. 주입하는 에탄올 양이 많으면 치료 효과가 좋아지지만 합병증 발생 확률도 올라가게 된다.
 | Fig. 1Ethanol injection is effective against cyst. (A) A complex nodule (arrow) was observed in the right thyroid prior to ethanol injection. (B) Cystic content was aspirated using a 24 G needle. (C) Ethanol was injected into the nodule using the same needle. (D) Three months after the ethanol injection, the cystic content disa-ppear-ed, leaving only the solid portion (arrow). |
만약 에탄올을 넣는 도중 환자가 통증을 호소한다면, 바로 주입을 멈추고, 에탄올이 낭종 밖으로 새지는 않았는지 확인한다. 새는 것을 예방하기 위해서는 너무 많은 양을 넣지 않도록 하고, 주입 시 압력을 세게 주지 않는다. 에탄올을 넣은 후에 2분 정도 기다린 후 넣었던 에탄올을 뽑아낸다. 2분을 기다리는 것은 에탄올이 세포변성을 일으킬 수 있는 최소 시간으로 본다.(12) 시술자에 따라서 에탄올을 10 ml 이하로 넣고 에탄올을 뽑지 않고 시술을 종료하는 경우도 있다. 주입한 에탄올을 흡인하여 제거하는 것과 그냥 두는 것은 시술자마다 선호하는 방법이 다르다. 넣었던 에탄올을 다시 흡인하는 것이 환자의 통증 및 불편감을 줄이고, 에탄올이 새는 합병증 발생이 적다라는 연구가 있다. 반면 넣었던 에탄올을 빼 내는 과정 중에 낭종 내 출혈 가능성이 높아지고, 시술 시간이 길어진다는 연구도 있다.(13)
5) 부작용
에탄올 주입술의 부작용으로 통증이 있으며, 드물게 미주신경 반응, 낭종 내 출혈, 일시적인 쉰 목소리, 일시적인 갑상선기능항진증 등이 보고되었다. 시술 후 일시적으로 얼굴이 빨개지고 화끈거리는 등 술에 취한 듯한 기분 변화가 있을 수도 있다.(15)
2. 고주파 열 절제술
1) 원리
바늘을 결절에 넣고 고주파를 보내면 바늘 주변의 조직 내 전해질의 이온 불안정(ionic agitation)으로 마찰열이 발생한다. 온도가 50℃ 이상이 되면 세포벽 파괴와 단백질 변성이 일어나고, 세포 수분의 기화(evaporation)와 응고 괴사(coagulation necrosis)로 비가역적인 손상이 일어난다. 괴사된 조직 주변으로 염증 반응이 일어나면서 반흔 조직이 형성되고 서서히 부피가 줄어들게 된다. 하지만 너무 높은 온도 발생은 치료의 효율을 떨어뜨린다. 온도가 100℃를 넘어가면 탄화가 발생해서 응고체(coagulum)가 형성되는데, 이것은 바늘에 붙어 고주파 전달을 막게 된다. 높은 온도로 상승하는 것을 막기 위해, 고주파 장비는 바늘에 냉각수를 순환시키고 온도 감지 장치를 결합하였다.(16)
2) 적응증
갑상선 양성 결절이 부피가 커서 음식 섭취 시 불편감, 이물감 같은 압박증상을 유발하거나, 볼록 나온 목으로 미용상 문제가 있는 경우에 시술을 고려한다. 시술 전에 세포검사나 조직검사를 통해 양성으로 확인된 경우에 시행한다. 검사는 위음성 가능성으로 2번을 권고한다. 만약 초음파상 전형적인 양성 모양인 경우는 한 번 검사로도 충분하다. 낭성과 고형이 같이 있는 복합결절인 경우, 고형성분 50% 이상이면 고주파 치료를 우선한다. 만약 낭성이 우세한 경우는 에탄올 주입술이 일차 치료이다. 만약 에탄올 주입술이 실패하였을 경우는, 추가적인 고주파 열 절제술이 효과적이다. 기능성 갑상선결절 치료에도 고주파 열 절제술이 가능하다.(17-20)
양성 결절에 대한 안정성과 효과가 증명된 후에, 갑상선 악성결절에 대해서 고주파 치료가 연구 되었고, 국내에서 수술하기 어려운 재발암에 대해서는 2019년 10월부터 보험 요양급여 적용이 되었다. 재발된 갑상선암이나 전이성 림프절의 치료는 고전적으로 전신마취 하 수술이다. 하지만 전신마취가 곤란하거나 과거 수술로 인한 조직변형 및 유착으로 수술이 어려울 때 고주파 열 절제술이 berry picking 수술의 대체 방법이 된다.(21-24) 2016년 이후부터 크기가 작은 원발성 암에 대해서도 고주파 치료 연구 결과가 나오고 있다. 아직은 연구 단계이며, 장기적인 추적 결과를 지켜봐야 하는 상태로 인정된 치료방법은 아니다.(25-28)
3) 시술 방법
에탄올 주입술과 자세는 같다. 앙와위(supine position) 후 베개를 어깨 밑으로 넣어서 머리를 뒤로 젖히는 자세로 한다. 고주파는 전기를 이용하는 것으로 환자 몸에 반지, 열쇠 같은 금속 물질이 없는지 확인하고, 환자 다리나 복부 등 비교적 근육이 많은 곳에 플레이트를 부착한다.
바늘의 방향은 목 중앙부 주변 피부부터 갑상선 협부를 통해 결절로 들어가도록 한다. 협부를 통해 들어가면 갑상선 관통 부위가 많아져서 바늘 고정이 잘 되고, 기도 위쪽으로 바늘이 지나가서 되돌이 후두신경(recurrent laryngeal nerve)을 피할 수 있다.(29)
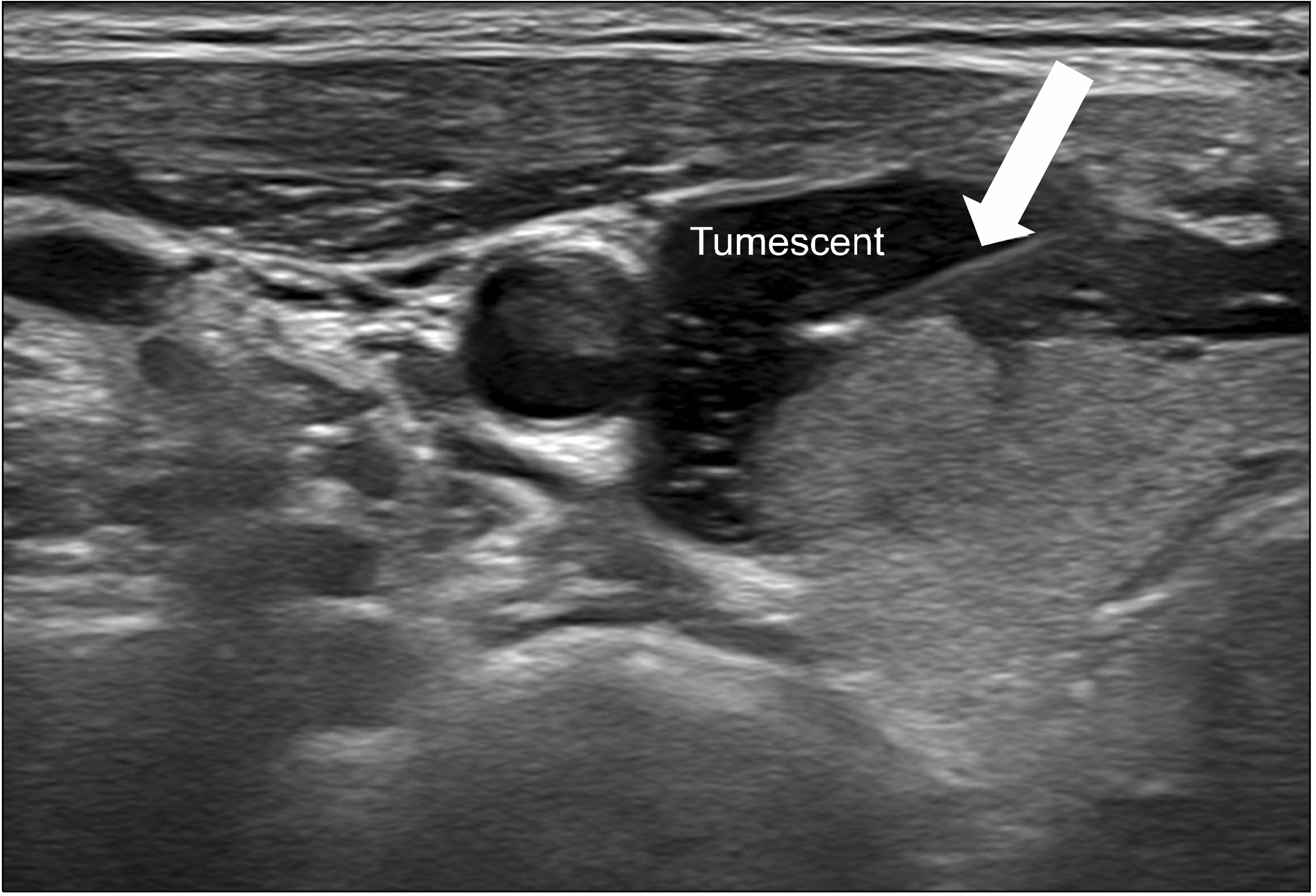
피부 마취 후에 초음파를 보면서 바늘을 넣어 국소 마취액을 갑상선 앞쪽 피막에 주입한다. 그 다음 갑상선 주변의 경동맥과, 갑상선 뒤편, 기도와 인접한 곳에 수액을 넣어 주변 장기와 갑상선의 거리를 떨어트린다. 액체를 주입하여 두 구조물 사이를 박리하는 것을 hydrodissection이라고 하는데, 이는 갑상선 주변 장기와의 거리를 2 mm 이상 떨어트려 열 손상을 예방하는 효과가 있다(Fig. 2). 주입하는 수액은 5% 포도당 혹은 0.2% 리도카인 희석액 등이 사용된다.(29-31)
고주파 바늘을 넣기 전에 바늘이 지나갈 통로에 상갑상선동맥이 있는지 도플러로 확인한다. 상갑상선동맥은 압력이 높아 절제술 시 결찰이 완전히 되지 않으면 출혈이 일어나기 쉬운 혈관으로 고주파 시술 시 상갑상선동맥 손상은 피하는 것이 좋다.(32) 혈관이 발달되어 있는 갑상선 결절은 혈관을 먼저 응고시키면, 열이 혈관을 타고 밖으로 새는 열배출현상(heat sink effect)이 적어지고 결절 내 출혈도 적어지는 효과가 있다.(30)
고주파 장비를 작동시키면 바늘 주변에 열 변성 및 증발로 수증기가 발생하는데, 수증기는 초음파에서 고에코 영역으로 보이게 된다. 수증기는 초음파가 투과 되지 않아 수증기 뒤편은 초음파 화면에서 보이지 않게 된다. 화면에서 바늘은 꼭 확인해야 하므로 결절의 깊은 곳부터 열 주는 것을 시작해서 얕은 곳으로 진행한다. 고주파 바늘은 온도센서가 결합되어 있어, 적정 온도 이상으로 올라가면 장비가 멈추는 cut-off 기능이 있다. 고에코 영역이 보이면 바늘을 조금씩 빼면서 움직이는 moving shot technique으로 cut-off 발생을 피할 수 있다.(33) 되돌이 후두신경은 초음파상 보이지 않으므로 주행을 고려해서 열 손상을 받지 않도록 주의한다. 해부학적으로 우측은 비스듬히, 좌측은 일직선으로 올라온다.(34)
결절 전체에 고에코 영역이 보이고, 도플러나 CEUS (cont-rast-enhanced ultrasound)로 결절 내 혈류가 사라진 것을 확인하고 시술을 종료한다(Fig. 3).
 | Fig. 3Radiofrequency ablation (RFA) is effective against solid no-dules. (A) A heterogeneous nodule was observed in the right thyroid before the RFA procedure (arrow). (B) During RFA, hyperechoic lesions were shown around the tip of the needle due to air bubbles. (C) Imme-diately after the RFA, the nodule changed to a heterogeneous lesion. (D) One year after the RFA, the nodule (arrow) had shrunk. |
4) 시술 결과
부피가 큰 양성 갑상선 결절에서 6개월 때 64.5%, 1년 경과 시 76.9%, 2년 경과 시 80.1%, 3년째 80.3% 정도 부피가 줄어드는 것으로 보고하였다. 결절은 시술 후 6개월 때 가장 많이 감소하다가, 그 이후는 천천히 줄어들고, 1년 이후에는 거의 줄어드는 것이 없다.(35)
5) 부작용
가장 흔한 것은 통증이다. 대부분 진통제 복용으로 통증 조절은 잘된다. 일시적 성대마비로 인한 목소리 변형이 있을 수 있는데 대부분 시간이 지나면 회복된다. 일시적 성대마비는 고주파 바늘이 직접 신경에 닿지는 않았지만, 열 전도 현상으로 발생하는 것으로 추정된다. 피부 화상, 출혈, 일시적 갑상선중독증, 영구적인 갑상선기능저하증, 감염, 종양 파열 등의 부작용이 드물게 보고되었다.(37)
6) 재성장
갑상선고주파 후 줄어들었던 결절이 자라는 경우가 있는데, 이는 대부분 결절의 경계면에 살아 있는 세포가 다시 증식한 것이다. 큰 결절이 주요 장기와 인접한 경우에 경계면은 소극적으로 치료되는 경우가 있다. 경계면에 대한 고주파 시술은 충분한 hydrodissec-tion 후에 moving shot technique을 사용할 것을 권유한다.(38)
3. 레이저 열 절제술(Laser ablation)
1) 원리
레이저(laser)란 영어로 light amplification by the stimulated emission of radiation의 머리글자로 유도방출에 의해 증폭된 빛이다. 빛 에너지는 출력이 높으면 열에너지를 발산한다. 빛을 내는 레이저광섬유를 결절 내로 삽입하여 레이저 빛을 보내면 60℃-100℃ 온도에서 단백질 변성 및 응고가 일어나고, 기화가 발생한다. 레이저 빛을 만들 때 사용하는 매질의 종류는 여러 가지가 있는데, 갑상선 열 절제술에 사용하는 매질은 주로 Nd;YAG (neodymium - yttrium aluminum garnet)이다.(41)
3) 시술 방법
기본 자세는 고주파 열 절제술과 같다. 고주파 장비는 바늘을 한 개 사용하지만, 레이저는 한 개부터 4개까지 바늘을 동시에 넣어 시술할 수 있다. 2개 이상의 바늘을 넣을 때는 바늘끼리 1 cm 거리를 두고 수평을 유지한다. 유도 바늘을 넣은 뒤 레이저 광섬유를 유도 바늘 끝까지 밀어 넣고, 유도 바늘을 5 mm 이상 뒤로 당겨서 광섬유가 조직과 맞닿게 한다. 보통 3-5 W (와트)의 출력으로 레이저를 보낸다. 열에 의해 조직이 변성되고 기화되면 수증기가 발생하고 이것이 초음파상 고에코 영역으로 보이게 된다. 고에코 영역이 보이면 광섬유와 유도 바늘을 일부 빼고 레이저를 다시 보낸다. 고주파 열 절제술처럼 결절 전체에 고에코 영역이 생긴 것을 확인하고 시술을 종료한다(Fig. 4).
 | Fig. 4Laser ablation is similar to radiofrequency ablation in that both use heat. (A) A nodule was observed in the left thyroid before laser ablation (arrow). (B) After the ablation, the nodule changed to a heterogeneous lesion. (C) Three months after the ablation, the nodule had shrunk. (D) One year after the ablation, the nodule (arrow) had shrunk even more. |
6) 다른 시술과의 비교
고주파와 레이저를 비교해 보았을 때 연구자마다 차이가 있다(Table 1). 부피 감소율이 레이저가 우세하다라는 연구가 있고, 고주파가 우세하다라는 메타 분석 연구가 있으며, 차이가 없다라는 연구들도 있다.(44-48) 시술자의 숙련도 차이가 결과에 영향이 있다.(44) 고주파와 레이저 열 절제술 모두 압박 증상을 없애고 부피를 줄이는데 효과적이다.
Table 1
Comparison of Laser with Radiofrequency Ablation
| LA (VRR %) | RFA (VRR %) | P-value | Follow-up | Comment | |
|---|---|---|---|---|---|
| Pacella et al.(44) | 70 ± 19% | 62 ± 22% | 0.001 | 1 year | Laser effective |
| Ha et al.(45) | 49.5% | 77.80% | 0.02 | 6 months | RFA effective |
| Cesareo et al.(46) | 53.20% | 63.40% | 0.71 | 6 months | No difference |
| Ben Hamou et al.(47) | 83.9% | 75% | 0.03 | 18 months | No difference |
| Mauri et al.(48) | 70% | 74% | 12 months | No difference |
4. 고강도 집속 초음파, 하이푸(high-intensity focused ultrasound, HIFU)
1) 원리
하이푸는 바늘을 사용하지 않는다. 몸 밖에서 국소 고에너지 초음파 빔을 몸 안의 하나의 초점에 집중시키면 1,000분의 1초의 짧은 시간에 열이 발생한다. 마치 볼록렌즈로 햇볕을 한 곳에 집중시켜 불을 피우는 것과 비슷한 원리이다. 결절의 부피가 큰 경우에는 여러 개의 초점을 만든다. 하이푸는 열 발생 하는 것 외에 추가적으로 음향공동현상(acoustic cavitation)을 만들어서 조직 괴사를 유도한다. 음향공동현상은 기포의 운동 에너지를 초음파 파장으로 조절하여 세포 괴사를 유발하는 기술이다.(49)
2) 적응증
증상이 있는 갑상선 양성 결절이 대상으로 고주파 열 절제술 및 레이저 열 절제술과 적응증이 같다. 하지만 하이푸는 결절의 위치와 양상에 따라 시술의 제한이 있다. 환자가 목을 뒤로 젖히는 것이 불편한 경우, 갑상선 결절이 주요 장기와 맞붙어 있는 경우(경동맥과 2 mm 이내, 기도와 3 mm 이내, 되돌이 후두신경과 5 mm 이내)와, 결절이 피부에 근접한 경우(5 mm 이하)는 열 손상 가능성으로 시술 제한이 있으며, 결절이 피부로부터 3 cm 이상 너무 깊이 있는 경우도 권하지 않는다. 낭성 결절은 흡인을 하지 않으므로 적용대상이 아니며, 거대 석회화가 있는 경우는 석회화가 초음파 투과를 방해해서 사용되지 않는다.(50) 기능성 갑상선 결절과 갑상선암에서는 적용된 보고가 없다.
3) 시술 방법
환자는 누워 있는 상태에서 베개를 어깨 밑에 받쳐서 고개를 뒤로 젖히는 자세를 취한다. 환자가 움직일 시 다른 부위 손상 가능성이 있어 환자 움직임을 주의해야 한다. 6시간 이상 금식 후에 수면마취를 유도해서 하기도 하고 수면마취 없이 각성 상태에서 시행하기도 한다.(51) 프로브를 목 피부 위에 맞닿게 한다. 컴퓨터 설정을 완료하고 열 발생을 시작한다. 프로브에는 피부 냉각 장치가 되어 있어 8초간 초음파 고에너지를 보낸 후, 약 40초 정도 냉각을 한다. 냉각시간은 보내는 출력에 따라서 컴퓨터에서 자동으로 계산되어 조절된다. 다른 시술과 달리 바늘을 사용하지 않는 장점이 있고, 시술 시간은 60분 정도로 오래 걸리는 단점이 있다(Fig. 5).
5. 마이크로파 열 절제술(Microwave ablation)
1) 원리
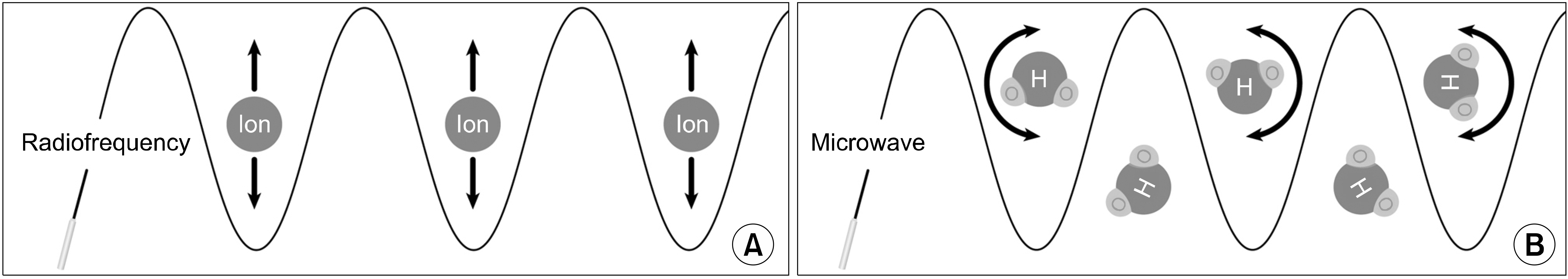
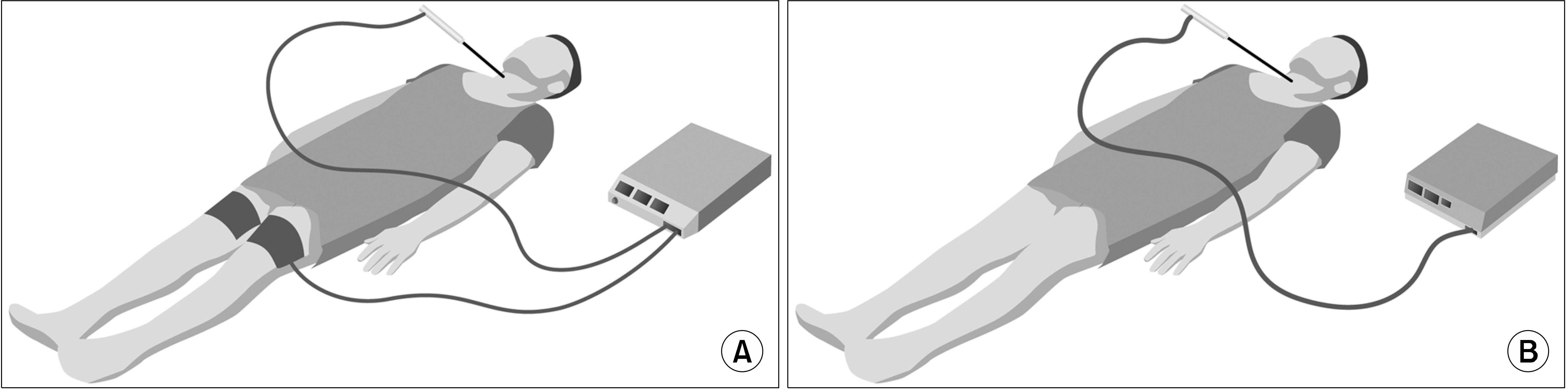
마이크로파를 바늘을 통해서 조직에 보내면, 조직 내 물 분자들이 마이크로파의 극성변화에 따라서 빠른 속도로 회전과 충돌을 일으켜 열이 발생한다. 고주파는 450-500 kHz의 주파수를 사용하는데, 마이크로파는 915-2,450 MHz의 주파수를 사용한다. 고주파는 전해질을 요동치게 하는 반면, 마이크로파는 물 분자들을 회전시키고 움직이게 한다(Fig. 6). 고주파는 조직 상태에 따라서 열 발생 정도 차이가 있지만, 마이크로파는 조직 상태에 상관없이 균일하게 원형으로 열을 발생시킨다. 마이크로파 장비 구성은 고주파 장비와 비슷하다. 마이크로파를 발생시키는 본체와, 냉각 기능이 들어 있는 바늘(cooled-shaft microwave antenna), 본체와 연결 케이블로 구성되며, 바늘 끝은 유착방지를 위해서 polytetrafluoroethylene으로 코팅되어 있다. 고주파는 전류 순환 방식으로 접지판이 필요하지만, 마이크로파는 전파 방사 방식으로 접지판이 없다(Fig. 7). 갑상선고주파 바늘은 18 G인데, 마이크로파에서는 더 굵은 16 G를 사용한다.(53)
Go to : 
결 론
낭성 결절의 치료는 에탄올 주입술을 선택한다. 낭성 결절의 효과는 에탄올과 열 절제술이 비슷하지만 비용적인 면에서 에탄올 주입술이 저렴하다. 낭성 결절이 재발한 경우나, 고형 성분이 많은 혼합 결절은 열 절제술을 선택한다. 고형 성분의 결절은 열 절제술이 일차 선택이다. 열 절제술은 갑상선 결절 내에 열을 주어 세포를 파괴시키는 것으로, 고주파, 레이저, 하이푸, 마이크로파를 이용한다. 양성 결절에 대한 고주파와 레이저 열 절제술은 보편화 되었으며, 치료 효과도 비슷하다. 하이푸와 마이크로파 열 절제술은 새로운 기술로 하이푸는 바늘을 사용하지 않고, 마이크로파는 열 발생이 균일하고 시간이 짧으나 아직은 효과가 완전히 평가되지 않았다(Table 2). 양성 결절 치료뿐만 아니라 갑상선 재발암이나, 전이암에 대해서 환자의 전신마취 위험도가 높고, 수술이 어려운 경우에 고주파 열 절제술이 사용된다. 갑상선 원발암 일차 치료로 수술이 아닌 고주파 열 절제술에 대해서 일부 기관에서 연구 중이다.
Table 2
Technical Characteristics of Ablations for Thyroid Nodule
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download