Abstract
Breast cancer is the most commonly diagnosed cancer in women and its incidence and the mortality associated with it have increased over the years. Early detection of breast cancer via various imaging modalities can significantly improve the prognosis of patients. Ultrasound is a useful imaging tool for breast lesion characterization due to its acceptable diagnostic performance and non-invasive and real-time capabilities. However, one of the major drawbacks of ultrasound imaging is operator dependence. Artificial intelligence (AI), particularly deep learning, is gaining extensive attention for its excellent performance in image recognition. AI can make a quantitative assessment by recognizing imaging information, thereby improving ultrasound performance in the diagnosis of breast cancer lesions. The use of AI for breast ultrasound in clinical practice is extremely important, as it saves time, reduces radiologist fatigue, and compensates for a lack of experience and skill in some cases. This review article discusses the basic technical knowledge required, the algorithms of AI for breast ultrasound, and the application of AI in image identification, segmentation, extraction, and classification. In addition, we also discuss the future perspectives for the application of AI in breast ultrasound.
유방암은 전 세계 여성에서 가장 많이 발생하는 암으로 암 사망률 2위를 차지하고 있으며 매년 발생률과 사망률이 증가하고 있다.(1) 유방암을 조기에 발견해 적절한 치료를 시행하면 사망률을 감소시킬 수 있기 때문에 그동안 유방암을 초기에 정확하게 발견하기 위한 많은 노력이 있어 왔다. 유방암의 선별 검사(screening test)와 보조적 진단을 위한 영상학적 검사로 유방촬영술(mammography), 유방 초음파(ultrasound), 유방 자기공명영상(magnetic resonance imaging) 등이 이용되었으며 이 중 유방 초음파는 안전성, 편리성, 비침습성 그리고 높은 정확도 등의 장점으로 유방 병변의 진단을 위해 널리 사용되고 있다.(2) 또한 유방 초음파는 치밀 유방(dense breast)을 가진 환자에서 유방촬영술의 낮은 민감도(sensitivity)를 보완할 수 있는 장점이 있다. 하지만 표준화(standardization)의 부재, 낮은 재현성(reproducibility), 높은 검사자(operator) 의존도, 긴 검사 시간 등의 단점이 존재한다.(3)
최근에 인공 지능(artificial intelligence; AI)은 자동 음성 인식(automatic speech recognition), 이미지 인식(image recognition) 및 자연어 처리(natural language processing) 등의 분야에서 괄목할 만한 성과를 이루었다. 의료 이미지 분야에서는 인공 지능 중 딥러닝(deep learning; DL) 기술에 관한 연구가 활발하게 시행되고 있는데 특히 유방 이미지 분야에서 그 유용성이 많이 보고되고 있다.(4)
인공 지능은 유방 병변을 촬영할 때 영상 정보를 자동으로 인식해 정량적으로 평가(quantitative assessment)함으로써 유방 초음파의 유용성을 향상시킬 수 있다.(5) 임상 현장에서 유방 초음파에 인공 지능을 활용하는 것은 시간을 절약하고 전문의의 피로를 감소시키며 경우에 따라 의료인의 경험과 기술 부족을 보완하기 때문에 매우 중요하다.(6)
이에 저자들은 인공 지능의 기초 지식과 유방 초음파에서 인공 지능을 이용한 이미지 식별(identification), 분할(segmentation), 추출(extraction) 및 분류(classification)에 대해 살펴보고 유방 초음파에서 인공 지능 활용의 향후 전망에 관해 논의하고자 한다.
인공 지능은 인간의 지능을 필요로 하는 작업을 수행할 수 있는 스마트 기계(smart machine)를 구축하는 것과 관련된 컴퓨터 과학의 광범위한 영역이다.(7) 인공 지능은 외부 데이터를 정확하게 해석하고 그 데이터를 학습하여 유연한 적응(flexible adaptation)을 통하여 목표를 달성하기 위해 학습한 데이터를 사용하는 시스템의 능력이라 정의할 수 있다. 1956년에 John McCarthy가 인공 지능의 개념을 발표한 후 인공 지능 기술은 획기적인 발전을 거듭하여 인간의 뇌와 같이 반응하는 새로운 지적 기계(intelligent machine)를 개발하는 단계에 이르렀다.(8)
의료 분야에서 인공 지능은 건강 관리, 임상 결정 지원, 의료 영상, 질병 선별 및 조기 질병 예측, 의료기록/문헌 분석, 병원 관리 등에 적용할 수 있다. 또한 인공 지능은 질병 선별 및 예측을 위해 의료 영상과 정보를 분석하고 의사의 진단을 지원(support)할 수 있다. Al-Antari 등(9)은 유방촬영술에 컴퓨터 보조 진단(computer- aided diagnosis; CAD)을 적용하여 유방 종양을 발견하고 분류 하였을 때 92% 이상의 정확도를 보였다고 하였다. 또한 Rodriguez- Ruiz 등(10)은 훈련된 인공 지능을 사용하여 자동으로 종양을 미리 선택하는 시스템을 이용하였을 때 영상의학과 전문의의 업무량을 17% 감축하였다고 보고하였다.
기계 학습(machine learning; ML)은 인공 지능을 실현하는 가장 중요한 방법 중 하나이다. 기계 학습은 명확하게 제시되는 프로그래밍 없이 경험으로부터 자동으로 배우고 개선하는 능력을 가진 시스템을 제공한다. 기계 학습은 방사선학(radiomics)에 의해 추출된 이미지의 특징을 입력(input)해 질환의 결과를 예측하는 출력(output)을 제공하기 위한 컴퓨터 알고리즘(computational algorithm)을 제시한다.(11,12)
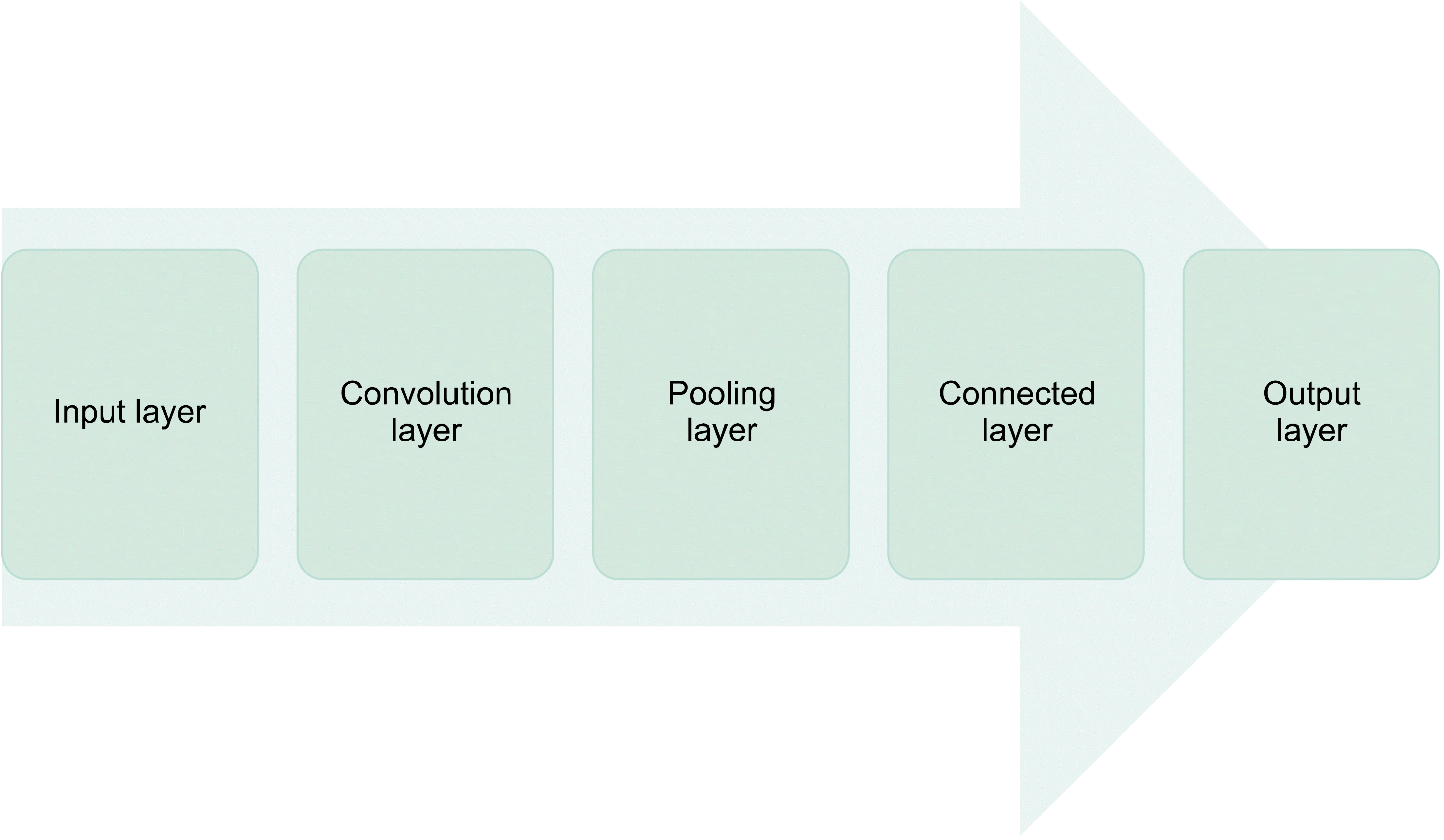
신경망(neural network)을 기반으로 한 인공 지능 시스템 중 하나인 딥러닝은 인간의 뇌를 모방한 모델을 구축한 것으로 현재 이미지 분류를 위한 최신 기술로 꼽힌다. 딥러닝은 대량의 데이터를 학습하고 공통적인 특징들을 자동으로 추출하여 상황에 따른 유연한 결정을 내릴 수 있다.(13) 이미지 분류에서는 소위 convolutional neural network (CNN) 라고 불리는 딥러닝 기술이 주를 이루고 있다. 일반적으로 CNN은 입력 단계(input layer), 나열 단계(con-volution layer), 수집 단계(pooling layer), 연결 단계(con-nected layer)와 출력 단계(output layer)의 연속적인 단계들(con-tinuous layers)로 구성되어 있다(Fig. 1). 나열 단계는 입력된 이미지로부터 특징을 추출해 그 결과를 다음 단계로 전달하고 수집 단계는 과적합(overfitting) 가능성을 최소화하기 위해 활성화 맵(acti-vation map)의 공간 크기(spatial size)를 줄인다. 공간 수집(spatial pooling)은 subsampling 또는 downsampling이라고 하는데, 이는 각 맵의 차원(dimensionality)을 줄이지만 중요한 정보는 유지한다. 완전한 연결 단계의 목적은 나열/수집 단계의 결과를 통해 획득한 이미지를 label에 따라 분류하는 것이다. 출력 단계는 프로그램에 대해 지정된 출력을 생성하는 마지막 단계이다. 입력과 출력 단계 사이의 여러 단계들을 숨겨진 단계들(hidden layers)이라고 부른다.(14,15) 이러한 다중 단계 시스템(multilayer system)은 각 단계들의 유기적인 결합과 배치로 복잡한 문제들을 풀 수 있다.
딥러닝을 실행하기 위해서는 훈련(training), 검증(validation) 그리고 시험(test) 데이터세트(dataset)를 수집해야 한다. 훈련 데이터는 모델 변수(parameter)들과 부합하는데 사용된 예들의 세트이다. 일치시킨 모델(fitted model)은 검증 데이터라 불리는 두 번째 데이터세트의 관찰 반응을 예측하는데 이용된다. 마지막으로 시험 데이터를 이용해 훈련 데이터와 일치시킨 최종 모델의 오차 없는(unbiased) 평가를 수행한다.(16)
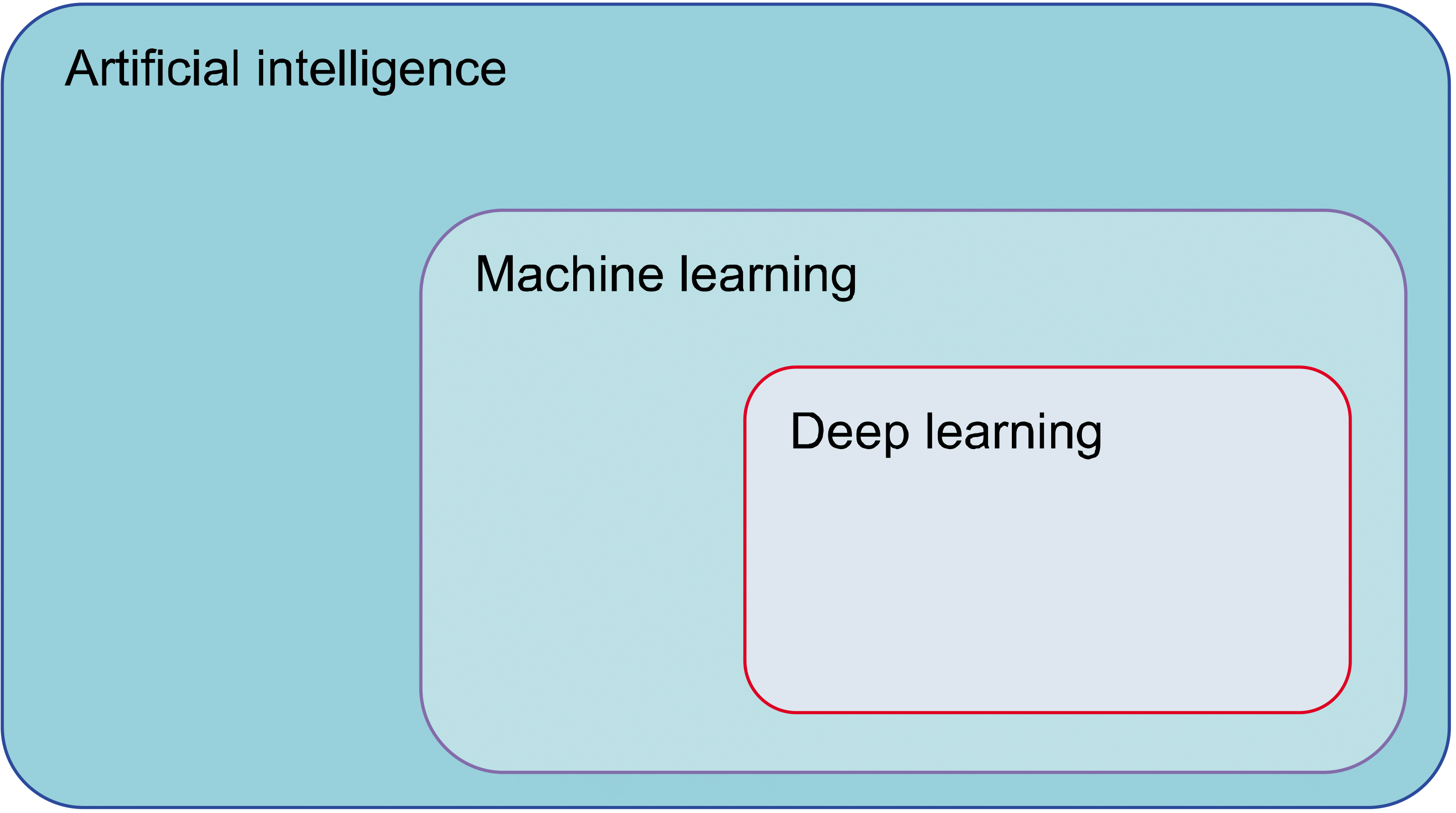
인공 지능과 기계 학습 그리고 딥러닝의 개략적인 모식도는 Fig. 2와 같다.
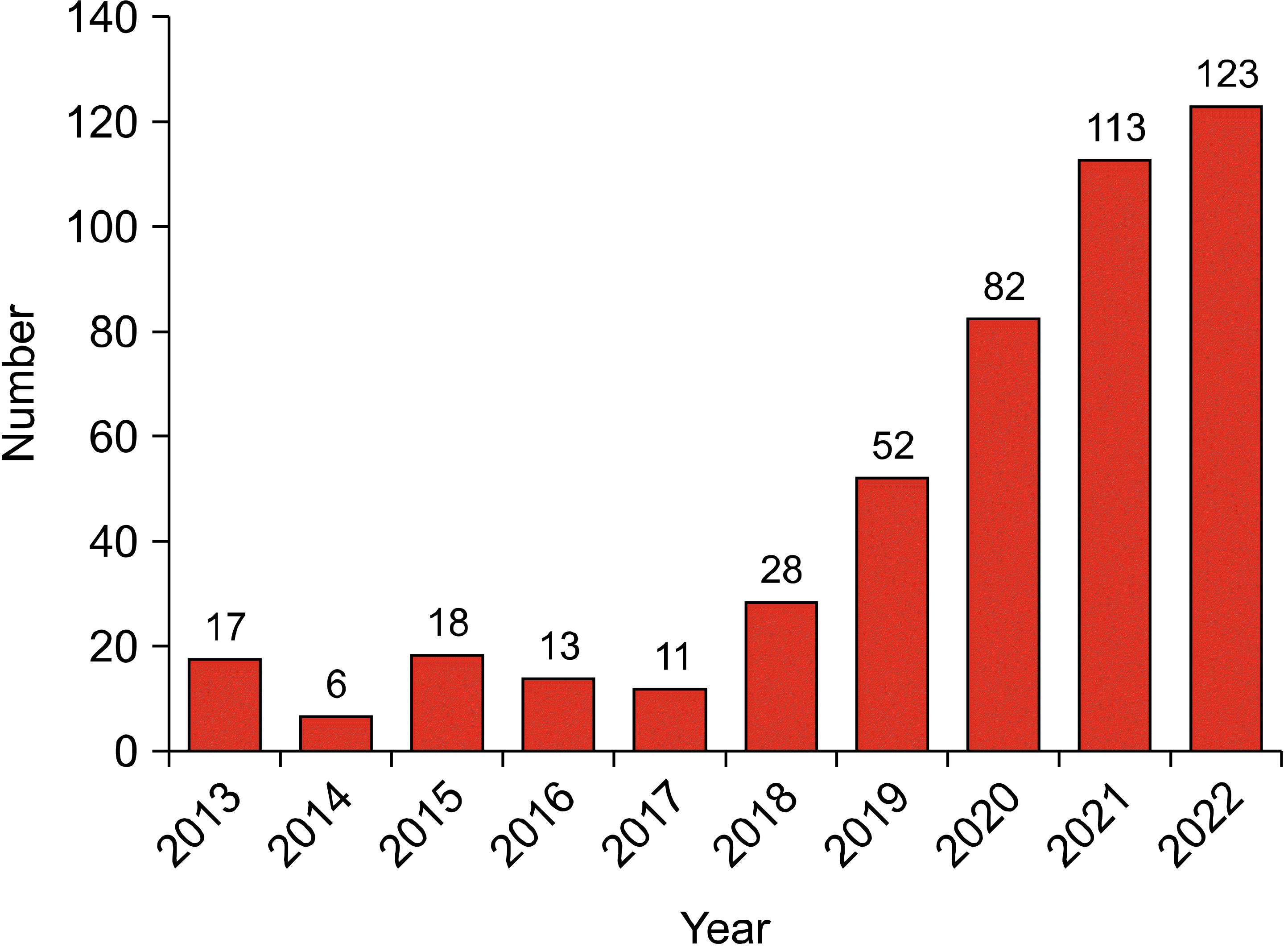
초음파는 높은 활용도를 가진 진단 방법으로 방사선이 없고 작동 방법이 간단하며 실시간으로 확인이 가능한 점 등의 많은 장점이 있어 유방암의 진단을 위한 일반적인 영상학적 검사가 되었다. 다른 영상학적 검사와 마찬가지로 유방 초음파에서도 의료진의 경험 부족 또는 주관적인 판단으로 인한 진단 누락이나 오진을 피하고 영상 진단의 정량화와 표준화를 달성하기 위해 영상에 인공 지능 시스템을 적용하기 시작했다.(17) Pubmed에서 “Artificial intelligence”와 “Breast ultrasound”의 검색어로 최근 10년 동안 발행된 논문의 수를 조사하였을 때 2013년-2017년까지는 큰 변화가 없다가 2018년 이후 급속도로 증가하는 경향을 볼 수 있다(Fig. 3). 이 연구들의 대부분은 유방 초음파에서 이미지 식별과 분할, 추출 그리고 양성과 악성 병변의 분류에 대한 인공 지능의 역할에 관련된 것이었다.
유방 병변들을 정확하게 식별하고 진단하기 위해서 먼저 병변들을 배경(background)에서 분할해야 한다. 현재 임상 현장에서 유방 초음파 이미지의 분할은 임상의에 의해 수동으로 이루어지며 시행자의 임상 경험에 의존적이고 시간과 노력이 많이 소모된다. 또한 유방 초음파 이미지는 낮은 대비(contrast), 흐릿한 경계와 많은 양의 음영(shadow)를 보이기 때문에 인공 지능을 활용한 자동 분할 방법이 제안되었다.
유방 초음파 영상의 분할 과정에는 주로 병변을 포함하는 관심 영역(region of interests; ROI)의 식별과 윤곽선의 묘사가 포함된다. CNN 기술에 기초한 빠르고 정확한 분할 모델로 Fully Convolu-tional Network(18), SegNet(19), U-net(20) 등이 개발되었다. Kumar 등(21)은 여성 258명의 유방 초음파 이미지에 다중-U-net 알로리즘(multi-U-net algorithm)을 이용해 종양들을 분할하여 0.84의 진양성(true positive fraction)과 0.01의 위양성(false positive fraction)을 보여 기존의 U-net 알로리즘보다 명확하게 좋은 결과를 보였다. 또한 Hu 등(22)도 dilated fully convolutional network을 이용한 자동 종양 분할 방법을 소개하였는데 이 인공 지능 모델을 통해 88.9%의 Dice similarity coefficient (DSC)를 획득해 높은 정확도와 효능으로 수동 분할(manual segmentation)을 대체할 수 있을 것이라고 보고하였다.
유방 초음파에서 인공 지능을 이용하여 병변을 정확하게 식별하고 분할하면 이를 위한 의료인의 업무 시간을 상당 부분 줄일 수 있어 유방 질환의 효율적인 진단을 위한 인공 지능 적용의 기반을 제공할 수 있다.
임상의(clinician)들은 일반적으로 유방 영상의 형태학적(morphological), 질적(texture) 특징들에 기초하여 의심되는 종양들을 식별하고 분할한다. 이러한 특징들은 모양(shape), 방향(orientation), 경계(edge), 에코(echo), 후방 특징(rear feature), 석회화(calcification)와 경도(hardness) 등이며 이들을 종합하여 악성 종양의 의심 정도를 Breast Imaging Reporting and Data System (BI-RADS) 범주에 따라 분류한다.(23) 유방 초음파는 BI-RADS 범주를 이용해 판독하지만 경험이 풍부한 임상의가 부족한 곳에서는 진단의 정확도를 유지하기 어려울 수 있기 때문에 이미지 추출에 대한 임상의의 경험 의존도를 줄이기 위해 유방 초음파에 인공 지능을 적용하기 시작했다.
Hsu 등(24)의 보고에 따르면 Hausdorff-based fuzzy c-means (FCM) 알고리즘을 유방 초음파에 적용해 이미지를 추출하였을 때 89.4%의 정확도와 92.5%의 민감도 그리고 86.3%의 특이도를 보였다. 전단파 탄성초음파(shear-wave elastography)의 이미지 추출에 이중 단계(two layer) 딥러닝 시스템을 이용하면 정확도 93.4%, 민감도 88.6%, 특이도 97.1%와 area under curve (AUC) 0.947의 우수한 결과를 낳았다는 보고도 있다.(25) 또한 초음파에서 작업 장소(workstation)로 이미지를 보내지 않고 바로 유방 병변을 식별, 추출할 수 있는 딥러닝 시스템(S-Detect, Sam-sung RS80A ultrasound system)은 유방 병변의 서술(descrip-tion)을 개선하고 나아가 치료 방향을 결정하는 데 도움이 될 수 있으며, 임상의들이 유방 종양의 특징들을 일관성 있게 판단하는 능력을 향상시켰다.(26,27)
대부분의 임상의들은 유방 초음파 영상에서 BI-RADS 범주에 따라 유방 병변을 분류한다. 다양한 경험을 가진 의사들이 양성과 악성 병변 분류에 일관된 결론을 내리기 위해 인공 지능이 점차적으로 개발되어 왔다.
Ciritsis 등(28)은 deep CNN을 이용하여 BI-RADS 2, 3과 BI-RADS 4, 5를 분류하였을 때 93.1%의 정확도를 보여 영상의학과 전문의의 91.6%보다 높은 정확도를 나타냈다. 637개의 유방 초음파 이미지(악성 84개와 양성 553개)를 대상으로 딥러닝 시스템의 유용성을 분석한 후향적 연구에서도 인공 지능은 영상의학과 전문의와 유사한 정확도를 보였으며(29), 유방 초음파에서 5,151명 환자의 3,154개의 악성과 4,254개의 양성 결절들의 특징적인 유형을 CNN (GoogLeNet)을 이용하여 분석하였을 때 90.0%의 정확도와 86.0%의 민감도, 96.0%의 특이도를 보여 단시간에 악성 병변을 분류하고 임상의의 진단을 보조할 수 있었다는 연구 결과도 있었다.(30) 이러한 연구 결과들을 종합해 보면 유방 초음파에서 인공 지능을 이용한 분류와 진단은 판독 시간을 의미있게 줄이고 경험이 부족한 임상의의 진단적 정확도를 향상시킨다고 할 수 있다.
인공 지능은 의학 분야에서 그동안 많은 발전을 거듭해 왔지만 임상의들의 업무에 완전히 적용되어 사용되기까지는 아직 시간이 더 필요할 것으로 보인다. 유방 초음파에서 인공 지능의 역할도 마찬가지로 대규모 공공 데이터의 부족, ROI 해석에 대한 의존, 고화질의 이미지 요구, 지역적 차이, 과적합 및 이분법적인 분류(binary classification), 진단 오류 시 책임 소재 등의 제한점이 있다. 또한 유방 초음파 이미지의 해석에서 대부분의 인공 지능은 한 가지 작업 수행을 목표로 하고 있어 아직까지는 여러 작업을 동시에 시행할 수 없다는 어려움이 있다.(32) 유방 초음파에서 인공 지능이 적절하게 적용되기 위해서는 어떤 대상군에서 무슨 목적으로 사용할 것인지에 관한 확실한 정립이 필요하다.
다양한 유방 영상 기법에 인공 지능을 적용하여 좀 더 정확하고 신속한 진단과 나아가 치료 방향을 결정하려는 연구가 활발히 지속되고 있다.(33,34) 유방 초음파도 기존의 전통적인 B-mode 이미지 뿐 아니라 탄성초음파, 자동 유방 초음파(automated breast ultrasound), 조영 증강 초음파(contrast-enhanced ultrasound)와 같은 발전된 기술에 적용하려는 노력이 시도되고 있다.(35) 유방 초음파에서 인공 지능의 적용은 미래에 더욱 큰 영향을 미칠 것으로 예상되기에 임상의들은 인공 지능의 기초 지식을 가지고 현재의 상황을 잘 인지하며 앞으로 어떻게 발전할 것인가에 대해 관심을 가지고 발생할 수 있는 문제점들을 해결하기 위해 준비해야 한다.
인공 지능 기술이 더 발전하면 임상의는 높은 효율성으로 좀 더 정확한 분류 및 적절한 치료 방법의 결정을 통해 유방암을 조기에 발견하고 치료할 수 있을 것이다. 향후 좀 더 많은 연구가 이루어지고 긍정적인 결과를 보인다면 유방 초음파에서 인공 지능은 겨드랑이 림프절을 포함한 유방 병변의 정확한 발견과 분류뿐만 아니라 환자의 임상 정보를 포함한 다양한 데이터의 조합을 통해 예후까지도 예측할 수 있는 시대가 올 것으로 기대한다.
REFERENCES
1. Siegel RL, Miller KD, Jemal A. 2018; Cancer statistics, 2018. CA Cancer J Clin. 68:7–30. DOI: 10.3322/caac.21442. PMID: 29313949.

2. Kornecki A. 2011; Current status of breast ultrasound. Can Assoc Radiol J. 62:31–40. DOI: 10.1016/j.carj.2010.07.006. PMID: 20870376.

3. Hooley RJ, Scoutt LM, Philpotts LE. 2013; Breast ultrasonography: state of the art. Radiology. 268:642–59. DOI: 10.1148/radiol.13121606. PMID: 23970509.

4. Le EPV, Wang Y, Huang Y, Hickman S, Gilbert FJ. 2019; Artificial intelligence in breast imaging. Clin Radiol. 74:357–66. DOI: 10.1016/j.crad.2019.02.006. PMID: 30898381.

5. Hosny A, Parmar C, Quackenbush J, Schwartz LH, Aerts HJWL. 2018; Artificial intelligence in radiology. Nat Rev Cancer. 18:500–10. DOI: 10.1038/s41568-018-0016-5. PMID: 29777175. PMCID: PMC6268174.

6. Fujioka T, Mori M, Kubota K, Oyama J, Yamaga E, Yashima Y, et al. 2020; The utility of deep learning in breast ultrasonic imaging: a review. Diagnostics (Basel). 10:1055. DOI: 10.3390/diagnostics10121055. PMID: 33291266. PMCID: PMC7762151.

7. Madani M, Behzadi MM, Nabavi S. 2022; The role of deep learning in advancing breast cancer detection using different imaging modalities: a systematic review. Cancers (Basel). 14:5334. DOI: 10.3390/cancers14215334. PMID: 36358753. PMCID: PMC9655692.

8. Obermeyer Z, Emanuel EJ. 2016; Predicting the future - big data, machine learning, and clinical medicine. N Engl J Med. 375:1216–9. DOI: 10.1056/NEJMp1606181. PMID: 27682033. PMCID: PMC5070532.

9. Al-Antari MA, Al-Masni MA, Choi MT, Han SM, Kim TS. 2018; A fully integrated computer-aided diagnosis system for digital X-ray mammograms via deep learning detection, segmentation, and classification. Int J Med Inform. 117:44–54. DOI: 10.1016/j.ijmedinf.2018.06.003. PMID: 30032964.

10. Rodriguez-Ruiz A, Lång K, Gubern-Merida A, Teuwen J, Broeders M, Gennaro G, et al. 2019; Can we reduce the workload of mammographic screening by automatic identification of normal exams with artificial intelligence? A feasibility study. Eur Radiol. 29:4825–32. DOI: 10.1007/s00330-019-06186-9. PMID: 30993432. PMCID: PMC6682851.

11. Tagliafico AS, Piana M, Schenone D, Lai R, Massone AM, Houssami N. 2020; Overview of radiomics in breast cancer diagnosis and prognostication. Breast. 49:74–80. DOI: 10.1016/j.breast.2019.10.018. PMID: 31739125. PMCID: PMC7375670.

12. Pesapane F, Codari M, Sardanelli F. 2018; Artificial intelligence in medical imaging: threat or opportunity? Radiologists again at the forefront of innovation in medicine. Eur Radiol Exp. 2:35. DOI: 10.1186/s41747-018-0061-6. PMID: 30353365. PMCID: PMC6199205.

13. LeCun Y, Bengio Y, Hinton G. 2015; Deep learning. Nature. 521:436–44. DOI: 10.1038/nature14539. PMID: 26017442. PMCID: PMC10191635.

14. Yasaka K, Akai H, Kunimatsu A, Kiryu S, Abe O. 2018; Deep learning with convolutional neural network in radiology. Jpn J Radiol. 36:257–72. DOI: 10.1007/s11604-018-0726-3. PMID: 29498017.

15. Angermueller C, Pärnamaa T, Parts L, Stegle O. 2016; Deep learning for computational biology. Mol Syst Biol. 12:878. DOI: 10.15252/msb.20156651. PMID: 27474269. PMCID: PMC4965871.

16. Chartrand G, Cheng PM, Vorontsov E, Drozdzal M, Turcotte S, Pal CJ, et al. 2017; Deep learning: a primer for radiologists. Radiographics. 37:2113–31. DOI: 10.1148/rg.2017170077. PMID: 29131760.
17. Akkus Z, Cai J, Boonrod A, Zeinoddini A, Weston AD, Philbrick KA, et al. 2019; A Survey of deep-learning applications in ultrasound: artificial intelligence-powered ultrasound for improving clinical workflow. J Am Coll Radiol. 16(9 Pt B):1318–28. DOI: 10.1016/j.jacr.2019.06.004. PMID: 31492410.
18. Long J, Shelhamer E, Darrell T. 2015. Jun. 7-12. Fully convolutional networks for semantic segmentation. Paper presented at: 2015 IEEE Conference on Computer Vision and Pattern Recognition (CVPR). Boston, USA: 3431–40. DOI: 10.1109/CVPR.2015.7298965.
19. Badrinarayanan V, Kendall A, Cipolla R. 2017; SegNet: a deep convolutional encoder-decoder architecture for image segmen-tation. IEEE Trans Pattern Anal Mach Intell. 39:2481–95. DOI: 10.1109/TPAMI.2016.2644615. PMID: 28060704.
20. Ronneberger O, Fischer P, Brox T. 2015. Oct. 5-9. U-Net: convolutional networks for biomedical image segmentation. Paper presented at: Medical Image Computing and Computer-Assisted Intervention - MICCAI 2015: 18th International Conference. Munich, Germany: 234–41. DOI: 10.1007/978-3-319-24574-4_28.
21. Kumar V, Webb JM, Gregory A, Denis M, Meixner DD, Bayat M, et al. 2018; Automated and real-time segmentation of suspicious breast masses using convolutional neural network. PLoS One. 13:e0195816. DOI: 10.1371/journal.pone.0195816. PMID: 29768415. PMCID: PMC5955504.

22. Hu Y, Guo Y, Wang Y, Yu J, Li J, Zhou S, et al. 2019; Automatic tumor segmentation in breast ultrasound images using a dilated fully convolutional network combined with an active contour model. Med Phys. 46:215–28. DOI: 10.1002/mp.13268. PMID: 30374980.

23. Eghtedari M, Chong A, Rakow-Penner R, Ojeda-Fournier H. 2021; Current status and future of BI-RADS in multimodality imaging, from the AJR special series on radiology reporting and data systems. AJR Am J Roentgenol. 216:860–73. DOI: 10.2214/AJR.20.24894. PMID: 33295802.
24. Hsu SM, Kuo WH, Kuo FC, Liao YY. 2019; Breast tumor classification using different features of quantitative ultrasound parametric images. Int J Comput Assist Radiol Surg. 14:623–33. DOI: 10.1007/s11548-018-01908-8. PMID: 30617720.

25. Zhang Q, Xiao Y, Dai W, Suo J, Wang C, Shi J, et al. 2016; Deep learning based classification of breast tumors with shear-wave elastography. Ultrasonics. 72:150–7. DOI: 10.1016/j.ultras.2016.08.004. PMID: 27529139.

26. Park HJ, Kim SM, La Yun B, Jang M, Kim B, Jang JY, et al. 2019; A computer-aided diagnosis system using artificial intelligence for the diagnosis and characterization of breast masses on ultrasound: added value for the inexperienced breast radio-logist. Medicine (Baltimore). 98:e14146. DOI: 10.1097/MD.0000000000014146. PMID: 30653149. PMCID: PMC6370030.
27. Choi JH, Kang BJ, Baek JE, Lee HS, Kim SH. 2018; Application of computer-aided diagnosis in breast ultrasound interpretation: improvements in diagnostic performance according to reader experience. Ultrasonography. 37:217–25. DOI: 10.14366/usg.17046. PMID: 28992680. PMCID: PMC6044219.

28. Ciritsis A, Rossi C, Eberhard M, Marcon M, Becker AS, Boss A. 2019; Automatic classification of ultrasound breast lesions using a deep convolutional neural network mimicking human decision-making. Eur Radiol. 29:5458–68. DOI: 10.1007/s00330-019-06118-7. PMID: 30927100.

29. Becker AS, Mueller M, Stoffel E, Marcon M, Ghafoor S, Boss A. 2018; Classification of breast cancer in ultrasound imaging using a generic deep learning analysis software: a pilot study. Br J Radiol. 91:20170576. DOI: 10.1259/bjr.20170576. PMID: 29215311. PMCID: PMC5965470.
30. Han S, Kang HK, Jeong JY, Park MH, Kim W, Bang WC, et al. 2017; A deep learning framework for supporting the classification of breast lesions in ultrasound images. Phys Med Biol. 62:7714–28. DOI: 10.1088/1361-6560/aa82ec. PMID: 28753132.

31. Brunetti N, Calabrese M, Martinoli C, Tagliafico AS. 2022; Artificial intelligence in breast ultrasound: from diagnosis to prognosis-a rapid review. Diagnostics (Basel). 13:58. DOI: 10.3390/diagnostics13010058. PMID: 36611350. PMCID: PMC9818181.

32. Lei YM, Yin M, Yu MH, Yu J, Zeng SE, Lv WZ, et al. 2021; Artificial intelligence in medical imaging of the breast. Front Oncol. 11:600557. DOI: 10.3389/fonc.2021.600557. PMID: 34367938. PMCID: PMC8339920.

33. Sechopoulos I, Teuwen J, Mann R. 2021; Artificial intelligence for breast cancer detection in mammography and digital breast tomosynthesis: state of the art. Semin Cancer Biol. 72:214–25. DOI: 10.1016/j.semcancer.2020.06.002. PMID: 32531273.

34. Adachi M, Fujioka T, Mori M, Kubota K, Kikuchi Y, Xiaotong W, et al. 2020; Detection and diagnosis of breast cancer using artificial intelligence based assessment of maximum intensity projection dynamic contrast-enhanced magnetic resonance images. Diagnostics (Basel). 10:330. DOI: 10.3390/diagnostics10050330. PMID: 32443922. PMCID: PMC7277981.

35. Wu GG, Zhou LQ, Xu JW, Wang JY, Wei Q, Deng YB, et al. 2019; Artificial intelligence in breast ultrasound. World J Radiol. 11:19–26. DOI: 10.4329/wjr.v11.i2.19. PMID: 30858931. PMCID: PMC6403465.

Table 1
Key Studies on the Role of Artificial Intelligence in Breast Ultrasound




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download