Abstract
Epstein-Barr virus (EBV) is an extremely prevalent virus which infects over 90% of the global population at some point in their lifetime. Chronic active EBV infection (CAEBV) is a disease with a high mortality rate with life-threatening complications. Although the main symptom of CAEBV is inflammation, most patients present with fever, hepatic dysfunction with or without hepatomegaly, splenomegaly, lymphadenopathy, thrombocytopenia, anemia, hypersensitivity to mosquito bites, rash, oral ulcers, hemophagocytic syndrome, coronary artery aneurysms, and interstitial pneumonia. Although some cases of CAEBV with other organ symptoms have been reported, CAEBV of external auditory canal and parotid gland is extremely rare. We report a case of CAEBV infection mimicking cellulitis or malignancy diagnosed after a number of biopsies in a patient who presented with a mass accompanied by inflammation in the external auditory canal.
Epstein-Barr virus (EBV)는 전 세계 인구의 90%에 해당하는 사람이 살면서 한 번쯤은 감염이 된다고 알려져 있는 드물지 않은 질환이다[1]. 그중 chronic active EBV infection (CAEBV)은 생명을 위협하는 합병증을 포함하며 높은 발병률과 사망률을 보인다[1,2]. CAEBV의 주된 증상은 염증이며[3], 주로 발열, 간부전, 비장 비대, 림프절염, 림프종, 혈소판감소증, 간비대, 빈혈, 피부발진, 구강 궤양, 관상동맥질환 등을 동반한다[4-6]. 국내 문헌에는 CAEBV가 다양한 기관을 침범한 사례는 간혹 보고된 바가 있으나 외이도 및 이하선을 침범한 증례는 아직 보고되지 않았으며, 국외 문헌의 경우도 매우 드물어 찾기 힘든 실정이다. 저자들은 외이도의 연조직염 및 외이도와 이하선을 침범한 악성종양으로 오인된 병변에 대하여 여러 차례의 조직검사를 한 결과 CAEBV로 보고된 드문 증례를 경험하였기에 보고하고자 한다.
77세 남자 환자가 내원 2달 전부터 발생한 좌측 귀의 수양성 이루와 부종을 주소로 내원하였다. 과거력상 환자는 고혈압, 고지혈증, 관상동맥 질환, 비기능성 뇌하수체종양으로 타병원 추적 관찰 중이었으며, 갑상선기능저하증 진단하 synthyroxine 100 mcg 및 부신기능저하증으로 hydrocortisone 5 mg을 4년간 복용 중이었다. 신체진찰상 좌측 이주 부위와 외이도 연골부 발적과 부종이 관찰되었으며, 장액성 이루가 동반되었다(Fig. 1A). 양측 고막은 정상 소견이었다. 순음청력검사에서는 좌측의 기도 청력 56 dB, 기도-골도차 35 dB의 혼합성 난청 소견이 관찰되었다(Fig. 1B).
외이도 연조직염 진단하 경험적 경구 항생제 투약 및 병변 부위 드레싱을 1주 이상 시행하였으나, 외이도 부종 악화로 인한 외이도 연골부 협착 소견 및 장액 혈성 이루가 관찰되었다. 이에 치료 시작 후(post start of treatment day) 24일에 입원하여 이주 및 외이도의 염증성 조직에 대하여 정맥 항생제 치료 및 악성종양 의심하 조직 생검을 시행하였다(Fig. 2A and B). 경부 컴퓨터단층촬영상 좌측 외이도와 이개 주변 3.4×2.3×2.9 cm 크기의 병변과 이하선 하부로 타원형의 림프절 비대가 관찰되었다(Fig. 3). 조직 생검상 급성 및 만성 염증소견이 보고되었으며, 균 배양 검사 결과 메티실린 내성 황색포도상구균이 동정되어 vancomycin을 사용하며 보존적 치료를 시행하였다. 치료 초기에는 호전 양상을 보였으나 이후 다시 악화되는 양상이었다(Fig. 2C and D). 백혈구수치, 적혈구침강속도, C-반응성 단백질, 항핵항제, 류마티스 인자, IgG 등의 혈청검사상 정상 범위였으며, 단순 포진 바이러스 및 대상포진 바이러스에 대한 viral marker 검사에서 현성감염증 등의 특이소견은 보이지 않았다.
환자 본인의 의사로 타 병원으로 전원 하였고, 본원 최초 내원 두 달 후 타 병원에서 시행한 측두골 자기공명영상에서 좌측 외이도와 이개부 연조직의 부종, 이하선 및 주변 림프절 비대소견으로 염증성 병변과 함께 종양성 상태 의심 소견이 보고되었다(Fig. 4). 재내원 시 병변의 범위는 후이개까지 확장된 악화소견이 관찰되었다(Fig. 2E and F). 환자는 본원에서의 치료 지속을 원하여 양전자컴퓨터단층촬영을 시행하였으며, 좌측 외이도, 이개부 및 이하선을 포함한 불규칙한 과대사성 병변이 관찰되어 악성종양이 여전히 의심되었다(Fig. 5).
최종 보고된 병리학적 소견상 세포질의 양은 다소 증가된 림프구 증식 소견이 뚜렷하여 최종적으로 CAEBV가 보고되었다(Fig. 6C and D). 이후 면역조직화학염색에서 CD3, EBV in situ-hybridization 양성, CD56 음성 소견으로 T세포형 CAEBV에 합당한 소견이었다(Fig. 6E and F). 이후 말초혈액에서 시행한 EBV PCR 결과 2891.8 IU/mL로 증가된 소견으로, 최초 내원일로부터 총 6개월 이상의 이환 기간을 가지며, 말초혈액과 조직 생검상 EBV를 확인한 사례로 T세포형 CAEBV로 최종 진단되었다.
환자는 진단 이후 혈액종양내과로 의뢰되었으며, 감염내과, 병리과, 영상의학과, 혈액종양내과 및 이비인후과의 다학제 진료 후 bortezomib과 valacyclovir를 통한 항암치료를 시행하며 추적 관찰하였으며, 2개월간 치료를 유지하며 귀의 병변은 호전 양상을 보였다(Fig. 7). 이후 fever가 발생하여 시행한 골수검사 결과 혈구탐식성 림프조직구증식증(Hemophagocytic lymphohistiocytosis, HLH) 진단하 etoposide, dexamethasone, cyclosporine A를 병용하여 치료를 개시하는 항암면역 치료 프로토콜인 HLH 2004와 함께 rituximab 병용 치료 및 골수이식 후 경과 관찰 중이다.
CAEBV는 면역저하질환이 없는 환자에서 말초 혈액의 EBV DNA의 상승을 보이며, 조직에서 EBV 양성 T cell의 침윤 소견이 확인되고, 6개월 이상의 이환 기간을 특징으로 하는 만성질환으로 정의된다[4,7,8]. 최근 연구에서는 더 급격한 진행을 보이는 사례가 있어 3개월을 이환기간으로 정의하기도 한다[2,7]. 본 증례는 면역저하질환은 없으나 hydrocortisone 5 mg을 수년간 복용한 기왕력이 있는 자로, 문헌에 따르면 매일 5 mg 이하 혹은 총 누적용량 700 mg 이하의 corticosteroid 복용은 감염위험을 증가시키지 않는 것으로 알려져 있으나[9], 스테로이드 복용력은 약물 용량에 비례한 세포매개 면역반응을 억제하여 EBV 감염에 더 취약하게 한다. 이러한 면역저하상태임을 고려할 때, 병리학적으로 post-transplant lymphoproliferative disease (PTLD)를 고려해 볼 수 있다(Table 1). 증례의 환자는 형태학적으로 그중 polymorphic PTLD로 분류 가능하며, 임상적으로는 위 진단기준을 만족하여 CAEBV에 합당하다고 할 수 있다.
CAEBV의 치료는 동종 조혈모세포이식이 유일한 치료적인 방법이며[10], 이외 항바이러스제, 스테로이드 등 면역억제제는 효과적이지 않다고 알려져 있다[4,11]. 항암치료 또한 효과적이지 않으며, 동종 조혈모세포이식만이 몇몇 성공적 치료 사례로 보고된 바가 있다[4,5,11].
CAEBV의 감별질환으로 외이도 및 중이의 악성종양의 경우 특이적 종양표지자가 없으며, 조직학적 소견을 통해서만 진단이 이루어진다. 본 증례에서는 국소마취하 이개 주변 표면 조직검사 2회, 전신마취하 이하선 및 임파선 조직검사 1회, 전신마취하 후이개 절개를 통한 심부 조직검사 1회를 시행하였다. 이 중 마지막으로 시행한 조직검사에서 비정형성을 동반한 림프구의 증식소견이 보고되어 진단이 되었는데, 이는 표면 조직검사는 정확성이 떨어질 수 있고, 이하선 및 주변 림프조직은 심부조직이지만, 주 병변이 아닐 수 있으며, 후이개 절개를 통한 조직의 경우 주 병변의 심부 조직이기에 진단이 된 경우로 사료된다. CAEBV의 주된 병리기전은 염증으로[3], 연조직염과 조직학적으로 감별이 쉽지 않고[12,13], 본 증례의 경우, 혈청 검사 및 viral marker 검사에서도 정상소견으로 보고되었으나, 후향적으로 분석할 때 EBV titer를 조기에 시행하는 것이 조기진단에 도움이 될 것으로 판단된다.
CAEBV의 외이도 및 이하선 침범 사례는 국내에서 아직 보고된 바 없고, 해외에서도 찾아보기 힘든 실정이다. CAEBV로 인한 외이도 병변의 경우 부종, 발적 등 비특이적 염증 소견을 보이며 신체검진, 영상의학적 검사에서도 특징적 소견을 보이지 않아 다른 질환과의 감별이 어렵다[11]. CAEBV 환자가 적절한 치료를 받지 못하는 경우 항생제 등 적극적 치료에 단기적인 호전은 가능하나 장기적으로는 병의 악화를 초래한다[4,11]. 따라서 염증 치료만으로 호전되지 않으며 악성 종양 등 타 질환이 의심되는 경우 반복적이고 정교한 조직검사를 통해 진단을 위한 지속적인 노력이 이루어져야 하며, 조직검사에서 비정형성을 동반한 림프구의 증식을 확인하는 것이 CAEBV 진단에 중요하다. CAEBV는 HLH, 혈액응고 장애, 다발성 장기부전, 림프구 증식성 질환, 림프종 등 치명적인 합병증을 유발할 수 있어, 진단 후 신중한 평가 및 적극적인 치료가 필요하며 향후 효과적인 진단 및 치료방법을 위한 연구가 추가적으로 수행되어야 할 것이다[1,3,5].
ACKNOWLEDGMENTS
This research was supported by a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (grant number: HI22C0851).
Notes
Author Contribution
Conceptualization: Tae Hoon Kong. Data curation: Dong Hwan Kwon. Funding acquisition: Tae Hoon Kong. Investigation: Minheon Kim. Project administration: Tae Hoon Kong. Supervision: Tae Hoon Kong. Visualization: Minheon Kim. Writing—original draft: Joo Hyung Lee. Writing—review & editing: Joo Hyung Lee, Tae Hoon Kong.
REFERENCES
1. Wauchope J, Dorris CB, Smith CP, Hanna B. Chronic active Epstein-Barr virus: A multidisciplinary approach. BMJ Case Rep. 2020; 13(12):e236287.

2. Kimura H, Hoshino Y, Kanegane H, Tsuge I, Okamura T, Kawa K, et al. Clinical and virologic characteristics of chronic active EpsteinBarr virus infection. Blood. 2001; 98(2):280–6.

3. Arai A. Advances in the study of chronic active Epstein-Barr virus infection: Clinical features under the 2016 WHO classification and mechanisms of development. Front Pediatr. 2019; 7:14.

4. Bollard CM, Cohen JI. How I treat T-cell chronic active EpsteinBarr virus disease. Blood. 2018; 131(26):2899–905.

5. Cohen JI, Jaffe ES, Dale JK, Pittaluga S, Heslop HE, Rooney CM, et al. Characterization and treatment of chronic active Epstein-Barr virus disease: A 28-year experience in the United States. Blood. 2011; 117(22):5835–49.

6. Fujiwara S, Nakamura H. Chronic active Epstein-Barr virus infection: Is it immunodeficiency, malignancy, or both? Cancers (Basel). 2020; 12(11):3202.

7. Hue SS, Oon ML, Wang S, Tan SY, Ng SB. Epstein-Barr virusassociated T- and NK-cell lymphoproliferative diseases: An update and diagnostic approach. Pathology. 2020; 52(1):111–27.

9. Oray M, Abu Samra K, Ebrahimiadib N, Meese H, Foster CS. Long-term side effects of glucocorticoids. Expert Opin Drug Saf. 2016; 15(4):457–65.

10. Cohen JI, Iwatsuki K, Ko YH, Kimura H, Manoli I, Ohshima K, et al. Epstein-Barr virus NK and T cell lymphoproliferative disease: Report of a 2018 international meeting. Leuk Lymphoma. 2020; 61(4):808–19.

11. Wass M, Bauer M, Pfannes R, Lorenz K, Odparlik A, Müller LP, et al. Chronic active Epstein-Barr virus infection of T-cell type, systemic form in an African migrant: Case report and review of the literature on diagnostics standards and therapeutic options. BMC Cancer. 2018; 18(1):941.

Fig. 1.
Initial ear findings and audiometry of the patient on first visit. A: Initial skin and soft tissue inflammation (post start of treatment day 21). B: Pure tone audiometry shows the air-bone gap (35 dB) of the left ear (red: right ear, blue: left ear).
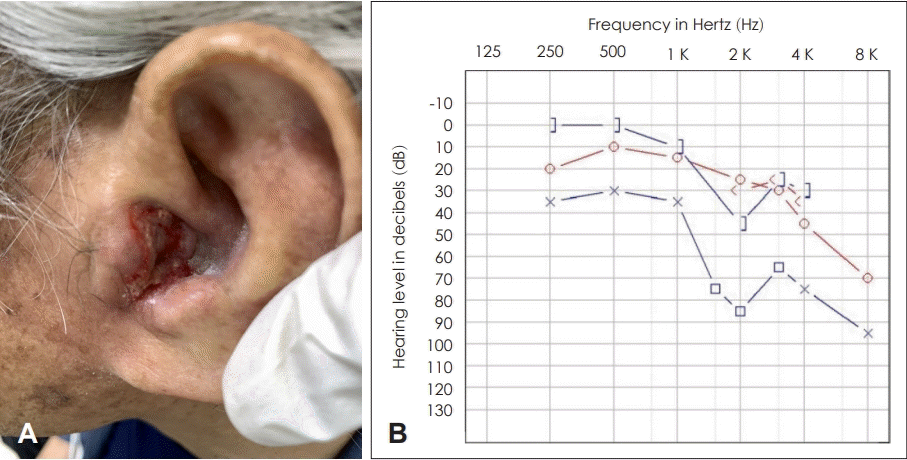
Fig. 2.
Skin and soft tissue inflammation. Redness and swelling aggravated during antibiotic therapy and daily wound care. A: Post start of treatment day (PTD) 40. B: PTD 46. C: PTD 64. D: PTD 69. E: PTD 93. F: PTD 99.
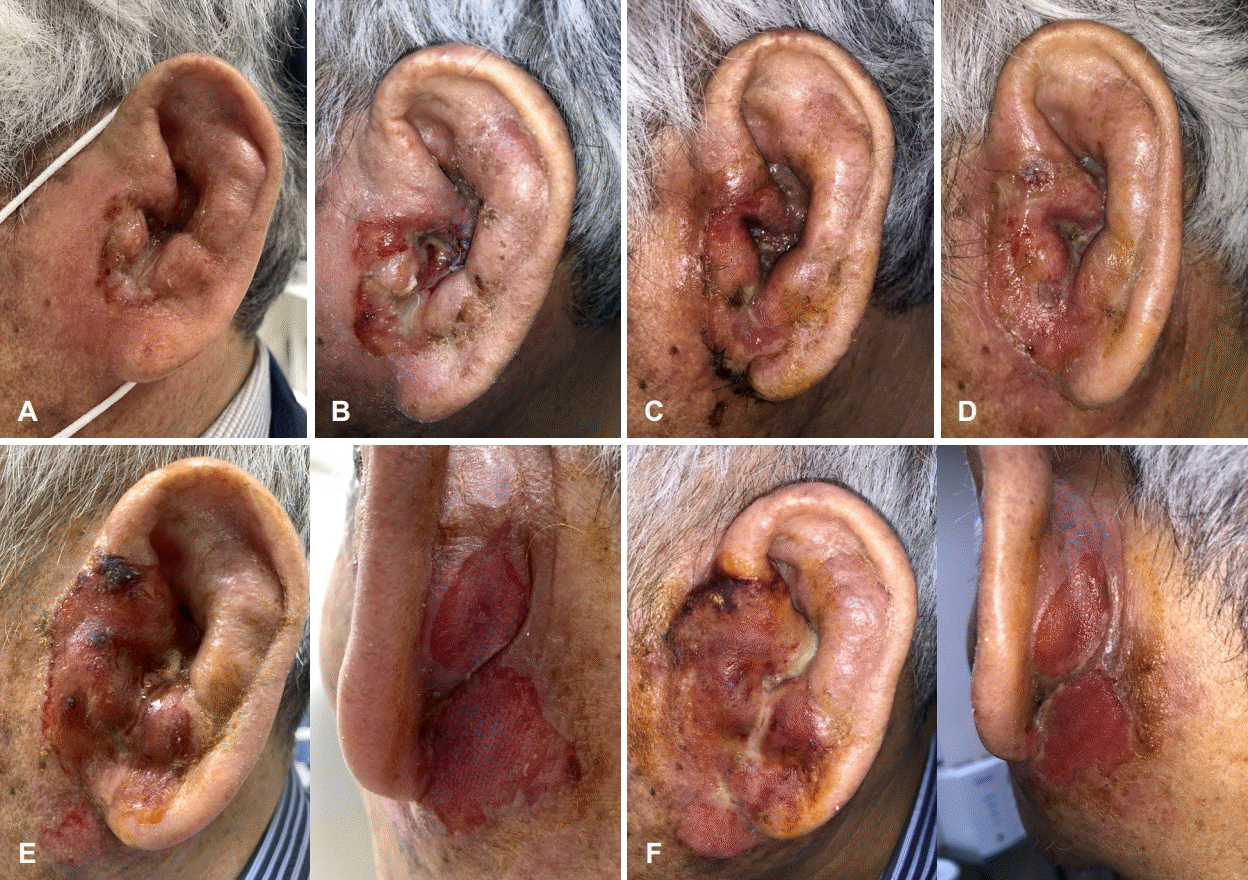
Fig. 3.
CT of neck. 3.4×2.3×2.9 cm sized enhancing mass-like lesion at left external auditory canal and left ear auricle with enlarged lymph nodes at periparotid region. A: Coronal view. B: Axial view. C: Axial view of enlarged lymph node.
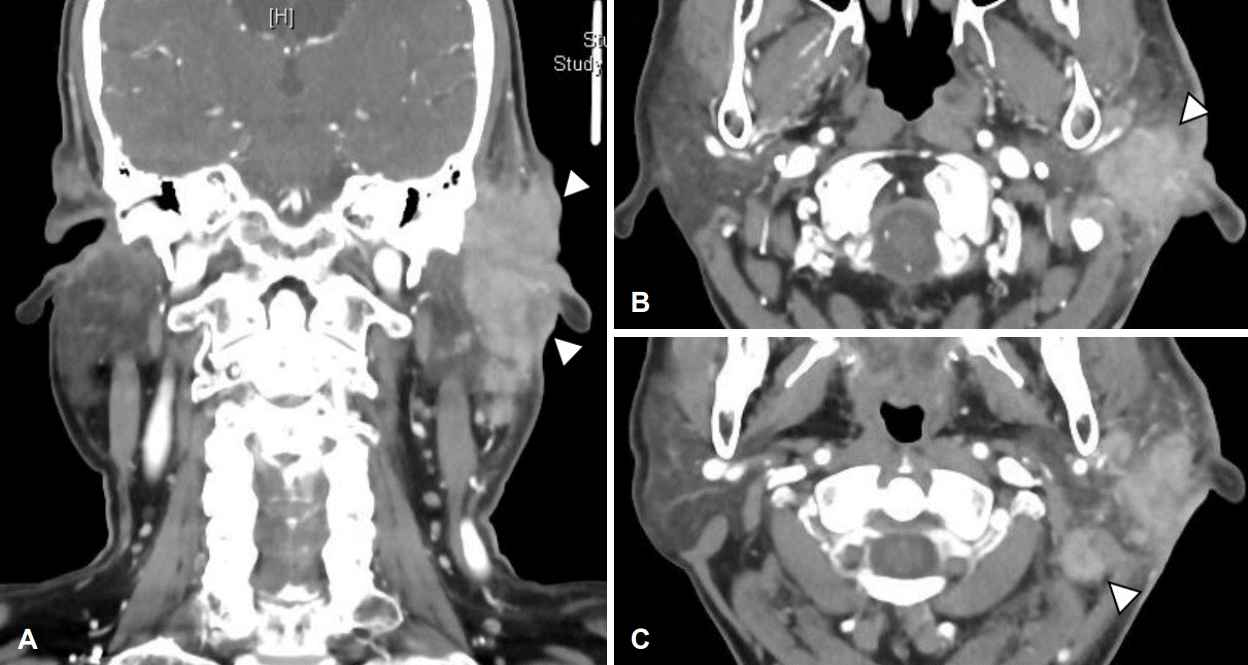
Fig. 4.
MRI of temporal bone. Subepithelial soft tissue thickening in the external auditory canal (cartilaginous portion) and auricle aggravated during antibiotic therapy and daily wound care. A: Post start of treatment day (PTD) 16, T2 weighted image (T2WI) axial. B: PTD 16, T1 weighted image (T1WI) coronal. C: PTD 96, T2WI axial. D: PTD 96, T1WI coronal.
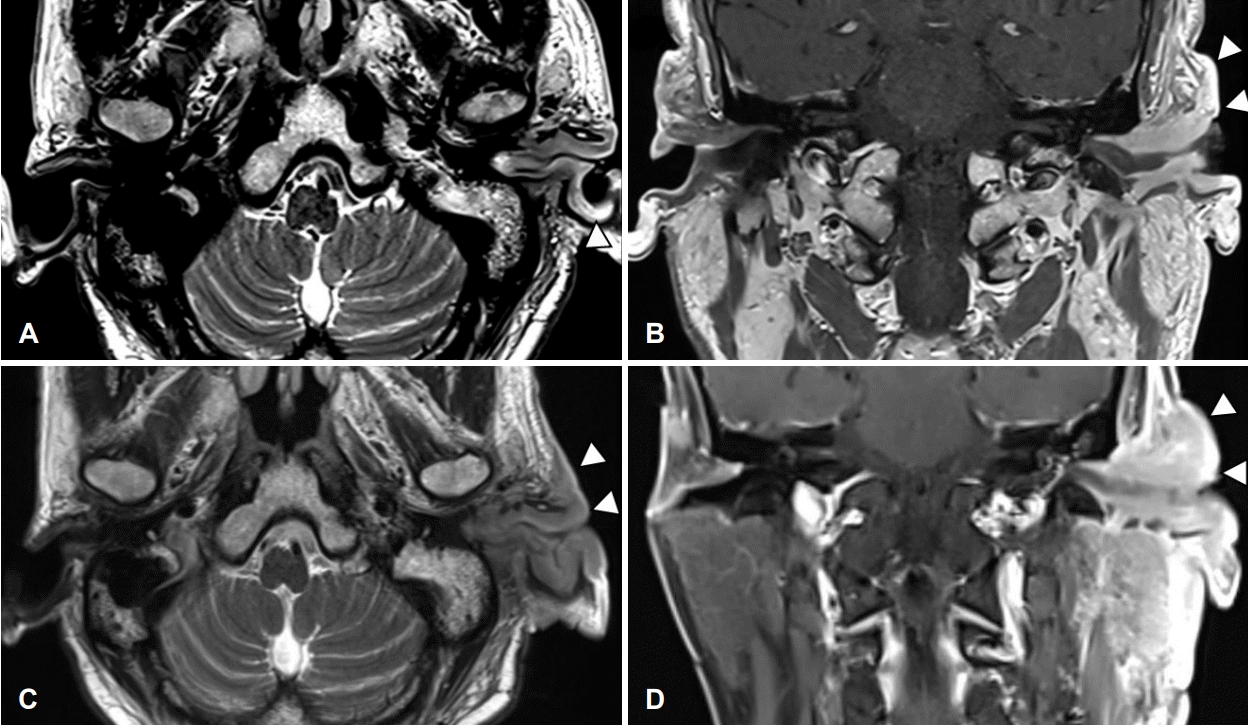
Fig. 5.
PET-CT scan (torso). Left external auditory canal and left ear auricle, periauricular area, left parotid gland involving irregular hypermetabolic lesion was seen.
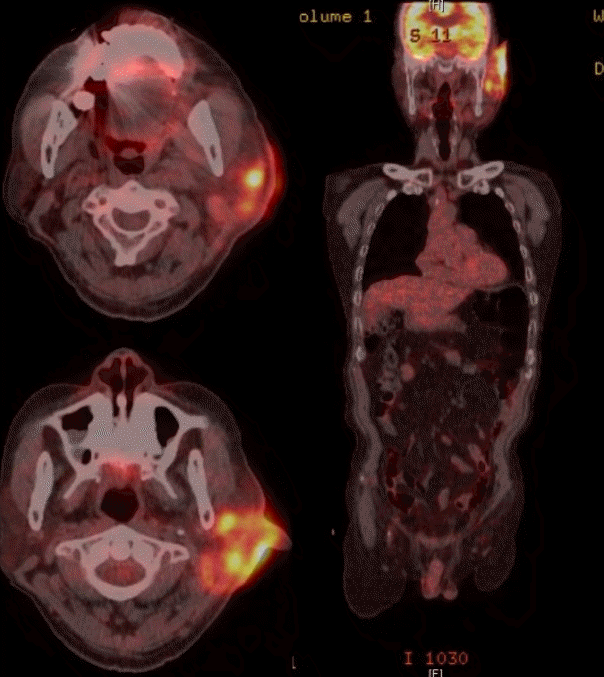
Fig. 6.
Histological findings. Polymorphous lymphoid cells infiltrate lacing cytologic atypia on PTD 112 compared to previous study. A: Post start of treatment day (PTD) 16, ear, Lt (hematoxylin and eosin [H&E], ×200). B: PTD 24, ear, Lt (H&E, ×200). C: PTD 58, parotid gland, Lt (H&E, ×200). D: PTD 112, ear, Lt (H&E, ×200). E: PTD 112, ear, Lt (CD3, ×100). F: PTD 112, ear, Lt (Epstein-Barr virus in situ hybridization, ×100 view).
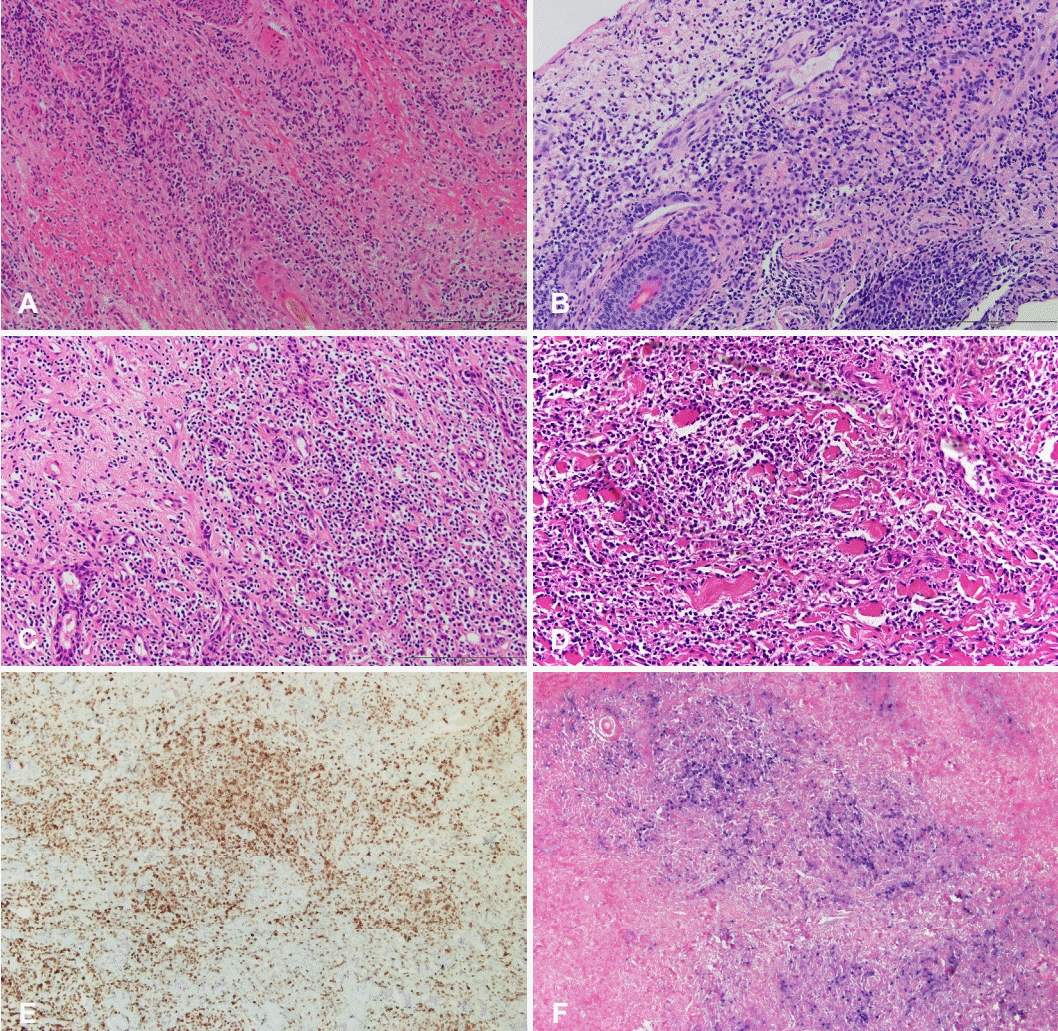
Fig. 7.
Skin and soft issue inflammation has shown much improvement and epithelization of the wound was achieved after six months of treatment (post start of treatment day 174).
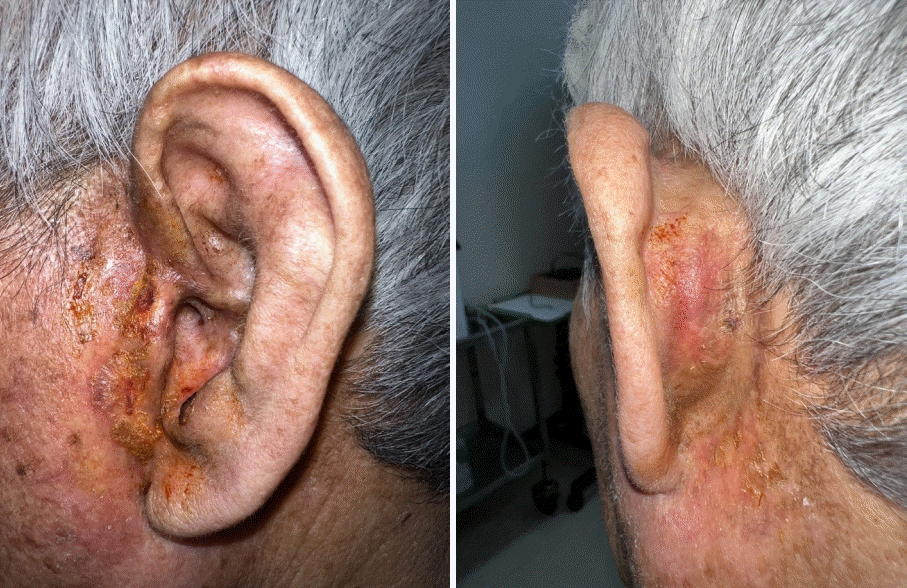
Table 1.
Differential diagnosis of chronic active Epstein-Barr virus of T-cell type




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download