초록
배경
코로나19 팬데믹 이후 체외진단의료기기의 성장은 괄목할 만하다. 체외진단의료기기의 개발과 임상적 성능시험, 국내 및 해외 인허가 등 다양한 과정에서의 애로사항과 앞으로 개선 및 지원을 주력해야 하는 부분이 무엇인지 우리나라 체외진단의료기기 기업을 대상으로 설문조사를 시행하였다.
방법
한국체외진단의료기기협회에 등록된 기업을 대상으로 구글 설문지를 이용하여 2021년 11월부터 12월까지 설문조사를 실시하였다. 질문은 체외진단의료기기의 개발 대상 감염병의 종류와 임상적 성능평가의 목적, 임상시험에 대한 애로사항과 지원이 필요한 부분이 무엇인지에 대한 질문을 포함하여 리커트 척도 혹은 백분율로 알아보았다. 44개 기업 중 23개(52.3%)가 회신을 하였다.
Abstract
Background
The in vitro diagnostic (IVD) medical device industry has experienced remarkable growth during the COVID-19 pandemic. We here survey the existing difficulties in addressing various processes, including IVD development, clinical trials, domestic and overseas licensing, and areas in which improvement efforts and support should be focused.
Methods
A survey of companies registered in the Korea in vitro Diagnostic Association between November and December 2021was conducted using a Google questionnaire. In addition to basic questions about IVD development for infectious diseases and clinical trials, participants were asked for feedback regarding targeted infectious agents and hurdles faced in clinical trials. Twenty-three (52.3%) of 44 companies responded to our survey. For scoring, we either used the Likert scale or calculated the percentage of multiple answers.
Results
Matching with a clinical trial agency was the most difficult aspect of clinical trials, and delays in review and approval by the Korean Ministry of Food and Drug Safety (KMFDS) was a major challenge facing domestic licensing. Currently, the most actively targeted IVD development arena is COVID-19 (42.7%) followed by influenza (23.5%). The major purpose of clinical trials is to obtain KMFDS approval (91.3%), followed by European IVDR (in vitro Diagnostic Regulation) approval (60.9%).
의료기기 산업은 코로나19 팬데믹 영향으로 감염병 체외진단의료기기 생산 및 판매의 비약적 증대를 이루었다. 국내 의료기기 생산실적은 코로나19 발생 이전인 2018년 약 6조 5,000억 원, 2019년 약 7조 2,800억 원인 반면, 2020년 약 10조 1,000억 원으로 증가하였다. 의료기기 수출은 2018년 약 4조 원, 2019년 약 4조 3,000억 원에서 2020년 약 7조 8,000억 원으로 가파른 성장세를 보였다[1]. 이는 코로나19 팬데믹 이후 대한민국 의료기기 생산과 수출이 얼마나 증가하였는지 보여주는 자료이다. 최근 의료기기 생산과 수출에 가장 큰 몫을 차지한 것은 체외진단의료기기이다. 체외에서 감염체의 유무를 판별할 수 있는 체외진단의료기기의 생산은 코로나19가 전 세계적으로 유행하면서 더욱 성장하는 계기가 되었다. 코로나19의 급속한 확산으로 미국 식품의약처(Food and Drug Administration, FDA)는 코로나19에 대한 다양한 체외진단의료기기에 긴급사용승인(emergency use authorization, EUA)을 발급하였다[2]. 국내 또한 코로나19 진단시약 긴급사용승인과 수출허가로 신속하게 대응하여 우리나라 체외진단의료기기의 해외진출을 지원하였고, 이로 인해 체외진단의료기기의 생산과 수출이 대폭 증가하였다. 체외진단의료기기의 2020년 생산실적은 2019년 대비 약 5.5배 증가한 약 3조 4,000억 원으로 전체 의료기기 중 33.1%를 차지하였고, 2020년 수출 실적은 2019년 대비 약 6배 증가한 약 4조 2,000억 원으로 전체 의료기기 중 53.8%를 차지하는 등 의료기기 시장의 성장을 견인했다[1, 3].
본 연구에서는 우리나라의 감염병 체외진단의료기기 산업이 급성장하는 가운데 현재 개발에 주력하는 종목과 기업들이 갖는 애로사항이 무엇인지 알아보고자 했다. 체외진단의료기기 기업을 대상으로 한 설문으로 체외진단의료기기 기업들이 가진 문제점을 분석하여 어떤 부분에 정부와 의료기관 연구자의 지원이 필요하고, 자원을 집중해야 하는지 살펴보았다. 본 연구를 통해 우리나라 감염병 체외진단의료기기의 지속적인 발전과 해외에 진출하기 위한 지원방향을 설정하는 데 도움이 되고자 하였다.
설문조사 실시기간은 2021년 11월부터 12월까지 실시하였으며, 설문조사는 감염병 체외진단의료기기 회사들을 대상으로 구글 설문지를 이용하여 진행하였다(Supplementary Table 1). 2021년 11월 한국체외진단의료기기협회에 등록된 57개 기업 중 설문조사를 요청한 기업은 44개이며 이 중 조사에 응답한 기업은 23개(52.3%) 기업이었다. 응답한 기업의 규모를 알아보기 위해 직원수와 연매출을 설문하였다. 설문조사에 응답한 체외진단의료기기 기업들이 체외진단의료기기 개발, 임상적 성능시험, 제품의 인허가를 받는 과정에서 어려운 점이 있는지 문의하였다. 설문조사에는 현재 개발 중이거나 개발 예정인 체외진단의료기기에 대한 질의들이 포함되어 있어서 기업들이 주력하는 체외진단의료기기 및 감염병 종류를 분석할 수 있었다. 그리고 한국보건산업진흥원, 식품의약품안전처 등 정부 담당부서의 행정적 지원에 관련된 사항을 포함하여 현재 기업이 필요로 하는 정부 지원이 무엇인지 알아보았다.
체외진단의료기기 제품 개발과 성능시험, 제조 및 수입 허가 신청 시 애로사항에 대한 설문문항의 응답은 리커트 5점 척도를 이용하여 매우 쉬움이 1점, 매우 어려움이 5점으로 점수를 매긴 후 평균을 내어 분석하였다. 현재 개발 중이거나 개발 계획 중인 체외진단의료기기의 감염병 종류 문항은 우선순위를 정해 1순위 3점, 2순위 2점, 3순위 1점을 매긴 점수를 백분율로 계산하였다. 체외진단의료기기의 임상성능평가 목적, 검사방식, 검체의 종류는 복수응답으로 설문하였으며, 현재 체외진단의료기기 기업이 어떤 감염병에 대하여 어떤 방법으로 개발 중인지 확인하였다.
본 연구에 참여한 체외진단의료기기를 개발하는 회사의 45.5%는 직원수 10-50명이었으며, 27.3%의 기업의 연매출이 50-500억 원이었고 5-50억 원, 1,000억 원 이상이 각각 22.7%였다(Table 1).
감염병 체외진단의료기기의 개발, 임상시험, 인허가 분야에서 기업이 가지는 어려운 점을 각각 설문한 문항에서의 응답은 다음과 같다. 감염병 체외진단의료기기 개발 및 승인 시 가장 어려운 점은 해외 임상적 성능시험(4.8)이었고, 국내 인허가(4.3)와 해외 인허가(4.3), 국내 임상적 성능시험(4.3), 전문인력 부족(4.1)이 그 뒤를 이었다(Fig. 1). 국내 임상적 성능시험시 애로사항으로는 임상 성능시험기관과의 매칭이 어렵다는 응답(4.2)이 가장 많았고, 그 다음 기관생명윤리위원회(Institutional Review Board, IRB)의 심사 소요시간(3.9), 임상 성능시험기관의 성능시험 수행역량에 대한 정보 부족(3.7), 기업의 담당자 및 모니터링 요원의 전문성 부족(3.7), 연구개발비 부족(3.7) 등이었다(Fig. 2). 국내 제조, 수입 허가 신청 시 심사 및 허가 지연(4.4)이 가장 어렵고, 심사관에 따른 심사 일관성 부족(4.2), 제조 수입 허가 심사 중 식약처 임상시험 수정 요구(4.1), 연구 전 사전승인(investigational new drug application, IND) 논의 과정(3.9)이 뒤를 이었다(Fig. 3).
현재 기업이 개발하는 감염병 체외진단의료기기의 임상적 성능평가의 목적과 체외진단의료기기의 종류, 목표하는 감염병을 설문한 문항의 응답은 다음과 같다. 감염병 체외진단의료기기의 임상적 성능평가의 목적을 중복응답으로 설문하였을 때 국내 식품의약품안전처 허가(91.3%)가 가장 많았고, 유럽 허가(60.9%), 긴급 수출용 허가(56.5%), 제품의 성능 확인(52.2%), 미국 캐나다 허가(47.8%)가 뒤를 이었다(Table 2). 현재 운영 중이거나, 개발 예정인 감염병 체외진단의료기기를 중복응답으로 설문한 결과 감염병 체외진단검사 방식으로는 현장검사용 항원검사(65.2%)가 가장 많았다. 분자진단검사 이외의 항원, 항체검사는 현장검사용 체외진단의료기기가 중앙검사실용보다 많았다(Table 3). 현재 개발 중이거나 고려 중인 체외진단의료기기의 감염병 종류는 코로나19 (42.7%)가 가장 많았고, 인플루엔자(23.5%), 뎅기열(9.6%), 간염 바이러스(5.1%), 결핵(5.1%)이 그 다음 순이었다(Table 4).
우리나라의 2019년 의료기기 시장규모는 2018년 대비 14.4% (9,860억 원) 증가한 7조 8,039억 원으로 2016년에서 2019년까지 연평균 9.99%의 성장률을 보였다[1]. 이 중 체외진단의료기기 시장은 2019년 약 8,100억 원 규모로 최근 5년간 연평균 7.7%로 성장하고 있고 특히 면역화학분석장치/시약과 기타분석장치/시약 및 유전자분석장치 시장이 빠르게 증가하고 있다[4]. 이러한 체외진단의료기기 시장이 성장하는데 기업과 임상시험기관의 노력이 상당하였다. 의료기기의 생산 및 제조, 임상적 성능시험, 유통 및 판매 등 의료기기의 안전성과 유효성을 엄격하게 규제하는 정부의 인허가를 통과해야 하기 때문이다[5]. 해외에서 사용하고자 할 경우 해당 국가의 의료기기 규제당국의 승인을 받아야 수출을 할 수 있게 된다. 하지만 미국의 FDA와 유럽의 in vitro Diagnostic Regulation (IVDR), 캐나다의 Health Canada, World Health Organization (WHO) Prequalification (PQ)/Emergency use listing (EUL) 등 국제간 인허가 제도가 달라서 각 나라의 최신 의료기기 허가제도를 파악하여야 하기 때문에 해외 시장 진입이 어렵고 오래 걸리기도 한다.
국내 체외진단의료기기 시장은 2019년 말부터 시작된 코로나19의 확산으로 인해 지난 2년여 동안 체외진단의료기기 산업 중 코로나19를 비롯한 감염병 진단키트 개발이 활발하게 이루어졌다. 2020년 정식허가를 받은 코로나19 진단키트는 13건(PCR 9건, 항원 2건, 항체 2건)이지만, 국내 판매가 아닌 수출만을 목적으로 하는 수출용 허가의 경우 2020년도에 총 236건(PCR 107건, 항원 58건, 항체 71건)이 허가되었다[6]. 기업의 설문 응답 중에 감염병 체외진단의료기기 임상적 성능평가의 목적으로는 국내 식품의약품안전처 허가가 가장 많았고, 유럽 IVDR 승인, 그 다음 긴급수출용 허가가 뒤를 이었는데, 이는 코로나바이러스 체외진단의료기기의 긴급승인을 받기 시작한 이후 많은 기업들이 코로나 진단키트를 개발했기 때문이라고 볼 수 있다.
현재 운영 중이거나, 개발 예정인 감염병 체외진단의료기기의 검사 방식 중 현장검사(point-of-care, POC) 방식(56.9%)이 중앙검사실 방식(43.1%)보다 더 많았다. 이는 코로나19 팬데믹 기간 동안 의료 시스템이 심각한 부담을 겪고 있고, 검사결과를 신속하게 알 수 있어 빠른 조치가 가능한 현장검사 키트 개발에 노력했기 때문으로 판단하였다[7]. 분자진단검사를 위한 제품은 실험실 기반 분석과 실험실 장비가 필요하지 않은(near or at the point of care) 장비가 있다[8]. 현장검사 진단을 위한 검사방법으로는 항원검사, 항체검사와 분자진단검사가 있다[9]. 시기 적절한 현장검사 진단 방법은 진단 시간을 단축하고 의료진의 과중한 업무를 줄여주며 의료보호장구를 착용하지 않아도 되는 등 적절한 감염병 관리 정책을 시행할 수 있도록 하기 때문에[9] 코로나19 팬데믹 상황에 반드시 필요한 체외진단의료기기이다. 국제 비영리단체인 The Foundation for Innovative New Diagnostics (FIND)에서 제공한 코로나19 면역분석과 분자진단용 제품 데이터베이스에 따르면 2022년 1월 기준 전 세계의 코로나19 현장검사 제품은 True POC 402개, Near POC 84개이며, 그 중 우리나라 제품은 True POC 37개, Near POC 3개였다[10].
임상적 성능시험은 『체외진단의료기기법』 제2조에 따라 체외진단의료기기의 성능을 증명하기 위해 검체를 분석하여 임상적·생리적·병리적 상태와 관련된 결과를 확인하는 시험을 의미한다[11]. 해당 시험을 수행하는 임상적 성능시험 기관은 의료기관, 혈액원, 의과대학 및 검체수탁·분석기관 등으로 지정하고 있다[5]. 감염병 체외진단용 의료기기의 국내 임상적 성능시험 시 어려운 부분으로 임상적 성능시험기관과의 매칭이 가장 많은 응답을 받은 것을 감안하면 한국보건산업진흥원의 임상시험기관과의 매칭이 큰 역할을 한다는 것을 알 수 있다.
국내에서 발생이 드물거나 전혀 없는 감염병의 경우 체외진단의료기기 개발과 임상적 성능시험을 위해 해외에서 검체를 수급해야 한다. 해외 바이오뱅크에서 구하기 쉬운 검체도 있지만, 발병률이 낮고 지역이 한정되어 있는 경우 검체를 구하기가 어렵다. 예를 들어, 인플루엔자의 경우 2019년 우리나라에서 인플루엔자 바이러스가 총 1,702건이 검출되었으나[12], 코로나19의 확산으로 전 세계적으로 마스크와 개인위생을 철저히 하여 호흡기 감염에 주의를 하다 보니 인플루엔자 유병률이 대폭 감소하였다[13]. 또한 인플루엔자 형 별 검체를 구하기는 더 어려운 실정이 되었다. 뎅기열과 쯔쯔가무시증, 랩토스피라증, 신증후군출혈열, 지카바이러스감염증 등 열성질환 검체의 경우에는 동남아시아와 남아메리카 열대지역에 한정적인 경우도 있어 상업적 바이오뱅크에서 구하기 어려울 수도 있다. ‘한국보건산업진흥원 혹은 국내 연구진의 도움이 가장 필요한 분야는 무엇인가’라는 질문에 86%의 기업이 ‘부족한 임상검체의 수급’을 답한 이유는 체외진단의료기기 개발과 임상적 성능시험을 위하여 잔여검체의 활용이 적극적으로 이루어져야 함을 시사한다. 잔여검체는 생명윤리법의 적용을 받는 것으로서[14], 피험자의 권리를 보장하면서 국내 체외진단의료기기 개발에 적극적으로 활용하여 의료기기산업의 육성을 활성화하는 방안을 모색해야 한다. 한국보건산업진흥원에서 체외진단의료기기 임상시험 지원 시 국내외 검체 수급을 하여 기업과 임상시험 연구기관을 매칭하는 이유이기도 하다.
국내 진단검사 의료기기의 해외 수출 매출이 늘고 있지만, 좋은 품질의 제품에 대한 개발과 승인으로 세계적으로 기술력을 인정받는 제품의 공급이 필요하다. 좋은 품질의 체외진단 제품 개발을 위해서는 기업, 임상 연구자, 기관생명윤리위원회, 정부 모두 노력해야 한다.
첫째, 체외진단의료기기 개발 기업에서는 시장성, 검사의 신속성, 사용의 편의성, 결과의 정확성, 가격 우위 등 여러 면에서 경쟁력 있는 제품을 개발해야 한다. 하지만 제품의 개발과 임상적 성능시험, 인허가 모든 면에서 원활하게 진행되기가 쉽지 않다. 따라서 각 분야에 전문성이 있는 담당자를 양성하고 배치하여 역할분담을 정확하게 하는 것이 필요하다. 예를 들어, 제품의 임상적 성능시험 시 성능시험 기관에서 제품과 함께 사용하는 기기의 사용법에 대해서 충분히 교육하고, 임상시험 개시 모임과 모니터링, 식품의약처 제품 승인 담당자 등을 육성해야 한다. 또한 빠르게 변하고 발전하는 의료기술에 발맞춰 연구기술개발(R&D)을 할 수 있도록 지원을 아끼지 않아야 한다. 주요 다국적 기업들은 차세대 제품개발을 위해 연구개발에 투자를 활발하게 하지만, 국내 의료기기업체 중에는 연구기술개발에 투자가 미흡한 곳도 많다[15]. 현재의 기술을 따라잡고 미래의 첨단 의료기기 개발을 위해 연구기술개발에 가치를 두고 지속적으로 추진해야 한다.
둘째, 임상시험 연구자는 생명윤리법 및 체외진단의료기기법에 대한 이해를 바탕으로 윤리적이고 신뢰할 수 있는 임상적 성능시험을 수행할 수 있도록 노력해야 한다. 임상적 성능시험 담당자 교육 및 훈련을 정기적으로 이수하여 임상시험기관의 업무 능력을 향상시키고, 업무처리 효율을 증가시키면서 임상적 성능시험 전 과정을 체계적이고 신속하게 수행할 수 있어야 한다. 체외진단의료기기의 개발과 임상시험에 반드시 필요한 검체를 수집하고 관리하는 것 또한 국내외 허가를 위한 임상시험을 신속하게 수행할 수 있는 기반이 될 것이다. 반드시 기관생명윤리위윈회에서 승인받은 연구계획서대로 임상시험을 진행하고, 자료의 신뢰성과 정직성, 열정과 책임감을 가지고 임상시험을 수행해야 한다.
셋째, 기관생명윤리위원회(IRB)의 심사 및 과제관리에 있어 일관성과 전문성이 필요하다. 체외진단의료기기의 임상적 성능시험 시 기관생명윤리위원회의 심사 및 승인 과정이 필수적이지만 임상적 성능시험 기관별 기관생명윤리위원회의 판단이 상이하여 심사와 승인 절차에 소요되는 시간이 천차만별이다. 예를 들어 잔여검체 사용의 피험자 동의 및 재동의, 잔여검체를 이용한 후향적 연구에서의 동의서 취득 등에 대한 해석과 기준이 각 기관별로 상이하다. 때로는 일관적이지 않은 규정 해석과 적용으로 체외진단의료기기의 개발이 늦어지는 요인이 되기도 한다. 따라서 기관생명윤리위원회 담당자들의 일관성과 전문성을 위한 교육과 훈련이 필요하다.
넷째, 의료기기 인허가 업무를 수행하는 정부부처(식품의약품안전처)는 임상시험 평가에 대한 정확한 가이드라인 제시와 심사 및 허가에 일관성이 필요하다. 일정한 허가기준과 보완 내용에 대한 명확한 정보전달이 있어야 기업은 임상시험 및 인허가 관련업무를 신속하게 진행할 수 있다. 국내 제조회사에서는 임상 검체 확보 부족으로 개발 중 혹은 수출 시 제품에 대한 임상 평가가 충분하지 않은 문제가 있다. 국내 임상 검체 수가 부족한 감염병의 경우, 일률적인 검체 수를 요구하게 되면 임상적 성능시험 기간 지연 및 임상시험 비용 상승의 결과를 낳게 된다. 국내 임상 검체의 부족으로 해외 임상시험이 필수적으로 진행되어야 하며 이러한 경우 임상시험 및 인허가에 많은 시간과 비용이 소요된다. 이로 인해 기업체는 임상시험 및 인허가를 포기하게 되고, 장기적으로는 해외에 수출가능한 체외진단의료기기 개발이 불가능한 동시에 국내에는 해외 제품을 수입해서 판매하거나 연구용 제품(research-use only, RUO)을 진단검사 과정에 사용해야 하는 결과를 초래하게 된다. 국내에 부족한 임상 검체의 경우 인허가를 위한 피험자 수를 완화하거나 해외에서 검체를 수급할 수 있는 방법을 지원하는 것이 필요하다. 한국보건산업진흥원에서는 기기개발과 임상시험에 사용할 수 있는 임상시험기관별 보유 검체 현황을 찾을 수 있는 네트워크를 구축하여 체외진단의료기기 기업과 임상적 성능시험 기관의 매칭 사업을 시행하고 있다. 아울러 해외시장 개척, 교육, 홍보 등 다양한 활동을 지원하고 있다.
본 연구는 국내 감염병 체외진단의료기기 제조 회사의 현재 개발현황을 알아보고 체외진단의료기기의 개발, 임상시험, 인허가, 수출 등 전 과정에서 애로사항을 분석하여 앞으로 우리나라 체외진단의료기기 산업의 성장전략을 도출하기 위해 수행되었다. 그 결과 체외진단의료기기 제품의 개발 시 가장 어려운 점은 국내외 임상적 성능시험과 인허가에 있었다. 국내 임상적 성능시험 시 가장 어려운 점은 임상적 성능시험 기관과 매칭이었으며, 국내 인허가 시 가장 어려운 점은 식품의약품안전처의 심사 및 허가 지연이었다. 요약하면 우리나라 감염병 체외진단의료기기의 성공적인 개발과 수출을 위해서는 충분한 임상 검체를 보유한 임상적 성능시험 기관과의 적절한 매칭을 통해 국내 임상적 성능시험과 인허가의 신속한 처리가 필요하며, 나아가 해외 임상적 성능시험과 해외 인허가에 지원이 필요하다.
이번 연구는 국내의 체외진단의료기기 기업 중 체외진단의료기기 협회에 등록된 기업을 대상으로 진행하였고, 또한 감염병 분야에 국한했기 때문에 국내 모든 체외진단의료기기 기업의 의견을 종합할 수 없는 한계가 있다. 그리고 2018년도 기준의 설문조사가 있었다면 코로나19 팬데믹 이전과 이후의 체외진단의료기기의 중점적인 변화를 알아볼 수 있었을 것이기에 비교 분석의 제한점이 있다.
감사의 글
이 연구는 한국연구재단(2021R111A3044483) 및 한국보건산업진흥원(KHIDI)의 체외진단의료기기 해외 진출 임상시험 지원센터 사업의 일환으로 시행한 설문조사를 기반으로 하였습니다. 설문조사에 응해 주신 회사 관계자 분들께 깊이 감사드립니다.
REFERENCES
1. Ministry of Food, Drug Safety. 2021. Food & Drug statistical yearbook 2021. GPRN 11-1471000-000165-10. https://www.mfds.go.kr/brd/m_371/down.do?brd_id=stat0016&seq=30720&data_tp=A&file_seq=1. Updated on Dec 2021. Choengju: Ministry of Food and Drug Safety.
2. U.S. Department of Health and Human Services Food and Drug Administrations. Coronavirus Disease 2019 (COVID-19) Emergency Use Authorizations for Medical Devices. https://www.fda.gov/medical-devices/emergency-use-authorizations-medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices. Updated on Nov 2021.
3. Ministry of Food, Drug Safety. First trade surplus for medical devices, continuous reinforcement of innovative regulatory services. https://www.mfds.go.kr/brd/m_99/view.do?seq=45489&srchFr=&srchTo=&srchWord=&srchTp=8&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&Data_stts_gubun=C9999&. Updated on Jun 2021.
4. Korea Health Industry Development Institute. Industry analysis and policy research of medical device for diagnosis. KHIDI-CHIP-R-2020-1. https://www.khidi.or.kr/fileDownload?titleId=451530&fileId=1&fileDownType=C¶mMenuId=MENU02686. Updated on Jun 2021. Cheongju: Korea Health Industry Development Institute.
5. Korea Health Industry Development Institute. Medical device industry analysis report 2020. https://www.khidi.or.kr/fileDownload?titleId=455915&fileId=1&fileDownType=C¶mMenuId=MENU00085. Updated on Oct 2021.
6. Ministry of Food, Drug Safety. 2020 Medical device approval report. GPRN 11-1471000-000216-10. https://www.mfds.go.kr/brd/m_218/view.do?seq=33407&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=6. Updated on Aug 2021.
7. Ravi N, Cortade DL, Ng E, Wang SX. 2020; Diagnostics for SARS-CoV-2 detection: A comprehensive review of the FDA-EUA COVID-19 testing landscape. Biosens Bioelectron. 165:112454. DOI: 10.1016/j.bios.2020.112454. PMID: 32729549. PMCID: PMC7368663.
8. Dinnes J, Deeks JJ, Berhane S, Taylor M, Adriano A, Davenport C, et al. 2021; Rapid, point‐of‐care antigen and molecular‐based tests for diagnosis of SARS‐CoV‐2 infection. Cochrane Database of Syst Rev. 3:CD013705. DOI: 10.1002/14651858.CD013705. PMID: 32845525. PMCID: PMC8078202.

9. Wang YC, Lee YT, Yang T, Sun JR, Shen CF, Cheng CM. 2020; Current diagnostic tools for coronaviruses-From laboratory diagnosis to POC diagnosis for COVID-19. Bioeng Transl Med. 5:e10177. DOI: 10.1002/btm2.10177. PMID: 32838038. PMCID: PMC7435577.

10. FIND. Test directory. https://www.finddx.org/covid-19/test-directory/. Updated on Jan 2022.
11. Act on In Vitro Diagnostic Medical Devices. Act no. 16433, Apr. 30, 2019. https://elaw.klri.re.kr/kor_service/lawView.do?hseq=53555&lang=ENG.
12. Ministry of Health, Welfare. Infectious Disease Surveillance Yearbook, 2019. GPRN 1-1352159-000048-10. Cheongju: Korea Disease Control and Prevention Agency;2020.
13. Lee H, Lee H, Song KH, Kim ES, Park JS, Jung J, et al. 2021; Impact of public health interventions on seasonal influenza activity during the COVID-19 outbreak in Korea. Clin Infect Dis. 73:e132–40. DOI: 10.1093/cid/ciaa672. PMID: 32472687. PMCID: PMC7314207.
14. Bioethics And Safety Act. Act No. 16372, Apr. 23, 2019. https://elaw.klri.re.kr/kor_service/lawView.do?lang=ENG&hseq=52559.
15. National Institute of Medical Device Safety Information. National Certified Medical Device Regulatory Affairs Specialist 1 - Premarket Approval. Gwangju: Chaoreum;2021.
Fig. 1
Difficulties facing developers of in vitro diagnostic medical devices for infectious diseases. Responses were averaged after scoring on the Likert 5-point scale (1, very easy; 5, very difficult).
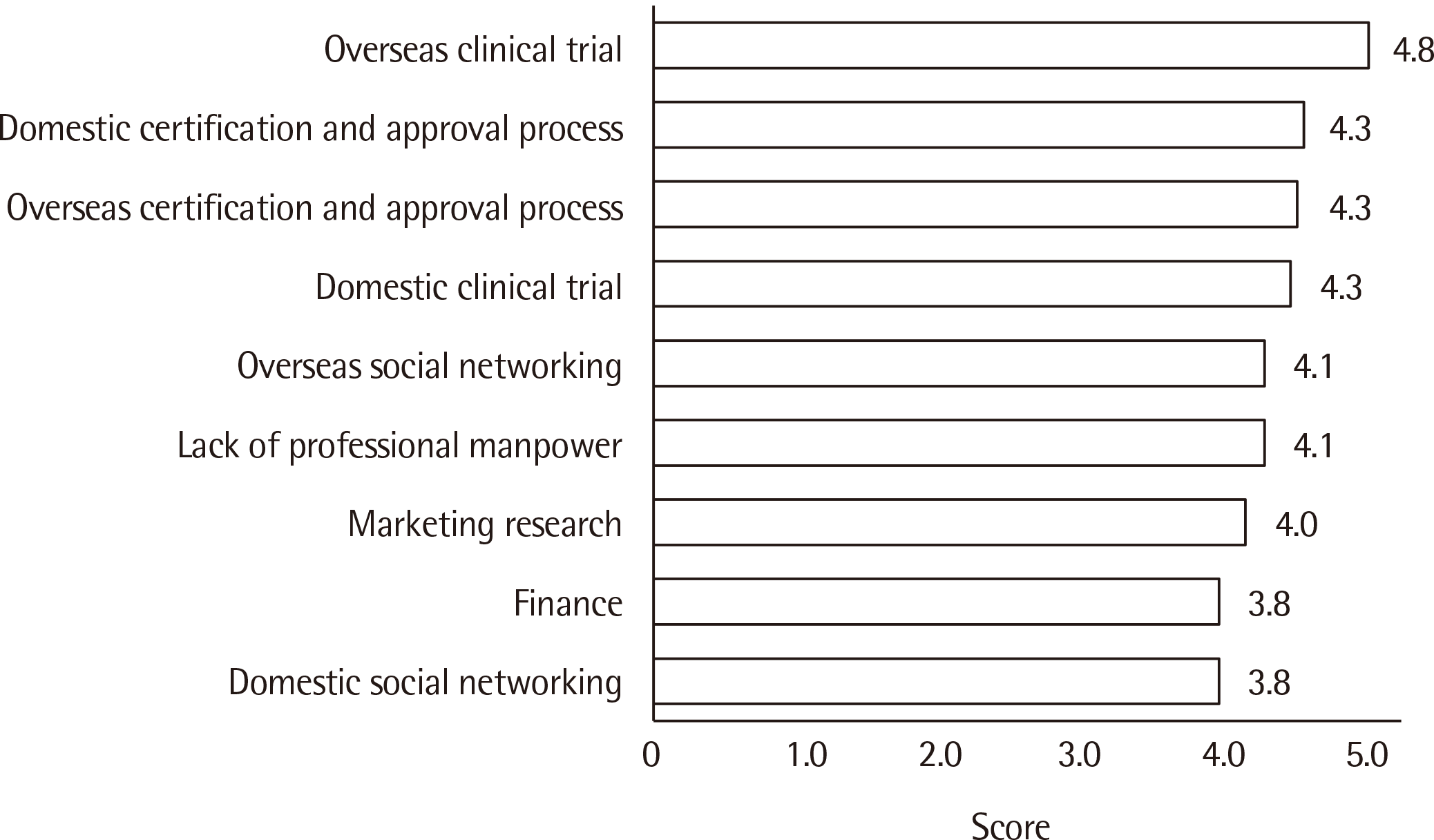
Fig. 2
Challenges in conducting domestic clinical trials of in vitro diagnostic medical devices for infectious disease detection (1, very easy; 5, very difficult).
Abbreviation: IRB, institutional review board.
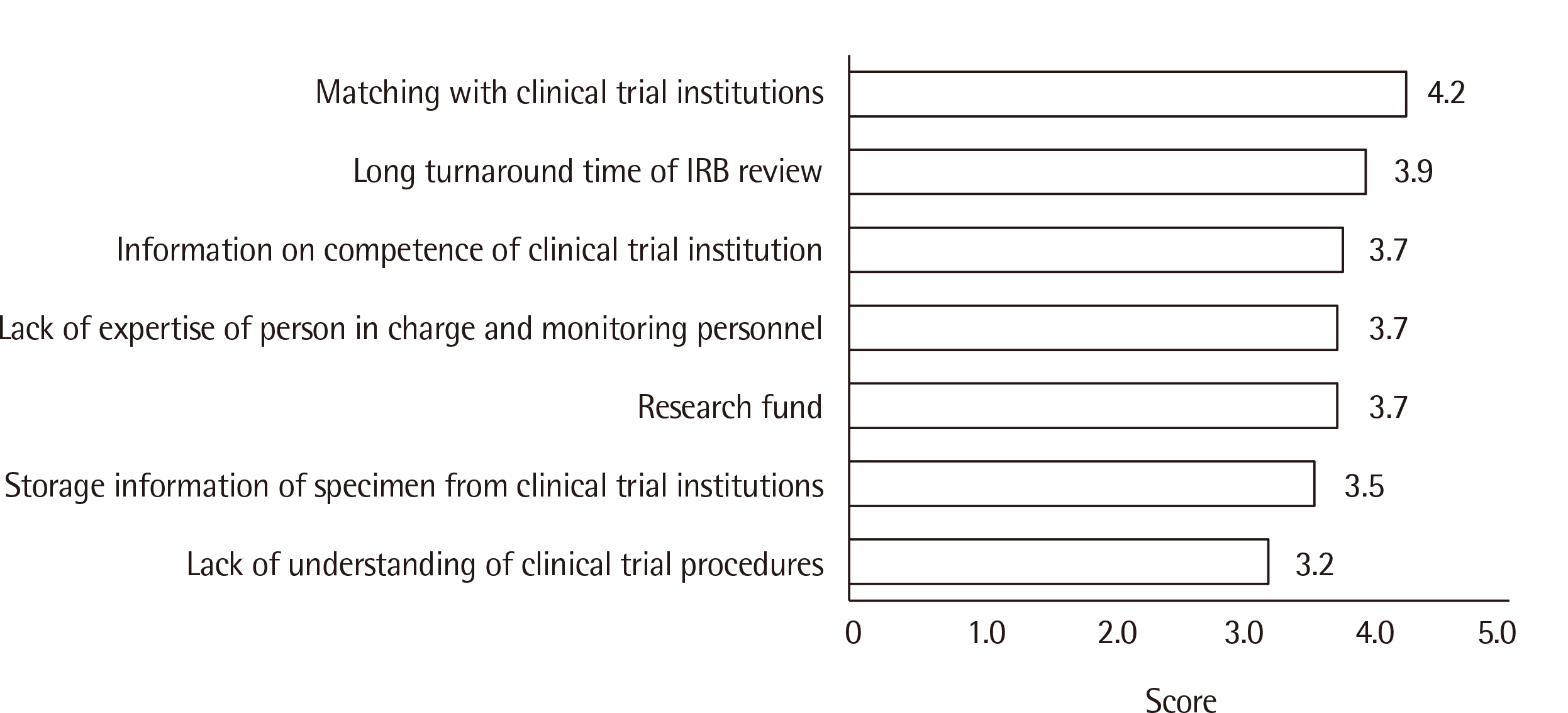
Fig. 3
Challenges faced by those applying for permission to manufacture and import in vitro diagnostic medical devices for infectious disease diagnosis (1, very easy; 5, very difficult).

Table 1
Annual revenue and number of employees of each respondent company (N=22)
Table 2
Purpose of clinical trial for an in vitro diagnostic medical device for infectious disease diagnosis (N = 23)
Table 3
Medical devices for in vitro diagnosis of infectious diseases currently in operation or scheduled to be developed (N=23)
Table 4
Priority of infectious diseases for which an in vitro diagnostic medical device is under development or under consideration
| Infectious disease type | Sum of priority points* (%) | 1st priority | 2nd priority | 3rd priority |
|---|---|---|---|---|
| COVID-19 | 58 (42.7) | 17 | 3 | 1 |
| Influenza | 32 (23.5) | 2 | 12 | 2 |
| Dengue | 13 (9.6) | 1 | 3 | 4 |
| Hepatitis viruses | 7 (5.1) | 1 | 1 | 2 |
| Tuberculosis | 7 (5.1) | 0 | 1 | 5 |
| Zika virus | 6 (4.4) | 1 | 1 | 1 |
| Other respiratory viruses | 5 (3.7) | 1 | 0 | 2 |
| Others (malaria, sexually transmitted disease) | 8 (5.9) | 0 | 2 | 4 |
| Total | 136 (100) | 23 | 23 | 21† |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download