Abstract
Nasal cavity and paranasal sinus cancers comprise about 1% of all malignancies, and 5% of head and neck malignancy. Squamous cell carcinoma comprises more than half of nasal cavity cancers. Treatment is determined by considering tumor size, location, staging, age, general condition, purpose of treatment, etc. Conventional therapy includes surgery, radiotherapy, and chemotherapy; however, for the locally advanced, recurrent, or metastatic cancer after conventional therapy, immunotherapy or targeted therapy are taken into consideration. Target therapy attacks specific cancer cells directly, such as cancer cells with certain gene mutation, whereas immunotherapy attacks cancer cells indirectly, stimulating our own immune system, such as T-cell activity. Histologically poorly differentiated carcinomas are treated with surgery, radiotherapy, and sometimes chemotherapy, but 5-year survival rate is low due to frequent recurrence. Here, we present a case of successful targeted therapy applied to recurrent nasal cavity cancer after serial application of conventional therapies.
비강과 부비동의 악성 종양은 전체 악성종양의 약 1% 정도, 전체 두경부암의 5% 정도를 차지하며 조직학적으로는 편평세포암이 반이상의 비율로 가장 흔하게 관찰된다[1]. 치료는 병변의 병기, 위치, 나이, 전신 상태, 치료의 목적 등을 고려하여 결정하게 된다. 고전적인 치료방법은 수술 혹은 방사선 치료, 그리고 항암 요법 혹은 이들의 조합으로 이루어지게 되며, 고전적인 치료방법에도 불구하고 지속적인 국소진행, 재발, 혹은 전이를 보이는 경우 그 다음 치료옵션으로 면역치료 및 표적치료를 고려할 수 있다. 표적치료는 특정 유전자 변이를 보이는 환자의 암세포 등에 약물이 직접적으로 작용하는 치료이며, 치료제가 T세포의 작용 등 우리 몸의 자연면역기능을 여러 방식으로 도와 더욱 활성화시켜 암세포를 공격하는 것이 면역치료이다.
조직학적 저분화형 암종의 경우 수술 및 방사선 요법, 또한 필요시 항암치료까지 진행하게 되나, 잦은 재발로 인해 5년 생존률은 다른 암종에 비해 낮아 치료가 어렵다[2]. 이번 증례에서 좌측 코의 종물에 대해 타원 조직 검사상 저분화형 암종(poorly differentiated carcinoma)으로 진단 후, 여러 차례에 걸친 수술적 치료, 항암방사선치료, 그리고 면역치료에도 지속적으로 재발하는 환자에게 표적치료를 시행하여 성공적인 반응을 보인 1예를 문헌 고찰과 함께 보고하고자 한다.
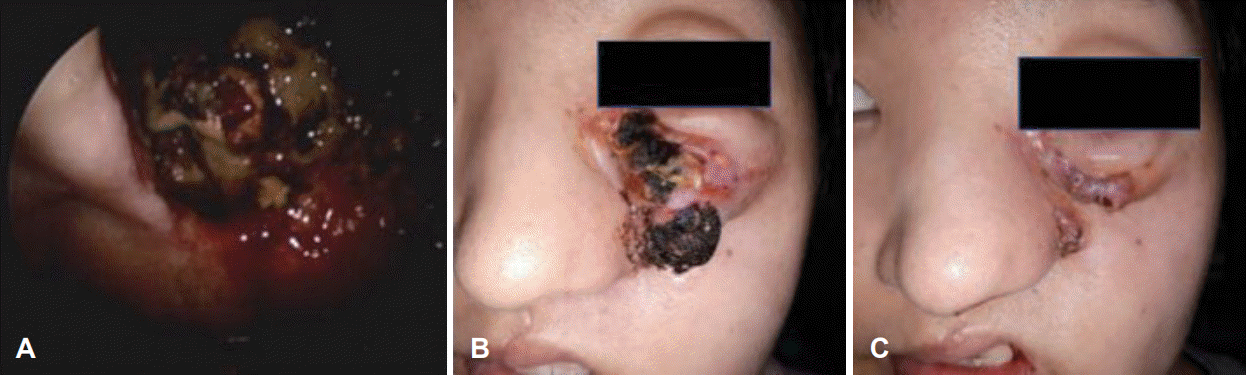
특이 과거력 없는 35세 여자 환자가 좌측 코막힘으로 타원 내원하여 발견된 좌측 코의 종물에 대해 조직검사 시행 후 저분화형 암종으로 진단 후 내원하였다. 내시경검진상 좌측 비강내 외측벽의 종물 관찰되고 있었으며 시행한 전산화단층촬영(CT) 및 자기공명영상(MRI)상 좌측 비강 내 3.5 cm의 비균질적 조영증강되는 종물 관찰되었으며, 임파선 비대는 관찰되지 않았다. 양전자방출단층촬영(PET-CT)상 원격 전이는 발견되지 않았다(Fig. 1). 임상적병기 cT1N0M0의 비강암에 대해 내시경하 내측상악절제술(endoscopic medial maxillectomy)를 시행하였고, 병리결과상 후연 침범소견있는 저분화형 편평세포암종 확인되었다. 본원 다학제회의 진행하였고, 병기 T1이며 비강 내에 국한된 조직으로 생각되어 수술 후 방사선 치료 등 추가 치료는 시행하지 않고 경과 관찰하기로 결정되었다. 수술 후 3달 뒤 시행한 CT상 좌측 비강 앞부분에 재발로 의심되는 병변 관찰되었으며(Fig. 2), 조직검사상 다시 저분화도 암종 확인되어 시스플라틴(cisplatin) 기반 항암방사선치료를 1달간 시행하였다(좌측 상악동에 67.5 Gy, 우측 상악동 및 좌측 비강 및 비중격에 54 Gy, 좌측 경부림프절 Lv II, III, IV에 48 Gy). 항암방사선치료 종료 후 4달째 시행한 MRI상 잔존암은 줄어들었으나 좌측 해면정맥동(cavernous sinus)에 결절 관찰되어 정위적 방사선치료(stereotactic ablative radiotherapy) 시행하였다(좌측 해면정맥동에 40 Gy). 이후 촬영한 MRI상 해면정맥동 결절 사라졌으나 좌측 상악동 종물 크기는 그 사이 증가하였고, 좌측 사골동에 새로운 병변 또한 확인되어 PET-CT 시행하였다. 좌측 상악동 종괴의 standard uptake value (SUV)는 14.8이었으며, 새로이 폐의 우하엽에 결절이 관찰되었으며, SUV는 3.0이었다(Fig. 3). 두 번째 수술로 좌측 하부부분상악절제술(inferior partial maxillectomy)과 비디오 흉강경 우하엽 쐐기절제술(VATS RLL wedge resection) 시행하였고, 모두 저분화형 암종 확인되었다. 수술 후 두 달째 촬영한 전신 양전자단층촬영-자기공명영상(PET-MRI)상 좌측 비강과 상악동에 대사항진된 종물이 관찰되었으며, SUV는 13.8이었다. 또한 폐좌상엽에 SUV 5.3의 대사항진된 결절이 관찰되었다. 이에 다른 항암요법(docetaxel, 5-FU, CDDP)을 3달간 시행하였다. 항암요법 진행중 시행한 chest CT, PNS MRI상 폐 좌상엽 및 좌측 상악동 병변은 크기 감소한 소견이었으나, 이후 몇 개월 사이 검진상, 그리고 MRI와 PET 검사 결과상 좌측 비강 및 상악동 내 병변의 크기는 급격히 증가하였다(Fig. 4). 이에 세 번째 수술로 좌측 상악전절제술(total maxillectomy) 시행하였다. 하지만 두 달이 채 되지 않아 좌측 상악동 내 병변 다시 급격히 증가하였고, 이번에는 볼과 안와까지 침범하기 시작하였다. 전통적인 치료 방법에도 계속 재발하여 면역치료로 대식세포의 활성을 돕는 ALX148과 T-cell의 활성을 돕는 펨브로리주맙(pembrolizumab)을 사용하였음에도 불구하고 병변의 크기 및 범위는 더욱 증가하기만 하였다(Fig. 5). 재발성, 전이성 두경부암 환자들에 여러 표적치료제를 사용하여 비교하는 임상시험이 본원에서 진행중에 있었고, 이 표적치료제들 중 여러 성장인자 수용체를 억제하는 닌테다닙(nintedanib)이라는 약을 200 mg bid로 시작하였다. 시작 후 수 주 내 종양의 크기는 급격히 줄어들기 시작했으며(Fig. 6), 이후 3년간 닌테다닙 사용한 뒤 임상시험 종료로 치료 종결하였다. 치료 종결 후 3달이 지난 현재까지 재발없이 유지되고 있으며(Fig. 7), 만약 재발 시 다른 FGFR 억제제를 시도해볼 계획 중에 있다.
비강의 편평세포암은 T1의 점막에 국한된 암을 제외하고는 근치적 수술과 수술 후 방사선치료의 조합으로 치료하게 된다. 만약 암의 크기 혹은 범위가 근치적 수술을 시행하기에 너무 크다면, 수술 전 항암방사선치료로 크기를 줄이고 수술을 시행하기도 한다. 진행성 두경부 편평세포암의 경우 치료 후 국소재발 혹은 원격전이의 비율이 30%-40%에 이르고 있으며, 그 경우 항암방사선 치료, 혹은 면역치료, 표적치료 등을 고려하게 된다. 국소 진행성 두경부 편평세포암의 경우, 시스플라틴과 5-플루오로우라실(5-FU)을 조합한 항암방사선 치료가 표준으로 사용되며, 재발성암에서 시스플라틴과 도세탁셀(docetaxel)이 조합도 생존률, 종양의 반응, 점막 독성의 측면에서 효과가 좋다는 연구도 보고되고 있다[3]. 기존의 전통적인 수술 혹은 항암 방사선 치료는 진행된 단계의 종양, 고위험 조직학적 유형, 두개골 내부 혹은 경부 림프절의 침범이 있는 경우에 특히 효과적이지 못하며, 이러한 경우 면역치료를 시도해 볼 수 있을 것 같다[4,5].
세툭시맙(cetuximab)은 상피세포 성장인자 수용체(epidermal growth factor receptor, EGFR)에 결합하는 인간-쥐 키메라 단일클론항체로 국소진행성 두경부 편평세포암에서 방사선과 함께 사용하는 것이 방사선 단독 사용보다 생존률에서 우월하다는 보고[6] 및 재발 혹은 전이성 두경부 편평세포암에서 항암제와 함께 사용하는 것이 항암제 단독 사용보다 생존률에서 우월하다는 보고가 있다[7]. 다만 바이오마커의 측면에서 본다면, 두경부 암에서 EGFR 발현비율이 90% 이상으로 다른 암종에 비해 월등히 높긴 하지만, 다른 EGFR 치료제는 뚜렷한 유의미한 효과를 보이지 못하는 것으로 보아 세툭시맙(cetuximab)도 EGFR 자체보다는 면역조절의 측면이 더 클 것이라는 보고도 있다[8]. 이외에 세툭시맙의 사용으로 인한 부작용의 일부인 발진의 정도가 심할수록 생존률이 오히려 좋다는 연구도 있다[9].
암세포는 종양미세환경을 바꿔 면역을 억제하거나 면역관용 등의 면역회피(immune escape)를 통해 살아남게 된다. 이러한 면역회피의 가장 주요한 전략의 하나로 면역 체크포인트(immune checkpoint)를 통해 T세포를 억제하는 방법을 사용한다. 가장 흔히 알려져있는 면역 체크포인트는 암세포에 발현되는 PD-L1이라는 단백질로, T세포의 PD-1과 결합하면 T세포의 기능을 억제하게 된다. 이에 PD-L1, PD-1 등을 억제하는 몇 가지 약물들이 FDA 승인을 받아 사용되고 있다[10]. CheckMate 141 임상시험을 거친 니볼루맙(nivolumab)은 IgG4 단일클론항체로, PD-1에 결합하여 면역 체크포인트 억제제(immune checkpoint inhibitor) 역할을 한다. 이는 재발성 두경부 편평세포암에 대해 사용하였을 때 메토트렉세이트(methotrexate), 도세탁셀(docetaxel), 세툭시맙의 단독사용보다 더 높은 생존률을 보였다[11]. KEYNOTE 012 임상시험을 거친 펨브로리주맙(pembrolizumab)은 IgG4-k 단일클론항체로 마찬가지로 PD-1에 대한 면역 체크포인트 억제제 역할을 한다. 이는 재발성, 전이성 두경부 편평세포암에서 플래티넘과 5-FU 항암제와 같이 사용되었을 때, 항암제와 세툭시맙의 병합요법에 비해 높은 생존률을 보였다. 또한 PD-L1 양성인 군에서는 펨브로리주맙 단독 요법이 항암제와 세툭시맙의 병합요법에 비해 우월하여 바이오마커로의 기능에 대한 가능성을 보여주었다[12,13].
닌테다닙은 3가지 수용체(FGFR, VEGFR, PDGFR)에 대해 작용하는 티로신 키나아제 억제제로, 주로 특발성 폐섬유증 혹은 비소세포 폐암에서의 효과가 보고되어 왔다[14]. 두경부암에서는 재발성, 전이성 침샘암에 대해서 사용되었을 때 75%의 질병통제률을 보인다는 결과는 있으나[15], 그 외의 두경부암에 대해서 이루어진 임상시험 결과는 많지 않다. 플래티넘 기반 항암치료에 효과가 없는 재발성, 전이성 두경부암 환자들의 유전자 변이를 분석하여 2차 약제로 닌테다닙 등 여러 표적치료제를 사용하여 비교하는 KCSG-TRIUMPH 임상시험이 최근까지 진행되어 왔다. 이번 임상시험에서 또한 질병통제률에서 좋은 결과를 보이길 기대할 수 있으며, 나아가 반응률 및 생존률에도 또한 긍정적인 효과를 보이기를 기대해 볼 수 있겠다. 이번 케이스에서 면역치료 사용 후 종양의 크기는 급격하게 줄어들었으며, 사용 시작한지 1달가량 지났을 때 어떤 종양 type이 이러한 면역 치료에 반응을 잘 하는지 알아보려고 조직검사를 시행하였으나(2018-09-21) 그 시점에서 이미 잔여 악성세포가 관찰되지 않았다. 따라서 이 약제가 어떤 조직학적 특징을 가지는 종양에 잘 듣는지, 앞으로 어떤 두경부암 환자들에게 처방할지 알기 어려운 한계가 있다. 3년간의 약제 사용 및 약제 종료 후 경과 관찰 중인 현재까지 추적 혈액검사 결과를 포함한 여러 전신 부작용을 의심할 수 있는 소견은 없었으며, 장기적인 약제 사용의 긍정적인 가능성을 보여주었다.
본 증례의 경우, 고전적인 치료방법인 수술, 항암방사선과 비교적 잘 알려진 면역치료에도 지속적으로 재발하는 비강내 편평세포암종에 대해 표적치료를 진행하여 성공적으로 종양을 치료하였기에 이에 최신 치료방법들에 대한 고찰과 함께 보고하는 바이다. 국소 진행성 혹은 재발성 비강 내 편평세포암종에 대해 종양내과와 긴밀히 협력하여 다른 여러 치료 옵션을 적극적으로 고려하고, 또한 아직까지 널리 사용되고 있는 바이오마커가 많지 않지만 재발성 두경부암, 특히 비강 및 부비동암의 면역치료, 표적치료 등에 있어 치료의 결과를 예측할 수 있는 바이오마커 연구가 더 이루어져 적절한 환자군에 더 면역치료, 표적치료가 적용될 수 있기를 기대하는 바이다.
Notes
Author Contribution
Conceptualization: Hyun Jik Kim. Data curation: Suyeon Pyo. Formal analysis: Hyung Dong Jo, Hyun Jik Kim. Methodology: Hyung Dong Jo. Project administration: Hyun Jik Kim. Supervision: Hyun Jik Kim. Visualization: Hyun Tae Ryu. Writing—original draft: Hyun Tae Ryu. Writing—review & editing: Hyun Jik Kim.
REFERENCES
1. Sjöstedt S, Jensen DH, Jakobsen KK, Grønhøj C, Geneser C, Karnov K, et al. Incidence and survival in sinonasal carcinoma: A Danish population-based, nationwide study from 1980 to 2014. Acta Oncol. 2018; 57(9):1152–8.
2. Ackall FY, Issa K, Barak I, Teitelbaum J, Jang DW, Jung SH, et al. Survival outcomes in sinonasal poorly differentiated squamous cell carcinoma. Laryngoscope. 2021; 131(4):E1040–8.
3. Glisson BS, Murphy BA, Frenette G, Khuri FR, Forastiere AA. Phase II trial of docetaxel and cisplatin combination chemotherapy in patients with squamous cell carcinoma of the head and neck. J Clin Oncol. 2002; 20(6):1593–9.
4. Kazi M, Awan S, Junaid M, Qadeer S, Hassan NH. Management of sinonasal tumors: Prognostic factors and outcomes: A 10 year experience at a tertiary care hospital. Indian J Otolaryngol Head Neck Surg. 2013; 65(Suppl 1):155–9.
5. Bugra Cengiz A, Uyar M, Comert E, Dursun E, Eryilmaz A. Sinonasal tract malignancies: Prognostic factors and surgery outcomes. Iran Red Crescent Med J. 2013; 15(12):e14118.
6. Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006; 354(6):567–78.
7. Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S, et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med. 2008; 359(11):1116–27.
8. Agarwal V, Subash A, Nayar RC, Rao V. Is EGFR really a therapeutic target in head and neck cancers? J Surg Oncol. 2019; 119(6):685–6.
9. Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol. 2010; 11(1):21–8.
10. Mei Z, Huang J, Qiao B, Lam AK. Immune checkpoint pathways in immunotherapy for head and neck squamous cell carcinoma. Int J Oral Sci. 2020; 12(1):16.
11. Ferris RL, Blumenschein G Jr, Fayette J, Guigay J, Colevas AD, Licitra L, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck. N Engl J Med. 2016; 375(19):1856–67.
12. Burtness B, Harrington KJ, Greil R, Soulières D, Tahara M, de Castro G Jr, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): A randomised, open-label, phase 3 study. Lancet. 2019; 394(10212):1915–28.
13. Kitamura N, Sento S, Yoshizawa Y, Sasabe E, Kudo Y, Yamamoto T. Current trends and future prospects of molecular targeted therapy in head and neck squamous cell carcinoma. Int J Mol Sci. 2020; 22(1):240.
14. McCormack PL. Nintedanib: First global approval. Drugs. 2015; 75(1):129–39.
15. Kim Y, Lee SJ, Lee JY, Lee SH, Sun JM, Park K, et al. Clinical trial of nintedanib in patients with recurrent or metastatic salivary gland cancer of the head and neck: A multicenter phase 2 study (Korean Cancer Study Group HN14-01). Cancer. 2017; 123(11):1958–64.
Fig. 1.
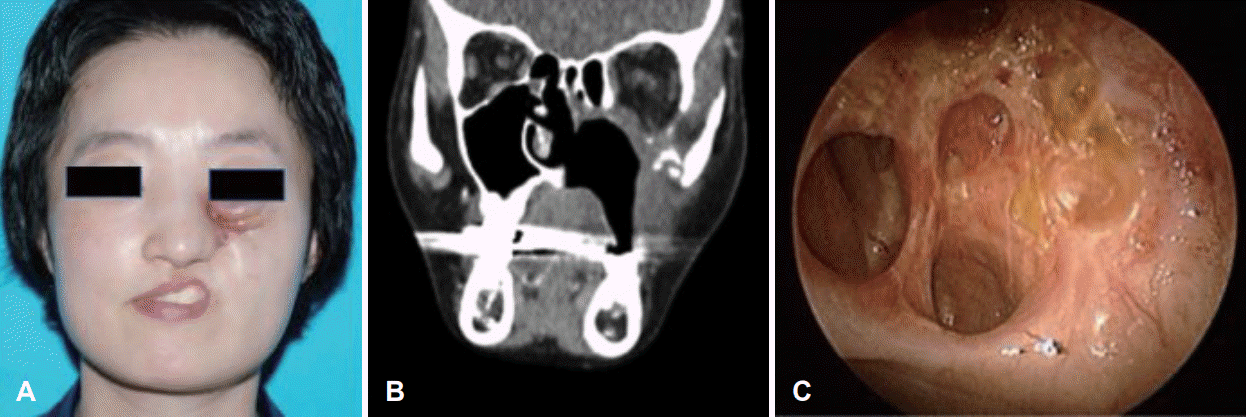
A: Preoperative endoscopic finding shows nasal cavity wall protruding mass. B: In the paranasal sinuses CT, there was about 3.5 cm heterogeneously enhancing mass in the left nasal cavity. C: In the PET-CT imaging, standard uptake value of left nasal cavity mass was 15.5.
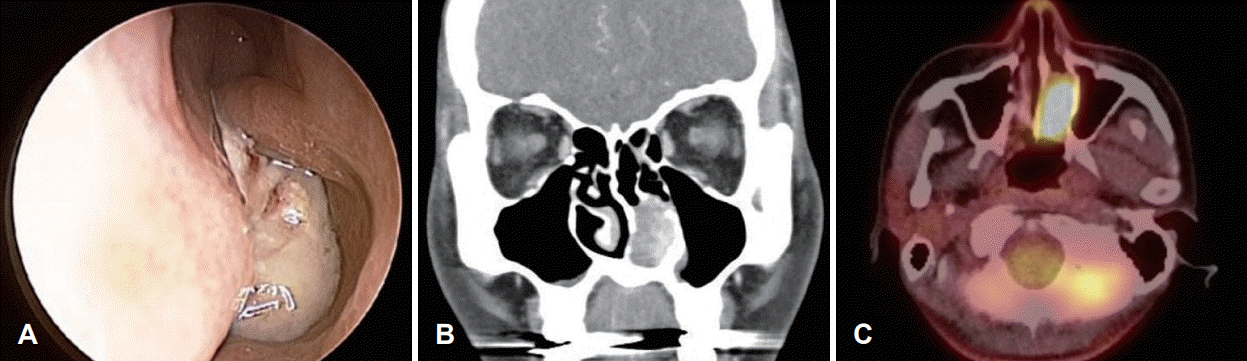
Fig. 2.
A: Histology type was poorly differentiated squamous cell carcinoma, with pleomorphic cells and marked mitotic activity. B: CT was taken at post operative day 3 months, and there was enhancing mass in the left nasal cavity, suspicious of residual tumor or recur.
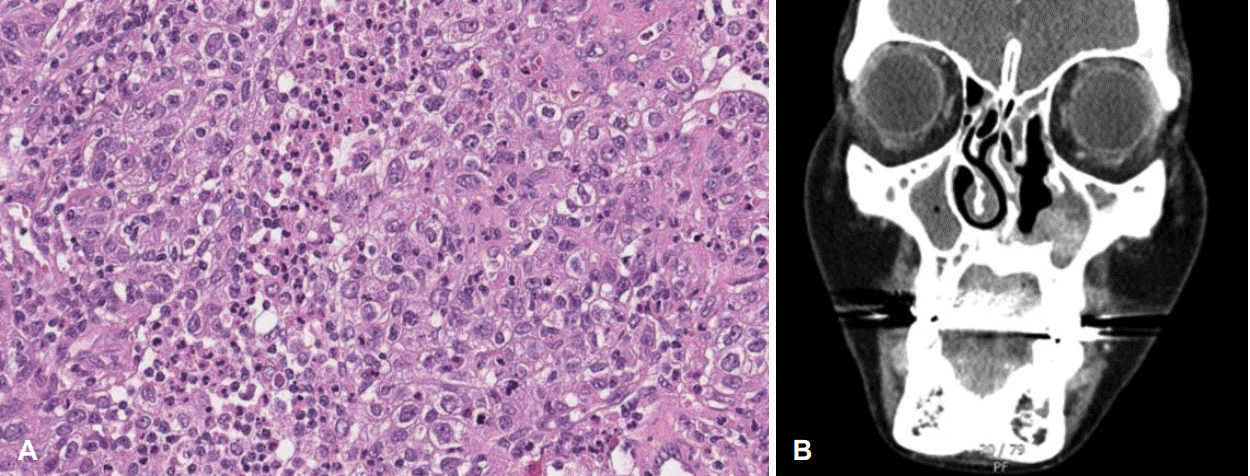
Fig. 3.
A: MR image taken 1 month after stereotactic ablative radiotherapy shows decreased cavernous sinus nodule, but paranasal sinus lesion increased in size. In the PET-CT imaging, SUV of left maxillary sinus lesion was 14.8 (B), and there was new right lung lesion with SUV of 3.0 (C). SUV, standard uptake value.
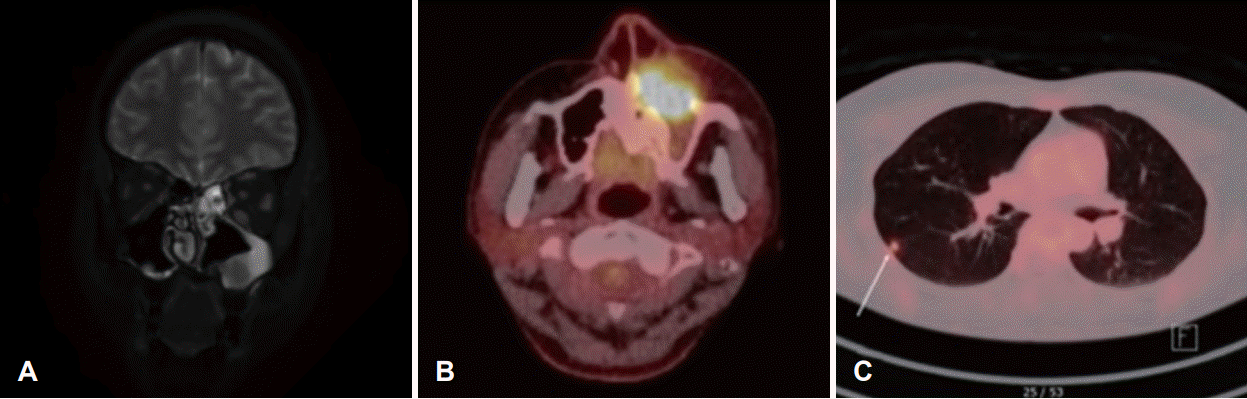
Fig. 4.
A: Endoscopic finding 1month after chemotherapy shows rapidly growing left nasal cavity and maxillary sinus mass. B and C: MR and PET-CT image also show sinus mass involving all sinuses with wall destruction, and standard uptake value was 13.5.
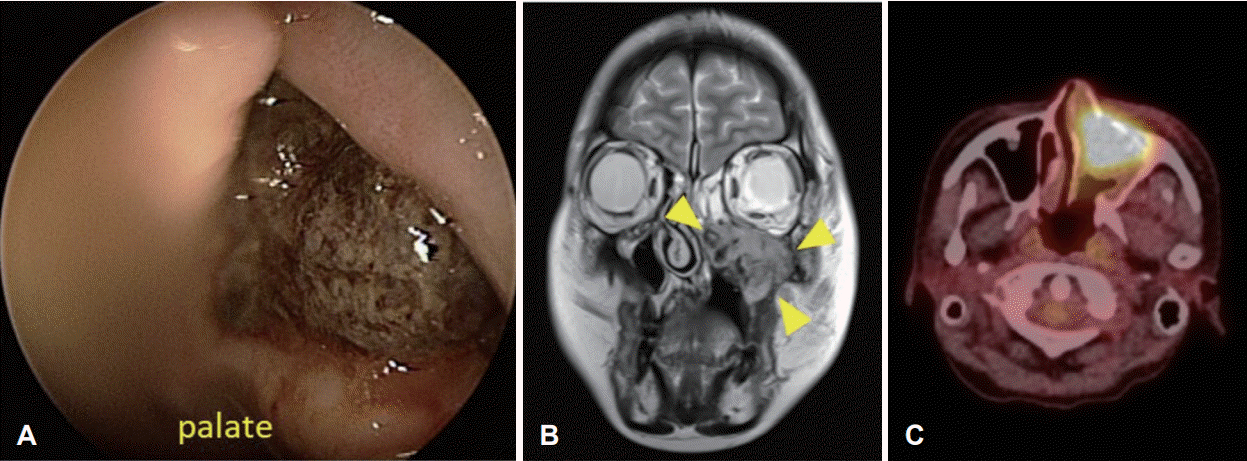
Fig. 5.
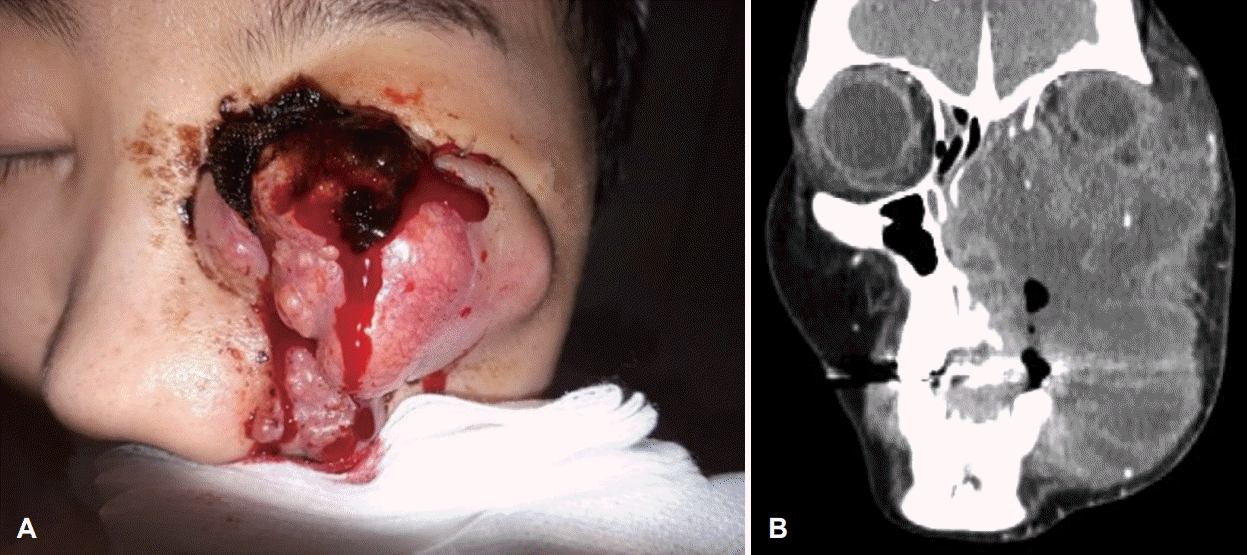
Mass increased in spite of total maxillectomy and use of pembrolizumab, extension to left zygomatic, lower periorbital lesion, left buccal space.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download