Abstract
Purpose
The study investigated the effects of a single bout of high-intensity interval training (HIIT) and moderate-intensity continuous training (MICT) on blood glucose homeostasis and exosome levels in young healthy adults.
Methods
A total of 20 healthy young people aged 20 to 30 years were voluntarily recruited from our local community. The subjects were randomly assigned to either HIIT or MICT.
Results
The analyses of variance with repeated measures showed that HIIT resulted in a significant treatment (before vs. after HIIT)×time (0, 30, 60, 90, and 120 minutes during oral glucose tolerance tests) interaction (F(1,9)=5.623, p=0.028) on blood glucose concentrations. HIIT resulted in significant decreases in blood glucose levels at 90 minutes (p<0.05) and 120 minutes (p<0.05). MICT did not result in any significant treatment×time interaction on blood glucose concentrations. Neither HIIT nor MICT resulted in any significant treatment×time interaction on blood insulin concentrations. Finally, there was a significant treatment×time interaction (F(1,19)=11.815, p<0.001) in circulating exosome levels. HIIT resulted in a significant increase in exosome levels, whereas MICT did not.
운동은 인슐린 감수성을 자극하여 골격근(skeletal muscle)의 혈당을 이용하게 함으로써 혈당 항상성(glucose homeostasis) 조절 개선, 혈중지질(blood lipids) 개선, 부종 사이토카인(proinflammatory cytokines) 감소, 항 부종 사이토카인(anti-inflammatory cytokines) 증가 등 여러 가지 긍정적인 효과를 유도한다1-3. 이처럼 운동으로 인한 혈당 항상성 조절과 인슐린 감수성 개선 효과는 골격근의 인슐린 수용체의 자가 인산화(autophosphorylation of insulin receptors)와 근수축 작용으로 인한 세포막의 인슐린 의존성 당 수송체(insulin-dependent glucose) 및 비의존성 당 수송체(insulin-independent glucose transporter) 활성화 등이 관여하고 있는 것으로 보고되고 있다4.
이처럼 혈당 대사와 인슐린 감수성에 대한 운동 효과는 지속적이고 일관되게 보고되고 있지만, 운동량, 운동 강도, 운동 유형 등을 포함하는 운동 방법에 따라서 유의한 차이가 있는 것으로 선행연구에서는 보고하고 있다5. 이 중 강도 측면에서 운동의 효과를 살펴보면, 저강도 유산소성 운동이 체지방 감량에 효과적인 것으로 보고되고 있지만6, 중등도 이상에서 실시하는 고강도 유산소 운동이 상대적으로 더 효과적이라고 주장하는 상반된 연구 결과와7,8 저강도와 고강도 유산소성 운동 간에 차이가 없다는 연구 결과도 있다9. 이러한 사실과 더불어 저강도 혹은 중강도 유산소 운동은 고강도 유산소 운동보다 지속 시간이 상대적으로 길어서, 지루함으로 인해 운동 실천율이 떨어진다는 단점도 있다10.
선행연구에서 지적한 저강도 및 중강도 운동의 단점을 보완하는 동시에 효과를 극대화할 수 있는 대안으로 최근에는 단시간 고강도 유산소 운동을 제시하고 있다11. Miyashita 등12은 19명의 건강한 남성을 대상으로 최대 산소섭취량의 70% 강도에서 6분 트레드밀 달리기와 30분 휴식을 교대로 실천한 결과, 짧게 반복하는 일회성 운동이 식후 혈중 중성지방과 혈압을 유의하게 감소시켰다고 보고하였다. Campbell 등13은 가정에서 실시하는 간헐적 인터벌 운동 프로그램과 식이 제한을 병행하는 복합 처치와 지속성 운동 프로그램과 다이어트를 병행하는 복합 처치가 심폐 체력, 신체 구성, 안정 시 대사, 혈중 지질에 미치는 영향을 비교하였다. 그 결과, 간헐적 인터벌 운동과 지속성 운동 모두 이러한 종속 변인을 유의하게 개선하였지만, 혈중 초저밀도 지단백(very-low-density lipoprotein)은 간헐적 인터벌 운동 프로그램 후에만 유의하게 개선된 것으로 나타났다. 이와 유사하게 Campos 등14도 20대 일반인을 대상으로 최대 산소섭취량의 90% 이상 고강도 인터벌 운동(high-intensity interval training)이 지방 대사 개선에 효과적이라고 보고하였다.
한편, 대부분의 세포는 다양한 크기와 성분을 함유하고 있는 세포 내 기원의 세포 외 소낭(extracellular vesicle)을 분비한다. 이 중 물리적 스트레스와 질병 등 여러 상황에서 다양한 조직, 세포, 혈구로부터 분비되는 엑소좀(exosome)은 30–100 nm 크기의 천연 나노 입자로, 단백질, messenger RNA, microRNA 등 다양한 유전 물질을 함유하고 있으며15,16, 이들 유전 물질이 주변 세포로 전달되어 그 주변 세포의 기능을 변화시키는 등 세포 간 의사 전달에 중요한 역할을 하고 있는 것으로 알려져 있다17. 따라서 혈중 엑소좀은 제2형 당뇨병이나 비만과 같은 다인성 대사질환의 진단과 치료 목적으로 활용할 수 있는 새로운 생체지표(biomarker)의 역할을 할 수 있을 것으로 기대되고 있다18.
특히, 골격근은 운동에 반응하여 엑소좀을 혈중으로 유리시켜 뇌, 간, 심장, 지방 조직(adipose tissue) 등의 각 말초기관으로 신호 전달을 한다고 알려져 있다19. Safdar 등20은 C57BL/6 마우스를 대상으로 하는 동물실험에서 15 m/min의 속도로 90분 동안 트레드밀에서 운동한 후 근육에서 엑소좀 방출이 증가한다는 사실을 확인하였다. Frühbeis 등21은 12명의 건강한 사람들을 대상으로 하는 임상 실험에서 점증적 부하 운동의 사전, 직후, 그리고 회복 90분 시점에서 혈중 엑소좀 반응을 분석한 결과 운동 직후에 혈중 엑소좀이 유의하게 증가했다고 하였고, Safdar 등20은 혈중 엑소좀 반응은 유산소 운동 강도에 따라 증가한다고 보고하였다.
이처럼 최근 국외 선행연구 결과에 의하면 고강도로 짧게 반복하는 인터벌 운동은 전통적으로 심폐 지구력 증진과 더불어 혈당 항상성 조절, 혈중 지질 대사, 체중 조절 등 다양한 측면에서 긍정적인 효과를 유도하는 것으로 보고되고 있지만, 국내에서 혈당 항상성 조절 측면에서 고강도 인터벌 트레이닝의 효과를 검증한 연구는 미흡한 실정이다. 또한, 운동 강도에 따른 혈당 조절의 긍정적인 효과는 골격근에서 순환계로 방출되는 엑소좀 반응과도 연관이 있을 것으로 판단되나 관련 선행연구는 미흡한 실정이다. 이러한 점에 착안하여 본 연구는 건강한 성인을 대상으로 일회성 고강도 인터벌 운동과 중강도 지속성 운동(moderate-intensity continuous training)이 혈당 항상성 조절과 혈중 엑소좀 농도에 미치는 영향을 비교하는 것을 주요 목적으로 하였다.
본 연구의 대상은 대한민국 수원에 거주하고 의학적 소견이 없으며 자발적 참여를 원하는 신체 건강한 남성 20명(평균 연령 20–30세)으로 하였다. 모든 대상자는 혈압, 혈당, 체중 등에 영향을 미치는 약물을 복용하고 있지 않았으며, 사전에 연구자로부터 연구의 목적과 내용에 대해 충분히 설명을 듣고 참여 동의서 서명 후 실험에 참여하였다. 본 연구는 성균관대학교 연구윤리위원회의 승인을 받아 진행하였다(No. SKKU-2017-06-011-001).
최종 20명의 참여자는 실험 전 1주부터는 규칙적인 운동, 음주, 흡연 등을 통제했고, 신체 구성, 체력검사 등의 기초 조사를 완료한 후 무선 배치 방식으로 고강도 인터벌 운동 집단(n=10)과 중강도 지속성 운동 집단(n=10)으로 세분화하였다. 그런 다음 1차 경구 당부하 검사(oral glucose tolerance test), 7일간 휴식, 1회성 운동(고강도 인터벌 혹은 중강도 지속성 운동), 2차 경구 당부하 검사, 자료 분석의 순서로 실험을 진행하였다(Fig. 1).
Table 1은 중강도 지속성 운동 집단과 고강도 인터벌 운동 집단의 신체적 조건과 심폐 체력을 비교한 결과이다. 두 집단은 평균 연령(p=0.367), 신장(p=0.3331), 체중(p=0.388), 체질량지수(p=0.698)에서 유사한 것으로 나타났다. 심폐 체력의 척도인 분당 최대 산소섭취량 또한 두 집단 간에 유사한 수준인 것으로 확인되었다(p=0.944). 따라서 무작위적 집단 구분이 적절하게 이루어졌다고 판단하였다.
(1) 고강도 인터벌 운동
본 연구의 고강도 인터벌 운동량은 5 km 트레드밀 달리기로 구성하였다. 운동 전 실시한 사전 검사의 개인별 최대 산소섭취량을 근거로, 산소섭취량과 심박수를 이용하여 개인별 회귀식을 산출하고 최대 여유 심박수(maximum heart rate reserve, HRR)의 85% 달리기 1분, 50% 걷기 2분으로 실시하여 5 km 개인별 운동량을 설정하였다.
(2) 중강도 지속성 운동
본 연구의 중강도 지속성 운동량 또한 5 km 트레드밀 달리기로 구성하였다. 운동 전 실시한 사전 검사의 개인별 최대 산소섭취량을 근거로, 산소섭취량과 심박수를 이용하여 개인별 회귀식을 산출하고 최대 HRR의 60% 달리기 또는 걷기로 실시하여 5 km 개인별 운동량을 설정하였다.
모든 종속 변인에 대한 측정은 10–12시간 공복 상태에서 실시하였다. 신장과 체중, 허리둘레, 혈압의 측정은 표준화를 위한 관리지침에 따라 시행하였고, 피험자들이 얇은 옷만 입은 상태에서 측정하였다.
신장(cm)과 체중(kg)은 자동 측정기(DS-102; JENIX)를 이용하여 측정하고, 체질량지수는 체중(kg)/신장(m2) 공식을 이용하여 산출하였다. 혈압은 실험실 도착 후 10분 이상 안정을 취한 후 자동 혈압계(FJ-500R; Jawon Medical)로 측정하였다. 측정은 2회 실시하여 평균값을 기록하고, 측정 간의 시간 간격은 2분으로 하였다.
경구 당부하 검사는 20구경 폴리에틸렌 카테터(20-gauge polyethylene catheter)를 상완정맥에 삽입한 상태에서 정맥 혈액을 채취하고(0분), 75 g 포도당을 복용한 후 30분, 60분, 90분, 120분 경과 시점에서 각각 정맥혈을 채취하였다. 상온에서 약 10분 정도 배양한 후 원심분리 방법으로 혈청을 분리하여 –75 ℃ 초저온 냉동기에 보관하였다. 이렇게 냉동 보관된 혈청을 이용하여 혈당 및 인슐린 농도를 분석하였다.
혈당은 glucose (Bayer) 시약을 이용하여 ADVIA 1650 (Siemens)로 측정하였다. 인슐린 농도는 Insulin RIA kit (Biosource)을 이용하여 Gamma Counter (Hewlett Packard)로 측정하였다. 혈중 엑소좀은 운동 전과 후 공복 상태로 전완 정맥에서 3 mL을 채혈하여 혈청 분리관(serum-separating tube)에 넣고 17,709 ×g으로 3분 동안 원심분리 후, 세포 pellet을 제외한 엑소좀을 포함하는 상층액을 Amicon Ultra Centrifuge Filter (UFC900342; Merk Millipore)를 이용하여 20배 농축하였다.
농축한 배양액은 Eppendorf tube (Sigma-Aldrich)로 옮겨 1:5 비율로 ExoQuick-TCTM (EXOTC50A-1; System Bioscience)을 처리하여 4 ℃에 12시간 동안 방치하고, 12시간 후 4 ℃에서 1,500 ×g으로 30분 동안 원심분리 후 상층액을 제거하였다. 5분 더 원심분리하여 완벽히 상층액을 제거하여 엑소좀을 분리한 다음, phosphate-buffered saline으로 부유시킨 엑소좀은 일반적으로 사용하는 단백질 정량법인 bicinchoninic acid assay으로 농도를 측정하였다22.
트레드밀(Medtrack ST 65; Quinton)과 가스 분석기(True-one; Quinton)를 이용하여 Bruce protocol에 따라 최대 운동부하 검사(VO2max)를 실시하였다. 최대 능력 도달의 기준은 (1) 호흡 교환율(respiratory exchange ratio) 1.15 이상, (2) 자각적 운동 강도 17 이상, (3) 운동 강도와 VO2값의 고원 현상, (4) 자발적 중단 의사 등을 포함하는 4가지 조건에서 2가지 이상 충족할 경우로 하였다23.
본 연구의 모든 자료는 평균과 표준편차로 표기하였고, 가설 검증을 위한 유의수준은 0.05로 설정하였다. 두 집단 간 피험자 특성을 비교하기 위해 일원분산분석(one-way analysis of variance [ANOVA])을 실시하였고, 각 집단의 혈당과 인슐린 반응에서 측정 시기(사전 및 사후)와 시간대별(0분, 30분, 60분, 120분) 상호작용 효과를 알아보기 위해 반복측정 방식의 이원변량분석(two-way ANOVA with repeated measures)을 실시하였다. 사전과 사후 엑소좀 농도에서 집단 간 차이는 이원변량분석을 이용하여 검증하고, 추가로 paired t-tests with Bonferroni correction를 이용하여 사후검증을 실시하였다. 모든 자료에 대한 통계 분석은 IBM SPSS version 28.0 (IBM Corp.)을 이용하였다.
고강도 인터벌 운동 집단과 비교하여 중강도 지속성 운동 집단의 운동시간은 유의하게 더 길었지만(p<0.001), 운동 중에 측정한 심박수 반응을 근거로 추정한 결과 운동 에너지 소모량에서는 두 집단 간에 유의한 차이가 없는 것으로 확인되었다(p=0.175). 이러한 결과로 중강도 지속성 운동과 고강도 인터벌 운동의 운동 지속 시간을 달리하여 강도에 따른 운동 에너지 소모량을 동일하게 하는 isocaloric exercise가 적절하게 수행된 것으로 판단하였다(Table 2).
Fig. 2는 경구 당부하를 이용하여 혈당 항상성 조절에 대한 고강도 인터벌 운동과 중강도 지속성 운동 효과를 비교한 것이다. 경구당 부하에 대한 혈당 반응은 고강도 인터벌 운동에서는 사전보다 사후에 유의하게 감소했지만(F(1,9)=5.623, p=0.028), 중강도 지속성 운동의 경우 사전과 사후에 통계적으로 유의한 수준의 변화는 없는 것으로 나타났다(F(1,9)=3.177, p=0.125). 특히, 고강도 인터벌 운동의 경우 경구당 부하 30분 시점(p<0.050) 및 60분 시점(p<0.050)에서 혈당이 운동 전보다 후에 유의하게 감소한 것으로 나타났다.
Fig. 3은 경구당 부하를 이용하여 혈중 인슐린 항상성에 대한 고강도 인터벌 운동과 중강도 지속성 운동 효과를 비교한 결과다. 경구당 부하에 대한 혈중 인슐린 반응은 고강도 인터벌 운동(F(1,9)=2.418, p=0.181)과 중강도 지속성 운동(F(1,9)=1.636, p=0.248) 모두에서 사전과 사후에 통계적으로 유의한 수준의 변화가 없는 것으로 나타났다.
Fig. 4는 고강도 인터벌 운동과 중강도 지속성 운동 전과 후의 혈중 엑소좀 농도를 비교한 결과다. 혈중 엑소좀 농도는 두 운동 집단 간 사전과 사후에 유의한 상호작용 효과(F(1,19)=11.815, p<0.001)가 있는 것으로 나타났다. 상호작용에 대해서 추가로 사후검증을 실시한 결과, Fig. 5에 제시한 바와 같이 혈중 엑소좀 농도는 고강도 인터벌 운동에서는 사후에 유의하게 증가했지만(p=0.003), 중강도 지속성 운동의 경우 사전과 사후에 유의한 수준의 변화가 없는 것으로 나타났다(p=0.935).
Fig. 6은 고강도 인터벌 운동과 중강도 지속성 운동에 참여한 모든 피검자를 대상으로 운동 전과 후에 변화한 엑소좀과 혈당 수치 간의 상관관계를 나타낸 것이다. 엑소좀 변화 값은 혈당 변화 값과 유의한 부적 상관계수(r=–0.488, p=0.043)를 갖는 것으로 나타났다.
본 연구는 지역사회에 거주하는 외견상 신체 건강한 20–30세 성인 총 20명을 대상으로 혈당 항상성 조절 측면에서 고강도 인터벌 운동과 중강도 지속성 운동의 효과 비교를 통하여 운동 강도의 역할을 검증하는 것을 주요 목적으로 하였다. 혈당 항상성 조절 측면에서 고강도 인터벌 트레이닝에 비해 중강도 유산소 운동이 더 효과적이었고, 혈중 엑소놈 수준 또한 고강도 인터벌 운동 후에 유의하게 증가했지만, 중강도 운동 후에는 통계적으로 유의한 수준의 변화가 없는 것으로 나타났다. 다만, 전신 인슐린 감수성(whole body insulin sensitivity)은 예상과는 달리 고강도 인터벌 운동과 중강도 지속성 운동 모두에서 유의하게 변화가 없는 것으로 나타났다.
이러한 결과를 종합적으로 판단해 볼 때 혈당 항상성 조절 측면에서 고강도 인터벌 운동이 중강도 지속성 운동보다 더 효과적이지만, 이러한 운동 효과 차이는 운동 유형에 따른 전신 인슐린 감수성에서의 차이보다는 혈중 엑소좀 반응에서의 차이와 연관이 있을 것으로 생각된다. 다만, 혈당 항상성 조절은 골격근, 간, 지방 조직, 신장(kidneys) 등과 같은 인슐린 감수성 조직에서의 인슐린 의존성 당 수송체와 비의존성 당 수송체 활성화에 의해서 결정되지만4, 본 연구에서는 이러한 당 수송체의 세부적인 역할을 구분하지 못하였다. 다시 말해, 중강도 지속성 트레이닝과 비교하여 고강도 인터벌 트레이닝이 전신 인슐린 감수성에서는 차이가 없었지만, 인슐린 의존성 당 수송체 혹은 인슐린 비의존성 당 수송체를 더 효과적으로 활성화하였고, 그 결과가 혈당 항상성 조절에 더 효과적으로 작용했을 가능성을 배제할 수 없다. 이러한 점을 감안할 때 본 연구에서 분석한 전신 인슐린 감수성은 인슐린 의존성과 인슐린 비의존성의 역할을 명확하게 구분할 수 없기에, 인슐린 상승 유글리세믹 크램프(hyperinsulinemic euglycemic clamp)과 같은 더 세밀한 방법을 이용하는 추가 연구가 필요하다.
혈당 항상성 조절 측면에서 연구의 결과는 선행연구의 결과와 부분적으로 일치하였다. 예를 들어, Mitranun 등24은 2형 당뇨 환자를 대상으로 고강도 인터벌 트레이닝과 중강도 지속성 트레이닝 효과를 검증한 결과, 혈당과 체지방 측면에서 둘 다 모두 효과적이었지만 당화혈색소는 고강도 인터벌 트레이닝이 중강도 지속성 트레이닝에 비해 더 효과적이었다고 보고하였다. 유사한 임상연구 실험 결과도 동물실험을 통하여 입증되고 있다. Chavanelle 등25이 비만 마우스(db/db mice)를 대상으로 실험한 결과에서 혈당 조절과 골격근 미토콘드리아 기능 측면에서 고강도 인터벌 트레이닝이 중강도 지속성 트레이닝에 비해 상대적으로 더 효과적이라고 보고하였다. 이들은 당뇨병에 걸린 마우스를 대상으로 주 5회 10주간의 고강도 인터벌 운동과 중강도 지속성 운동 효과를 비교한 결과, 고강도 인터벌 운동군에서 혈당이 유의하게 감소하였고, 근육에 glucose transporter type 4 (GLUT4)의 발현량이 2배로 유의하게 증가하였다고 보고하였다. 이러한 선행연구의 결과를 종합해 볼 때 본 연구에서 고강도 인터벌 운동이 중강도 유산소 운동보다 혈당 항상성 조절에 더 효과적인 이유는 골격근의 인슐린 감수성과 밀접한 연관이 있을 것으로 판단되며, 따라서 이러한 부분을 고려하여 생물학적 기전을 구명하는 후속 연구가 필요할 것이다.
중강도 지속성 운동보다 고강도 인터벌 운동 후의 혈중 엑소좀 농도가 유의하게 증가한 이유는 명확하지는 않지만, 선행연구의 결과와 부분적으로 일치하였다. Frühbeis 등21은 건강한 사람을 대상으로 점증적 부하 운동 후 혈중의 엑소좀 농도를 분석한 결과, 운동 직후 강도 의존적으로 엑소좀 농도가 증가했다고 보고했다. 또한, 최근의 동물실험 결과는 고강도 운동의 혈당 항상성과 인슐린 감수성 개선 효과는 엑소좀의 small interfering RNA를 통하여 유도되는 것으로 보고하고 있다. Castaño 등26은 동물실험을 통해 훈련된 마우스 혈액에서 추출한 엑소좀을 훈련되지 않은 마우스에 주입한 결과 당 내인성, 인슐린 감수성, 혈중 중성지방이 개선되는 효과를 유도했다. 훈련된 마우스의 골격근 엑소좀을 추출하여 분석한 결과 miR-133a와 miR-133b 발현이 유의하게 증가한 것으로 나타났으며, miR-133b를 주입한 결과 간 조직의 인슐린 조절 전사 인자(insulin-regulated transcription factor forkhead box O1) 발현을 억제하고, 골격근의 GLUT4 발현을 증가시켜 혈당 항상성 조절 개선을 유도하는 것으로 보고하였다. 임상연구에서도 골격근 엑소좀의 miRNAs는 1회성 지구력 운동 직후에 증가한 것으로 보고하였다. 그럼에도 불구하고 혈중 엑소좀은 1회성 운동에 반응하지 않는다고 보고한 상반된 선행연구도 있기에 1회성 운동 후 회복기, 장기간 운동 트레이닝 전과 후에 혈중과 골격근 엑소좀의 miRNAs 분석을 포함하는 추가 연구가 필요할 것이다27. 특히, 고강도 인터벌 운동에 대한 엑소좀 반응이 골격근의 인슐린 감수성과 혈당 항상성 조절에 미치는 긍정적인 효과를 유도하는 생물학적 기전을 규명하는 후속 연구가 필요하다 하겠다.
마지막으로 고강도 인터벌 운동과 중강도 지속성 운동 간에 혈당 항상성 조절 차이는 운동 후 회복기 에너지 소모량 차이와도 연관이 있을 수 있다. 예를 들어, Larsen 등28은 남성 대사증후군 환자를 대상으로 최대 심박수 70%의 중강도 유산소 운동과 85%–95%의 고강도 인터벌 운동의 1회 지속 시간을 달리하여 같은 에너지 소비량을 유도하는 isocaloric exercise를 통하여 운동 후 초과 산소소모량(excessive post-exercise oxygen consumption)을 비교한 결과에서도 고강도 인터벌 운동이 중강도 유산소 운동보다 더 효과적이었다고 보고하였다. Hazell 등29도 운동 지속 시간을 달리하여 에너지 소비량을 동질화시킨 VO2max 70% 중강도 운동(30분) 및 105% 고강도 인터벌 운동(2분) 후 24시간 산소소모량을 비교한 결과 중강도 운동보다 고강도 인터벌 운동이 더 효과적인 것으로 보고하였다. 다만 본 연구에서는 운동 후 회복기 산소소모량을 정량화하지 않아 직접적인 비교는 어렵기에, 이 부분을 고려하는 후속 연구가 필요할 것으로 생각한다.
본 연구의 제한점으로는 첫째, 인슐린 저항성이나 대사질환에 노출되지 않은 건강한 성인을 대상으로 하였기에 전신 인슐린 감수성 반응에서 유의미한 차이가 나타나지 않았을 수도 있기에 연구결과의 일반화를 위해서는 비만과 당뇨 환자를 대상으로 하는 재현 실험이 필요할 것이다. 둘째, 혈중 엑소좀은 인슐린 감수성 조직(예, 지방, 골격근, 간 등) 등 다양한 조직에서 방출될 수 있다. 따라서 고강도 인터벌 운동 후 증가한 혈중 엑소좀 의 유래가 명확하지 않기에 운동에 대한 엑소좀 반응에 대한 명확한 결론을 내리기 위해서는 골격근 생검을 추가하는 연구가 필요할 것이다. 셋째, 본 연구에서는 혈중 엑소좀의 총량을 정량화했지만 엑소좀은 크기와 기능이 다르게 때문에 세분화하여 분석할 필요가 있다30. 넷째, 본 연구에서는 중강도 지속성 트레이닝과 고강도 인터벌 트레이닝의 운동 지속 시간을 달리하여 운동 에너지 소모량을 가능한 최대한으로 동일하게 하였다. 그럼에도 불구하고 본 연구에서는 운동 에너지 소모량을 직접적으로 측정한 것이 아니라 심박수 반응과 에너지 소모량 간의 회귀식을 활용하여 추정했기 때문에 두가지 트레이닝 방법 간에 실제 운동 에너지 소모량이 차이가 일어났을 가능성을 완전히 배제할 수 없을 것으로 판단된다.
결론적으로 본 연구에서는 20–30대의 건강한 남성을 대상으로 혈당 항상성 조절과 혈중 엑소좀 농도에 대한 고강도 인터벌 운동과 중강도 지속성 운동의 효과를 비교했다. 그 결과 혈당 항상성 조절은 고강도 인터벌 운동 후에 유의하게 개선되었고, 혈중 엑소좀 농도도 증가하였다. 이러한 결과를 종합해 볼 때 혈당 항상성 조절 측면에서 고강도 인터벌 운동은 중강도 유산소 운동보다 그 효과가 상대적으로 더 우수한 것으로 나타났으며, 이러한 운동 효과의 차이는 전신 인슐린 감수성보다는 혈중 엑소좀 반응과 밀접한 연관이 있다고 하겠다.
REFERENCES
1. Parkash J, Chaudhry MA, Amer AS, Christakos S, Rhoten WB. 2002; Intracellular calcium ion response to glucose in beta-cells of calbindin-D28k nullmutant mice and in betaHC13 cells overexpressing calbindin-D28k. Endocrine. 18:221–9. DOI: 10.1385/ENDO:18:3:221. PMID: 12450313.
2. Albert MA, Glynn RJ, Ridker PM. 2004; Effect of physical activity on serum C-reactive protein. Am J Cardiol. 93:221–5. DOI: 10.1016/j.amjcard.2003.09.046. PMID: 14715354.
3. Reaven GM. 1988; Banting lecture 1988. Role of insulin resistance in human disease. Diabetes. 37:1595–607. DOI: 10.2337/diab.37.12.1595. PMID: 3056758.
4. Sampath Kumar A, Maiya AG, Shastry BA, et al. 2019; Exercise and insulin resistance in type 2 diabetes mellitus: a systematic review and meta-analysis. Ann Phys Rehabil Med. 62:98–103. DOI: 10.1016/j.rehab.2018.11.001. PMID: 30553010.
5. Borghouts LB, Keizer HA. 2000; Exercise and insulin sensitivity: a review. Int J Sports Med. 21:1–12. DOI: 10.1055/s-2000-8847. PMID: 10683091.
6. Davis ME, Blake C, Perrotta C, Cunningham C, O'Donoghue G. 2022; Impact of training modes on fitness and body composition in women with obesity: a systematic review and meta-analysis. Obesity (Silver Spring). 30:300–19. DOI: 10.1002/oby.23305. PMID: 35088563.
7. Sherwood NE, Jeffery RW, French SA, Hannan PJ, Murray DM. 2000; Predictors of weight gain in the pound of prevention study. Int J Obes Relat Metab Disord. 24:395–403. DOI: 10.1038/sj.ijo.0801169. PMID: 10805494.
8. Chiu CH, Ko MC, Wu LS, et al. 2017; Benefits of different intensity of aerobic exercise in modulating body composition among obese young adults: a pilot randomized controlled trial. Health Qual Life Outcomes. 15:168. DOI: 10.1186/s12955-017-0743-4. PMID: 28836987. PMCID: PMC5571495.
9. Mougios V, Kazaki M, Christoulas K, Ziogas G, Petridou A. 2006; Does the intensity of an exercise programme modulate body composition changes? Int J Sports Med. 27:178–81. DOI: 10.1055/s-2005-865625. PMID: 16541371.
10. Alkahtani S. 2014; Comparing fat oxidation in an exercise test with moderate-intensity interval training. J Sports Sci Med. 13:51–8.
11. Kessler HS, Sisson SB, Short KR. 2012; The potential for high-intensity interval training to reduce cardiometabolic disease risk. Sports Med. 42:489–509. DOI: 10.2165/11630910-000000000-00000. PMID: 22587821.
12. Miyashita M, Burns SF, Stensel DJ. 2008; Accumulating short bouts of brisk walking reduces postprandial plasma triacylglycerol concentrations and resting blood pressure in healthy young men. Am J Clin Nutr. 88:1225–31.
13. Campbell L, Wallman K, Green D. 2010; The effects of intermittent exercise on physiological outcomes in an obese population: continuous versus interval walking. J Sports Sci Med. 9:24–30.
14. Campos EZ, Bastos FN, Papoti M, Freitas Junior IF, Gobatto CA, Balikian Junior P. 2012; The effects of physical fitness and body composition on oxygen consumption and heart rate recovery after high-intensity exercise. Int J Sports Med. 33:621–6. DOI: 10.1055/s-0031-1295442. PMID: 22706939.
15. Zhang Y, Liu Y, Liu H, Tang WH. 2019; Exosomes: biogenesis, biologic function and clinical potential. Cell Biosci. 9:19. DOI: 10.1186/s13578-019-0282-2. PMID: 30815248. PMCID: PMC6377728.
16. Kalluri R, LeBleu VS. 2020; The biology, function, and biomedical applications of exosomes. Science. 367:eaau6977. DOI: 10.1126/science.aau6977. PMID: 32029601. PMCID: PMC7717626.
17. Camussi G, Deregibus MC, Bruno S, Grange C, Fonsato V, Tetta C. 2011; Exosome/microvesicle-mediated epigenetic reprogramming of cells. Am J Cancer Res. 1:98–110.
18. Müller G. 2012; Microvesicles/exosomes as potential novel bio-markers of metabolic diseases. Diabetes Metab Syndr Obes. 5:247–82. DOI: 10.2147/DMSO.S32923. PMID: 22924003. PMCID: PMC3422911.
19. Aswad H, Forterre A, Wiklander OP, et al. 2014; Exosomes participate in the alteration of muscle homeostasis during lipid-induced insulin resistance in mice. Diabetologia. 57:2155–64. DOI: 10.1007/s00125-014-3337-2. PMID: 25073444. PMCID: PMC4153976.
20. Safdar A, Saleem A, Tarnopolsky MA. 2016; The potential of endurance exercise-derived exosomes to treat metabolic diseases. Nat Rev Endocrinol. 12:504–17. DOI: 10.1038/nrendo.2016.76. PMID: 27230949.
21. Frühbeis C, Helmig S, Tug S, Simon P, Krämer-Albers EM. 2015; Physical exercise induces rapid release of small extracellular vesicles into the circulation. J Extracell Vesicles. 4:28239. DOI: 10.3402/jev.v4.28239.
22. Stoscheck CM. 1990; Quantitation of protein. Methods Enzymol. 182:50–68. DOI: 10.1016/0076-6879(90)82008-P. PMID: 2314256.
23. American College of Sports Medicine (ACSM). ACSM's guidelines for exercise testing and prescription. 6th ed. Lippincott Williams and Wilkins;2000.
24. Mitranun W, Deerochanawong C, Tanaka H, Suksom D. 2014; Continuous vs interval training on glycemic control and macro- and microvascular reactivity in type 2 diabetic patients. Scand J Med Sci Sports. 24:e69–76. DOI: 10.1111/sms.12112. PMID: 24102912.
25. Chavanelle V, Boisseau N, Otero YF, et al. 2017; Effects of high-intensity interval training and moderate-intensity continuous training on glycaemic control and skeletal muscle mitochondrial function in db/db mice. Sci Rep. 7:204. DOI: 10.1038/s41598-017-00276-8. PMID: 28303003. PMCID: PMC5427962.
26. Castaño C, Mirasierra M, Vallejo M, Novials A, Párrizas M. 2020; Delivery of muscle-derived exosomal miRNAs induced by HIIT improves insulin sensitivity through down-regulation of hepatic FoxO1 in mice. Proc Natl Acad Sci U S A. 117:30335–43. DOI: 10.1073/pnas.2016112117.
27. Wilhelm EN, Mourot L, Rakobowchuk M. 2018; Exercise-derived microvesicles: a review of the literature. Sports Med. 48:2025–39. DOI: 10.1007/s40279-018-0943-z. PMID: 29868992.
28. Larsen I, Welde B, Martins C, Tjønna AE. 2014; High- and moderate-intensity aerobic exercise and excess post-exercise oxygen consumption in men with metabolic syndrome. Scand J Med Sci Sports. 24:e174–9. DOI: 10.1111/sms.12132. PMID: 24118097.
29. Hazell TJ, Olver TD, Hamilton CD, Lemon PW. 2012; Two minutes of sprint-interval exercise elicits 24-hr oxygen consumption similar to that of 30 min of continuous endurance exercise. Int J Sport Nutr Exerc Metab. 22:276–83. DOI: 10.1123/ijsnem.22.4.276. PMID: 22710610.
30. Nielsen S, Scheele C, Yfanti C, et al. 2010; Muscle specific microRNAs are regulated by endurance exercise in human skeletal muscle. J Physiol. 588(Pt 20):4029–37. DOI: 10.1113/jphysiol.2010.189860. PMID: 20724368. PMCID: PMC3000590.
Fig. 1
Overall description of study design. MICT: moderate-intensity continuous training, HIIT: high-intensity interval training.
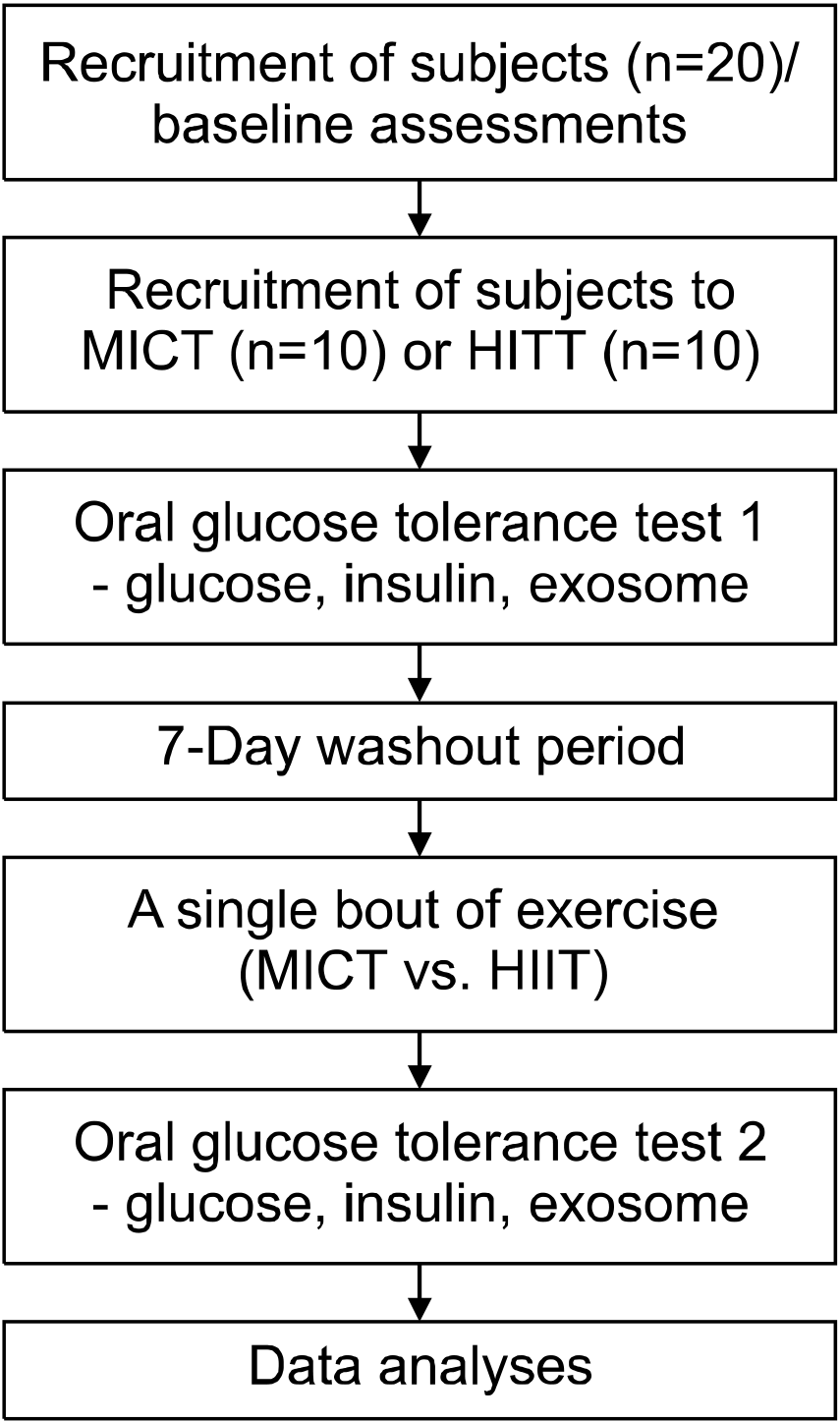
Fig. 2
Effect of high-intensity interval training (A) and moderate-intensity continuous training (B) on blood glucose responses to oral glucose lading.
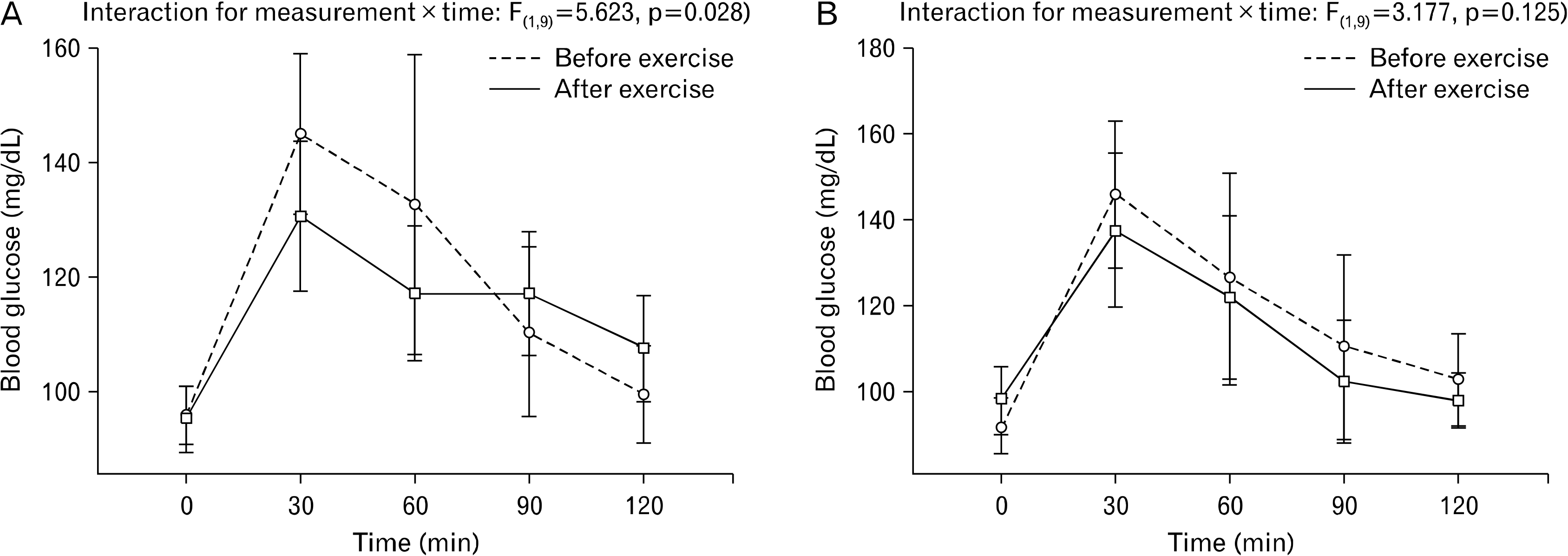
Fig. 3
Effect of high-intensity interval training (A) and moderate-intensity continuous training (B) on blood insulin responses to oral glucose lading.
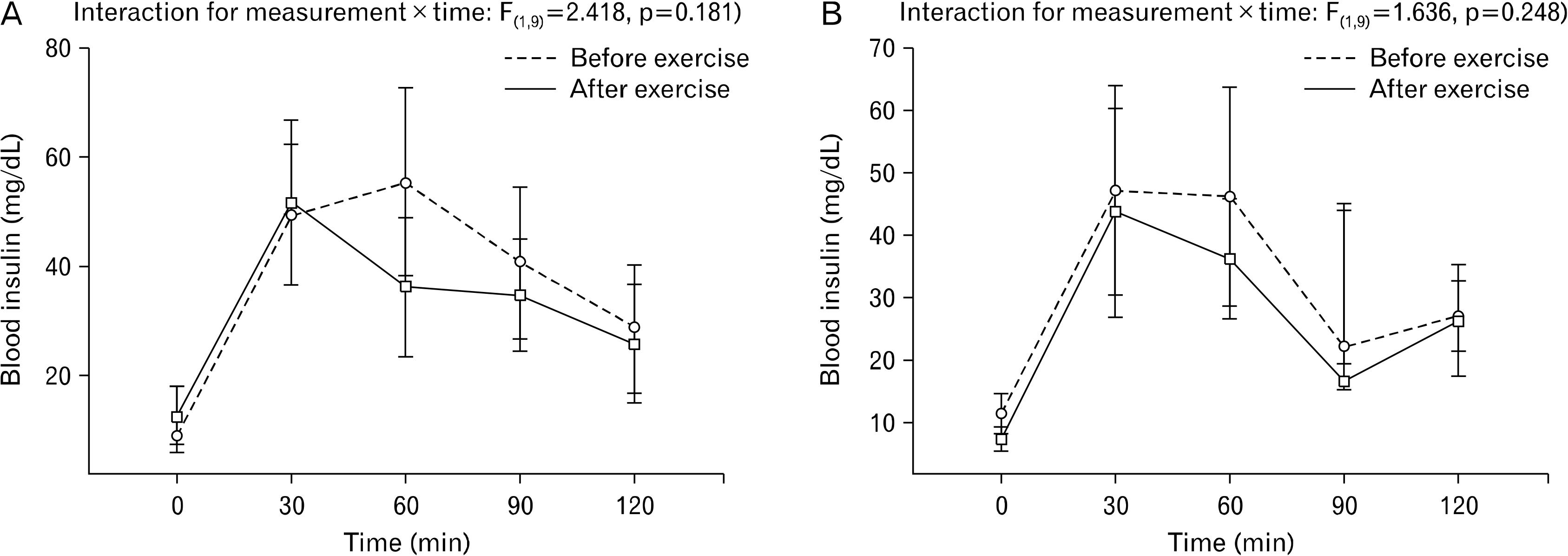
Fig. 4
Effect of high-intensity interval training (HIIT) and moderate-intensity continuous training (MICT) on blood exosome concentrations.
Fig. 5
Paired t-tests with Bonferroni correction on blood exosome concentrations before and after exercise in high-intensity interval training and moderate-intensity continuous training.
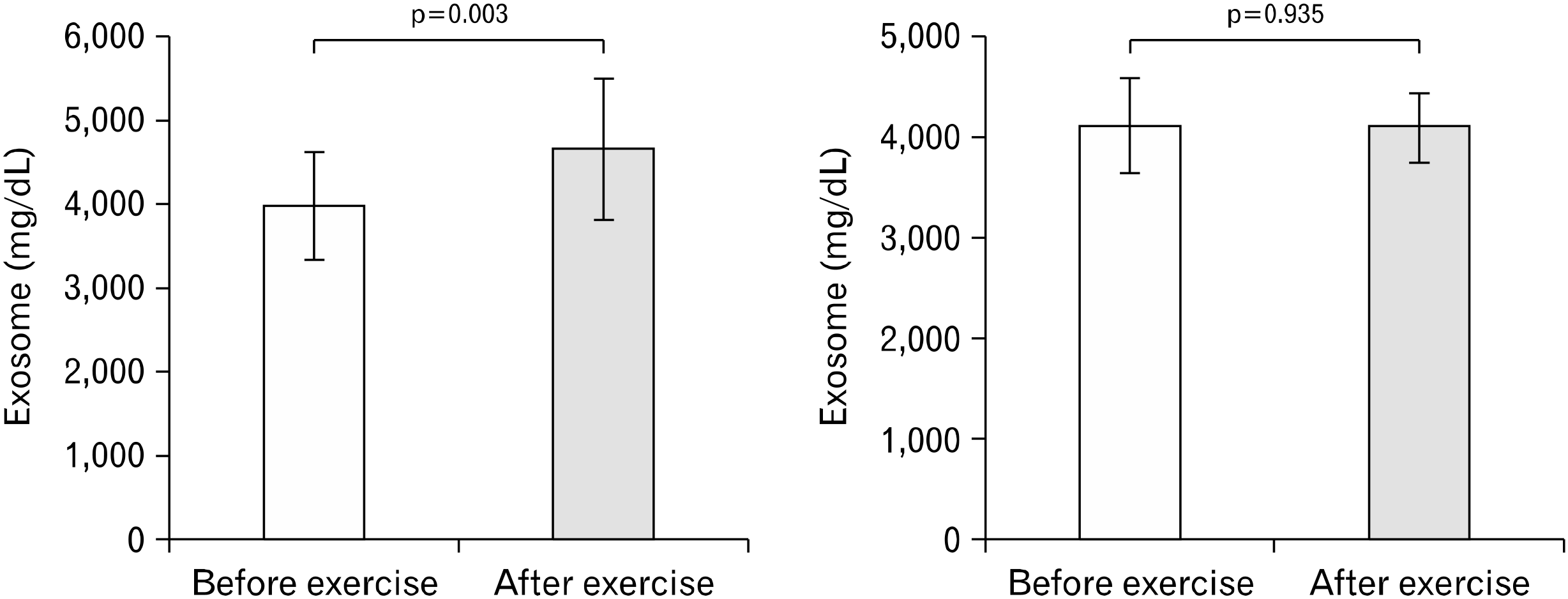
Fig. 6
Scatter plotting of changed blood exosome and changed fasting blood glucose (FBG) concentrations in the total study group.
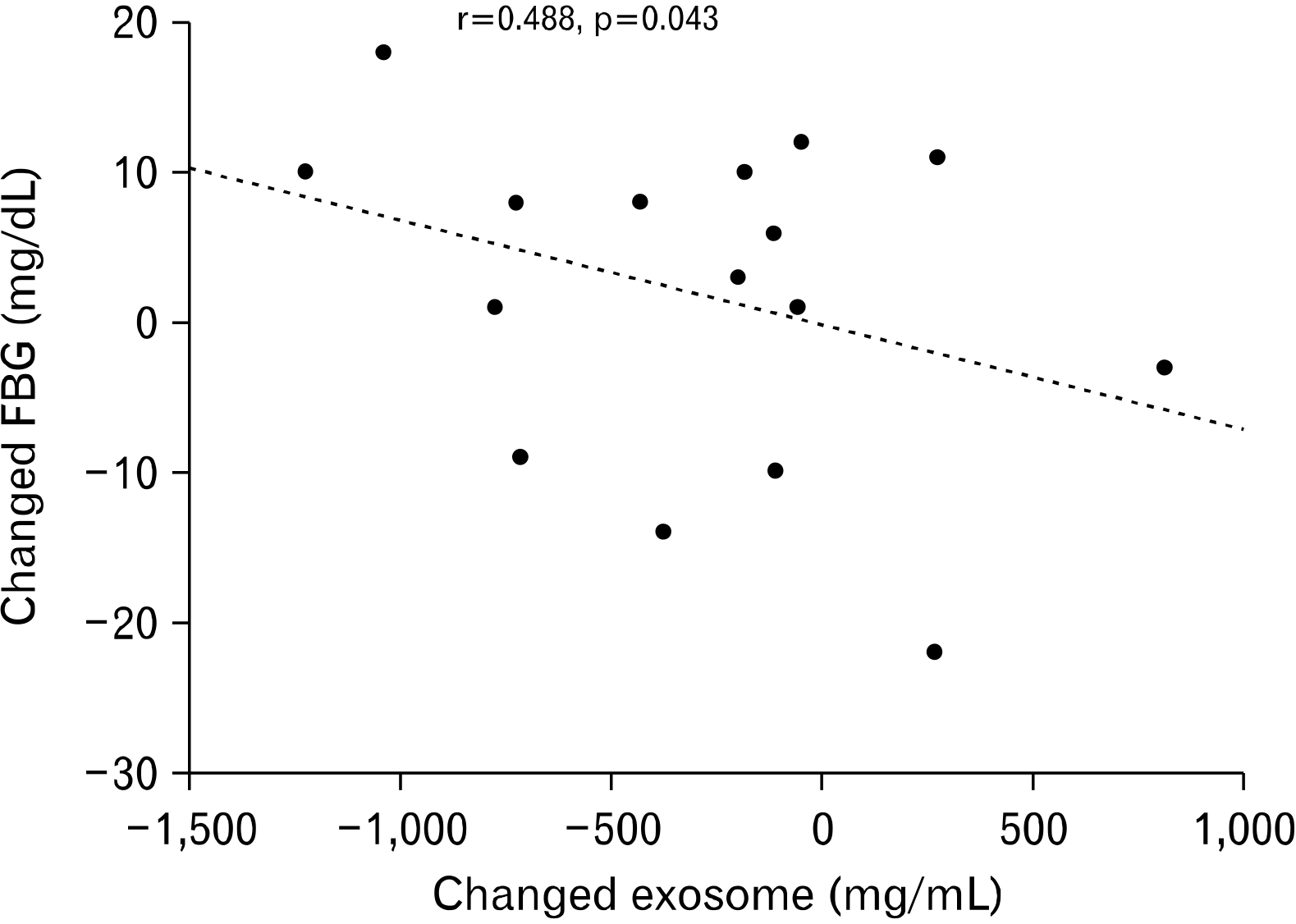
Table 1
Characteristics of study participants




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download