This article has been
cited by other articles in ScienceCentral.
Abstract
Background and Objectives
Parotid cancer is a rare malignancy tumor, constituting about 3% of head and neck cancers. Treatment of parotid carcinoma is challenging because of its rarity and unpredictable clinical course. Therefore, it is important to evaluate risk factors associated with prognosis and to predict adverse outcomes. In this article, we aimed to analyze risk factors associated with recurrence free survival in our 10-year single center retrospective study.
Subjects and Method
Retrospective medical chart review was performed for patients with parotid gland cancer who underwent parotidectomy with or without adjuvant treatment in our institute 2011 to 2020. Patient demographics, histopathologic results, operative method, treatment outcome were assessed.
Results
A total of 8 patients (15%) experienced recurrence. Old age and low body mass index was associated with recurrence. Univariate analysis also revealed that high clinical stage, tumor involvement in deep lobe and facial nerve, postoperative radiotherapy or concurrent chemo radiotherapy, positive resection margin, and high histologic grade were statistically significant with recurrence. Multivariate analysis concluded that facial nerve involvement with tumor was associated with higher incidence of recurrence. Deep lobe and facial nerve involvement, postoperative radiotherapy or concurrent chemo radiotherapy, positive resection margin, clinical stage, and histologic grade were statistically significant factors associated with recurrence free survival.
Conclusion
Our 10-year single institute study will be helpful for predicting adverse outcomes in parotid cancer patients.
Go to :

Keywords: Parotid cancer, Recurrence, Risk factors, Survival
서 론
전체 두경부 악성종양 중 침샘암종이 차지하는 비율은 약 3% 정도이며, 침샘 종양 중 70%는 이하선에서 발생하는 것으로 알려져 있다. 이처럼 이하선암종은 두경부 암종의 작은 부분을 차지하기에 연구에 제한이 있으며, 병리학적 병명이 40종류에 이르며 종양의 유형에 따라 다양한 임상적 특징을 나타내는 것으로 알려져 있다. 이하선암의 복잡한 병리조직학적 특성상 진단 및 치료에 이견이 많으며, 특히 예후 예측에 있어서 상대적으로 어려운 암 중 하나이다[
1].
특히, 이하선암종의 예후를 예측하는데 관여하는 인자들은 다양한 것으로 보고되어 있으나, 국내에서 이하선암종의 재발 및 예후에 관한 문헌을 찾기 어렵다. 따라서 저자들은 단일기관에서 10년간 이하선암 환자들을 대상으로 후향적 연구를 시행하여 이하선암종의 재발 및 무병생존율에 관여하는 인자들을 분석하여 향후 진단 및 치료의 지표로 삼는데 도움을 얻고자 한다.
Go to :

대상 및 방법
2011년부터 2020년까지 10년간 단일기관에서 이하선암종으로 수술적 치료를 받은 58명의 환자(남자 30명, 여자 28명)를 대상으로 의무기록을 후향적으로 분석하였으며 소속 기관의 임상시험심사위원회의 승인을 받았다(IRB No. 2021-0781). 병리조직검사상 림프종, 전이성 암종인 경우는 제외하였다.
술전 CT 및 초음파 소견에 따라서 임상적 TNM 병기 설정을 하였고, 이는 American Joint Committee on Cancer (AJCC) 7판에 근거하였다. 최종 병리학적 병기는 early, late stage로 이분화하였고, early stage는 1기, 2기, late stage는 3기, 4기로 선정하였다. T stage 역시 T1, T2를 early T stage, T3, T4를 late T stage로 구분하였다. N stage 역시 이분화하였는데, N0 군과 N1-N3로 나누어 분석하였다. 술전 영상 검사를 토대로 종양 부피를 계산하였고, 종양 부피(V)=(종양 너비[W]
2×종양 길이[L])/2와 같은 식으로 계산하였다[
2].
총 58명의 환자가 모두 수술적 치료를 받았으며, 수술 범위의 설정은 TNM 병기, 영상 검사, 술자의 판단에 따라 진행되었다. 천엽 절제술의 적응증은 세침흡인검사상 저악성도 암종이거나 양성종양인 경우, 술전 안면 신경마비의 임상적 증상이 없는 경우에 실시하였다. 안면신경 침범 여부는 술전 안면마비가 확인된 경우, 혹은 수술 중 종양의 안면신경으로 육안적 침범이 확인된 경우로 정의하였다. 술전 영상 검사상 병적인 경부 임파선 비대 혹은 세침흡인검사상 경부 림프절 전이가 확인된 경우, 고등급암종이 의심되는 경우, 경부 절제술을 시행하였다. 술전 영상 검사를 토대로 이하선 심엽의 침범 여부를 판단하였다.
수술 후 병리검사결과를 토대로 수술 절제연, 림프혈관계 침윤, 신경 침범 여부 등을 예후 인자로 분석하였다. 수술 절제연은 clear, close, positive로 나누었으며, clear는 절제연이 암종에서 5 mm 이상 위치한 경우, close는 1-5 mm, positive는 1 mm 미만으로 정의하였다.
술후 치료는 크게 두 종류로서 방사선치료와 항암방사선 치료를 시행하였고, 술후 치료 여부는 조직병리결과와 등급, 수술 절제연 양성 여부(positive resection margin) 등을 고려하여 결정하였다. 수술 전후 안면마비의 평가는 House Brackman grade를 사용하였으며 모든 환자는 수술 중 안면신경 감시 장치를 적용하였다.
Comorbidity index는 Bøje 등[
3]이 두경부암에서 동반 질환 유무에 따른 무병생존율 분석 연구에서 제시한 comorbidity index를 참고하였다. 최종 병리검사결과를 토대로 AJCC 7판에 근거하여 병기 설정을 하였다. 병리조직등급으로는 Kelley와 Spiro [
4]의 분류에 따라 고악성도암종은 중등도 및 고악성도 점액표피양암종, 선암종, 상피근암, 이하선관암종, 호산구 과립세포암종 등을 포함하였고, 저악성도암종은 저악성도 점액표피양암종, 선양낭성암종, 선방세포암종 등을 포함하였다. 무병생존율 기간의 평가는 수술 시점으로부터 재발 시점까지의 기간으로 정의하였다. 선양낭성암종 중 solid type은 고악성도암종, 나머지는 저악성도 및 중등도암종으로 분류하였다.
통계학적 분석
본 논문의 통계적 자료 분석은 SPSS version 19 (IBM Corp., Armonk, NY, USA)를 이용하였다. 재발 여부에 영향을 미치는 예후 인자를 탐색하기 위해 이산형 예후 인자와 재발여부간의 독립성 여부는 카이제곱 검정(chi-square test)을 실시하였고, 연속형 변수는 T-test 또는 Mann-Whitney 검정을 통해 분석하였다. 재발에 걸리는 시간에 대한 예후 인자 분석으로 칵스 비례위험모형(Cox proportional hazards model)을 이용하였으며, Graphpad Prism 7 (GraphPad Software, San Diego, CA, USA)을 이용하여 카플란 마이어 생존 분석 곡선을 그리고 log rank 검정을 시행하여 변수들 간의 유의미한 차이를 확인하였다. 모든 검정에서 통계적 유의성은 p-value가 0.05 이하인 경우로 판정하였다.
Go to :

결 과
수술 전 검사로는 세침흡인검사를 53예에서 시행하였고, 5예에서는 시행하지 않았다. 원발병소의 치료로는 천엽 절제술은 30예, 전절제술은 28예였다. 58예 중 32예에서 경부절제술을 시행하였고, 이하선전절제술 28예 중 25예에서 경부절제술을 같이 시행하였고, 이하선천엽절제술 30예 중 7예에서 경부절제술을 시행하였다.
병리조직 검사상 점액표피암종(mucoepidermoid carcinoma)이 21예로 가장 높은 빈도를 보였으며, 이하선관암종(salivary duct carcinoma)이 11예, 선양낭성암종(adenoid cystic carcinoma)이 8예, 선방세포암종(acinic cell carcinoma)이 8예, 선암종(adenocarcinoma)이 4예, 상피근암(myoepithelial carcinoma), 호산구과립세포암(oncocytic carcinoma), 기타(육종, 신경내분비암종)가 각각 2예였다. 병리조직 등급으로는 저악성도 및 중등도 37예, 고악성도가 21예로 분류되었다(
Table 1).
Table 1.
Histopathologic type of patients (n=58)
|
Histopathologic type |
n (%) |
|
Mucoepidermoid carcinoma |
21 (36.2) |
|
Salivary duct carcinoma |
11 (19.0) |
|
Acinic cell carcinoma |
8 (13.8) |
|
Adenoid cystic carcinoma |
8 (13.8) |
|
Adenocarcinoma |
4 (7.0) |
|
Myoepithelial carcinoma |
2 (3.4) |
|
Oncocytic carcinoma |
2 (3.4) |
|
Other (sarcoma, neuroendcorine carcincoma) |
2 (3.4) |

술후 보조조치료를 시행한 군은 30명이었으며, 방사선치료를 받은 군 13명, 항암방사선치료 병합 요법(concurrent chemoradiotherapy)을 받은 군 15명이었다. 총 흡수선량 평균 60 Gy (24-70 Gy)이었으며, 대부분 33회 정도의 방서선 치료가 진행되었고, 1명은 부작용 등의 이유로 치료 중단하였다. 항암방사선치료 병합 요법은 cisplatin 기반의 항암요법이 진행되었다.
추적 관찰 기간은 평균 1047일(최저 9일-최장 3622일)로, 총 58명의 환자 중 8명이 재발하였고, 이 중 4명이 수술부위의 국소 재발에서 있었으며, 3명이 원격전이가 있었으며, 2명은 폐와 간, 1명은 림프절 및 피부 쪽으로 원격전이가 있었다. 나머지 1명은 국소 및 원격전이가 동시에 나타났다. 재발 여부에 따라 환자들의 특성 및 종양 특성이
Table 2에 제시되어 있다.
Table 2.
Clinicopathologic factors associated with recurrence
|
Factors |
Recurrence
|
p-value |
|
Yes (n=8) |
No (n=50) |
|
Age (year) |
67.25±13.55 |
53.62±16.59 |
0.032*
|
|
Sex |
|
|
0.386 |
|
Male |
3 (37.5) |
27 (54.0) |
|
|
Female |
5 (62.5) |
23 (46.0) |
|
|
BMI (kg/m2) |
22.36±2.15 |
24.96±3.14 |
0.027*
|
|
Comorbidity index |
|
|
0.212 |
|
0 |
3 (54.0) |
34 (68.0) |
|
|
1 or more |
5 (46.0) |
16 (32.0) |
|
|
Tumor volume |
34.14 |
22.85 |
0.049*
|
|
Resection margin |
|
|
0.008†
|
|
Clear |
0 (0) |
24 (51.1) |
|
|
Close or positive |
8 (100) |
23 (49.9) |
|
|
Clinical stage |
|
|
0.005†
|
|
Early stage |
0 (0) |
26 (53.1) |
|
|
Late stage |
8 (100) |
23 (46.9) |
|
|
Clinical T stage |
|
|
0.016*
|
|
Early T stage |
4 (50.0) |
43 (86.0) |
|
|
Late T stage |
4 (50.0) |
7 (14.0) |
|
|
Clinical N stage |
|
|
0.001†
|
|
N0 |
3 (37.5) |
44 (88.0) |
|
|
N1-3 |
5 (62.5) |
6 (12.0) |
|
|
Facial nerve involvement |
|
|
<0.001†
|
|
No |
1 (12.5) |
40 (80.0) |
|
|
Yes |
7 (87.5) |
10 (20.0) |
|
|
Deep lobe involvement |
|
|
0.014*
|
|
No |
2 (25.0) |
35 (70.0) |
|
|
Yes |
6 (75.0) |
15 (30.0) |
|
|
Perineural invasion |
|
|
0.134 |
|
No |
2 (33.3) |
28 (65.1) |
|
|
Yes |
4 (66.7) |
15 (34.9) |
|
|
Lymphovascular invasion |
|
|
0.087 |
|
No |
3 (60.0) |
38 (92.7) |
|
|
Yes |
2 (40.0) |
3 (7.3) |
|
|
Adjuvant treatment |
|
|
0.017*
|
|
Not done |
1 (12.5) |
29 (58.0) |
|
|
Done (CCRT or RT only) |
7 (87.5) |
21 (42.0) |
|
|
Postoperative facial palsy |
|
|
0.006†
|
|
No |
2 (25.0) |
37 (74.0) |
|
|
Yes |
6 (75.0) |
13 (26.0) |
|
|
Pathologic grade |
|
|
<0.001†
|
|
Low to intermediate grade |
0 (0) |
37 (74.0) |
|
|
High grade |
8 (100) |
13 (26.0) |
|

이산형 예후 인자들과 재발 여부를 분석한 독립 검정 상임상적 병기, 종양의 심엽 및 안면신경 침범 여부, 수술 절제연, 술후 안면마비 발생, 술후 항암요법 여부, 조직학적 등급 등이 재발에 유의미한 차이가 있었다. 나이는 재발군에서 유의미하게 높았으며, body mass index (BMI)는 재발군에서 유의미하게 낮았다.
무병생존기간과 변수들 간의 카플란 마이어 생존분석에서, 수술 절제연, 임상적 병기, 종양의 심엽 및 안면신경 침범 여부, 조직학적 등급, 술후 항암요법 시행 여부 등이 유의미한 차이가 있음을 확인하였다(
Fig. 1). 다변량분석에서 종양의 안면신경 침범이 재발과 유의미한 관계가 있음을 확인하였다(
Table 3).
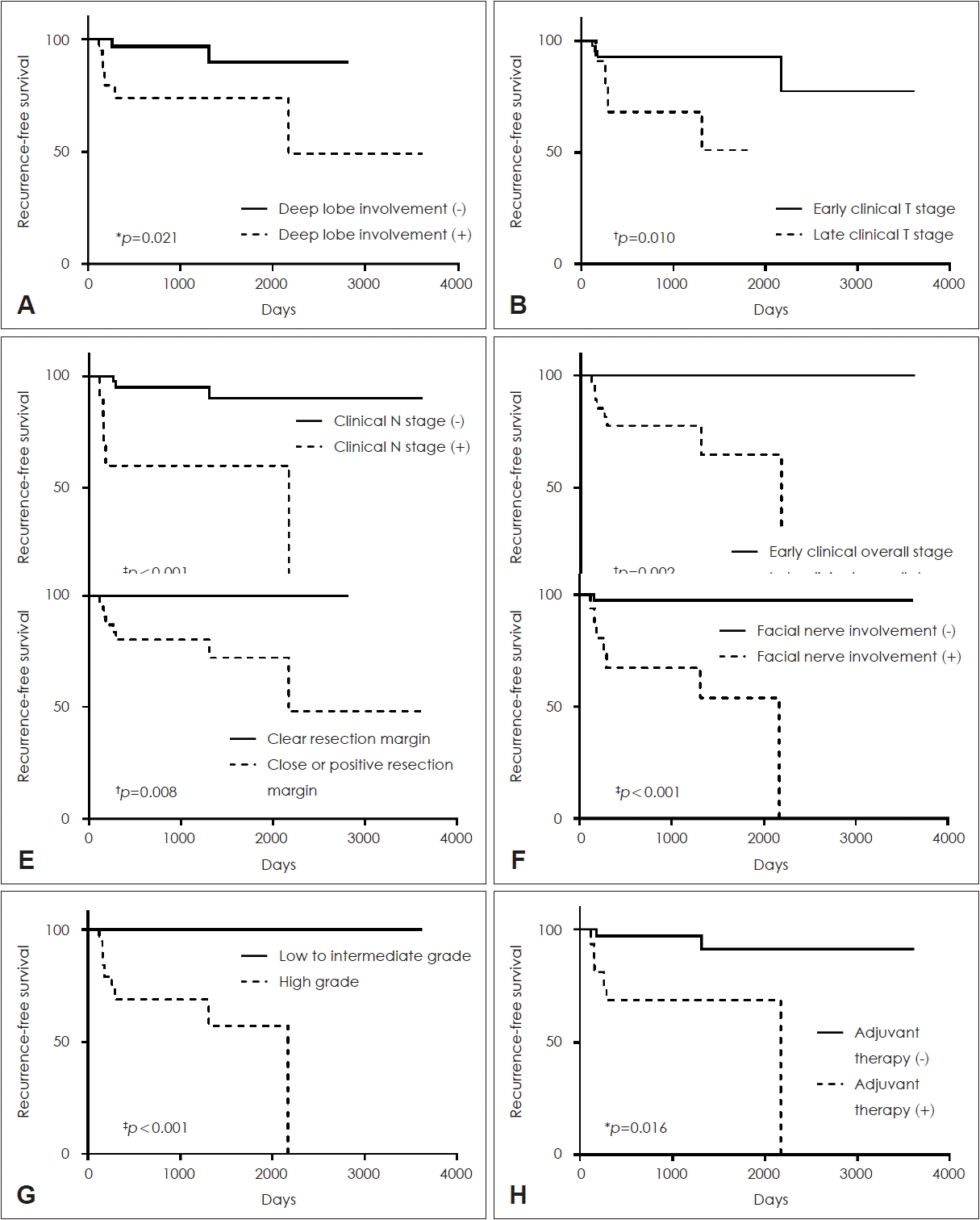 | Fig. 1.Kaplan-Meier curves of recurrence free survival according to clinicopathologic factors are shown. Factors with statistically significance are presented. A: Deep lobe involvement. B: Clinical T stage. C: Clinical N stage. D: Clinical overall stage. E: Resection margin. F: Facial nerve involvement. G: Histologic grade. H: Adjuvant therapy. *p<0.05; †p<0.01; ‡p<0.001. 
|
Table 3.
Cox multivariate regression analysis of the association with recurrence
|
Covariate |
Hazard ratio (95% CI) |
p-value |
|
Facial nerve involvement |
117.541 (0.024-564610.019) |
0.012*
|

Go to :

고 찰
기존 여러 연구에서 다양한 예후 인자들이 이하선암의 재발 및 무병생존율과 상관관계가 있음을 밝혔으며, TNM 병기, 신경주위 침습 여부(perineural invasion), 혈관 및 림프계 침범(lymphovascular invasion), 양성 수술절제연(resection margin), 병리조직등급 등이 연관성이 있음을 확인하였다[
4,
5]. 본 연구에서는 이전에 분석한 예후 인자들에 더하여 종양 부피, comorbidity index 등을 추가적으로 평가하여 이하선암의 예후를 예측하는 지표가 될지 알아보고자 하였다. 본 연구에서 통계적으로 유의미한 결과값으로 나타난 변수들에 대해 고찰하고자 한다.
낮은 BMI가 재발에 유의미한 예후 인자임을 본 연구에서 확인하였다. 기존 연구에 따르면 BMI는 침샘암의 예후 인자로 유의미한 결과가 도출되지 않았다[
5,
6]. BMI와 이하선암종의 예후와 상관관계를 고찰한 연구는 없었으며, 본 연구에서 최초로 밝혀낸 바이다. 본 연구에 등록된 환자들을 보면 전반적으로 BMI가 낮은 환자일수록 진단 당시 고령인 환자들이 대부분이며, 진단적 병기가 높고 전반적인 영양상태가 좋지 않음을 확인할 수 있다. 즉 진단 당시 이미 암의 진행으로 인한 암성 악액질(cancer cachexia) 상태임을 유추할 수 있으며 이는 높은 재발 위험으로 이어짐을 알 수 있다.
본 연구에서 종양의 안면신경 침범은 독립검정에서 유의미하게 재발의 불량한 예후 인자이며, 카플란 마이어 생존분석에서 무병생존율에서도 유의미한 차이가 있음을 확인하였다. 특히 콕스 다변량 분석에서 유일하게 유의미한 변수로 확인되었는데, 이는 종양의 안면신경 침범이 재발에 가장 중요한 위험 인자임을 시사한다. 술전 안면마비 환자는 총 6명이었으며, 술후 안면마비 환자는 19명으로 수술 중 안면신경의 침범이 확인된 17명과 비슷함을 알 수 있다. 결론적으로 13명이 수술로 인한 신경 손상이 발생하였으며, 술후 안면마비가 발생한 환자들에게서 유의미하게 재발이 높음을 확인할 수 있었다(
p=0.006). 비슷한 맥락으로 술전 영상검사로 평가한 종양의 심엽 침범 여부를 확인한 결과, 심엽까지 진행한 종양에서 유의미하게 재발이 높으며 무병생존율이 낮음을 확인할 수 있었다. 심엽의 기준으로 후하악 정맥을 지표로 삼았으며 이는 보통 안면신경의 주행 경로에 위치한다. 따라서 심엽까지 진행한 종양은 술중 안면신경의 침범이 있을 가능성이 높으며 이는 재발을 예측하는 데 있어 중요한 지표임을 본 연구에서 확인할 수 있다. 이하선암에서 수술 후 발생한 안면마비와 종양의 위치는 기존의 다른 연구에서도 확인되었는데, Huang 등[
7]은 수술 후 발생한 안면마비 환자의 88.1% (37/42)가 종양이 심엽에 위치하고 있음을 확인하였다. 기존의 다른 연구에서 술전 안면마비가 예후 예측 인자로 활용할 수 있음을 제시하였다. Jinnin 등[
8]은 술전 안면마비 유무가 림프절 전이를 예측하는 데 있어 중요함을 확인하였고, Koul 등[
9]은 술전 안면마비가 발생한 환자군이 대조군에 비해 유의하게 5년 생존율이 낮았다고 기술하였다. 본 연구에서는 술전 안면마비와 재발 간의 유의미한 결과값이 도출되지 않았다(
p=0.143). 물론 다른 연구에 비해 적은 환자 숫자로 인해 의미 있는 결과값이 도출되지 않았을 가능성도 있겠지만, 수술 중 확인된 안면신경 침범, 종양의 위치, 수술 중 발생한 안면신경의 물리적 외상 및 경색 등으로 인한 안면마비가 재발과 연관이 있음을 본 연구에서 확인하였다.
최종병기를 확인하였을 때 late stage (3기, 4기)가 early stage (1기, 2기)에 비해 유의하게 재발이 높았음을 확인할 수 있었다(p=0.001). 최종 T stage도 late T stage (T3, T4)가 early T stage (T1, T2)에 비해 유의하게 재발이 높았으며 무병생존율에서도 유의한 차이를 보였다(p=0.012). 앞에서 말한 바와 같이 종양의 안면신경 침범이 주요한 위험인자로 확인되었으며, 안면신경 침범일 경우 late stage이기에 당연한 결과이다. 본 연구의 목적은 재발 및 무병생존율을 예측할 수 있는 요소를 알아보는 것이기에 수술 전에 확인할 수 있는 임상적 병기에 초점을 두었다. 역시 술전 영상 검사를 토대로 분석하였으며, clinical stage, clinical T stage, clinical N stage에서 모두 유의하게 무병생존율의 차이를 보였으며, 재발이 late stage에서 높음을 확인했다. 이는 술전 영상 검사의 면밀한 판독과 분석의 중요성을 시사하며 이를 통해 환자에게 예후와 관련된 정보를 제공할 수 있다. 국내에서 진행한 Lee 등1)의 연구에서도 임상적 병기가 높은 환자군(3기, 4기)에서 재발이 높았으며, 병기가 낮은 환자들에 비해 전체 생존율이 유의하게 낮음을 확인하였다.
수술절제연의 경우 clear 군에 비해 close, positive 군에서 재발 빈도가 높았고, 무병생존율은 낮았다. 특히 clear 군의 경우 재발이 한 명도 없었던 반면, close 군에서 3예(27.2%), positive 군에서 5예(29.4%) 재발이 확인되었다. Morse 등[
10]의 연구에 의하면 양성 수술 절제연이 이하선암의 생존율 감소와 연관된 독립적인 예후 인자이며, 특히 고악성도암종 및 높은 T, N 병기와 양성 수술 절제연 환자의 비율과 상관관계가 있음을 제시하였고, 방사선치료 등의 추가적인 치료에도 불구하고 재발로 이어졌다. 본 연구에서 역시 close, positive 군에서 재발이 발생한 8명의 환자 중 추가적인 치료를 거부한 1명을 제외하고는 모두 방사선 혹은 항암방사선치료를 시행하였다. 수술 절제연이 이하선암종의 예후 예측 인자로 중요함을 시사하고 있다.
Westergaard-Nielsen 등[
11]은 26년간 덴마크 환자들을 대상으로 이하선암의 재발에 영향을 미치는 다양한 예후 인자들을 분석하였다. 이를 3개의 예후 예측 모델(Vander Poorten 등[
12], Carrillo 등[
13], Ali 등[
14])에 적용하여 어떤 모델이 가장 적합한지를 알아보았다. 결과상 Vander Poorten의 모델이 가장 적합도가 높았으며, 재발에 영향을 미치는 예후 인자로 고령, 고등급암종, 높은 병기, 림프절 전이, 양성 수술 절제연 등이 포함되었다. 향후 연구에서는 국내 환자들을 대상으로 대규모 코호트 연구를 통해 이하선암의 예후 예측 인자들을 분석하여 유의미한 예측 인자를 확인하는 것이 중요하다고 생각한다. 결과상 가장 유의미한 예측 인자들을 선정하여 간단한 예측 모델에 적용한다면 이하선암 환자의 개별적 추적 관찰 및 예후 예측에 상당한 도움이 될 것으로 생각한다.
본 연구의 한계점으로는 10년간의 후향적 연구로 진행되었는데, 예상보다 추적 관찰이 되지 않는 환자들의 비율이 높아서 정확한 무병생존율 분석에 한계가 있었다. 또한, 병리조직결과가 환자마다 일정하지 않아 통계 분석에 제한이 있었으며, 10년간의 후향적 연구임에도 기존의 다른 연구들에 비해 적은 환자 숫자도 한계점으로 지적된다.
결론적으로, 본 연구에서 임상적 병기, 양성 수술 절제연, 종양의 안면신경 침범 및 심엽 침범, 고등급암종이 생존율 및 재발에 통계적으로 유의한 영향을 미치는 것으로 나타났다. 특히 종양의 안면신경 침범은 다변량 분석에서 유일하게 유의미한 결과값으로 도출되었기에 예후 예측에 있어 가장 중요한 변수임을 본 연구에서 확인하였다. 본 연구 결과를 토대로 향후 이하선암종의 진단 및 예후 예측에 도움이 될 것으로 생각한다.
Go to :






 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download