서론
로타바이러스 감염과 관련된 중추신경계 합병증에 대한 보고는 Salmi 등[1]에 의해 처음으로 보고되었으며, 이후 신생아에서도 서맥, 무호흡, 경련, 뇌수막염과 뇌증이 보고되어 로타바이러스 감염이 신생아에서 중추신경계 합병증을 일으킬 수 있음이 알려졌다[2,3].
최근 신생아에서 로타바이러스 감염과 관련하여 발생한 뇌백질의 이상 소견에 대한 보고가 있으며, 뇌 자기공명영상(magnetic resonance imaging, MRI)에서 대뇌겉질에는 병변을 보이지 않으면서, 확산강조영상에서 심부 대뇌백질에 고신호 강도를 보이는 특징적인 소견들이 관찰되었다. 대부분 생후 4일에서 6일 사이에 경련이 발생하였으며 장기적인 신경학적 예후를 봤을 때 정상 발달을 보이는 경우도 있으나 뇌백질 연화증이나 뇌위축을 보이면서 발달 장애가 동반되기도 하였다[4,5].
저자들은 생후 4–5일째 다른 경련의 원인이 없이 로타바이러스 감염으로 인한 경련이 있었던 환자들에서 뇌 MRI에서 뇌겉질은 정상이나 확산강조영상에서 양측 뇌 백질에 대칭적인 고신호 강도를 보였던 증례들을 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증례
1. 증례 1
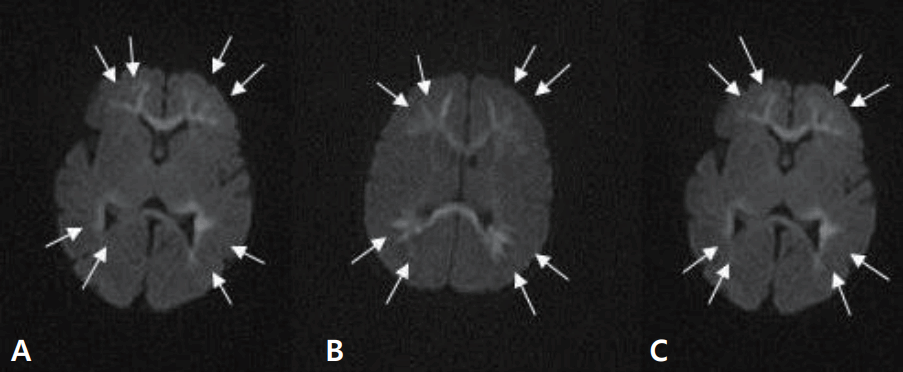
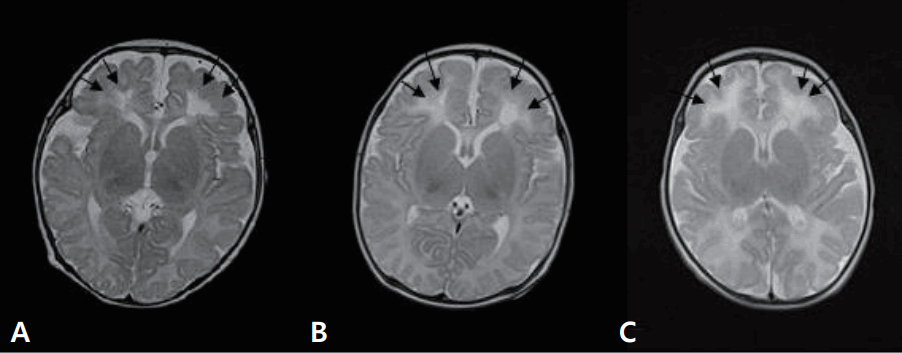
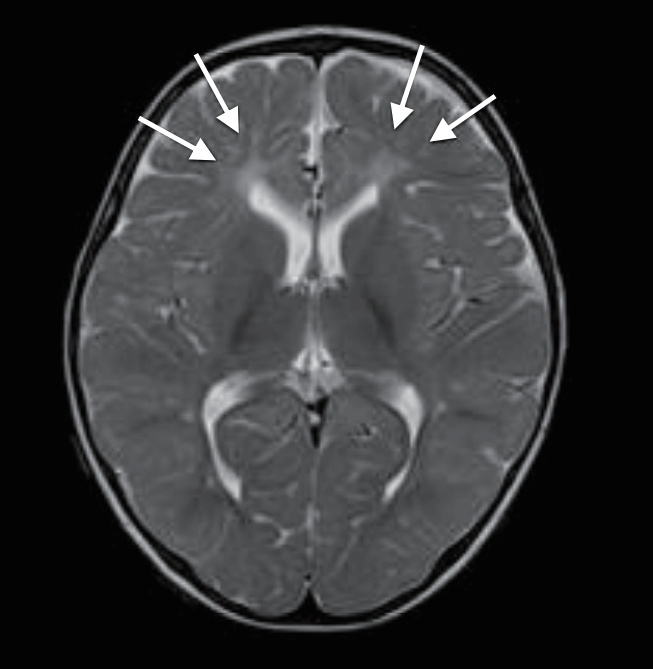
재태 연령 36주 4일, 출생 체중 2.94 kg으로 분만력 2-0-0-2인 39세 산모에서 조기진통이 있어 제왕절개로 개인병원에서 태어난 남아로, 아프가 점수는 1분과 5분에 각각 10점이었다. 분만 중이나 출생 후 특이 소견은 없었다. 환자는 생후 4일째에 10여 초간 지속되는 전신성 간대성 경련이 4차례 있어 전원 되었다. 가족력 및 산과력에서 특이 소견 없었다. 입원 시 활력징후는 혈압 75/34 mm Hg, 맥박 124회/분, 체온 36.3°C, 호흡수 50회/분이었다. 체중은 2.78 kg이었으며 무른 변을 보고 있었으나, 수유량은 양호하였고 구토나 발열, 무호흡은 없었다. 말초혈액 검사에서 혈색소 17.1 g/dL, 백혈구 9,140/mm3, 혈소판 147,000/mm3이었고, 전해질 검사에서 나트륨 137 mEq/L, 칼륨 4.3 mEq/L, 혈당은 71.5 mg/dL이었다. 생화학 및 면역혈청 검사에서 총 단백질 4.65 g/dL, 알부민 3.19 g/dL, 간기능 검사 35.7/12.4 U/L, 혈액요소질소 5.7 mg/dL, 이온화된 칼슘/총 칼슘 4.3/7.21 mg/dL, 인 6.48 mg/dL, C-반응단백(정상치 ≤0.3 mg/dL) 0.08 mg/dL이었다. 뇌척수액 검사에서 백혈구 7/mm3, 단백질 88.4 mg/dL, 당농도 38.1 mg/dL이었으며, 세균배양 검사에서 균이 동정 되지 않았다. 대변항원 검사(enzyme immunoassay kits, RIDASCREEN® ROTAVIRUS, Darmstadt, Germany)에서는 로타바이러스 양성이었다. 입원 중에 시행한 선천성 대사이상 검사는 정상이었다. 입원 1일째와 2일째 수십 초간 지속되는 전신성 간대성 경련 1차례, 입맛을 다시는 듯 쩝쩝거리면서 자전거 페달을 밟는 듯한 경련이 2차례 발생하여 amplitude-integrated electroencephalography (a-EEG) 모니터링을 하면서 페노바르비탈(phenobarbital)을 투여했다. 뇌파 검사에서 오른쪽 측두부와 양측 중앙부에서 다수의 예파가 관찰되었으며, 뇌 MRI 확산강조영상에서 양측 뇌실주위백질의 신호 증가 소견을 보였다(Figure 1A). 환자는 더 이상의 경련은 없고 대변 양상도 호전되어 입원 10일째에 페노바르비탈을 복용하면서 퇴원하였다. 한달 뒤 외래에서 시행한 뇌 MRI에서 양측 전두부의 낭성 뇌실주위백질 연화증을 보였다(Figure 2A). 환자는 출생 후 4개월째 경련이 없으며 뇌파검사에서 정상 소견을 보여 항경련제 치료를 중단하였고, 만 1세 때 추적한 뇌 MRI에서는 낭성 병변은 흡수되었으나 뇌실주위백질의 연화증을 보였다(Figure 3). 환자는 현재 2세 7개월로 체중 12.5 kg (10–25 백분위수), 신장 91 cm (25–50 백분위수), 두위 48 cm (10–25 백분위수)이며 한국영유아발달선별검사에서 정상 발달을 보이고 있다.
2. 증례 2
재태 연령 36주 5일, 출생 체중 2.88 kg으로 분만력 2-0-0-2인 34세 산모에서 조기진통이 있어 제왕절개로 개인병원에서 태어난 남아로, 아프가 점수는 1분과 5분에 각각 10점이었다. 분만 중에 특별한 외상력은 없었고 출생 후 특이 소견도 없었으나, 생후 4일째 수십초간 지속되는 전신성 간대성 경련이 3차례(각각 20초, 15초, 1분)있어 전원 되었다. 산모는 15년 전 뇌전증으로 한 달여간 치료받은 과거력이 있었으나, 현재는 아무런 약물치료 없이 건강했다. 입원 시 활력징후는 혈압 72/46 mm Hg, 맥박 126회/분, 체온 36.9°C, 호흡수 66회/분이었다. 체중은 2.8 kg이었으며 환자는 발열, 구토, 그리고 무호흡의 증상은 없었고 수유량과 소변 배출이 양호하고 신체 검진에서도 탈수를 의심할 만한 소견을 보이지는 않았으나 무른 변이 지속되고 있었다. 신경학적 검사에서도 이상 소견을 보이지 않았으며 근육긴장도와 반사도 정상이었다. 전혈구계산치, 전해질 검사, 이온화된 칼슘 및 총 칼슘, 생화학 검사, C-반응단백, 선천성 대사이상 검사는 정상이었다. 뇌척수액 검사에서 정상이었고, 세균배양 검사에서도 균이 동정 되지 않았다. 대변항원 검사에서는 로타바이러스 양성이었다. 입원 후에도 수십 초간 지속되는 전신성 간대성 경련이 10여 초간 2차례 발생하여 a-EEG 모니터링을 하면서 페노바르비탈을 투여하였으며 이후 경련의 재발은 없었다. 뇌파 검사에서 오른쪽 측두부에서 예파와 극파가, 양쪽 중앙부에 약간의 예파가 관찰되었다. 뇌 MRI 확산강조영상에서 양측 뇌실주위백질의 신호 증가 소견을 보였다(Figure 1B). 입원 7일째에 환자는 더 이상 경련이 없으며 무른 변도 호전을 보여서 페노바르비탈의 복용을 지속하며 퇴원하였다. 한 달 뒤 추적한 뇌 MRI에서 양측 전두부의 낭성 뇌실주위백질 연화증을 보였다(Figure 2B). 환자는 퇴원 두 달 후에도 경련이 없으며 뇌파 검사에서 정상 소견을 보여 항경련제 치료를 중단하였다. 추적 뇌 MRI는 보호자의 거부로 더 이상 시행하지 못했으나 현재 2세 7개월로 체중 14 kg (50–75 백분위수), 신장 90 cm (25–50 백분위수)이며, 한국영유아발달선별검사에서 정상 발달을 보이고 있다.
3. 증례 3
재태 연령 37주 4일, 출생 체중 2.96 kg으로 분만력 1-0-0-1인 30세 산모에서 자연분만으로 개인병원에서 태어난 여아로, 아프가 점수는 1분과 5분에 각각 10점이었다. 분만 중이나 출생 후 특이 소견 없었으며 생후 2일째부터 수유량이 감소하고, 구토와 무른 변이 있었으며 생후 5일째 40여 초간 지속되는 국소성 간대성 경련이 있어 전원 되었다. 가족력 및 산과력에서 특이 소견이 없었다. 입원 시 활력 징후는 혈압 78/46 mm Hg, 맥박 150회/분, 체온 36.4°C, 호흡수 56회/분이었다. 체중은 2.66 kg이었으며 발열이나 무호흡은 없었다. 전혈구계산치, 전해질 검사, 이온화된 칼슘 및 총 칼슘, 생화학 검사, C-반응단백, 선천성 대사이상 검사는 정상이었다. 뇌척수액 검사에서 백혈구 0/mm3, 단백질 85.3 mg/dL, 당 농도 66.2 mg/dL이었으며, 세균배양 검사에서 균 동정 되지 않았다. 대변항원 검사에서는 로타바이러스 양성이었다. 입원 후 10여 초간 지속되는 국소성 간대성 경련이 1차례 발생하여 a-EEG 모니터링을 하면서 페노바르비탈을 투여했으며 이후 경련 재발은 없었다. 뇌파 검사에서 오른쪽 측두부에 약간의 예파와 왼쪽 중앙부와 측두부에 간헐적으로 예파가 관찰되었으며, 뇌 MRI 확산강조영상에서 양측 뇌실주위백질의 신호 증가 소견을 보였다(Figure 1C). 환자는 경련이 없고 전신상태 양호하여 입원 6일째 페노바르비탈 복용하면서 퇴원했다. 한 달 뒤 외래에서 시행한 뇌 MRI에서 양측 전두부의 낭성 뇌실주위백질 연화증을 보였다(Figure 2C). 항경련제를 복용 중이며 역연령 4개월에 외래를 통해 발달평가 및 추후 뇌 MRI를 추적할 예정이다.
고찰
로타바이러스는 영아와 특히 5세 미만 소아에서 급성 위장관염을 일으키는 주된 원인 바이러스로 감염은 주로 위장관에 국한되어 생각되었다. 로타바이러스 감염은 여러 합병증을 동반할 수 있는데 탈수가 가장 흔하며, 간염이나 괴사성 장염과 같은 장내 합병증을 동반하기도 한다[6]. 그리고 장외 합병증도 보고 되어 있으며[7], 뇌수막염, 뇌염, 열을 동반하거나 동반하지 않은 경련, 뇌병증, 출혈성 쇼크, 중심 뇌교 용해증(central pontine myelinolysis), 길랭-바레증후군, 라이증후군과 같은 신경학적 합병증도 보고되고 있다[8].
신생아에서의 로타바이러스 감염은 영아나 소아에서의 감염과 비교해 일반적으로 무증상이거나 증상이 있어도 경한 경우가 대부분이다[9]. 또한 로타바이러스 감염으로 인한 중추신경계 합병증도 대개 6개월에서 3세 사이의 영아와 어린 소아에서 좀 더 흔하지만, 신생아에서도 서맥, 무호흡, 경련, 뇌수막염과 뇌증이 보고되었다[2,3].
로타바이러스 감염으로 인한 경련을 보이는 신생아에서 뇌 MRI 확산강조영상에서 특징적인 양측의 대칭성 뇌백질의 확산 제한 음영을 보이는 증례들이 지속적으로 보고되고 있으며 그 연관성에 관한 연구들이 제기되고 있다[10,11].
로타바이러스로 인한 경련을 보였던 만삭의 신생아 30명을 대상으로 한 Lee 등[5]의 연구에서 13명의 환자가 뇌 MRI 확산강조영상에서 뇌백질의 병변을 보였고 특징적으로 뇌겉질은 정상이었다. 그리고 이 환자들 모두 생후 4일에서 6일 사이에 경련이 발생하였다. 추후 뇌 MRI를 추적한 10명 중 4명에서 뇌위축이나 뇌백질의 연화증을 보였고, 발달 추적이 이루어진 10명 중 3명에서 언어나 운동 발달의 장애를 보였다. 본원에서 경험한 환자들도 생후 4–5일 사이에 경련을 보였으며, 3명 모두 뇌 MRI 확산강조영상에서 심부 대뇌백질에 고신호 강도를 보이면서 대뇌겉질에는 병변을 보이지 않아 기존 연구 대상자들에게서 관찰된 특징적인 소견과 일치하였다. 로타바이러스 감염 기간 동안 경련을 보인 5명의 미숙아와 3명의 만삭 신생아를 대상으로 한 Verboon-Maciolek 등[4]의 연구에서 4명의 미숙아에서 뇌 MRI에서 낭성 병변과 뇌백질의 고신호 강도가 관찰되었으며 2명의 만삭아 에서도 낭성 변화를 동반한 국소 병변이 관찰되었다. 4명의 미숙아에서 발달장애나 뇌성마비를 보였으나 3명의 만삭아는 9에서 12개월에 시행한 발달 상태가 정상이었다. 특히 미숙아에서 교정연령으로 34–36주인 출생 후 21일에서 42일 사이에 로타바이러스에 감염되어 경련이나 무호흡, 처침과 같은 신경학적 증상을 보였던 증례들에서 뇌실주위백질 연화증을 보였는데, 이는 심부 대뇌백질이 후기 조산아 시기에 감염이 발생했을 때 좀 더 취약하기 때문으로 생각된다. 로타바이러스 감염 후에 위장관계의 증상을 보이기까지 1–2일의 잠복기가 있고, 발작은 일반적으로 영유아에서 설사가 나타난 후 1일에서 5일 사이에 발생한다고 알려져 왔다[12]. 따라서 출생 후 얼마 되지 않은 시기에 로타바이러스 감염이 있었다면 경련이 출생 후 5일 전후에 발생한 이유를 설명할 수 있다. 후기 조산아나 만삭아를 대상으로 했던 연구들에서 로타바이러스 감염으로 인한 경련을 보이면서 뇌 MRI 확산강조영상에서 심부 대뇌백질에 손상을 보였던 환자들은 모두 생후 4–6일 사이에 경련을 보이고 있었으며 본원에서 경험한 증례들 또한 생후 4–5일 사이에 경련을 보였다. Kim 등[13]의 연구에서도 경련을 보인 전체 144명의 신생아를 대상으로 경련 증상을 보인 17명과 경련 증상이 없었던 127명의 환아를 대상으로 봤을 때, 경련 증상을 보인 환아들은 경련이 없던 환아들에 비해 경련 이외의 구토나 발열 등 다른 임상 증상이 거의 없었으며, 로타바이러스 항원 검출 시기가 경련이 없었던 환아들에 비해 통계적으로 의미 있게 빨랐다. 본원에서 경험한 증례들 또한 모든 증례에서 발열이 동반되지 않았고 3번째 증례를 제외하고는 경련 외에 특이 증상이 없었으며, 세 증례 모두 출생 후 초기에 로타바이러스 감염에 노출된 것으로 판단된다. 국내의 증례 보고 중에는 만삭아에서 생후 7일경에 로타바이러스 감염으로 인한 경련을 보인 신생아에서 경련 전에 발열이 지속되었던 경우도 보고되어 있다[14]. 위 증례에서도 본원의 첫 번째 증례와 같이 뇌실주위백질 연화증을 보이나 생후 17개월경의 신경학적 발달은 정상 소견을 보였다. 본 증례들은 출생 후 4–5일 사이에 로타바이러스로 인한 경련을 보이면서 뇌 MRI 확산강조영상에서 뇌백질의 손상을 보였던 후기 조산아와 만삭아를 대상으로 비교적 장기적인 예후와 뇌 MRI 병변의 추적이 이루어졌다.
Verboon-Maciolek 등[15,16]에 의한 연구에서 로타바이러스 외에도 human parechovirus나 enterovirus 감염 후에도 경련과 뇌백질의 손상이 동반되는 등 유사한 증상을 보였으나 parechovirus나 enterovirus 감염 후에는 발열이나 피부에 발진이 더 많이 동반되는 경향을 보였다. 따라서 급성 바이러스 감염으로 인한 뇌백질의 손상(뇌실주위백질 연화증)은 특정 바이러스 감염에 의해서 발생하기보다는 바이러스 감염에 취약한 신생아기 뇌백질의 특성과 관련된 반응에 의한다고 해석할 수 있다.
특이한 점은 대부분의 로타바이러스 감염으로 경련이 있었던 신생아에서 뇌척수액의 백혈구, 단백질, 당 농도 등이 대부분 정상 소견을 보였다는 점이다. 이것은 로타바이러스 장염과 동반되어 영아와 어린 소아에서 발생하는 양성 경련에서도 마찬가지다[17]. 본 증례의 경우 혈액이나 뇌척수액에서 로타바이러스 중합효소연쇄반응 검사를 시행하지 못했으나 이전 연구들에서도 혈액이나 뇌척수액에서 로타바이러스가 검출되지 않아도 신경 증상을 보였다[18,19]. 로타바이러스 감염으로 인한 신경계 합병증의 발생 기전은 명확하지 않으나 로타바이러스에 의한 직접적인 신경계 감염이 원인이라는 설과 바이러스의 특정 단백질(NSP4)에 의한 이차적 영향이라는 가설이 있다[14]. 로타바이러스 소뇌염에서는 뇌척수액 내에 interleukin-6와 자유 활성산소가 염증 과정에 관여하는 것으로 보인다[20].
전해질 불균형이나 대사 이상, 뇌출혈이나 경색과 같은 뇌혈관질환 등의 이상 없이 특히 생후 5일경에 경련을 보이는 신생아에서 발열이나 장염 증상의 유무와 상관없이 로타바이러스 감염에 의한 경련과 뇌 병변의 가능성을 염두에 두고, 뇌 영상검사 및 발달평가의 추적이 필요하다. 그리고 미숙아의 경우 로타바이러스 감염으로 뇌백질 연화증이 합병될 가능성이 만삭아에 비해 높으므로 신생아중환자실과 같은 취약한 환경에서는 로타바이러스 전파를 막기 위한 예방적 노력이 필요할 것으로 생각된다.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download