This article has been corrected. See "Corrigendum: A Case of Epidermolysis Bullosa Simplex (Dowling-Meara 1 Type) in Newborn" in Volume 30 on page 20.
Abstract
Epidermolysis bullosa is a rare genetic skin disease in which skin easily peels off and blisters are formed with mild mechanical trauma. It is classified into simple, borderline, dysmorphic, and mixed type. These four subtypes are further classified according to the location of gene mutation and genetic patterns. Epidermolysis bullosa simplex (EBS) is characterized by separation in the epidermal or subepidermal layer. And it is mostly caused by mutation of keratin 5 (KRT5) and KRT14 genes. Recently, genetic test has become increasingly important for diagnosis, confirming subtypes and genetic counseling. And there are moderate correlation exists between the EBS phenotype and genotype. Here, we report a case of 2-day-old boy with EBS Dowling-Meara type (EBS-DM) diagnosed by mutation analysis in KRT14.
수포성 표피박리증(epidermolysis bullosa)은 경미한 자극에도 피부가 쉽게 벗겨지고 수포가 생성되는 약 100만 명 중 50명 정도의 유병률의 매우 드문 유전성 피부질환이다[1,2]. 일반적으로 수포가 발생되는 위치에 따라 단순형, 경계형, 이영양형, 혼합형으로 분류가 되고, 이 4가지의 아형들은 유전자 돌연변이의 위치, 유전 양상에 따라 더 세부적으로 분류된다[3].
단순형 수포성 표피박리증(epidermolysis bullosa simplex, EBS)은 표피 세포 내의 keratin 5 (KRT5) 또는 keratin 14 (KRT14) 유전자의 돌연변이에 의해 발생하며 대부분 상염색체 우성으로 유전된다. 임상적 중증도에 따라 심한 형태의 Dowling-Meara형(EBS-DM), 전신에 병변이 나타나는 Koebner형, 그리고 국소적이고 경한 Weber-Cocckayne형으로 나뉘며 중증도는 케라틴 단백 유전자의 이상이 있는 부위와 상관 관계가 있음이 이전 연구들에서 밝혀지고 있다[4].
신생아 시기에 발현이 시작된 EBS의 경우 감염성 질환과의 감별이 어렵고, 아형 확인과 치료, 예후 예측을 위한 유전자 검사의 중요성이 대두되고 있다. 치료에 있어서도 수포 발생 예방이나 상처 관리, 영양 및 성장관리, 부모의 심리적 지지 등 고려하고 주의해야 할 사항들이 많다[5].
본 저자들은 출생 직후에 전신에 관찰된 수포성 병변을 주소로 입원한 신생아에서 유전자 검사를 통해 EBS를 진단하고 치료하였기에 보고하는 바이다.
재태연령 38주 1일, 출생체중 3.2 kg, 자연분만으로 출생한 남아가 출생 직후에 관찰된 오른쪽 발등의 수포성 병변을 시작으로 턱과 양손, 양 슬와, 서혜부, 엉덩이로 병변이 퍼져 생후 3일째 전원 되었다. 산전 초음파에서는 특이 소견 없었으며 분만 당시 아프가 점수 1분 10점, 5분 10점이었다. 가족력에서 부모와 첫째 여아 포함하여 유전질환이나 피부 병변 등의 특이사항이 있는 가족은 없었다.
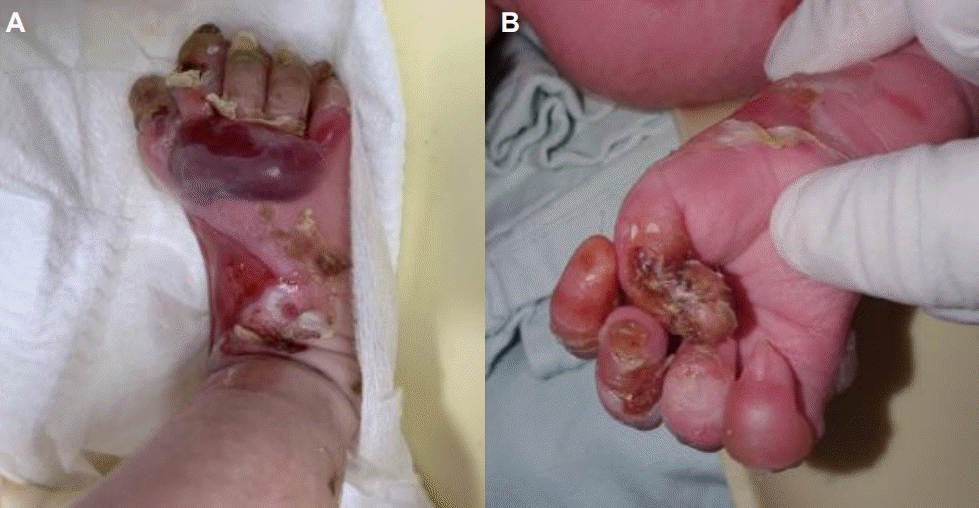
입원 시 혈압 74/41 mmHg, 심박동수 141회/분, 호흡수 58회/분, 체온 36.9℃로 양호하였으며 체중 3.16 kg (43 백분위수), 신장 50.0 cm (55 백분위수), 두위 33.5 cm (32 백분위수)로 측정되었다. 신체검진에서 턱과 양손, 배꼽, 양 서혜부, 양 다리의 오금, 양발 뒤꿈치로 다양한 크기의 수포가 있었고(Figure 1), 오른쪽 발등의 수포가 벗겨진 부위로는 화농성 분비물이 관찰되었다(Figure 2A). 입술과 구강 내 점막에도 수포가 동반된 병변이 발견되었으며 양 손가락의 손톱 아래로 수포성 병변이 있으면서 손톱의 변형이 관찰되었다(Figure 2B).
환아의 상태 파악과 질병의 원인 분석을 위해 혈액검사를 시행하였다. 전혈구검사에서 혈색소 15.0 g/dL, 백혈구 14,960/μL, 혈소판 239,000/μL으로 양호하였으며 C-반응단백 0.20 mg/dL, 프로칼시토닌 1.05 ng/mL로 특이사항 없었다. 바이러스, 세균 감염 등을 배제하기 위해 헤르페스 바이러스 포함한 바이러스 검사, 혈액배양 검사 등을 시행하였으며 이상 소견 없었고 병변 부위 도말하여 시행한 단순포진 바이러스 polymerase chain reaction 결과도 음성이었다.
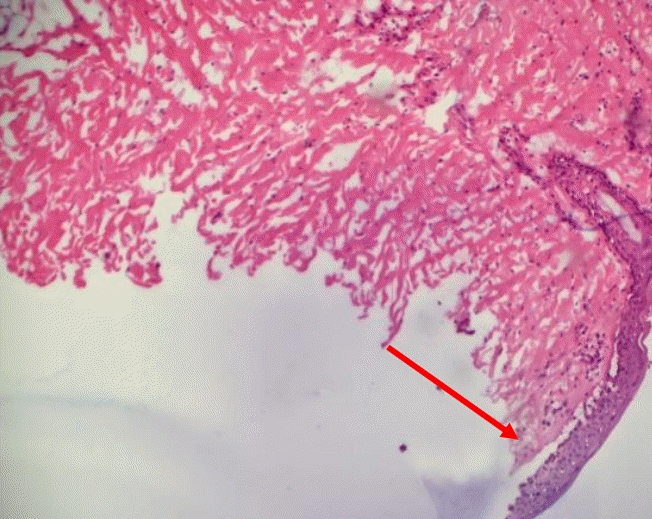
사타구니에 새로 발생한 병변 부위에서 펀치 생검을 시행하였으며 광학현미경 검사 결과 수포는 표피 하층에서 관찰되었으며 전자현미경 검사는 검사실 사정 상 시행하지 못하였다(Figure 3).
EBS의 진단 및 아형 확인을 위해 diagnostic exome sequencing (DES) 검사를 시행하였다. Celemics G-Mendeliome DES Panel (Celemics, Seoul, Korea)을 이용하여 총 5,447개 유전자의 약 70,418개의 표적 exon 및 190개의 single nucleotide variant (SNV)를 capture 하고, NextSeq (Illumina Inc., San Diego, CA, USA) 장비로 2×150 paired end reads 방법으로 염기서열분석을 시행하였고, University of California, Santa Cruz (UCSC) hg19 표준염기서열과 비교하여 질환과 관련된 변이를 확인하였다. 검사 결과 KRT14 sequence NM_000526.4:C.373C>T; p.(Arg 125Cys) 이형접합 형태가 관찰되었다. 가족력 확인을 위한 유전자 검사를 시행하려 하였으나 보호자의 거부로 시행하지 못하였다.
환아는 입원 후 피부의 마찰 감소와 삼출물 흡수를 위해 접착력이 약한 폼형 창상 피복재를 전신에 대주고(Figure 1), 2일에 한 번씩 교체하였으며 수포가 벗겨진 부위에는 mupirocin 성분의 항생제 연고와 히알루론산 나트륨 연고를 도포하였다. 우측 발등 부위로는 화농성 분비물이 지속되었고 입원 3일차 시행한 수포 배양검사 결과 methicillin sensitive Staphylococcus aureus가 동정되어 항생제 Ampicillin/Sulbactam을 일주일간 정맥 투여 하였으며 이후로는 배양검사에서 동정되는 균은 관찰되지 않았다.
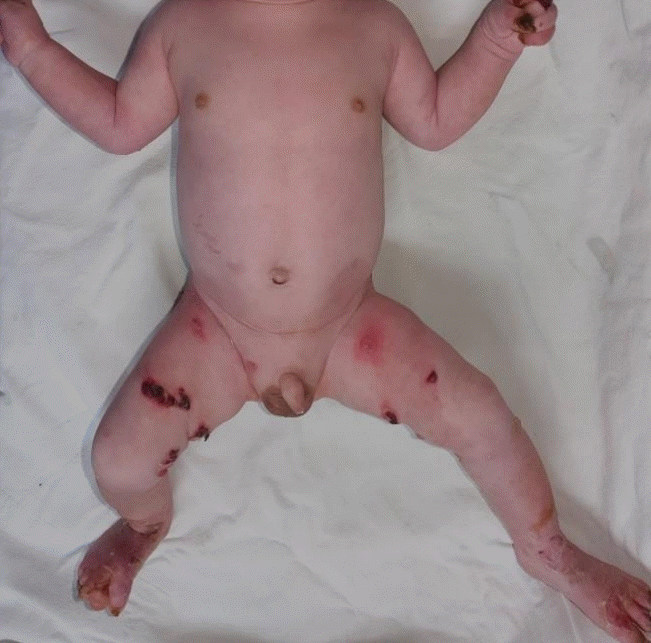
엉덩이와 기저귀 마찰로 인한 병변이 관찰되어 2차 감염 예방을 위해 기저귀를 자주 갈아주었다. 피부 간의 마찰이 생기는 부위에는 바셀린(Firson, Cheonan, Korea) 연고를 도포하였으며 수유를 진행하면서 입술과 점막에 수포성 병변이 관찰되고 통증이 있어 구강도포제를 사용하고 모유 온도를 낮춰서 수유하였다. 하루에 한 번씩 병변 드레싱을 시행하였으며 소독 전에 통증 완화를 위해 아세트아미노펜을 복용하였다. 입원 이후에도 수포성 병변이 자극되거나 접촉되는 부위에 지속적으로 새로 발생하였으나 초기에 있었던 우측 발등, 서혜부 등의 병변은 호전 소견을 보였다(Figure 4).
입원 2개월 후 기존의 병변들은 거의 호전되었고 새로운 병변 발생은 지속되었으나 초기 처치 및 드레싱 후에는 곧 회복되는 모습을 보여 보호자에게 창상 관리 및 드레싱 교육을 시행 후 퇴원하였다. 수유는 분유로 120-140 mL씩 진행하였고, 45일 후 체중 4.17 kg, 1.2 백분위수로 체중 증가가 더뎌 칼로리 보충제 듀오칼(Scientific Hospital Supplies Ltd., Liverpool, UK) 120 mL 당 5 g씩 추가하여 35 kcal/kg/day를 보충하여 수유하였다.
퇴원하고 생후 4개월에 외래에서 기존의 양 팔과 다리 부위의 병변은 관찰되지 않았다. 체중은 6 kg으로 8.9 백분위수에 해당하여 고칼로리의 특수분유로 변경하여 수유 시작하였고 추후 성장발달 확인 및 창상 관리에 대해 추적관찰하기로 하였다.
수포성 표피박리증은 일반적으로 수포가 발생되는 위치에 따라 단순형, 경계형, 이영양형, 혼합형으로 분류가 되고, 4가지의 아형들은 유전자 돌연변이의 위치와 유전 양상에 따라 더 세부적으로 분류된다[3]. 그 중 EBS는 임상적 중증도에 따라 EBS-DM형, Koebner형, Weber-Cocckayne형으로 나뉜다[4,6]. 이 중 가장 심한 형태의 EBS-DM의 경우 출생 직후에 증상이 관찰되며 간혹 기도나 식도 협착이 동반되어 생명에 위협을 주기도 한다. 임상적인 증상으로는 전신에 다수의 수포가 관찰되며 손바닥과 발바닥의 과각화증이 동반되고 구강 점막의 침범과 손발톱 변형도 흔하게 나타난다[7]. 수포성 표피박리증과 함께 고려해야 할 감별진단으로는 단순 포진바이러스와 같은 바이러스에 의한 감염성 수포, 수포성 농가진, 포도알균 열상 피부증후군, 신생아 칸디다증, 신생아 수두 같은 감염성 질환과 과다각화증이나 결합조직 장애, 미란성 질환 등이 있을 수 있어 관련 검사들을 시행하여 상기 진단들을 배제해야 한다[8,9].
EBS가 의심되는 환자에서 가장 추천되는 1차 진단법은 새롭게 형성된 수포의 조직을 광학현미경 및 전자현미경으로 검사하는 것이다[8]. 광학현미경 검사에서 표피 박리가 피부의 어느 부위에서 관찰하며, 대부분의 EBS의 경우 표피 내, 표피 하층에서 박리가 관찰된다[8,10]. 아형 확인을 위해서는 전자현미경 검사가 유용하며 수포가 피부 세포 조직의 어느 층에 있는지를 확인할 수 있고 EBS-DM의 경우 기저 각질세포 내에 keratin filament가 뭉쳐있는 것을 확인함으로써 진단에 이용할 수 있다[3,8].
최근에는 보다 더 정확한 아형과 유전 양상 및 예후 확인을 위한 유전자 검사가 권고되고 있다. 본 사례에서는 검사실 사정 상 전자현미경 검사를 시행하지 못하여 조직검사로 유전자 검사 시행 전 아형을 예측하는 데에는 어려움이 있었고, 유전자 검사 시행 전까지는 수포성 표피박리증 의심 하에 치료를 지속하였다. 이후 유전자 검사를 통해 확진하고 아형 확인을 하였으며 유전 상담 등을 진행하였으므로 진단에 있어 유전자 검사의 중요성을 보여준다.
EBS는 일반적으로 상염색체 열성 또는 우성으로 유전된다. 관련 유전자로는 KRT5, KRT14, plectin (PLEC), CD151, dystonin (DST), exophilin 5 (EXPH5)가 있고 유전형에 따라 유전 방식에의 차이가 있다. 유전자의 변이가 있는 부위와 수포성 표피박리증의 표현형에는 상관관계가 있는 것으로 보고되고 있는데 본 사례인 EBS-DM의 경우 KRT5의 rod 1A domain의 시작부위 또는 2B domain에의 돌연변이나 KRT5와 KRT14의 1A 또는 2B의 돌연변이가 주로 관찰된다[9]. EBS의 유전자 변이에 대해 연구한 Muller 등[7]의 논문에서 총 27명의 EBS 환자와 가족들의 유전자 분석을 시행하였으며 이중 15명의 환자가 EBS-DM으로 진단되었다. 15명의 환자 중 11명의 유전자에서 KRT14, 4명의 유전자에서는 KRT5의 변이가 관찰되었으며 KRT14의 변이 중 4건이 본 사례와 동일하게 p.Arg125Cys에서c.373C>T 변이를 보였다.
국내에서는 2010년 Kang [4] 등에 의해 보고된 16개의 사례가 있었으나 신생아기에 진단된 사례는 아니었고, 2020년 Lim [3] 등에 의해 신생아기에 증상 발현된 환자에서 전자현미경 검사에서는 특이소견 없었으나 유전자 검사 결과 기존에 발견되지 않은 KRT14의 c.369T>G;p (Asn 123Lys) 변이에 대해 보고된 바가 있다. 유전 보고는 아니지만 1996년 Son 등[11]에 의해 보고된 사례에서는 출생 직후 수포가 발생한 미숙아에서 위유문부 폐쇄증이 동반된 드문 케이스가 보고된 바가 있다.
수포성 표피박리증에는 완치법이 없고 증상에 대한 보존적인 치료와 수포 발생의 예방이 주된 치료이다. 신생아 시기에는 새로운 수포 발생의 예방과 상처에 대한 관리가 치료에서 가장 중요하다[8,12]. 피부 손상을 막아 새로운 수포 형성을 막기 위해 환아를 조심스럽게 다뤄야 하며 헐렁한 옷을 입히고, 피부를 직접 접촉하거나 비비는 것은 삼가고 접착성이 있는 테이프는 사용하지 않아야 한다. 또한 환경 온도를 낮춤으로써 피부가 과열되어 피부의 취약성이 증가되는 것을 막고, 피부의 벗겨진 부위는 무균 생리식염수로 닦아주고 접착성이 없는 드레싱 패드나 바셀린 거즈를 이용해 덮어주는 것이 좋다[5]. 2차 감염을 막기 위해 mupirocin 성분의 항생제 연고를 도포하고 수포나 과각질화로 인한 손가락 사이의 융합을 막기 위해 바셀린 거즈를 끼워두거나 손가락을 랩으로 싸두는 것이 도움이 될 수 있다[1,8].
수포성 표피박리증 환아는 화상 환자들과 비슷하게 상처 치유를 위해 소모되는 에너지가 높아 칼로리와 단백질 요구량이 증가한다. 영양공급을 최대화하여 성장과 발달을 촉진시키는 것이 상처 치유와 삶의 질을 향상시킬 수 있으므로 영양공급 및 성장 발달에 주의해야 한다[8]. 본 사례의 환아도 입원기간 중 체중 증가가 더뎌 칼로리 보충제를 분유에 추가하여 수유하였고, 퇴원 후 외래 방문 시에도 체중 증가가 잘 되지 않아 특수분유로 변경 후 성장과 발달에 대해 추적관찰 중이다.
신생아 시기의 수포성 표피박리증의 경우 치료뿐만 아니라 보호자, 가족들에의 지지와 교육 또한 중요하며 유전상담도 함께 이루어져야 한다. 질환의 경과 및 예후에 대해 자세히 설명하고, 추후 수포나 상처에 대한 소독, 관리 등에 대하여 확실하게 교육한 뒤 퇴원을 하는 것이 재입원 가능성을 줄이고 감염 등의 합병증을 줄이는 데 도움이 될 수 있다.
본 사례의 경우 초기에 환아의 임상증상 진행 상태를 확인하면서 조기에 수포성 표피박리증을 의심하여 유전자 검사를 시행하고 치료를 지속하였다. 수포성 표피박리증은 단기간에 완치되는 질환이 아니라 지속적인 치료와 관리가 필요한 질환이므로 신생아에서 수포성 병변이 지속되면서 다른 감염성 질환 등 감별 질환들이 배제가 되었을 때, 수포성 표피박리증을 의심하고 조기에 검사 및 치료를 적극적으로 해야 한다. 또한 의심이 되는 환아에서 유전자 검사를 적극 활용하여 확진 및 아형을 확인하고, 가족검사 및 유전 양상 등에 대한 유전 상담도 이루어져야 한다. 국내에서는 신생아기에 유전자 검사를 통해 EBS-DM으로 진단된 두 번째 사례이며 수포성 질환이나 수포성 표피박리증이 의심되는 신생아에서 유전자 검사의 중요성을 알리고 이를 관리 및 치료하는 데에 도움이 될 것이다.
Notes
Ethical statement
This study was approved by the Institutional Review Board of Chosun University Hospital (Approval number: CHOSUN 2022-07-016). Written informed consent by the patients was waived due to a retrospective nature of our study.
REFERENCES
1. Peterside O, Kunle-Olowu OE, Adeyemi OO, Akinbami FO, Omene J. Epidermolysis bullosa simplex: a case report. Niger J Paediatr. 2012; 39:194–6.
2. Yasukawa K, Sawamura D, Goto M, Nakamura H, Jung SY, Kim SC, et al. Epidermolysis bullosa simplex in Japanese and Korean patients: genetic studies in 19 cases. Br J Dermatol. 2006; 155:313–7.
3. Lim SM, Kim JH, Kim Y, Paik SS, Kim JE, Ko JY, et al. A novel mutation of KRT14 gene in a newborn with epidermolysis bullosa simplex (Dowling-Meara type): case report. Perinatology. 2020; 31:39–43.
4. Kang TW, Lee JS, Kim SE, Oh SW, Kim SC. Novel and recurrent mutations in keratin 5 and 14 in Korean patients with epidermolysis bullosa simplex. J Dermatol Sci. 2010; 57:90–4.
5. Dabas H, Xavier T, Varghese P, Malik S. Management of newborn with epidermolysis bullosa: case report. Ann Clin Case Rep. 2019; 4:1667.
6. Sawamura D, Nakano H, Matsuzaki Y. Overview of epidermolysis bullosa. J Dermatol. 2010; 37:214–9.
7. Muller FB, Kuster W, Wodecki K, Almeida H Jr, BrucknerTuderman L, Krieg T, et al. Novel and recurrent mutations in keratin KRT5 and KRT14 genes in epidermolysis bullosa simplex: implications for disease phenotype and keratin filament assembly. Hum Mutat. 2006; 27:719–20.
8. Gonzalez ME. Evaluation and treatment of the newborn with epidermolysis bullosa. Semin Perinatol. 2013; 37:32–9.
9. So JY, Teng J. Epidermolysis bullosa simplex. In : Adam MP, Everman DB, Mirzaa GM, editors. GeneReviews [Internet]. Seattle: University of Washington, Seattle;1993-2022. [cited 2022 Oct 25]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1369.
10. Fallatah BA, Al-shareef OM. Generalized epidermolysis bullosa simplex, Dowling Meara in Saudi family: case report and review of literature, Saudi Arabia 2017-2018. Int J Med Res Prof. 2018; 4:469–71.
11. Son MK, Lee TK, Choeh HJ, Choeh KC. A case of pyloric atresia associated with epidermolysis bullosa. Korean J Pediatr. 1996; 39:1015–9.
12. Boesen ML, Bygum A, Hertz JM, Zachariassen G. Newborn with severe epidermolysis bullosa: to treat or not to treat? BMJ Case Rep. 2016; 2016:bcr2016214727.
Figure 1.
Multiple blisters and erosions are on the whole body, especially intertriginous skin area in hospital day 2. Foam-type wound covering material was applied to the back and right forearm.
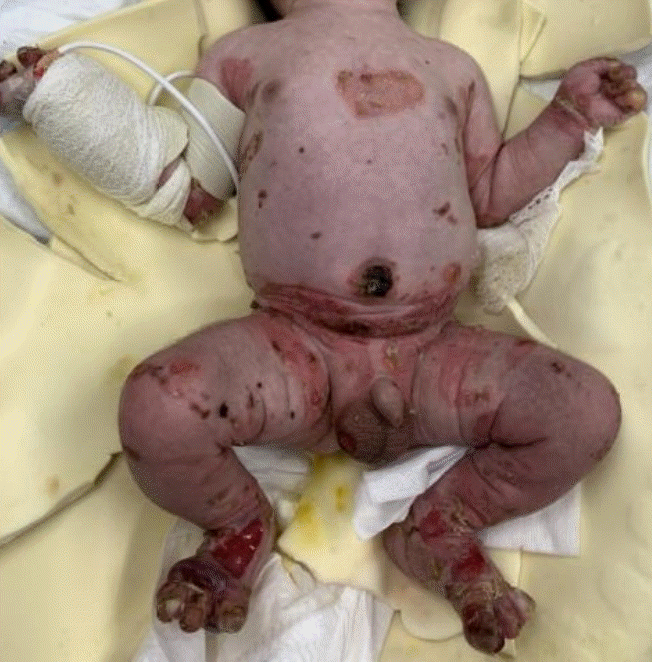
Figure 2.
(A) Large size of blister and erosions are on right foot. (B) Nail dystrophy of the left finger is observed (especially on thumb).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download