Abstract
Purpose
Atrial flutter is an uncommon arrhythmia in the neonatal period. This study aimed to describe the cause and clinical course of atrial flutter in neonates.
Methods
The medical records of 14 patients diagnosed with atrial flutter at Ulsan University Hospital Neonatal Intensive Care Unit (NICU) between March 2008 and August 2020 were reviewed retrospectively.
Results
All 14 cases occurred on the first day of birth. Of these, two were term infants, and 12 were preterm infants. Causes of atrial flutter included three cases of the umbilical venous catheter misplacement, one with a diabetic mother, and one ivolving atrial flutter after an intravenous aminophylline injection. Thirteen patients had structurally normal hearts with no congenital heart diseases. The patient, born to a diabetic mother, had an atrial septal defect and ventricular hypertrophy. Adenosine was administered first to differentiate it from paroxysmal supraventricular tachycardia. Synchronized cardioversion was attempted in 11 patients, while one received it after an esmolol injection that failed to convert to sinus rhythm. One patient had a recurrence after the intrusion of a peripherally inserted central catheter; however, atrial flutter disappeared after repositioning it. No patient had a recurrence after discharge.
Conclusion
Neonatal atrial flutter is a rare tachyarrhythmia with the risk factors often unknown; however, it could occur in structural heart disease, mispositioning of the umbilical venous catheter, and if the mother has diabetes. During umbilical venous catheterization, clinicians should be cautious and ensure appropriate monitoring of infants in the NICU as it may cause complications.
심방 조동은 심방 내 회귀성 빠른맥으로, 전형적인 경우 심전도에서 특징적인 톱니 형태의 조동파를 나타낸다[1,2]. 신생아기에 진단되는 부정맥 중 비교적 드문 유형으로, 진단 당시 특별한 증상을 동반하지 않는 경우가 많으나, 장기간 지속될 경우 심부전이 발생할 가능성이 높으므로 조기 진단 및 적극적인 치료가 중요하다[3-5]. 영아기 이후 소아에서 발생하는 심방 조동은 선천성 심장 질환이나 광범위한 심방 수술 후 합병증으로 인해 주로 발생하는 반면 신생아기에는 구조적 심장 질환이 없는 경우에도 발생하는 경우가 많으며, 상당수는 원인이 불명확한 것으로 알려져 있다[3-6].
2008년 3월부터 2020년 8월까지 울산대학교병원 신생아집중치료실에 입원한 환아들 중 심방 조동으로 진단된 환아들의 의무기록을 후향적으로 분석하였다. 신생아의 임상적 특성으로는 재태주령, 출생 체중, 성별, 출생 방법, 1분 및 5분 아프가 점수, 다태아 여부 등에 관한 정보를 조사하였고, 심방 조동과 관련해서는 발생 시기 및 진단 시기, 흉부 X선 검사 소견, 심전도 소견, 심초음파 검사 소견, 가능성 있는 원인들, 치료 방법, 재발 여부 등에 관하여 조사하였다. 심전도 검사 중 12 유도 심전도는 PageWriter TC30 (Philips, Cambridge, Massachusetts, USA)를 사용하였고, 단일 유도 심전도는 IntelliVue MP70 (Philips, Amsterdam, Netherlands) 환자 감시 모니터를 이용하여 기록하였으며 소아 심장 전문의에 의해 판독되었다. 이번 연구에서 심방 조동의 발생이 배꼽정맥 카테터와 연관성이 있다고 판단한 기준으로는 (1) 카테터 삽입술 도중 심방 조동이 발생한 경우; (2) 심방 조동이 발생시 시행하였던 흉부 X선 검사에서 카테터의 위치가 좌심방 또는 우심방 내에 위치한 경우; (3) 시술 후 카테터의 위치가 부적절하여 카테터를 재고정하는 도중 또는 재고정 후 30분 이내 심방 조동이 발생한 경우로 정의하였다.
연구 기간 중 신생아집중치료실에 입원한 환아는 4,860명이었으며, 심방 조동으로 진단된 신생아는 총 14명으로, 이 중 남아는 9명, 여아가 5명이었다. 재태주령 중앙값은 33.9주, 출생 체중 중앙값은 2405g이었으며, 만삭아가 2명, 미숙아가 12명을 차지하였다. 출생 방법은 자연 분만으로 태어난 환아 4명, 제왕 절개 분만으로 태어난 환아가 10명이었고, 4명의 환아는 다태아였으며, 5분 아프가 점수는 1명의 환아를 제외하고는 모두 7점 이상으로 양호하였다. 만삭아 중 1명은 빠른맥을 주소로, 나머지 1명은 출생 후 빠른 호흡을 주소로 타원에서 전원 되었으며, 2명 모두 산전에서 특이소견은 없었고, 미숙아 12명은 본원에서 출생 후 미숙아에 대한 전반적인 치료를 위해 입원하였다.
총 14명의 환아 중 11명은 빠른맥이 발생하기 이전부터 빠른 호흡 또는 신생아 호흡곤란 증후군으로 호흡 보조 요법을 시행 받았으며, 시행 방법에 따라 4명은 기계 환기 요법, 6명은 고유량 비강캐뉼라, 나머지 1명은 지속적 비강 양압 환기 요법을 시행 받았다. 고유량 비강캐뉼라를 사용 중이던 6명 중 2명은 빠른맥 발생 후 호흡 양상이 악화되어 추가적으로 기계 환기 요법을 시행 받았다. 빠른맥 발생 이전에 호흡이 비교적 안정적이었던 3명 중 1명은 빠른맥 발생 후 심한 흉골 함몰 및 빠른 호흡이 발생하여 기계 환기 요법을 시행 받았고, 1 명은 고유량 비강캐뉼라를 적용하였으며 나머지 1명은 호흡 보조 요법을 필요로 하지 않았다(Table 1).
심방 조동으로 진단된 시기는 생후 24시간 이내에 진단된 경우가 13명이었으며, 나머지 1명은 생후 24시간 이내에 빠른맥이 발생하였으나 생후 2일째 비로소 심방 조동으로 진단되었다. 의료인에 의해 빠른맥이 인지된 후 빠른맥의 치료 또는 감별진단을 목적으로 얼음주머니를 대 보거나 아데노신을 투여하기까지 걸린 시간의 중앙값은 261분이었다. 얼음주머니는 5명에서 사용하였으나 효과가 없어 모두 아데노신을 투약하였다.
심전도 검사에서 심실 조동 발생시 심방 박동수의 중앙값은 403 회/분이었으며, 심실 박동수는 201회/분, 모든 환아에서 2:1 방실 전도가 주된 패턴이었다(Figure 1). 12 유도 심전도나 단일 유도 심전도 검사를 통해 전형적인 조동파를 확인할 수 있었던 환아는 13명이었으며(Figure 1), 나머지 1명은 12 유도 심전도 검사에서 조동파가 명확하지 않았으나 아데노신 투여 시 조동파를 확인할 수 있었다 (Table 2, Figure 2).
심장 초음파 검사에서 구조적으로 정상인 경우 1명, 난원공이 있었던 경우 6명, 작은 심방중격결손이 있었던 경우 1명, 결손이 작은 근성 심실중격결손이 있었던 경우 1명, 혈역학적으로 유의하지 않은 동맥관 개존이 있었던 경우 3명, 심실 비대가 있었던 경우 1명, 폐동맥 고혈압이 있었던 경우가 1명이었다. 심실 비대가 있었던 환아(증례 12)의 경우는 산모의 당뇨병의 영향으로 심실 비대가 발생한 경우였으며, 폐동맥 고혈압이 있었던 환아(증례 13)의 경우는 후기 미숙아로 이행기 과정 중 불안정으로 인해 태아 시기의 폐동맥 고혈압이 지속되어 동맥관과 난원공을 통한 양방향성 단락이 관찰되었으나 안정 후 추적 검사에서 호전되었음을 확인할 수 있었다.
심방 조동에 대한 원인으로는 배꼽정맥 카테터와 연관성이 있는 경우가 3명(Table 3), 산모의 임신성 당뇨병과 연관성이 의심되는 경우가 1명, 아미노필린 투여 후 발생한 경우가 1명이었으며, 나머지 9명에서는 명확한 원인을 규명하지 못하였다.
심방 조동에 대한 치료는 일차적으로 동기화 심율동 전환을 시행한 경우가 11명이었으며, 에스모 투여 후 호전이 없어 동기화 심율동 전환을 시행한 경우가 1명, 나머지 2명은 아데노신 투여 후 반응이 없었고, 이후에 심방 조동은 자연 소실 되었다. 동기화 심율동 전환으로 치료한 12명 중 8명은 한 번의 시도로 동율동(sinus rhythm)으로 전환되었으며, 4명은 2차례 이상 시도 후 동기화 심율동 전환에 성공하였다. 동율동으로 전환 후 13명의 환아에서는 입원 기간 중 심방 조동의 재발이 없었으며, 1명은 생후 12일째 말초 중심 정맥관 삽입 후 심방 조동이 재발하였으나 말초 중심 정맥관 위치 재고정 후 자연 소실 되었다. 퇴원 후 외래에서 추적 관찰 중 추가적인 심방 조동이 발생한 경우는 없었다(Table 3).
이번 연구를 통해 지난 12년 동안 본원 신생아집중치료실에 입원한 전체 환아의 0.28%에서 심방 조동이 발생하였음을 알 수 있었다. 다수의 환아에서 명확한 발생 원인을 알 수 없었으나 3례에서는 배꼽정맥 카테터 삽입술과 연관성이 있었다(Figure 3). 치료적 측면에서 동기화 심율동 전환이 재태 주수가 어린 미숙아를 포함한 신생아에서 발생한 심방 조동의 치료로서 매우 효과적인 방법임을 보여 주었다.
심방 조동은 태아기에 발생하는 빈맥의 주요 원인 중 하나로 알려져 있다. 태아 심방 조동에 대한 Wacker-Gussmann 등[10]의 연구에 따르면 태아기 빈맥은 전체 임신의 0.4%–0.6%에서 발생하며, 그 중심방 조동이 26%–29%를 차지하기 때문에 심방 조동의 발생 빈도는 0.10%–0.17%로 추정해 볼 수 있다. 신생아 시기 심방 조동의 발생 빈도는 연구 대상이나 심전도 검사 방법에 따라 다양하게 보고되고 있다. Southall 등[11]은 표준 심전도 검사를 시행한 정상 신생아 3,383명 중 1명(0.03%)에서 심방 조동을 진단한바 있으며, 영국에서 시행된 인구 기반 연구에서는 정상 출생아 10만명 당 2.1명(0.002%)에서 심방 조동이 발생한 것으로 조사되었다[12]. 최근 일본의 단일 신생아집중치료실에서 시행된 후향적 연구에 따르면, 8,082명의 입원 환아 중 3명(0.04%)의 환아에서 심방 조동이 발생한 것으로 보고한바 있으며[13], 이번 연구에서는 연구 기간 동안 신생아집중치료실에 입원한 환아 1,000명당 약 3명(0.3%)에서 심방 조동이 발생하였다. 이들의 연구와 비교해 볼 때, 연구 기간 동안 본원에서 입원한 환아에서 심방 조동의 발생 빈도가 높은 것에 대한 명확한 원인을 알 수는 없으나 이번 연구에서는 배꼽정맥 카테터 삽입술과 연관되어 발생한 예들이 일부 포함되어 있어 빈도가 다소 증가한 것으로 생각된다.
신생아에서 빠른맥은 분당 맥박수가 180회 이상 지속되는 경우로 정의하고 있다. 하지만 실제 임상에서는 신생아가 여러 가지 이유로 울거나 보채는 경우에도 동성 빠른맥을 보이는 경우가 종종 발생하므로 의료인들이 빠른맥의 중요성을 간과하는 경우가 생길 수 있다. 이번 연구에서도 빠른맥이 발생하였음에도 의료진이 이를 임상적으로 유의한 부정맥으로 판단하고 이에 대한 처치나 감별 진단을 위해 접근하기까지 때로는 상당 시간이 소요되는 경우가 발생하였기에 이에 대한 주의 깊은 관찰이 필요함을 상기시켜 주었다.
심방 조동은 심전도에서 전형적인 '톱니' 또는 '말뚝 울타리' 패턴을 보이는 경우 비교적 용이하게 진단할 수 있으나, 이러한 전형적인 형태의 심방 조동파가 신생아나 어린 영아에서 항상 잘 보이는 것은 아니다. Dunnigan 등[14]의 연구에 따르면 심방 조동으로 진단된 8명의 영아 중 12 유도 심전도에서 전형적인 조동파가 관찰된 경우는 단지 2명뿐이었으며, 나머지 6명은 경식도 심전도를 통해 진단한 것으로 보고한바 있다. 특히 심방 조동파가 QRS파와 ST-T파에 겹쳐진 경우에는 조동파를 확인하기가 어려우며, 이러한 경우 상실성 빠른 맥에 대한 감별 진단을 위해 임상에서 흔히 사용하고 있는 아데노신의 정맥 내 투여가 숨어 있는 조동파를 밝혀내는데 유용한 것으로 알려져 있다[15]. 이번 연구에서 심방 조동으로 진단된 대다수의 환아는 12 유도 심전도나 단일 유도 심전도에서 특징적인 심방 조동파가 관찰되어 진단이 어렵지 않았으나, 1명의 환아에서는 아데노신 투여 후에 비로소 전형적인 조동파를 확인할 수 있었다.
신생아기 심방 조동의 발생과 연관성이 밝혀져 있는 주된 원인으로는 구조적 심장 질환 및 심장 수술[12,14], 배꼽정맥 카테터의 위치 이상[2,8,14,16-19], 산모의 코카인이나 오피오이드계 약물 사용[20,21] 등이 있으며, 당뇨병 산모에게서 태어난 신생아는 일반 신생아에 비해 심방 부정맥이 발생하는 빈도가 높은 것으로 알려져 있다[16,22].
신생아기에 발생한 심방 조동의 경우에 Turner와 Wren [12]의 연구에 따르면 36%에서 구조적 심장 질환이 동반된 것으로 보고한 바 있으나 다수의 연구에서는 정상 심장 구조를 가진 신생아에서 주로 발생하여 그 원인이 불명확한 경우가 많은 것으로 보고하였다[3-5]. 이번 연구에서도 복잡 심기형을 가진 환아는 없었으며, 미숙아에서 이행기 중에 흔히 관찰되는 난원공 개존 또는 동맥관 개존증 등이 관찰되었으나 혈역학적으로 유의한 소견을 보이지 않았다. 당뇨병 산모에게서 태어난 증례 12의 경우 심실의 비대가 관찰되었으며, 증례 13의 경우 이행기 과정 중 불안정으로 인해 폐동맥 고혈압 및 동맥관을 통한 우좌 단락이 관찰되었으나 추적 검사에서 호전되었음을 확인할 수 있었다.
배꼽정맥 카테터 삽입술과 관련된 다양한 합병증 중 하나로 부정맥이 발생할 수 있다. 이는 주로 카테터의 위치가 부적절한 경우에 발생하며 대부분은 삽입 시점에 나타나는 것으로 알려져 있다. 이번 연구에서는 14명의 환아 중 13명에서 배꼽정맥 카테터 삽입술이 시행되었으며, 이 중 3명의 환아에서는 카테터의 위치와 시술 또는 카테터 재고정 후 심방 조동의 발생 시간을 고려하였을 때 연관성이 매우 높은 것으로 판단되었다. 따라서 시술 전 제대정맥 카테터의 삽입 길이를 가늠하여 카테터의 삽입 길이를 최대한 정확하게 추정 후 시술을 진행하는 것이 중요하며 시술 후에는 흉부 X선 검사나 초음파 검사를 통해서 카테터의 위치를 반드시 확인하여 적절한 높이에 위치하도록 해야 한다. 카테터 삽입 후 부정맥이 발생하는 주된 기전 으로는 카테터 끝이 심내막과 접촉할 때 유도되는 조기 심방 박동이 심방 조동이나 부전도를 통한 방실 접합부 회귀성 빠른맥 발생의 트리거로 작용할 수 있을 것으로 생각되고 있다[17,18]. 배꼽정맥 카테터와 관련되어 발생하는 임상적으로 중요한 부정맥은 방실 접합부 회귀성 빠른맥과 심방 조동이다. 방실 접합부 회귀성 빠른맥에 비해 심방 조동은 일반적으로 카테터와 관련되지 않은 상황에서 매우 드물게 발생하므로 카테터 삽입술 후 빠른맥이 발생 시 간과되기가 쉽다. 하지만 방실 접합부 회귀성 빠른맥의 경우는 아데노신 투여로 동율동으로 전환되는 경우가 많은 반면, 심방 조동의 경우에는 동기화 심율동 전환으로 치료해야 경우가 빈번하기 때문에 이 두 가지 부정맥을 감별하는 것은 매우 중요하다.
당뇨병 산모에게서 출생한 신생아나 거대아의 경우에는 심실 비대와 상관없이 심방 조동이 발생하는 경우가 있으며 이는 자궁 내에서 심장의 이완기 기능 장애와 심방의 신전 손상과 관련이 있는 것으로 여겨지고 있다[22]. 이번 연구에서 포함된 당뇨병 산모에게서 출생한 환아의 경우에는 심실 비대가 동반되어 있었다. 또한 이번 연구에서는 아미노필린 투약 후 심방 조동이 발생한 예가 있었으며 아미노필린과 연관하여 성인에서는 심방 세동이나 다소성 심방 빠른맥 등의 부정맥이 발생한 증례가 보고된바 있다[23]. 신생아에서 아미노필린과 연관하여 심방 조동이 발생한 보고는 없으나 아미노필린 투약시 빠른맥이 발생할 수 있기에 투약 후에는 심박수를 모니터링하는 것을 권고하고 있으며, 분당 심박수가 180회 이상일 경우 그 다음 투약을 보류하는 것을 추천하고 있다.
심방 조동의 치료 목표는 심실 박동수를 조절하고, 조동파를 동율동으로 전환시킨 후 부정맥이 재발하지 않도록 유지하는 것이다. Texter 등[5]의 연구에 따르면 신생아 및 영아에서 발생한 심방 조동의 경우 환아의 26%에서 진단 후 24시간 내에 자연적으로 동율동으로 전환되는 것으로 보고한 바 있다. 이를 바탕으로 무증상 신생아의 경우 심기능이 정상이라면 진단 후 6–12시간까지는 심율동 전환을 보류하고 자연 호전을 기대하며 기다려 보는 것을 제안한 바 있다. 이번 연구에서도 아데노신 투여 후 또는 배꼽정맥 카테터 위치를 재고정 후 심방 조동이 자연 소실됨을 관찰하였기에 혈역학적으로 안정된 무증상의 신생아의 경우 일정 시간 경과 관찰하는 것도 합리적인 것으로 생각된다. 하지만 재태 주수가 어린 미숙아의 경우에는 심방 조동이 발생 시 호흡곤란 증세가 악화되는 경향이 있어 조기 치료가 안전할 것으로 판단된다. 심방 조동이 발생한 신생아에서 혈역학적으로 안정적인 경우에는 약물 치료를 우선적으로 고려하게 된다. 하지만 신생아기에 발생한 심방 조동은 베타차단제나 디곡신과 같은 일차 약물에는 효과가 없는 경우가 많아 이차 치료제인 flecainide, amiodarone, sotalol 등의 약물이나 경식도 조율 또는 전기적 심율동 전환이 필요한 경우가 흔하다[6,24,25]. 동기화된 심율동 전환은 혈역학적으로 불안정한 급성기나 다른 치료 방법이 실패한 경우에 시도될 수 있으며, 특히 신생아의 경우 다른 치료 방법에 비해 가장 효과적인 방법으로 선호되는 치료법이다[6]. 이번 연구에서는 12명의 환아에서 전기적 심율동 전환을 시행하였으며 모든 예에서 동율동 전환이 가능하였다.
일반적으로 신생아기에 발생한 심방 조동의 경우 구조적 심질환이 없고 심기능이 안정적이며 초기 치료한 반응이 양호하였던 경우에는 재발의 위험이 낮아 장기간의 예방적 약물 요법은 대부분에서 필요하지 않은 것으로 알려져 있다[3-5]. 이번 연구에서도 1명의 환아에서 말초 중심 정맥관 삽입 후 일시적으로 심방 조동이 재발하였으나 정맥관 위치를 재고정 후 자연 호전되었으며, 모든 예에서 예방적 약물 요법은 필요하지 않았다.
결론적으로 신생아기에 발생하는 심방 조동의 경우 위험 요인을 알 수 없는 경우가 빈번하나 구조적 심장 질환, 배꼽정맥 카테터의 위치 이상, 당뇨병 산모에게서 태어난 신생아 등에서 발생할 수 있다. 특히 신생아중환자실에서 흔히 시행되는 배꼽정맥 카테터 삽입과 관련된 합병증으로 발생하는 경우가 있기에 시술 후 발생 가능한 합병증에 대한 적절한 모니터링이 필요하다. 또한 신생아에서 빠른 맥이 발생 시 임상적으로 유의한 빠른맥을 항상 염두에 두고 적극적인 감별 진단 및 치료가 중요한 것으로 판단된다.
Notes
Ethical statement
This study was approved by the Institutional Review Board of Ulsan University Hospital (IRB No. 2020-09-011). Informed consent was waived by the board.
REFERENCES
1. Dubin AM. Arrhythmias in the newborn. NeoReviews. 2000; 1:e146–51.
2. de Almeida MM, Tavares WG, Furtado MM, Fontenele MM. Neonatal atrial flutter after the insertion of an intracardiac umbilical venous catheter. Rev Paul Pediatr. 2016; 34:132–5.
3. Lisowski LA, Verheijen PM, Benatar AA, Soyeur DJ, Stoutenbeek P, Brenner JI, et al. Atrial flutter in the perinatal age group: diag nosis, management and outcome. J Am Coll Cardiol. 2000; 35:771–7.
4. Casey FA, McCrindle BW, Hamilton RM, Gow RM. Neonatal atrial flutter: significant early morbidity and excellent long-term prognosis. Am Heart J. 1997; 133:302–6.
5. Texter KM, Kertesz NJ, Friedman RA, Fenrich AL Jr. Atrial flutter in infants. J Am Coll Cardiol. 2006; 48:1040–6.
6. Wojtowicz-Marzec M, Wysokinska B, Respondek-Liberska M. Successful treatment of neonatal atrial flutter by synchronized cardioversion: case report and literature review. BMC Pediatr. 2020; 20:370.
7. Ko JK, Kim SH, Bae EJ, Kang IS, Lee HJ. Atrial flutter conversion in infants and children using transesophageal atrial pacing. J Korean Pediatr Soc. 1994; 37:969–75.
8. Oh KW, Lee KY, Kim JH, Kim JS. A case of atrial flutter after umbilical venous catheterization. Korean J Perinatol. 2012; 23:13–6.
9. Lee MJ, Ahn SH, Kim JH, Kim SY, Ban JE. Intractable atrial flutter successfully treated with flecainide and propranolol in a premature infant. Ewha Med J. 2017; 40:140–2.
10. Wacker-Gussmann A, Strasburger JF, Srinivasan S, Cuneo BF, Lutter W, Wakai RT. Fetal atrial flutter: electrophysiology and associations with rhythms involving an accessory pathway. J Am Heart Assoc. 2016; 5:e003673.
11. Southall DP, Johnson AM, Shinebourne EA, Johnston PG, Vulliamy DG. Frequency and outcome of disorders of cardiac rhythm and conduction in a population of newborn infants. Pediatrics. 1981; 68:58–66.
12. Turner CJ, Wren C. The epidemiology of arrhythmia in infants: a population-based study. J Paediatr Child Health. 2013; 49:278–81.
13. Doi Y, Ueda K, Ogino K, Hayashi T, Takahashi A, Waki K, et al. Incidence of non-benign arrhythmia in neonatal intensive care unit: 18 years experience from a single center. J Arrhythm. 2022; 38:363–8.
14. Dunnigan A, Benson W Jr, Benditt DG. Atrial flutter in infancy: diagnosis, clinical features, and treatment. Pediatrics. 1985; 75:725–9.
15. Kothari DS, Skinner JR. Neonatal tachycardias: an update. Arch Dis Child Fetal Neonatal Ed. 2006; 91:F136–44.
16. Kedziora P, Stasiak A. Atrial flutter-unique arrhythmia in neonatal population, presentation of 3 cases. Adv Neonatal Care. 2020; 20:487–94.
17. Amer A, Broadbent RS, Edmonds L, Wheeler BJ. Central venous catheter-related tachycardia in the newborn: case report and literature review. Case Rep Med. 2016; 2016:6206358.
18. Verheij G, Smits-Wintjens V, Rozendaal L, Blom N, Walther F, Lopriore E. Cardiac arrhythmias associated with umbilical venous catheterisation in neonates. BMJ Case Rep. 2009; 2009:bcr04.2009.1778.
19. Sinha A, Fernandes CJ, Kim JJ, Fenrich AL Jr, Enciso J. Atrial flutter following placement of an umbilical venous catheter. Am J Perinatol. 2005; 22:275–7.
20. Sivakumar S. Atrial flutter in preterm babies. Arch Dis Child Fetal Neonatal Ed. 2004; 89:F564.
21. Gad A, Morelli P, Decristofaro J. Perinatal isolated atrial flutter associated with maternal cocaine and opiate use in a late preterm infant. J Matern Fetal Neonatal Med. 2010; 23:1062–5.
22. Pike JI, Krishnan A, Kaltman J, Donofrio MT. Fetal and neonatal atrial arrhythmias: an association with maternal diabetes and neonatal macrosomia. Prenat Diagn. 2013; 33:1152–7.
23. Tisdale JE, Chung MK, Campbell KB, Hammadah M, Joglar JA, Leclerc J, et al. Drug-induced arrhythmias: a scientific statement from the American Heart Association. Circulation. 2020; 142:e214–33.
24. Yilmaz-Semerci S, Bornaun H, Kurnaz D, Cebeci B, Babayigit A, Buyukkale G, et al. Neonatal atrial flutter: three cases and review of the literature. Turk J Pediatr. 2018; 60:306–9.
25. Ghandi Y, Alinejad S. A case report of neonatal atrial flutter with poor feeding and tachypnea. Iran J Neonatol. 2020; 11:92–6.
Figure 1.
A 12-lead electrocardiogram of Case 1 shows a saw-tooth pattern of atrial flutter with 2:1 atrioventricular conduction in leads II, III, and aVF.
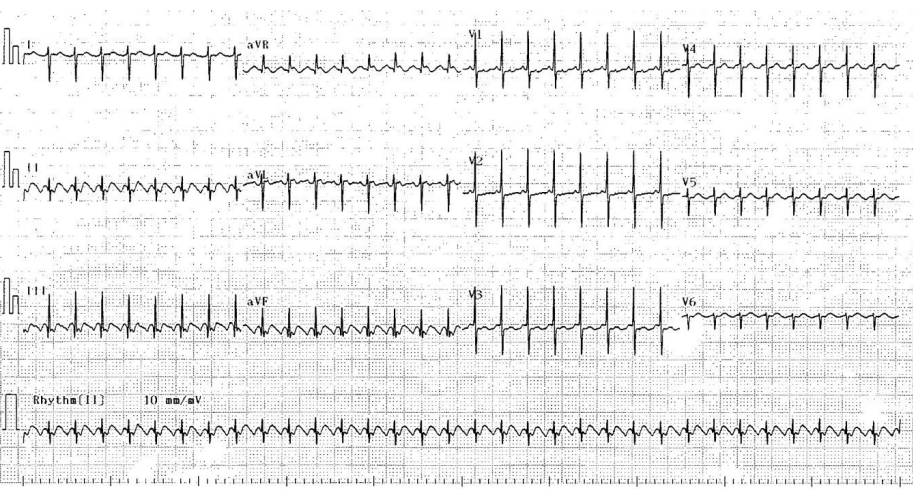
Figure 2.
(A) Baseline 12-lead electrocardiogram of Case 10 demonstrates narrow QRS-tachycardia with a ventricular rate of 200 beats per minute. (B) A 12-lead electrocardiogram after adenosine injection shows atrial flutter of 462 beats per minute with variable atrioventricular conduction.
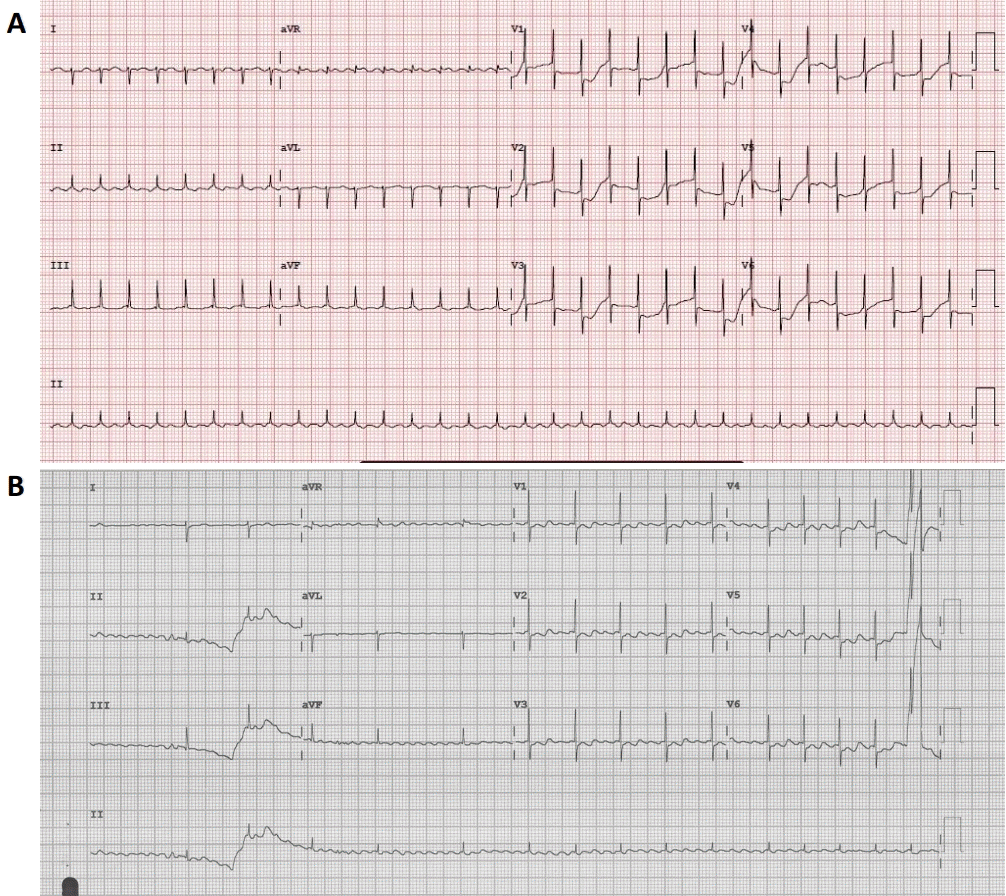
Figure 3.
Chest radiograph of Case 13 demonstrating an umbilical venous catheter in the left atrium (white arrow: tip of umbilical catheter).
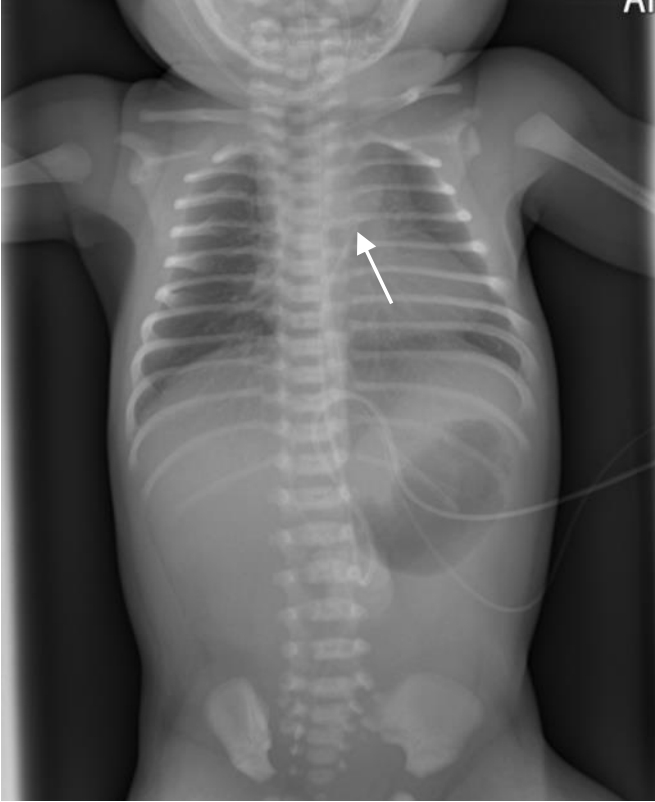
Table 1.
Demographics and Clinical Characteristics of 14 Patients with Neonatal Atrial Flutter
Table 2.
Diagnosis and Electrocardiogram Findings of 14 Patients
| Onset of tachycardia after birth (hr) | Time interval* (min) | Age at diagnosis (d) | Atrial rate | Ventricular rate | Atrioventricular conduction ratio | |
|---|---|---|---|---|---|---|
| Case 1 | <1 | 336 | 1 | 396 | 198 | 2:1 |
| Case 2 | 10 | 2,290 | 3 | 446 | 223 | 2:1 |
| Case 3 | 16 | 110 | 1 | 374 | 187 | 2:1 |
| Case 4 | 5 | 5 | 1 | 456 | 228 | 2:1 |
| Case 5 | 2 | 150 | 1 | 460 | 230 | 2:1 |
| Case 6 | 3 | 65 | 1 | 390 | 195 | 2:1 |
| Case 7 | 13 | 13 | 1 | 444 | 222 | 2:1 |
| Case 8 | 4 | 356 | 1 | 406 | 203 | 2:1 |
| Case 9 | 2 | 130 | 1 | 392 | 196 | 2:1 |
| Case 10 | 2 | 26 | 1 | 400 | 200 | 2:1 |
| Case 11 | 3 | 175 | 1 | 426 | 213 | 2:1 |
| Case 12 | 6 | 55 | 1 | 382 | 191 | 2:1 |
| Case 13 | 2 | 9 | 1 | 375 | 185 | 2:1 |
| Case 14 | 3 | 10 | 1 | 436 | 218 | 2:1 |
Table 3.
Risk Factors, Treatment, and Recurrence of 14 Patients
|
Echocardiography |
UVC catheterization | Risk factor | Treatment | Recurrence | ||
|---|---|---|---|---|---|---|
| Initial | Follow-up (mo) | |||||
| Case 1 | ASD/PFO | Normal (12) | No | Unknown | Cardioversion | No (12 yr 11 mo) |
| Case 2 | PFO | Not done | Yes | UVC | Esmolol, Cardioversion | No (2 mo) |
| Case 3 | PDA/ASD | Normal (11) | Yes | Unknown | Cardioversion | Yes* (6 yr 6 mo) |
| Case 4 | mVSD/ASD | Normal (10) | Yes | Unknown | Cardioversion | No (1 yr 8 mo) |
| Case 5 | PFO | Normal (10) | Yes | UVC | Cardioversion | No (3 yr) |
| Case 6 | PDA/ASD | Normal (3) | Yes | Unknown | Cardioversion | No (1 yr 2 mo) |
| Case 7 | PFO | Not done | Yes | Unknown | Cardioversion | No (3 yr) |
| Case 8 | PFO | Not done | Yes | Unknown | Cardioversion | No (9 mo) |
| Case 9 | PFO | Normal (36) | Yes | APL | Cardioversion | No (3 yr 1 mo) |
| Case 10 | Normal | Not done | Yes | Unknown | Spontaneous recovery | No (2 yr 11 mo) |
| Case 11 | PFO | Not done | Yes | Unknown | Spontaneous recovery | No (5 mo) |
| Case 12 | Ventricular hypertrophy/ASD | Normal (1) | Yes | Maternal DM, ventricular hypertrophy | Cardioversion | No (4 mo) |
| Case 13 | PHT/Large PDA/mVSD/ASD | Normal (1) | Yes | UVC | Cardioversion | No (6 mo) |
| Case 14 | PDA/ASD | Normal (2) | Yes | unknown | Cardioversion | No (1 yr 6 mo) |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download