Abstract
Purpose
Patent ductus arteriosus (PDA) is associated with increased mortality and morbidities such as intraventricular hemorrhage, necrotizing enterocolitis, bronchopulmonary dysplasia, and neurodevelopmental impairment. The objective of this study was to evaluate mortality and morbidities according to the time of PDA closure.
Methods
For this study, 117 preterm infants with gestational age (GA) of <30 weeks who had PDA were enrolled and allocated to two groups according to the time of PDA closure as follows: early closed group (n=40, PDA closure in <14 days after birth) and delayed closed group (n=77, PDA closure in ≥14 days after birth).
Results
GA was higher in the early closed group than in the delayed closed group (27.2±1.6 weeks vs. 26.3±1.7 weeks, P=0.005). Other demographic factors, such as birth weight, Apgar score, and maternal status were not significantly different between the two groups. The incidence rates of surfactant redosing, retinopathy of prematurity (stage ≥II), necrotizing enterocolitis (stage ≥II), moderate to severe bronchopulmonary dysplasia, and mortality were similar between the two groups. The total durations of mechanical ventilation, invasive ventilation, and hospital stay were longer in the delayed closed group than in the early closed group. However, these became similar after adjustment for GA. The incidence rate of intraventricular hemorrhage (grade ≥III) was significantly higher in the early closed group than in the delayed closed group after adjustment for GA (25.0% vs. 13.0%, adjusted P for GA=0.021).
동맥관은 태생기에는 우심실 박출량의 대부분을 대동맥으로 보내는 중요한 역할을 하지만 출생 후 폐순환이 시작됨에 따라 불필요해지며, 평활근의 수축과 평활근의 허혈성 저산소증이 진행되면서 폐쇄된다[1]. 동맥관은 만삭 신생아에서는 생후 48시간 이내에 90%에서 기능적으로 폐쇄되며 이후에 해부학적으로 완전히 폐쇄된다[1]. 이러한 폐쇄 기전은 35주 정도에 완전히 성숙되지만, 미숙아는 폐쇄 과정에 대한 민감도가 떨어지고, 산소 대사가 역설적으로 프로스타글란딘 E2 (prostaglandin E2) 생성을 자극하고, 동맥관의 확장을 야기해서 폐쇄 과정이 지연되거나 폐쇄 후 재개방되는 경우가 많다[2]. 따라서 동맥관개존증은 초미숙아에서 가장 흔한 심장상태로, 재태연령(gestational age, GA) 29주 미만 미숙아의 40%-60%에서 발생하며[3] GA 28주 미만 미숙아의 70%에서 발생한다[4].
미숙아에서 동맥관개존증은 체순환에서 폐순환으로의 단락을 유발하고, 그 결과 체순환의 혈류량 감소와 폐순환의 혈류랑 증가로 인해 폐손상을 야기하며, 폐출혈, 기관지폐이형성증의 위험성을 증가시킨다[5]. 또한 체순환 혈류의 감소는 주요 장기 부전을 일으키며 괴사성 장염[6], 뇌실내출혈[7]의 위험을 증가시킨다. 따라서 이전에는 미숙아의 예후 향상을 위해 동맥관개존증을 생후 초기에 약물 또는 수술적 방법으로 폐쇄하는 것을 목표로 하였다[8].
그러나 인도메타신, 이부프로펜과 같은 동맥관 폐쇄에 사용되는 약물은 미숙아에서 뇌, 장, 신장으로의 혈류를 감소시키며[9], 미숙아에서 생후 초기의 수술은 수술 합병증과 마취 관련 혈역학적 및 호흡기 합병증을 유발하며 발달 지연의 위험 또한 증가시킨다고 보고되고 있다[10].
최근에는 지속되는 동맥관개존증과 미숙아의 예후 사이에 상관관계가 없다는 연구 결과가 발표되고 있으며[11], 또한 최근 동맥관을 약물이나 수술적 치료법으로 폐쇄하지 않고 수액 제한을 통한 보존적 접근법으로 예후를 향상시킨 결과들이 발표되면서[12] 동맥관개존증을 언제 치료할지, 약물이나 수술적 결찰술 등 어떤 방법으로 치료할지 정하는 것은 여전히 논란의 여지가 있다.
이 연구에서는 동맥관개존증이 있는 미숙아에서 동맥관 폐쇄 시기에 따른 뇌실내출혈, 기관지폐이형성증, 괴사성 장염, 미숙아 망막증 등의 예후와 사망률에 차이가 있는지 알아보고자 한다.
2014년 1월부터 2018년 12월까지 인제대학교 의과대학 부산백병원 신생아 집중치료실에 입원한 GA 30주 미만의 미숙아 중 동맥관개존증이 진단된 환자 145명 중, 동맥관이 열린 채 퇴원 후 외래에서 폐쇄 여부가 확인되지 않은 환자 6명과 폐쇄 여부를 확인하지 못하고 사망한 환자 22명을 제외한 117명을 대상으로 하였다(Figure 1).
117명의 환자의 의무기록을 후향적으로 분석하여 생후 14일 이전에 동맥관이 폐쇄된 군을 조기폐쇄군(40례)으로, 생후 14일부터 그 이후에 폐쇄된 군을 지연폐쇄군(77례)으로 정의[13]하였으며 폐쇄 시기에 따른 두 군 간의 특징 및 예후를 알아보았다.
인구 통계학적 요인으로 GA, 출생체중, 성별, 1분 및 5분 아프가 점수 등의 출생력과 산모의 임신성 고혈압, 임신성 당뇨, 산전 스테로이드 사용 여부, 조직학적으로 확진된 융모양막염 유무 등을 조사하였다. 예후인자는 신생아 호흡곤란증후군, 폐계면활성제의 2차 투여 여부, 뇌실내출혈, 미숙아 망막증, 괴사성 장염, 기관지폐이형성증, 인공환기 치료기간, 침습적 인공환기 치료기간, 입원기간, 입원 중 사망률을 조사하였다.
연구 대상 환자들은 출생 후 첫 1주일 이내에 심장초음파(Vivid S5, GE Healthcare, Chicago, IL, USA)를 시행하였으며, 혈역학적으로 의미 있는 동맥관개존증(hemodynamically significant patent ductus arteriosus, HS PDA)은 2 mm 이상의 직경을 가지며, 초음파에서 저명한 좌우 단락을 가지고 있는 동맥관이 존재하며, 인공환기의 도움이 필요하고 심잡음, 저혈압, 맥압(수축기 혈압과 이완기 혈압의 차이) 증가, 호흡 악화 등 동맥관개존증을 시사하는 증상이 동반되는 경우로 정의하였다[12]. 동맥관개존증이 진단된 환자는 수액제한과 같은 보존적 치료를 시행하였으며 HS PDA가 진단된 환자는 약물 치료를 시행하였다. 약물 치료의 금기에 해당하거나 약물 치료 후에도 HS PDA가 지속되는 경우 수술적 치료를 시행하였다. 심장초음파에서 HS PDA가 지속되며 임상적으로 HS PDA로 인한 심폐기능이 악화되는 경우에 HS PDA의 증상의 심한 정도에 따라 신생아 의사와 소아심장 의사가 수술 여부를 결정하였다. 동맥관개존증이 진단되었으나 HS PDA가 아닌 경우는 1주일 후 심장초음파 추적 검사를 하였고, HS PDA로 약물 치료를 한 경우는 약물 투여 1주일 이내에 심장초음파를 시행하였으며, 수술적 치료를 한 경우는 환자 상태에 따라서 1개월 후나 퇴원 전에 심장초음파를 시행하였다.
신생아 호흡곤란증후군은 신생아의 호흡 증상 및 흉부방사선, 혈액 가스분석 결과에 따라 정의하였다[14]. 기관지폐이형성증은 생후 28일 이후에도 산소나 인공환기가 필요하고[15], National Institutes of Child Health and Human Development (NICHD) Classification에 따라 중증도별로 경증, 중등도, 중증으로 구분하였으며 본 연구에서는 중등도 이상의 기관지폐이형성증을 포함하였다. 뇌실내출혈은 뇌초음파를 이용해 Papile 등[16]의 분류에 따라 3단계 이상인 경우로 정의하였고, 괴사성 장염은 modified Bells staging criteria[17]에 따라 2단계 이상인 경우, 미숙아 망막증은 international classification of retinopathy of prematurity 국제분류법[18]에 따라 2단계 이상으로 정의하였다.
통계분석은 IBM SPSS Statistics for Windows version 25.0 (IBM Corp., Armonk, NY, USA)를 이용하였다. 두 군 간의 차이는 정규분포를 따르는 연속변수는 Student t-test, 정규분포를 따르지 않는 연속변수나 이산변수는 Mann-Whitney U-test를 이용하여 분석하였고, 명목변수는 chi-square test를 이용하여 분석하였다. 관찰값은 평균값±표준편차로 표시하였다. GA의 영향을 보정하기 위해 연속변수는 공변량분석(analysis of covariance, ANCOVA), 이산변수는 다변량 로지스틱 회귀분석(multivariate logistic regression)을 이용하였다. P 값이 0.05 미만인 경우를 통계상 유의한 것으로 정의하였다.
총 117명의 연구대상 중 생후 14일 이전에 동맥관이 폐쇄된 조기폐쇄군은 34% (40/117), 생후 14일부터 그 이후에 폐쇄된 지연폐쇄군은 66% (77/117)였다. 조기폐쇄군의 GA가 지연폐쇄군에 비해 높았으며(27.2±1.6주 vs. 26.3±1.7주, P=0.005), 출생체중은 두 군 간의 차이가 없었다(972.4±264.1 g vs. 945.2±294.5 g, P=0.613). 성별, 1분 및 5분 아프가 점수, 산모의 임신성 고혈압, 임신성 당뇨, 산전 스테로이드 투여, 융모양막염에서도 두 군 간의 유의한 차이는 없었다.
동맥관이 폐쇄되기 전에 발생한 폐출혈과 저혈압은 두 군 간의 유의한 차이는 없었으며(11 [27.5%] vs. 22 [28.6%], P=0.903; 15 [37.5%] vs. 29 [37.7%], P=0.986, respectively) 동맥관이 폐쇄되기 전에 진단된 뇌실내출혈과 괴사성 장염도 두 군 간의 유의한 차이는 없었다(3 [7.5%] vs. 7 [9.1%], P=0.770; 1 [2.5%] vs. 3 [3.9%], P=0.693, respectively).
각 군의 자연 폐쇄 비율은 유의한 차이가 없었으나(9 [22.5%] vs. 18 [23.4%], P=0.915) 약물 치료 후 폐쇄된 환자는 조기폐쇄군에서 많았으며(20 [50.0%] vs. 20 [26.0%], P=0.009), 수술적 치료가 필요한 환자는 지연폐쇄군에서 많았다(11 [27.5%] vs. 39 [50.6%], P=0.016) (Table 1).
모든 환자들이 신생아 호흡곤란증후군을 진단받았으며, 폐계면활성제의 2차 투여는 각 군 간의 차이가 없었다(4 [10.3%] vs. 10 [13.3%], P=0.635). 3단계 이상 뇌실내출혈은 조기폐쇄군에서 22.6±20.0일에 발생하였고 지연폐쇄군에서 16.3±12.0일에 발생하였다. 뇌실내출혈은 GA를 보정했을 때 조기폐쇄군에서 더 많았으며 (10 [25.0%] vs. 10 [13.0%], P=0.102, adjusted P for GA=0.021), 동맥관 치료의 합병증을 분석하기 위해 동맥관 폐쇄 후에 발생한 뇌실내출혈만 분석하였을 때에도 조기폐쇄군에서 더 많았다(7 [17.5%] vs. 3 [3.9%], P=0.013, adjusted P for GA=0.011). 미숙아 망막증(11 [32.4%] vs. 34 [44.7%], P=0.222, adjusted P for GA=0.453), 기관지폐이형성증(5 [15.2%] vs. 19 [26.8%], P=0.191, adjusted P for GA=0.384), 입원 중 사망률(5 [12.5%] vs. 7 [9.1%], P=0.564, adjusted P for GA=0.384)은 두 군 간의 유의한 차이는 없었다.
괴사성 장염은 조기폐쇄군에서 16.3±12.0일에 발생하였고, 지연폐쇄군에서 29.0±12.9일에 발생하였다. 괴사성 장염 또한 두 군 간의 차이는 없었다(4 [10.0%] vs. 7 [9.1%], P=0.873, adjusted P for GA=0.796). 동맥관 치료의 합병증을 분석하기 위해서 동맥관 폐쇄 후에 발생한 괴사성 장염만 분석하였을 때에도 두 군 간의 차이가 없었다(3 [7.5%] vs. 4 [5.2%], P=0.618, adjusted P for GA=0.677). 인공환기 치료기간은 조기폐쇄군이 지연폐쇄군에 비해 짧았으나 GA를 보정하였을 때 유의한 차이는 없었다(22.2±19.7 days vs. 37.1±36.1 days, P=0.004, adjusted P for GA=0.247). 침습적 인공환기 치료기간 또한 조기폐쇄군에서 짧았으나 GA를 보정했을 때 유의한 차이는 없었다(17.3±17.9 days vs. 29.9±29.1 days, P=0.004, adjusted P for GA=0.218). 입원기간도 조기폐쇄군이 지연폐쇄군에 비해 짧았으나 GA를 보정했을 때 유의한 차이는 없었다(75.7±37.7 days vs. 99.5±39.9 days, P=0.002, adjusted P for GA=0.056) (Table 2).
GA의 영향을 보정하기 위해 각 군을 GA에 따라 GA 24-26주, GA 27-29주로 세분하였다. 폐계면활성제의 2차 투여, 미숙아 망막증, 괴사성 장염, 기관지폐이형성증, 인공환기 치료기간, 침습적 인공환기 치료기간은 조기폐쇄군과 지연폐쇄군 간 차이가 없었다. 3단계 이상 뇌실내출혈(6 [21.4%] vs. 0 [0.0%], P=0.004)과 사망률(4 [14.3%] vs. 0 [0.0%], P=0.021)은 GA 27-29주의 조기폐쇄군에서 지연폐쇄군에 비해서 높았다. 입원기간은 GA 27-29주의 지연폐쇄군에서 더 길었다(62.75 ±30.2 vs. 82.54±25.2, P=0.008) (Table 3).
본 연구에서는 HS PDA의 조기폐쇄군이 지연폐쇄군에 비해 뇌실내출혈은 많았으나, 미숙아 망막증, 괴사성 장염, 기관지폐이형성증, 사망률은 차이가 없었다. 인공환기 치료기간, 침습적 인공환기 치료기간도 차이가 없었다.
이전에는 미숙아의 예후 향상을 위해서 동맥관개존증을 생후 초기에 치료하였다. 좌우단락의 동맥관으로 인한 좌심실 압력 증가로 폐혈류량이 증가하여 폐동맥 압력이 증가하며 이로 인해 폐 간질로의 이행이 증가하여 폐부종과 폐출혈을 야기하며 혈장 단백의 폐포로의 누출은 폐표면활성제의 기능을 억제한다[4]. 동맥관의 조기폐쇄군이 지연폐쇄군에 비해 인공환기 치료기간이 유의하게 짧았으며[19], 예방적으로 생후 초기에 인도메타신을 투여한 군이 생후 일주일 이후에 필요 시 치료를 한 군에 비해서 저혈압 및 인공환기 의존도가 적었고[20], 기관지폐이형성증 또는 사망이 적었다[21]. Schena 등[22]에 의하면 HS PDA에 노출되는 시간이 1주일 증가할수록 기관지폐이형성증의 위험이 1.7배 증가하였으며, GA 28주 미만에서 생후 3일에 존재하는 큰 동맥관은 사망률 또는 고도 뇌출혈, 괴사성 장염, 기관지폐이형성증의 위험을 증가시켰다[23]. 또한 생후 3주 이전에 동맥관개존증이 폐쇄된 군에서 기관지폐이형성증, 뇌실내출혈, 급성 신부전의 빈도를 줄였고, 신경학적 예후를 향상시켰다[24].
그러나 동맥관 폐쇄에 사용하는 약물인 인도메타신과 이부프로펜은 프로스타글란딘 합성의 억제를 통해 혈관 수축을 초래하며, 뇌, 장, 신장으로의 혈류를 감소 시켜 뇌실내출혈, 괴사성 장염, 소변량 감소 등의 부작용이 생길 수 있다[9]. Bourgoin 등[25]의 연구에서 29주 미만의 미숙아 중 동맥관을 수술적으로 폐쇄한 환자군에서 2세의 신경발달지연이 더 빈번하게 나타났다. 또한 Benitz 등[26]의 연구에 따르면 수술적 치료는 신속히, 완벽하게 동맥관을 폐쇄시킬 수는 있지만, 수술과 마취와 관련된 심각한 혈역학적 또는 호흡기 합병증이 발생할 수 있으며 이로 인해 집중 치료에 대한 필요가 증가하며, 좌측성대 또는 횡격막 마비, 유미흉, 척추 측만증 등과 같은 합병증이 생길 수 있다. 따라서 최근에는 수액 제한, 승압제 사용, 양압환기 등의 보존적인 방법을 이용해서 동맥관을 통한 단락의 영향을 최소화함으로써 약물 치료나 수술적 치료를 줄이려는 연구가 많이 진행되고 있다.
미국의 한 연구에서는 28주 미만의 미숙아에서 동맥관개존증의 치료와 사망률 간의 상관관계가 없었으며[27], 약물로 동맥관 폐쇄에 실패한 환자에서 결찰술을 시행한 군과 결찰술을 시행하지 않은 군을 비교한 연구에서 사망 또는 신경발달 손상은 차이가 없었다[28]. Sung 등[29]의 연구에서는 동맥관개존증을 약물 및 수술적으로 적극적으로 폐쇄한 환자군에 비해 수액 제한, 이뇨제 사용 등 보존적 치료를 한 환자군에서 기관지폐이형성증의 빈도가 낮았으며, 입원 중 사망률, 뇌실내출혈, 낭포성 백질연화증, 미숙아 망막증은 동맥관개존증의 치료 방법에 따른 유의한 차이가 없었다. Jhaveri 등[30]의 연구에서는 동맥관개존증에 대해 생후 초기에 적극적으로 치료한 환자군에 비해 보존적 치료를 한 환자군에서 괴사성 장염의 빈도가 더 낮았으며, 기관지폐이형성증, 패혈증, 미숙아 망막증, 신경손상, 사망률은 각 환자군의 유의한 차이가 없었다. 미숙아의 HS PDA를 언제, 어떤 방법으로 치료해야 하는지는 아직 논란의 여지가 있지만, 증상이 없는 미숙아에서 생후 초반에 예방적으로 일괄적으로 치료를 하는 것은 미숙아의 장기적인 예후 향상에 도움이 되지 않으며 오히려 치료와 관련된 합병증을 증가시킬 위험이 있어서 권하지 않는다[26].
본 연구에서는 조기폐쇄군에서 뇌실내출혈의 빈도가 높았으며, 동맥관 폐쇄 후에 발생한 뇌실내출혈의 빈도도 높았고 GA 27-29주의 조기폐쇄군에서 뇌실내출혈, 사망률이 높았다. 이는 생후 초기에 약물 혹은 수술을 통해 적극적으로 치료하였을 때 HS PDA에 노출되는 기간은 줄어들지만 치료의 부작용을 간과할 수는 없음을 시사하는 소견이며, 이에 대해서는 향후 추가적인 연구가 필요할 것으로 생각된다.
본 연구는 몇 가지 제한점을 가지고 있다. 두 군 간에 차이가 있는 GA는 보정하였으나, 후향적 연구이기 때문에 GA 외에도 예후에 영향을 줄 수 있는 다른 요인들이 있을 가능성이 있다. 심장초음파 시행 전 사망한 17명과 심장초음파로 동맥관개존증이 진단되었으나 폐쇄 여부를 확인하지 못하고 사망한 22명을 제외하고 폐쇄 여부를 확인할 수 있었던 환자의 사망률을 비교하였는데 제외된 환자의 사망과 HS PDA의 관련성도 있을 것으로 생각된다. 약물 치료의 금기에 해당하거나 약물 치료에도 HS PDA가 지속되는 경우 수술을 하였으므로, 지연폐쇄군에 수술을 한 환자가 더 많이 포함되는 선택편향으로 인해 결과에 영향을 주었을 수도 있다.
결론적으로, 미숙아에서 동맥관 폐쇄 시기를 결정함에 있어서 여러 인자를 고려해야 하며 심한 심폐 증상을 동반한 큰 동맥관에 대한 치료는 불가피하겠지만 약물 치료나 수술적 치료의 효과와 부작용을 고려했을 때 생후 초기에 적극적으로 약물이나 수술로 동맥관을 폐쇄하는 것에 대해 보다 신중할 필요가 있으며, 보존적 치료로 동맥관의 혈류를 감소시켜 동맥관과 관련된 합병증을 줄이면서 미숙아를 키우는 것도 합리적인 대안이 될 수 있다고 생각한다.
Notes
Ethical statement
This study was reviewed and approved by the Institutional Review Board of Inje University Busan Paik Hospital (identification code: 20-0046) in accordance with the Declaration of Helsinki. The Institutional Review Board waived the need for informed consent for this retrospective chart review.
REFERENCES
1. Wyllie JP, Gupta S. Prophylactic and early targeted treatment of patent ductus arteriosus. Semin Fetal Neonatal Med. 2018; 23:250–4.
2. Liu H, Manganiello V, Waleh N, Clyman RI. Expression, activity, and function of phosphodiesterases in the mature and immature ductus arteriosus. Pediatr Res. 2008; 64:477–81.
3. Vettukattil JJ. Pathophysiology of patent ductus arteriosus in the preterm infant. Curr Pediatr Rev. 2016; 12:120–2.
4. Clyman RI. Patent ductus arteriosus, its treatments, and the risks of pulmonary morbidity. Semin Perinatol. 2018; 42:235–42.
5. Finlay ER, Subhedar NV. Pulmonary haemorrhage in preterm infants. Eur J Pediatr. 2000; 159:870–1.
6. Havranek T, Rahimi M, Hall H, Armbrecht E. Feeding preterm neonates with patent ductus arteriosus (PDA): intestinal blood flow characteristics and clinical outcomes. J Matern Fetal Neonatal Med. 2015; 28:526–30.
7. Mirza H, Laptook AR, Oh W, Vohr BR, Stoll BJ, Kandefer S, et al. Effects of indomethacin prophylaxis timing on intraventricular haemorrhage and patent ductus arteriosus in extremely low birth weight infants. Arch Dis Child Fetal Neonatal Ed. 2016; 101:F418–22.
8. Noori S, McCoy M, Friedlich P, Bright B, Gottipati V, Seri I, et al. Failure of ductus arteriosus closure is associated with increased mortality in preterm infants. Pediatrics. 2009; 123:e138–44.
9. Sinha R, Negi V, Dalal SS. An interesting observation of PDA closure with oral paracetamol in preterm neonates. J Clin Neonatol. 2013; 2:30–2.
10. Foster M, Mallett LH, Govande V, Vora N, Castro A, Raju M, et al. Short-term complications associated with surgical ligation of patent ductus arteriosus in ELBW infants: a 25-year cohort study. Am J Perinatol. 2019; Nov. 4. [Epub]. https://doi.org/10.1055/s-0039-1698459.
11. Kaempf JW, Wu YX, Kaempf AJ, Kaempf AM, Wang L, Grunkemeier G. What happens when the patent ductus arteriosus is treated less aggressively in very low birth weight infants? J Perinatol. 2012; 32:344–8.
12. Sung SI, Chang YS, Kim J, Choi JH, Ahn SY, Park WS. Natural evolution of ductus arteriosus with noninterventional conservative management in extremely preterm infants born at 23-28 weeks of gestation. PLoS One. 2019; 14:e0212256.
13. Sung SI, Choi SY, Park JH, Lee MS, Yoo HS, Ahn SY, et al. The timing of surgical ligation for patent ductus arteriosus is associated with neonatal morbidity in extremely preterm infants born at 23-25 weeks of gestation. J Korean Med Sci. 2014; 29:581–6.
14. Jobe A. Respiratory distress syndrome: new therapeutic approaches to a complex pathophysiology. Adv Pediatr. 1983; 30:93–130.
15. Kinsella JP, Greenough A, Abman SH. Bronchopulmonary dysplasia. Lancet. 2006; 367:1421–31.
16. Papile LA, Burstein J, Burstein R, Koffler H. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm. J Pediatr. 1978; 92:529–34.
17. Walsh MC, Kliegman RM. Necrotizing enterocolitis: treatment based on staging criteria. Pediatr Clin North Am. 1986; 33:179–201.
18. International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch Ophthalmol. 2005; 123:991–9.
19. Ibrahim MH, Azab A, Kamal NM, Salama MA, Elshorbagy HH, Abdallah EA, et al. Outcomes of early ligation of patent ductus arteriosus in preterms, multicenter experience. Medicine (Baltimore). 2015; 94:e915.
20. Liebowitz M, Koo J, Wickremasinghe A, Allen IE, Clyman RI. Effects of prophylactic indomethacin on vasopressor-dependent hypotension in extremely preterm infants. J Pediatr. 2017; 182:21–7.
21. Liebowitz M, Clyman RI. Prophylactic indomethacin compared with delayed conservative management of the patent ductus arteriosus in extremely preterm infants: effects on neonatal outcomes. J Pediatr. 2017; 187:119–26.
22. Schena F, Francescato G, Cappelleri A, Picciolli I, Mayer A, Mosca F, et al. Association between hemodynamically significant patent ductus arteriosus and bronchopulmonary dysplasia. J Pediatr. 2015; 166:1488–92.
23. Sellmer A, Bjerre JV, Schmidt MR, McNamara PJ, Hjortdal VE, Host B, et al. Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3. Arch Dis Child Fetal Neonatal Ed. 2013; 98:F505–10.
24. Fonseca E, Georgiev SG, Gorenflo M, Loukanov TS. Patent ductus arteriosus in preterm infants: benefits of early surgical closure. Asian Cardiovasc Thorac Ann. 2014; 22:391–6.
25. Bourgoin L, Cipierre C, Hauet Q, Basset H, Gournay V, Roze JC, et al. Neurodevelopmental outcome at 2 years of age according to patent ductus arteriosus management in very preterm infants. Neonatology. 2016; 109:139–46.
26. Benitz WE; Committee on Fetus and Newborn, American Academy of Pediatrics. Patent ductus arteriosus in preterm infants. Pediatrics. 2016; 137:e20153730.
27. Slaughter JL, Reagan PB, Newman TB, Klebanoff MA. Comparative effectiveness of nonsteroidal anti-inflammatory drug treatment vs no treatment for patent ductus arteriosus in preterm infants. JAMA Pediatr. 2017; 171:e164354.
28. Weisz DE, Mirea L, Resende MHF, Ly L, Church PT, Kelly E, et al. Outcomes of surgical ligation after unsuccessful pharmacotherapy for patent ductus arteriosus in neonates born extremely preterm. J Pediatr. 2018; 195:292–6.
29. Sung SI, Chang YS, Chun JY, Yoon SA, Yoo HS, Ahn SY, et al. Mandatory closure versus nonintervention for patent ductus arteriosus in very preterm infants. J Pediatr. 2016; 177:66–71.
30. Jhaveri N, Moon-Grady A, Clyman RI. Early surgical ligation versus a conservative approach for management of patent ductus arteriosus that fails to close after indomethacin treatment. J Pediatr. 2010; 157:381–7.
Figure 1.
Patient flowchart. Abbreviations: GA, gestational age; PDA, Patent ductus arteriosus; HS, hemodynamically significant.
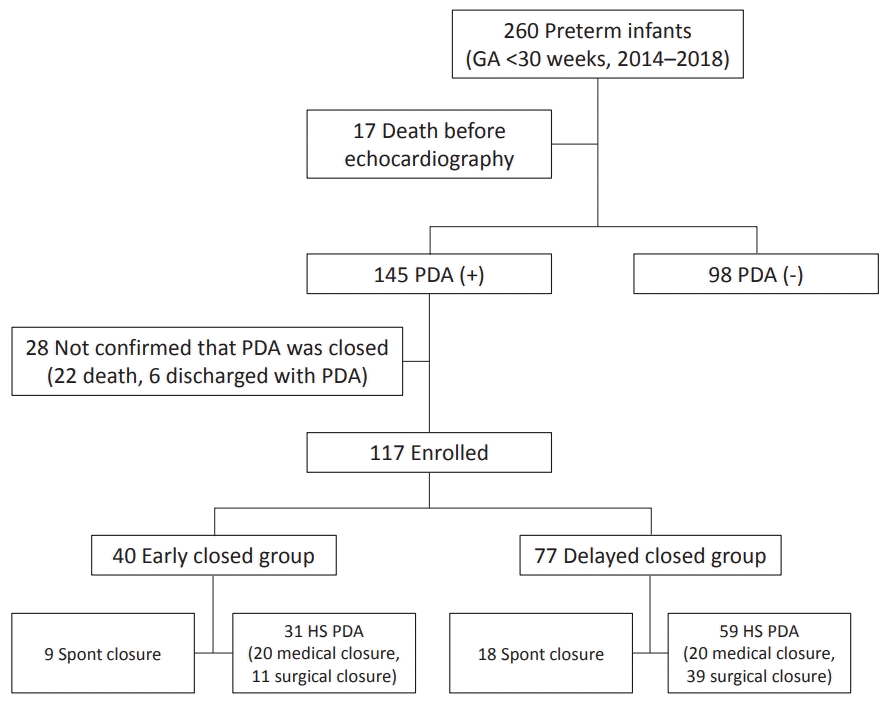
Table 1.
Demographic Factors
Table 2.
Outcomes
| Variable | Early closed group (n=40) | Delayed closed group (n=77) | P-value | P-value* |
|---|---|---|---|---|
| RDS | 40 (100.0) | 77 (100.0) | | |
| Surfactant redosing | 4 (10.3) | 10 (13.3) | 0.635 | 0.842 |
| IVH (≥grade III) | 10 (25.0) | 10 (13.0) | 0.102 | 0.021 |
| Postclosure IVH | 7 (17.5) | 3 (3.9) | 0.013 | 0.011 |
| ROP (≥stage II) | 11 (32.4) | 34 (44.7) | 0.222 | 0.453 |
| BPD (moderate to severe) | 5 (15.2) | 19 (26.8) | 0.191 | 0.384 |
| Mortality | 5 (12.5) | 7 (9.1) | 0.564 | 0.384 |
| NEC (≥stage II) | 4 (10.0) | 7 (9.1) | 0.873 | 0.796 |
| Postclosure NEC | 3 (7.5) | 4 (5.2) | 0.618 | 0.677 |
| Total duration of mechanical ventilation (d) | 22.2±19.7 | 37.1±36.1 | 0.004 | 0.247 |
| Duration of invasive ventilation (d) | 17.3±17.9 | 29.9±29.1 | 0.004 | 0.218 |
| Hospital stay (d) | 75.7±37.7 | 99.5±39.9 | 0.002 | 0.056 |
Table 3.
Outcomes Stratified by Gestational Age




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download