Abstract
Purpose
To identify factors associated with the clinical response to low-dose dexamethasone therapy (LDDT) in preterm infants for bronchopulmonary dysplasia (BPD).
Methods
We used a retrospective medical record review to evaluate preterm infants who were born before 32 weeks of gestation or with a birth weight less than 1,500 g. All infants were admitted to the neonatal intensive care unit at a tertiary academic hospital between January 2010 and June 2019, and received LDDT for BPD. The preterm infants’ respiratory severity scores (RSS) were calculated from the first day of LDDT to the day of extubation, or the last day of LDDT. A good response was defined as a decreasing RSS with a slope greater than 0.181. A poor response was defined as a non-decreasing RSS, or a decreasing RSS with a slope less than 0.181 during LDDT. A total dose of 1.1 mg/kg was administered for 10 days for each single course of LDDT.
Results
A total of 51 preterm infants were included in the final analysis. Thirty preterm infants (58.8 %) were in the good response group, and 21 preterm infants (41.2%) were in the poor response group. There were no significant differences in gestational age, birth weight, and sex between the good response group and poor response group. Preterm premature rupture of membrane and histologic chorioamnionitis were significantly associated with a poor response to LDDT. Higher RSS on the first day of the LDDT was associated with a good response to LDDT.
기관지폐이형성증(bronchopulmonary dysplasia)은 조산아의 주요 합병증의 하나로 신생아중환자실 입원 기간을 증가시킬 뿐 아니라 장기적인 호흡기계 및 신경발달 예후에도 불리하게 작용한다[1]. 기관지폐이형성증의 발생을 줄이기 위해 침습적 기계환기(invasive mechanical ventilation)를 최소화하고 비침습적 기계환기를 적극적으로 사용하는 전략이 널리 사용되고는 있지만 아직 기관지폐이형성증의 발생 빈도는 크게 변동이 없는 상태이다[2-5]. 출생 후 부신피질스테로이드(corticosteroid), 주로 덱사메타손(dexamethasone) 치료는 기관지폐이형성증의 예방 또는 치료를 위해 한동안 무분별하게 사용되었지만, 출생 초기, 특히 출생 첫 일주일 이내에 덱사메타손을 투여한 경우 뇌성마비의 발생이 증가하는 등, 장기적인 신경발달 예후에 부정적인 영향을 준다는 사실이 2000년대 초반에 밝혀지면서 그 사용이 현격히 감소하였다[6-8]. 그럼에도 불구하고 아직 기관지폐이형성증에 대한 효과적인 예방법이나 치료법이 없는 상태에서 장기간의 침습적 기계환기를 받고 있는 조산아들에서 부신피질스테로이드의 투여가 일시적으로나마 폐 기능을 호전시키고, 기계환기로부터의 이탈을 용이하게 해주며, 사망률을 낮추는 효과가 있는 것으로 알려져 있기 때문에[9,10], 실제 진료 현장에서는 예전에 비해서는 훨씬 제한적이지만 장기간의 침습적 기계환기가 필요할 것으로 예측되는 조산아들에게는 부신피질스테로이드의 투여를 고려한다. 그러나 부신피질스테로이드는 조산아에게 신경계 부작용 이외에도 감염, 고혈당, 위장관 출혈 및 장 천공, 성장부진 등을 초래할 수 있어 그 사용은 최대한 제한적이어야 한다[9-11]. 따라서 부작용은 최소화하면서 폐 기능 호전의 효과를 유지하기 위한 최적의 부신피질스테로이드의 종류, 용량, 투여경로 및 투여시기를 찾기 위한 연구들이 있다[12-16].
그러나 아직까지 적절한 저용량 덱사메타손의 투여시기와 투여대상에 대해서는 정립된 바가 없으며, 실제 임상에서는 비슷한 정도의 호흡부전 상태에 있다고 판단되는 조산아들에게 저용량 덱사메타손을 정맥 투여하였을 때 임상반응이 각기 다름을 확인할 수 있다. 즉 한 주기의 저용량 덱사메타손 요법만으로도 발관이 가능한 조산아들이 있고, 발관을 위해 두 주기 이상의 저용량 덱사메타손 요법이 필요한 조산아들도 있다. 이는 조산아마다 각기 다른 주산기인자를 가지고 있으며, 기관지폐이형성증의 발생에 관여되는 병태 생리가 각기 다름에 기인하는 것으로 추정해볼 수 있다[17,18]. 그러나 조산아에게 기관지폐이형성증의 예방 또는 치료를 위해 사용한 저용량 덱사메타손 요법에 대한 임상반응에 영향을 주는 인자들에 대한 연구는 드문 상태이다. 따라서 본 연구는 기관지폐이형성증의 예방 또는 치료를 위한 저용량 덱사메타손 요법에 대한 임상반응에 영향을 미치는 주산기 인자와 저용량 덱사메타손 치료와 관련된 인자들을 찾아보고자 하였다.
2010년 1월부터 2019년 6월까지 분당서울대학교병원에서 출생한 임신나이 32주 미만 또는 출생체중 1,500 g 미만의 조산아들 중에서 생후 7일 이후에 기관지폐이형성증의 예방 또는 치료를 위해 저용량 덱사메타손 요법을 받은 조산아들을 대상으로 의무기록 고찰을 통한 후향적 연구를 시행하였다. 월경후나이 36주 이전에 사망하거나 다른 병원으로 전원 되어 기관지폐이형성증의 중증도를 평가 할 수 없었던 경우, 주요 선천성 기형이 있었던 경우, 쌍태아간 수혈증후군이 있었던 경우는 연구대상에서 제외하였다. 본 연구는 분당 서울대학교병원 의학연구심의위원회(Institutional Review Board, IRB)로부터 승인받았고 동의서는 면제되었다(IRB No. B-2004-604117).
총 69명의 연구대상 조산아들 중 18명이 제외되어 최종적으로 51명의 조산아들이 분석대상이 되었다. 산모와 신생아의 의무기록을 고찰하여 산모의 임신 및 분만력, 신생아의 인구학적 및 임상적 특성을 조사하였다. 저용량 덱사메타손 요법은, 생후 7일 이후에도 침습적 기계환기가 필요했던 조산아들 중 침습적 기계환기에 의존적이어서 단기간 안에 기계환기로부터 이탈이 불가능할 것으로 예상되어, 담당 신생아세부전문의가 필요하다고 판단한 경우에 시행되었으며, 구체적인 투여방법은 0.1 mg/kg의 덱사메타손을 12시간 간격으로 하루 2회, 총 이틀간 투여하였고, 그 이후로는 이틀마다 용량을 1/4씩 감량하여 10일째 중단하였다. 결과적으로 열흘간의 저용량 덱사메타손 요법 한 주기에 투여된 덱사메타손은 총 1.1 mg/kg이 되었다.
저용량 덱사메타손 요법에 대한 치료반응을 정량화하기 위해 덱사메타손 투여기간 동안의 호흡기중증도지수(respiratory severity score, RSS)를 일 단위(daily-base)로 계산하였다. RSS는 흡입산소농도(FiO2)에 평균기도내압(mean airway pressure)을 곱한 값으로 정의하였으며 해당일에 가장 많은 시간 비중을 차지한 흡입산소농도와 평균기도내압을 해당일의 대표 값으로 하여 RSS를 계산하였다. RSS는 덱사메타손 최초 투여일부터, 저용량 덱사메타손 요법 중 발관(extubation)에 성공을 한 경우에는 발관일까지, 발관을 못한 경우에는 덱사메타손 최종 투약일까지 계산하였다. 저용량 덱사메타손 요법에 대한 치료반응은 덱사메타손 최초 투여일의 RSS에서 발관일의 RSS를 뺀 값인 ΔRSS를 덱사메타손 최초 투여일부터 발관일까지의 일 수로 나눈 값인 RSS 기울기를 이용하여 평가하였다. 열흘 간의 저용량 덱사메타손 요법 기간 동안에 발관을 하지 못한 경우에는 덱사메타손 최초 투여일부터 덱사메타손 최종 투약일까지의 RSS 기울기로 치료반응을 평가하였다. RSS 기울기가 0.181 이상이면 양호반응으로 0.181 미만이면 불량반응으로 정의하였다. 양호 또는 불량 반응의 기준 RSS 기울기 값인 0.181은 발관 성공 또는 실패에 대한 RSS 기울기의 receiver operating curve (ROC)의 절단값(cutoff value)이었고, 이 절단값에서 발관 성공 또는 실패에 대한 민감도는 72.4%, 특이도는 61.9%이었다. 저용량 덱사메타손 요법에 대한 치료반응과 관련된 인자들을 분석하기 위해 양호반응군과 불량반응군 간에 산모와 신생아의 임상적 특성들과 덱사메타손 치료와 관련된 특성들을 비교하였다.
총 51명의 연구대상 조산아들의 임신나이와 출생체중의 중앙값은 각각 25+5주, 730 g이었으며 남아 23명, 여아 28명이었다. 열흘 간의 저용량 덱사메타손 투여기간 중 발관에 성공한 조산아는 30명(58.8 %)이었고, 21명(41.2 %)은 덱사메타손 최종 투여일까지 발관되지 못하였다. 양호반응군은 30명(58.8%), 불량반응군은 21명(41.2%)이었으며, 대상 조산아들 모두 월경후나이 36주에 중등도 이상의 기관지폐이형성증을 진단받았다(Figure 1). 저용량 덱사메타손 최초 투여시점에는 모든 조산아들이 기관 삽관된 상태이었지만 최초 투여 후 3일째부터 발관되기 시작하여 최종 투여일까지 모두 30명(58.8 %)의 조산아들이 발관 되었다(Figure 2A). RSS는 덱사메타손 최초 투여 당일 4.4에서 투여 2일째부터 감소하기 시작하여 투여 5일째 가장 낮은 값을 보인 후 점차 다시 증가하는 모습을 보였다(Figure 2B). 저용량 덱사메타손 투여기간 동안의 RSS 기울기 0.181 이상과 미만을 기준으로 정의한 양호반응군과 불량반응군은 각각 30명(58.8%)과 21명(41.2%)이었다. 총 30명의 양호반응군에서는 저용량 덱사메타손 요법 기간 동안 22명(73.3%)에서 발관이 가능하였고 21명의 불량반응군에서는 같은 기간 동안 8명(38.1%)에서만 발관이 가능하였다. 양호반응군과 불량반응군사이에 저용량 덱사메타손 투여기간 동안 고빈도 진동 환기요법(high frequency oscillatory ventilation)를 적용한 평균 기간은 유의한 차이를 보이지 않았다(각 1±2일 vs. 1±3일, P=0.799).
저용량 덱사메타손 요법 기간 동안의 RSS 기울기가 0.181 이상이었던 양호반응군은 RSS 기울기가 0.181 미만이었던 불량반웅군에 비해 발관에 성공할 가능성이 2.3배 높았다(P=0.011; 95 % 신뢰구간, 1.17–4.59). 덱사메타손 최초 투약일의 RSS와 ΔRSS와 RSS 기울기 사이에는 양의 상관관계가 있었다(각각 상관계수 0.745, P<0.001; 상관계수 0.568, P<0.001) (Table 1). 저용량 덱사메타손 요법에 대한 양호반응군의 최초 투약일의 RSS는 5.5±2.1이었고 불량반응군의 최초 투약일의 RSS는 3.6±1.3으로 양호반응군의 덱사메타손 투약 첫날의 RSS가 유의하게 높았다(P<0.001). 저용량 덱사메타손 요법의 시작시기는 양호반응군이 생후 31±15일, 불량반응군이 생후 22±9일로 양호반응군에서 저용량 덱사메타손 요법이 유의하게 늦게 시작되었으나(P=0.019), 월경후나이로는 양호반응군이 30+2±2+4주, 불량반응군이 29+1±1+4주로 두 군 간에 유의한 차이는 없었다(P=0.137) (Table 2).
양호반응군 조산아들의 임신나이는 25+6±1+2주, 출생체중은 734±168 g이었으며, 불량반응군 조산아들의 임신나이는 26+0±1+6주, 출생체중은 801±194 g으로 두 군 간에 통계적으로 유의한 차이는 없었다. 두 군 간에 남녀비의 차이도 없었다. 덱사메타손 치료 중 투약의 부작용으로 치료를 중단한 경우는 없었다. 임신나이에 비해 출생체중과 출생키가 크거나 작은 정도를 반영하는 출생체중과 출생키의 Z-점수, 다태아 여부, 분만방법, 1분 및 5분 아프가 점수, 임신성 고혈압, 임신성 당뇨와 양수과소증의 빈도 모두 두 군 간에 유의한 차이를 보이지 않았다(Table 3). 그러나 조기양막파수가 양호반응군에서 8명(26.7%), 불량반응군에서 14명(66.7%)으로 불량반응군에서 유의하게 많았으며(P=0.005), 조직학적 융모양막염도 양호반응군에서 11명(37.9%), 불량반응군에서 16명(76.2%)으로 불량반응군에서 유의하게 많았다(P=0.007).
대상이 되었던 모든 환아들에서 중등도 이상의 기관지폐이형성증이 있었으며 이는 두 군 간에 차이가 없었다. 미숙아망막증(retinopathy of prematurity)과 뇌실주위백질연화증(periventricular leukomalacia), 월경후나이 36주 이후 사망의 빈도도 두 군 사이에서 유의한 차이를 보이지 않았다(Table 4). 덱사메타손 치료의 반응에 영향을 줄 수 있는 동맥관(patent ductus arteriosus) 치료, 폐혈증, 덱사메타손 투약 이전에 부신기능 저하(adrenal insuffiency)로 하이드로코티손(hydrocortisone) 투약하였던 경우도 두 군 사이에 유의한 차이가 없었다(Table 5).
기관지폐이형성증은 매우 미성숙한 조산아에서 융모양막염, 태아 성장지연, 임신성 고혈압 등의 출생 전 요인과 침습적 기계환기, 산소치료, 전신 또는 호흡기 감염, 부족한 영양공급 등의 출생 후 요인들이 복합적으로 작용하여 발생한다[21]. 기관지폐이형성증에 대한 특이 치료법이 아직 존재하지 않으므로 실제 기관지폐이형성증의 예방 또는 치료는 위의 기관지폐이형성증의 발생과 관련된 인자들에의 노출을 최소화하는 것이 현재로서는 가장 효과적이고 현실적인 전략이라고 할 수 있다[22]. 출생 후 일주일이 지나서도 침습적인 기계환기가 계속 필요한 조산아들은, 같은 시기에 이미 발관되어 비침습적인 보조환기를 받고 있는 조산아들에 비해 기관지폐이형성증의 발생위험이 현저히 크다[23,24]. 따라서 가능한 이들을 조기에 발관하고 비침습적 환기로 전환시켜주기 위해 저용량 덱사메타손 요법을 고려하는 경우가 드물지 않게 있다[25]. 현재 가장 보편적으로 사용하는 용법은 저용량(0.20–0.25 mg/kg/day) 전신 덱사메타손 요법인데, 한 메타분석연구에서는 생후 7일 이후에 저용량 덱사메타손을 기관지폐이형성증의 위험인자가 있는 조산아들에게 정맥 투여하였을 때 뇌성마비의 빈도 증가 없이 월경후나이 36주에 기관지폐이형성증의 발생 빈도가 유의하게 감소하였음을 보고하였다[26]. 기관지폐이형성증의 병태생리에 염증반응이 매우 중요한 역할을 하는 점을 생각해보면 기관지폐이형성증의 예방 또는 치료를 위해 항염증 효과가 있는 부신피질스테로이드를 사용하는 것은 이치에 맞는다고 할 수 있다[21]. 그러나 위에 언급하였듯이 같은 기관지폐이형성증이라고 하더라도 그의 발생에 염증반응이 어느 정도 관여하는지에 따라 부신피질스테로이드에 대한 효과가 다를 수 있다고 생각해볼 수 있다. 예를 들면 태아 성장지연과 임신성 고혈압의 경우, 이들이 기관지폐이형성증의 발생에 기여하는 구체적인 기전이 아직 밝혀지지는 않았지만, 염증반응을 통해 기관지폐이형성증을 일으키기보다는 폐포 및 폐혈관의 전반적인 생성 및 발달을 저해하는 방식으로 기관지폐이형성증의 발생에 기여하는 것으로 보인다[27,28]. 한편 융모양막염, 침습적 기계환기와 전신 또는 호흡기 감염의 경우, 이들이 기관지폐이형성증의 발생에 기여하는 주된 기전은 염증 반응일 것으로 생각된다[29]. 이런 점을 고려할 때 기관지폐이형성증을 예방 또는 치료하기 위해 조산아들에게 저용량 덱사메타손 요법을 사용할 때 각 조산아들이 갖고 있는 주산기 인자들에 따라 그 효과가 다를 것이라고 예상해볼 수 있다. 즉, 임신성 고혈압이나 태아 성장지연에 노출되었던 조산아의 경우에는 저용량 덱사메타손 요법에 대한 치료반응이 불량할 것이고, 융모양막염이나 출생 후 감염 또는 염증에 노출되었던 경우에는 치료반응이 양호할 것이라는 가설을 세워볼 수 있다. 본 연구는 이런 가설을 바탕으로 저용량 덱사메타손의 치료반응에 영향을 미치는 주산기 인자들을 찾아보았다. 연구 결과, 임신성 고혈압 유무와 태아 성장지연 정도를 반영하는 지표인 조산아의 출생체중과 출생키의 Z-점수는 저용량 덱사메타손 요법에 대한 치료반응에 영향을 주지 않았고, 조직학적 융모양막염과 상행성 자궁내 감염 또는 염증의 위험을 증가시키는 조기양막 파수는 저용량 덱사메타손에 대한 치료반응에 부정적인 영향을 주었다. 또한 저용량 덱사메타손 첫 투여일의 RSS가 높은 경우에 치료 반응이 양호하였다. 종합해보면 제한된 연구대상으로부터 후향적 분석을 통해 도출된 결론이기는 하지만 임신성 고혈압과 태아 성장 지연의 병력은 저용량 덱사메타손의 치료반응에 영향을 주지 않으며 자궁 내 감염 또는 염증의 병력은 예상과 달리 저용량 덱사메타손 요법에 대한 치료반응에 부정적인 영향을 준다고 할 수 있다. 다만 저용량 덱사메타손 첫 투여일의 RSS가 높은 경우에 저용량 덱사메타손 요법에 대한 치료반응이 양호하였던 것으로 보아 저용량 덱사메타손에 대한 치료반응은 시간적으로 멀리 떨어진 자궁 내 염증보다는 저용량 덱사메타손 요법을 시작할 당시의 폐의 염증반응 정도에 더 직접적인 영향을 받는다고 생각할 수 있다. 침습적 기계환기요법을 받고 있는 조산아들에서 높은 RSS는 보다 심한 폐의 염증 반응을 의미한다고 볼 수 있기 때문이다. 이는 염증이 유발된 시점에 따라 미성숙한 폐조직의 손상에 기여하는 정도와 방법이 다르기때문일 것으로 정하였다. 최근 기관지폐이형성증을 한 두가지의 병인론으로 설명하기 보다는, 미숙한 폐조직이 자궁 내 염증반응에 대해 반복적이고 비정상적인 치유 과정과 출생 후 침습적 기계환기 등을 통한 추가 손상으로 인하여 구조적 변화가 일어나는 연속적이고 복합적인 과정으로 이해하고자 하는 노력이 지속되고 있다[22]. 실제로 동물실험에서 양막 내 lipopolysaccharide 주입을 통하여 자궁 내 염증을 유발하여 출생 후 폐조직을 현미경으로 확인하였을 때 이미 기도와 폐포의 불규칙한 파괴가 확인되었던 바 있다[30]. 따라서 이미 자궁 내 염증으로 폐조직의 비가역적인 손상이 초래 된 경우에는 부신피질스테로이드 치료에 대한 임상적인 반응이 불량할 것으로 예측할 수 있다. 하지만 임상적으로는 자궁내 염증과 출생 후 가해지는 손상으로 인한 염증반응을 구별해내는 것이 어렵기 때문에 정확한 비교를 위해서는 통제된 전향적 연구가 필요할 것으로 생각된다.
기관지폐이형성증의 예방 또는 치료를 위해 사용하는 부신피질스테로이드 요법은 저용량을 사용하더라도 장기적인 뇌신경계 합병증에 대한 우려 때문에 그 사용에 신중을 기할 수 밖에 없다[31,32]. 따라서 저용량 덱사메타손 요법을 통해 가장 많이 혜택을 받을 수 있는, 즉 저용량 덱사메타손에 가장 잘 반응할 수 있는 조산아군을 찾아내는 것이 중요할 것으로 생각되나 아직 이에 대한 지식은 매우 미흡한 상태이다[33]. 본 연구의 결과로 유추해볼 때, 생후 7일 이상 침습적 기계환기를 받고 있는 조산아들 중에서 융모양막염이나 조기양막파수의 병력이 없고, 호흡부전의 정도가 심한 조산아들이 저용량 덱사메타손 요법을 통해 혜택을 가장 많이 받을 수 있을 것으로 보인다. 반면 저용량 덱사메타손 요법에 대해 치료 반응이 불량할 것으로 예측되는 조산아들에서 저용량 덱사메타손 요법을 고려하지 않는 것이 적절한지에 대해서는 면밀한 검토가 필요할 것이다. 본 연구의 결과만으로 저용량 덱사메타손 요법에 대한 치료방침을 일반화하여 제시하기에는 무리가 있다. 다만 저용량 덱사메타손 치료에 대해 불량한 반응이 예상되는 경우에는 조산아의 자발호흡에 최적화된 동기화 방법을 사용하는 등 기계환기로 인한 폐 손상을 최소로 할 수 있는 기계환기 전략을 찾는 노력도 필요할 것이며, 저용량 덱사메타손 요법 외의 다른 제제와 경로의 부신피질스테로이드 요법에 대한 고려도 필요할 수 있을 것이다.
조산아에서 덱사메타손의 뇌신경계 부작용은 대부분이 고용량(0.5 mg/kg/day 이상)을 전신적으로 출생 첫 일주일 이내부터 사용한 경우에 보고가 되어왔다[6,34]. 따라서 기관지폐이형성증의 예방 또는 치료를 위한 부신피질스테로이드 요법은 뇌신경계 부작용을 줄이기 위해 고용량 대신 저용량(0.25 mg/kg/day 이하)의 덱사메타손을 적어도 생후 일주일이 지나서 투여하는 추세이다[35,36]. 그러나 저용량의 덱사메타손을 언제 사용해야 발관에 가장 효과적인가에 대해서는 잘 알려져 있지 않다. 한 후향적 코호트 연구에 따르면 출생 후 저용량 덱사메타손 요법을 생후 28일 이전에 시작한 조산아군과 생후 29일 이후에 시작한 조산아군을 비교하였을 때, 생후 28일 이전에 시작한 조산아군에서 발관성공률이 더 높았고 산소투여 기간도 더 짧았다고 하였다[37]. 이러한 결과는 기계환기요법을 받고 있는 조산아들에서 부신피질스테로이드를 늦게 사용하는 경우에는 이미 폐조직이 비가역적인 구조적 손상을 받아 부신피질스테로이드에 대한 반응성이 떨어지기 때문인 것으로 해석해볼 수 있다. 그러나 본 연구에서는 이와는 반대로 치료반응이 양호했던 조산아들은 불량했던 조산아들에 비해 덱사메타손을 늦게 투여 받은 조산아들이었다(생후 31±15일 vs. 생후 22±9일). 그러나 월경후나이로는 각각 30+2±2+4주, 29+1±1+4주로 두 군 간에 유의한 차이가 없어서 치료시기가 저용량 덱사메타손 요법에 대한 반응에 유의한 영향을 미치지는 않는 것으로 생각되었다.
본 연구에서는 저용량 덱사메타손 요법을 시작한 후 발관은 투약 3일째부터 가능하였으며 이후 투약 6일째까지 비교적 빠른 속도(5–6명/일)로 발관이 진행되다가 이후로는 발관이 되는 속도가 약간 완만해졌다(2–4명/일). RSS의 변화도 유사하게 투약 다음 날부터 RSS가 감소하기 시작하여 투약 5일째에 최저값을 보였다. 그러나 최종 덱사메타손 투약일까지 발관이 계속 이루어진 것과는 달리 RSS는 투약 6일째부터 다시 점차 증가하다가 최종 투약일에 다시 감소하는 모습을 보였다. 이는 RSS의 경우 조산아들이 발관이 되면 더 이상 계산을 하지 않았기 때문에 첫 투약 후 시간이 경과할수록, 발관이 되지 못한, 즉 상대적으로 저용량 덱사메타손에 반응이 불량했던, 조산아들의 RSS가 상대적으로 많이 반영되었기 때문으로 생각된다.
본 연구는 단일기관에서 시행된 후향적 연구라는 근본적인 한계가 있다. 그러나 일관된 기준과 방법으로 저용량 덱사메타손 요법을 사용하였고 치료반응을 단순히 발관 성공 또는 실패로만 평가하지 않고 덱사메타손 투여기간 동안의 RSS의 일 단위 변화를 평가하여 정량화하였다는 장점이 있다. 향후 다기관 전향적 연구를 통해 가장 효과적이면서도 부작용을 최소화할 수 있는 저용량 덱사메타손 요법과 그로부터 가장 혜택을 받을 수 있는 대상을 찾는 노력이 필요할 것이다.
Notes
REFERENCES
1. Baraldi E, Filippone M. Chronic lung disease after premature birth. N Engl J Med. 2007; 357:1946–55.
2. Jo HS, Cho KH, Cho SI, Song ES, Kim BI. Recent changes in the incidence of bronchopulmonary dysplasia among very-low-birth-weight infants in Korea. J Korean Med Sci. 2015; 30 Suppl 1:S81–7.
3. Kim JK, Chang YS, Sung S, Ahn SY, Yoo HS, Park WS. Trends in survival and incidence of bronchopulmonary dysplasia in extremely preterm infants at 23-26 weeks gestation. J Korean Med Sci. 2016; 31:423–9.
4. Manktelow BN, Draper ES, Annamalai S, Field D. Factors affecting the incidence of chronic lung disease of prematurity in 1987, 1992, and 1997. Arch Dis Child Fetal Neonatal Ed. 2001; 85:F33–5.
5. Stoll BJ, Hansen NI, Bell EF, Walsh MC, Carlo WA, Shankaran S, et al. Trends in care practices, morbidity, and mortality of extremely preterm neonates, 1993-2012. JAMA. 2015; 314:1039–51.
6. Doyle LW, Ehrenkranz RA, Halliday HL. Early (<8 days) postnatal corticosteroids for preventing chronic lung disease in preterm infants. Cochrane Database Syst Rev. 2014; 5:CD001146.
7. Lin YJ, Yeh TF, Hsieh WS, Chi YC, Lin HC, Lin CH. Prevention of chronic lung disease in preterm infants by early postnatal dexamethasone therapy. Pediatr Pulmonol. 1999; 27:21–6.
8. Olaloko O, Mohammed R, Ojha U. Evaluating the use of corticosteroids in preventing and treating bronchopulmonary dysplasia in preterm neonates. Int J Gen Med. 2018; 11:265–74.
9. Groneck P, Reuss D, Gotze-Speer B, Speer CP. Effects of dexamethasone on chemotactic activity and inflammatory mediators in tracheobronchial aspirates of preterm infants at risk for chronic lung disease. J Pediatr. 1993; 122:938–44.
10. Gupta S, Prasanth K, Chen CM, Yeh TF. Postnatal corticosteroids for prevention and treatment of chronic lung disease in the preterm newborn. Int J Pediatr. 2012; 2012:315642.
11. Ehrenkranz RA, Mercurio MR. Bronchopulmonary dysplasia.
JC Sinclair
MB Bracken
. Effective care of the newborn infant. Oxford: Oxford University Press;1992. p. 399–424.
12. Shah SS, Ohlsson A, Halliday HL, Shah VS. Inhaled versus sys temic corticosteroids for preventing bronchopulmonary dysplasia in ventilated very low birth weight preterm neonates. Cochrane Database Syst Rev. 2017; 10:CD002058.
13. Onland W, De Jaegere AP, Offringa M, van Kaam A. Systemic corticosteroid regimens for prevention of bronchopulmonary dysplasia in preterm infants. Cochrane Database Syst Rev. 2017; 1:CD010941.
14. Michael Z, Spyropoulos F, Ghanta S, Christou H. Bronchopulmonary dysplasia: an update of current pharmacologic therapies and new approaches. Clin Med Insights Pediatr. 2018; 12:1179556518817322.
15. Onland W, Cools F, Kroon A, Rademaker K, Merkus MP, Dijk PH, et al. Effect of hydrocortisone therapy initiated 7 to 14 days after birth on mortality or bronchopulmonary dysplasia among very preterm infants receiving mechanical ventilation: a randomized clinical trial. JAMA. 2019; 321:354–63.
16. Morris IP, Goel N, Chakraborty M. Efficacy and safety of systemic hydrocortisone for the prevention of bronchopulmonary dysplasia in preterm infants: a systematic review and meta-analysis. Eur J Pediatr. 2019; 178:1171–84.
17. Kalikkot Thekkeveedu R, Guaman MC, Shivanna B. Bronchopulmonary dysplasia: a review of pathogenesis and pathophysiology. Respir Med. 2017; 132:170–7.
18. Gien J, Kinsella JP. Pathogenesis and treatment of bronchopulmonary dysplasia. Curr Opin Pediatr. 2011; 23:305–13.
19. Salafia CM, Weigl C, Silberman L. The prevalence and distribution of acute placental inflammation in uncomplicated term pregnancies. Obstet Gynecol. 1989; 73:383–9.
20. Fenton TR, Kim JH. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatr. 2013; 13:59.
21. Bhandari V. Postnatal inflammation in the pathogenesis of bron chopulmonary dysplasia. Birth Defects Res A Clin Mol Teratol. 2014; 100:189–201.
22. Thebaud B, Goss KN, Laughon M, Whitsett JA, Abman SH, Steinhorn RH, et al. Bronchopulmonary dysplasia. Nat Rev Dis Primers. 2019; 5:78.
23. Avery ME, Tooley WH, Keller JB, Hurd SS, Bryan MH, Cotton RB, et al. Is chronic lung disease in low birth weight infants preventable? A survey of eight centers. Pediatrics. 1987; 79:26–30.
24. Trembath A, Laughon MM. Predictors of bronchopulmonary dysplasia. Clin Perinatol. 2012; 39:585–601.
25. Doyle LW, Davis PG, Morley CJ, McPhee A, Carlin JB; DART Study Investigators. Low-dose dexamethasone facilitates extu bation among chronically ventilator-dependent infants: a multicenter, international, randomized, controlled trial. Pediatrics. 2006; 117:75–83.
26. Doyle LW, Cheong JL, Ehrenkranz RA, Halliday HL. Late (> 7 days) systemic postnatal corticosteroids for prevention of bronchopulmonary dysplasia in preterm infants. Cochrane Database Syst Rev. 2017; 10:CD001145.
27. Torchin H, Ancel PY, Goffinet F, Hascoet JM, Truffert P, Tran D, et al. Placental complications and bronchopulmonary dysplasia: EPIPAGE-2 cohort study. Pediatrics. 2016; 137:e20152163.
28. Bhatt AJ, Pryhuber GS, Huyck H, Watkins RH, Metlay LA, Maniscalco WM. Disrupted pulmonary vasculature and decreased vascular endothelial growth factor, Flt-1, and TIE-2 in human infants dying with bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001; 164:1971–80.
29. Speer CP. Pulmonary inflammation and bronchopulmonary dysplasia. J Perinatol. 2006; 26 Suppl 1:S57–62.
30. Choi CW. Chorioamnionitis: is a major player in the development of bronchopulmonary dysplasia? Korean J Pediatr. 2017; 60:203–7.
31. Barrington KJ. The adverse neuro-developmental effects of postnatal steroids in the preterm infant: a systematic review of RCTs. BMC Pediatr. 2001; 1:1.
32. Halliday HL, Ehrenkranz RA. Delayed (>3 weeks) postnatal cor ticosteroids for chronic lung disease in preterm infants. Cochrane Database Syst Rev. 2001; 2:CD001145.
33. Doyle LW, Cheong JLY. Postnatal corticosteroids to prevent or treat bronchopulmonary dysplasia: who might benefit? Semin Fetal Neonatal Med. 2017; 22:290–5.
34. Cheong JL, Burnett AC, Lee KJ, Roberts G, Thompson DK, Wood SJ, et al. Association between postnatal dexamethasone for treatment of bronchopulmonary dysplasia and brain volumes at adolescence in infants born very preterm. J Pediatr. 2014; 164:737–43.
35. Jobe AH. Postnatal corticosteroids for bronchopulmonary dysplasia. Clin Perinatol. 2009; 36:177–88.
36. Zeng L, Tian J, Song F, Li W, Jiang L, Gui G, et al. Corticosteroids for the prevention of bronchopulmonary dysplasia in preterm infants: a network meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2018; 103:F506–11.
37. Cuna A, Lewis T, Dai H, Nyp M, Truog WE. Timing of postnatal corticosteroid treatment for bronchopulmonary dysplasia and its effect on outcomes. Pediatr Pulmonol. 2019; 54:165–70.
Figure 1.
Flow chart of the study population. A total of 51 preterm infants were included in the analysis. Thirty infants (58.8%) were extubated successfully during the low-dose dexamethasone therapy, while 21 infants (41.2%) failed to be extubated. Thirty infants (58.8%) showed a good response to the low-dose dexamethasone therapy. The other 21 infants (41.2%) showed a poor response to therapy. All included infants developed moderate or severe bronchopulmonary dysplasia (BPD) on postmenstrual age (PMA) 36 weeks. Abbreviations: GA, gestational age; TTTS, twin to twin transfusion syndrome.
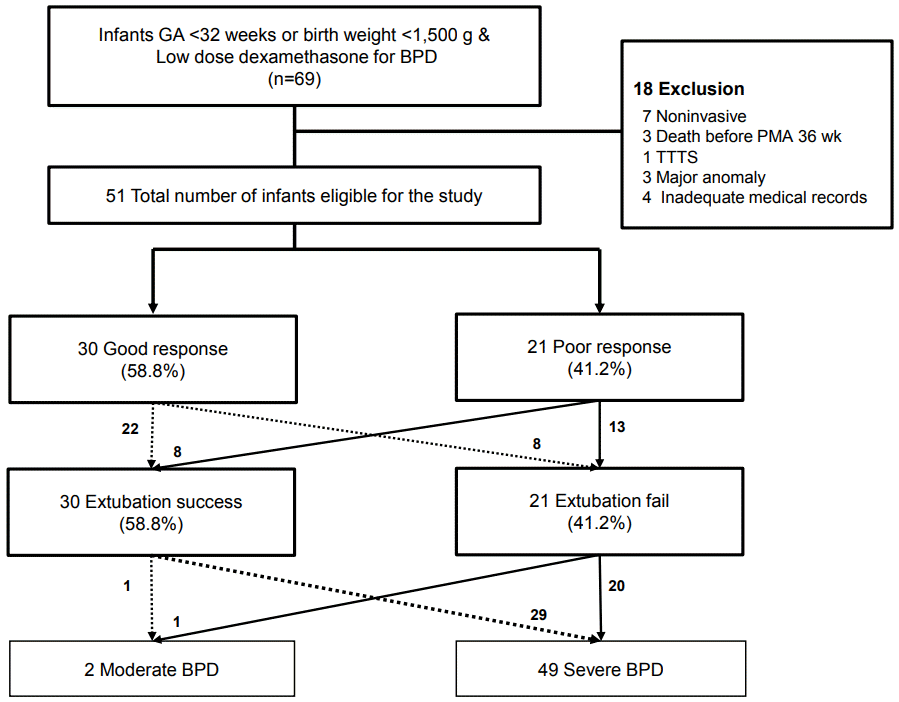
Figure 2.
(A) The number of infants intubated during the low-dose dexamethasone therapy. The total number of intubated infants decreased rapidly until day 6 (at a rate of 5 to 6 infants/day) and then slowed down. In the poor response group, the total number of intubated infants decreased more slowly than in the good response group, and more infants remained intubated on the final day of low-dose dexamethasone therapy. (B) Changes in respiratory severity score (RSS) during the low-dose dexamethasone therapy. RSS rapidly decreased until day 5. However, RSS was high from day 6. Infants who remained intubated and showed a poor response until the end of the low-dose dexamethasone therapy needed additional respiratory support. The good response group showed a higher initial RSS than did the poor response group. However, compared to that in the poor response group, RSS in the good response group decreased rapidly until day 5.
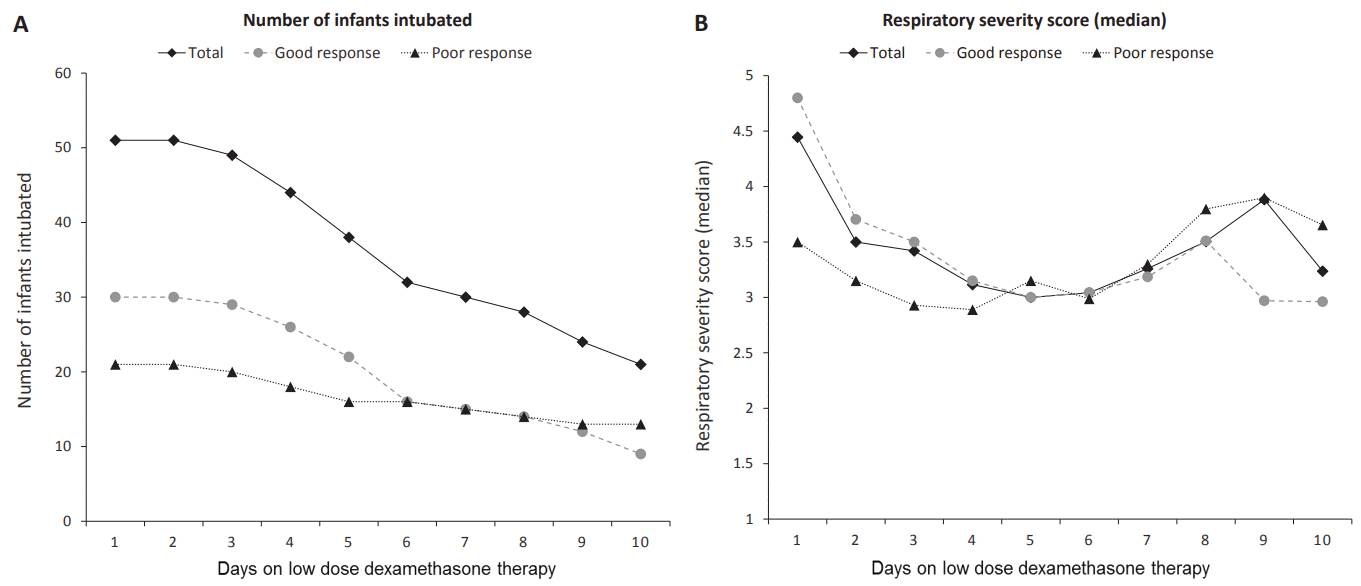
Table 1.
Correlation between Delta RSS, Slope, and Associated Factors via Univariate Analysis
Table 2.
Response to Low-Dose Dexamethasone Therapy between the Good and Poor Response Groups
Table 3.
Demographic Characteristics between the Good and Poor Response Groups
Table 4.
Neonatal Outcomes between the Good and Poor Response Groups
| Variable | Good response (n=30, 58.8%) | Poor response (n=21, 41.2%) | P-value |
|---|---|---|---|
| BPD | 30 (100) | 21 (100) | |
| Moderate or severe BPD | 30 (100) | 21 (100) | |
| ROP* | 17 (56.7) | 9 (42.9) | 0.400 |
| PVL | 8 (26.7) | 2 (9.5) | 0.167 |
| Death after PMA 36 wk | 2 (6.7) | 0 | 0.506 |
Table 5.
Neonatal Morbidities before the First Low-Dose Dexamethasone Therapy
| Variable | Good response (n=30, 58.8%) | Poor response (n=21, 41.2%) | P-value |
|---|---|---|---|
| PDA treatment before 1st dexamethasone | 16 (53.3) | 8 (36.4) | 0.394 |
| Sepsis before 1st dexamethasone | 4 (13.3) | 5 (23.8) | 0.460 |
| HCS* before 1st dexamethasone | 11 (36.7) | 6 (28.6) | 0.736 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download