Abstract
Purpose
Comparison between lung ultrasound (LUS) score and indices of respiratory severity in very preterm infants born at 28 to 31 weeks’ gestation.
Methods
We retrospectively reviewed medical records of 32 very preterm infants born at 28 to 31 weeks’ gestation at Keimyung University Dongsan Medical Center. Before surfactant administration, bedside LUS in the neonatal intensive care unit was recorded within the first hour of life. Partial pressure of capillary oxygen to fraction of inspired oxygen ratio (PcO2)/FiO2, alveolar-arterial gradient (A-aO2), modified oxygenation index (OI), and arterial to alveolar ratio were calculated. Correlation between LUS score and indices of respiratory severity were analyzed between the intubation and nasal continuous positive airway pressure (NCPAP) groups depending on the presence or absence of endotracheal intubation.
Results
Mean LUS scores, A-aO2, and modified OI in the intubation group were significantly higher than those in the NCPAP group. Conversely, PcO2/FiO2 and arterial to alveolar ratios in the intubation group were significantly lower than those in the NCPAP group. LUS score was found to be significantly correlated with A-aO2 (r=0.448, P<0.05) and modified OI (r=0.453, P<0.05), but not with PcO2/FiO2 ratio (r=–0.205, P> 0.05) and arterial to alveolar ratio (r=–0.190, P>0.05).
미숙아에서 호흡곤란증의 적합한 치료는 폐표면활성제의 투여이다[1]. 그렇지만, 폐표면활성제의 투여를 위한 기도 삽관은 그 자체로 부작용을 일으킬 수 있고, 잇달아 발생하는 양압환기에 의한 급성 폐 손상에 대한 문헌도 보고되고 있다[2]. 최근에는 비강 지속적 양압환기(nasal continuous positive airway pressure, NCPAP)과 같은 비침습적 환기가 출생 후 자발호흡을 가진 미숙아의 일차적인 치료로 사용되는 보고들이 있다[3-5]. 특히 Cochrane 데이터베이스 분석에서 출생 후 즉각적으로 기도 삽관 및 예방적 폐표면활성제를 투여한 경우보다 NCPAP으로 치료한 경우 오히려 폐 손상을 예방할 수 있다고 발표하였다[6]. 2016년 발표된 유럽의 호흡곤란증후군(respiratory distress syndrome)의 가이드라인에서 폐표면활성제의 투여가 치료의 중요한 부분이지만, 전반적인 목표는 가능한 인공 환기를 피하거나 지속시간을 줄이는 것으로 기술하였다[7]. 또한, Isayama 등[8]은 메타분석을 통하여 예방적인 폐표면활성제의 투여가 NCPAP에 비하여 어떠한 이점도 없다고 보고한다. 이러한 연구 결과들을 토대로, 현재 국내에서 시행되는 임신나이 30주 미만 또는 출생체중 1,250 g 이하에서 시행되는 예방적 폐표면활성제의 투여가 정기적으로 이루어져야 하는지에 대한 의문과 함께, 폐표면활성제의 투여를 위한 기도 삽관의 필요성에 대한 의문을 가지게 된다.
폐 초음파(lung ultrasound, LUS)는 간질 또는 폐포의 패턴이 다르게 확인되어 정상적으로 기포된 폐를 쉽게 인식할 수 있는 장점이 있으며[9], 신생아의 폐질환에 대한 진단적 도구로 LUS가 단순흉부영상에 비하여 정확성, 신뢰성, 단순성이 높고, 방사선 손상의 위험이 없다[10]. 이러한 LUS의 장점을 바탕으로, Copetti 등[11,12]은 LUS가 신생아 호흡곤란에서 관찰되는 양상을 기술하면서, 신생아 호흡곤란증후군 및 신생아 일과성 빈호흡의 진단에서 LUS가 높은 민감도와 특이도를 보인다고 발표하였다[13]. 2015년도 발표된 Standards for the Reporting of Diagnostic Accuracy Studies (STARD) guidelines에 따라 전향적으로 시행한 호흡곤란증후군의 진단 정확도 연구에 따르면, LUS score가 산소화지수나 폐표면활성제 투여의 필요성을 예측한다고 발표되었다[14]. 국내에서 LUS를 이용한 호흡곤란증후군의 중등도 평가에 대한 연구는 없지만, 저자들은 LUS가 단일기관에서 출생한 후기 미숙아에서 호흡곤란에 대한 폐표면활성제의 사용을 줄이는 데 도움이 되는 것을 이미 밝힌바 있다[15]. 또한, Kim 등[16]은 국내에서 예방적 폐표면활성제의 사용에 대한 보험적용이 허용된 후부터, 신생아 호흡곤란증후군 진단이 미국이나 일본에 비하여 많이 붙여졌을 가능성을 제시하였다. 이에 저자들은 임신나이 28–31주에 해당하는 극소 미숙아(very preterm infant)에서 LUS를 이용하여 호흡곤란의 중등도를 평가하고, LUS가 호흡곤란증후군에서 폐표면활성제의 사용을 위한 보조적인 진단 도구로 사용될 수 있는 가능성을 평가하였다.
2018년 3월부터 12월까지 계명대학교 동산의료원에서 출생한 임신나이 28+0–31+6주의 극소 미숙아에서, 2015년도에 개정된 신생아소생술[17]에 근거하여 양압환기에도 불구하고 심박동수가 반복적으로 무호흡을 동반한 100회/분 미만의 서맥이 발생하였거나, 양압환기에 반응 없이 심박동수가 지속적으로 100회/분 미만의 서맥이 나타난 아기들에게 기도 삽관을 시행하였다. LUS는 신생아집중치료실 입원 1시간 이내, 폐표면활성제를 투여받기 전에 시행되었다. 보육기 안에서 인공환기 또는 NCPAP 치료를 받는 동안, 2명의 소아청소년과 전문의 또는 5명의 소아청소년과 전공의에 의하여 ACUSON Sequoia C512 Echocardiography System (Siemens Ultrasound, Mountain View, CA, USA)을 이용하여 고해상도의 10-MHz 선형 프로브(high-resolution 10-MHz linear probe)로 앙와위에서 경흉부 접근 방법(transthoracic approach)으로 양측 흉부의 3 부위(upper anterior, lower anterior, lateral)에서 촬영하였다. Brat 등[14]의 연구를 참고하여, LUS score는 양측 흉부 3 부위에서 촬영된 각각의 영상을 분석하여, 늑막선 아래에 등거리로 나타나는 일련의 고해상의 수평선으로 보이는 A선이 보이면 0점, 또는 늑막선으로부터 발생하는 ‘혜성꼬리(comet-tail)’ 형태의 수직선인 B선이 존재하면 1점, 양측 백색 폐병변(bilateral white lung)이 보이면 2점, 대규모 경화(large consolidation) 소견을 보이거나 늑막선 이상이 관찰되면 3점으로 정하고, 총 6 부위의 점수를 합산하였다.
신생아집중치료실에 입원 후 1시간 이내에 모세혈관을 통하여 채취된 혈액을 Radiometer ABL80 Flex Blood gas analyzer (Radiometer Medical ApS, Bronshoj, Denmark)로 분석된 결과를 바탕으로, 모세혈 산소분압(partial pressure of capillary oxygen, PcO2)과 흡입산소(fraction of inspired oxygen, FiO2)의 비(PCO2 to FiO2 ratio), NCPAP의 압력 또는 침습적 인공호흡기의 평균 기도압(mean airway pressure)과 FiO2의 승에 대하여 PcO2의 비율로 정의한 변형된 산소화지수(oxygenation index), 폐포압(alveolar pressure, PA=FiO2×(760–47)–PcCO2/0.8)과 PcO2의 차(alveolar-arterial gradient), PcO2와 PA의 비(arterial to alveolar ratio)를 각각 계산하였다.
다른 연관인자들인 임신나이, 출생체중, 성별, 분만 방법, 다태아, 양수감소증, 산모의 임신성 고혈압, 조기양막파수, 산전스테로이드 사용, 1분/5분 아프가 점수, 폐표면활성제 투여 여부, 반복적인 폐표면활성제 투여, 인공호흡기 사용기간, 사망 또는 중등도 이상의 기관지폐이형성증 발생에 대하여 조사하였다. 연구에 등록된 환아는 임신나이 23–31주에 출생한 극소 미숙아로, 출생 후 기도 삽관 또는 NCPAP의 보조호흡기의 치료를 받으면서, LUS의 양측 흉부 3 부위에서 A선이 없이 백색의 폐병변을 보이거나, 단순흉부영상에서 미만성의 망상과립상 음영 및 공기-기관지 음영이 보이는 경우를 호흡곤란증후군으로 정의하고 기도 삽관 후 폐표면활성제를 투여와 동시에 인공호흡기 치료를 하였다.
통계학적 분석은 IBM SPSS Statistics version 25.0 (IBM Co., Armonk, NY, USA)을 이용하였으며, 연속변수는 independent t-test를 이용하여 mean±standard deviation으로 표시하였으며, 정규분포를 따르지 않는 연속변수는 Mann-Whitney test를 이용하여 median (interquartile range)로 표시하였다. 범주형 변수는 chi-square test 또는 Fisher’s exact test로 비교하였으며, 상관분석은 Pearson 상관계수를 이용하였다. P-value가 0.05 미만인 경우 통계학적으로 유의한 것으로 판정하였다.
본 연구는 후향적 데이터분석연구로 연구자의 동의서 취득이 면제되며, 연구의 계획은 사전에 계명대학교 동산병원 기관생명윤리위원회의 승인을 받았다(IRB No. 2019-05-068).
연구 기간 동안 본원에서 출생한 42명의 극소 미숙아에서 출생 후 즉각적인 기도 삽관 후 예방적 폐표면활성제를 투여한 10명은 제외하였다. 호흡곤란을 보인 32명 중 폐표면활성제를 투여받은 환아는 81.3% (26/32)이었는데, 기도 삽관을 받은 그룹에서 폐표면활성제 투여율은 100% (12/12), 대조군의 폐표면활성제 투여율은 70% (14/20)이었다. 반복적인 폐표면활성제 투여는 43.8% (14/32)이었다.
기도 삽관의 여부에 따른 두 그룹에서, 임신나이와 출생체중은 유의한 차이가 없었지만, 1분/5분 아프가 점수가 기도 삽관 그룹에서 유의하게 낮았다(P<0.05). 두 그룹에서 성별, 분만 방법, 다태아, 양수감소증, 산모의 임신성 고혈압, 조기양막파수, 산전 스테로이드 사용의 차이는 없었다(P>0.05) (Table 1).
기도 삽관의 여부에 따른 두 그룹에서 호흡곤란의 중등도를 비교하였는데(Table 2), LUS score와 호흡곤란의 중등도를 나타내는 인자인 변형된 산소화지수, PA와 PcO2의 차, PcO2와 FiO2의 비, PcO2와 PA의 비가 기도 삽관 그룹에서 유의하게 높았다(P<0.05). 그렇지만, 폐표면활성제의 투여 여부, 반복적인 폐표면활성제의 투여 여부, 보조호흡기의 사용기간, 사망 또는 중등도 이상의 기관지폐이형성증의 발생 여부에서는 차이가 없었다(P>0.05) (Table 2).
LUS는 변형된 산소화지수(r =0.453, P =0.009)와 PA와 PcO2의 차(r =0.448, P =0.010)와는 유의한 양의 상관관계를 나타내었다. 그렇지만, PcO2와 FiO2의 비(r =–0.205, P =0.261)와 PcO2와 PA의 비(r =–0.190, P =0.297)에서는 음의 상관관계를 보였지만, 통계적인 유의성은 없었다(Figure 1).
본 연구에서는 Brat 등[14]의 LUS score를 이용한 연구를 바탕으로 단일기관에서 임신나이 28–31주의 극소 미숙아에서 호흡곤란의 중등도를 평가하였고, LUS score가 변형된 산소화지수와 PA와 PcO2의 차와 유의한 양의 상관관계를 나타내었는데, LUS가 극소 미숙아에서 호흡곤란의 중등도를 평가하는 하나의 도구로 사용될 수 있는 것으로 나타났다.
LUS에 대한 연구로, Brat 등[14]은 출생 후 호흡곤란으로 NCPAP를 시행 받는 임신나이 34주 미만의 미숙아에서 LUS score가 폐표면활성제의 투여를 잘 예측할 수 있다고 발표하였는데, 산소화를 측정하는 인자로 경피적 산소분압(transcutaneous partial pressure of oxygen)에 대한 FiO2의 비, 산소화지수, PA와 산소분압의 차, 및 산소분압과 PA의 비를 비교하였다. 본 연구에서는 모세혈 가스분석을 통하여 얻은 산소분압 및 이산화탄소분압으로 상기 기술한 4가지 인자를 계산하였고, 이러한 호흡곤란의 중등도를 나타내는 지표들과 LUS score를 비교하였다.
산소화지수는 국내에서도 호흡곤란증후군을 가진 조산아에서 폐표면활성제 투여에 대한 치료 효과의 지표로 사용되었다. Kim 등[18]은 폐표면활성제 투여 방법에 대한 비교를 위한 지표로 산소화지수 및 동맥혈-폐포 산소분압의 비 등을 비교하였다. Jeon 등[19]은 폐표면활성제 투여 후 산소화지수의 변화를 비교하였는데, 호흡곤란의 중등도를 파악하는데 유용한 지표로 사용될 수 있다고 하였다. 이러한 연구들에서 측정한 산소화지수는 동맥혈 산소분압(partial pressure of arterial oxygen)을 이용하였지만, 본 연구에서는 침습적인 동맥혈을 대신한 본 연구에서는 모세혈관에서 얻은 혈액을 분석한 PcO2를 이용하여 변형된 산소화지수를 계산하였다.
PA와 산소분압의 차도 이미 호흡곤란에 대한 또 다른 지표로 사용되었는데[20,21], 본 연구에서도 PA와 PcO2의 차가 LUS score와 유의한 양의 상관관계를 나타내었다.
또한, 동맥혈 산소분압과 FiO2의 비도 이미 급성 호흡곤란증후군의 지표로 사용되었다[22,23]. Narayanan 등[23]은 태변흡입증후군을 가진 신생아에서 출생 후 첫 24시간 이내에 측정한 동맥혈 산소분압과 FiO2의 비가 사망을 예측하는 좋은 지표라고 기술하였다. 그렇지만, 신생아에서 동맥혈 산소분압은 동맥 카테터를 삽관하거나, 동맥 천자를 시행하는 침습적인 검사이다. 따라서, 저자들은 임신나이 28–31주에 출생한 극소 미숙아에서 동맥혈 채취에 대한 침습적인 시술을 지양하고, 변형된 지표인 PcO2에 대한 FiO2의 비를 비교하였다. 최근 동맥혈을 포함한 침습적인 혈액검사를 줄이는 방향으로, 산소포화도 측정기를 이용한 말초 관류 지표(peripheral perfusion index)와 경피적 일산화탄소(transcutaneous carbon monoxide) 등 환자 감시 장치에서 측정된 지표를 이용한 연구도 있다[24-26]. Ray 등[26]은 집중치료실에 입원한 소아에서 산소포화도 측정기를 이용하여 비침습적으로 측정한 혈중 산소포화도(hemoglobin oxygen saturation)를 이용한 호흡지표가 동맥혈에서 측정한 호흡지표와 비교하여서도 나쁘지 않다고 발표하였다. 미숙아에서도 비침습적인 방법으로 측정된 호흡지표를 이용한 호흡곤란의 중등도를 분석한 연구가 필요할 것이다.
본 연구는 호흡곤란증후군에서 폐표면활성제의 투여와 LUS에 대한 비교 연구가 아니다. 그렇지만, 임신나이 30주 미만 또는 출생체중 1,250 g 미만의 아기에게 예방적으로 폐표면활성제가 투여되어야 하는지에 대한 의문이 이 연구를 시행하게 된 다른 배경이기도 하다. Finer 등[4]은 임신나이 24–27주에 출생한 환아들에서 NCPAP 그룹과 폐표면활성제를 투여한 그룹의 사망 또는 기관지폐이형성증 발생에 차이가 없다고 발표하였다. Dunn 등[5]은 임신나이 26–29주에 출생한 환아들에서 예방적 폐표면활성제를 투여하고 인공환기 치료를 시행한 그룹, 기도 삽관을 통한 폐표면활성제 투여 후 NCPAP를 통하여 치료한 그룹, NCPAP를 통한 치료를 하면서 필요한 경우 폐표면활성제를 투여한 그룹으로 나누어 비교하였는데, 초기의 NCPAP 치료가 기도 삽관 및 폐표면활성제의 투여를 줄일 수 있다고 보고하였다. 그렇지만, 국내 심사평가원 급여기준인 임신나이 30주 미만 또는 출생체중 1,250 g 이하에서 사용되는 예방적 폐표면활성제가 오히려 다른 국가에 비하여 폐표면활성제 투여율을 증가시키는 요인일 수 있다. 정확한 폐표면활성제 사용에 대한 객관적인 진단을 위한 추가적인 연구를 위하여, 폐표면활성제 사용을 위한 LUS score의 절단값(cut-off value)을 분석하고, 추가적으로 폐표면활성제의 투여 방법에 따른 LUS score의 차이를 비교해 볼 필요가 있다.
물론, 본 연구에서 등록된 환아에서 폐표면활성제 투여에 대하여 객관적인 기준이 아닌 LUS 또는 단순흉부영상 소견을 기초로 한 의사의 주관적 기준으로 투여되었기에, 폐표면활성제 투여에 대한 결과의 해석에 제한이 많다. 그렇지만, 신생아 호흡곤란증후군에 대한 단순흉부영상과 LUS의 진단적 민감도를 비교한 연구는 없다. Copetti 등[11]의 연구에서 호흡곤란증후군에서 LUS를 나타내는 소견의 민감도와 특이도가 100%로 확인되었지만, 단순흉부영상과의 비교연구가 아니다. 연구를 시행하는 과정에서 LUS가 다수의 검사자에 의하여 진행된 점도 검사자에 따른 오류 발생으로 인한 연구 결과의 해석에 제한이 있다. 이러한 제한점을 고려하여, 보다 객관적인 폐표면활성제 투여를 예측하는 인자로 알려진 안정 미세기포 검사(stable microbubble test) [27], 제대혈의 혈청에서 측정한 폐표면활성제 단백 A (pulmonary surfactant protein A) [28], 제대혈의 혈관내피성장인자(vascular endothelial growth factor) [29], 라멜라 체 수(lamellar body count) [30,31] 등과 함께 비교 분석을 시행한다면, LUS가 극소 미숙아에서 폐표면활성제 투여의 여부를 결정하는 도구로 사용될 수 있을 것이다.
본 연구는 단일기관에서 시행된 후향적인 연구로 통계적인 유의성을 해석하기에 제한이 있지만, LUS가 극소 미숙아에서 호흡곤란의 중등도를 파악하는 하나의 지표가 될 수 있다는 것을 확인하였다. 다기관의 전향적인 연구를 통하여, 호흡곤란증후군에서 폐표면활성제 투여를 위한 보다 객관적인 진단적 도구로 LUS가 사용될 수 있는 근거가 될 연구가 필요할 것이다.
REFERENCES
1. Committee on Fetus and Newborn; American Academy of Pediatrics. Respiratory support in preterm infants at birth. Pediatrics. 2014; 133:171–4.
2. Iliodromiti Z, Zygouris D, Sifakis S, Pappa KI, Tsikouras P, Salakos N, et al. Acute lung injury in preterm fetuses and neonates: mechanisms and molecular pathways. J Matern Fetal Neonatal Med. 2013; 26:1696–704.
3. Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB, et al. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med. 2008; 358:700–8.
4. SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network, Finer NN, Carlo WA, Walsh MC, Rich W, Gantz MG, et al. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med. 2010; 362:1970–9.
5. Dunn MS, Kaempf J, de Klerk A, de Klerk R, Reilly M, Howard D, et al. Randomized trial comparing 3 approaches to the initial respiratory management of preterm neonates. Pediatrics. 2011; 128:e1069–76.
6. Rojas-Reyes MX, Morley CJ, Soll R. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev. 2012; 3:CD000510.
7. Sweet DG, Carnielli V, Greisen G, Hallman M, Ozek E, Plavka R, et al. European consensus guidelines on the management of respiratory distress syndrome: 2016 Update. Neonatology. 2017; 111:107–25.
8. Isayama T, Chai-Adisaksopha C, McDonald SD. Noninvasive ventilation with vs without early surfactant to prevent chronic lung disease in preterm infants: a systematic review and metaanalysis. JAMA Pediatr. 2015; 169:731–9.
9. Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein DA, Mathis G, Kirkpatrick AW, et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 2012; 38:577–91.
10. Liu J. Lung ultrasonography for the diagnosis of neonatal lung disease. J Matern Fetal Neonatal Med. 2014; 27:856–61.
11. Copetti R, Cattarossi L, Macagno F, Violino M, Furlan R. Lung ultrasound in respiratory distress syndrome: a useful tool for early diagnosis. Neonatology. 2008; 94:52–9.
12. Copetti R, Cattarossi L. The 'double lung point': an ultrasound sign diagnostic of transient tachypnea of the newborn. Neonatology. 2007; 91:203–9.
13. Vergine M, Copetti R, Brusa G, Cattarossi L. Lung ultrasound accuracy in respiratory distress syndrome and transient tachypnea of the newborn. Neonatology. 2014; 106:87–93.
14. Brat R, Yousef N, Klifa R, Reynaud S, Shankar Aguilera S, De Luca D. Lung ultrasonography score to evaluate oxygenation and surfactant need in neonates treated with continuous positive airway pressure. JAMA Pediatr. 2015; 169:e151797.
15. Sin SY, Jin MJ, Lee NH, Park JH, Kim CS, Lee SL. Lung ultrasonography for the diagnosis of respiratory distress syndrome in late preterm infants: changing incidence: a single center experience. Neonatal Med. 2017; 24:13–9.
16. Kim TH, Choi MS, Chung SH, Choi YS, Bae CW. Morbidity of low birth weight infants in Korea (2012): a comparison with Japan and the USA. Neonatal Med. 2014; 21:218–23.
17. Wyckoff MH, Aziz K, Escobedo MB, Kapadia VS, Kattwinkel J, Perlman JM, et al. Part 13: neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015; 132(18 Suppl 2):S543–60.
18. Kim BI, Choi JH, Yun CK. Changes of respiratory indices and clinical response to the different modes of delivery for administration of surfactant replacement therapy in the respiratory distress syndrome. J Korean Soc Neonatol. 1997; 4:205–16.
19. Jeon JH, Namgung R, Park MS, Park KI, Lee C. Oxygenation index as a respiratory parameter of respiratory distress syndrome in preterm infants. Korean J Pediatr. 2008; 51:145–9.
20. Krummel TM, Greenfield LJ, Kirkpatrick BV, Mueller DG, Kerkering KW, Ormazabal M, et al. Alveolar-arterial oxygen gradients versus the neonatal pulmonary insufficiency index for prediction of mortality in ECMO candidates. J Pediatr Surg. 1984; 19:380–4.
21. Berry DD, Pramanik AK, Philips JB 3rd, Buchter DS, Kanarek KS, Easa D, et al. Comparison of the effect of three doses of a synthetic surfactant on the alveolar-arterial oxygen gradient in infants weighing > or = 1250 grams with respiratory distress syndrome. American Exosurf Neonatal Study Group II. J Pediatr. 1994; 124:294–301.
22. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994; 149(3 Pt 1):818–24.
23. Narayanan A, Batra P, Faridi MMA, Harit D. PaO2/FiO2 ratio as predictor of mortality in neonates with meconium aspiration syndrome. Am J Perinatol. 2019; 36:609–14.
24. Terek D, Gonulal D, Koroglu OA, Yalaz M, Akisu M, Kultursay N. Effects of two different exogenous surfactant preparations on serial peripheral perfusion index and tissue carbon monoxide measurements in preterm infants with severe respiratory distress syndrome. Pediatr Neonatol. 2015; 56:248–55.
25. Karadag N, Dilli D, Zenciroglu A, Aydin B, Beken S, Okumus N. Perfusion index variability in preterm infants treated with two different natural surfactants for respiratory distress syndrome. Am J Perinatol. 2014; 31:1015–22.
26. Ray S, Rogers L, Pagel C, Raman S, Peters MJ, Ramnarayan P. PaO2/FIO2 ratio derived from the SpO2/FIO2 ratio to improve mortality prediction using the pediatric index of mortality-3 score in transported intensive care admissions. Pediatr Crit Care Med. 2017; 18:e131–6.
27. Chida S, Fujiwara T, Konishi M, Takahashi H, Sasaki M. Stable microbubble test for predicting the risk of respiratory distress syndrome: II. Prospective evaluation of the test on amniotic fluid and gastric aspirate. Eur J Pediatr. 1993; 152:152–6.
28. Cho K, Matsuda T, Okajima S, Matsumoto Y, Sagawa T, Fujimoto S, et al. Prediction of respiratory distress syndrome by the level of pulmonary surfactant protein A in cord blood sera. Biol Neonate. 2000; 77:83–7.
29. Tsao PN, Wei SC, Chou HC, Su YN, Chen CY, Hsieh FJ, et al. Vascular endothelial growth factor in preterm infants with respiratory distress syndrome. Pediatr Pulmonol. 2005; 39:461–5.
30. Lee IS, Cho YK, Kim A, Min WK, Kim KS, Mok JE. Lamellar body count in amniotic fluid as a rapid screening test for fetal lung maturity. J Perinatol. 1996; 16(3 Pt 1):176–80.
31. Daniel IW, Fiori HH, Piva JP, Munhoz TP, Nectoux AV, Fiori RM. Lamellar body count and stable microbubble test on gastric aspirates from preterm infants for the diagnosis of respiratory distress syndrome. Neonatology. 2010; 98:150–5.
Figure 1.
Relations between lung ultrasound (LUS) score and indices of respiratory severity. (A) Capillary partial pressure of oxygen (PcO2) to fraction of inspired oxygen (FiO2) ratio. (B) Alveolar-arterial gradient. (C) Modified oxygenation index. (D) Arterial to alveolar ratio. Results of correlation analysis are shown, with r indicating the crude Spearman coefficient.
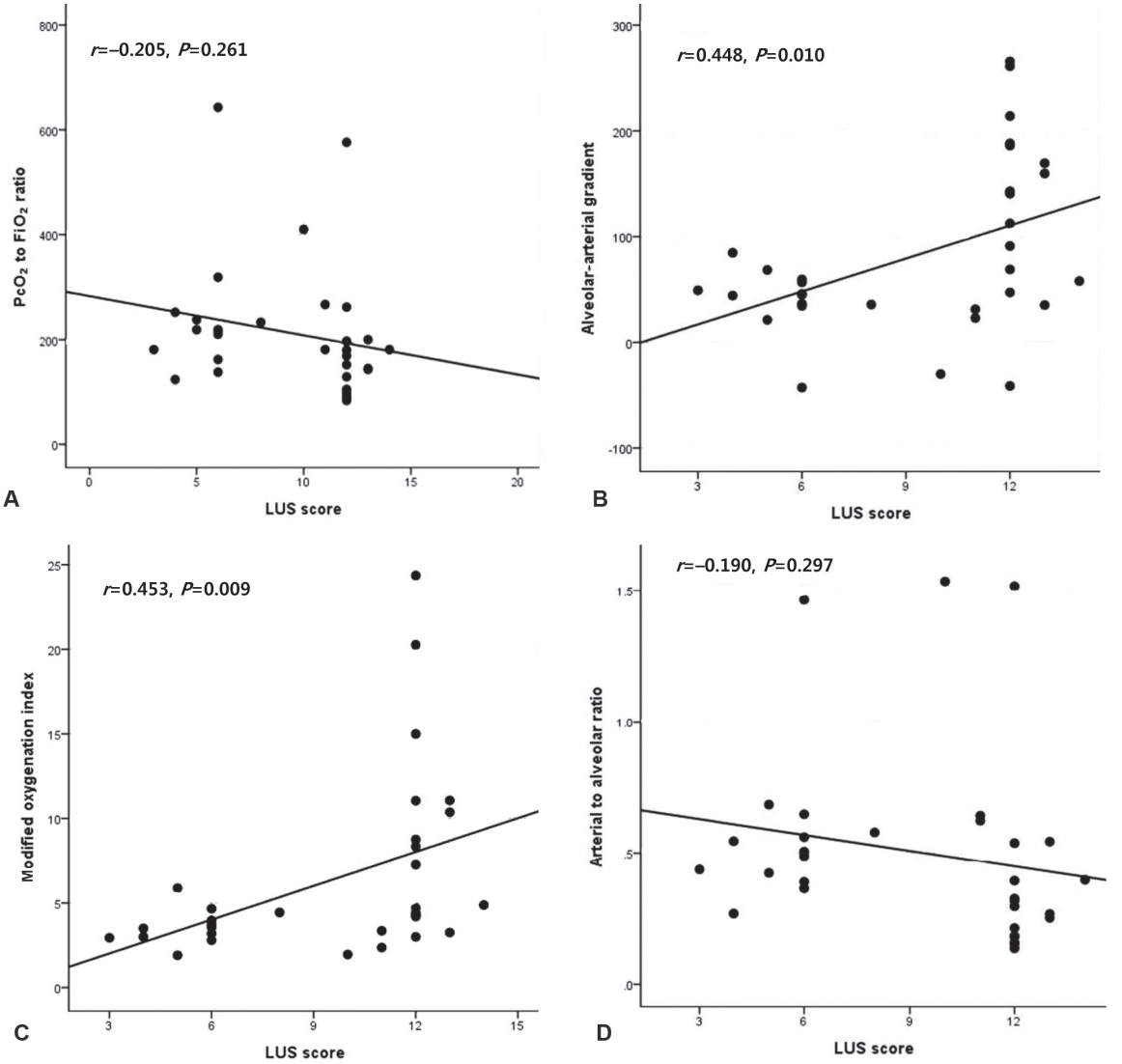
Table 1.
Perinatal Characteristics between Intubation Group and NCPAP Group
Table 2.
Primary Outcomes between Intubation Group and NCPAP Group during NICU Hospitalization
Values are expressed as number (%), mean±standard deviation, or median (interquartile range).
Abbreviations: NCPAP, nasal continuous positive airway pressure; NICU, neonatal intensive care unit; BPD, bronchopulmonary dysplasia; LUS, lung ultrasound; PcO2, partial pressure of capillary oxygen; FiO2, fraction of inspired oxygen.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download