Abstract
Purpose
To analyze and compare the clinical factors and neurodevelopmental outcomes compare early- and late-onset periventricular leukomalacia (PVL) in very low birth weight infants (VLBWI).
Methods
We performed a retrospective study involving 199 newborn infants weighing <1,500 g admitted to the neonatal intensive care unit between March 2009 and December 2015. VLBWI with PVL were categorized into early- and late-onset PVL groups based on the time of diagnosis based on 28 days of age. We analyzed the clinical factors and neurodevelopmental outcomes between the groups.
Results
The incidence rate of PVL was 10.1% (16/158). The Apgar score at 1 minute and the mean duration of tocolytic therapy were associated with the development of PVL. The incidence rate of premature rupture of membranes (PROM) was significantly higher in the early-onset PVL group (P=0.041). No significant differences were observed in neurodevelopmental outcomes between the early- and late-onset PVL groups.
Conclusion
Results suggest that a higher incidence of PROM was associated with clinical characteristics in the early-onset PVL group. No significant intergroup differences were observed in neurodevelopmental outcomes; however, the Bayley Scales of Infant Development-III scores were lower in the early-onset PVL group.
전 세계적으로 주산기 의학 및 신생아학이 발달함에 따라 미숙아 및 고위험 신생아의 생존율이 크게 향상되었다[1]. 그러나 생존한 극소 저체중출생아는 신경발달학적 장애의 고위험군으로, 10%–15%는 뇌성마비를 보이고, 50%는 인지 및 행동장애를 보인다[2-5]. 이러한 신경발달학적 합병증의 가장 중요한 원인은 미숙아에서 발생하는 뇌실 주위 백질연화증(periventricular leukomalacia)이며[6], 뇌실 주위 백질연화증은 측뇌실 외측의 괴사와 괴사 주변부 백질의 손상으로 발생하는 질환으로 알려져 있다[7]. 미숙아는 뇌혈관의 자율조절 기전이 불안정하고 측뇌실 부위의 혈관 발달이 미비하여 저산소 및 허혈성 손상에 대해 취약하며 재관류에 의한 산소유리기 손상 등의 원인 인자가 함께 동반되어[6,8], 뇌실 주위 백질연화증의 위험이 높은 것으로 이해되고 있다. 국내외 여러 문헌에서 뇌실 주위 백질연화증의 출생 전 위험요인으로 산모의 조기양막파열, 융모양막염(chorioamnionitis), 태아곤란증, 출생 후 요인으로 신생아 가사, 기계적 환기요법 및 저탄산혈증, 동맥관개존에 의한 뇌혈류의 변화, 호흡곤란증후군(respiratory distress syndrome)과 반복적인 무호흡 등을 보고하고 있다[4,9,10]. 최근에는 뇌실 주위 백질연화증과 같은 합병증이 출생 후의 요인 및 신생아중환자실의 치료에 의해서도 영향을 받지만, 그 이전 태내에서부터의 요인에 의해서 좀 더 중요한 영향을 받는다는 사실이 여러 연구를 통하여 알려지고 있다[1,2]. 특히 자궁 내 감염 및 염증으로 인한 태아 염증 반응(fetal inflammation response)으로 유발된 체내 사이토카인의 증가가 뇌실 주위 백질연화증의 발생을 높이며 장기적인 신경 발달 예후와 관련 있음이 연구되고 있다[1,11]. 뇌실 주위 백질연화증의 위험요인에 대한 연구는 주로 극소 저체중출생아를 대상으로 이루어졌고, Chey와 Shim [9]은 재태연령에 따른 발생 원인 및 위험요인의 차이 등에 대해 연구하였다. 최근 극소 저체중출생아의 생존율이 높아지는 상황에서 뇌실 주위 백질연화증은 장기적인 신경발달 예후에 영향을 미치는 중요한 질환으로 이에 따른 위험요인을 고찰하고 이를 통한 조기 예측과 진단을 통해 손상을 최소화하는 것이 중요하다고 생각된다.
저자들은 1,500 g 미만의 극소 저체중출생아에서 뇌실 주위 백질연화증이 생후 28일 이내 조기 진단되는 환자가 증가하는 것을 경험하고, 외래에서 발달 추적 시 후기 진단되는 환자보다 신경발달 예후가 좋지 않은 것으로 의심되어 뇌실 주위 백질연화증이 진단되는 시기에 따른 환자군의 임상적 인자들을 비교하고 장기적인 신경발달학적 예후를 알아보고자 본 연구를 진행하였다.
2009년 3월부터 2015년 12월까지 부산대학교 어린이병원에서 출생하여 신생아집중치료실에 입원한 출생체중 1,500 g 미만의 극소저체중출생아 199명을 대상으로 의무기록지를 통한 후향적 연구를 시행하였다. 출생 28일 이전에 사망한 경우(n=29), 타 병원으로 전원 된 경우(n=8), 염색체 이상, 다발성 기형, 선천성 심기형이 있는 경우(n=4)는 연구 대상에서 제외하였다(Figure 1). 뇌 초음파검사 또는 뇌 자기공명영상(magnetic resonance image, MRI)을 통하여 뇌실 주위 백질 내 다수의 낭종성 변화를 가진 경우 뇌실 주위 백질연화증으로 진단하였고 총 16명의 환자가 연구에 포함되었다. 생후 28일 미만에 진단된 환자들을 조기 진단군(early-onset PVL group), 생후 28일 이후 진단된 환자들을 후기 진단군(late-onset PVL group)으로 분류하였다. 3기 이상의 중증 뇌출혈에서 출혈성 경색으로 낭종이 발생한 경우는 대상군에서 제외하였다. 뇌 초음파검사는 출생 후 1주 이내에 최초 검사를 시행하였고 이후 1–2주 간격으로 재검사하였으며, 퇴원 전 월경 후 연령(postmenstrural age)으로 38–40주가 되었을 때 뇌 MRI를 시행하거나, 퇴원 후 추적관찰 중 발달지연 등의 합병증이 생겼을 때 영상검사를 시행하였다. 본 연구는 부산대학교병원 임상연구윤리위원회의 승인 하에 후향적 의무기록 분석 연구로 진행하였다(IRB No. H-1810-011-071).
극소 저체중출생아를 대상으로 뇌실 주위 백질연화증으로 진단받은 환아들과 대조군들의 위험인자를 산과적, 주산기적, 신생아적 요인들로 나누어 먼저 비교하고 이후 뇌실 주위 백질연화증으로 진단받은 16명의 환자를 대상으로 진단 시기에 따른 임상적 인자들과 신경발달학적 예후를 조사하였다.
출산 전 산모 요인으로 산모의 나이, 다태임신, 인공수정, 임신성 고혈압(pregnancy-induced hypertension), 산모의 당뇨, 분만 전 스테로이드 투여, 18시간 이상의 조기양막파수, 양막파수 후 분만까지의 시간, 조기 수축 유무와 시간, 조기 진통억제제 치료 여부와 치료시간, 태아 스트레스, 융모양막염 등을 조사하였다. 이때 융모양막염은 태반의 병리학적 소견이 아닌 임상적 소견으로 진단하였고, 산모의 발열이 38℃ 이상, 자궁의 압통, 혈액검사에서 백혈구 수가 20,000/μL 이상, C-reactive protein가 5 mg/dL (정상범위, 0–0.5) 이상, 산모의 맥박수가 100회/분 이상, 그리고 태아의 맥박수가 160회/분 이상 중에서 3가지 이상 만족할 시 진단하였다[12]. 임신성 고혈압은 임신 중 새로 생긴 고혈압으로 수축기 혈압이 140 mm Hg 이상 또는 이완기 혈압이 90 mm Hg 이상이거나 무작위로 채취한 요의 dipstick test에서 1+ 이상 단백뇨를 보이는 경우로 정의하였다[13].
신생아 특성으로는 재태연령, 출생체중, 분만 방법, 1분 및 5분 Apgar 점수, 신생아 호흡곤란증후군, 중등증과 중증의 기관지폐이형성증(bronchopulmonary dysplasia), 동맥관개존증(patent ductus arteriosus)은 심초음파상 혈역학적으로 의미가 있는 동맥관 단락이 있으면서 약물 혹은 외과적 치료가 필요한 경우, Papile 등[14]의 분류에 의한 3단계 이상의 뇌실내출혈(intraventricular hemorrhage)을 조사하였다. 생후 72시간 이내에 발생한 저혈압은 재태연령에 따른 평균 동맥압의 5% 미만이면서 승압제 등의 치료가 필요한 경우로 정의하였고, 혈액 배양검사로 확진된 조발형 신생아 패혈증, modified Bell’s staging criteria [15]에 의해 진단된 2기 이상의 괴사성장염(necrotizing enterocolitis) 등을 조사하였다. 출생 당시 동맥혈 가스 분석검사를 통하여 출생 후 첫 pH, 이산화탄소 분압, 산소 분압, 중탄산염의 농도, 출생 후 72시간 이내 측정된 이산화탄소 분압이 28 mm Hg 미만인 경우를 저탄산혈증으로 정의하고 이의 유무 및 가장 낮은 이산화탄소 분압 수치를 조사하였다.
신경학적 발달 평가를 위해 교정연령 18개월에 뇌성마비, 항경련제를 복용 중인 경련 여부, 사시, 청력 손상 여부를 조사하였으며 외래 방문 시 측정한 키와 몸무게를 이용하여 따라잡기 성장 여부를 조사하였다. 뇌성마비는 비진행성 중추 신경계 장애로 적어도 1개 이상의 사지에서 비정상적인 근 긴장도와 행동 및 자세 장애를 가지는 경우로 정의하였고[3], 소아 재활의학과 전문의의 신경학적, 이학적 검사를 통하여 진단하였다. 또한 Bayley Scales of Infant Development-III (BSID-III)을 시행하여, 인지, 언어, 운동, 사회-정서, 적응 행동 척도의 점수를 분석하였다.
수집된 자료에 대한 통계분석은 SPSS for Windows version 22.0 (IBM Co., Armonk, NY, USA)을 사용하였다. 두 군의 연속변수는 mean±standard deviation으로 표현하였고, 그 평균값은independent t-test를 이용하여 분석하였다. 또는 두 군의 연속변수 중 정규분포를 따르지 않을 경우에는 median (range)로 표시하였고 Mann-Whitney test를 이용하여 분석하였다. 범주형 변수는 두 군 사이의 빈도 차를 chi-square test 또는 Fisher’s exact test로 비교하였다. 두 군 간 변수의 비교는 모든 분석에서 P-value가 0.05 미만인 경우에 통계학적으로 유의하다고 판정하였다.
뇌실 주위 백질연화증으로 진단된 16명과 대조군 142명의 산과적, 주산기적 위험인자를 비교하였을 때 환자군에서 1분 Apgar 점수가 의미 있게 낮았고(P =0.049), 조기 진통억제제 치료시간이 더 길었다(P =0.019). 그 외 분만 방법, 5분 Apgar 점수, 다태임신, 인공 수정, 산모의 당뇨, 임신성 고혈압, 분만 전 스테로이드 투여, 분만 전 항생제 사용, 조기양막파열 유무에서는 두 군 사이에 유의한 차이가 없었다(Table 1).
신생아기 위험인자를 비교하였을 때 뇌실 주위 백질연화증으로 진단된 환자군이 대조군에 비하여 신생아 호흡곤란증후군(P = 0.014), 기관지폐이형성증(P =0.007)의 발생빈도가 유의하게 높았고, 입원기간(P =0.007)이 유의하게 길었다. 그 외 두 군 간에 의미 있는 차이는 없었다(Table 2).
뇌실 주위 백질연화증을 진단받은 16명 중에서 생후 28일 미만에 진단받은 조기 진단군은 8명, 생후 28일 이후에 진단받은 후기 진단군은 8명이었다. 조기 진단군과 후기 진단군의 산과적, 주산기적 임상적 특징을 비교하였을 때 조기 진단군에서 18시간 이상의 조기양막파수의 빈도가 유의하게 높았고(P =0.041), 양막파수 후 분만까지의 시간은 통계학적인 차이는 보이지 않았으나 조기 진단군에서 더 길었다(P =0.833). 그 외 산모의 나이, 다태임신, 산모의 당뇨, 임신성 고혈압, 임상적 융모양막염 등에서는 두 군 간에 의미 있는 차이는 보이지 않았다(Table 3).
뇌실 주위 백질연화증의 조기 진단군과 후기 진단군의 신생아기 임상적 특징을 비교하였을 때 재태연령의 중앙값은 각각 28.1주(범위, 24.1–30.3), 28.1주(범위, 26.0–30.2)였고 출생체중의 중앙값은 각각 1,020 g (범위, 640–1,390), 1,090 g (범위, 930–1,410)으로 의미있는 차이는 없었다(P =0.878, P =0.574). 뇌실 주위 백질연화증 진단 시기의 중앙값은 조기 진단군은 16일(범위, 6–27), 후기 진단군은 69일(범위, 36–84)이었다(P =0.001). 그 외 임상적 특징에서는 두 군 간에 통계학적인 차이가 없었다(Table 4).
뇌실 주위 백질연화증의 조기 진단군과 후기 진단군의 신경발달학적 예후 비교를 위해 교정연령 18개월에 뇌성마비, 경련, 사시, 청력 손상, 따라잡기 성장 등을 평가하였고 조기 진단군에서 따라잡기 성장의 실패가 많았으나 두 군 간에 통계학적인 차이는 없었다(Table 5). 교정연령 18개월에 BSID-III를 시행하였고 두 군 간에 유의한 차이를 보이는 항목은 없었으나, 조기 진단군이 후기 진단군 보다 모든 항목에서 더 낮은 점수를 보였으며 특히 인지, 운동에서 더 큰 차이를 보였다(Table 6). 인지와 운동 발달지수에서 69점 이하 심한 발달지연을 보인 미숙아는 조기 진단군에서 4명, 후기 진단군에서 2명이었다.
본 연구에서는 생후 28일 이내에 뇌실주위 백질연화증이 진단되는 군에서 조기양막파수의 빈도가 높았고, 교정연령 18개월에 시행한 BSID-III 검사에서 조기 진단과 후기 진단군 간에 각각 유의한 차이는 없었으나 조기 진단군이 후기 진단군 보다 모든 항목에서 더 낮은 점수를 보였다.
최근 신생아 집중 치료의 발달로 인해 국내 극소 저체중출생아의 생존율은 1988년 33.3%에서 2014년 84.8%로 크게 개선되었으며[16,17], 생존한 극소 저체중출생아의 신경발달 예후에 대한 관심이 증가하고 있다. 이 중 뇌실 주위 백질연화증은 향후 운동 및 인지기능 장애와 같은 신경발달학적 예후와 밀접한 관련성이 있어 이를 예방하기 위한 다양한 연구가 활발히 이루어지고 있다. 국내 문헌에서 Ahn 등[18]이 Korean Neonatal Network (KNN) 데이터를 이용한 연구에서 극소 저체중출생아의 뇌실 주위 백질연화증의 발생률은 8.3%로 출생 주수에 따라서 빈도가 달라지는 상관관계는 보이지 않았다고 보고하였으며, 해외 문헌에서는 6.3%–29% 정도로 조금 더 넓은 범위를 보인다[6]. 본 연구에서 뇌실 주위 백질연화증의 발생률은 10.1%로 나타났고 KNN연구에 비하면 다소 높은 편이나 해외 문헌과 비교하였을 때는 비슷한 발생률을 보였다.
뇌실 주위 백질연화증은 측뇌실의 외각 부위(dorsal and lateral to external angles of lateral ventricle)에 발생한 괴사와 괴사 주변부 백질의 손상으로 발생하는 질환이며[19], 저산소 및 허혈로 인해 유발된 흥분 독성과 자유라디칼에 의한 뇌손상, 최근에는 산전 및 출생 후 감염과 염증으로 유발된 사이토카인으로 인한 전신적인 염증 반응이 주요 원인으로 보고되고 있다[5,20]. 미숙아는 해부학적으로 혈관 발달이 미약하여 뇌혈류 감소에 취약한 경계 지대(border zone, watershed zone)를 형성하고 뇌혈류량이 감소할 경우 이 부분이 허혈성 손상을 받기 쉽고[5], 미숙아는 뇌혈류 자율조절 기능이 약하므로 전신 혈압이 감소할 때 뇌혈류도 감소하며 이로 인해 발생한 뇌허혈로 인해 뇌실 주위 백질연화증이 유발된다[6,9]. 특히 하지로 가는 하행성 신경섬유 주행 부위에 잘 침범하므로 성장 후 하지의 강직성 마비 증상이 잘 나타난다. 뇌실 주위 백질연화증의 발생 기전은 명확하지는 않으나 복합적 요소가 관여하는 것으로 추정된다. 최근의 연구는 자궁 내 감염 및 염증으로 인한 전신적인 염증 반응이 뇌실 주위 백질연화증을 일으키는데 좀 더 중요한 영향을 준다고 보고하고 있다[21].
출생 전 염증 반응은 자궁 내 염증, 융모양막염, 양수감염, 태반감염, 양막내감염 등으로 표현되며 융모양막염의 경우 임상적, 조직학적 융모양막염으로 나누기도 한다[1,22]. 일반적으로 출생 전 염증 반응은 주로 질과 자궁경부를 통한 상행성 세균감염으로 인해 발생하며 조기양막파수가 선행되는 경우가 많다. 태아가 자궁 내에서 감염, 혹은 염증에 의해 선천 면역 체계가 활성화되는 일련의 과정을 태아 염증 반응증후군(fetal inflammatory response syndrome, FIRS)이라고도 하며, FIRS가 있는 태아의 경우 신생아 호흡곤란증후군, 기관지폐형성이상, 뇌실내출혈, 뇌실 주위 백질연화증, 뇌성마비, 괴사성장염, 미숙아 망막증 등의 발생 위험이 높다고 알려져 있다[1].
융모양막염은 태아 사이토카인의 증가와 연관되어 태아 염증반응증후군을 유발하는 것으로 알려져 있으며, 여러 연구에서 사이토카인은 균혈증의 유발 없이도 그 자체로 뇌백질에 손상을 준다고 한다[11]. 경계의 염증 전구물질은 뉴런 전구체 세포의 증식 억제와 핍지교세포(oligodendrocyte)의 세포사멸을 촉진시켜 뇌백질 손상의 위험을 증가시킨다. 즉 활성화된 미세아교세포(microglia)는 다양한 염증 매개체인 interleukin-1 (IL-1), IL-6, tumor necrosis factor-α 등을 활성화시키고 이는 자유라디칼을 생성하여 뇌실 주위 백질연화증을 촉진시킨다는 것이다[23,24]. FIRS를 보이는 미숙아에서 양수와 제대혈 내 사이토카인의 증가와 제대염은 뇌실 주위 백질연화증과 관련이 있으며[2] 뇌성마비 발생을 증가한다고 보고하고 있다[1]. Denzler 등[11]은 융모양막염(56% vs. 1%, P<0.001)과 조기양막파수(56% vs. 11%, P<0.001)가 뇌실 주위 백질연화증의 위험요인이라 보고 하였고, 진단받은 미숙아의 55%에서 조직학적 융모양막염을 보인다고 하였으며, 분만 전까지 48시간 이상 지속된 조기양막파수(오즈비, 9.0; 95% 신뢰구간, 4.1–20.0)는 뇌실 주위 백질연화증의 발생률을 9배 높인다고 하였다. 본 연구에서 뇌실 주위 백질연화증과 대조군 사이에 융모양막염이나 조기양막파수는 통계학적인 차이를 보이지 않았으나, 진단 시기에 따른 뇌실 주위 백질연화증 비교에서는 조기 진단군에서 조기양막파수(87.5% vs. 25%, P =0.041)를 보였던 경우가 더 많았고 양막파수 후 분만까지의 시간(123±120.0시간 vs. 77±54.5시간, P =0.833)은 통계학적 차이는 보이지 않았지만 조기 진단군에서 더 길었다. 조기양막파수로 인한 FIRS 반응이 유발되면 태내에서 저산소 허혈성 손상을 받은 후 백질 손상이 진행되어 조기에 낭종성 변화가 나타남에 따라 빠르게 진단되는 경우가 더 많은 것으로 생각된다.
뇌실 주위 백질연화증의 초기 초음파 소견은 저산소 허혈성 손상을 받은 후 2주 내 뇌실 주위 백질에 고에코 음영이 양측으로 대칭적이거나 또는 비대칭적으로 관찰된다고 하며[25], 손상을 받은 후 2주에서 3주 사이에 뇌실 주위 백질에 낭성 변화를 보인다고 알려져 있다[26]. 본 연구에서 조기에 뇌실 주위 백질연화증이 진단된 환자 중생후 1주 이내 뇌초음파에서 낭종성 변화가 확인된 경우는 8예 중 3예였고, 생후 1–2주 이내 확인된 경우는 2예였다. 뇌초음파에서 생후 2주 이내 낭종성 변화가 확인되는 것은 태내에서부터 뇌백질의 손상이 진행된 것으로 생각된다. Pierra 등[27]은 국소성 뇌실 주위 백질연화증에서는 평균 생후 5주째에, 확장성 뇌실 주위 백질연화증에서는 평균 생후 3주째에 낭성 변화를 확인하였고, 뇌실 주위 백질연화증의 손상 범위가 넓을수록 뇌실 주위 백질연화증의 진단 시기가 짧아진다고 하였다. 본 연구에서는 뇌실 주위 백질연화증의 범위 및 등급에 따른 분류와 그에 대한 신경발달학적 예후를 비교 분석하지 못하였고, 양측 뇌실 주위의 고에코 음영이 나타나는 경우를 반영하여 분석하지 못하였기에 아쉬움이 남는다.
뇌실 주위 백질연화증을 진단받은 환자에서 교정연령 18개월에 시행한 BSID-III 검사 결과는 생후 28일을 기준으로 진단 시기를 나눈 두 군 간에 통계학적으로 유의한 차이는 보이지 않았지만 모든 항목에서 조기 진단군의 점수가 더 낮았으며 69점 이하인 심한 발달지연을 보인 미숙아는 조기 진단군에서 4명으로 후기 진단군보다 더 많았다. 이는 조기 진단군에서 광범위한 백질연화증이 빠른 시기에 낭성 변화를 보이므로 더 나쁜 신경학적 예후를 보이는 것으로 고려된다. 본 연구는 교정연령 18개월까지만 포함한 결과로 추후 학동기까지의 신경발달학적 결과를 연구한다면 통계학적으로 유의한 차이를 보일 가능성도 있을 것으로 예상되며 추후 계속된 연구가 필요할 것으로 보인다. 또한, 교정연령 18개월에 평가한 따라잡기 성장에서 뇌실 주위 백질연화증의 조기 진단군이 실패한 경우가 더 많았다. 이는 조기 진단으로 인한 이른 재활치료의 시작으로 인한 피로도 증가 및 강직성 발달 장애로 인한 음식물 섭취에 어려움이 있어 그런 것으로 생각된다.
신생아 집중 치료의 발달로 고위험 신생아들의 생존율이 높아짐에 따라 발달 장애에 대한 조기 발견 및 예방의 중요성이 증대되고 있으며, 장기적인 신경 발달 예후와 관련이 있는 뇌실주위 백질연화증의 위험인자에 대해 알아보았다. 본 연구에서는 극소 저체중출생아에서의 뇌실주위 백질연화증이 조기 진단되는 환자군에서 조기양막 파수의 빈도가 유의하게 높았고, 교정 18개월에 시행한 BSIDIII 검사에서 더 낮은 점수를 보였다. 이는 조기양막파수와 같은 자궁 내 감염 및 염증 유발 인자가 뇌실주위 백질연화증에 영향을 끼친다는 점을 시사하므로 이를 예방하기 위한 노력이 필요할 것이다. 본 연구에는 몇 가지 한계가 있다. 먼저 단일기관 연구로 대상 환아의 수가 적어 통계적 오류의 가능성이 있고, 후향적 연구로 여러 교란 변수가 존재하는 점, 연구 초기에 병리적 융모양막염의 진단에 어려움이 있어 임상적 융모양막염을 분석한 것이다. 또한, 교정 18개월까지 추적한 결과를 기준으로 하였기 때문에 신경발달학적 장애의 정확한 평가에는 한계가 있으며 향후 학동기까지 추적하여 이들 장애의 정도와 생후 28일 이내 조기 진단된 뇌실 주위 백질연화증의 관계 분석이 더 필요하리라 생각된다.
REFERENCES
1. Sung TJ. Recent advances between prenatal inflammatory response and prematurity associated complications. Korean J Perinatol. 2013; 24:127–32.
2. Andrews WW, Cliver SP, Biasini F, Peralta-Carcelen AM, Rector R, Alriksson-Schmidt AI, et al. Early preterm birth: association between in utero exposure to acute inflammation and severe neurodevelopmental disability at 6 years of age. Am J Obstet Gynecol. 2008; 198:466. e1-11.
3. Kim S, Song IG, Kim KL, Kim YJ, Shin SH, Lee SH, et al. Outpatient follow-up status and neurodevelopmental outcomes of extremely low birth weight infants. J Korean Soc Neonatol. 2012; 19:17–25.
4. Tsimis ME, Johnson CT, Raghunathan RS, Northington FJ, Burd I, Graham EM. Risk factors for periventricular white matter injury in very low birthweight neonates. Am J Obstet Gynecol. 2016; 214:380. e1-6.
5. Wang LY, Wang YL, Wang ST, Huang CC. Using the Alberta Infant Motor Scale to early identify very low-birth-weight infants with cystic periventricular leukomalacia. Brain Dev. 2013; 35:32–7.
6. Al Tawil KI, El Mahdy HS, Al Rifai MT, Tamim HM, Ahmed IA, Al Saif SA. Risk factors for isolated periventricular leukomalacia. Pediatr Neurol. 2012; 46:149–53.
7. Resch B, Neubauer K, Hofer N, Resch E, Maurer U, Haas J, et al. Episodes of hypocarbia and early-onset sepsis are risk factors for cystic periventricular leukomalacia in the preterm infant. Early Hum Dev. 2012; 88:27–31.
8. Resch B, Vollaard E, Maurer U, Haas J, Rosegger H, Muller W. Risk factors and determinants of neurodevelopmental outcome in cystic periventricular leucomalacia. Eur J Pediatr. 2000; 159:663–70.
9. Chey MJ, Shim GH. Risk factors of cystic periventricular leukomalacia in preterm infants with gestational ages of less than 32 weeks according to gestational age group. Korean J Perinatol. 2016; 27:36–44.
10. Oda N, Takeuchi K, Tanaka A, Maruo T. Obstetric risk factors associated with the development of periventricular leukomalacia in preterm infants born to mothers complicated by placenta previa. Fetal Diagn Ther. 2008; 24:345–8.
11. Denzler A, Burkhardt T, Natalucci G, Zimmermann R. Latency after preterm prelabor rupture of the membranes: increased risk for periventricular leukomalacia. J Pregnancy. 2014; 2014:874984.
12. Gibbs RS, Blanco JD, St Clair PJ, Castaneda YS. Quantitative bacteriology of amniotic fluid from women with clinical intraamniotic infection at term. J Infect Dis. 1982; 145:1–8.
13. Lee NY, Cho SJ, Park EA. Influence of antenatal magnesium sulfate exposure on perinatal outcomes in VLBW infants with maternal preeclampsia. Neonatal Med. 2013; 20:28–34.
14. Papile LA, Burstein J, Burstein R, Koffler H. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm. J Pediatr. 1978; 92:529–34.
15. Walsh MC, Kliegman RM, Fanaroff AA. Necrotizing enterocolitis: a practitioner's perspective. Pediatr Rev. 1988; 9:219–26.
16. Shim JW, Jin HS, Bae CW. Changes in survival rate for very-lowbirth-weight infants in Korea: Comparison with other countries. J Korean Med Sci. 2015; 30 Suppl 1:S25–34.
17. Cho JH, Choi SK, Chung SH, Choi YS, Bae CW. Changes in neonatal and perinatal vital statistics during last 5 decades in republic of Korea: compared with OECD nations. Neonatal Med. 2013; 20:402–12.
18. Ahn SY, Shim SY, Sung IK. Intraventricular hemorrhage and post hemorrhagic hydrocephalus among very-low-birth-weight infants in Korea. J Korean Med Sci. 2015; 30 Suppl 1:S52–8.
19. Perlman JM, Risser R, Broyles RS. Bilateral cystic periventricular leukomalacia in the premature infant: associated risk factors. Pediatrics. 1996; 97(6 Pt 1):822–7.
20. Volpe JJ. Neurobiology of periventricular leukomalacia in the premature infant. Pediatr Res. 2001; 50:553–62.
21. O'Shea TM, Allred EN, Dammann O, Hirtz D, Kuban KC, Paneth N, et al. The ELGAN study of the brain and related disorders in extremely low gestational age newborns. Early Hum Dev. 2009; 85:719–25.
22. Thomas W, Speer CP. Chorioamnionitis: important risk factor or innocent bystander for neonatal outcome? Neonatology. 2011; 99:177–87.
23. Deguchi K, Mizuguchi M, Takashima S. Immunohistochemical expression of tumor necrosis factor alpha in neonatal leukomalacia. Pediatr Neurol. 1996; 14:13–6.
24. Choi EK, Park D, Kim TK, Lee SH, Bae DK, Yang G, et al. Animal models of periventricular leukomalacia. Lab Anim Res. 2011; 27:77–84.
25. Lee YS, Yoo DS. Cystic periventricular leukomalacia in the neonate: analysis of sequential sonographic findings and neurologic outcomes. J Korean Radiol Soc. 2003; 49:57–62.
26. de Vries LS, Eken P, Dubowitz LM. The spectrum of leukomalacia using cranial ultrasound. Behav Brain Res. 1992; 49:1–6.
27. Pierrat V, Duquennoy C, van Haastert IC, Ernst M, Guilley N, de Vries LS. Ultrasound diagnosis and neurodevelopmental outcome of localised and extensive cystic periventricular leucomalacia. Arch Dis Child Fetal Neonatal Ed. 2001; 84:F151–6.
Figure 1.
Flowchart showing details of infants included in the study. Abbreviation: PVL, periventricular leukomalacia.
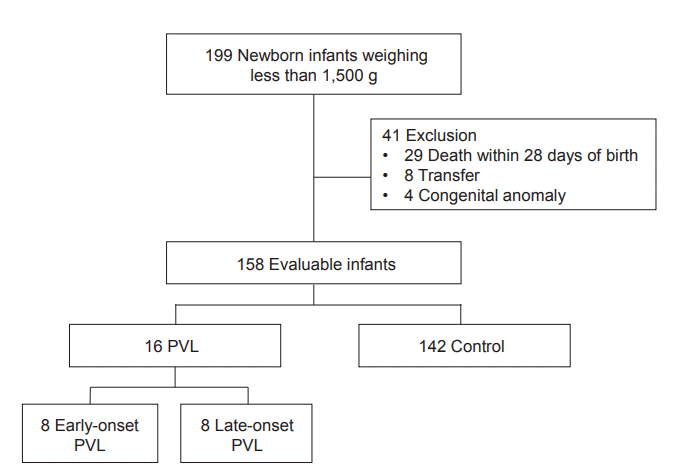
Table 1.
Comparison of Maternal and Perinatal Risk Factors between the PVL and Control Groups
Table 2.
Comparison of Neonatal Risk Factors between the PVL and Control Groups
Table 3.
Comparison of Maternal and Perinatal Factors between the Early- and Late-Onset PVL Groups
Table 4.
Comparison of Neonatal Factors between the Earlyand Late-Onset PVL Groups
| Variable | Early-onset PVL (n=8) | Late-onset PVL (n=8) | P-value |
|---|---|---|---|
| Gestational age (wk) | 28.1 (24.1–30.3) | 28.1 (26–30.2) | 0.878 |
| Birth weight (g) | 1,020 (640–1,390) | 1,090 (930–1,410) | 0.574 |
| Age at PVL diagnosis (d) | 16 (6–27) | 69 (36–84) | 0.001 |
| Cesarean section | 6 (75.0) | 6 (75.0) | 1.000 |
| Apgar score at 1 min | 3 (1–7) | 4 (1–5) | 0.798 |
| Apgar score at 5 min | 6 (3–8) | 6 (4–8) | 1.000 |
| RDS | 8 (100) | 8 (100) | 1.000 |
| BPD | 8 (100) | 8 (100) | 1.000 |
| Hemodynamically significant PDA | 4 (50.0) | 6 (75.0) | 0.608 |
| IVH (≥grade III) | 1 (12.5) | 4 (50.0) | 0.467 |
| Early neonatal hypotension | 1 (12.5) | 4 (50.0) | 0.282 |
| Neonatal early onset sepsis | 1 (12.5) | 1 (12.5) | 1.000 |
| Surgical necrotizing enterocolitis | 0 | 1 (12.5) | 0.200 |
| Hypocarbia* in the first 72 hours of life | 6 (75.0) | 6 (75.0) | 1.000 |
| pH at birth | 7.3 (7.1–7.5) | 7.4 (7.3–7.5) | 0.818 |
| PCO2 at birth (mm Hg) | 31.1 (23.0–43.9) | 24.6 (14.6–40.0) | 0.394 |
| PaO2 at birth (mm Hg) | 85.4 (49.1–112.0) | 117.2 (41.3–222.5) | 0.589 |
| HCO3 at birth (mm Hg) | 18.1 (10.6–22.5) | 16.5 (7.4–23.0) | 0.485 |
| Lowest PaCO2 (mm Hg) | 16.0 (14–29.5) | 19.9 (14.0–32.7) | 0.589 |
Table 5.
Neurodevelopmental Outcomes at the Corrected Age of 18 Months in the Early- and Late-Onset PVL Groups
Table 6.
Comparison of the Bayley Scales of Infant Development-III Scores at the Corrected Age of 18 Months between the Early- and Late-Onset PVL Groups




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download