Abstract
Purpose
17-Hydroxyprogesterone (17-OHP) screening results are difficult to interpret owing to the many influencing factors, and confirming the test results takes time. In this study, we examined the factors that affected the 17-OHP level in premature infants. We also evaluated the correlation between 17-OHP level and the clinical parameters related to adrenal cortical function.
Methods
From January 2012 to April 2017, 358 very-low-birth-weight infants (VLBWI) born with birth weights of <1,500 g were included in the study. Their 17-OHP levels were measured in the neonatal screening test after birth and analyzed by considering various factors that may have influenced the values.
Results
The 17-OHP levels negatively correlated with gestational age and birth weight. The values of the parameters that affected the 17-OHP levels were significantly higher in the infants with respiratory distress syndrome (RDS). In relation to the clinical parameters, blood pressure measured within 24 hours, 72 hours, and 1 week after birth negatively correlated with the 17-OHP level. Serum sodium and 17-OHP levels 24 hours after birth were found to be positively correlated. Urine outputs in 1 and 3 days after birth showed significant positive correlations with the 17-OHP level.
선천부신과다형성(congenital adrenal hyperplasia, CAH)은 콜레스테롤로부터 코티솔의 부신 생합성에 필요한 다섯 가지 효소 중 하나의 결핍으로 인해 발생하는 상염색체 열성 질환이다[1,2]. 전 세계적으로 CAH의 발생률은 다양한 연구에서 약 1만 5천 명 중 1명의 빈도로 알려져 있다[3]. CAH 중 90%–95%를 차지하는 가장 빈번한 형태는 21-수산화효소 결핍증(21-hydroxylase deficiency, 21-OHD)으로 임상적 증상은 효소 결핍의 중증도에 따라 고전적 및 경미한 비고전적 형태로 나눌 수 있다[4,5].
고전적인 CAH의 경우, 효소 활성이 완전히 없어서 코티솔과 알도스테론 결핍이 나타난다. 특히 염분 소실형 선천부신과다형성(salt wasting CAH)에서 알도스테론의 결핍은 저혈당증 및 고칼륨혈증으로 인한 나트륨 소실로 이어진다. 코티솔 결핍은 심장 수축력 저하 및 혈관 색조(vascular tone)를 감소시킨다. 임상 증상은 신생아기에 발생하며 혼수상태, 수유력 저하, 탈수 그리고 생후 첫 주 이후에 나타나는 혈액량 감소 쇼크를 포함한다[6].
따라서 이러한 증상을 줄이기 위해서는 조기 진단이 필수적이며, 혈장 17-알파-히드록시프로게스테론(17-alpha-hydroxyprogesterone, 17-OHP)의 측정은 21-OHD의 진단에 중요하다. 필터 종이에 건조 혈액 반점을 이용한 17-OHP의 분석을 기반으로 한 신생아 스크리닝은 21-OHD에 의한 CAH의 조기 진단을 위한 효과적인 도구이다[3,7,8]. 21-OHD에 대한 신생아 선별검사(neonatal screening test, NST)의 중요한 단점은 CAH가 없는 미숙아에서도 높은 복합 스테로이드 농도와 상대적으로 미성숙한 신장의 배설 지연 때문에 스크리닝 검사 시 17-OHP 결과값이 높아질 수 있다는 것이다[9,10]. 하지만 미숙아들은 부신피질 기능이 재태 연령과 연관되어 실제로 그 기능이 저하되어 있다는 연구[11]도 있어 상승된 17-OHP 값이 위양성인지, 부신 기능부전으로 인한 결과인지 판단하기가 어렵다. 재태 연령[12-14] 또는 출생 체중[15,16]과 관련하여 17-OHP 상한값(cut-off) 수준을 설정하여 잘못된 비율을 줄일 수 있으나, 부신 기능부전으로 인한 결과인지는 단순 결과값 만으로 확인하기는 어렵다. 본 연구는 미숙아들 특히 극소 저체중출생아에서 NST로 확인되는 17-OHP 값에 영향을 줄 수 있는 인자들에 대해서 살펴보고, 상승된 17-OHP 측정값이 실제 부신피질 기능(adrenal cortex function)을 통한 스테로이드 생합성과 상관성이 있을 것이라는 전제하에 혈압, 소변량, 나트륨 수치와 같은 부신 기능과 관련된 인자들을 설정하고 이와 17-OHP값과의 관련성을 살펴보고자 하였다.
2012년 1월부터 2017년 4월까지 수원 아주대병원에서 출생한 358명의 출생 체중 1,500 g 미만 극소 저체중출생아들을 대상으로 후향적 의무기록 조회를 통해 대상 전체에서 17-OHP 값과 출생 체중, 재태 연령 및 병력을 조사하였다. 모든 대상은 17-OHP 검사를 포함한 NST를 생후 3–10일 사이에 실시하였고 그 중 생후 1주일 이내 급성 질환으로 사망한 경우는 대상에서 제외하였다. NST는 한두 방울의 전혈을 적신 건조 여과지를 통해 효소면역측정법을 이용하였고, 본원에서는 11.8 ng/mL 미만을 정상으로 하고 그보다 높은 경우 전혈, 혈장 17-OHP를 통한 재확인을 시행하였으며, 재검의 간격은 1–5주였다. 추적 검사를 시행한 경우 결과의 변화 양상을 확인하고, 정상수치가 확인될 때까지 검사를 시행하였다.
재태 연령과 체중은 출생 당시 측정 후 기록된 의무기록을 참고하였으며 산전 스테로이드 투여는 출생 전 태아 폐 성숙을 위해 덱사메타손 스테로이드를 투여받은 경우를 포함하였다. 조기양막파열(premature rupture of membrane, PROM)은 분만 전 자궁경부로부터 18시간 이상 양수가 흐르는 것을 직접 확인하거나 니트라진(nitrazine) 검사 상 양성이 확인된 경우로 한정하였고[17], 임신고혈압(pregnancy-induced hypertension, PIH)은 임신 기간 중에 수축기 혈압이 140 mm Hg 이상 또는 확장기 혈압이 90 mm Hg 이상인 경우를 기준으로 분만 후 정상으로 회복된 경우, 그렇지 않은 경우 모두를 포함하였다[18].
또한 혈압 측정은 최대한의 정확도를 높이기 위해 적절한 cuff size를 사용하고 최대한 조용하고 안정된 상태에서 3회 측정된 평균 동맥압(mean blood pressure, MBP) 수치를 평균하여 확인하였고 그 중 신생아 저혈압은 혈관수축제(dopamine, dobutamine, epinephrine)가 요구되는, 즉 치료가 필요한 저혈압으로 규정하였으며[19,20] 신생아 호흡곤란증후군(respiratory distress syndrome, RDS)은 최소한 48시간 동안 보충 산소를 사용하여 기계적 환기가 필요하거나, 외인성 계면 활성제를 투여하고 흉부 방사선검사에서 망상형 패턴(reticulogranular pattern)으로 전형적인 양상이 확인된 경우로 하였다[21]. 중증 뇌실내출혈(intraventricular hemorrhage, IVH)은 초음파를 통한 검사 결과 3기 이상으로 한정하였다[19].
수집된 모든 통계치는 정규 분포 여부에 따라 평균±표준편차 또는 중앙값(25백분위수–75백분위수)으로 표시하여 확인하였고, 성별, 산모의 PIH, PROM, 산전 스테로이드 사용, 신생아 RDS와 같은 관련 인자 여부에 따른 17-OHP 선별검사 값의 비교는 Mann-Whitney U test로 분석하였으며 모든 인자를 대상으로 다중선형회귀분석을 시행하였다. 17-OHP 선별검사 값과 재태 연령, 출생 체중 이외 병력 및 신체징후를 포함한 각 인자와의 분석을 위해 Pearson 상관관계 분석을 시행하였으며 P 값이 0.05미만인 경우 통계적 유의성이 있는 것으로 판단하였다. 통계 분석은 R 소프트웨어(R Foundation for Statistical Computing, Vienna, Austria)를 이용하여 시행하였으며[22] 본 연구 진행은 아주대학교병원 기관연구윤리심의위원회의 승인을 받았다(AJIRB-MED-MDB-18-540).
본원에서 출생한 1,500 g 미만 극소 저체중출생아 358명의 평균 재태 연령은 29.2±2.9주, 출생 체중은 1,114±263 g이었다. 성별은 여자 162명(45%), 남자 196명(55%)이고, 자궁 내 스트레스(intrauterine stress)를 평가할 수 있는 PROM이 발생했던 경우가 106명(30%), PIH 병력이 있던 경우는 83명(23%)으로 확인되었다. 산전 스테로이드를 사용한 경우는 270명(75%), 출생 후 신생아 RDS 병력이 있는 경우는 237명(66%), 저혈압의 경우 79명(22%), IVH 3–4단계로 확인된 수는 31명(9%)으로 Table 1과 같다.
출생 후 처음 시행한 NST 17-OHP의 평균값은 9.2±11.8 ng/mL (중앙값, 5.2)이었고, 검사를 처음 시행한 시기는 출생 후 평균 7.3±2.6일, 정상 수치가 확인될 때까지 시행한 검사 횟수는 평균 1.8±0.9회였다. 비정상적인 선별검사 결과로부터 정상 기준에 도달하기까지 걸린 기간은 출생 후 3.6±4.3주였다. 전체 358명의 추적 관찰 중 최종적으로 21-OHD로 CAH가 확진된 경우는 없었다.
전체 358명의 출생 후 3–10일 사이에 처음으로 시행한 NST 항목들 중에서 17-OHP 값을 확인한 결과 재태 연령과는 그 값이 음의 상관관계를 보였으며(Pearson 상관계수 –0.527, P<0.001), 출생 체중과도 동일한 음의 상관관계를 보였다(Pearson 상관계수 –0.483, P<0.001) (Figure 1).
성별 및 PROM은 17-OHP 값과의 상관관계에서는 통계적 유의성은 없었다. 출생 전 덱사메타손 투여 여부 또한 유의성을 확인하지 못하였다. 그러나 출생 전 산모의 PIH 발생은 상관분석에서 17-OHP 선별검사 값이 유의하게 낮았고(P =0.002), 출생 후 발생한 신생아 RDS는(P<0.001) 검사 값이 유의하게 높았다(Table 2). 이후 모든 인자를 대상으로 다중선형회귀분석 결과 신생아 RDS만 통계적으로 유의한 인자로 분석되었다(P<0.001).
출생 후 시기별로 측정한 혈압과 17-OHP 값과의 상관성에서 결과값은 출생 후 24시간(Pearson 상관계수 –0.384, P<0.001), 72시간(Pearson 상관계수 –0.324, P<0.001), 1주(Pearson 상관계수 –0.274, P<0.001) MBP와 모두 음의 상관관계를 보였다(Table 3).
또한 출생 후 측정한 나트륨 수치와 17-OHP 값과의 상관성에서 결과값은 출생 후 24시간 뒤 측정한 혈청 나트륨 수치와 양의 상관관계를(Pearson 상관계수 0.149, P =0.012) 보였으나 그 외 72시간(Pearson 상관계수 0.060, P =0.269), 1주에 측정한 수치(Pearson 상관계수 0.048, P =0.377)와는 유의미한 상관성을 찾지 못하였다(Table 3).
일별 소변량(urine output)을 같은 방법으로 살펴보았을 때 출생 후 1일(Pearson 상관계수 0.127, P =0.019), 출생 3일째(Pearson 상관계수 0.209, P<0.001)의 소변량은 17-OHP 값과 양의 상관관계를 보이며 유의성을 확인하였고, 출생 7일째 소변량과 17-OHP 값과의 상관성은 확인하지 못하였다(Pearson 상관계수 –0.032, P =0.563) (Table 3).
미숙아에서의 17-OHP 선별검사 값은 재태 연령 및 출생 체중이 작을수록 유의하게 높았고, 출생 후 신생아 RDS의 발생은 17-OHP 결과값의 상승에 유의한 관계가 있음을 확인할 수 있었다. 실제적으로 CAH를 확인한 사례는 없으나, 혈압이 낮거나, 일별 소변량이 증가된 경우에서 17-OHP 상승과의 상관성이 있음을 확인하였다.
대부분은 재태 연령, 출생 체중이 적을수록 17-OHP가 상승되는 유의한 결과를 보인 연구 결과들이 많다. 특히 정상 출생아와 미숙아들과의 비교에서 확인된 연구 결과들이 많으며[20,23-26] 그 중 Anandi와 Shaila [27]의 연구에 의하면 출생 주수가 빠르거나, 출생 체중이 적을 경우, 만삭 혹은 정상 체중 출생아에 비해서 17-OHP가 유의하게 높아짐을 확인하였다. 본 연구에서는 1,500 g 미만의 극소 저체중 출생아들로 대상을 제한하여 비교하여도 체중이 적거나, 재태 연령이 낮을수록 17-OHP가 유의하게 높아지는 것을 확인한 것에 의미가 있다.
산전 스테로이드 사용에 대해서는 사용 여부가 17-OHP의 상승과 상관성이 없었고, 이는 이전 연구들에서 스테로이드 노출은 17-OHP 수치를 억제하지 않는다는 결과와 상통하나[27,28], 이와는 반대로 시상하부-뇌하수체-부신축(hypothalamic-pituitary-adrenal axis, HPA axis)에 영향을 줄 수 있으며 특히 1주 이내의 부신 기능에 영향을 주어 위 음성(false negative)을 증가시킬 수 있기 때문에 17-OHP 선별검사의 시점에 주의해야 한다는 연구 결과도 있다[29].
또한 출생 후 발생한 신생아 RDS는 17-OHP 상승과 유의한 상관관계가 나타났고, 이전 연구들과 같은 결과임을 확인하였다[20,25,27]. 신생아 RDS가 대부분 짧은 재태 연령과 관련되어 있어 단순히 짧은 재태 연령으로 인한 17-OHP 상승으로 여겨지는 이전 연구들도 있었으나, Ryckman 등[25]의 연구는 신생아 RDS 자체만으로도 17-OHP의 증가와 상관성이 있다고 하였다. 본 연구에서는 PIH, PROM 등 다른 요인들과의 다변량 분석에서도 신생아 RDS가 17-OHP 값의 증가와 상관관계가 있음을 확인하였다.
17-OHP 값의 상승이 미성숙 HPA axis에 의한 부신 기능부전으로 스테로이드 생합성이 잘 되지 않아 나타난 것이라는 전제를 확인하기 위해 CAH 중 가장 많은 21-OHD 염분 소실형의 임상 증상인 저혈압, 저나트륨혈증, 소변량을 확인하도록 하였다. 혈압은 출생 후 24시간, 72시간, 1주일에서 17-OHP 값과 음의 상관관계가 있었다. 부신 기능은 혈압 변화에 중요한 영향을 주는 여러 원인들 가운데 중요한 인자이며, 이는 17-OHP가 상승된 원인이 부신 기능부전으로 인해 발생한 것임을 생각해 볼 수 있게 한다. 그에 비해 나트륨 수치는 부신 기능부전과의 상관성 측면에서 살펴보았을 때, 생후 24시간 나트륨 수치는 오히려 고나트륨 혈증이 17-OHP 상승과 상관성이 있음을 확인하였다. 미성숙 무기질코르티코이드 경로(premature mineralocorticoid pathway)로 인해서는 알도스테론 분비 저하 결과로 나트륨 수치가 낮아져야 하지만, 출생 24시간은 짧은 시간이고 소변 배출이 원활하지 않은 상태이므로 나트륨 수치를 부신 기능 부전으로 인한 스테로이드 생합성 저하만을 가지고 확인하기는 어려운 것으로 보인다. 이후 나트륨 수치는 17-OHP와 상관성이 없었고, 이는 대부분 미숙아들은 출생 후 총 정맥 영양법(total parenteral nutrition)을 투여하는 경우가 많아 수치 변화를 매일 확인하면서 수액을 통한 전해질 교정을 하기 때문에 외부적 요인으로 인해서 나트륨 수치와 17-OHP와의 상관성을 파악하기 어려웠던 것으로 판단된다. 소변 배출량은 1, 3일째까지 17-OHP 상승과 유의미한 양의 상관관계를 확인하였다. 1주일은 상관관계를 확인하지 못하였는데 이는 정맥을 통한 수액이 유지되어 외부적인 요인에 의한 섭취량과 배출량의 조절 및 전해질 조절이 되었기 때문으로 보인다. 또는 미숙아의 부신의 스테로이드 합성이 출생 3일 이후 호전되어 알도스테론값이 안정되었던 연구[30]와 같이 본 연구에서도 수일 소요 후, 무기질코르티코이드 경로 호전의 영향이 있을 것으로 생각된다.
본 연구에서 소변 배출량 및 저혈압과 17-OHP 값 상승의 상관성을 파악하였다. 본 연구에서 CAH로 진단된 환아는 없었고, 모두 시간이 지남에 따라 정상으로 회복되는 양상을 고려해 볼 때, 저혈압, 소변 배출량의 증가는 미숙아의 부신 기능부전으로 인해 나타나는 일시적 미숙아의 부신 기능부전(transient adrenocortical insufficiency of prematurity, TAP)으로 보이며, 이는 부신이 일시적으로 코티솔 항상성을 유지할 수 없게 되는 것을 말한다. TAP는 미숙아의 HPA axis의 결과로 임상적으로 전신적 저혈압이 발생하고, 11β-수산화효소와 같은 합성 경로에서 필요한 중간 효소의 기능이 감소된다. TAP는 대부분 일시적으로 발생하며, 부신 기능은 2주 내외로 정상화된다[31,32]. 그러나 미숙아는 글루코-코르티코이드의 합성이 저하되어 때때로 정상화가 지연되기도 한다[11].
미숙아에서 출생 후 처음 시행한 17-OHP 값은 대부분 높은 값을 보이지만 임상적 심각한 증상이 없는 경우 추가적인 평가 및 치료 없이 대부분 시간이 지남에 따라 호전됨을 확인하였고[23] 본 연구에서도 추가적인 평가 없이 최대 102일 이후 정상 수치를 확인할 수 있었다. 그렇기 때문에 다른 연구들에서 출생 체중, 재태 연령에 따른 상한치 값을 각각 다르게 기준으로 제시하고 있다. Berry 등[33]은 NST에서 미숙아와 만삭아들의 17-OHP 값을 비교하여 만삭아에서의 정상치를 20 nmol/L, 미숙아에서는 더 높은 200 nmol/L를 생후 첫 주 내의 정상치로 제시하였다. 재태 연령에 따른 연구에 의하면 17-OHP의 정상 상한치를 91.5 ng/mL (31주 미만), 16.2 ng/mL (32–35주), 9.7 ng/mL (36–37주), 8.5 ng/mL (38주 초과)으로 제시하였으며[34], 출생 체중별로 기준을 구분한 다른 연구에서는 1.3 kg 미만은 165 ng/mL, 1.3–1.6 kg는 135 ng/mL, 1.7–2.2 kg 출생아는 90 ng/mL, 그리고 2.2 kg 이상에서는 40 ng/mL로 하였다[15]. 위와 같이 미숙아 및 저체중출생아들의 17-OHP 값은 만삭아들에 비해 상승된 위양성 결과값으로 나타나는 경우가 많다. 출생 후 스트레스로 증가된 부신겉질자극호르몬(adrenocorticotropic hormone, ACTH)에 의해 콜레스테롤부터 프레그네놀론(pregnenolone)으로 전환이 증가되나, 11β-수산화효소의 발현 지연으로 11-디옥시코티졸(11-deoxycortisol)에서 코티솔로 전환이 저하되면서 17-OHP가 축적되고 또한 미성숙함으로 인한 신장에서의 스테로이드 대사산물의 배설 지연으로 결국 혈중 17-OHP가 증가하는 것으로 추정되며[35,36] 17-OHP 이외의 다른 스테로이드 물질과의 교차반응으로 인해서도 17-OHP가 증가할 수 있다고 한다[37,38]. 또한 본 연구를 통해서 출생 후 신생아 RDS로 인해 17-OHP 값이 영향을 받을 수 있음을 확인하였고, 타 논문에서는 출생 전 스테로이드 사용 등으로 인해서도 17-OHP가 변화할 수 있음을 알았다[29]. 미숙아에서 17-OHP가 일시적으로 상승될 수 있는 다양한 원인 중에서 실제 미성숙한 HPA axis의 결과에 의해 발생하는 초기 부신 기능부전을 파악하기 위해서는 본 연구에서 상관성을 확인하였던 혈압 및 소변 배출량을 참고하는 것이 도움이 될 수 있을 것으로 보인다.
단일 연구 기관으로 모집군의 다양성이 확보되지 않은 점과 연구 대상이 극소 저체중출생아들이기 때문에 동반된 다른 여러 가지 문제들로 인해 정확한 간격을 두고 검사를 균일하게 시행하지 못한 점, 17-OHP 이외에 부신피질자극호르몬검사(ACTH stimulation test) 등 추가적 진단평가가 없었다는 점이 연구의 제한점으로 생각된다. 또한 17-OPH 검사 상 전혈을 통한 선별검사를 바탕으로 비교 분석하였으나, 반복적인 확인 과정에서 혈장 검사도 포함되어 분석되었다. 전혈과 혈장 검사의 구분과 결과 보정이 필요하나 이에 대한 평가가 시행되지 못한 점도 제한점이다. 하지만 검사 평균 시행횟수가 1.8회로 초기 2회까지는 모두 전혈 검사를 시행하였기 때문에 검체 대부분이 전혈을 바탕으로 분석되었고, 혈장 검사로 인한 영향은 미미할 것으로 생각된다.
결론적으로, 미숙아에서의 17-OHP 선별검사 값은 편차가 매우 크며, 재태 연령 및 출생 체중이 작을수록 그 값이 유의하게 높아지고, 출생 후 신생아 RDS에 의해서 영향을 받을 수 있다. 또한 출생 초기 혈압, 소변량의 적절한 감시는 일시적 미숙아의 부신 기능부전이 의심되는 극소 저체중출생아를 파악하는 데 도움이 될 것으로 판단된다.
REFERENCES
1. Hughes IA. Congenital adrenal hyperplasia: a continuum of disorders. Lancet. 1998; 352:752–4.
2. Speiser PW, White PC. Congenital adrenal hyperplasia. N Engl J Med. 2003; 349:776–88.
3. Barra CB, Silva IN, Pezzuti IL, Januario JN. Neonatal screening for congenital adrenal hyperplasia. Rev Assoc Med Bras (1992). 2012; 58:459–64.
4. Riepe FG, Sippell WG. Recent advances in diagnosis, treatment, and outcome of congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Rev Endocr Metab Disord. 2007; 8:349–63.
5. White PC, Speiser PW. Congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Endocr Rev. 2000; 21:245–91.
6. Sharma R, Seth A. Congenital adrenal hyperplasia: issues in diagnosis and treatment in children. Indian J Pediatr. 2014; 81:178–85.
7. Pang S, Hotchkiss J, Drash AL, Levine LS, New MI. Microfilter paper method for 17 alpha-hydroxyprogesterone radioimmunoassay: its application for rapid screening for congenital adrenal hyperplasia. J Clin Endocrinol Metab. 1977; 45:1003–8.
8. Gruneiro-Papendieck L, Prieto L, Chiesa A, Bengolea S, Bossi G, Bergada C. Neonatal screening program for congenital adrenal hyperplasia: adjustments to the recall protocol. Horm Res. 2001; 55:271–7.
9. Honour JW, Torresani T. Evaluation of neonatal screening for congenital adrenal hyperplasia. Horm Res. 2001; 55:206–11.
10. Ballerini MG, Chiesa A, Scaglia P, Gruneiro-Papendieck L, Heinrich JJ, Ropelato MG. 17Alpha-hydroxyprogesterone and cortisol serum levels in neonates and young children: influence of age, gestational age, gender and methodological procedures. J Pediatr Endocrinol Metab. 2010; 23:121–32.
11. Masumoto K, Kusuda S, Aoyagi H, Tamura Y, Obonai T, Yamasaki C, et al. Comparison of serum cortisol concentrations in preterm infants with or without late-onset circulatory collapse due to adrenal insufficiency of prematurity. Pediatr Res. 2008; 63:686–90.
12. Steigert M, Schoenle EJ, Biason-Lauber A, Torresani T. High reliability of neonatal screening for congenital adrenal hyperplasia in Switzerland. J Clin Endocrinol Metab. 2002; 87:4106–10.
13. Cavarzere P, Camilot M, Teofoli F, Tato L. Neonatal screening for congenital adrenal hyperplasia in North-Eastern Italy: a report three years into the program. Horm Res. 2005; 63:180–6.
14. van der Kamp HJ, Oudshoorn CG, Elvers BH, van Baarle M, Otten BJ, Wit JM, et al. Cutoff levels of 17-alpha-hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational age rather than on birth weight. J Clin Endocrinol Metab. 2005; 90:3904–7.
15. Allen DB, Hoffman GL, Fitzpatrick P, Laessig R, Maby S, Slyper A. Improved precision of newborn screening for congenital adrenal hyperplasia using weight-adjusted criteria for 17-hydroxyprogesterone levels. J Pediatr. 1997; 130:128–33.
16. Olgemoller B, Roscher AA, Liebl B, Fingerhut R. Screening for congenital adrenal hyperplasia: adjustment of 17-hydroxyprogesterone cut-off values to both age and birth weight markedly improves the predictive value. J Clin Endocrinol Metab. 2003; 88:5790–4.
17. Kunze M, Hart JE, Lynch AM, Gibbs RS. Intrapartum management of premature rupture of membranes: effect on cesarean delivery rate. Obstet Gynecol. 2011; 118:1247–54.
18. Ersch J, Beinder E, Stallmach T, Bucher HU, Torresani T. 17-Hydroxyprogesterone in premature infants as a marker of intrauterine stress. J Perinat Med. 2008; 36:157–60.
19. Paul DA, Leef KH, Stefano JL, Bartoshesky L. Factors influencing levels of 17-hydroxyprogesterone in very low birth weight infants and the relationship to death and IVH. J Perinatol. 2004; 24:252–6.
20. Chung HR, Shin CH, Yang SW, Yun KA, Lee YA, Park SE, et al. Interpretation of screening for congenital adrenal hyperplasia in preterm infants. Korean J Pediatr. 2008; 51:616–21.
21. Sweet D, Bevilacqua G, Carnielli V, Greisen G, Plavka R, Saugstad OD, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome. J Perinat Med. 2007; 35:175–86.
22. R Core Team. R: a language and environment for the statistical computing [Internet]. Vienna: R Foundation for Statistical Computing;2019. [cited 2019 Jan 4]. Available from: https://cran.r-project.org/mirrors.html.
23. Cavarzere P, Samara-Boustani D, Flechtner I, Dechaux M, Elie C, Tardy V, et al. Transient hyper-17-hydroxyprogesteronemia: a clinical subgroup of patients diagnosed at neonatal screening for congenital adrenal hyperplasia. Eur J Endocrinol. 2009; 161:285–92.
24. Choi YS, Lee BS, Kim KS, Kim EA. Study of 17-alpha-hydroxy progesterone in preterm infants. J Korean Soc Neonatol. 2012; 19:77–83.
25. Ryckman KK, Cook DE, Berberich SL, Shchelochkov OA, Berends SK, Busch T, et al. Replication of clinical associations with 17-hydroxyprogesterone in preterm newborns. J Pediatr Endocrinol Metab. 2012; 25:301–5.
26. Chennuri VS, Mithbawkar SM, Mokal RA, Desai MP. Serum 17 alpha hydroxyprogesterone in normal full term and preterm vs sick preterm and full term newborns in a tertiary hospital. Indian J Pediatr. 2013; 80:21–5.
27. Anandi VS, Shaila B. Evaluation of factors associated with elevated newborn 17-hydroxyprogesterone levels. J Pediatr Endocrinol Metab. 2017; 30:677–81.
28. King JL, Naber JM, Hopkin RJ, Repaske DR, Bailey L, Leslie ND. Antenatal corticosteroids and newborn screening for congenital adrenal hyperplasia. Arch Pediatr Adolesc Med. 2001; 155:1038–42.
29. Gatelais F, Berthelot J, Beringue F, Descamps P, Bonneau D, Limal JM, et al. Effect of single and multiple courses of prenatal corticosteroids on 17-hydroxyprogesterone levels: implication for neonatal screening of congenital adrenal hyperplasia. Pediatr Res. 2004; 56:701–5.
30. Travers S, Martinerie L, Boileau P, Lombes M, Pussard E. Alterations of adrenal steroidomic profiles in preterm infants at birth. Arch Dis Child Fetal Neonatal Ed. 2018; 103:F143–51.
31. Ng PC, Lam CW, Fok TF, Lee CH, Ma KC, Chan IH, et al. Refractory hypotension in preterm infants with adrenocortical insufficiency. Arch Dis Child Fetal Neonatal Ed. 2001; 84:F122–4.
32. Ng PC, Lee CH, Lam CW, Ma KC, Fok TF, Chan IH, et al. Transient adrenocortical insufficiency of prematurity and systemic hypotension in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed. 2004; 89:F119–26.
33. Berry J, Betts P, Wood PJ. The interpretation of bloodspot 17 alpha-hydroxyprogesterone levels in term and pre-term neonates. Ann Clin Biochem. 1986; 23(Pt 5):546–51.
34. Ohkubo S, Shimozawa K, Matsumoto M, Kitagawa T. Analysis of blood spot 17 alpha-hydroxyprogesterone concentration in premature infants: proposal for cut-off limits in screening for congenital adrenal hyperplasia. Acta Paediatr Jpn. 1992; 34:126–33.
35. Hingre RV, Gross SJ, Hingre KS, Mayes DM, Richman RA. Adrenal steroidogenesis in very low birth weight preterm infants. J Clin Endocrinol Metab. 1994; 78:266–70.
36. Huysman MW, Hokken-Koelega AC, De Ridder MA, Sauer PJ. Adrenal function in sick very preterm infants. Pediatr Res. 2000; 48:629–33.
37. Riepe FG, Mahler P, Sippell WG, Partsch CJ. Longitudinal study of plasma pregnenolone and 17-hydroxypregnenolone in fullterm and preterm neonates at birth and during the early neonatal period. J Clin Endocrinol Metab. 2002; 87:4301–6.
38. Krasowski MD, Drees D, Morris CS, Maakestad J, Blau JL, Ekins S. Cross-reactivity of steroid hormone immunoassays: clinical significance and two-dimensional molecular similarity prediction. BMC Clin Pathol. 2014; 14:33.
Figure 1.
The correlation between 17-hydroxyprogesterone (17-OHP) level and gestational age, birth weight. (A) The 17-OHP results are negatively correlated with the gestational age in very low birth weight infant (Pearson correlation coefficient –0.527, P<0.001). (B) Birth weight is also negatively correlation with the 17-OHP result values (Pearson correlation coefficient –0.483, P<0.001).
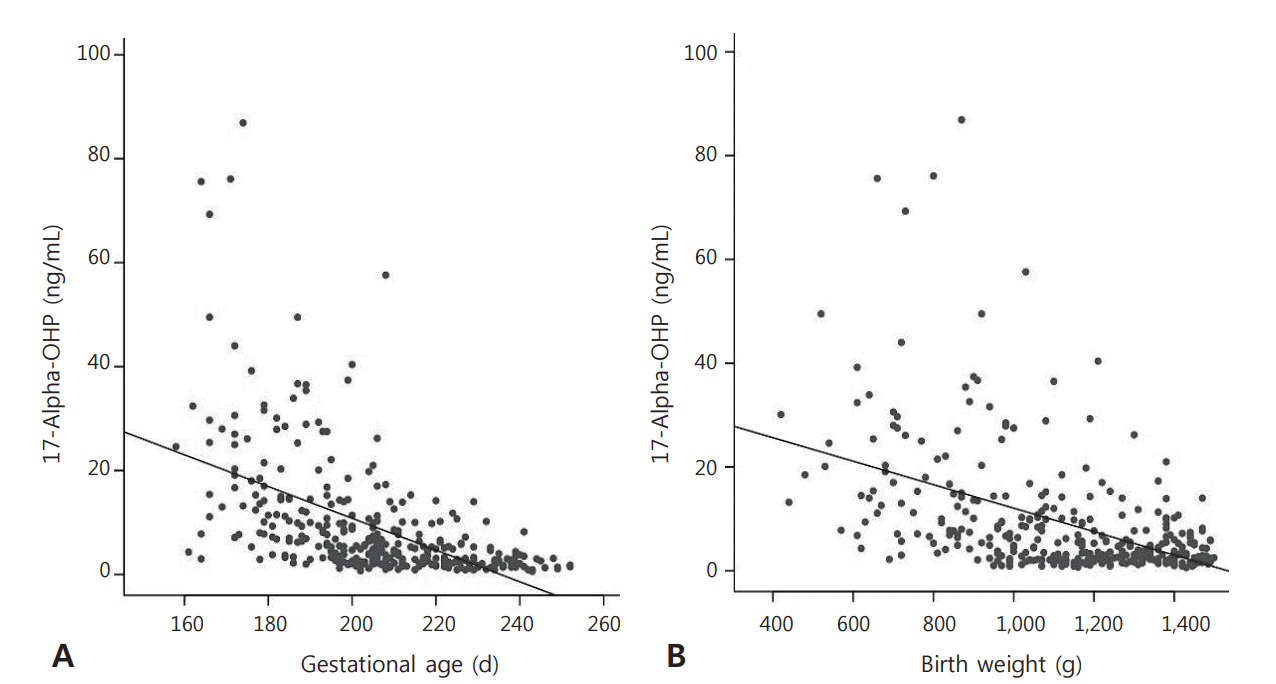
Table 1.
Demographic and Perinatal Characteristics of Enrolled Infants
Table 2.
The Analysis of Pre/Post-Natal Influencing Factor of 17-OHP Value
Table 3.
The Analysis of Correlation between 17-Hydroxyprogesterone Value and Adrenal Insufficiency




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download