INTRODUCTION
Helicobacter pylori (
H. pylori)는 나선형의 그람음성 균으로 사람의 위점막에서만 서식하며 각종 위질환을 유발하는 병원체로서 전세계 인구의 50% 이상이 보균자인 것으로 추정되고 있다
(1,
2). 국내 선행연구에서 보고된 소아기
H. pylori 항체 양성률과
H. pylori 감염 후 대부분 만성 감염으로 이어지는 것을 고려할 때 국내 40대 이상의 연령에서는 90%이상이 보균자로 추정된다
(3,
4,
5,
6). 특히
H. pylori는 세계보건기구(World Health Organization)에 의해 지정된 1급 발암병원체로서 국내의 높은 위암 유병률의 주요 원인으로 알려져 있다
(4).
국제암연구기관(International Agency for Research on Cancer)이 2020년에 발간한 보고서에 의하면
H. pylori는 가장 주요한 발암병원체로서 감염에 의한 전세계 암 발생의 36.3%가
H. pylori에 의한 것으로 조사되었다(https://gco.iarc.fr/causes/infections). 하지만 모든
H. pylori 보균자에서 위암이 발생하지는 않으며 실제 보균자의 10~15%에서만이 위암이 발생하는데
(7,
8) 이는
H. pylori 감염과 더불어
H. pylori의 병원성 인자, 환자와 병원체의 상호작용, 환자의 유전적 요인 등이 위암 발생 기전에 중요한 역할을 하고 있음을 시사한다
(7,
8,
9,
10,
11).
이에 암발생의 위험도를 증가시키는
H. pylori 병원성 인자에 대한 연구가 활발히 진행되어
H. pylori의 다양한 유전형과 함께 다양한 병원성 인자들이 규명되고 있다. 가장 대표적인 병원성 인자는 장상피화생을 유도하여 위암 발생 위험을 증가시키는
cagA와
vacA이다.
cagA와
vacA는 직접 세포독성을 보이고 만성 염증을 유발함으로써 장상피화생을 유발하는 것으로 보고되었다
(1,
12,
13,
14,
15). 그 밖에 위 점막 상피세포에 서식이 가능하도록 운동성을 부여하는 편모(
flaA)
(16,
17), 낮은 수소이온농도지수 환경의 위에서 생존할 수 있도록 해주는 요소분해요소(
ureB)
(18,
19), 상피세포 부착에 관여하는 부착인자(
alpA,
babA,
sabA,
oipA)
(20,
21,
22,
23), 항산화인자(퍼옥시레독신,
ahpC)
(24) 및 최근 상피세포 염증유도 기능이 확인된
groEL (25,
26) 등은
H. pylori 감염에 따른 위암 발생 기전에 중요한 병원성 인자로 밝혀졌다.
위암 발병기전에 관여하는
H. pylori의 병원성 인자들은 서식 환경에 따라 발현의 차이를 보이게 된다
(7,
12,
27,
28). 이는 같은 병원성 인자를 가진 병원체에 감염되더라도 감염된 환경에 따른 병원성 인자의 발현 차이로 인해 위암 발생 위험도가 달라지게 됨을 의미한다. 이에
H. pylori 감염과 위암 발생기전을 규명하기 위해서는
H. pylori의 실제 감염환경에서의 다양한 병원성 인자의 발현 비교 분석이 매우 중요하다. 하지만
in vitro에서 위점막의 환경(낮은 수소이온농도지수, 연동운동 등)을 구현하기는 어려워
H. pylori 감염 및 위암 발병기전 연구가 힘든 실정이다. 그럼에도 불구하고 AGS 세포(human gastric adenocarcinoma cells)는 위상피세포 유래의 세포주이기에
H. pylori 연구에 많이 활용되고 있다
(29,
30,
31,
32,
33). 이에 본 연구에서는 AGS 세포와 공생 배양된
H. pylori의 병원성 인자 발현정도를 일반 배지에서 성장한
H. pylori에서의 병원성 인자 발현과 비교하여
H. pylori의 대표 병원성 인자의 발현 수준이 환경에 따라 어떻게 달라지는 분석함으로써 병원성 인자를 바탕으로 한 위암 발생 위험도 평가에 과학적 근거를 제시하고자 한다.
Go to :

MATERIALS AND METHODS
H. pylori의 배양과 AGS 세포주 배양
H. pylori 26695 균주는 헬리코박터 파이로리 분리균주은행(
Helicobacter pylori Korean Type Culture Collection, Gyeongsang National University, Jinju, Korea)에서 제공받았다. 액체질소에 보관되었던 균주는 10% 소혈청(ThermoFisher, Waltham, MA, USA)이 첨가된 브루셀라 한천배지(Difco, Franklin Lakes, NJ, USA)에 접종하여 10% CO
2, 100% 습도 및 37°C 조건에서 재활성화 하였다. 재활성화된
H. pylori는 10% 우태아혈청(Gibco, Waltham, MA, USA)과 0.4% 효모추출액(Sigma-Aldrich, St. Louis, MO, USA)이 첨가된 RPMI-1640 (Gibco) 배지에 박층액체배양법을 이용하여 균주를 계대배양하여 이후 실험에 이용하였다
(34).
본 연구에서 사용한 세포주는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입한 위암세포주인 AGS (human female adenocarcinoma, KCLB No. 21739)를 사용하였다. 세포주는 10% 우태아혈청, penicillin (100 U/mL, Sigma-Aldrich), streptomycin (100 μg/mL, Sigma-Aldrich)이 첨가된 RPMI-1640 배지를 사용하여 5% CO2, 37°C 조건에서 계대배양 하였다.
H. pylori와 AGS 세포의 공동배양
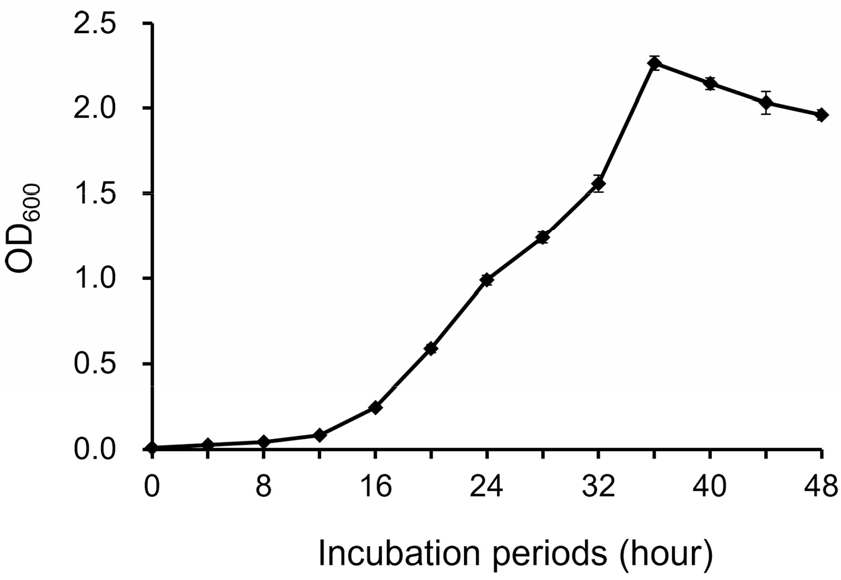
H. pylori를 10% 우태아혈청과 0.4% 효모추출액이 첨가된 RPMI-1640 배지에 배양하면서 4시간 간격으로 OD600에서 흡광도(UVmini-1240, Shimadzu, Kyoto, Japan)를 측정하였다. 흡광도를 통해 분석된 성장곡선의 대수증식기인 24시간 배양된 H. pylori를 AGS 세포와 공동배양에 활용하였다.
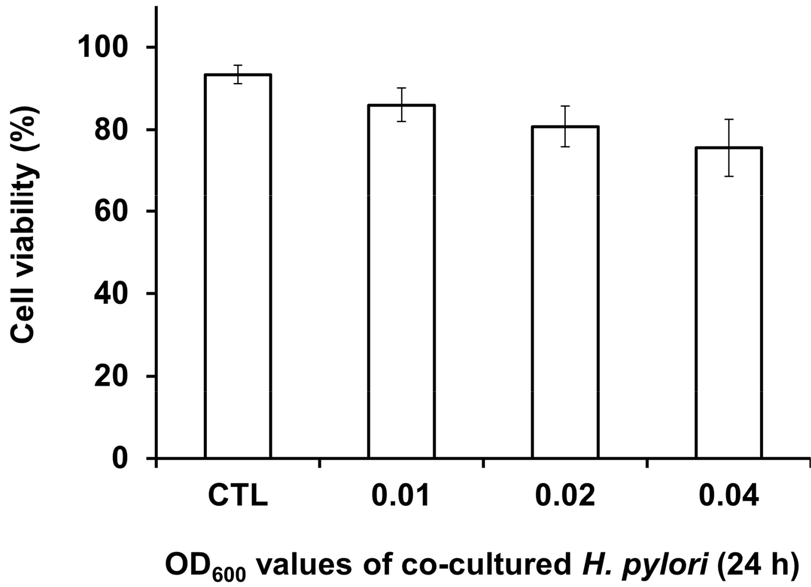
배양된 AGS 세포를 인산완충용액(pH 7.4)으로 3회 세척 후 10% 우태아혈청과 0.1% 효모추출액이 첨가된 RPMI-1640 배지(항생제 미첨가)로 부유하여 2 × 105 cells/mL로 직경 100 mm 세포배양접시(ThermoFisher)에 5% CO2, 37°C 조건에서 24시간 배양하였다. 배양된 세포에 박층액체배양으로 24시간 배양된 대수증식기의 H. pylori를 세포배양액 접종 후 배지의 최종 OD600 흡광도가 0.01, 0.02, 0.04가 되도록 접종하였다. 공동배양된 AGS 세포는 시간대별로 트립신(WelGENE, Gyeongsan, Korea) 처리 후 수거하여 세포수 및 세포 생존율을 MTT assay (ThermoFisher)를 통해 측정하였다. H. pylori 접종 후 세포 생존율의 변화가 매우 미비한 OD600 흡광도 0.01 접종양을 공동배양 최종 조건으로 선정하여 이후 실험을 진행하였다(multiplicity of infection, MOI 50).
H. pylori 공동배양 후 AGS 세포공포 형성 분석
H. pylori에 의한 AGS 세포공포 형성을 분석하기 위해 실시간 세포 영상 촬영을 실시하였다. H. pylori와 공동배양된 AGS 세포를 5% CO2, 37°C 조건에서 Real time cell image system (Carl Zeiss, Oberkochen, Germany)를 이용하여 24시간 동안 1시간 간격으로 촬영하였다. 세포공포 형성정도는 촬영된 세포 사진의 3회 암맹평가를 통해 이루어졌다.
H. pylori 병원성 인자의 발현 분석
단독 배양된
H. pylori와 AGS 세포와 함께 배양된
H. pylori를 수거하여 RNA를 추출하였다(Qiagen, Hilden, Germany). 추출된 RNA는 NanoDrop 1000 Spectrophotometer (ThermoFisher)로 정량 후 reverse transcriptase (Qiagen)을 이용하여 cDNA로 역전사 되었다. 이후
Table 1의 primer와 조건으로 cDNA를 PCR로 증폭(SimpliAmp Thermal Cycler, ThermoFisher)하고 전기 영동 후 밴드의 강도를 ImajeJ software (1.53e version, NIH, Bethesda, MD, USA)로 측정하였다. 측정된 전기 영동 밴드는 housekeeping 유전자인 16S rRNA 유전자의 발현량으로 보정(semi-quantitative digital analysis of PCR)하여 AGS 세포 RNA에 의한 실험 오차를 최소화하였다
(35).
H. pylori와 AGS 세포의 상호작용에 의한
H. pylori 병원성 인자의 발현 변화는 같은 배지에 단독으로 배양된
H. pylori의 병원성 인자 발현과 비교하여 분석하였다.
Table 1.
Nucleotide sequences of primers and PCR condition
|
|
Gene
|
Sequence (5’-3’)
|
Annealing
|
Cycles
|
Size (bp)
|
Pathogenesis
(virulence)
|
cagA
|
5’-GATAACAGGCAAGCTTTTGATC-3’
5’-CTGCAAAAGATTGTTTGGCAGA-3’
|
55
|
30
|
349
|
|
vacA
|
5’-ATGGAAATACAACAAACACAC-3’
5’-GCGTCTAAATAATTCCAAGG-3’
|
52
|
30
|
259/286
|
|
groEL
|
5’-AGCGGCTGTTGAAGAAGGTA-3’
5’-CAAAATGCCCTTCGTGTTTT-3’
|
55
|
30
|
212
|
|
flaA
|
5’-GGCGGTCAGGATTTAACAAA-3’
5’-AAATTCACCGTGGTTTCTGC-3’
|
55
|
30
|
164
|
|
ureB
|
5’-TCTTTGGCGTAAAACCCAAC-3’
5’-CATAAGCCGCTTGAGACACA-3’
|
55
|
30
|
177
|
|
adhesion
|
alpA
|
5’-ACGCTTTCTCCCAATACC-3’
5’-AACACATTCCCCGCATTC-3’
|
55
|
30
|
304
|
|
oipA
|
5’-CAAGCGCTTAACAGATAGGC-3’
5’-AAGGCGTTTTCTGCTGAAGC-3’
|
55
|
30
|
450
|
|
sabA
|
5’-GAGCTATTGACCAGCTCAATG-3’
5’-TAGTTTGGATTCGTTCTCATTA-3’
|
50
|
30
|
447
|
|
babA
|
5’-AATCCAAAAAGGAGAAAAAACATGAAA-3’
5’-GTCCGTGAAAGGGTTGAAAG-3’
|
55
|
30
|
1,098
|
Antioxidant
peroxiredoxin
|
ahpC
|
5’-GAAAAAGGCGGTATTGGTCA-3’
5’-GATCACCGCATGCCTTACTT-3’
|
55
|
30
|
163
|
|
House keeping
|
16S rRNA
|
5’-GGAGGATGAAGGTTTTAGGATTG-3’
5’-TCGTTTAGGGCGTGGACT-3’
|
55
|
30
|
390
|

통계 분석
결과는 평균 ± 표준편차로 표기하였다. SPSS version 27.0 (SPSS Inc., Chicago, IL, USA) 프로그램을 이용하여 Student’s t-test와 repeated measures of ANOVA (Tukey’s HSD test for post-test of multiple comparison) 통계분석을 실시하였다. p <0.05일 경우 유의적인 차이가 있다고 판단하였다.
Go to :

DISCUSSION
H. pylori는 국제보건기구(WHO)에서 지정한 1급 발암 병원체이다
(2). 다양한
H. pylori의 병원성 인자가 위암 발생의 위험도를 높이는 것이는 것으로 보고되었으나
H. pylori 감염과 위암 발생의 명확한 기전은 명확히 규명되지 않았다. 이는
H. pylori가 실험동물 감염모델이 명확히 확립되지 않은 난배양성 병원체이며 병원성 인자가 매우 다양하다는 특징 이외에도 병원성 인자의 발현이 서식 환경에 따라 달라지고, 병원체가 감염·서식하는 위 조직 환경을 실험적으로 구현하기 힘들기 때문이다. 이러한 어려움을 극복하고
H. pylori 감염과 위암 발생의 기전을 규명하고자 많은 연구에서 위암세포주인 AGS (human female gastric adenocarcinoma)를 활용하고 있다
(29,
30,
31,
32,
33). AGS는 위상피세포 유래로서
H. pylori가 부착하여 증식하는
in vivo의 위상피세포의 특징을 가지고 있어 실제 감염에서의 세포와 병원체간 부착에 의한 상호작용 연구에 활용되고 있다.
다양한 선행연구에서 AGS 세포를 활용한
H. pylori 감염과 병인기전 연구가 수행되고 있지만 대부분의 연구가 AGS 세포반응 분석에 집중되어져 있고
H. pylori-AGS 세포 상호작용이
H. pylori 병원체에 미치는 영향 연구는 매우 미비하다
(30,
31,
32,
36,
37). 일부 선행연구에서
H. pylori-AGS 세포 상호작용에 의한
H. pylori 유전자 발현 변화를 분석하였으나 난배양성의
H. pylori 특징으로 인해 장기간 공생배양을 할 수 없어 짧은 공생배양시간(3~6시간 내외) 조건을 활용하고 있다
(30,
32,
33,
37). 하지만 이는
H. pylori가 숙주 세포에 부착하기는 충분하나 상호작용에 의한
H. pylori의 유전자 등의 변화를 분석하기에는 매우 짧은 시간이다.
이에 본 연구에서는 장시간 공생 배양할 수 있는 조건을 확립하여
H. pylori-AGS 세포 상호작용이
H. pylori의 대표적인 위암 발생 병원성 인자의 발현에 미치는 영향을 분석하였다. 난배양성인
H. pylori의 공생 배양 시 생존율을 높이고 AGS 세포 자체 성장에 미치는 영향을 최소화하기 위하여 0.1% 효모추출액을 활용하였다. 0.4% 효모추출액에 첨가된 배지에서 성장한
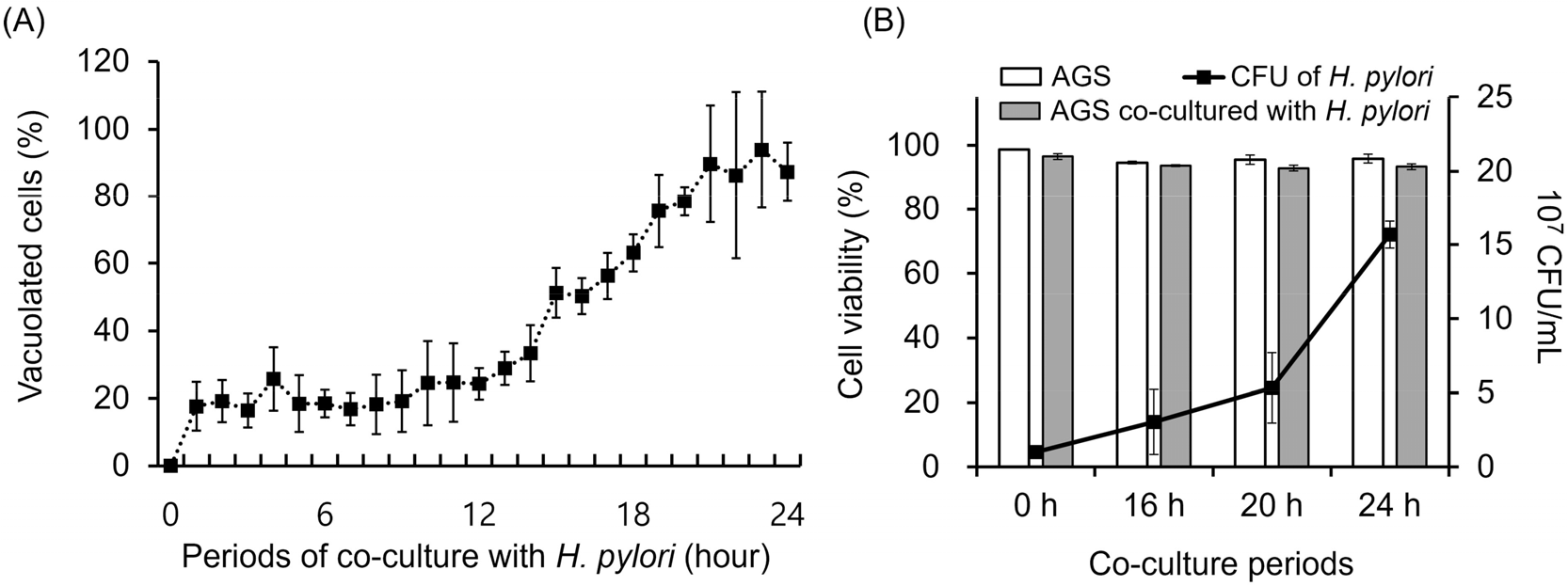
H. pylori는 0.1% 효모추출액이 첨가된 공생 배양 조건에서도 집락형성능(CFU)을 유지하였으며 AGS 세포 성장 역시 확인할 수 있었다 (
Fig. 3B). 또한
H. pylori에 의한 AGS 세포 공포형성 정도를 분석하여 접종 후 16~24시간 사이에
H. pylori-AGS 세포 상호작용이
H. pylori에 미치는 영향이 제일 큰 것으로 판단하였고 이 시간대를 바탕으로
H. pylori 병원성 인자 발현 변화를 분석하였다 (
Fig. 3A).
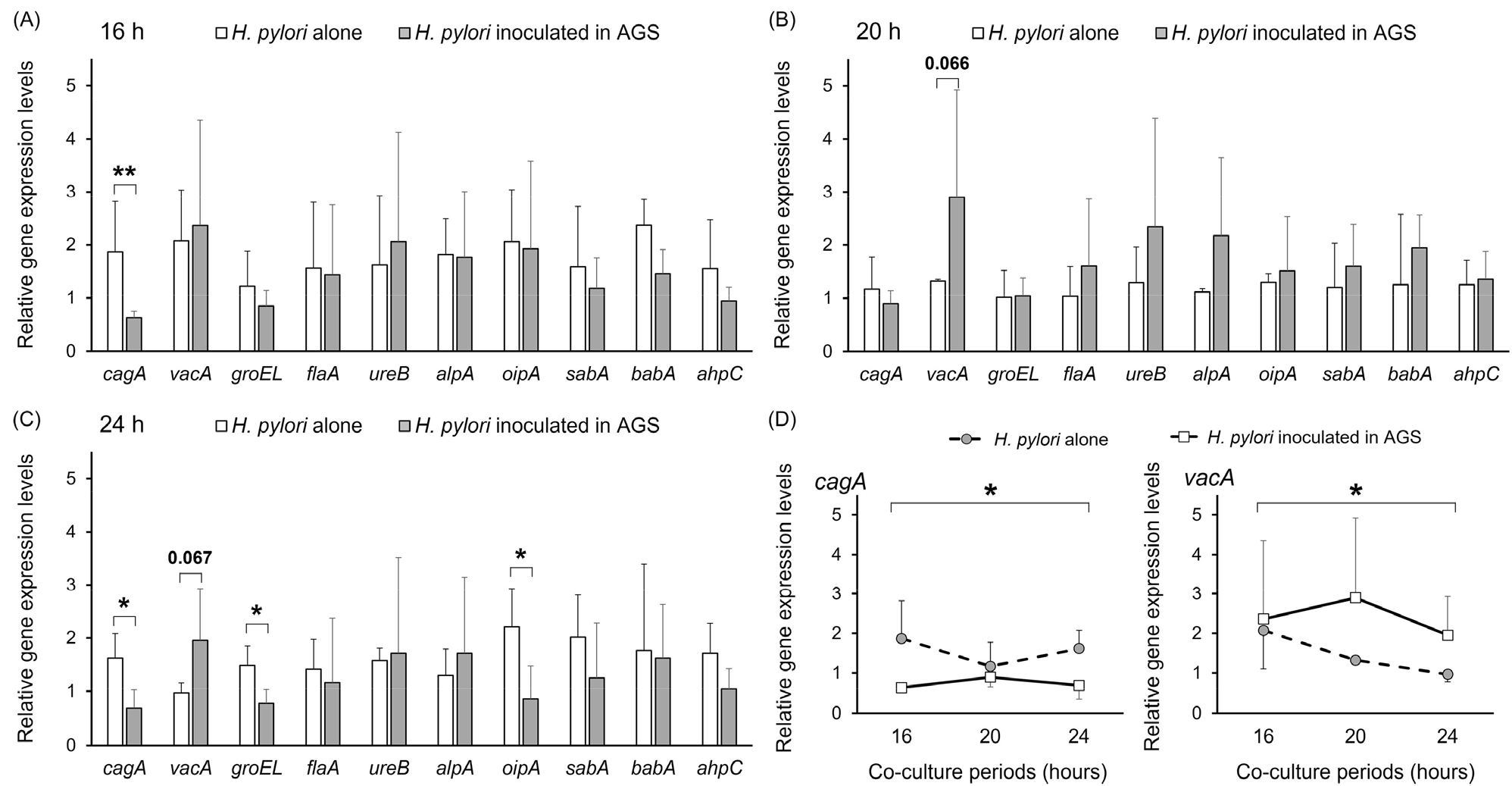
cagA는
H. pylori 위암 발생 기전에서 가장 많은 연구가 수행된 병원성 인자로 CagA 단백질이 세포내로 유입되어 세포독성을 나타냄으로써 위암을 유발하는 것으로 알려져 있다
(11,
38). 이 병원성 인자는
H. pylori의 철 이온의 농도, NaCl 농도, 수소이온농도지수의 변화 등과 같은 서식환경에 따라 발현이 달라지는 것이 선행연구에서 보고되었으며 본 연구에서도
H. pylori-AGS 세포 간의 상호작용이
cagA의 발현 차이를 유발하는 것이 확인되었다
(37,
39,
40,
41).
cagA 인자의 발현이 달라지는 명확한 기전은 규명되지 않았지만 선행연구에서 낮은 수소이온농도지수 환경에서 발현이 감소하고 수소이온농도지수, 적절한 철 이온 농도, 높은 NaCl의 농도에서 발현이 증가하는 것을 고려할 때
cagA는
H. pylori가 성장이 용이한 환경에서 발현이 증가하는 것으로 보인다. 하지만 AGS 세포에 부착한
H. pylori의
cagA 발현이 부유 된
H. pylori 보다 발현이 증가함을 보고한 선행연구
(29)와는 달리 본 연구에서는 단독으로 배양한
H. pylori에서 증가된
cagA의 발현이 관찰되었다(
p <0.05). 이는 본 연구가
H. pylori-AGS 세포의 상호작용에 의한
H. pylori 병원성 인자 발현 차이에 초점을 맞추어 공생배양 된
H. pylori를 모두 수거하여 RNA 샘플링을 실시하였고, 부착 병원체와 접종 후 일부 부유 병원체를 분리하지 않은 점에서 유발된 차이로 보인다.
cagA가 위암 발생의 위험도를 증가시키는 병원성 인자임을 고려할 때, 이러한 다양한 연구결과를 바탕으로
cagA의 발현을 증가시키는 요인과 기전이 추후에 명확히 규명될 필요가 있을 것을 것으로 생각된다.
vacA는 세포 공포형성을 유도하는 병원성 인자로 대부분의
H. pylori가 보유하고 있다.
vacA는 세포표면 투과성을 변화시키고 신호전달체계 이상을 유발하여 세포자멸사를 유발함으로써 위암 발생 위험도를 증가시키는 것을 알려져 있다
(11,
38,
42). 본 연구에서는
H. pylori-AGS 세포의 상호작용에 의해서
H. pylori의
vacA 발현이 16-24시간 동안 높은 수준으로 유도되는 양상을 확인할 수 있었다 (
Fig. 4,
p <0.05). 세포공포형성 비율이 급격히 증가했던 24시간 째에
vacA의 발현차이가 가장 큼을 확인할 수 있었다. 단독 배양과 비교 시 AGS 세포와의 공생배양에 의한 상호작용으로 인해
vacA의 발현이 증가됨을 확인할 수 있는 결과로 선행연구 결과와 일치하였다
(29).
GroEL은
H. pylori에서 분비되어 철성분과 결합하는 특징을 가지는 단백질로 알려져 있다
(43). 또한 heat shock proteins으로서 대식세포 등을 자극하여 만성 염증을 유발하는 항원으로
H. pylori에 다량 존재하는 항원이다
(25). 그럼에도 불구하고
groEL의 위암 발병기전 역시 거의 알려진 바 없으며, 최근에 들어서야
groEL 항원에 대한 양성 혈청 환자에서 위암의 위험도가 유의적으로 높은 것이 확인되었다
(44,
45,
46). 본 연구에서는
groEL의 발현이 16 및 20시간에는 없었으나 24시간 때에 유의적으로
H. pylori-AGS 공생배양 조건에서 발현이 감소한 것이 확인되었다. 본 연구에서 24시간때에
H. pylori-AGS 세포 공생배양에서
H. pylori의 병원성 부착인자(adhesin)인
oipA (
p <0.05),
subA,
babA의 발현이 감소하였는데 이는
groEL의 발현과 부착인자 발현의 밀접한 상관관계를 보고한 선행연구와 일치하는 결과이다
(47). 하지만 위암과의 높은 상관관계가 새롭게 보고된
groEL의 발현변화와 병인기전은 후속연구에서 좀더 자세히 다루어져야 할 필요성이 있다.
H. pylori의 초기 위 조직 정착 및 병인기전에서 편모(
flaA), 요소분해요소(
ureB), 각종 부착인자(
alpA, oipA, sabA, babA), 및 항산화인자(
ahpC)는 매우 중요한 역할을 한다. 위에 침투한
H. pylori는 강산의 위 환경에서
ureB를 통해 위산과 병원체의 접촉부위를 중화하고 편모를 통해 수소이온농도지수가 중성인 위점막으로 이동한 후 부착인자를 활용해 상피세포와 위점막 사이에 정착하게 된다. 또한 항산화인자를 이용하여 숙주 활성산소 등을 중화하여 면역반응으로부터 스스로를 보호한다
(7,
38,
48,
49). 이중
flaA는 구조단백질로 서식환경에 따라 발현이 크게 달라지지 않는 것으로 보고된 병원성 인자이다
(50).
ureB와
ahpC는 수소이온농도지수와 활성산소와 같은 서식환경변화에 따라 발현이 달라지는 인자이나 본 연구에서는 수소이온농도지수의 환경과 활성산소 등의 환경이 동일하여 발현차이를 보이지 않은 것으로 생각된다
(24,
51). 부착인자(
alpA, oipA, sabA, babA) 역시 환경에 따라 발현이 달라지는 것으로 알려진 병원성 인자이다. 본 연구에서는
oipA는 24시간째 유의적으로
H. pylori-AGS cells의 상호작용에 의해 발현이 감소한 것이 확인되었다.
oipA의 발현은
cagA의 발현과 상관관계가 있는 것으로 보고되었는데
(21,
52) 본 연구의 24시간째
H. pylori-AGS 세포에서의 유의적인 발현 감소는 같은 시간대의
cagA 발현 감소와 관련이 있는 것으로 생각된다.
alpA,
sabA와
babA 역시 병원체의 외막에 발현되는 병원성 부착인자로 서식 환경에 따라 발현이 크게 변화는 것으로 알려져 있다. 그 중
alpA (20,
23,
53)와
sabA (21)는 주로 수소이온농도지수의 변화에 의해서 발현이 달라지는 것이 보고되었는데 본 연구의 배양 환경에서는 두 병원성 인자의 발현을 다르게 유도할 만큼의 수소이온농도지수 변화가 없었을 것으로 판단된다.
babA는 서식 환경에 따라 발현이 매우 크게 달라지는 병원성 인자이다
(22).
babA는 공생배양에 의한 세포 상호작용 보다는 Le
b 항원 발현 여부, 염증의 상태 등의 환경에 의해서 주로 발현이 달라지는 인자로 생각되어진다
(54,
55). 선행연구에서 제시한 것과 같이 본 연구에서도
babA의 발현차이는 관찰되지 않았다. 이는 세포와의 부착 및 상호작용의 서식 환경이
babA의 발현 차이를 유도할 수 있는 요인이 되지 못함을 시사한다. 추가로,
babA의 발현은 위암 발생 위험도를 21.7배 증가시키는 것으로 보고된 주요 병원성 인자이다
(56). 그럼에도 불구하고 병원체의 서식 환경에 의해 발현이 on/off 방식으로 조절되는 특징을 보이고 있어
(22) babA 발현의 차이를 유발하는 요인 분석이 추후 연구에서 반드시 수행되어야 할 것으로 보인다.
본 연구를 통해 H. pylori 감염에서 위암 발생 위험도를 높이는 것으로 알려진 대표적인 병원성 인자 10개의 발현 수준이 H. pylori 서식 환경에 따라, 특히 AGS 세포와의 공생 환경에서 어떻게 달라지는지 확인할 수 있었다. AGS 세포와 공생 배양된 H. pylori는 단독 배양된 H. pylori에 비해 높은 vacA 발현 수준과 낮은 cagA 수준으로 보여주었다. oipA를 제외한 부착인자와 대표적인 병원성 인자인 flaA와 ureB에서는 발현의 차이를 보이지 않았다. 이를 통해 cagA와 vacA를 제외한 다른 병원성 인자와 부착 인자들은 H. pylori가 서식 세포와 접촉을 하더라도 발현에 크게 영향을 받지 않음을 확인할 수 있었다. 이러한 유전자들은 세포 접촉 자체만의 환경 변화보다는 수소이온농도지수 변화, 염증 면역의 발현 여부, 서식 세포의 특이 항원 발현 여부 등에 더 큰 영향을 받는 것으로 판단된다.
상기의 결과들은 병원성 인자를 활용한 H. pylori 감염 후 위암 발생 위험도를 평가할 때 병원성 인자 유전자의 유무와 함께 유전자 발현 차이를 고려해야 함을 시사한다. 또한 위암 발생 요인의 유전자를 지닌 H. pylori에 감염되었음에도 불구하고 위암이 발생하지 않는 사례에 과학적 근거로 활용될 수 있을 것이다. 이는 향후 효과적이고 정확한 위암 위험도 및 예후 판단에 활용되어 세계 1위의 위암 발생국이라는 오명을 씻는데 일조할 수 있으리라 생각된다.
Go to :





 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download