Abstract
REFERENCES
Fig. 1
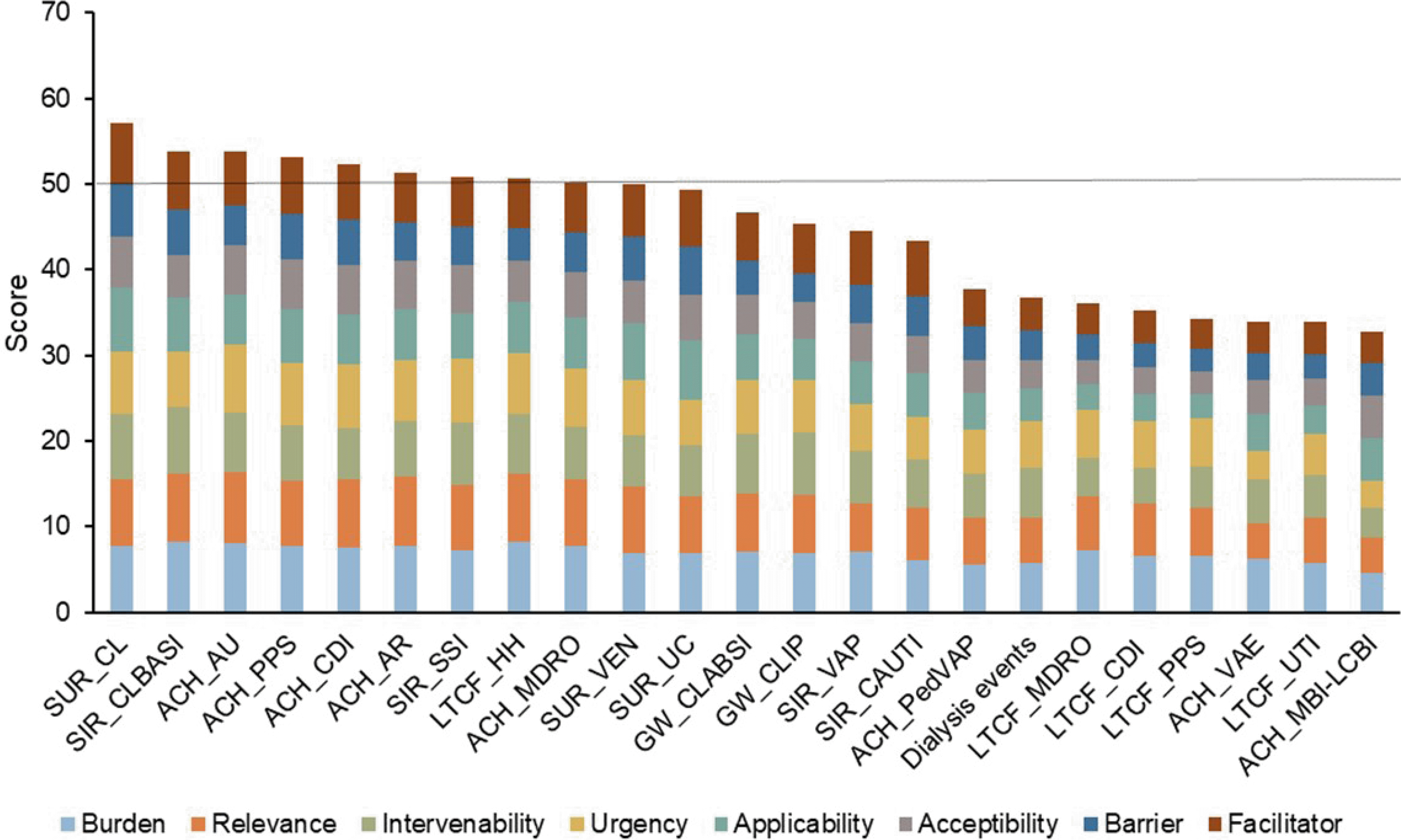
Table 1
Abbreviations: ICU, intensive care unit; BSI, bloodstream infection; UTI, urinary tract infection; CLABSI, central line-associated bloodstream infection; CAUTI, catheter-associated urinary tract infection; VAP, ventilator-associated pneumonia; DUR, device utilization ratio; SSI, surgical site infection; NICU, neonatal intensive care unit; HH, hand hygiene; ABH, alcohol-based handrub; CL, central line; SAB, Staphylococcus aureus bacteremia; MRSA, methicillin-resistant Staphylococcus aureus; MSSA, methicillin-susceptible S. aureus; UC, urinary catheter.
Table 2
| Continent | Country | Healthcare-associated infection surveillances program | Acronym | Start year |
|---|---|---|---|---|
| ASIA | Japan | Japanese Nosocomial Infection Surveillance System | JANIS | 2000 |
| Taiwan | Taiwan Nosocomial Infections Surveillance System | TNIS | 2007 | |
| North America | The US | National Healthcare Safety Network | NHSN | 2005* |
| Canada | Canadian Nosocomial Infection Surveillance Program | CNISP | 1994 | |
| Oceania | Australia |
Victoria Nosocomial Infection Surveillance System Healthcare Infection Surveillance Western Australia Tasmanian Infection Prevention and Control Unit |
VICNISS HISWA TIPCU |
2002 2005 2008 |
| Europe | The EU | ECDC healthcare-associated infections surveillance network | HAI-Net | 2010† |
| Central | Germany | Krankenhaus Infektions Surveillance System | KISS | 1997 |
| Western | The UK |
UK Health Security Agency (former the Health Protection Agency, Public Health England), Scottish Surveillance of Healthcare-Associated Infection Programme Welsh Healthcare Association Infection Programme |
UKHSA SSHAIP WHAIP |
2001‡, 2004§ |
| France | Réseau de Prévention des Infections Associées aux Soins | RePias | 2017∥ | |
| The Netherlands | PREventie van ZIEkenhuisinfecties door Surveillance | PREZIES | 1996 | |
| Belgium | National Surveillance of Healthcare associated infections and antimicrobial resistance | NSIH | 2003 | |
| Northern | Norway | Norsk overvåkingssystem for antibiotikabruk og helsetjenesteassosierte infeksjoner | NOIS | 2005 |
*National Nosocomial Infections Surveillance System (NNIS) started in 1970 and changed into the NHSN in 2005.
†Hospitals in Europe Link for Infection Control through surveillance (HELICS) started in 2000, and the coordination of the European surveillance of HAIs was transferred to the ECDC in 2008. The HAI-Net started in 2010.
‡,§In England, Nosocomial Infection Surveillance Scheme (NINSS) started in 1996, and mandatory healthcare associated infection surveillance started in 2001 with mandatory report of S. aureus bacteremia. Surgical Site Infection Surveillance (SSISS) was established in 1997 and became mandatory in 2004. These former surveillance systems have been coordinated by UKHSA since 2021.
Table 3
| Method | Measure | Type | KONIS | JANIS | TNIS | NHSN | CNISP | VICNISS | KISS | UKHSA | RePias | PREZIES | NSIH | NOIS | ECDC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ongoing, prospective | Outcome | BSI | V,I | V,I | V,A | V,A | V,A | M,A | V,I | ||||||
| CLABSI | V,I | V,I | V,I | V,A | V,I | M,I | V,A | V,I | V,A | V,I | V,I | ||||
| UTI | V,I | V,I | V,I | V,A | V,A | V,I | V,I | V,I | |||||||
| CAUTI | V,I | V,I | V,A | V,A | V,I | V,I | V,I | ||||||||
| PNEU | V,I | V,I | V,A | V,I | V,I | V,I | |||||||||
| VAP | V,I | V,I | V,I | V,A | V,I | V,I | V,I | ||||||||
| VAE | V,A | V,I | |||||||||||||
| SSI | V,A | V,A | V,A | V,A | V,A | M,A | V,A | M,A | V,A | V,A | V,A | M,A | V,A | ||
| SAB | V,A | V,A | V,A* | V,A | M,A | V,A | M,A | V,A | |||||||
| GNB | M,A | ||||||||||||||
| MDRO | V,A | V,A | V,A† | M,A† | V,A | V,A | M,A | ||||||||
| CDI | V,A | V,A | M,A | V,A | M,A | V,A | V,A | V,A | |||||||
| AR (%) | V,A | V,A | V,A | V,A | |||||||||||
| AU | V,A | V,A | V,A | V,A | |||||||||||
| Other HAIs | V,A‡ | ||||||||||||||
| Dialysis events | V,A | V,A | V,A | ||||||||||||
| Process | CLIP | V,A | V,A | V,A | |||||||||||
| Hand hygiene | V,A | V,A | V,A | ||||||||||||
| Adherence to CP | V,A | ||||||||||||||
| PPM during dialysis | V,A | ||||||||||||||
| HCP & patient safety | Patient vaccination§ | V,A | |||||||||||||
| HCP vaccination | V,A | M,A | |||||||||||||
| HCP exposure | V,A | V,A | V,A | V,A | |||||||||||
| Point estimate | Outcome | ACH | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A | |||
| LTCF | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A | V,A |
Abbreviations: KONIS, Korean National Healthcare-associated Infections Surveillance System; JANIS, Japanese Nosocomial Infection Surveillance System; TNIS, Taiwan Nosocomial Infections Surveillance System; NHSN, National Healthcare Safety Network; CNISP, Canadian Nosocomial Infection Surveillance Program; VICNISS, Victoria Nosocomial Infection Surveillance System; KISS, Krankenhaus Infektions Surveillance System; RePia, Réseau de Prévention des Infections Associées aux Soins; UKHSA, UK Health Security Agency (former the Health Protection Agency, Public Health England); PREZIES, PREventie van ZIEkenhuisinfecties door Surveillance; NSIH, National Surveillance of Healthcare associated infections and antimicrobial resistance; NOIS, Norsk overvåkingssystem for antibiotikabruk og helsetjenesteassosierte infeksjoner; ECDC, European Centre for Disease Control and Prevention; V, voluntary; M, mandatory; I, ICUs; A, all areas; BSI, bloodstream infection; CLABSI, central-line associated bloodstream infection; UTI, urinary tract infection; CAUTI, catheter-associated urinary tract infection; PNEU, pneumonia; VAP, ventilator-associated pneumonia; VAE, ventilator-associated event; SSI, surgical site infection; SAB, Staphylococcus aureus bacteremia; GNB, Gram-negative bacteremia; MDRO, multidrug-resistant organisms; CDI, Clostridioides difficile infection; AR, antimicrobial resistance; AU, antimicrobial use; HAI, healthcare-associated infection; CLIP, central line insertion practice; CP, contact precaution; PPM, prevention practice measures; HCP, healthcare personnel; ACH, acute care hospitals; LTCH, long-term care facilities.
*NHSN includes surveillance of MRSA bacteremia only. †CNISP includes voluntary surveillance of carbapenemase-producing Enterobacteriaceae (CPE) among MDROs whereas in VICNISS, it is mandatory to report CPE among MDROs. ‡Other HAIs include Candida auris infection/colonization and cerebrospinal fluid shunt associated surgical site infections. § Patient vaccination refers to influenza vaccination coverage among dialysis patients.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download