This article has been
cited by other articles in ScienceCentral.
초록
원발성면역결핍증은 면역계의 유전적 결함으로 발생하는 이질적인 여러 질환들의 집합으로, 주된 특징인 재발되는 감염을 포함하여 다양한 임상증상을 보인다. 적절한 치료적 개입을 위해서는 빠른 진단이 필요하므로 면역표현형으로 림프구를 신속하게 구분할 수 있는 전통적인 림프구 아형검사가 중요한 역할을 하였다. 그러나 분화 및 성숙단계에 따른 보다 세분화된 림프구 하위집단의 분류를 제공하여, 원발성면역결핍증이 의심될 때 질환의 유무를 선별하고 추가 검사의 방향성과 우선순위에 대한 안내를 하기 위해 표준화된 Primary Immunodeficiency Orientation Tube (PIDOT) 패널이 제안되었다. 저자들은 PIDOT 패널을 이용해 분화 및 성숙단계에 따라 림프구 아형을 분석하여 원발성면역결핍증을 진단할 때 도움이 된 2명의 환아 증례를 통해 임상검사실에서 PIDOT 패널의 유용성을 보고하는 바이다.
Go to :

Abstract
Primary immunodeficiency diseases (PIDs) are a heterogeneous group of disorders caused by genetic defects in the immune system and exhibit a variety of clinical manifestations, including recurrent infections. Rapid and proper diagnosis is vital for proper therapeutic intervention. Compared to the conventional lymphocyte subset analysis, the standardized Primary Immunodeficiency Orientation Tube (PIDOT) panel has been proposed to provide a more detailed dissection of lymphocyte subsets according to their differentiation and maturation stages. This helps in screening of a suspected PID sample, and to provide quick guidance regarding further course of testing. Here, we report two cases of PID diagnosed by lymphocyte subset analysis using PIDOT panel to establish its usefulness in a clinical laboratory.
Go to :

Keywords: Primary immunodeficiency disease, Severe combined immunodeficiency, Common variable immunodeficiency, Flow cytometry, Primary Immunodeficiency Orientation Tube
서 론
원발성면역결핍증은 인체 면역계를 구성하는 다양한 요소들의 유전적 결함에 의해 발생하는 이질적인 질환군으로, International Union of Immunological Societies (IUIS)에서는 404개 질환을 10개의 표현형 카테고리로 분류하였다[
1]. 주요한 표현형을 기준으로 분류된 각각의 카테고리에는 질환과의 연관성이 밝혀진 총 430종의 유전자 결함이 포함되어 있다. 여러 국가의 원발성면역결핍증 등록에 따르면 십만 명당 1-11.8명의 유병률을 보이며[
2] 국내에서는 어린이 십만 명당 1.125명에 발생하는 희귀질환이다[
3]. 유전자 결함으로 인한 면역계 세포들의 수적 또는 기능적 이상으로 감염에 대한 감수성이 증가하여 발생하는 빈번한 감염이 주요한 임상적 특징이고, 결핍된 면역계의 구성에 따라 여러 감염 양상이 함께 나타날 수 있다. 그러나 동일한 유전자 결함에 의해서도 개인에 따라 다양한 임상증상과 중증도를 나타낼 수 있기 때문에 원발성면역결핍증이라는 질환군으로 크게 묶게 된다. 원발성면역결핍증 환자에게 적절한 예방적 항생제 치료와 정맥 면역글로불린 대체 요법을 시행하여 감염에 대한 이환율과 사망률을 낮출 수 있으며, 단클론항체 등의 표적치료제와 조혈모세포이식이 도입되어 환자들의 장기 생존 또한 가능해졌다[
4]. 그리고 이러한 빠른 치료를 통해 이차적인 발육 장애나 성장 및 발달 지연을 포함한 다양한 합병증을 예방할 수 있는 기회가 생기기 때문에[
5], 신속한 치료 개입을 위해 원발성면역결핍증을 의심하고 적절한 검사를 시행하여 빠르게 진단하는 것이 중요하다.
원발성면역결핍증은 기능 장애가 발생한 면역체계에 따라 임상 증상의 차이를 보이는 다양한 질환들로 세분화할 수 있고 진단을 위해서는 의심되는 면역계 구성 세포에 맞춰 여러 선별검사 방법들을 단계적으로 시행할 수 있다[
1,
6]. 그러나 이러한 선별검사들의 결과와 임상증상을 종합하여 원발성면역결핍증을 감별 진단하는 과정은 상당한 시간과 비용을 소모하게 된다. 또한 확진검사로 유전자 검사를 시행하고자 할 때, 광범위한 유전자 목록에서 검사할 유전자를 선별하는데 기존의 선별검사만으로는 정보가 부족할 수 있다. 이러한 부분들을 보완하기 위해 림프구 아형검사를 이용해 면역표현형을 분석할 수 있는데, 기존의 림프구 아형검사는 T, B, NK 세포로 림프구의 주요한 계열을 구분할 수 있었지만 면역결핍질환의 감별진단을 위해서는 추가적으로 개별 림프구 집단을 분화 및 성숙 단계에 따라 세분화된 하위 집합으로 분류하고 계수하는 것이 필요하다[
7,
8].
이를 위해 많은 연구들이 시행되었지만 표지자로 사용하는 단클론항체가 검사실마다 다양하고 검사방법의 표준화가 이루어지지 않아 검사실 간의 결과를 비교하는 데 어려움이 있었다. 최근 EuroFlow 컨소시엄에서 원발성면역결핍증의 면역 표현형 진단을 표준화할 수 있도록 필수적인 세포 표지자를 조합한 Primary Immunodeficiency Orientation Tube (PIDOT) 패널(Cytognos, Salamanca, Spain)을 제안하였다[
8]. 한 가지 형광색소에 B 세포와 T 세포 표지자를 결합하였으며, 표지자 구성은 각각 림프구의 하위 집합 중 한 계열에서만 발현되는 안전성을 가지고 있는 표지자들로 조합되었다. PIDOT 패널의 항체(형광) 구성은 CD4와 IgM (PerCP-Cyanine5.5), CD8과 IgD (FITC), CD16과 CD56 (PE), CD19와 TCRγδ (PerCP-Cyanine7), CD3 (APC), CD45 (APC-C750), CD27 (BV421), CD45RA (BV510)로 8색 형광을 이용한 12가지 표지자를 이용해 주요 림프구 집합을 구분하고 발달 및 성숙 단계에 따라 상세히 분류할 수 있다(
Table 1). 표준화된 검사 방법을 통해 얻은 림프구의 면역표현형 정보를 통해 원발성면역결핍증이 의심되는 환자에서 면역표현형을 확인하고, 결함이 있는 림프구 계열에 대한 추가 검사와 검사할 유전자를 추리는 데 유용하다. 또한 결함이 있는 유전자가 확인되기 전에라도 면역표현형을 통해 필요한 치료가 시작될 수 있다. 본 연구에서는 원발성면역결핍증 의심 환자의 선별검사로서의 PIDOT 패널의 유용성을 본원에 내원한 2명의 환자에서 확인해보았다. 본 연구는 양산부산대학교병원의 임상연구심의위원회의 승인(05-2022-117)을 받은 후 진행되었다.
Table 1
Gating strategy for detecting lymphoid subpopulations using PIDOT panel
|
Population |
Gating strategy |
|
B-cells |
CD45hi/CD16-CD56-/CD3-/CD19+
|
|
Pre-GC B-cells |
CD27-/smIgM+/smIgD+
|
|
Post-GC B-cells |
|
|
Unswitched MBC/PC |
CD27+/smIgM+/smIgD+
|
|
Switched MBC/PC |
CD27+/smIgM-/smIgD-
|
|
T-cells |
CD45hi/CD16-CD56-/CD3+/CD19-
|
|
CD4+ T-cells |
CD4+/CD8-/TCRγδ-
|
|
Naïve CD4+ T-cells |
CD27+/CD45RA+
|
|
CM/ TM CD4+ T-cells |
CD27+/CD45RA-
|
|
EM CD4+ T-cells |
CD27-/CD45RA-
|
|
TD CD4+ T-cells |
CD27-/CD45RA+
|
|
CD8+ T-cells |
CD4-/CD8+/ TCRγδ-
|
|
Naïve CD8+ T-cells |
CD27+/CD45RA+
|
|
CM/TM CD8+ T-cells |
CD27+/CD45RA-
|
|
Effector CD27dim CD8+ T-cells |
CD27int/CD45RA+
|
|
EM CD8+ T-cells |
CD27-/CD45RA-
|
|
TD CD8+ T-cells |
CD27-/CD45RA+
|
|
NK cells |
CD45hi/CD16+CD56+/CD3-/CD19-
|

Go to :

증 례
1. 증례 1
3세 남아가 2개월 전부터 지속된 기침, 발열을 주소로 장기간 항생제 치료를 하였으나 호전되지 않아 소아감염내과로 내원하였다. 특별한 가족력은 없었으나 체중은 동일 연령에서 50퍼센타일, 키는 25퍼센타일에 속하였다. 환아는 2세 이전부터 반복된 중이염의 병력이 있고 장기간의 항생제 치료에도 반응이 없는 중증 감염의 소견을 통해 원발성면역결핍증을 의심하여 선별검사를 시행하였다. 일반혈액검사에서 백혈구는 경미하게 증가하였고(16,890/μL), 간기능검사에서 총 단백질 감소(5.5 g/dL)와 알부민 대 글로불린 비율이 상승(2.1)되어 있었다. 보체검사는 정상 범였으며 호중구기능검사(neutrophil respiratory burst test for screening chronic granulomatous disease)는 유의하게 감소한 세포활성도를 보이지 않았다. 면역글로불린 검사에서 IgG (0 mg/dL; 참고치 452-916 mg/dL), IgA (3 mg/dL; 20-100 mg/dL), IgM (14 mg/dL; 19-146 mg/dL), IgE (<1 IU/mL; ≤52 IU/mL) 및 IgD (0.13 mg/dL; 0.13-15.27 mg/dL) 모두 참고치 이하로 감소한 무감마글로불린혈증이 확인되었다. 또한 표준 예방접종 일정에 따라 B형 간염바이러스(hepatitis B virus, HBV) 및 A형 간염바이러스(hepatitis A virus, HAV) 예방접종을 시행하였음에도 anti-HBs Ab, anti-HAV Ab IgG 검사에서 음성 결과가 관찰되었다.
림프구 아형검사에서는 CD4
+ T 세포와 CD8
+ T 세포가 약간 증가하고 CD4/CD8 세포 비율과 NK 세포가 경미하게 감소한 소견을 보였으며, B 세포의 비율은 정상 범위에 속하였다(
Table 2). 추가로 시행한 PIDOT 패널 분석에서 T 세포수 및 B 세포수는 정상 범위를 보이고 CD27과 IgD/IgM 발현에 따른 미접촉 B 세포(naïve B cells; CD27
−IgD
+IgM
+) 비율도 정상 범위 내에 속하였으나, 종자중심후 B 세포(post-germinal center B cells; CD27
+IgD
+IgM
−), 치환된 기억 B 세포 및 형질세포(switched memory B cells/plasma cells; CD27
+IgM
−IgD
−), 미치환된 기억 B 세포(unswitched memory B cells; CD27
+IgM
+IgD
+/−)의 비율이 감소된 것을 관찰하였다(
Fig. 1). 환자는 분류불능형면역결핍증(common variable immunodeficiency, CVID)으로 의심되어 치료를 시작하였으나 도중에 타 병원으로 전원하였다.
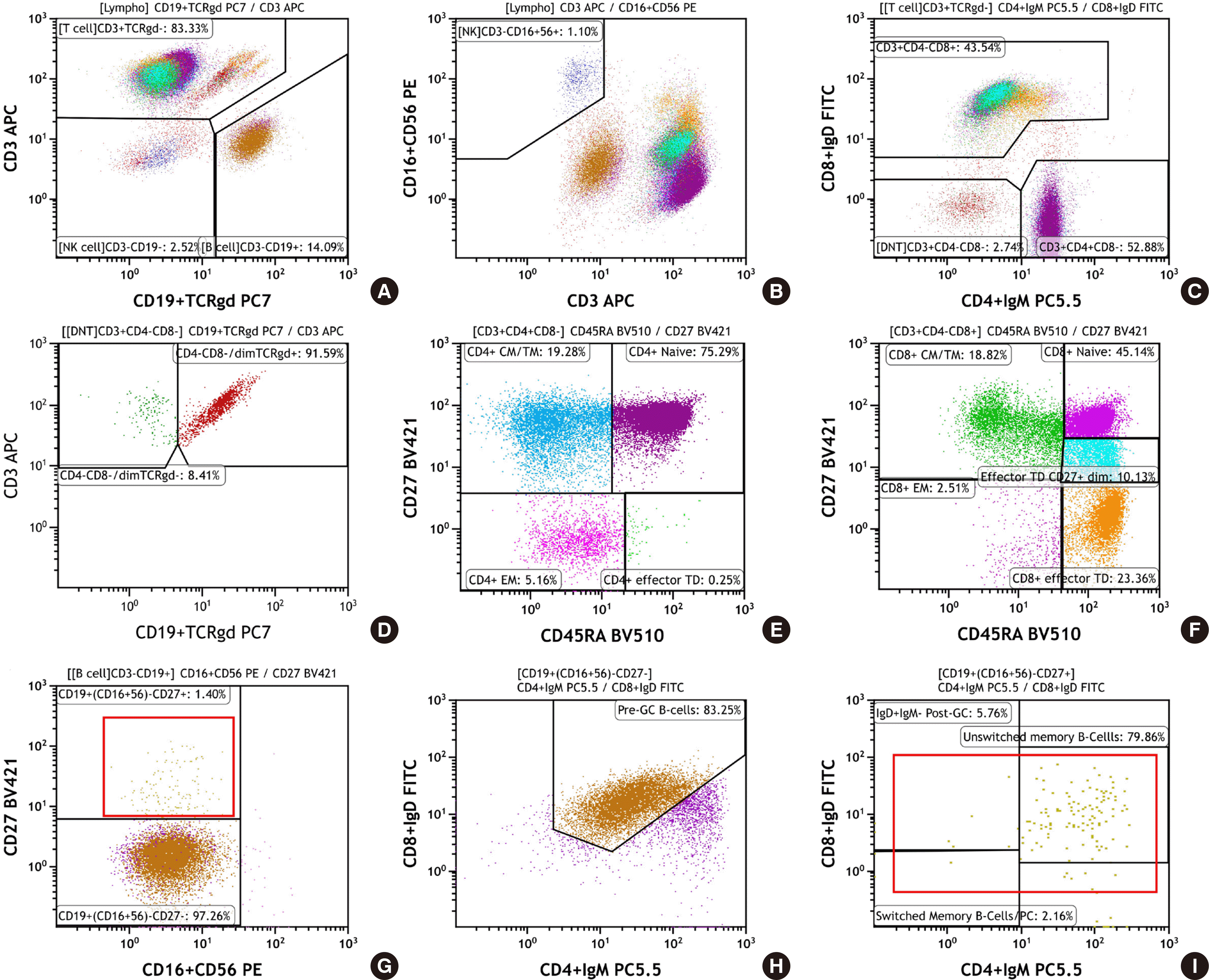 | Fig. 1Lymphocyte subset analysis of the peripheral blood (Case 1) by flow cytometry using Primary Immunodeficiency Orientation Tube (PIDOT) panel. Patient’s B-cell subsets show strong reduction in CD27 expression including unswitched memory B cells/plasma cells and switched memory B cells. Impaired maturation of post-GC B-cells is a hallmark of common variable immunodeficiency (CVID). (A) After gating lymphocytes on CD45 channel, forward scatter channel (FSC) and side scatter channel (SSC), CD3 and CD19 in combination with TCRγδ were used to define subsets of lymphocytes; T-cells (upper left), B-cells (lower right) and NK cells (lower left). (B) CD16+CD56+ and CD3 markers were used to define NK cells (upper left). (C) The CD3+ T-cells were divided into CD4+ (lower right), CD8+ (upper left) and double negative T-cells (DNT) (lower left). (D) The double negative T-cells were subdivided into two subpopulations according to the expression of TCRγδ; TCRγδ- T-cells (upper left) and TCRγδ+ T-cells (upper right). (E) CD4+ T-cell subsets were subdivided into naïve (CD27+CD45RA+; upper right), central memory/transitional memory (CM/TM; CD27+CD45RA-; upper left), effector memory (EM; CD27-CD45RA-; lower left) and terminally differentiated (TD; CD27-CD45RA+; lower right) CD4+ T-cells. (F) CD8+ T-cell subsets were subdivided into naïve (CD27+CD45RA+; upper right), CM/TM (CD27+CD45RA-; upper left), EM (CD27-CD45RA-; lower left) and TD (CD27-CD45RA+; lower right) CD8+ T-cells. For CD8+ T-cells, one additional subpopulation is defined, effector CD27dim (middle right). (G) Subdivision of the B-cell subset demonstrated pre-germinal center B-cells (Pre-GC; CD27-CD16-CD56-; lower left) and reduced post-germinal center B-cells (Post-GC; CD27+CD16-CD56-; upper left). (H) Pre-GC B-cells were sub-classified into mature naïve B-cells (CD27-smIgM+IgD++; upper right; brown) and transitional/immature B-cells (CD27-smIgM++IgD+; lower right; magenta) by the intensity of surface membrane immunoglobulin (smIg) M and D markers. (I) Likewise, post-GC B-cells were sub-classified into two different subsets based on the expression level of smIgM and smIgD; unswitched memory B cells/plasma cells (MBC/PC; CD27+smIgM+IgD+; upper right) and switched MBC/PC (CD27+smIgM-IgD-; lower left). In this plot, proportion of post-GC cells was generally reduced. 
|
Table 2
Routine lymphocyte subset analysis including CD4/CD8 ratio in the peripheral blood by flow cytometry
|
Case 1 |
Reference range |
Case 2 |
Reference range |
|
WBC count (/μL) |
13,680 |
5,400-9,300 |
2,560 |
5,400-17,500 |
|
Lymphocyte (%) |
46.3 |
42-59 |
7.0 |
51-68 |
|
Lymphocyte (/μL) |
6,334 |
2,500-5,100 |
179 |
2,800-5,700 |
|
CD3+ (%) |
80.5 |
58-68 |
51.3 |
60-71 |
|
Total T cell (/μL) |
5,099 |
1,500-2,900 |
92 |
1,800-3,500 |
|
CD4+ (%) |
36.4 |
29-40 |
36.4 |
37-48 |
|
Helper T cell (/μL) |
2,306 |
1,000-2,100 |
65 |
1,700-2,400 |
|
CD8+ (%) |
42.6 |
19-25 |
8.2 |
16-21 |
|
Cytotoxic T cell (/μL) |
2,698 |
700-1,200 |
15 |
800-1,100 |
|
CD4+/CD8+ ratio |
0.9 |
1.1-2.0 |
4.4 |
1.6-2.9 |
|
CD16+CD56+ (%) |
4.0 |
7-19 |
42.0 |
7-16 |
|
NK cell (/μL) |
253 |
300-600 |
75 |
100-800 |
|
CD19+ (%) |
13.7 |
3.9-19.7 |
1.1 |
3.9-19.7 |
|
B cell (/μL) |
868 |
700-1,300 |
2 |
700-1,300 |

2. 증례 2
10개월 여아가 2개월 전부터 시작된 발열로 항생제 치료를 받았으나 발열이 호전되지 않아 소아감염내과로 내원하였다. 신체 검진에서 BCG 접종부위의 림프절염과 구강 궤양이 특징적으로 관찰되었다. 환아는 정상 출생 후 특이 병력은 없었고 형제 2명을 포함한 가족력에도 특이 사항은 확인되지 않았다. 일반혈액검사상 적혈구, 백혈구의 감소가 있고 흉부 CT상에서 간유리음영과 림프절비대 소견이, 가슴 초음파에서는 심장과 관련한 이상은 없으나 정상보다 작은 흉선이 관찰되었다. IgG (1,120 mg/dL; 232-1,411 mg/dL), IgM (129 mg/dL; 0-145 mg/dL), IgA (162 mg/dL; 0-83 mg/dL) 및 IgE (4.93 IU/mL; ≤29 IU/mL)에서는 이상 소견이 없었다. 기관지 내시경을 통한 결핵균 배양검사에서는 비결핵 항산균이 검출되었으며 이후 구강 궤양의 진균 배양에서 Candida albicans가 동정되었다. 또한 엡스타인-바 바이러스(Epstein-Barr virus, EBV) PCR 검사 결과에서 양성(정량 4,616.8 copies/mL)임에도 불구하고 EBV에 대한 항체 검사는 음성이었고 HBV 예방접종을 하였으나 HBV 항체 검사도 음성 결과를 확인하여 특이 항체 반응이 결핍된 것으로 판단되었다. 후천성 면역결핍증을 배제하기 위한 HIV 항원 및 항체 검사와 HIV RNA PCR 검사는 음성이었다.
림프구 아형검사에서는 총 림프구(7%), CD3+ T 세포 및 B 세포의 분율과 절대수가 모두 감소하였고 NK 세포는 정상범위보다 높은 분율을 보였다(
Table 2). CD3+ T 림프구가 두드러지게 감소하여 추가로 시행한 PIDOT 패널 검사 결과로 동일한 연령대의 정상아와 환아의 림프계 세포 집단의 분율[
9]을 비교하였을 때 총 림프구, 전체 B 세포군과 전체 T 세포군이 현저한 감소를 보였다. 특히 T 세포의 경우, CD4+ T 세포와 CD8+ T 세포 모두 미접촉 T 세포(naïve T cells)가 심각하게 감소한 것이 특징적으로 관찰되었다(
Fig. 2). 이후 유전자 패널 검사에서 recombination activating gene 1 (
RAG1) 유전자에 2개의 pathogenic 변이(NM_000448.2:c.1871G>A (p.Arg624His), NM_000448.2:c.2095C>T (p.Arg699Trp))가 확인되어 T 세포와 B 세포가 극히 감소하고 NK 세포는 보존되어 있는 중증복합면역결핍증(T-B-NK+ Severe combined immunodeficiency, SCID)으로 진단되었다.
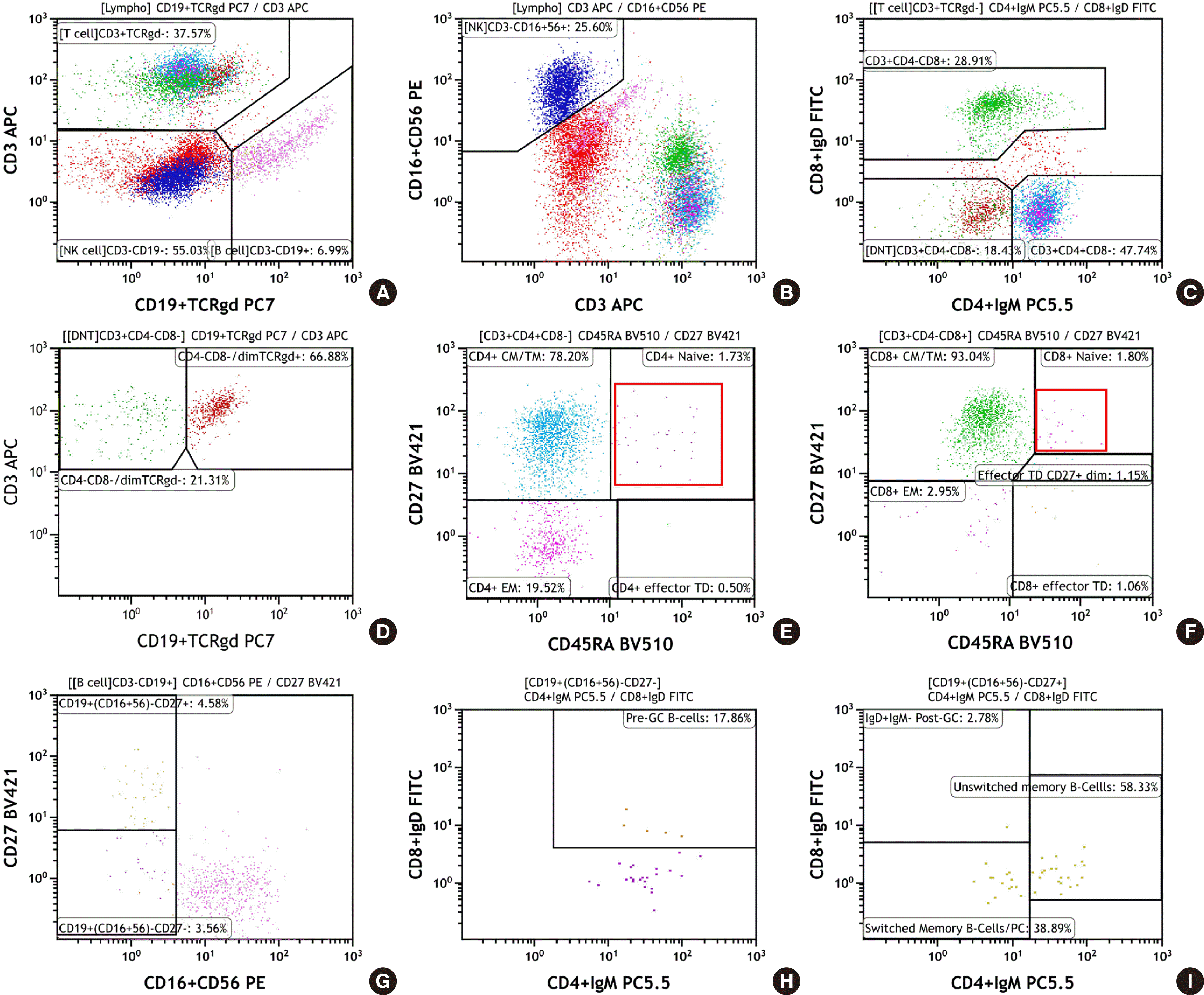 | Fig. 2Lymphocyte subset analysis of the peripheral blood (Case 2) by flow cytometry using Primary Immunodeficiency Orientation Tube (PIDOT) panel. In this patient, naïve CD4+/CD8+ T-cells were markedly reduced along with B-cell subsets, but NK cell population was preserved. (A) After gating lymphocytes on CD45 channel, forward scatter channel (FSC) and side scatter channel (SSC), CD3 and CD19 in combination with TCRγδ were used to define lymphocytes subsets; T-cells (upper left), B-cells (lower right) and NK cells (lower left). (B) CD16+CD56 marker and CD3 marker were used to define NK cells (upper left). (C) The CD3+ T-cells were divided into CD4+, CD8+ and double negative T-cells (DNT). In this plot, the distribution of CD3+ T-cells showed an overall reduction. (D) The double negative T-cells were subdivided into two subpopulations based on the expression of TCRγδ; TCRγδ- T-cells (upper left) and TCRγδ+ T-cells (upper right). (E) CD4+ T-cell subsets were subdivided into naïve (CD27+CD45RA+; upper right), central memory/transitional memory (CM/TM; CD27+CD45RA-; upper left), effector memory (EM; CD27-CD45RA-; lower left) and terminally differentiated (TD; CD27-CD45RA+; lower right) CD4+ T-cells. All CD4+ T-cell subsets were decreased, particularly lack of naïve CD4+ was pronounced. (F) CD8+ T-cell subsets were subdivided into naïve (CD27+CD45RA+; upper right), CM/TM (CD27+CD45RA-; upper left), EM (CD27-CD45RA-; lower left), effector CD27dim (middle right) and TD (CD27-CD45RA+; lower right) CD8+ T-cells. In this case also, there was a decrease in the overall CD8+ T-cell subsets and severe reduction in naïve CD8+ T-cells. (G) Subdivision of the B-cell subsets demonstrated an overall reduction in pre-GC B-cells (CD27-CD16-CD56-; lower left) and post-GC B-cells (CD27+CD16-CD56-; upper left). (H) Reduced pre-GC B-cells were further classified into mature naïve B-cells (CD27-smIgM+IgD++; upper right) and transitional/immature B-cells (CD27-smIgM+IgD+; lower right). (I) Post-GC B-cells were sub-classified into unswitched MBC/PC (CD27+smIgM+IgD+; upper right) and switched MBC/PC (CD27+smIgM-IgD-; lower left). 
|
Go to :

고 찰
증례 1에서 의심된 분류불능형면역결핍증은 저감마글로불린혈증의 하위 그룹에 속하며, 특정 항체 생산의 결핍과 반복 감염에 취약한 질환군으로 환자들의 B 세포수는 감소되거나 정상을 보이지만, 치환된 기억 B 세포가 감소하는 양상을 보인다[
8,
10,
11]. 다만, 본 환자의 경우 유전자 검사를 진행하지 않고 전원하여 확진명을 알 수 없었다. 본 증례에서는 B 세포수는 정상범위에 속하였지만 치환된 기억 B 세포를 포함한 기억 B 세포가 전체적으로 감소한 소견이 관찰되어 일반적으로 시행하는 림프구 아형검사에서는 검출할 수 없는 B 세포 하위 집단의 분포를 관찰하여 기억 B 세포의 고갈이 항체 생성에 영향을 주었음을 밝혔기 때문에, 진단 가능한 질환군을 선별하고 치료하는 과정에 도움이 될 것으로 생각된다.
증례 2에서는 300/μL 미만의 CD3+ T 림프구감소로 중증복합면역결핍증을 의심하였고 확진을 위해 관련된 유전자들이 포함된 유전자 패널검사를 시행하여 중증복합면역결핍증의 원인 중 하나인
RAG1 유전자의 변이가 확인되었다.
RAG1 유전자는 T 및 B 림프구의 발달 과정 중 세포 표면 수용체의 유전자 재조합 단계에서 다양한 조합의 세포 표면 수용체를 만들어내는 데 관여하여 후천성 면역계의 항원 인식을 광범위하게 조성하는 역할을 하고, 결핍된 경우의 임상 및 면역학적 표현형은 다양하게 나타날 수 있다[
12]. 주요하게 세균, 바이러스 및 진균과 같은 감염원에 대한 면역계의 방어력이 전반적으로 감소하여 여러 조직과 장기에 치명적인 감염이 발생할 수 있다. 본 증례의 환아의 경우, 내원 당시 EBV와 구강 아구창 등 면역저하상태에서 보일 수 있는 비전형적인 감염 소견들을 보였다.
RAG 결핍 환자의 림프구 아형검사는 다양한 패턴을 보일 수 있는데 유전자 변이 형태가 넌센스 돌연변이인 경우는 T와 B 세포 모두 완벽히 감소하는데 반해, 넌센스 돌연변이가 아닌 경우 잔여 T, B 세포가 남아있으며, 잔여 T 세포는 미접촉 CD4
+, CD8
+ T 세포의 고갈로 인해 기억 및 효과 T 세포 형태로 나타나기도 한다. 본 연구의 환자에서 보인 T 및 B 세포의 감소, 특히 미접촉 T 세포 감소와 T 세포의 고도로 활성화된 상태가 기존
RAG 결핍 환자에서의 보고[
7,
13]와 부합하였고 특히 PIDOT 패널을 이용하여 SCID 질환군을 분류한 보고와도 동일한 면역표현형[
8]을 확인하여, 질환을 진단하는 데 도움이 될 수 있었다.
원발성면역결핍증의 진단을 위한 선별검사의 일부로 기존의 림프구 아형검사는 매우 중요하며 신속한 도구이다. 그러나 림프구를 T, B, NK 세포로만 구별하여 대략적인 이상을 파악하는 수준의 결과만으로는 원발성면역결핍증의 감별진단을 위한 수많은 추가 검사들의 방향성과 우선순위를 결정하는 데 충분한 정보를 제공하기 어렵다. 따라서 어떤 계열의 림프구에 문제가 있는지, 더 나아가 미접촉 세포 및 기억 세포같이 림프구의 발달과 성숙 단계에서 이상이 있는지 확인할 수 있는 보다 상세한 림프구 아형검사가 필요하다. 이러한 세분화된 면역표현형 분석에 따라 방대한 원발성면역결핍질환군에서 의심되는 림프구 계열을 추려낼 수 있고, 질환에 따라서는 세부적인 면역결핍증까지도 의심해 볼 수 있어서, 적절한 추가 검사를 선택하는 데 도움이 된다. 특히 유전자 검사를 시행하고자 할 때, 검사 대상 유전자를 선별하는 데 단초를 제공해 줄 수 있다. 따라서 임상적으로 원발성면역결핍증이 의심되는 환자의 검사가 의뢰될 경우 기존의 림프구 아형검사에 더해 본 연구에서 사용된 PIDOT 패널을 이용하면, 임상검사실에서 빠르고 표준화된 원발성면역결핍증 선별검사로서 유용하게 사용될 것으로 생각된다.
Go to :

감사의 글
본 연구는 2022년 부산대학교병원의 임상연구비 지원으로 이루어졌습니다.
Go to :

Notes
Go to :

REFERENCES
1. Tangye SG, Al-Herz W, Bousfiha A, Chatila T, Cunningham-Rundles C, Etzioni A, et al. 2020; Human inborn errors of immunity: 2019 update on the classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 40:24–64. DOI:
10.1007/s10875-019-00737-x. PMID:
31953710. PMCID:
PMC7082301.
2. Abolhassani H, Azizi G, Sharifi L, Yazdani R, Mohsenzadegan M, Delavari S, et al. 2020; Global systematic review of primary immunodeficiency registries. Expert Rev Clin Immunol. 16:717–32. DOI:
10.1080/1744666X.2020.1801422. PMID:
32720819.
4. Leiding JW, Forbes LR. 2019; Mechanism-based precision therapy for the treatment of primary immunodeficiency and primary immunodysregulatory diseases. J Allergy Clin Immunol Pract. 7:761–73. DOI:
10.1016/j.jaip.2018.12.017. PMID:
30832891.
5. Aguilar C, Malphettes M, Donadieu J, Chandesris O, Coignard-Biehler H, Catherinot E, et al. 2014; Prevention of infections during primary immunodeficiency. Clin Infect Dis. 59:1462–70. DOI:
10.1093/cid/ciu646. PMID:
25124061.
6. Long PM, Sanford KW, Bluth MH. McPherson RA, Pincus MR, editors. 2017. Immunodeficiency disorders. Henry's clinical diagnosis and management by laboratory methods. 23rd ed. p. 984–92. St. Louis, MO: Elsevier.
7. Abraham RS, Aubert G. 2016; Flow cytometry, a versatile tool for diagnosis and monitoring of primary immunodeficiencies. Clin Vaccine Immunol. 23:254–71. DOI:
10.1128/CVI.00001-16. PMID:
26912782. PMCID:
PMC4820507.
8. van der Burg M, Kalina T, Perez-Andres M, Vlkova M, Lopez-Granados E, Blanco E, et al. 2019; The EuroFlow PID Orientation Tube for flow cytometric dDiagnostic screening of primary immunodeficiencies of the lymphoid system. Front Immunol. 10:246. DOI:
10.3389/fimmu.2019.00246. PMID:
30886612. PMCID:
PMC6410673.
9. Ding Y, Zhou L, Xia Y, Wang W, Wang Y, Li L, et al. 2018; Reference values for peripheral blood lymphocyte subsets of healthy children in China. J Allergy Clin Immunol. 142:970–3. DOI:
10.1016/j.jaci.2018.04.022. PMID:
29746882.
10. Warnatz K, Denz A, Dräger R, Braun M, Groth C, Wolff-Vorbeck G, et al. 2002; Severe deficiency of switched memory B cells (CD27(+)IgM(-)IgD(-)) in subgroups of patients with common variable immunodeficiency: a new approach to classify a heterogeneous disease. Blood. 99:1544–51. DOI:
10.1182/blood.V99.5.1544. PMID:
11861266.
11. Del Pino-Molina L, López-Granados E, Lecrevisse Q, Torres Canizales J, Pérez-Andrés M, Blanco E, et al. 2021; Dissection of the pre-germinal center B-cell maturation pathway in common variable immunodeficiency based on standardized fFlow cytometric EuroFlow tools. Front Immunol. 11:603972. DOI:
10.3389/fimmu.2020.603972. PMID:
33679693. PMCID:
PMC7925888.
13. Kalina T, Bakardjieva M, Blom M, Perez-Andres M, Barendregt B, Kanderová V, et al. 2020; EuroFlow standardized approach to diagnostic immunopheneotyping of severe PID in newborns and young children. Front Immunol. 11:371. DOI:
10.3389/fimmu.2020.00371. PMID:
32265901. PMCID:
PMC7096355.
Go to :







 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download