증 례
78세 여자 환자가 내원 1주일 전부터 지속된 호흡곤란을 주소로 내원하였다. 환자의 키와 몸무게는 146 cm, 57 kg이었다. 환자는 5년 전 비분비성 골수종으로 진단된 후, 두 차례 항암화학요법을 변경하며 치료를 받았음에도 불구하고 뚜렷한 효과가 없었다. 비분비성 골수종으로 진단 시 혈청 검사상 총 단백질 5.8 g/dL, 알부민 3.5 g/dL, 유리경쇄는 kappa 7.06 mg/L (참고구간: 3.3–19.4 mg/L), lambda 2.46 mg/L (참고구간: 5.71–26.3 mg/L)이었고, 혈청 단백전기영동에서 단클론단백은 검출되지 않았다. 혈청과 소변 면역고정전기영동에서 단클론단백 띠는 검출되지 않았다. 골수흡인 백혈구감별계산에서 형질세포는 19.4%였고, 골수생검의 면역조직화학 염색에서 CD3 음성, CD20 음성, CD138 양성, kappa, lambda 경쇄 제한은 없었다. 염색체 결과는 정상 핵형이었고, 형광제자리교잡 결과는 약 10%의 세포에서 사염색체 소견이 관찰되었다. T1 강조 척추 자기공명영상에서는 몸통뼈대에 골수종이 광범위하게 침범되어 있었다(
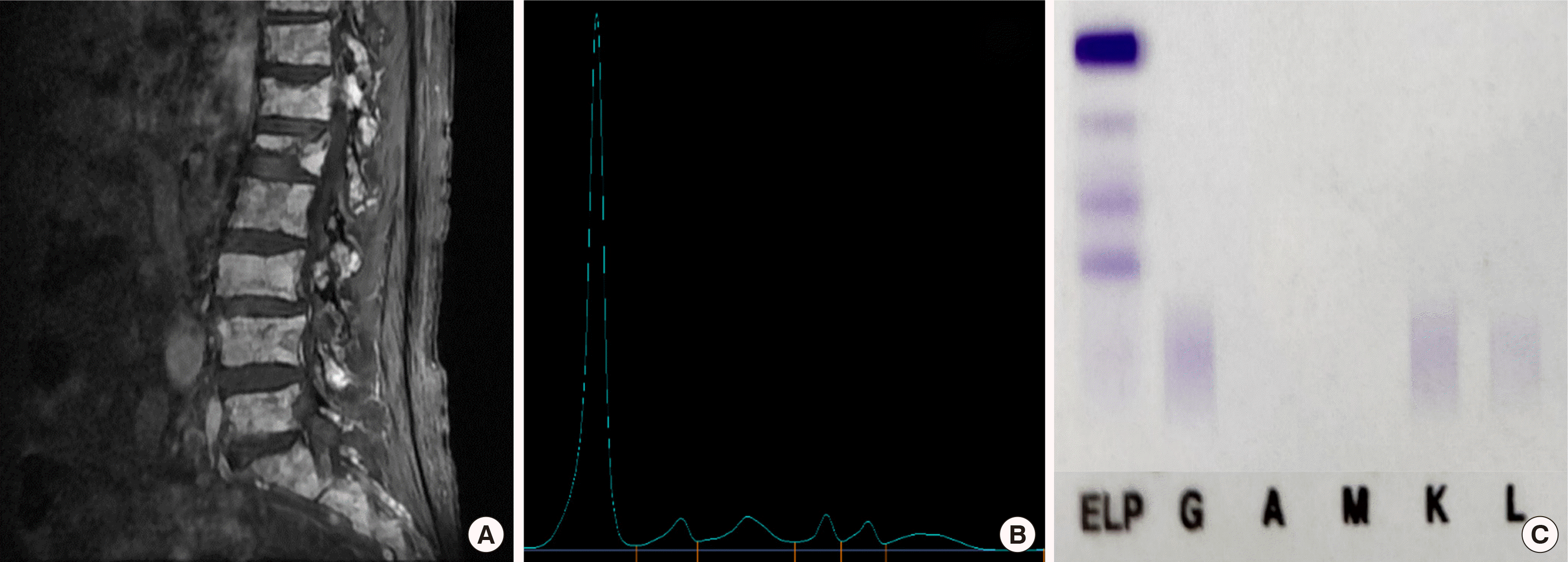
Fig. 1A).
 | Fig. 1
Images of the patient’s relevant test results during the clinical course. (A) Sagittal T1-weighted spine MRI showing diffuse myeloma involvement in the axial skeleton and T11/12 compression fracture with T12 significant retropulsion at the time of initial diagnosis as non-secretory myeloma. (B) Serum protein electrophoresis showing no monoclonal spike when diagnosed as plasma cell leukemia. (C) Serum immunofixation electrophoresis showing no band when diagnosed as plasma cell leukemia.
Abbreviation: MRI, magnetic resonance imaging.

|
내원 8개월 전 치과 치료를 위해 항암치료를 중단하였다. 내원 7개월 전 일반혈액 검사상 백혈구 수 86.75×10
9/L (형질세포 85%), 혈색소 6.9 g/dL, 혈소판 수 47×10
9/L로 이차성 형질세포백혈병으로 진단되었다. 혈청 단백전기영동에서 단클론단백은 검출되지 않았고(
Fig. 1B), 혈청 면역고정전기영동에서 단클론단백 띠는 관찰되지 않았다(
Fig. 1C). 골수흡인 백혈구감별계수에서 형질세포는 92.8%였고, 골수생검의 면역조직화학 염색에서 kappa, lambda 경쇄 제한은 없었다. 염색체 결과는 복잡성 핵형이었다(42,X,-X,t(2;11)(p11.2;q13),-4,-13,der(16)t(13;16)(q21;q12-13),der(17;21)(q10;q10)[15]/46,XX[5]). 크레아티닌은 2.27 mg/dL로 내원 8개월 전(0.99 mg/dL, 참고구간: 0.70–1.40 mg/dL)에 비해 높았다. 이에 형질세포백혈병에 의한 급성신부전으로 판단되어 입원하였고, carfilzomib/dexamethasone으로 항암화학요법을 변경하여 치료를 받은 후 호전되었다. 이후 항암치료를 지속하였고, 내원 2개월 전 외래에서는 특별히 불편한 점을 토로하지는 않았다. 내원 1개월 전 외래에서는 청력 저하와 안구 건조증을 호소하였는데, 일반혈액 검사상 백혈구 수 20.55×10
9/L (형질세포 64%), 혈색소 10.7 g/dL, 혈소판 수 101×10
9/L였다.
독립적인 일상생활이 가능하였던 환자는 내원 1주일 전부터 호흡곤란, 전신쇠약과 기억력 저하가 발생하였다. 이에 응급실로 입원하였으며, 입원 직후부터 섬망이 나타났다. 입원 당시의 활력징후는 혈압 116/55 mmHg, 맥박수 81회/분, 호흡수 22회/분, 체온 37.2°C로 호흡수가 증가되어 있었고, 산소포화도는 93-95%로 감소되어 있었다. 일반혈액 검사상 백혈구 수 335.60×10
9/L (형질세포 88%,
Fig. 2A), 혈색소 9.0 g/dL, 혈소판 수 43×10
9/L였다. 혈청 검사상 총 단백질 5.8 g/dL, 알부민 4.0 g/dL, 유리경쇄는 kappa 2.77 mg/L, lambda 2.01 mg/L로 증가하지 않았고, 혈청 단백전기영동에서 단클론단백은 검출되지 않았으며 비분비성 골수종으로 진단된 때의 결과와 유사하였다. 내원 1개월 전의 검사와 비교하였을 때, 크레아티닌은 1.01 mg/dL에서 1.3 mg/dL로 증가하였다. 총칼슘은 9.2 mg/dL (참고구간: 8.8–10.5 mg/dL)에서 11.0 mg/dL로, 인은 4.2 mg/dL (참고구간: 2.5–4.5 mg/dL)에서 4.9 mg/dL로, 요산은 8.3 mg/dL (참고구간: 3.0–7.0 mg/dL)에서 11.3 mg/dL로 증가하였다. 이에 allopurinol과 rasburicase를 포함한 대증적 치료를 시작하였다.
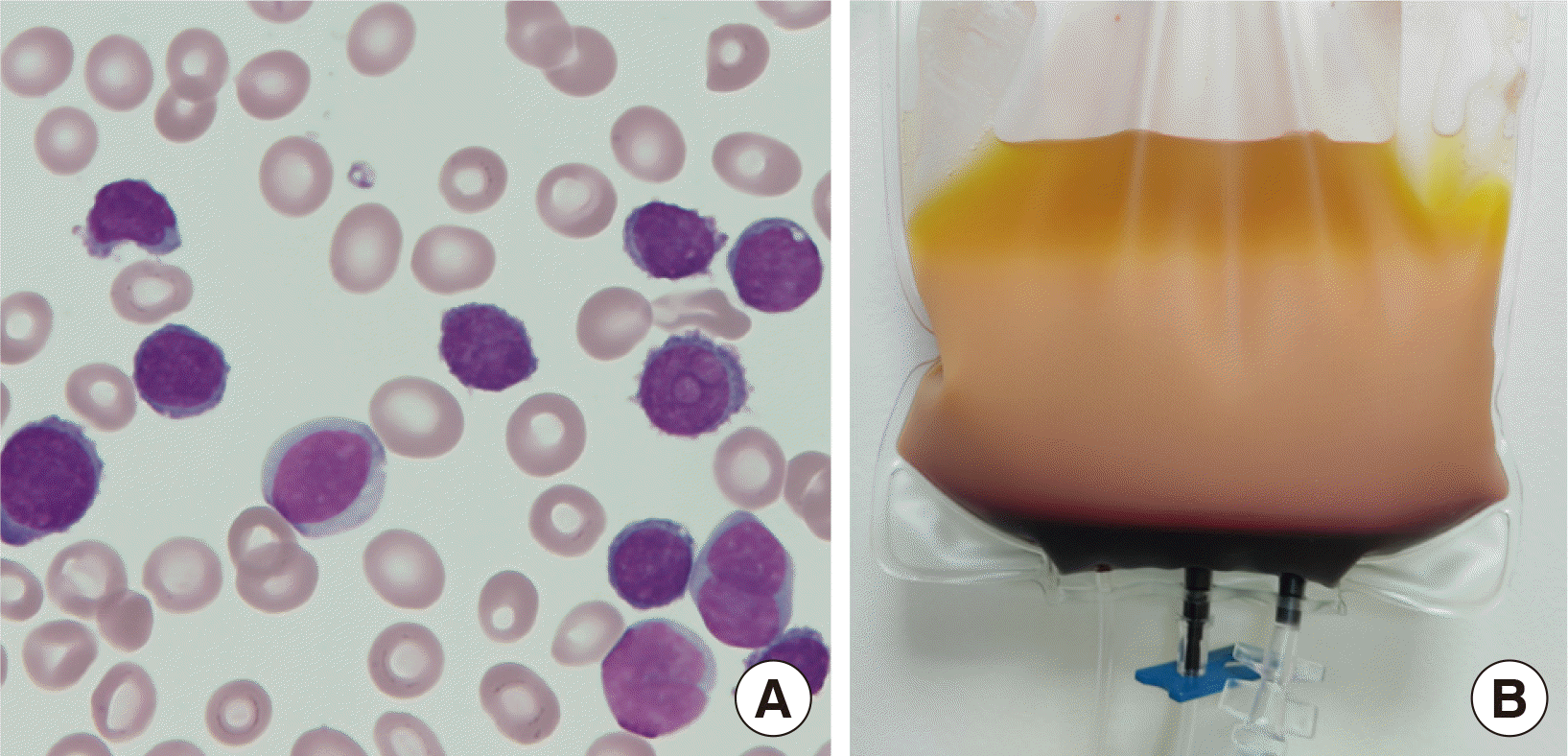 | Fig. 2Images related to the patient at the time of therapeutic leukapheresis. (A) Morphological features of the peripheral blood smear (Wright-Giemsa stain, ×1,000) on hospital day 1 showing numerous abnormal plasma cells. (B) Product of the first therapeutic leukapheresis procedure performed on hospital day 2. A thick layer of white blood cells is present in the middle area. 
|
환자는 입원 전 한 달 동안 백혈구 수가 급격히 증가하였고 호흡기계 및 신경계 증상이 동반되어 고백혈구증가증으로 인해 발생한 백혈구울혈이 의심되었다. 백혈구울혈을 완화하고 항암치료 시 종양융해증후군이 발생할 가능성을 낮추기 위해 입원 2일째 내경정맥의 이중관 카테터와 Spectra Optia (Terumo BCT, Lakewood, CO, USA)의 IDL 세트를 이용한 백혈구제거술(WBDC)로 치료적 백혈구성분채집술을 시행하였다. 섬망을 진정시키기 위한 약물은 투여하지 않았으며, 혈액성분치료실에서 시술을 진행하였다. 백혈구는 시술 전 329.94×10
9/L에서 시술 후 171.29×10
9/L로 48%가 감소하였다. 혈청 총칼슘은 시술 전 10.7 mg/dL에서 시술 후 9.9 mg/dL로 감소하였고, 혈청 이온화 칼슘은 시술 전 1.40 mmol/L (참고구간: 1.05–1.35 mmol/L)에서 시술 후 1.29 mmol/L로 감소하였다. 입원 3일째 추가로 치료적 백혈구성분채집술을 한 차례 더 시행하였고, 시술 후 백혈구 수는 84.53×10
9/L로 첫 시술 전에 비해 74%가 감소하였다(
Fig. 3). 각 시술마다 총 시술량(total processed volume)은 5 L로, 환자의 총 혈액량의 1.7배, 1.9배에 해당하였다. 시술 시간은 각각 75분, 58분이었다. 항응고제는 ACD formula A (Terumo BCT)를 사용하여 항응고제:전혈 비를 1:24로 하였다. 글루콘산칼슘은 사용하지 않았으며, 시술 중 부작용은 발생하지 않았다. 채집물(
Fig. 2B)은 각각 500 mL, 550 mL였다.
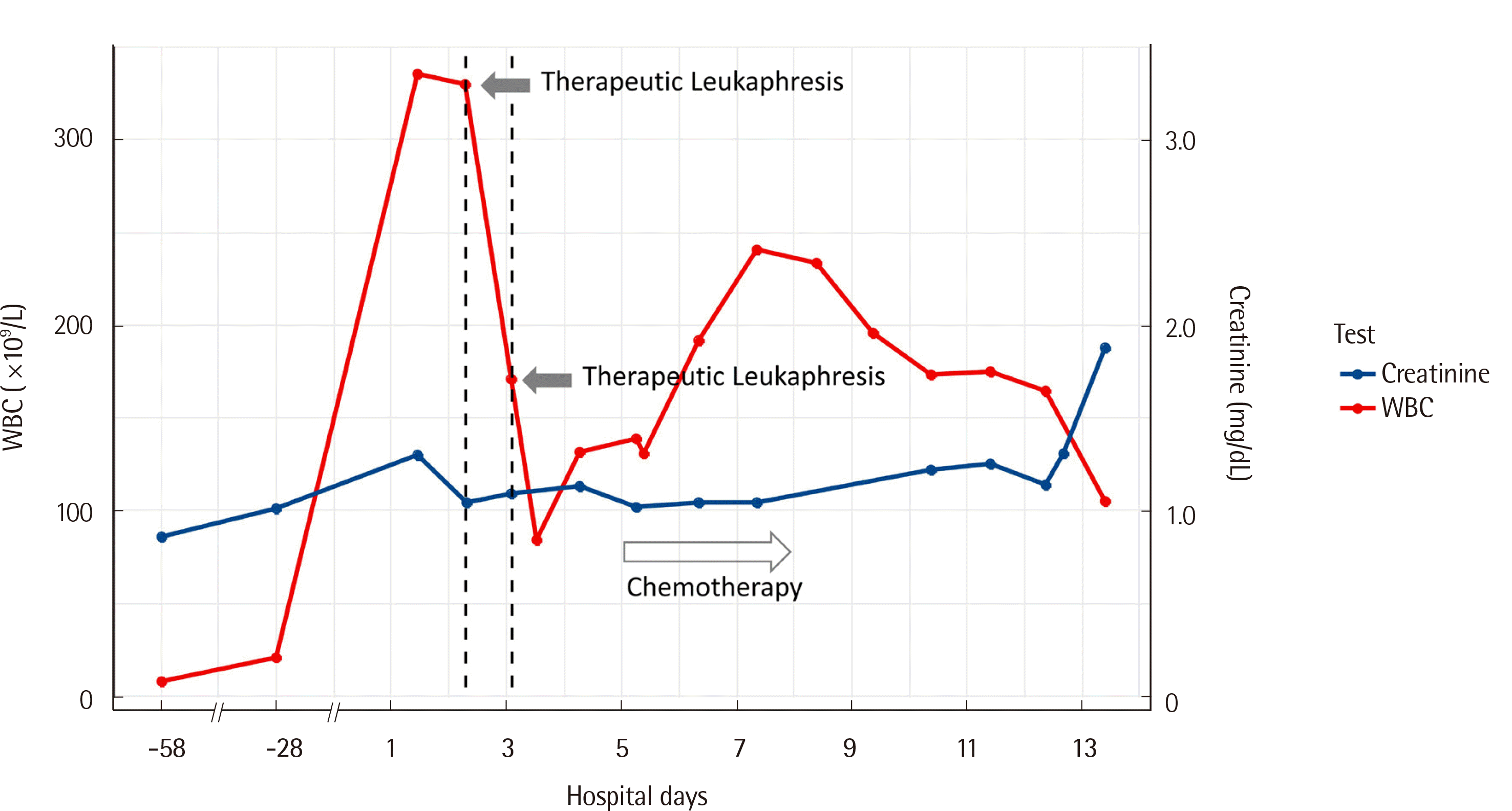 | Fig. 3
Changes in peripheral blood WBC count and serum creatinine level before and after admission. A significant increase in the WBC count was observed at the time of admission compared to 58 and 28 days before admission. The WBC count effectively decreased after therapeutic leukapheresis. Solid arrows indicate the days on which therapeutic leukapheresis was performed. The hollow arrow indicates the duration of chemotherapy from hospital day 5 to day 8.
Abbreviation: WBC, white blood cell.

|
치료적 백혈구성분채집술 후 환자의 호흡기계 증상은 호전(호흡 수 18-20회/분, 산소포화도 95-99%)되었으나, 입원 직후 발생한 섬망으로 환자와 의사소통하는 것이 원활하지 않아 신경계 증상 호전 여부는 정확하게 평가하는 것이 어려웠다. 이후에도 섬망이 지속되고 혈액 검사상 백혈구 수가 다시 증가하는 경향을 보였으나 입원 5일째 D-CEP (dexamethasone, cyclophosphamide, etoposide, cisplatin) 항암화학요법으로 변경하여 치료를 시작한 뒤 백혈구 수의 감소세를 보였고, 신기능의 악화가 뚜렷하지 않아 치료적 백혈구성분채집술은 추가로 더 시행하지 않았다. 그러나 다발성 장기부전이 발생하며 환자 상태가 점차 악화되었고, 백혈구 수가 감소되는 경향이었음에도 불구하고 지속적으로 100×109/L 이상을 유지하였으며, 크레아티닌도 급격히 상승하여 추가적인 치료적 백혈구성분채집술을 고려하던 중, 입원 13일째 환자는 사망하였다.
Go to :

고 찰
형질세포백혈병의 발생 비율은 원발성이 60%, 이차성이 40%로 알려져 있다[
4]. 최근 다발골수종 환자에게 신약의 발전에 따른 새로운 항암화학요법을 사용함에 따라 생존율이 증가하고 클론 선택이 일어남에 따라 이차성 형질세포백혈병으로 진행되는 경우가 늘어날 것으로 예상된다[
5]. 최근의 연구에서는 말초혈액의 형질세포가 백혈구감별계산의 5% 이상일 경우, 이전의 정의(20% 이상)와 비교하여 예후에 차이가 없었기 때문에 이 역시 형질세포백혈병으로 진단해야 한다고 하였다[
6,
7]. 이와 같은 논의를 거쳐 향후 형질세포백혈병의 진단 및 발생률이 증가할 가능성이 있을 것으로 예상된다. 형질세포백혈병의 치료로는 다발골수종과 유사하게 항암치료와 조혈모세포이식이 가능하다. 하지만 최근 다발골수종 환자의 생존율이 증가한 것과 달리 형질세포백혈병 환자에서는 생존기간이 크게 증가하지 않았다는 보고가 있어[
8], 형질세포백혈병의 진단 및 치료에 대한 연구가 필요한 실정이다.
치료적 성분채집술은 크게 혈장성분채집술과 세포성분채집술로 분류되며, 제거하고자 하는 성분에 따라 적절한 채집 방식을 사용하여 혈액의 병적 성분을 빠르고 선택적으로 분리해 제거하고 환자의 증상을 완화하는 것에 목적이 있다[
9]. 치료적 성분채집술에 대한 가장 대표적인 참고문헌으로 미국혈액성분치료학회(American Society for Apheresis, ASFA)의 진료지침을 꼽을 수 있는데, ASFA 진료지침에서는 체계적 문헌고찰을 통해 다양한 질환에서 치료적 성분채집술의 임상적 유효성에 대해 기술하고 있다[
10]. 형질세포질환에서 일반적으로 고려되는 치료적 성분채집술은 고감마글로불린혈증으로 인한 과다점도증후군에서 시행하는 치료적 혈장교환술이다[
11]. 유증상의 과다점도증후군은 발덴스트롬 마크로글로불린혈증의 10–30%, 그리고 다발골수종의 2–6%에서 발생한다는 보고가 있으나[
12], 형질세포백혈병에서는 소수의 단발성 증례만 보고되어 있다[
13,
14]. 비분비성 골수종과 비분비성 형질세포백혈병은 면역글로불린을 분비하지 않으며, 본 증례의 환자에서도 혈청 유리경쇄가 증가하지 않았고 단클론단백이 검출되지 않았으므로, 고백혈구증가증 외에 고감마글로불린혈증에 의한 과다점도증후군이 동반되어 있었을 가능성은 없었다고 판단된다.
고백혈구증가증은 일반적으로 말초혈액의 백혈구 수가 100×10
9/L 이상인 경우를 의미하며, 고백혈구증가증이 있는 환자는 백혈구울혈, 종양융해증후군, 파종혈관내응고가 수반되어 있을 수 있어 적절히 관리되지 않거나 인지하지 못하면 1주 이내 사망률이 40%에 육박할 수 있다[
10]. ASFA 진료지침에 따르면 고백혈구증가증에서의 치료적 백혈구성분채집술은 백혈구울혈의 증상이 있는 경우는 Category II (단독 치료방법으로 사용하거나 다른 치료방법과 병합하여 시술할 수 있어 이차적 치료로 인정되는 질환), Grade 2B (중간 정도의 효과가 증명되어 약한 추천 등급), 예방적이거나 이차적으로 시행하는 경우는 Category III (치료의 명확한 역할이 성립되지 않아 환자의 상황에 따라 시행할 수 있는 질환), Grade 2C (낮은 정도의 효과가 증명되어 약한 추천 등급)에 해당한다[
10]. Giammarco 등[
15]의 연구에 의하면 급성골수성백혈병에서는 백혈구 수가 100×10
9/L 이상인 경우 고백혈구증가증에 의한 백혈구울혈이 발생할 가능성이 있지만, 급성림프모구백혈병에서는 백혈구 수가 400×10
9/L 이하인 경우에 발생할 가능성은 작다고 한다. 이처럼 질병에 따라 암세포의 크기와 성질이 달라 고백혈구증가증에 의한 증상이 발생할 가능성이 다르나, 형질세포백혈병에서의 고백혈구증가증에 대해서는 아직 보고된 사례가 매우 적어 적절한 판단기준을 세우는 것이 어려운 상황이다. 형질세포백혈병 진단 시 말초혈액 백혈구 수의 중앙값은 원발성의 경우를 보고한 두 연구[
16,
17]에서 각각 13.7 (최댓값 56.7)×10
9/L과 16.5 (최댓값 124)×10
9/L로 보고되었고, 이차성의 경우를 보고한 연구[
18]에서는 11.5 (최댓값 81)×10
9/L로 알려진 바 있어 고백혈구증가증이 발생할 가능성은 다른 급성백혈병에 비해 낮을 것으로 추정된다. 현재로서는 특정한 백혈구 수에 의존하기 보다는 환자가 백혈구울혈 증상을 보이거나 백혈구 수가 빠른 속도로 증가할 것으로 예상되는 경우, 또는 종양융해증후군의 발생을 예방할 목적이라면 적극적으로 시술을 고려할 필요가 있다고 판단된다.
드물게 형질세포백혈병에서 고백혈구증가증이 관찰된 한 증례 보고를 살펴보면, 임신 24주의 35세 여자 환자가 내원 2주 전부터 발생한 전신쇠약과 감각이상을 호소하였으며, 백혈구 수 259×10
9/L (형질세포 90%)의 형질세포백혈병으로 진단 받았다. 환자는 항암화학요법으로 호전되었으나 3개월 뒤 신기능 저하 및 백혈구 수 증가로 다시 항암치료를 받았고, 진단 후 6개월 시점까지 생존했던 것으로 확인되었다[
19]. 다른 증례 보고에서는 호흡곤란, 복통과 발열을 호소한 65세 여자 환자가 형질세포백혈병으로 진단 받았으며, 백혈구 수는 138.5×10
9/L (형질세포 42%)로 확인되었다. 환자의 신기능 및 골격계는 정상이었으며, 항암화학요법에 잘 반응하였다[
20]. Godbey 등[
3]의 증례 보고에서는 45세 남자가 원발성 형질세포백혈병으로 진단된 후, 고감마글로불린혈증에 의한 과다점도증후군이 의심되어 치료적 혈장교환술을 2회 시행하였지만, 증상의 호전은 뚜렷하지 않았다. 이후 항암치료를 시작하였으나 5일 간 백혈구가 40.4×10
9/L에서 89.9×10
9/L로 증가하였으며, 호흡곤란이 악화되어 기관내삽관 및 체외막산소공급장치 치료가 시행되었다. 고백혈구증가증은 심하지 않았으나 중증 호흡곤란의 원인으로 백혈구울혈이 의심되어 치료적 백혈구성분채집술을 2회 시행한 후 백혈구가 효과적으로 감소하며 증상이 호전되었다. 이후 항암치료를 재개하였으나 3주 후 소장 폐색, 패혈증, 뇌사에 이르렀다. 비록 환자는 사망하였으나, 치료적 백혈구성분채집술을 시행하여 고백혈구증가증에 의한 증상을 단기적으로 호전시킬 수 있었던 것으로 판단된다.
본 증례의 환자는 내원 시 백혈구 수가 335.6×10
9/L (형질세포 88%)로 내원 1개월 전 20.55×10
9/L (형질세포 64%)와 비교해 급격히 증가된 상태였고, 이차성 형질세포백혈병의 악화에 따른 고백혈구증가증과 백혈구울혈에 의해 호흡곤란, 전신쇠약과 섬망이 발생하였을 가능성을 고려하여야 했다. 이에 신속히 치료적 백혈구성분채집술을 실시하였고, 효과적으로 백혈구 수를 감소시키고 활력 징후를 호전시켰다. ASFA 진료지침에서도 급성백혈병 환자의 근본적인 치료는 항암화학요법이 중요하다고 제시하고 있고, 고백혈구증가증에서 치료적 백혈구성분채집술의 역할은 혈관 내 세포 수를 신속히 줄여서 조직으로의 원활한 산소 공급을 회복하고 백혈구울혈로 인한 증상을 완화하는 보조적인 방법으로 기술하고 있다[
10]. 따라서 본 증례는 드물게 발생하는 고백혈구증가증이 동반된 형질세포백혈병에 대한 기존 문헌에서의 사례[
3,
19,
20] 대비 백혈구 수가 가장 높았으며, 비록 환자가 다발성 장기부전으로 사망하였으나 치료적 백혈구성분채집술을 시행하여 백혈구 수를 성공적으로 감소시키고 질병의 악화를 지연시키는 단기적 효과의 가능성을 제시한 국내 첫 번째 사례이고, 세계적으로 두 번째 사례라는 데 의의가 있다.
결론적으로, 형질세포백혈병에서도 이전에 알려진 고감마블로불린혈증에 의한 과다점도증후군 외에도 드물지만 고백혈구증가증으로 인한 합병증이 발생할 수 있음을 고려하여야 한다. 이에 따라 치료적 성분채집술은 환자의 상태 및 질병의 원인에 따라 적절한 채집 방식을 선택하고 신속히 시행하여 환자의 증상을 호전시키도록 노력할 필요가 있다.
Go to :








 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download