Abstract
Desmoid fibromatosis is a very slowly growing benign fibroblast tumor. Locally aggressive and non-metastasizing, it is a well-differentiated, unencapsulated monoclonal myofibroblastic proliferation that has a tendency for local invasion and recurrence. About 15% of all desmoidtype fibromatosis develops within the head and neck. The majority of head and neck desmoid tumor is located in the neck, but less frequently in the face, scalp, oral cavity, mandible, paranasal sinuses, orbit, ear and other structures. We report a very rare case in a 55-year-old female of a desmoid fibromatosis arising from the lateral nasal wall of anterior portion of uncinated process. We discuss the clinicopathologic features and successful treatment of nasal desmoid tumor with a literature review.
횡문근 형태의 섬유종(desmoid-type fibromatosis) 또는 데스모이드 섬유종증은 근건막 기질 요소에서 기원하여 매우 천천히 자라는 양성 섬유아세포 종양이다[1]. 다른 부위로 전이되지 않기에 악성으로 분류되지 않으나 국소 재발을 잘하며, 인접한 주위 조직이나 기관을 공격적으로 침범하는 특징을 가진다. 발생 부위에 따라 복강 내, 복부, 복강 외 데스모이드 섬유종증으로 나눌 수 있으며 복부 및 복강 내 데스모이드 섬유종증이 2/3로 더 흔하다[1]. 두경부에서 발생하는 데스모이드 섬유종증은 약 15%로 드문 편이며, 그중 가장 흔한 발생 부위는 경부이고, 다음으로는 얼굴, 구강, 두피 및 부비동 순으로, 비강에서는 극히 드문 것으로 알려져 있다. 좌측 코막힘을 주소로 내원한 55세 여자 환자의 비강 내 구상돌기 전방 비측벽에서 기원하는 데스모이드 섬유종증을 경험하였기에 임상적 특징과 진단 및 치료에 대해 문헌 고찰과 함께 보고하고자 한다.
환자는 55세 여자로 내원 1달 전부터 생긴 코막힘을 주소로 내원하였다. 환자는 과거력상 유방암으로 호르몬 억제제 복용력 외에 특이 병력은 없었다. 내원 당시 시행한 내시경 검사에서 좌측 비강 안에 비강 입구부터 폐쇄하고 있는 백색의 견고한 종물이 관찰되었다(Fig. 1A). 조영증강 CT에서 좌측 비강 전정부터 중비갑개 전방까지 공간을 점유하는 1.5×2.6×3.5 cm의 비균질하게 조영증강되는 종양이 발견되었으며, 하비갑개와 중비갑개는 종괴 효과로 인해 압박성 미란 및 변형을 보이고 있었다(Fig. 1B). CT 판독에서 신경성 종양이나 악성종양 전이 등의 감별이 필요하다는 소견을 받았고, 외래에서 이를 감별하기 위해 술전 조직검사를 시행하였고, 육아종이나 악성 세포가 보이지 않는다는 소견만이 확인되었다. 치료 및 정확한 조직학적 진단을 위해 내시경하 비강 종물 절제술을 시행하였다. 전신마취하에 내시경 부비동 수술로 종물을 enbloc으로 절제하였는데 비강 입구보다 큰 견고한 종물이라 나오지 않아 2조각으로 분리하여 비강 밖으로 제거하였고, 종물의 기원부위는 좌측 구상돌기 전방의 비강 측벽으로 확인되었다. 종물의 부착부는 비루관이 노출될 때까지 주위 비점막과 함께 얇아진 골편을 포함하여 제거하였고 전기소작 하였다(Fig. 2). 특수면역화학염색상 β-catenin 양성, CD35, desmin, smooth muscle actin, S-100, androgen receptor는 음성 소견을 보여, 최종적인 병리조직 진단은 desmoid-type fibromatosis indeterminate margin으로 나왔다(Fig. 3). 환자는 4년 지난 시점까지 특별한 증상이나 재발 소견없이 연 1회 외래 추적 관찰 중이다.
두경부에서 발생하는 데스모이드 섬유종증은 전체 데스모이드 종양의 약 7%-15%를 차지하고, 경부, 얼굴, 구강 내, 두피, 부비동 순으로 알려져 있고 상악동 및 하악이 쉽게 이환된다[2]. 일반적으로 15세에서 60세 사이에 발생하나 두경부 데스모이드 섬유종증은 소아에서 조금 더 흔히 발생한다[3]. 남성에 비해 여성에서 약간 더 흔하며 인종 분포에는 큰 차이를 보이지 않는다[4].
데스모이드 섬유종증은 주변 조직을 국소 침범을 잘하며, 완전한 제거가 힘들고 제거 후에도 재발을 잘하는 것이 특징이지만 다른 장기로 전이되지 않아 악성 가능성은 없는 것이 특징이다. 발병 원인으로 두경부 영역에서는 과거 수술력 혹은 외상으로 미성숙 섬유아세포가 증식하면서 종양을 형성한다는 가설과 임신 혹은 에스트로겐 등 호르몬에 의해 발생한다는 가설도 있다[5]. 또한 대다수의 데스모이드 섬유종증은 β-catenin gene (체세포 CTNNB1, T41A, S45F, S45P, S45N 돌연변이)과 연관되어 있고, 나머지는 생식세포 adenomatous polyposis coli (APC) 유전자 돌연변이와 가드너증후군, 가족성 선종성 용종증과 연관되어 있어 유전학적 발생 가설도 있다[6]. 데스모이드 섬유종증의 진단은 어려우나 β-catenin에 대한 면역조직화학염색이 중요한 도구가 될 수 있다. 대부분의 APC 유전자 돌연변이 연관성 데스모이드 섬유종증은 복강 내이고 두경부에는 흔하지 않다[6].
데스모이드 섬유종증은 임상적으로 무증상이며 단단하고 천천히 자라는 종괴의 형태로 나타나고, 어느정도 크기가 커지면 인접 구조물을 압박하여 이로 인한 압박 증상이 가장 흔하다. 본 증례와 같이 비강 내에 생길 경우 처음에는 무증상이나 점점 크기가 커지면서 코막힘, 코피, 안면 통증을 유발할 수 있다.
CT 또는 MRI와 같은 영상 검사들이 수술 전 수술의 범위를 결정하는 데 도움이 된다. MRI의 경우 연조직에 대한 해상도가 우수하고 조영제에 대한 노출이 없어 특히 소아 데스모이드 섬유종증에서 유용하다. 매끄럽거나 소엽형으로 경계가 분명한 종양으로 보이며, T2-강조영상에서는 균질하게 또는 비균질하게 조영 증강되면서 림프절과 비교했을 때 저강도 또는 등강도 신호를 보이고, 확산강조영상(diffusion weighted imaging)에서 확산 계수가 더 높다[7,8]. CT는 조영 전 및 조영 후 영상 모두에서 다양한 감쇠를 나타내며 연조직 특성이 잘 평가되지 않으나, 골 미란, 골의 재형성 등을 입증하는 데 유용하다[7].
데스모이드 섬유종증의 진단을 위해서는 병리조직학적 확진이 필요한데 조직학적으로 풍부한 섬유기질 안에 근섬유모세포의 방추세포 증식이 있는 것이 특징이다[9]. 근섬유모세포는 병변의 주변부를 침범하는 경향이 있고 세포 밀도는 낮다. 조직학적으로 세포 밀도가 높은 경우 섬유육종으로 오진될 수도 있지만, 데스모이드 섬유종증은 핵 비대, 다형성 또는 과염색증과 같은 악성 종양의 세포학적 특징이 없고 이상 유사분열이나 괴사소견이 없는 것으로 섬유육종 및 악성종양과 감별할 수 있다[10].
데스모이스 섬유종증의 치료는 종양의 완전 적출을 목적으로 하는 광범위한 수술적 제거이다. 하지만 최근 연구에 따르면 자발적으로 퇴행하는 경우가 27% 정도 보고되어 무증상일 경우 적절히 추적 관찰하면서 기다리는 능동 감시를 초치료로 시행할 수 있다[11,12]. 하지만 대부분 수술이 필요하며, 주요 구조물들이 근처에 있을 경우 사망률 증가나 기능적 장애를 초래할 수 있고, 그런 경우에는 중요한 구조물들을 보존하면서 최대한 종괴를 절제하는 보존적 절제를 시행해야 하는데 주위 조직으로의 침윤으로 종괴의 완전한 적출이 어려울 경우에는 재발률이 올라간다.
데스모이드 섬유종증이 양성병변임에도 주변 조직을 침윤하는 특성으로 방사성 치료는 종양의 위치적 한계에 의한 절제가 불가능한 경우, 수술 치료가 불가능한 내과 질환이 있는 경우, 종양이 남은 경우, 절제면 양성, 종양의 재발 등의 경우에 적응증을 가지나 일차 치료로서 권유되지는 않는다. 또한 현미경적 양성 절제면을 가진 데스모이드 섬유종증에 대해 술후 방사선 요법의 치료효과에 대해서는 아직 논란이 있다. 본 증례에서는 불확실한 경계소견(indeterminate margin)으로 나왔으나 제거 시 종물의 부착부는 비루관이 노출될 때까지 주위 비점막과 함께 얇아진 골편을 포함하여 제거하였고 전기소작하여 완전히 제거하여 추가적인 방사선 치료는 시행하지 않았다. 그 외에도 수술적 절제가 불가한 데스모이드 섬유종증이나 수술을 받기 힘들 정도로 전신상태가 불량할 경우 보조요법을 시행할 수 있다[13]. 보조요법은 항암 화학 요법, 스테로이드, 항에스트로겐 제제(tamoxifen), 비스테로이드성 항염증제(sulindac), tyrosine kinase inhibitor (pazopanib)를 포함하고 있다[2,13]. 하지만 두경부 데스모이드 섬유종증의 발생률이 매우 적어 보조요법의 효과를 입증할 대규모 연구가 부족한 상태로 보조요법의 효과는 아직 명백하게 증명되지 않았다.
이러한 치료에도 불구하고 40년간의 문헌 고찰을 다룬 논문에서 두경부 데스모이드 섬유종증의 국소 재발률은 30%에 이르며, 대부분 두경부에서의 재발은 일반적으로 초기 2년 안에 일어난다고 알려져 있지만, 재발 기간은 수개월에서 10년 이상 되는 경우도 있어 최소 2년 동안은 면밀한 추적 관찰이 필요하다[2]. 국소 재발 시 재절제가 가장 국소 종양 제어에 우수하며, 불완전 절제 시 크기가 작은 경우 자연 소멸하거나 성장이 멈추는 경우를 기대해볼 수 있고, 성장하는 경우 방사선 치료를 고려할 수 있다[4].
본 증례에서 저자들은 드물게 발생하는 비강 내 구상돌기 전방의 비강 측벽에서 기원한 데스모이드 섬유종증을 내시경 부비동 수술로 절제 후 4년 추적 관찰 시 재발 소견 없이 연 1회 추적 관찰 중인 드문 증례를 경험하여 보고하는 바이다.
REFERENCES
1. de Bree E, Keus R, Melissas J, Tsiftsis D, van Coevorden F. Desmoid tumors: Need for an individualized approach. Expert Rev Anticancer Ther. 2009; 9(4):525–35.
2. de Bree E, Zoras O, Hunt JL, Takes RP, Suárez C, Mendenhall WM, et al. Desmoid tumors of the head and neck: A therapeutic challenge. Head Neck. 2014; 36(10):1517–26.
3. Alherabi AZ, Marglani OA, Bukhari DH, Al-Khatib TA. Desmoid tumor (fibromatosis) of the head and neck. Saudi Med J. 2015; 36(1):101–3.
4. Wang CP, Chang YL, Ko JY, Cheng CH, Yeh CF, Lou PJ. Desmoid tumor of the head and neck. Head Neck. 2006; 28(11):1008–13.
5. Yim CD, Kim JP, Woo SH. A case of desmoid-type fibromatosis occurring around the transverse process of cervical vertebra. Korean J Otorhinolaryngol-Head Neck Surg. 2018; 61(3):156–9.
6. Sideris A, Fuzi J, Jacobson I, Wong W, Havas T. Desmoid tumours of the head and neck: An Australian case series. Aust J Otolaryngol. 2020; 3:32.
7. Rhim JH, Kim JH, Moon KC, Park SW, Sohn CH, Choi SH, et al. Desmoid-type fibromatosis in the head and neck: CT and MR imaging characteristics. Neuroradiology. 2013; 55(3):351–9.
8. Oka K, Yakushiji T, Sato H, Fujimoto T, Hirai T, Yamashita Y, et al. Usefulness of diffusion-weighted imaging for differentiating between desmoid tumors and malignant soft tissue tumors. J Magn Reson Imaging. 2011; 33(1):189–93.
9. Kasper B, Baumgarten C, Garcia J, Bonvalot S, Haas R, Haller F, et al. An update on the management of sporadic desmoid-type fibromatosis: A European Consensus Initiative between Sarcoma PAtients EuroNet (SPAEN) and European Organization for Research and Treatment of Cancer (EORTC)/Soft Tissue and Bone Sarcoma Group (STBSG). Ann Oncol. 2017; 28(10):2399–408.
10. Ko JS, Joo YH, Kim JP, Woo SH. A case of desmoid-type fibromatosis that was taken for recurred papillary thyroid cancer. Korean J Otorhinolaryngol-Head Neck Surg. 2011; 54(2):162–5.
11. van Houdt WJ, Husson O, Patel A, Jones RL, Smith MJF, Miah AB, et al. Outcome of primary desmoid tumors at all anatomic locations initially managed with active surveillance. Ann Surg Oncol. 2019; 26(13):4699–706.
12. Desmoid Tumor Working Group. The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer. 2020; 127:96–107.
13. von Mehren M, Kane JM, Bui MM, Choy E, Connelly M, Dry S, et al. NCCN guidelines insights: soft tissue sarcoma, version 1.2021. J Natl Compr Canc Netw. 2020; 18(12):1604–12.
Fig. 1.
Endoscopic and CT findings. A: Endoscopic examination of the mass in the left nasal cavity shows pink-white mass obstructing left nasal vestibule. B: Coronal view of CT images reveals inhomogeneously enhancing soft tissue mass lesion from left anterior nasal vestibule to middle meatus eroding adjacent inferior and middle concha with pressure erosion and remodeling.
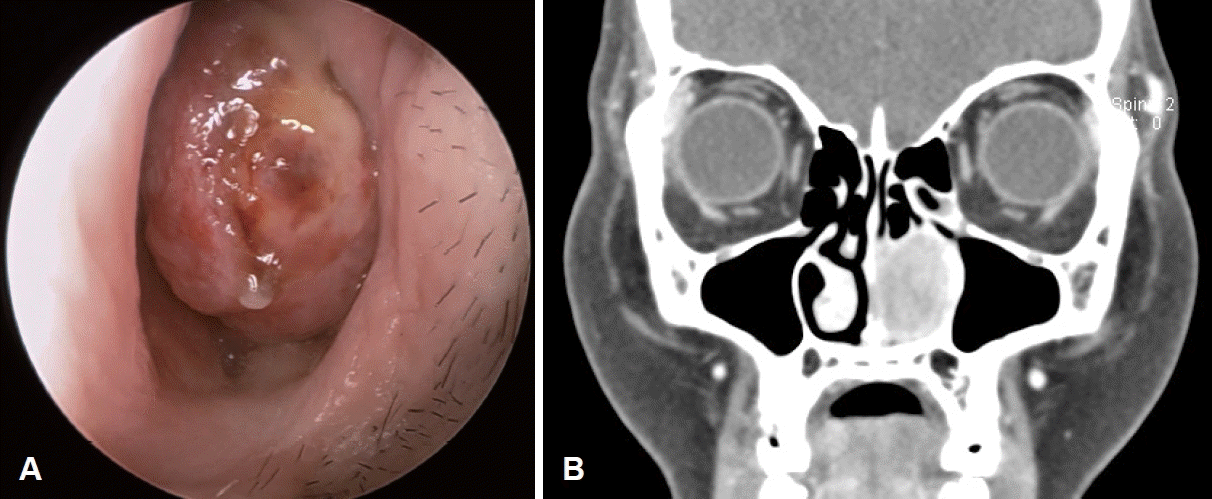
Fig. 2.
Endoscopic view after the removal of mass. The mass was identified to originate from the lateral nasal wall anterior to left uncinate process. It was removed for the attachment site of mass including surrounding nasal mucosa and thin bone fragment until the nasolacrimal duct was exposed (star: left lacrimal duct).
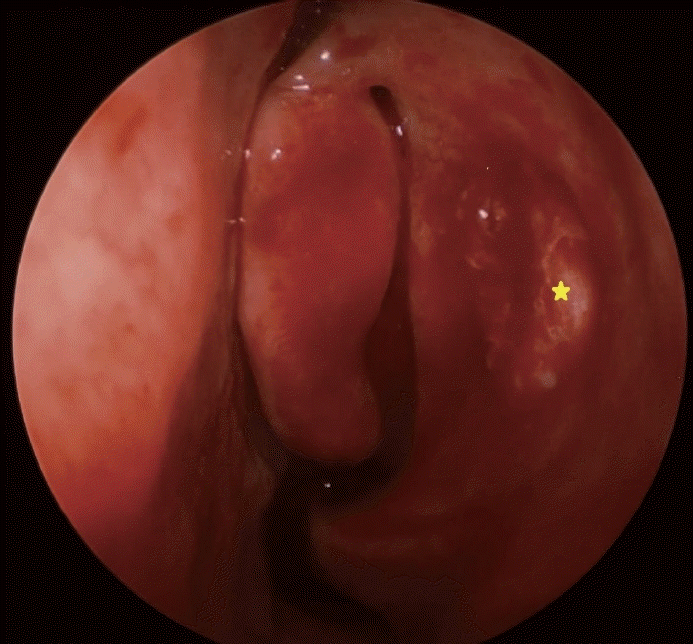
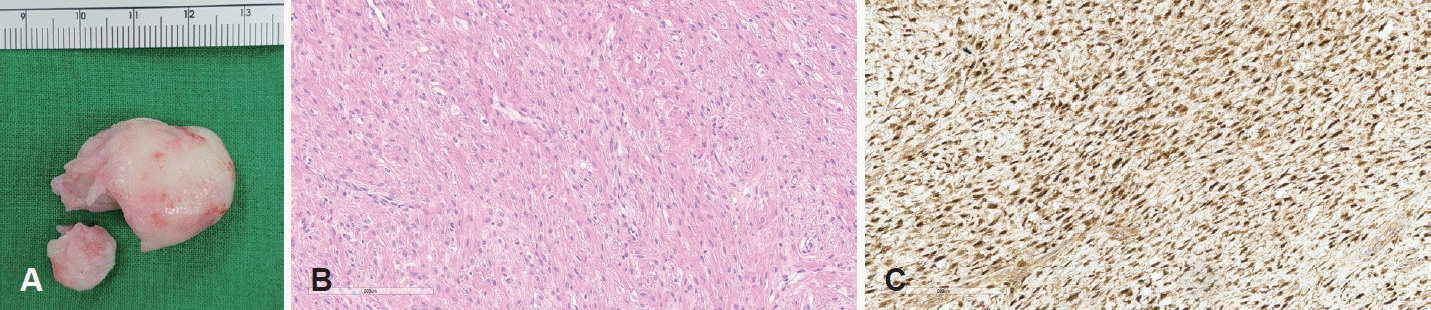
Fig. 3.
Gross and histopathologic findings. A: Gross view of whitish hard mass after endonasal resection, which was separated into two pieces to be pulled out due to larger size than the nasal entrance. B: Histopathological image showing elongated, spindle-shaped cells forming fascicular pattern in a myxoid stroma (hematoxylin and eosin, ×200). C: Immunohistochemistry staining of positive expression on β-catenin that shows positive, diffuse, myofibroblast nuclear staining with faint cytoplasmic staining, which is characteristic of desmoid type fibromatosis (×200).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download