Abstract
The preservation of the parathyroid gland during thyroid surgery is still challenging; Intraoperative detection of parathyroid glands using near-infrared autofluorescence (NIRAF) has been recently introduced as a solution. NIRAF is noninvasive and it can be applied without contrast dye. Recently, increasing number of studies using NIRAF to detect parathyroid glands under normal or hyperparathyroidism state have been reported, and commercialized products of the imaging devices or probe systems have been produced. NIRAF imaging is also useful to find unrevealed parathyroid gland tissues before exposure, and early localization reduces unintended removal or blood vessel damage of parathyroid glands. It has been reported that this technique significantly decreases the incidence of early postoperative hypocalcemia.
갑상선 수술 후 저칼슘혈증의 발생률은 일시적인 경우와 영구적인 경우 각각 약 15-38%, 0-7%로 발생한다.1-3) 또, 갑상선절제술 후 6개월 또는 12개월이 지나더라도 기능이 회복되지 않는 것으로 정의되는 영구적 부갑상선기능저하증(hypoparathyroidism)은 대규모 코호트 연구에서 12.5%까지 보고되었다.4) 수술 후 부갑상선기능저하증은 입술 주위의 감각이 저하되거나 손가락, 발가락이 저리는 증상, 불안감 등 가벼운 증상에서부터 심한 경우에는 경련, 후두 경련, 심부전, 심정지, 그리고 혼동, 환각 등 정신학적인 이상 증상까지 발생할 수 있다. 또, Almquist 등5)에 의하면 갑상선 전절제술 후 영구적인 부갑상선기능 저하증이 발생하면 그렇지 않은 경우에 비해 사망률이 약 2배 증가할 수 있다고 한다.
이처럼 Theodor Kocher (1841-1917)가 갑상선수술 방법을 체계화한지 이미 100년 이상이 훨씬 지난 현재까지도 부갑상선의 보존은 여전히 어려운 문제로 남아있다. 그 이유는 정상 부갑상선이 크기가 매우 작고 주변 지방 조직이나 림프절과 색상 및 모양이 비슷하므로 아무리 조심스럽게 수술을 해도 초심자의 경우 부주의하게 부갑상선을 절제할 위험이 항상 존재하기 때문이다.6) 뿐만 아니라, 숙련된 외과의가 갑상선절제술 시 본인은 부갑상선을 잘 보존하였다고 생각하고 수술을 마친 경우라 하더라도, 실제 수술 후 검체 조직검사에서는 22%까지 부갑상선이 확인되고 있다.7) 이것은 현재 부갑상선을 보존하기 위해 일상적으로 시행되고 있는 갑상선의 피막하 박리술(subcapsular dissection)과 외과의의 시각적 판단만으로는 부갑상선 기능의 보존이 충분하지 않다는 것을 의미한다.
수술 중 부갑상선 여부를 확인하는 확실한 방법은 의심되는 조직을 일부 떼어내어 동결 절편검사를 해보는 것이지만 이것은 정상조직의 손상과 시간 또는 비용 등의 부가적인 문제 등이 있어서 실제 수술 현장에서 널리 사용되지 않는다.8) 수술 중에 적용할 수 있는 다른 방법으로 부갑상선에 특이적으로 반응하는 염색 재료를 이용한 방법도 소개되었다. 이를테면, 1970년대에 methylene blue를 이용한 부갑상선 염색법이 소개되었는데 술자가 육안으로 부갑상선을 찾을 때와 비교하여 그 결과가 그다지 우수하지 않았고 신경독성 가능성이 있다는 점에서 널리 적용되지는 않았다.9,10) 그 이후 2006년도에 aminolevulinic acid를 이용한 연구가 소개되었는데, 마찬가지로 결과가 일정하지 않고(실패율 50%), 체내 주입 후 광과민 반응을 피하기 위해 48시간 이상 빛으로부터 격리되어야 하는 현실적인 어려움이 있다.11) 99m-Technetium을 이용한 핵의학적인 방법은 환자의 50% 이하에서 효과가 있고 방사선 노출이 심각하다는 단점이 있다.12) 또한 최근에는 optical coherence tomography (OCT)의 휴대용 probe를 사용하여 69%의 민감도와 66%의 특이도로 수술 중 PG 식별이 가능하다는 보고도 있고,13) dynamic optical contrast imaging (DOCI) 및 Raman 분광법과 같은 도구도 소개되었지만 그 유용성에 대해서는 좀 더 연구가 되어야 한다.14,15)
이처럼 많은 연구자들이 수술 중 실시간으로 부갑상선을 찾는 방법을 연구하던 중, 근적외선 자가형광(near infrared autofluorescence, NIRAF)을 이용하면 부갑상선을 확인할 수 있다는 가능성이 2011년부터 보고되기 시작하였다.16)
NIRAF을 이해하기 위해서는 자가형광(autofluorescence, AF)에 대한 약간의 광학적인 지식이 필요하다. 일반적으로 인체 내의 어떤 생물학적 형광단(biological fluorophore)이 외부로부터 빛을 받으면 바닥상태에 있던 전자가 들뜬 상태가 되어 에너지 준위가 올라가게 되고 이어서 극히 짧은 순간에 이 전자가 다시 고유의 에너지 상태로 돌아간다. 이때 에너지를 발산하면서 자극을 받은 빛보다 약간 더 긴 파장의 빛을 발산(emission)하는데 이 빛을 자가형광이라고 한다. 즉, 부갑상선에 근적외선의 범위에 있는 785 nm의 NIR light를 비추어 주었을 때 이 빛을 받은 부갑상선은 그 내부에 존재하는 형광단을 통해 자극을 받은 785 nm보다 긴 파장인 822 nm의 자가형광인 NIRAF를 발하게 된다(Fig. 1).
NIRAF의 발견은 2007년 미국 Vanderbilt 대학병원 외과 전공의 1년차 Lisa White가 전공의로서 처음으로 참여하였던 갑상선 수술에서 부갑상선을 찾는 것이 어렵다는 것을 알게 되었고, 부갑상선을 보다 더 잘 찾을 수 있는 방법을 알아보고자 Biomedical Engineering 학부의 Anita Mahadevan-Jansen과 함께 한 광학적인 연구에서 시작되었다. 그는 Raman spectroscopy를 통해 부갑상선이 경부의 주변 장기에 비해 매우 강한 형광이 있음을 발견하게 되었다. 이후 연구를 통해, 785 nm의 근적외선(near infrared) 빛을 경부에 비추면, 822 nm에서 갑상선에서는 약한 자가형광, 부갑상선에서는 아주 강한 형광을 보인 반면에 지방, 근육, 기관 등의 수술 부위 내의 장기에서는 자가형광이 관찰되지 않음을 알게 되었고 이것을 2011년도에 발표하였다(Fig. 2).16) 부갑상선과 주변조직과의 자가형광 강도를 비교하면 부갑상선은 주변 조직보다 2-11배 더 밝게 나타났다.16,17) 이것은 근적외선을 잘 활용하면 부갑상선을 다른 장기들과 감별할 수 있다는 대단히 중요한 결과이고, 이후 현재까지 NIRAF와 관련된 부갑상선의 수술 중 실시간 확인은 모두 이 결과를 토대로 연구된 것이다.
부갑상선의 NIRAF는 외부의 빛을 받아 부갑상선 내부에서 자연적으로 발생하는 형광이기 때문에 외부 조영제의 도움이 필요 없는 장점이 있다. 이처럼 어떤 분자로 하여금 형광을 내게 하는 물질을 형광단이라고 한다. 그러면 부갑상선으로 하여금 NIRAF를 방출하게 하는 형광단은 무엇일까? 많은 연구가 진행이 되었지만, 아직까지 어떤 분자가 자가형광을 만들어내는지 정확하게 밝혀지지 않은 상태이다. 하지만, 부갑상선내에 존재하는 secretory granule이나 calcium sensing receptor가 후보물질로 추정된다.17)
현재 외부 조영제를 사용하지 않고 부갑상선을 식별하는 NIRAF technique은 2가지 형태가 있는데, 그 중에 하나는 이미징(imaging)이고 다른 하나는 NIRAF spectroscopic fiber probe이다. 이 중 상용화된 NIRAF 이미징 장비는 Fluobeam 800Ⓡ, Fluobeam LXⓇ, PDE Neo IIⓇ 등이고, probe system으로 상용화된 것은 PTeyeⓇ이다. 저자의 연구팀은 NIRAF imaging과 probe system 모두를 연구, 개발을 해 왔으며, 현재 상용화를 준비하고 있다(Fig. 3). 특히, 최근 5년 사이에 국외에서는 갑상선, 부갑상선 수술 시 NIRAF를 이용하여 정상 부갑상선이나 기능 항진을 일으키는 부갑상선을 수술 중 실시간으로 확인해보자는 연구들이 급증하고 있다.21-24) 또 우리나라에서도 2021년에 ‘근적외선 자가형광 부갑상선 탐색술’이 신의료기술로 인정이 되어 앞으로 부갑상선의 자가형광을 통한 부갑상선의 위치를 확인하는 기법이 점차 활성화될 전망이다.
현재까지 상용화된 장비를 간단히 소개하면, Fluobeam 800Ⓡ은 hand-held type으로 부갑상선과 주변 조직을 보여줄 수 있고, 또, indocyanine green (ICG)을 투여하면 부갑상선의 관류(perfusion) 상태를 평가할 수 있다는 장점도 있다. 그러나 Fluobeam 800Ⓡ은 여러 가지 제한 사항도 있는데 그 중의 하나는 부갑상선의 자가형광의 강도가 아주 약하기 때문에 이미징하는 동안 수술실의 무영등, 실내등과 같은 조명을 꺼야만 촬영이 가능하다는 것이다. 이것은 수술실내에서의 작업 흐름을 방해할 수 있다는 단점이 있다. 최근에 새로 나온 Fluobeam LXⓇ는 이러한 단점을 보완하였다(Table 1). PDE Neo IIⓇ도 Fluobeam과 기본적으로 비슷한 구성을 하고 있으며 Fluobeam과 유사한 장점과 한계가 있다. PTeyeⓇ는 펜 모양의 fiber optic probe를 사용하여 auditory feedback과 함께 정량적인 정보를 제공하는 장점이 있다. PTeyeⓇ는 수술실 무영등 하에서도 작동을 한다는 장점이 있는 반면에, 카메라를 사용하기 않기 때문에 수술부위의 field view를 볼 수 없다는 단점도 있다(Table 1).
NIRAF로 부갑상선을 식별하는 소견은 저자의 교실에서 제작한 장비를 사용하여 Fig. 4에 기술하였다. 여러 연구에 의하면, probe-based systems으로 수술 중 부갑상선을 확인할 수 있는 정확도는 92-96%라고 보고되어 있고,24-26) NIRAF imaging은 90-100% 민감도와 정확도로 부갑상선을 90-100%에서 식별할 수 있는 것으로 보고되고 있다.20,23,26,27) 그러나 이들 대부분의 연구는 수술 중에 외과의에 의해 노출된 부갑상선으로 예측되는 구조물이 정말 부갑상선인지 아닌지 여부를 확인하는데 보조적으로 활용된 것이라고 할 수 있다.
앞서 기술한 바와 같이 갑상선 수술 중에 노출되는 구조물이 지방인지 림프절인지 갑상선 조직인지 혹은 부갑상선인지 애매한 경우에 NIRAF를 사용하면 이들 구조물을 구분하는데 도움이 된다. 하지만, NIRAF imaging을 이용한 부갑상선의 이미징이 외과의에게 정말 더 큰 도움을 주기 위해서는 지방이나 결체조직에 의해 덮여 아직 외과의의 눈으로는 발견할 수 없는 부갑상선을 이미징으로 조기에 발견할 수 있어야 할 것이다. 저자는 overlying tissue에 의해 육안으로 보이지 않는 부갑상선을 NIRAF imaging으로 찾는 과정을 ‘parathyroid gland mapping’이라고 명명하고 그 가능성을 집중적으로 연구하였다.22) 그 결과 저자들은 Fig. 5에 기술되어 있는 것처럼 눈으로 보이지 않는 부갑상선 70개의 부갑상선 중에서 64개(92%)에서 mapping으로 조기에 국소화(localization) 하는 것이 가능함을 보고하였다.22) 이러한 결과는 Fluobeam 800Ⓡ의 mapping rate인 46%보다 2배 높은 좋은 결과였다.27) 이처럼 지방이나 결체조직에 덮여 있는 부갑상선의 위치를 눈보다 먼저 미리 예측할 수 있는 이유는 NIR light가 가시광선보다 수 millimeter 더 깊게 조직을 투과할 수 있기 때문이다.28) 일상의 갑상선 수술에서 mapping으로 조기에 부갑상선의 위치를 파악할 수 있다면 부갑상선의 조작을 최소화하여 우발적으로 혈관에 손상을 주거나 혹은 부갑상선을 제거하는 경우를 피할 수 있을 것이다.
단일 기관 및 다기관 무작위 임상시험에서 NIRAF imaging 시스템은 수술 후 초기 저칼슘혈증의 비율을 감소시키는 것으로 나타났다.21,29) 최근 가장 큰 무작위 임상시험 연구(n=241)에서 수술 후 일시적인 저칼슘혈증의 빈도는 NIRAF에서 9.1%, 대조군에서 21.7%로 NIRAF 사용군에서 저칼슘혈증을 예방하는데 효과가 있었다(p=0.007).29) 최근 저자는 갑상선암을 대상으로 숙련된 외과의가 시행한 갑상선전절제술과 중심경부절제술에서 NIRAF imaging을 사용한 261명과 육안으로 대조군 281명을 비교한 결과 NIRAF imaging을 사용한 군에서 일시적인 부갑상선기능저하증의 빈도가 낮았고, 또 부주의한 부갑상선의 절제도 적었다는 결과를 보고하였다.30)
근적외선 이미징 장비는 자가형광을 이용하여 부갑상선을 확인하는 기본적인 기능 이외에도, 자가형광 대신 ICG를 사용함으로써 부갑상선의 혈관경(vascular pedicle) 상태(real-time vascular mapping)와 관류(perfusion) 상태를 평가할 수 있다.32,33) 만약, 갑상선 박리의 초기 단계에서 NIRAF imaging camera를 이용하여 지방이나 결체조직 내부에 숨어 있는 부갑상선을 자가형광으로 매핑(parathyroid gland mapping)하고 이를 토대로 부갑상선의 혈관경을 보존하고, 수술의 마무리 단계에서 ICG를 사용한 관류를 평가할 수 있다면 가장 이상적인 부갑상선 확인, 보존, 술 후 기능 예측이 가능할 것이다.
References
1. Duclos A, Peix JL, Colin C, Kraimps JL, Menegaux F, Pattou F, et al. 2012; Influence of experience on performance of individual surgeons in thyroid surgery: prospective cross sectional multicentre study. BMJ. 344:d8041. DOI: 10.1136/bmj.d8041. PMID: 22236412. PMCID: PMC3256252.

2. Edafe O, Antakia R, Laskar N, Uttley L, Balasubramanian SP. 2014; Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. Br J Surg. 101(4):307–20. DOI: 10.1002/bjs.9384. PMID: 24402815.

3. Tang JA, Salapatas AM, Bonzelaar LB, Friedman M. 2018; Parathyroidectomy for the treatment of hyperparathyroidism: thirty-day morbidity and mortality. Laryngoscope. 128(2):528–33. DOI: 10.1002/lary.26604. PMID: 28493416.

4. Annebäck M, Hedberg J, Almquist M, Stålberg P, Norlén O. 2021; Risk of permanent hypoparathyroidism after total thyroidectomy for benign disease: a nationwide population-based cohort study from Sweden. Ann Surg. 274(6):e1202–e8. DOI: 10.1097/SLA.0000000000003800. PMID: 32032086.
5. Almquist M, Ivarsson K, Nordenstrom E, Bergenfelz A. 2018; Mortality in patients with permanent hypoparathyroidism after total thyroidectomy. Br J Surg. 105(10):1313–8. DOI: 10.1002/bjs.10843. PMID: 29663312.

6. Shaha AR, Jaffe BM. 1998; Parathyroid preservation during thyroid surgery. Am J Otolaryngol. 19(2):113–7. DOI: 10.1016/S0196-0709(98)90106-5. PMID: 9550443.

7. Park J-W. 2014; Preservation of parathyroid glands during thyroid surgery. Clin Exp Thyroidol. 7(2):149–52. DOI: 10.11106/cet.2014.7.2.149.

8. McWade MA, Paras C, White LM, Phay JE, Mahadevan-Jansen A, Broome JT. 2013; A novel optical approach to intraoperative detection of parathyroid glands. Surgery. 154(6):1371–7. discussion 7DOI: 10.1016/j.surg.2013.06.046. PMID: 24238054. PMCID: PMC3898879.

9. Patel HP, Chadwick DR, Harrison BJ, Balasubramanian SP. 2012; Systematic review of intravenous methylene blue in parathyroid surgery. Br J Surg. 99(10):1345–51. DOI: 10.1002/bjs.8814. PMID: 22961511.

10. Tummers QR, Schepers A, Hamming JF, Kievit J, Frangioni JV, van de Velde CJ, et al. 2015; Intraoperative guidance in parathyroid surgery using near-infrared fluorescence imaging and low-dose Methylene Blue. Surgery. 158(5):1323–30. DOI: 10.1016/j.surg.2015.03.027. PMID: 25958068. PMCID: PMC4603995.

11. Prosst RL, Gahlen J, Schnuelle P, Post S, Willeke F. 2006; Fluorescence-guided minimally invasive parathyroidectomy: a novel surgical therapy for secondary hyperparathyroidism. Am J Kidney Dis. 48(2):327–31. DOI: 10.1053/j.ajkd.2006.05.002. PMID: 16860201.

12. Grubbs EG, Mittendorf EA, Perrier ND, Lee JE. 2008; Gamma probe identification of normal parathyroid glands during central neck surgery can facilitate parathyroid preservation. Am J Surg. 196(6):931–5. discussion 5–6. DOI: 10.1016/j.amjsurg.2008.07.026. PMID: 19095112.

13. Sommerey S, Al Arabi N, Ladurner R, Chiapponi C, Stepp H, Hallfeldt KK, et al. 2015; Intraoperative optical coherence tomography imaging to identify parathyroid glands. Surg Endosc. 29(9):2698–704. DOI: 10.1007/s00464-014-3992-x. PMID: 25475518.

14. Das K, Stone N, Kendall C, Fowler C, Christie-Brown J. 2006; Raman spectroscopy of parathyroid tissue pathology. Lasers Med Sci. 21(4):192–7. DOI: 10.1007/s10103-006-0397-7. PMID: 17024320.

15. Kim IA, Taylor ZD, Cheng H, Sebastian C, Maccabi A, Garritano J, et al. 2017; Dynamic optical contrast imaging. Otolaryngol Head Neck Surg. 156(3):480–3. DOI: 10.1177/0194599816686294. PMID: 28116982.
16. Paras C, Keller M, White L, Phay J, Mahadevan-Jansen A. 2011; Near-infrared autofluorescence for the detection of parathyroid glands. J Biomed Opt. 16(6):067012. DOI: 10.1117/1.3583571. PMID: 21721833.

17. McWade MA, Paras C, White LM, Phay JE, Solorzano CC, Broome JT, et al. 2014; Label-free intraoperative parathyroid localization with near-infrared autofluorescence imaging. J Clin Endocrinol Metab. 99(12):4574–80. DOI: 10.1210/jc.2014-2503. PMID: 25148235. PMCID: PMC4255111.

18. De Leeuw F, Breuskin I, Abbaci M, Casiraghi O, Mirghani H, Ben Lakhdar A, et al. 2016; Intraoperative near-infrared imaging for parathyroid gland identification by auto-fluorescence: a feasibility study. World J Surg. 40(9):2131–8. DOI: 10.1007/s00268-016-3571-5. PMID: 27220510.

19. Ladurner R, Sommerey S, Arabi NA, Hallfeldt KKJ, Stepp H, Gallwas JKS. 2017; Intraoperative near-infrared autofluorescence imaging of parathyroid glands. Surg Endosc. 31(8):3140–5. DOI: 10.1007/s00464-016-5338-3. PMID: 27844237.

20. McWade MA, Sanders ME, Broome JT, Solorzano CC, Mahadevan-Jansen A. 2016; Establishing the clinical utility of autofluorescence spectroscopy for parathyroid detection. Surgery. 159(1):193–202. DOI: 10.1016/j.surg.2015.06.047. PMID: 26454675. PMCID: PMC4836056.

21. Dip F, Falco J, Verna S, Prunello M, Loccisano M, Quadri P, et al. 2019; Randomized controlled trial comparing white light with near-infrared autofluorescence for parathyroid gland identification during total thyroidectomy. J Am Coll Surg. 228(5):744–51. DOI: 10.1016/j.jamcollsurg.2018.12.044. PMID: 30710614.

22. Kim SW, Lee HS, Ahn YC, Park CW, Jeon SW, Kim CH, et al. 2018; Near-infrared autofluorescence image-guided parathyroid gland mapping in thyroidectomy. J Am Coll Surg. 226(2):165–72. DOI: 10.1016/j.jamcollsurg.2017.10.015. PMID: 29122718.

23. Kim SW, Song SH, Lee HS, Noh WJ, Oak C, Ahn YC, et al. 2016; Intraoperative real-time localization of normal parathyroid glands with autofluorescence imaging. J Clin Endocrinol Metab. 101(12):4646–52. DOI: 10.1210/jc.2016-2558. PMID: 27648967.

24. Thomas G, McWade MA, Paras C, Mannoh EA, Sanders ME, White LM, et al. 2018; Developing a clinical prototype to guide surgeons for intraoperative label-free identification of parathyroid glands in real time. Thyroid. 28(11):1517–31. DOI: 10.1089/thy.2017.0716. PMID: 30084742. PMCID: PMC6247985.

25. Thomas G, McWade MA, Nguyen JQ, Sanders ME, Broome JT, Baregamian N, et al. 2019; Innovative surgical guidance for label-free real-time parathyroid identification. Surgery. 165(1):114–23. DOI: 10.1016/j.surg.2018.04.079. PMID: 30442424. PMCID: PMC6380501.

26. Thomas G, Squires MH, Metcalf T, Mahadevan-Jansen A, Phay JE. 2019; Imaging or fiber probe-based approach? Assessing different methods to detect near infrared autofluorescence for intraoperative parathyroid identification. J Am Coll Surg. 229(6):596–608 e3. DOI: 10.1016/j.jamcollsurg.2019.09.003. PMID: 31562910. PMCID: PMC7756928.

27. Kahramangil B, Dip F, Benmiloud F, Falco J, de La Fuente M, Verna S, et al. 2018; Detection of parathyroid autofluorescence using near-infrared imaging: a multicenter analysis of concordance between different surgeons. Ann Surg Oncol. 25(4):957–62. DOI: 10.1245/s10434-018-6364-2. PMID: 29411199.

28. Stolik S, Delgado JA, Perez A, Anasagasti L. Measurement of the penetration depths of red and near infrared light in human "ex vivo" tissues. J Photochem Photobiol B. 2000; 57(2-3):90–3. DOI: 10.1016/S1011-1344(00)00082-8. PMID: 11154088.

29. Benmiloud F, Godiris-Petit G, Gras R, Gillot JC, Turrin N, Penaranda G, et al. 2020; Association of autofluorescence-based detection of the parathyroid glands during total thyroidectomy with postoperative hypocalcemia risk: results of the PARAFLUO multicenter randomized clinical trial. JAMA Surg. 155(2):106–12. DOI: 10.1001/jamasurg.2019.4613. PMID: 31693081. PMCID: PMC6865247.

30. Kim DH, Kim SW, Kang P, Choi J, Lee HS, Park SY, et al. 2021; Near-infrared autofluorescence imaging may reduce temporary hypoparathyroidism in patients undergoing total thyroidectomy and central neck dissection. Thyroid. 31(9):1400–8. DOI: 10.1089/thy.2021.0056. PMID: 33906431.

31. Solórzano CC, Thomas G, Baregamian N, Mahadevan-Jansen A. 2020; Detecting the near infrared autofluorescence of the human parathyroid: hype or opportunity? Ann Surg. 272(6):973–85. DOI: 10.1097/SLA.0000000000003700. PMID: 31804401. PMCID: PMC8670620.
32. Muraveika L, Kose E, Berber E. 2020; Near-infrared fluorescence in robotic thyroidectomy. Gland Surg. 9(Suppl 2):S147–S52. DOI: 10.21037/gs.2019.12.15. PMID: 32175255. PMCID: PMC7044086.

33. Vidal Fortuny J, Karenovics W, Triponez F, Sadowski SM. 2016; Intra-operative indocyanine green angiography of the parathyroid gland. World J Surg. 40(10):2378–81. DOI: 10.1007/s00268-016-3493-2. PMID: 26944954. PMCID: PMC5028398.

34. Hitier M, Cracowski JL, Hamou C, Righini C, Bettega G. 2016; Indocyanine green fluorescence angiography for free flap monitoring: a pilot study. J Craniomaxillofac Surg. 44(11):1833–41. DOI: 10.1016/j.jcms.2016.09.001. PMID: 27745767.

35. Marshall MV, Rasmussen JC, Tan IC, Aldrich MB, Adams KE, Wang X, et al. 2010; Near-infrared fluorescence imaging in humans with indocyanine green: a review and update. Open Surg Oncol J. 2(2):12–25. DOI: 10.2174/1876504101002020012. PMID: 22924087. PMCID: PMC3424734.

Fig. 1
Emission of 822 nm autofluorescence from the fluorophore of the parathyroid gland (arrow) by excitation with 785 nm NIR light.
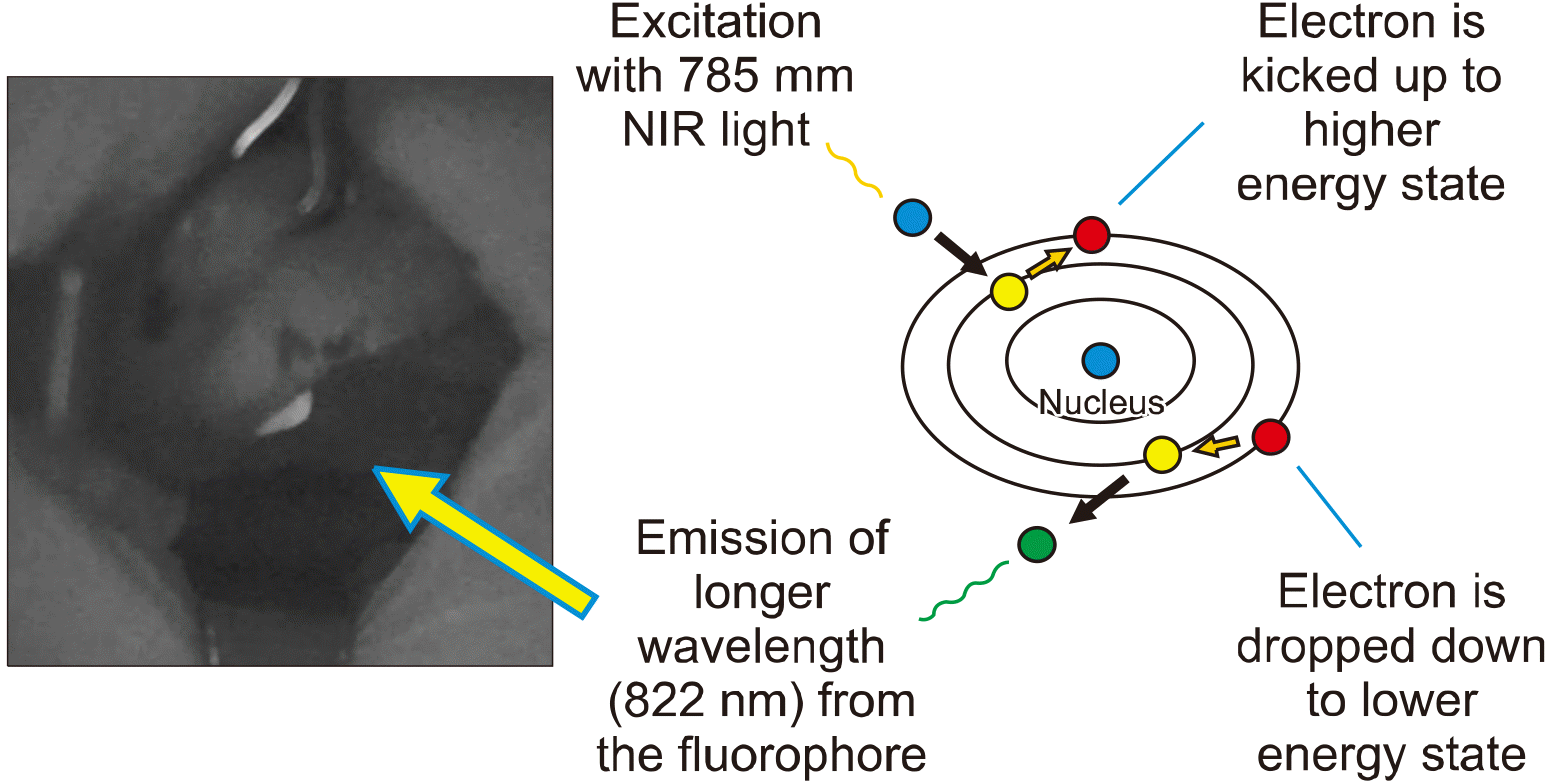
Fig. 2
Fluorescence spectra measured from parathyroid, thyroid fat, muscle and trachea. Near infrared (NIR) light can discriminate the parathyroid gland from surrounding tissues.
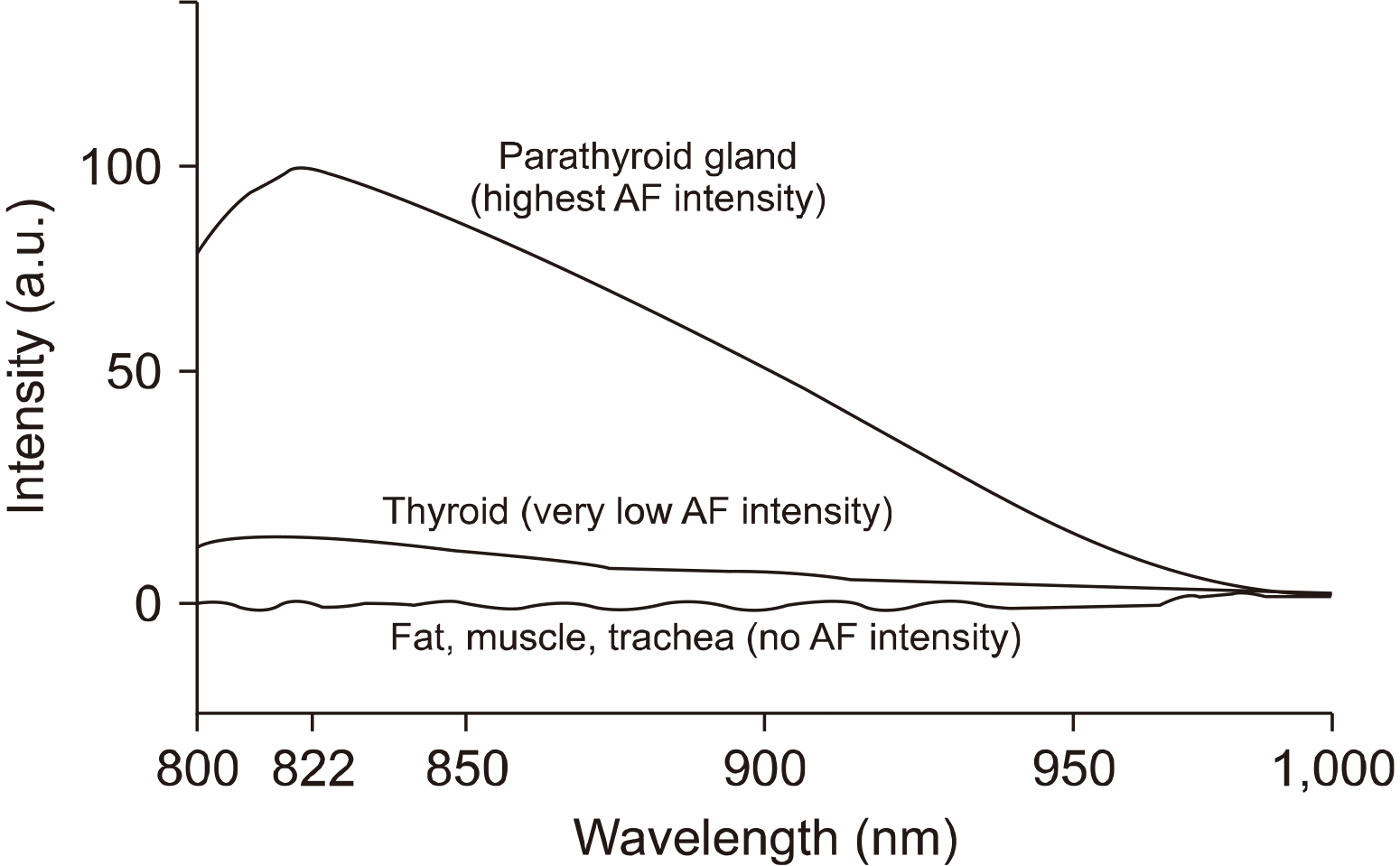
Fig. 3
Author’s laboratory-built NIRAF imaging system to identify parathyroid glands. When NIR light (785 nm) is illuminated to the surgical field (short arrow), the 822 nm of NIRAF is emitted from the fluorophore of parathyroid gland (long arrow) and then the camera detects the NIRAF. No need to use any exogenous contrast dye during the procedure (NIRAF, near-infrared autofluorescence).
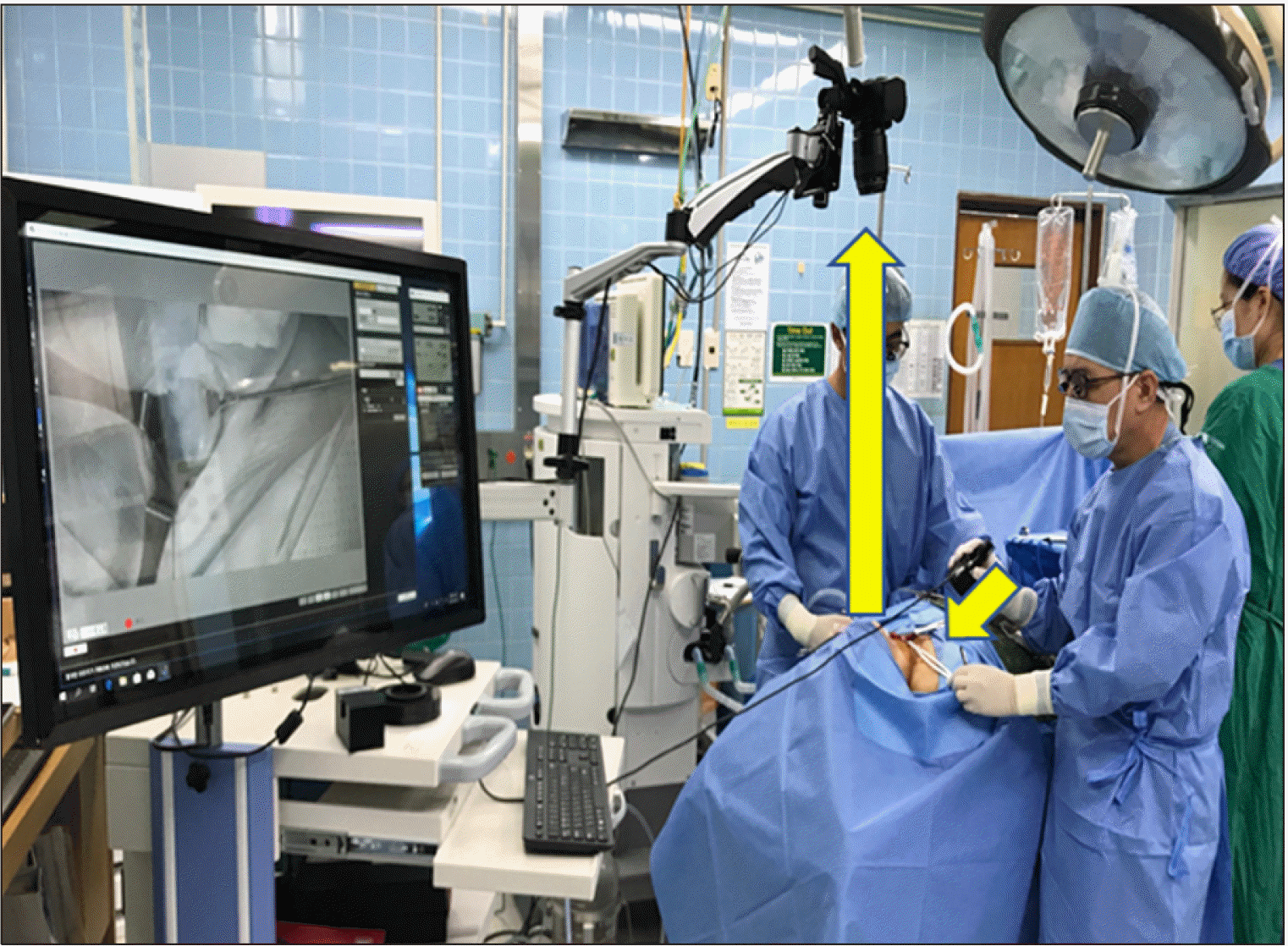
Fig. 4
Left thyroid lobe is mobilized and inferior parathyroid gland is exposed (A). The NIRAF image shows the glowing of the parathyroid gland (B). Surrounding tissues have no significant autofluorescence intensity.
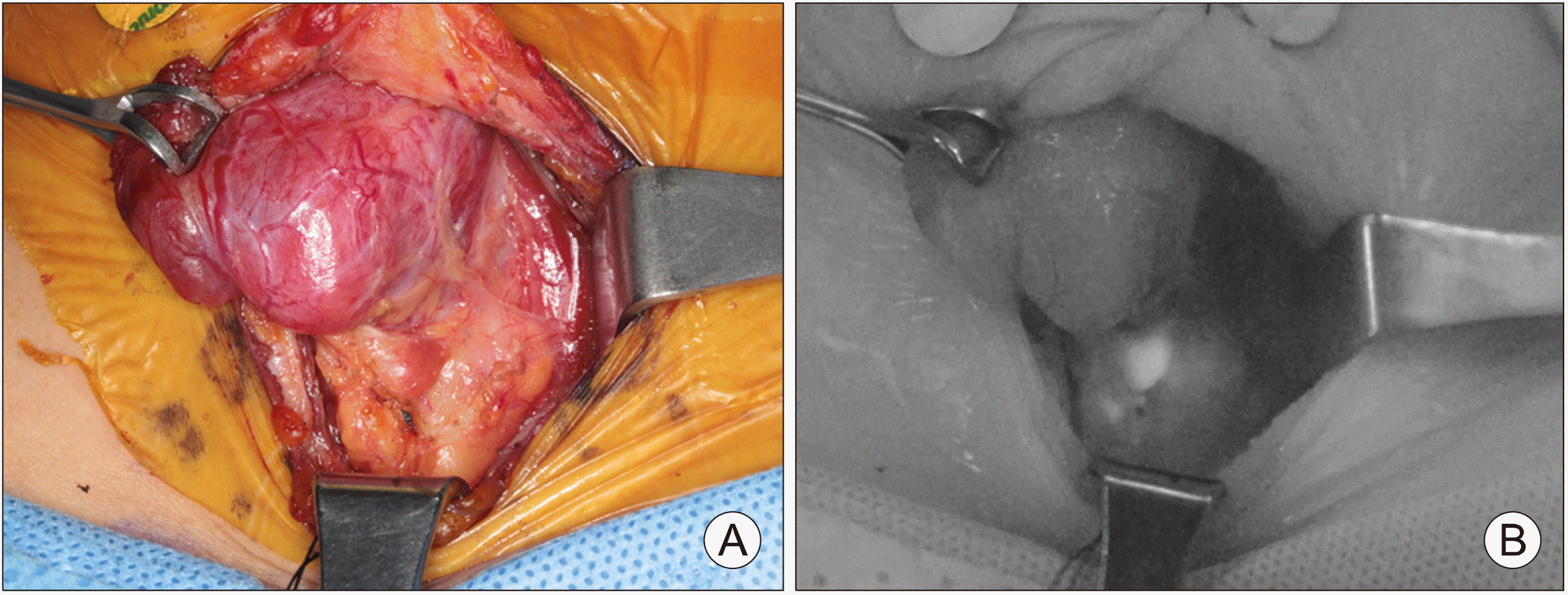
Fig. 5
Parathyroid gland mapping. In the white light image (A), no parathyroid glands can be seen with naked eye. Interestingly, with author’s lab-built NIRAF imager, the unexposed right inferior parathyroid gland can be clearly localized by mapping (B).
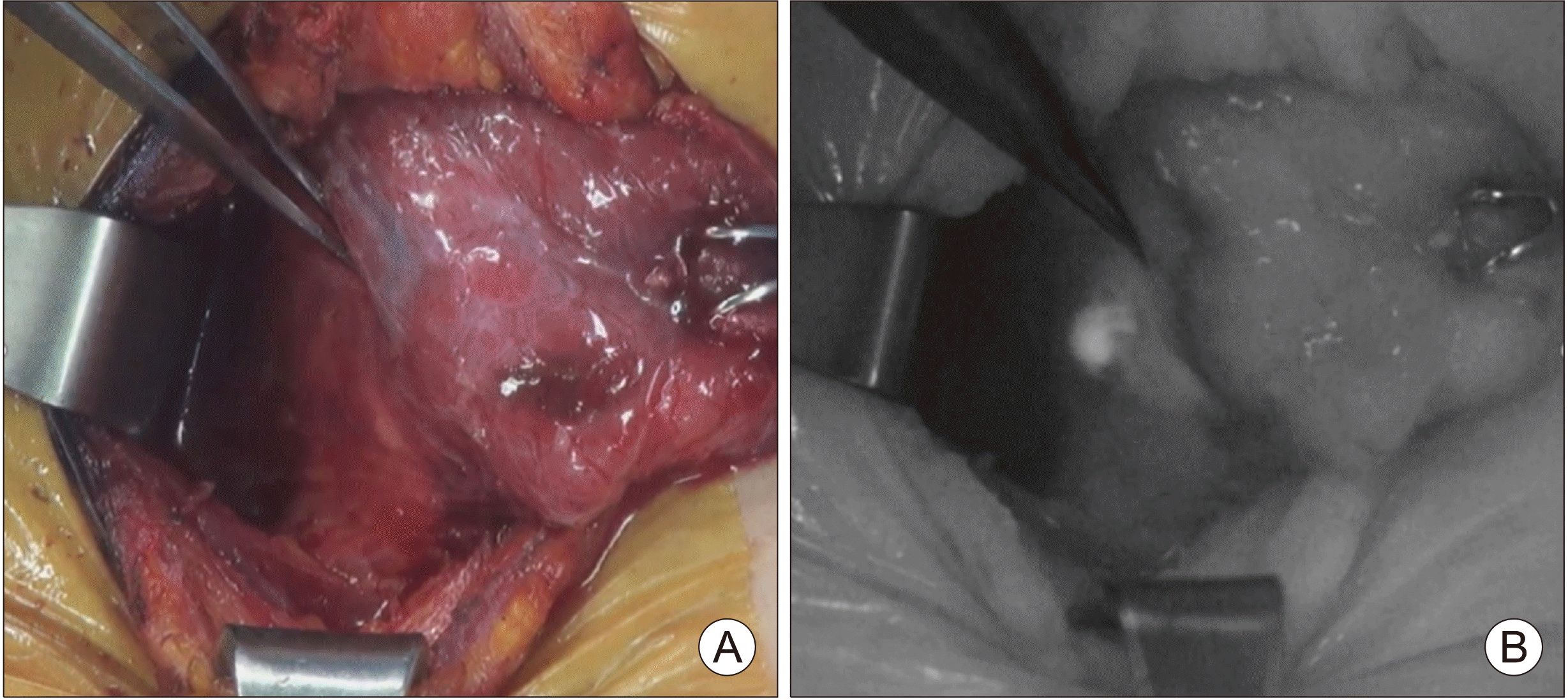
Table 1
Advantages and limitations of current NIRAF probe and imaging devices for identifying parathyroid glands
|
Probe-based NIRAF Detection (PTeyeⓇ) |
Imaging-based NIRAF Detection (Fluobeam 800Ⓡ) |
|
|---|---|---|
| 부갑상선 식별 시 음향 반응 | ○ | |
| 주변의 조명에 의한 영향 없음(수술실 조명 사용 가능) | ○ | * |
| 실시간 정량적 강도 측정 | ○ | |
| 깊숙한 위치의 부갑상선 접근 용이 | ○ | |
| 작은 절개선이나 틈으로 부갑상선 접근 용이 | ○ | |
| 소형이고 들고 있기 용이함 | ○ | |
| 부갑상선 탐지가 표적과 감지기 간 거리에 영향 받지 않음 | ○ | |
| 공간 정보나 수술 시야를 제공 | ○ | |
| 접촉 불필요 | ○ | |
| 다기능,다목적 | ○ | |
| 짧은 러닝 커브 | ○ | ○ |
| 교육 도구로 사용 가능 | ○ | ○ |
| 절제된 검체에서 우발적 제거된 부갑상선 감지 가능 | ○ | ○ |
| 부갑상선의 생존성에 대한 정보 미제공 | ○ | ○ |
| ICG 등 형광물질 주입과 함께 사용 가능 | ○ | ○ |
| 부갑상선의 혈류나 생존성에 관한 정보를 자체적으로 제공 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download