Abstract
Fine needle aspiration cytology (FNAC) has been used extensively for the diagnosis of breast lesions over the past decade and has now been largely replaced by core needle biopsy. However, ultrasound-guided fine needle aspiration cytology (US-guided FNAC) is still widely used because of its advantages of simple procedure, low cost, fewer side effects, and excellent tolerance by patients. Indeed, US-FNAC of indeterminate/suspicious lymph nodes in breast cancer patients can provide a more definitive diagnosis than ultrasonography alone. This review article summarizes the method of use and utility of US-guided FNAC in breast lesions.
중앙암등록본부의 보고에 의하면 2019년 한해 약 25,000명의 새로운 유방암 환자가 발생하였으며, 이는 여성암 발생률 1위로 전체 여성암의 20.6%를 차지하고 매년 증가 추세를 보이고 있다.(1) 유방암 발생 증가의 원인은 다양하겠지만 서구화된 식습관, 생활습관의 변화와 함께 유방검진의 활성화로 유방암의 조기 발견이 늘어난 점을 들 수 있다. 유방 검진으로 발견된 유방의 병변이 많아지면서 이에 따른 경피적 유방검사의 수도 증가해왔다.(2)
경피적 유방 검사에는 세침흡인세포검사(fine needle aspiration cytology)와 중심부 침생검(core needle biopsy), 진공보조흡인생검(Vacuum Assisted Breast Biopsy)이 있으며 이중에서 세침흡인 세포검사는 진단이 빠르고 정확하며, 검사비가 낮고, 부작용이 별로 없다는 장점들이 있어 여전히 많이 이용되고 있는 검사법이다.(3) 최근에는 유방종양을 진단할 때 세침흡인 세포검사 대신 중심부 침생검(core needle biopsy)이 표준 술식으로 자리잡았고 진공보조흡인생검도 증가하는 추세이나, 수술전 유방암 환자의 림프절 전이의 확인이나 유방암 환자의 수술 후 추적관찰시 국소재발의 여부와 치료효과를 판정할 때에는 여전히 우수하고 효과적인 검사방법으로 사용되고 있다.
이제 저자는 유방병변에서 초음파를 이용한 세침흡인 검사의 활용과 유용성에 대하여 정리해보고자 한다.
세침흡인세포검사(fine needle aspiration cytology; FNAC) 는 가는 바늘을 사용하여 고형 또는 낭성 유방 병변에서 세포들을 추출하여 세포학적 형태를 검사하는 방법으로 21-25게이지의 바늘과 주사기를 이용한다.
유방 세침흡인세포검사에서 사용되는 유도법은 촉지, 초음파, 유방촬영술이 있고, 이중에서 현재 가장 보편적으로 이용되는 방법은 초음파다.
수십년 동안 만져지는 유방 결절에 대한 세침흡인세포검사는 널리 이용되어졌고, 촉지되지 않는 유방 종괴의 초음파 유도 검사는 1980년대 처음 보고되었다.(4)
촉지 가능 하더라도 낭성병변내의 고형물질이 혼재되어 있는 경우, 심부에 존재하는 병변, 범위를 파악하기 어려운 병변 등은 반드시 초음파를 이용하여 진단에 가장 유효하다고 판단되는 부위에서 흡인술을 시행 할 것을 권장한다. 유방촬영술과 초음파검사 모두에서 보이는 병변이라면 초음파 유도하에 시행하는 것이 좋다.
유방 병변에 대한 세침흡인세포검사의 장점은 시행방법이 간편하면서 빠르고, 결과를 빨리 알 수 있다는 것이다. 또한 중심부 침생검에 비해 더 가는 바늘을 사용하여 상대적으로 환자의 고통이 적고 안전하며 시술로 인한 합병증이 적은 특징이 있다. 이러한 특성으로 인해 초음파 유도 세침흡인세포검사는 유방영상을 시작하는 경험이 적은 의사들도 쉽게 시행할 수 있는 검사이다. 또한 초음파 유도하에서 시행하게 되면 시술과정을 실시간 볼 수 있고 병변과 바늘의 관계를 정확히 알 수 있으므로 안전하고 정확한 검사가 가능하다.(5-7)
그리고 세침흡인 검사를 적절히 이용하면 수술을 통한 조직검사를 줄일 수 있다. Dixon 등(8)이 발표한 연구에 의하면 세침흡인세포검사를 시행한 후 유방 덩이에 대한 절제 수술이 83%에서 41%로 감소하였고, 유방 양성병변의 수술을 통한 조직검사 빈도가 74%에서 23%로 감소했음을 보고하였다(P < 0.001). 이 결과를 바탕으로 불필요한 수술적 조직검사 및 양성 유방 질환 환자에서 수행되는 과도한 수술을 줄이는데 세침흡인세포검사의 공헌도가 있음을 알 수 있다.
그러나 세침흡인세포검사의 또 따른 특성이자 약점은, 시술하는 의사의 경험, 대상 병변, 시술 방법, 그리고 판독하는 병리 의사 등의 다양한 변수에 영향을 받기 때문에 각 병원마다 진단 정확도의 편차가 다른 검사에 비해서 크다는 것이다. 연구마다 다양성을 보이고 있지만 Pisano 등(9)의 다기관연구에 따르면 불충분한 검체율은 35.4%이었고, 불충분한 검체를 포함하여 분석하였을 때 민감도와 특이도는 각각 85%-88%, 55.6%-90.5%였고, 정확도는 62.2%-89.2%이었다. 진단 정확도는 유방결절이 석회화보다 높았고(67.3% vs. 53.8%, P = 0.006), 초음파 유도법이 입체정위 유도법보다 정확도가 높았다(77.2 % vs. 58.9%, P = 0.002). 다른 연구들에서도 세침흡인세포검사는 불충분한 검체율과 높은 위음성률(민감도: 65%-99%, 특이도: 64%-100%, 정확도: 81%-98%)을 보이며, 각 기관마다 심한 진단 정확도 차이가 있으므로 선택적으로 시행하는 것이 필요하며, 시행할 때에도 주의가 필요하다.(10,11)
따라서 세침흡인세포검사는 시행 의사의 숙련된 기술과 경험이 중요하다. 또한 유방 세포진단학에 경험이 많은 병리과 의사가 반드시 있어야 하며 병리과 의사는 표본이 충분한지 결정하고, 악성 유무를 정확히 진단할 수 있어야 한다. 이러한 점들 때문에 유방 병변의 진단에서 점차 중심부 침생검을 시행하는 경향으로 바뀌고 있으나 세침흡입세포검사는 림프절 세포검사 등의 선별적 영역에서 여전히 중요한 검사법으로 남아있다.(12)
①환자의 출혈경향과 항응고제 사용여부를 확인한다. 일반적으로 아스피린은 복용을 중지할 필요는 없으나 와파린(Cou-madin)을 복용하는 환자는 시술 시행 2-3일전에 약물을 중단하는 것이 좋다.
②시술동의서를 작성한다. 검사에 대한 설명과 함께 동반될 수 있는 합병증에 대한 내용이 포함되어야 한다. 합병증은 통증, 출혈, 감염, 드물게 기흉과 대흉근 손상이 있을 수 있다.
③21-25게이지 바늘이 부착된 5-10 ml 주사기와 무균 시술을 위한 도구를 준비한다.
2) 초음파 유도 세침흡인세포검사 과정
①초음파로 병변으로 확인한 후 병변이 평평해지도록 환자의자세를 잡는다. 필요한 경우 환자의 등뒤로 삼각베개를 받쳐서 편안한 자세를 유지하도록 한다.
②바늘이 들어갈 부위를 표시하고 검사부위를 소독한 다음 초음파 탐촉자와 바늘이 들어갈 부위를 남기고 소독포로 주변을 덮는다. 멸균 비닐로 초음파 선형탐촉자 표면을 싼다.
③실시간으로 초음파 영상을 통해 바늘의 경로를 확인하면서 바늘을 병변내에 위치시킨다.
바늘을 초음파 영상과 평행하게 주입하는 방법을 주로 이용하는데 이는 바늘의 주행경로를 초음파 영상을 통해 전부 관찰할 수 있어 정확하고 안전하다(Fig. 1).
시술시 대부분은 국소마취가 필요하지 않지만 2% 리도카인을 이용해 선택적으로 피하마취를 시행할 수 있다.
④바늘 끝을 지속적으로 관찰하면서 주사기의 피스톤을 뒤로 당겨 음압을 유지한 상태에서 바늘을 결절 내부에서 앞뒤, 상하, 좌우로 빠르게 수회 이상 움직인다. 병변 안에서 최대한 넓게 움직여 여러 부분에서 세포를 얻는다.
⑤혈액이나 검체가 바늘의 허브(hub)에서 보이기 시작하면 흡인을 중단하고 바늘을 뽑는다. 검체를 얻은 바늘을 주사기와 분리하고 주사기를 공기를 채운 후 다시 바늘을 연결해 흡인물을 방출시킨다.
세포검사법은 검체를 유리슬라이드에 도말, 95% 알코홀로 고정하는 고식적인 도말법과 특수 보존액이 들어있는 용기에 흡인한 바늘을 담가 검체를 처리하는 액상세포검사법이 있다. 흡인물을 고정하는 방법은 각 병원마다 조금씩 다르므로 각 병원의 병리과 의사와 상의한다.
검체가 충분하다고 생각될 때까지 2회 이상 이 과정을 반복한다.
⑥세침흡인세포검사가 끝난 후 초음파 탐촉자를 이용해 검사로 인한 출혈이 없음을 확인하고 영상으로 기록한다. 검사 부위를 압박, 지혈한 후 피부천자 부위를 소독하고 작은 반창고를 붙이고 검사를 종료한다.
초음파 유도 세침흡인세포검사는 초음파에서 보이는 병변에 대하여 모두 시행할 수 있으나, 낭종과 농양, 수술 후 혈종과 장액종, 림프절, 유방암이 의심되는 병변에서의 수술 전 확진 등을 위해 주로 시행한다. 최근에는 유방암의 수술 전 병기결정을 위해 림프절의 세침흡인세포검사가 증가하고 있다.(13)
(1)림프절의 암전이여부 진단: 겨드랑림프절의 전이 여부는 유방암의 중요한 예후 인자이다. 따라서 수술전 겨드랑림프절의 전이를 발견하기 위해 촉진, 초음파 검사, 초음파 세침흡인세포검사, 중심부 침생검 등 다양한 방법이 사용된다. 촉진 등의 임상검사만으로는 민감도는 45.4%-68%로 부정확한 것으로 나타났는데, de Freitas 등(15)의 연구에 의하면 임상검사의 정확도는 최종적으로 68%였으며, 다른 연구들에서는 임상적으로 만져지지 않는 림프절이 있는 환자의 15%-60%가 추가 검사에서 림프절 전이가 있는 것으로 나타났다.(14-16)
초음파 검사도 림프절 전이 예측에 도움이 되는데 ‘의심스러운’(suspicious) 영상소견인 크기 10 mm 이상의 림프절, 지방문(fatty hilum)의 소실, 저에코의 림프절, 원형 및 피질의 비후 등의 특징을 확인하여 악성을 예측할 수 있다. 그러나 단순 초음파 검사는 여전히 제한점이 존재한다. 그동안의 연구에 의하면 겨드랑림프절 전이에 대한 초음파 검사의 민감도는 35%-82%, 특이도는 73%- 97.9%를 보이며,(16,17) 최근에 발표된 메타 분석에서는 64%의 민감도와 82%의 특이도를 보였다.(18) 초음파 단독으로 시행했을 경우 de Freitas 등(15)에 의하면 양성예측도 82% , 음성예측도 49%, 정확도는 67%로 보고하였으며, 이는 초음파 검사만으로 겨드랑 림프절 전이상태를 정확하게 예측하는 데 한계가 있음을 나타낸다.
그런데 초음파 유도하에 세침흡인세포검사 또는 중심부 침생검을 시행하면 겨드랑림프절 전이의 수술전 평가의 정확성을 향상시킬 수 있다.
초음파 유도 세침흡인세포검사는 겨드랑 림프절전이 평가에서 25%-87%의 민감도와 100%의 특이도를 보인다.(19) 또한 중심부 침생검에 비해 신속하고 환자들의 불편함이 적으며 혈종이나 통증, 감염, 기흉 등의 합병증 발생위험이 현저히 적고 의료 비용도 적게 소요되는 장점이 있어 여전히 널리 사용되고 있다. 실제로, 초음파 검사와 비정상 겨드랑 림프절의 세침흡인세포검사를 함께 시행하게 되면 불필요한 감시림프절 생검술을 8%에서 40%까지 크게 줄일 수 있고, 동시에 의료 비용을 20%까지 감소시키는 것으로 나타났다.(16,17,20)
겨드랑 림프절뿐 아니라 내유림프절(internal mammary lymph node), 쇄골위 림프절(supraclavicular lymph node) 전이 여부를 평가할 때도 초음파 유도 세침흡인세포검사는 유용하게 사용된다(Fig. 2, 3).
덧붙여 초음파 유도 중심부 침생검은 림프절 조직의 많은 부분을 획득할 수 있는 장점이 있고 79%-100%의 높은 민감도와 100%의 특이도를 보인다.(18,19) 따라서,림프절 전이 진단을 위한 초음파 유도 중심부 침생검은 향후 세포흡인세포검사의 단점을 보충하며 검사수가 점차 증대될 것으로 예상된다.
(2)유방암과 양성유방병변의 진단: 침윤성 유방암의 경우 초음파 유도 세침흡인 세포검사로 풍부한 세포를 얻을 수 있으므로 고형 병변을 정확히 진단할 수 있으나, 세포만으로 침윤성과 비침윤성 유방암을 감별하기는 어렵고, 경성암(scirrhous carcinoma)의 경우에는 검체가 충분하지 않을 수 있다. 그 외에 수질암(medullary carcinoma), 점액암(mucinous carcinoma), 림프종(lymphoma), 전이암(metastatic cancer)의 경우에도 세포학적으로 정확한 진단이 가능하다. 그 외에 양성질환으로 섬유선종, 지방괴사, 급성 염증, 표피봉입낭(epidermal inclusion cyst)도 초음파 유도 세침흡인 세포검사로 진단할 수 있다.(21,22)
그러나 현재까지 유방 세침흡인 세포검사는 점점 그 비율이 줄어들고 있으며, 중심부 침생검으로 대치되고 있다. 그 이유는 유방의 세침흡인세포검사가 중심부 침생검에 비하여 민감도와 특이도가 떨어지기 때문인데 Lieu (23)는 유방덩이에서 시행한 세침흡인세포검의 경우 민감도가 43.8%-91.7%, 특이도가 89.8%-100%까지 나타난 데 비해 중심부 침생검은 민감도가 91%-99.6%, 특이도가 98%-100%까지 나타난 것으로 보고 하였다. 하지만 14게이지 바늘을 사용하는 중심부 침생검에 비해 세침흡인 세포검사는 21-15 게이지 등의 가는 바늘을 사용하여, 환자에게 거부감이 적으며, 시행하는 의사도 좀 더 쉽게 접근할 수 있는 방법이다. 세침흡인 세포검사는 시술하는 의사의 경험, 대상 병변, 시술 방법, 그리고 판독하는 병리 의사에 따라서 다양한 변수의 영향을 받는 검사지만 경험이 많은 의사가 시술하는 경우, 간단하면서 매우 유용한 검사가 될 수 있다. He 등(24)은 세침흡인 세포검사로 진단된 유방암을 보고하였는데 민감도 97.72%, 특이도 99.4%, 정확도 97.94%로 이 검사법이 여전히 유용하고 신뢰할 수 있는 검사라고 보고하였다. 이러한결과는 유방 세침흡인 세포검사의 시술과 판독에 경험이 풍부한 연구자들에 의한 결과였고 , 연구마다 다양성을 보이고 있지만 여러 연구 결과를 살펴보면 유방 세침흡인 세포검사의 민감도는 43.8%-91.7%, 특이도는 89.8%-100%, 검체 부적절 비율은 19.1%로 중심부 침생검의 민감도 91%-99%, 특이도 98%-100%, 부절절 비율 1.1%와 대조되는 결과를 보였다.(25,26) 따라서, 세침흡인세포검사 후에는 반드시 그 결과를 확인하여 영상 소견과 일치하지 않거나 고형 병변에서 검체가 불충분한 경우에는 재생검(중심부 침생검 또는 절제 생검 등)을 시행해야 한다.
유방에 낭종이 있을 경우 세침흡인술(Fine needle aspiration)을 시행할 수 있다. 낭종이 커지면 낭종벽이나 주변조직의 장력이 증가함에 따라 환자는 심각한 불편감과 압통을 호소할 수 있다. 또한 낭종이 커지면 내부 액체가 주변 유방조직으로 빠져나가 무균성 염증 반응을 유발할 수 있다. 이때 흡인을 하면 증상을 해소 할 수 있다. 환자의 증상완화와 낭종상태 확인을 위해 흡인술을 시행할 경우에는 세포검사를 생략하고 흡인만을 시행하기도 한다.
초음파 검사에서 낭종이 의심되지만 모양이 비전형적인 때에도 초음파 유도 세침흡인술을 시행할 수 있다. 낭종의 흡인술 후에는 어떤한 잔여 영상도 초음파에서 없어야 하며, 지속적으로 이상 소견이 보인다면 중심부 침생검이나 단기간 추적 초음파 검사(6주-8주) 를 시행한다.
또한 수술 후 유방과 액와부에 간혹 발생하는 장액종이나 혈종에 의해 환자가 불편감을 느낀다면 초음파 유도 흡인술을 통해 액체의 성상을 파악하고 환자의 증상을 완화시킬 수 있다.
낭종을 비롯한 체액은 가는 바늘로 쉽게 흡인되지만 내용물이 찐득하고 진흙같은 물질이 포함되어 있는 경우에는 18게이지 바늘을 사용할 수 있다(Fig. 4).
현재까지 유방 고형병변의 진단에서 세침흡인세포검사는 점점 그 비율이 줄어들고 있으며, 더 많은 조직을 얻을 수 있는 중심부 침생검으로 대체되고 있다. 그러나 세침흡인세포검사는 가는 바늘(21-25 게이지)을 사용하여 환자에게 덜 침습적이고 안전하며, 시행하는 의사도 좀 더 쉽게 접근할 수 있고 경제적인 검사라는 점에서 여전히 임상적 활용도는 높다. 또한 초음파 유도하에 병변을 정확하게 찾고 검사가 제대로 이루어진다면 조직 진단과 마찬가지로 최종 진단에 이를 수 있는 검사법이다. 특히 초음파 유도 세침흡인세포검사는 유방암환자에서 림프절전이를 진단하는 매우 유용한 검사법이며 유방낭성병변을 진단하거나 치료하는 데 사용된다. 그리고 세침흡인세포검사 후 결과를 꼭 확인하고 영상소견을 참고하여 추가적인 조직검사가 필요할 수 있음을 숙지하여야 한다.
REFERENCES
1. National Health Insuarance Service. 2021. 2016 cancer registry statistics in Korea [Internet]. Statistics Korea;Daejeon: cited 2021 Dec 30.
2. Kim EK, Oh KK, Kim MH, You JK, Kwak JY, Park BW, et al. 2002; Changes in diagnostic methods of non-palpable breast lesions: analysis for 5 years. J Korean Radiol Soc. 47:93–8. DOI: 10.3348/jkrs.2002.47.1.93.

3. Silverman JF, Lannin DR, O'Brien K, Norris HT. 1987; The triage role of fine needle aspiration biopsy of palpable breast masses. Diagnosticaccuracy and cost-effectiveness. Acta Cytol. 31:731–6. PMID: 3425133.
4. Fornage BD, Faroux MJ, Simatos A. 1987; Breast masses: US-guided fine-needle aspiration biopsy. Radiology. 162:409–14. DOI: 10.1148/radiology.162.2.3541029. PMID: 3541029.

5. Gordon PB, Goldenberg SL, Chan NH. 1993; Solid breast lesions: diagnosis with US-guided fine-needle aspiration biopsy. Radiology. 189:573–80. DOI: 10.1148/radiology.189.2.8210392. PMID: 8210392.

6. Hann L, Ducatman BS, Wang HH, Fein V, McIntire JM. 1989; Nonpalpable breast lesions: evaluation by means of fine-needle aspiration cytology. Radiology. 171:373–6. DOI: 10.1148/radiology.171.2.2539608. PMID: 2539608.

7. Fornage BD. 1990; Guided fine-needle aspiration biopsy of nonpalpable breast lesions: calculation of accuracy values. Radiology. 884–5. DOI: 10.1148/radiology.177.3.2244007. PMID: 2244007.

8. Dixon JM, Clarke PJ, Crucioli V, Dehn TC, Lee EC, Greenall MJ. 1987; Reduction of the surgical excision rate in benign breast disease using fine needle aspiration cytology with immediate reporting. Br J Surg. 74:1014–6. DOI: 10.1002/bjs.1800741119. PMID: 3690225.

9. Pisano ED, Fajardo LL, Caudry DJ, Sneige N, Frable WJ, Berg WA, et al. 2001; Fine-needle aspiration biopsy of nonpalpable breast lesions in a multicenter clinical trial: results from the radiologic diagnostic oncology group V. Radiology. 219:785–92. DOI: 10.1148/radiology.219.3.r01jn28785. PMID: 11376270.

10. Jackson VP. 1992; The status of mammographically guided fine needle aspiration biopsy of nonpalpable breast lesions. Radiol Clin North Am. 30:155–66. DOI: 10.1016/S0033-8389(22)02492-7. PMID: 1732924.

11. Meunier M, Clough K. 2002; Fine needle aspiration cytology versus percutaneous biopsy of nonpalpable breast lesions. Eur J Radiol. 42:10–6. DOI: 10.1016/S0720-048X(01)00480-6. PMID: 12039016.

12. Simsir A, Rapkiewicz A, Cangiarella J. 2009; Current utilization of breast FNA in a cytology practice. Diagn Cytopathol. 37:140–2. DOI: 10.1002/dc.20987. PMID: 19021200.

13. MacNeill M, Arnott I, Thomas J. 2011; Fine needle aspiration cytology is a valuable adjunct to axillary ultrasound in the preoperative staging of breast cancer. J Clin Pathol. 64:42–6. DOI: 10.1136/jcp.2010.083063. PMID: 21097541.

14. Bruneton JN, Caramella E, Héry M, Aubanel D, Manzino JJ, Picard JL. 1986; Axillary lymph node metastases in breast cancer: preoperative detection with US. Radiology. 158:325–6. DOI: 10.1148/radiology.158.2.3510440. PMID: 3510440.

15. de Freitas R Jr, Costa MV, Schneider SV, Nicolau MA, Marussi E. 1991; Accuracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases in breast cancer. Eur J Surg Oncol. 17:240–4. PMID: 2044777.
16. van Rijk MC, Deurloo EE, Nieweg OE, Gilhuijs KG, Peterse JL, Rutgers EJ, et al. 2006; Ultrasonography and fine-needle aspiration cytology can spare breast cancer patients unnecessary sentinel lymph node biopsy. Ann Surg Oncol. 13:31–5. DOI: 10.1245/ASO.2005.01.024. PMID: 16372147.

17. Davis JT, Brill YM, Simmons S, Sachleben BC, Cibull ML, McGrath P, et al. 2006; Ultrasound-guided fine-needle aspiration of clinically negative lymph nodes versus sentinel node mapping in patients at high risk for axillary metastasis. Ann Surg Oncol. 13:1545–52. DOI: 10.1245/s10434-006-9095-8. PMID: 17009156.

18. Houssami N, Ciatto S, Turner RM, Cody HS 3rd, Macaskill P. 2011; Preoperative ultrasound-guided needle biopsy of axillary nodes in invasive breast cancer: meta-analysis of its accuracy and utility in staging the axilla. Ann Surg. 254:243–51. DOI: 10.1097/SLA.0b013e31821f1564. PMID: 21597359.
19. Rao R, Lilley L, Andrews V, Radford L, Ulissey M. 2009; Axillary staging by percutaneous biopsy: sensitivity of fine-needle aspiration versus core needle biopsy. Ann Surg Oncol. 16:1170–5. DOI: 10.1245/s10434-009-0421-9. PMID: 19263171.

20. de Kanter AY, van Eijck CH, van Geel AN, Kruijt RH, Henzen SC, Paul MA, et al. 1999; Multicentre study of ultrasonographically guided axillary node biopsy in patients with breast cancer. Br J Surg. 86:1459–62. DOI: 10.1046/j.1365-2168.1999.01243.x. PMID: 10583296.

21. Kim JY. 2007; General cytological characters of malignant breast lesions. Korean J Cytopathol. 18:100–11.
22. Mendoza P, Lacambra M, Tan PH, Tse GM. 2011; Fine needle aspiration cytology of the breast: the nonmalignant categories. Patholog Res Int. 2011:547580. DOI: 10.4061/2011/547580. PMID: 21660275. PMCID: PMC3108472.
23. Lieu D. 2009; Value of cytopathologist-performed ultrasound-guided fine-needle aspiration as a screening test for ultrasound-guided core-needle biopsy in nonpalpable breast masses. Diagn Cytopathol. 37:262–9. DOI: 10.1002/dc.20984. PMID: 19217029.

24. He Q, Fan X, Yuan T, Kong L, Du X, Zhuang D, et al. 2007; Eleven years of experience reveals that fine-needle aspiration cytology is still a useful method for preoperative diagnosis of breast carcinoma. Breast. 16:303–6. DOI: 10.1016/j.breast.2006.12.006. PMID: 17287118.

25. Berner A, Davidson B, Sigstad E, Risberg B. 2003; Fine-needle aspiration cytology vs. core biopsy in the diagnosis of breast lesions. Diagn Cytopathol. 29:344–8. DOI: 10.1002/dc.10372. PMID: 14648793.

26. Pisano ED, Fajardo LL, Tsimikas J, Sneige N, Frable WJ, Gatsonis CA, et al. 1998; Rate of insufficient samples for fine-needle aspiration for nonpalpable breast lesions in a multicenter clinical trial: the radiologic diagnostic oncology group 5 study. The RDOG5 investigators. Cancer. 82:679–88. DOI: 10.1002/(SICI)1097-0142(19980215)82:4<679::AID-CNCR10>3.0.CO;2-V. PMID: 9477100.
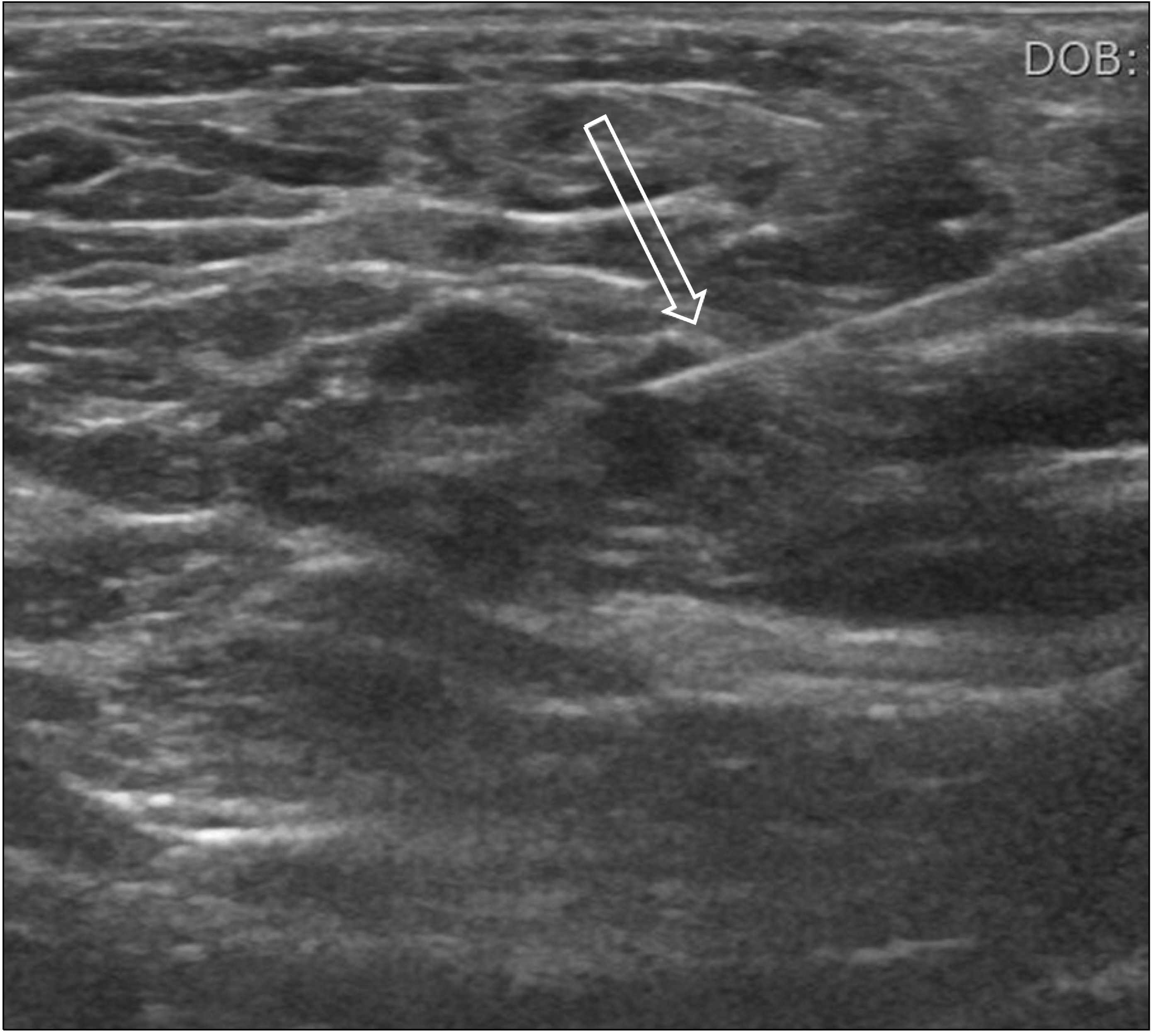
Fig. 1
Ultrasound-guided fine needle aspiration cytology. An ultrasound-guided fine needle aspiration cytology was performed on the axillary lymph node of a patient with breast cancer. The examination can be performed while observing a needle (arrows) with ultrasound in real time.
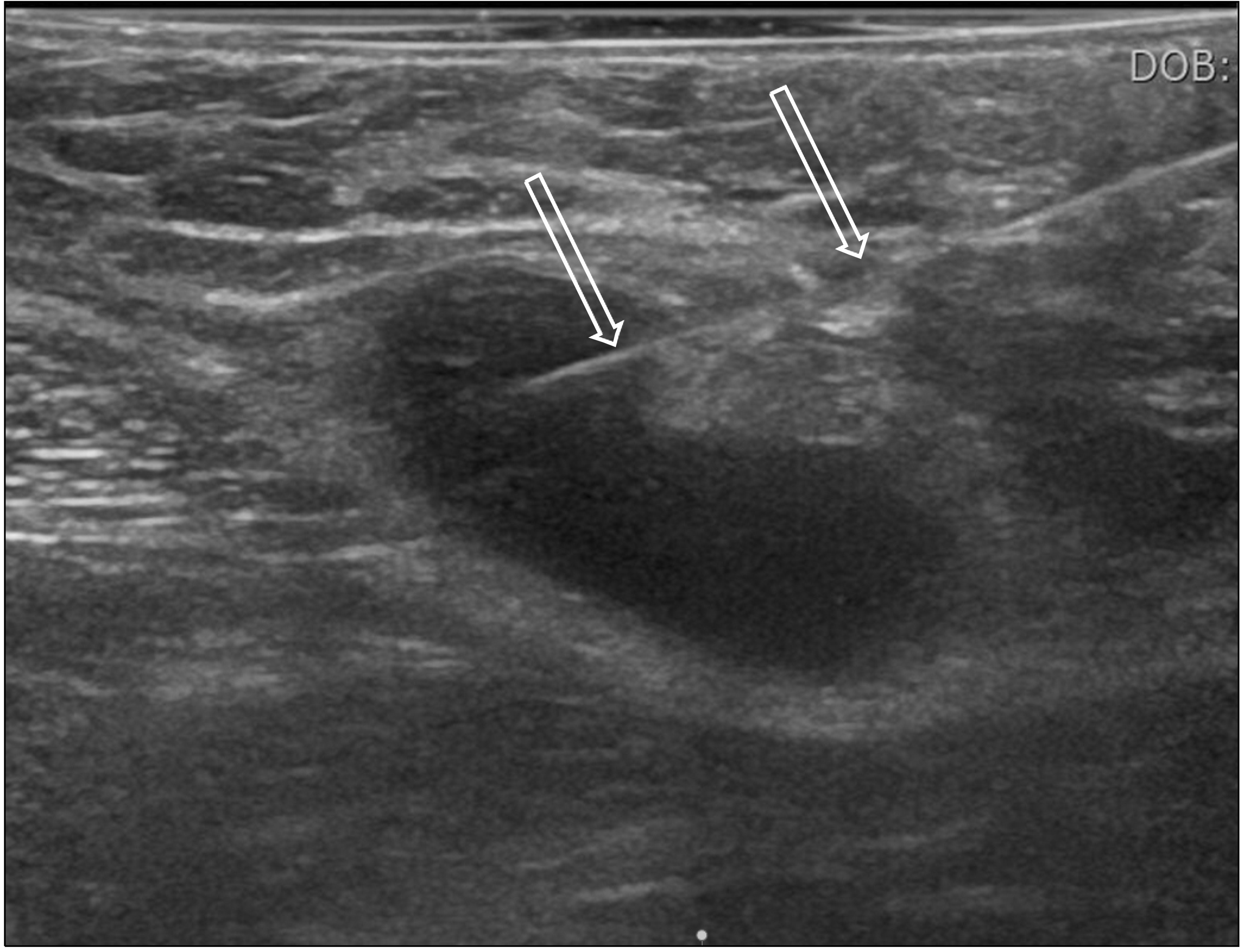
Fig. 2
Ultrasound-guided fine needle aspiration cytology performed on the supraclavicular lymph node. An ultrasound-guided fine needle aspiration cytology was performed on the supraclavicular lymph node in a patient with breast cancer suspected of metastasis using a 23-gauge needle (arrow), and metastatic cancer was diagnosed in the cytology.
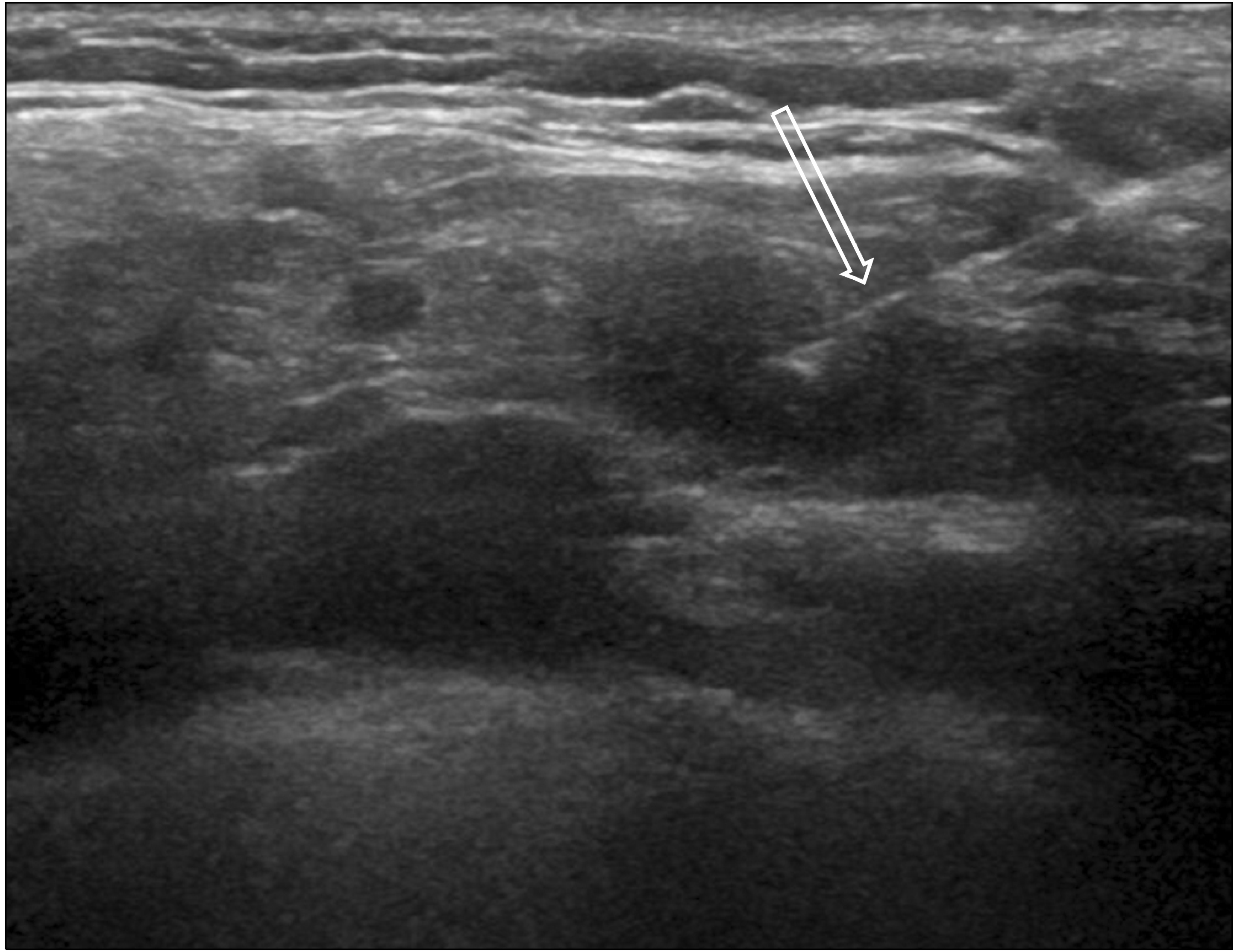
Fig. 3
Ultrasound-guided fine needle aspiration cytology performed on the small axillary lymph node. An ultrasound-guided fine needle aspiration cytology was performed on the axillary lymph node (less than 5 mm in size) in a patient with breast cancer suspected of metastasis using a 25-gauge needle, and it could be seen that the needle was placed correctly within the lymph node (arrow). This patient was diagnosed of lymph node metastasis of breast cancer in the cytology.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download