증례: 63세 남자가 1-2개월 전부터 발생한 복부 불편감을 주소로 외래로 내원하였다. 진단받은 기저 질환 및 약물 복용력은 없었다. 바이러스 간염의 과거력 및 가족력도 없었으나, 만성 음주자로 복부 팽만 증상이 발생하기 직전까지 매일 소주 1병 이상의 음주력을 가지고 있었다. 환자는 신체 진찰에서 복부의 압통 및 반발통은 관찰되지 않았다. 혈압 135/90 mmHg, 맥박수 85회/분, 호흡수 20회/분, 체온 36.9℃로 측정되었다. 말초혈액검사에서 백혈구 4,970/mm3, 혈색소 11.2 g/dL, 혈소판 96,000/mm3로 측정되었고 AST 104 U/L, ALT 31 U/L, ALP 185 U/L, GGT 319 U/L, 총 빌리루빈 1.40 mg/dL, 알부민 3.3 g/dL, PT INR 1.14였다. 아울러 AFP 92.3 ng/mL, PIVKA-II 26,925 mAU/mL로 증가되어 있었으며, HBsAg (-), anti-HBs (+), anti-HBc (+), anti-HCV (-)이며, 혈중 HBV DNA는 검출되지 않았다. 흉부와 복부 방사선 촬영에서는 이상 소견을 보이지 않았다. Gadoxetate sodium을 이용한 역동적 조영증강 자기공명영상에서 간 우엽에 장경 11.6 cm 크기의 종괴가 관찰되었으며, 간경변증 및 비장비대 소견도 동반되어 있었다. 해당 종괴는 동맥기 조영증강 및 간담도기 씻김 현상을 보여서 간세포암종으로 진단되었으며(Fig. 1), 종괴는 내부 괴사를 보였고 우간정맥을 침습하고 있었다. 흉부 CT에서 폐전이는 동반되어 있지 않은 상태로, 환자의 병기는 BCLC-C로 확인되었다. 이에 경동맥화학색전술과 방사선 치료의 병합 요법을 계획하였다.
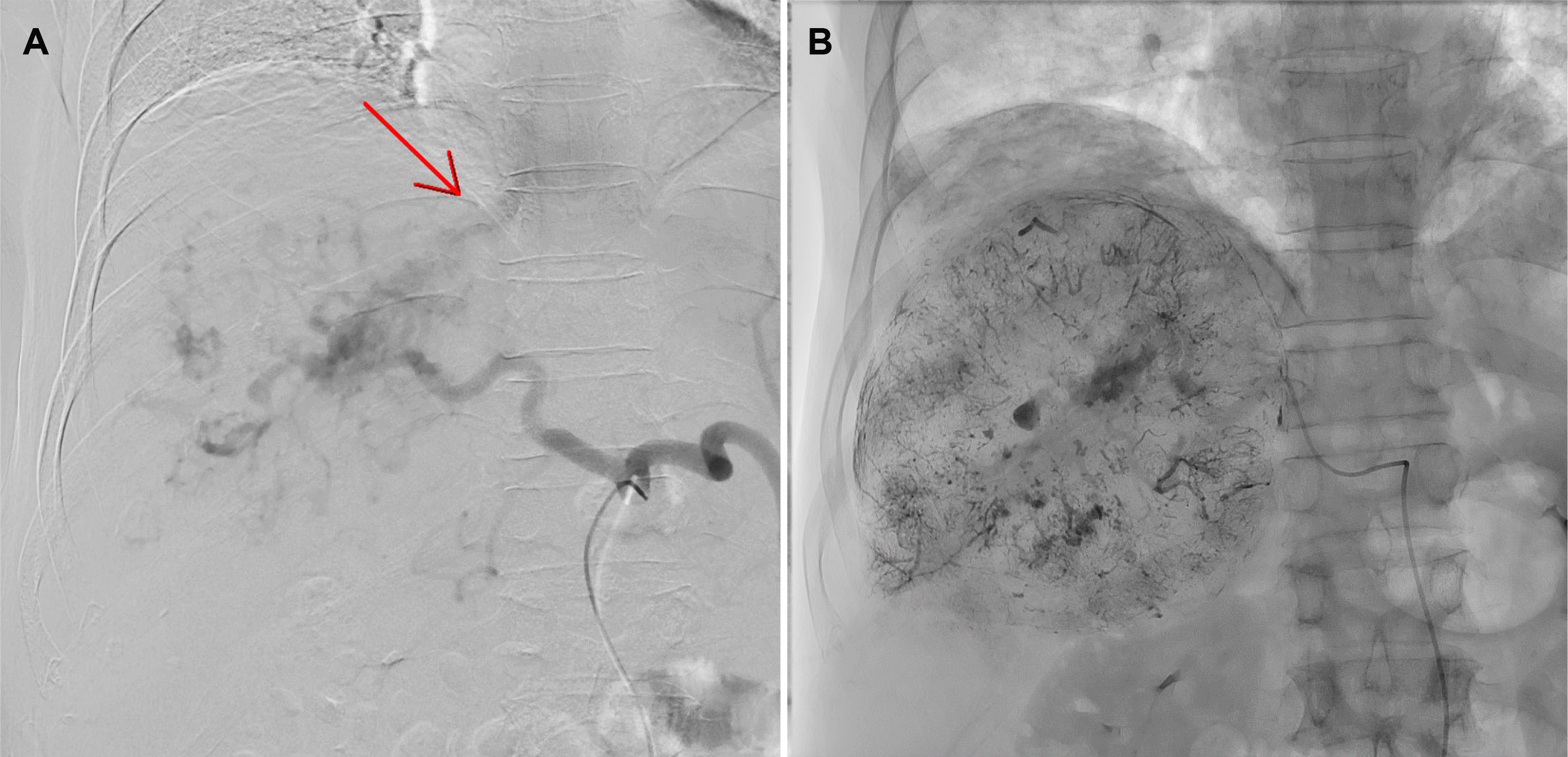
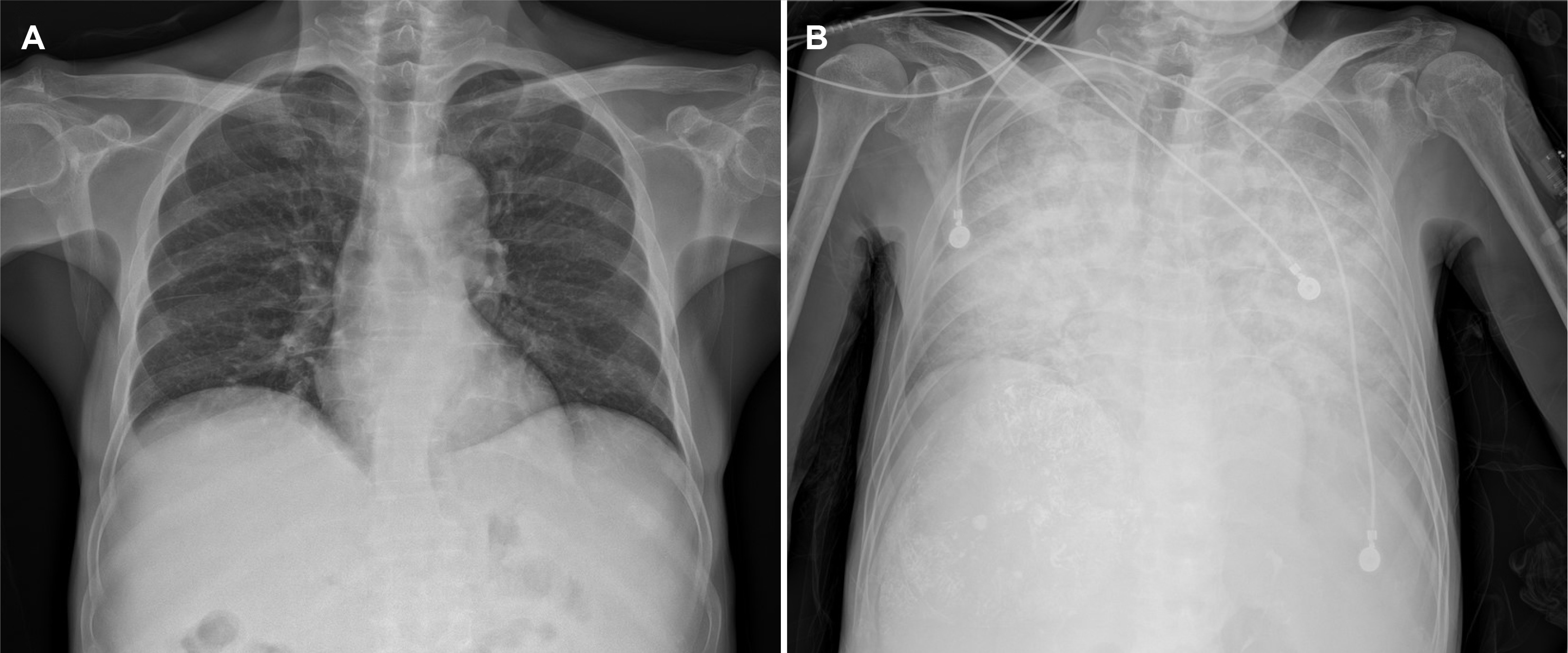
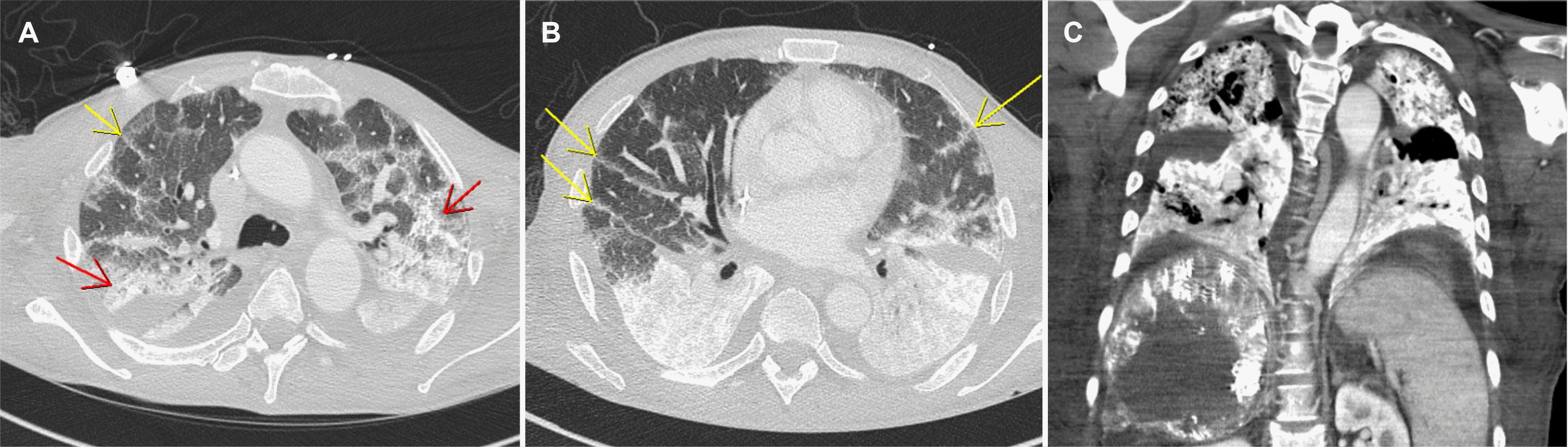
경동맥화학색전술을 위한 혈관조영술 중 간동맥과 간정맥 사이 동정맥 단락(arteriovenous shunt)이 관찰되었다(Fig. 2A). 이에 종양의 영양 혈관(feeding vessel)에 선택적으로 adriamycin 40 mg과 리피오돌(lipiodol®) 44 mL의 혼합액을 주입한 뒤, gelfoam® (710-1,000 μm)을 활용하여 색전술을 시행하였다(Fig. 2B). 시술 직후 호흡곤란 및 산소포화도의 저하가 발생하였다. 이에 시행한 흉부 방사선 촬영에서 양측 폐야에 미만성 침윤성 병변이 관찰되었다(Fig. 3). 급속한 산소 포화도 저하가 동반되어 흉부 CT는 시행하지 못하였지만, 임상 및 영상 소견을 바탕으로 리피오돌 유도 폐렴으로 진단하였다. 고유량 코 삽입관을 통한 산소 공급을 하며, 예방적 항생제(piperacillin/tazobactam과 levofloxacin)와 스테로이드 충격요법(IV methylprednisolone 125 mg [2 mg/kg])을 시행하였다. 해당 치료에도 호흡부전의 호전이 없어 시술 후 2일째 기관내 삽관 및 기계환기를 시작하였으며, 흉부 CT 촬영을 시행하였다. 흉부 CT에서 양측 폐야의 의존성 부위(dependent position)에 고음영을 보이는 경화(consolidation) 소견과 함께 미만성 간유리 음영(ground glass opacity)과 소엽간중격 비대(interlobular septal thickening) 소견이 관찰되었다(Fig. 4). 혈청 및 객담 배양 검사에서 배양된 균은 없었다. 지속된 기계호흡, 예방적 항생제 및 스테로이드 투여에도 불구하고 환자의 폐병변은 호전되지 않았으며, 경동맥화학색전술 시술 이후 12일째 사망하였다.
진단: 리피오돌 유도 폐렴
양귀비씨 기름에서 추출한 지방산의 에틸에스테르인 리피오돌은 림프관 조영술에 사용되는 조영제로 개발되었다. 1980년대에 리피오돌이 간암 조직에 선택적으로 축적되는 성질을 이용하여 리피오돌과 항암제를 병용한 경동맥화학색전술이 개발되었다. 리피오돌은 항암제와 혼합되어 유탁액(emulsion)을 형성한 후 간동맥을 통해 종양 조직 내로 주입된 다음, 점차적으로 항암제를 방출하여 종양 조직에서 높은 농도의 항암제를 유지한다. 현재 경동맥화학색전술은 전 세계적으로 간세포암종에 대해 가장 널리 사용되는 비수술적 치료 방법이다.
리피오돌 유도 폐렴은 간세포암종 환자에서 경동맥화학색전술 후 발생할 수 있는 드물고 치명적인 합병증으로,1-3 발병률은 0.05-2.3%로 보고되었다.4 경동맥화학색전술 후 리피오돌 유도 폐렴이 발생하는 기전은 아직 명확하지 않지만, 가장 가능성 있는 가설은 리파아제(lipase)에 의한 리피오돌의 분해로 인한 고농도의 결합되지 않은 유리 지방산(free fatty acids)으로 인한 폐모세혈관 누출 및 부종, 미세 색전(microemboli) 형성이다.5
Chung 등5은 리피오돌 유도 폐렴의 영상학적 소견으로 양측 폐를 침범하는 미만성 세망결절 혼탁(diffuse reticulonodular opacities)을 보고하였다. 이러한 방사선 소견은 시술 후 2-10일에 가장 심하였으며, 서서히 호전되어 10-28일 후에 사라지는 것으로 보고되었다. Tajima 등6은 경동맥화학색전술 이후 발생할 수 있는 폐 합병증을 중증도에 따라 5단계로 구분하였으며, 폐 합병증의 정도는 주입된 리피오돌의 용량에 비례하여 증가함을 보고하였다. 특히 20 mL 이상의 리피오돌을 주입하는 것은 리피오돌 유도 폐렴 발생의 가장 주요한 위험인자로 알려져 있다.5,7
간세포암종 환자 중에서 특히 간정맥 침습이 동반된 경우, 간의 동정맥 단락이 발생할 수 있다. 이러한 혈관 이상으로 인하여 경동맥화학색전술을 시행할 때 간동맥으로 주입된 리피오돌이 간의 동정맥 단락을 통하여 체순환으로 들어가게 되어 다양한 장기에서 색전증을 일으킬 수 있다. 추가적으로 하횡격막동맥(inferior phrenic artery)을 통한 색전술의 시행도 리피오돌 폐렴의 위험요소로 알려져 있다.6
리피오돌 유도 폐렴의 치료의 기본은 산소 공급과 항생제를 통한 보존적 치료이다. 정맥 내 스테로이드 투여는 리피오돌로 인한 염증을 줄이기 위해 고려될 수는 있지만 치료 효과에 관한 근거는 아직 미약하다. 종양의 크기가 매우 크고 동정맥루가 동반되어 있는 경우, 간정맥의 일시적 풍선 폐색을 시행한 이후 경동맥화학색전술을 실시하여 폐 합병증을 예방하면서 성공적으로 치료하였다는 연구가 보고되기도 하였다.8
본 증례의 환자는 간세포암종 종괴의 크기가 매우 크고, 시술 전 자기공명영상에서 우간정맥의 침습 소견과 혈관조영술에서 간의 동정맥 단락(Fig. 2A)이 확인되었다. 그리고 상대적으로 많은 용량의 리피오돌이 간동맥 내로 투여되었다. 이러한 위험요소들을 많이 가지고 있는 환자에서 리피오돌로 인한 폐렴이 발생하였다고 생각된다. 하지만 아직까지 간세포암종 환자에서 경동맥화학색전술 이후 발생하는 리피오돌 유도 폐렴의 발생 기전에 대한 구체적인 연구는 많이 부족하다. 따라서 본 증례와 같이 간세포암종의 크기가 크며 동정맥루가 동반된 환자에서 경동맥화학색전술을 시행할 때 리피오돌을 많이 사용하게 되는 경우, 리피오돌에 의한 폐렴의 발생 여부를 염두에 두고 이에 대한 면밀한 관찰이 필요하겠다.
REFERENCES
1. Jouneau S, Vauléon E, Caulet-Maugendre S, et al. 2011; 131I-labeled lipiodol-induced interstitial pneumonia: a series of 15 cases. Chest. 139:1463–1469. DOI: 10.1378/chest.10-1591. PMID: 20947651.
2. Kim S, Kim HY, Lee SL, Ku YM, Won YD, Kim CW. 2020; Lipiodol pneumonitis following transcatheter arterial chemoembolization for hepatocellular carcinoma. J Liver Cancer. 20:60–66. DOI: 10.17998/jlc.20.1.60.

3. Youn I, Chong S, Kwak BK, et al. 2011; Pulmonary lipiodol accumulation after transarterial chemoembolization: CT findings and its radiologic outcomes. J Korean Soc Radiol. 65:577–583. DOI: 10.3348/jksr.2011.65.6.577.

4. Xia J, Ren Z, Ye S, et al. 2006; Study of severe and rare complications of transarterial chemoembolization (TACE) for liver cancer. Eur J Radiol. 59:407–412. DOI: 10.1016/j.ejrad.2006.03.002. PMID: 16621394.

5. Chung JW, Park JH, Im JG, Han JK, Han MC. 1993; Pulmonary oil embolism after transcatheter oily chemoembolization of hepatocellular carcinoma. Radiology. 187:689–693. DOI: 10.1148/radiology.187.3.8388567. PMID: 8388567.

6. Tajima T, Honda H, Kuroiwa T, et al. 2002; Pulmonary complications after hepatic artery chemoembolization or infusion via the inferior phrenic artery for primary liver cancer. J Vasc Interv Radiol. 13:893–900. DOI: 10.1016/S1051-0443(07)61772-2. PMID: 12354823.

7. Lin MT, Kuo PH. 2010; Pulmonary lipiodol embolism after transcatheter arterial chemoembolization for hepatocellular carcinoma. JRSM Short Rep. 1:6. DOI: 10.1258/shorts.2009.090352. PMID: 21103098. PMCID: PMC2984328.

8. Lee JH, Won JH, Park SI, Won JY, Lee DY, Kang BC. 2007; Transcatheter arterial chemoembolization of hepatocellular carcinoma with hepatic arteriovenous shunt after temporary balloon occlusion of hepatic vein. J Vasc Interv Radiol. 18:377–382. DOI: 10.1016/j.jvir.2007.01.005. PMID: 17377183.

Fig. 1
Initial dynamic liver magnetic resonance image. (A, B) Axial images showed an 11.6 cm-sized mass with peripheral heterogeneous arterial enhancement and delayed washout in the right hepatic lobe. (A) Arterial phase. (B) Hepatobiliary phase.
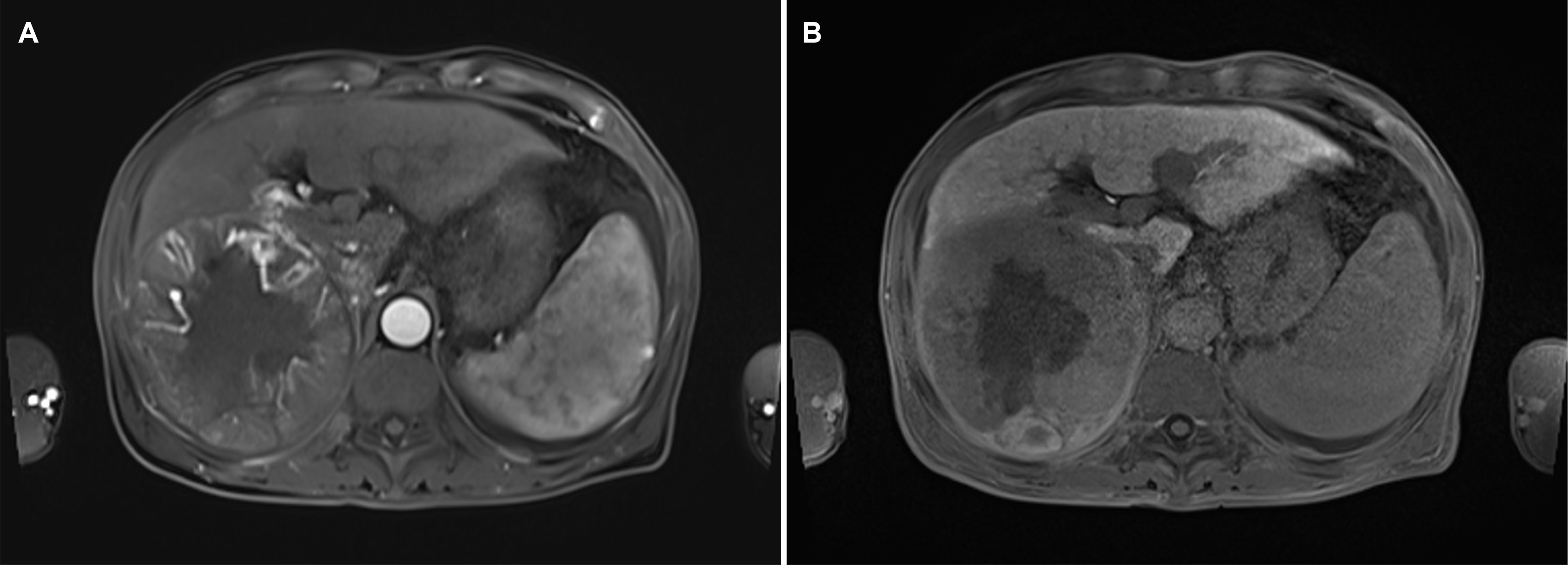
Fig. 2
Angiography findings. The angiogram showed the findings of hepatocellular carcinoma supplied from the right hepatic artery. (A) Arteriovenous shunting between the hepatic artery and hepatic vein was observed during angiography (red arrow). (B) Infusion of an adriamycin and lipiodol mixture and subsequent embolization was performed.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download