Abstract
Background and Objectives
Burning mouth syndrome (BMS) is a chronic pain disorder involving a burning sensation of the oral cavity without any identifiable oral lesion. According to the recent studies, the pathogenesis of BMS is presumed to be caused by a neuropathic condition. Gabapentin and pregabalin have been used for various neuropathic pains, but pregabalin has several pharmacokinetic advantages over gabapentin. To our best knowledge, there are no recent studies reported on the administration of pregabalin in treating BMS in Korea. Therefore, in this study, we investigated the therapeutic effect of pregabalin in treating BMS.
Subjects and Method
We chose as candidates 33 patients diagnosed as BMS and took pregabalin for more than four weeks. Pregabalin was administered at 75 mg once a day for 2 to 4 weeks at first, and then the dose was modified depending on whether or not symptoms improved. Effectiveness of treatment was evaluated in the way that the patients subjectively answered whether or not symptoms were improved.
Results
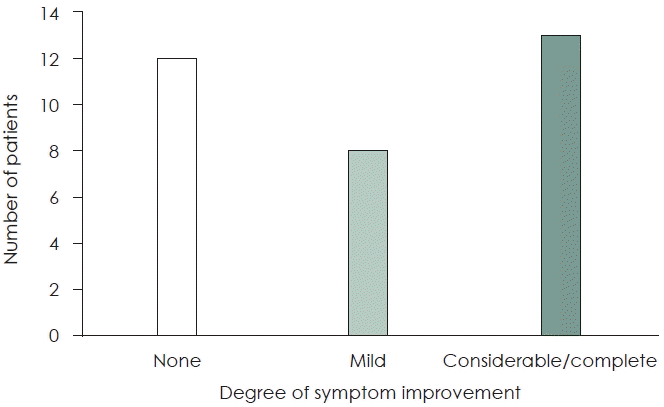
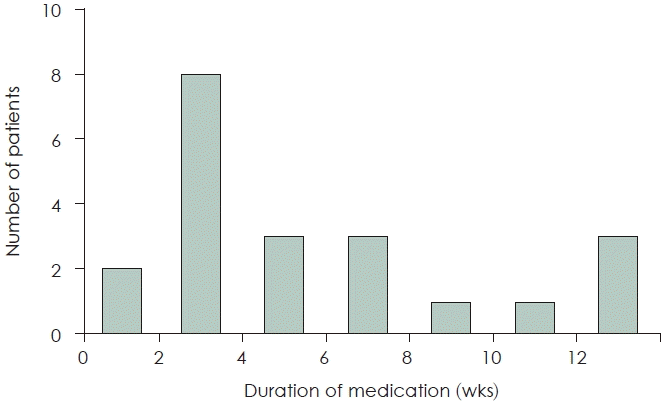
A total of 21 (63.6%) out of 33 patients were responsive to the treatment. Among those, at the last follow-up, 8 patients (38.1%) showed slight improvement, and 13 patients (61.9%) showed mostly improvement or disappearance of symptoms. The average time interval from starting pregabalin to the first symptom improvement was 50.1 days, and most patients showed symptom improvement within 8 weeks.
구강 작열감 증후군(burning mouth syndrome)은 구강의 뚜렷한 병변 없이 만성적으로 구강 내의 통증과 불편감을 호소하는 질환으로써, 구강의 타는 듯한 통증 외에도 미각 이상, 구강 건조감 등을 호소하기도 한다[1,2]. 구강 작열감 증후군의 발병기전은 아직 명확히 밝혀져 있지 않고 치료 원칙 또한 정립되어 있지 않기 때문에 본 질환의 치료는 증상 완화가 주된 목적이다.
최근 연구들에 의하면 구강 작열감 증후군의 발병기전은 신경병적 상태에서 기인한 것으로 추정되고 있으며 증상 발현에 중추신경계와 말초신경계가 관여함을 제시하고 있다[2]. 이에 치료 또한 신경물질의 전달에 관여하는 약물 치료들이 시도되고 있다[3-8]. 아직까지 구강 작열감 증후군의 치료에 승인된 약물은 없으나 현재까지 보고된 문헌 고찰에 따르면, clonazepam [9,10], alpha lipoic acid (ALA) [10,11], gabapentin [11,12], amitriptyline [13] 등이 50%-70%의 환자에서 효과가 있음을 확인하였다.
Gabapentin과 pregabalin은 다양한 신경병적 통증에 사용되는 약물로 지난 수년간 그 사용량이 꾸준히 증가하였다[14,15]. Gabapentin과 pregabalin은 구조적으로 서로 유사하며 중추신경계의 전압 개폐식 칼슘 채널에 작용하여 신경전달물질의 배출을 감소시킨다고 알려져 있으나, pregabalin은 gabapentin에 비해 몇 가지 약동학적 우위를 보인다[16]. Pregabalin은 gabapentin에 비해 경구 투여 후 빠르게 체내로 흡수된다(최고 혈중 농도 도달 시간: pregabalin 1시간 vs. gabapentin 3-4시간). 또한 약 혈장 농도에 있어 gabapentin은 용량 증가에 비례하여 증가하지 않는 반면에, pregabalin은 용량 증가에 비례하여 증가한다. 마지막으로, gabapentin의 생체이용률(biocompatibility)은 약 용량이 증가함에 따라 감소하는 반면 pregabalin의 생체이용률은 양 용량에 관계없이 높은 수준으로 유지됨을 보였다. 따라서 저자들은 pregabalin의 약동학적 우위 및 최근 국내 구강 작열감 증후군 환자의 pregabalin 투약 연구가 없었던 점에 주목하여, 구강 작열감 증후군으로 진단된 환자들에 대한 pregabalin의 치료 효과를 알아보고자 하였다.
본 연구는 후향적 연구로써 구강의 지속적인 통증 및 작열감을 주소로 2019년 1월 1일부터 2021년 5월 31일까지 고려대학교 구로병원 이비인후과를 외래 초진 내원한 환자들 중 pregabalin을 복용하였던 환자 79명을 초기 선정하였고, 최소 복용 기간은 2주였다. 이 중 구강 작열감 증후군을 진단받고 pregabalin을 4주 이상 복용한 환자 중 혈액검사를 시행하지 않았거나, pregabalin 복용 후 부작용이 있어 투약을 중지하거나 감량하였던 경우, 투약 중 구강 내 이상 소견이 관찰되어 타약제를 동시 복용한 경우, 인후두역류질환 증상이 있는 환자들을 제외 후 최종적으로 33명을 대상으로 연구를 시행하였다. 단, vitamin B12, Fe의 결핍이나 조절되지 않는 당뇨, 갑상선 기능 저하증의 경우 수치 교정 후 최종 환자군에 포함하였다. 통증의 이환기간은 최소 3개월 이상이었다.
환자가 외래를 방문하면 병력과 증상을 기록하고 혈액학적 검사를 시행하였다. 혈액학적 검사는 complete blood count, erythrocyte sedimentation rate, C-reactive protein, vitamin B12, Fe, folate, glucose, rheumatoid factor, cortisol, total estrogen, free T4, thyroid-stimulating hormone을 시행하였고, 이상 소견이 없을 시 pregabalin 복용을 시작하였다. Vitamin B12, Fe의 결핍이나 조절되지 않는 당뇨, 갑상선 기능 저하증의 경우 수치 교정 후 증상 여부에 대해 재문진 시행하였고 증상 지속 시 pregabalin 복용을 시작하였다.
Pregabalin은 75 mg 1일 1회 2-4주간 투여한 후 호전 없는 경우 165 mg으로 증량하였고, 조금 호전 있는 경우에는 추가 2-4주간 투약 용량을 유지하였으나 더 이상 호전이 없을 경우에 165 mg으로 증량하였다. 증상이 많이 호전되었거나 거의 소실되었을 경우 약을 감량하거나 중단하였다. 증상은 통증 및 작열감 호전 여부에 대하여 환자가 주관적으로 대답하는 방식으로 측정하였으며, 호전 여부는 호전 없음, 조금 호전, 대부분 호전 또는 증상 소실로 분류하였다.
통계는 전체 환자 수 대비 약 복용 후 호전을 보인 환자군의 비율을 계산하였다. 구강 작열감 증후군이 말초신경계 이상으로부터 기인한 것인지, 말초신경계와 중추신경계가 같이 관여하고 있는지 알아보기 위해 식사 시 악화되는 증상을 가진 환자군과 식사와 관계없는 증상을 가진 환자군으로 나누어 두 군 간의 치료 효과 비교에 대해 Fisher의 정확한 검정을 시행하였다. 통계 분석은 SPSS 22.0 (IBM Corp., Armonk, NY, USA)을 이용하였다. 본 연구는 헬싱키 선언문에 요약된 원칙에 의거하여 수행되었고, 고려대학교 구로병원 생명윤리심의위원회 검토와 승인을 받았다(승인번호: 2022GR0235).
연구에 포함된 33명의 환자 중 26명(78.8%)이 여성, 7명(21.2%)이 남성이었으며, 평균 연령은 63±11.8세였다. 이 중 구강 건조감을 호소하는 환자는 없었고 이갈이, 혀 내밀기 등 악습관 및 이상기능을 가진 환자도 없었다. 동반된 질환은 고혈압이 8명, 당뇨는 4명, 우울증 및 불면증 등의 정신질환은 7명, 갑상선 기능 저하증은 3명이었다. 전체 환자의 평균 pregabalin 복용 기간은 104.5일이었다(Table 1).
33명의 환자 중에서 총 21명(63.6%)의 환자가 치료에 반응이 있는 것으로 확인되었다. 그중 마지막 외래 추적 관찰 시 증상 호전 정도는 조금 호전된 환자가 8명(38.1%), 대부분 호전 또는 증상 소실된 환자가 13명(61.9%)이었다(Fig. 1). 치료에 반응을 보인 환자들의 평균 pregabalin 복용 기간은 128.2일이었고, 그렇지 않은 환자들의 평균 복용 기간은 63.1일이었다. 치료에 반응을 보인 환자들에 있어 pregabalin 복용 시작 후 처음 증상 호전까지의 평균 소요 기간은 50.1일이었고, 대부분의 환자들이 8주 이내에 호전을 보였다(Fig. 2). 식사 시 악화되는 증상을 가진 환자군(10명)과 식사와 관계없는 증상을 가진 환자군(23명)으로 나누어 pregabalin의 치료효과를 비교하였을 때 두 군 간의 통계학적 유의미한 차이는 없었다(Table 2).
초기 선정된 79명의 환자 중에 부작용으로 인한 pregabalin 투약 중단 또는 감량한 환자는 총 3명이었고, 졸음 2명, 변비 1명이었다. 그 외 부작용을 호소하는 환자는 없었다.
최근 연구들에 따르면 구강 작열감 증후군은 말초와 중추신경계가 모두 관여하는 신경병증성 통증 장애로 알려져 있다[4,17,18]. 신경병증성 통증에 있어 항우울제의 작용 기전은 중추신경계에서 세로토닌 및 노르아드레날린 재흡수를 억제함으로써 통증 억제 시스템을 활성화시키는 것으로 추정되고 있고[19], 항경련제의 경우 신경전 시냅스에서 칼슘 유입을 감소시키고 흥분성 신경전달물질의 과도한 방출을 억제함으로써 과도하게 흥분된 신경을 약화시키는 것을 통해 통증 경감 효과를 나타낸다고 알려져 있다[20].
구강 작열감 증후군 환자를 대상으로 pregabalin의 치료 효과를 연구한 위약 대조군 연구는 없는 상태이나 gabapentin에 대한 위약 대조군 연구는 1건 발표되었다. Lopez-D’ alessandro와 Escovich [12]의 2011년 위약 대조군 연구에 따르면 총 120명의 환자들 중 ALA 단독 투약 20명, gabapentin 단독 투약 20명, gabapentin과 ALA 동시 투약 20명, 위약군 환자는 60명이었고, 2개월 투약 후 위약군 환자들의 15%에서 증상 호전을 보인 반면에 gabapentin 단독 투약군 환자들은 50%에서 증상 호전을 보였다. 또한 gabapentin과 ALA가 동시 투약되었을 경우 70%의 환자에서 증상 호전을 보였다. 이 연구에서 gabapentin은 매일 3 00 m g씩 2개월 동안 투여되었고, 투여를 중단할만한 부작용은 발생하지 않았다. Gabapentin에 관한 또 다른 연구인 Choi 등[21]의 2012년 연구에 따르면 4주간 gabapentin을 투여한 환자 14명 중 12명(85.7%)이 증상 호전을 보였다. 이 연구에서 gabapentin은 300 mg을 1일 1회를 투여하여 2일마다 300 mg씩 증량하여 최대 2400 mg을 1일 1회까지 증량한 뒤 이를 유지하였고, 구강통증에 대해 visual analog scale (VAS)을 이용하여 VAS 점수가 2점 이상 감소된 경우를 증상 호전으로 정의하였다. 2명의 진정의 부작용이 관찰되었으나 투약을 중단할 만큼 심각한 부작용은 아니었다. 그러나 이 연구에서는 위약을 투여한 환자군을 만들지 않아 gabapentin을 투여한 환자군과 직접적인 비교가 어려운 것이 제한점이고, Lopez-D’alessandro와 Escovich [12]와 Choi 등[21]의 연구 모두 gabapentin 투여 기간이 1-2달 이내로 짧아서 이를 장기적으로 투여하였을 경우의 효과 및 부작용에 대해서도 알 수 없었다. 한편, Heck-mann 등[22]의 연구에 따르면 15명에게 gabapentin을 투여한 결과 4명의 환자에서 다소 증상 호전이 있었지만 gabapentin은 구강 작열감 증후군 치료에 큰 효과가 없는 것으로 설명하였고, Kim 등[23]은 34명의 환자에게 gabapentin을 투여하였을 때 복용 전후 구강 증상 점수의 통계학적 유의미한 차이는 없다고 하였다.
Pregabalin의 경우 국외에서 몇몇 증례 보고 형식으로만 발표되어 왔다. Ito 등[24]의 2015년 연구에 따르면 구강 작열감 증후군 치료로 세로토닌-노르에피네프린 재흡수 억제제를 장기 복용하였으나 증상 호전 없었던 5명의 환자를 대상으로 pregabalin을 하루 50-150 mg 용량으로 2-6개월 투여하였을 때 구강 작열감 증후군 증상에 대한 VAS 점수가 100점 기준으로 30-100점에서 약 투여 후 0-10점 사이로 감소하는 것을 확인하였고, 투약을 중단할 만한 심각한 부작용은 발생하지 않았다. 또한, Amasyalı 등[25]은 구강 작열감 증후군 환자 9명을 대상으로 pregabalin을 투여한 결과 모든 환자에서 증상 호전이 있음을 확인하였고, 동반질환으로는 고혈압, 갑상선 결절, 당뇨, 위염, 편두통 등이 있었다. 이 연구에서 pregabalin은 하루 100 mg씩 1주일 투여 후 300 mg으로 증량하였고 반응이 없는 일부 환자에서는 하루 450 mg으로 증량하였다. 부작용으로는 어지럼과 자세 불균형이 3명, 수면과다가 1명, 변비가 2명의 환자에게서 나타났지만 투약을 중단할 정도는 아니었다.
Pregabalin은 gabapentin과 구조적으로 유사하고 중추 신경계에 광범위하게 분포하는 전압 개폐식 칼슘 채널의 alpha2-delta 단백질에 작용하여 신경전달물질의 배출을 감소시킨다는 유사성이 있으나 alpha2-delta 구조물에 대한 친화도는 pregabalin이 더 높다. 이에 pregabalin은 이미 신경병적 통증에 있어 1차 선택 약물로 승인되어 광범위하게 투여되고 있다. 2019년에 발간된 코크란 리뷰에 따르면 하루에 300 mg 또는 600 mg 복용 시 post-herpetic neuralgia, painful diabetic neuropathy, mixed neuropathic pain 및 central neuropathic pain에 치료 효과가 있었다[26]. 그러나 pregabalin의 구강 작열감 증후군에 대한 치료 효과는 국내 및 국외에서조차 몇몇 증례 보고 형식으로만 발표되어 왔기때문에 본 연구를 통해 pregabalin이 구강 작열감 증후군의 치료에 의미 있는 옵션으로 추가될 수 있다고 생각한다.
본 연구에서 구강 작열감 증후군 환자에서의 pregabalin 치료 효과는 64%로 gabapentin (50%-85.7%)과 유사한 수치를 보였다. Pregabalin에 반응을 보이지 않는 환자들의 평균 약 복용 기간은 63.1일이었고, 증상 호전을 보인 환자에 있어서 첫 증상 호전 소요기간은 50.1일 것으로 보아 모든 환자에 있어 충분한 약 복용기간이 주어졌다고 생각해볼 수 있다. 본 연구에서는 몇몇 선행 연구를 참조하여 pregabalin의 투여 용량을 정하였지만, 추후 연구를 통해서 적절한 용량과 투여 기간을 확인한다면 gabapentin보다 높은 치료 효과를 기대할 수 있을 것이다.
Pregabalin은 중추신경계에 작용하는 약이기 때문에 식사 시 더 악화되는 통증과 같은 말초 신경병성 통증과 식사와 관계없이 지속되는 통증과 같은 중추 신경병성 통증에 치료 효과 차이가 있는지 알아보았을 때 통계학적인 유의미한 차이는 없었다. 이는 구강 작열감 증후군이 말초와 중추 신경계가 모두 관여하는 신경병증성 통증 장애로 알려져 있는 것과 일맥상통한다.
본 연구에서 pregabalin 복용 부작용 환자 발생률은 초기 선정 환자수를 기준으로 하였을 때 7.1%였다. 2019년에 발간 된 Pregabalin Cochrane review에 따르면 부작용 중에 어지럼과 졸음의 빈도가 가장 높았고, 논문에 따라 10%-30%의 부작용 발생률을 보였다. 또한, 약 복용을 중단할 정도의 부작용을 보인 환자 비율은 논문마다 상이하였지만 평균적으로 10% 내외였다[26].
이 연구의 단점은 위약을 투여한 환자군을 만들지 않아 약을 투여하지 않았을 경우에 미치는 효과에 대한 결과를 알 수 없고, 약 복용 후 증상 호전 정도를 정량화 하지 않아 정확한 비교가 불가능하다는 점이다. 또한, 구강 내 곰팡이 감염을 확인하기 위한 구강 내 세균 배양 검사 및 진균 배양 검사를 일괄적으로 시행하지 않았다. 구강 작열감 증후군 환자의 구강 미생물군을 조사한 결과 칸디다군이나 대장균의 이환율이 정상인보다 높다는 연구가 있으나, 실제 항진균치료가 환자에서 증상을 완화시키는 데 도움이 되는지에 대해서는 논란의 여지가 있기 때문에 구강의 육안적 병변이 없는 경우에는 관련 검사를 시행하지 않았다[27]. 알레르기에 의한 구강 작열감 증후군을 평가하기 위한 알레르기 첩포 검사도 일괄적으로 시행하지 않았다. 알레르기에 의한 구강 작열감 증후군 보고 빈도는 높지 않고 본원에서 첩포 검사가 제한되어 실시하지 않았다. 또 다른 제한점은 구강 작열감 증후군을 야기하는 것으로 알려진 항고혈압제 및 항정신병약을 복용중인 환자들을 포함시켰다는 점이다. 본 연구에서 고혈압으로 안지오텐신 전환효소 저해제(angiotensin-converting enzyme inhibitors, ACEi) 또는 안지오텐신 수용체 차단제(angiotensin receptor blocker, ARB)를 복용 중인 환자는 5명이었고, 정신질환으로 벤조디아제핀 계열의 약을 복용중인 환자는 2명이었다. 그러나 상기 약제로 인한 구강 작열감 증후군 보고 빈도는 높지 않고 실제 기전에 대해서도 논란의 여지가 있다[28,29]. 상기 약제 사용 후 언제 구강 작열감 증후군이 발병하는지에 대해서는 현재 정확히 알려진 바가 없고, 과거 연구 결과에 따르면 상기 약제 복용 시작과 구강 작열감 증후군 증상 시작 사이의 간격은 6일에서 7년 사이로 다양했다[30]. 또한, 장기간 부작용 없이 약제를 복용 후 이러한 부작용이 발생하는 이유 또한 알려진 바가 없다. 이에 본 연구에서는 ACEi, ARB 및 벤조디아제핀 계열의 약을 복용 중인 환자들을 배제하지 않았다. 마지막으로, 본 연구는 이중 맹검법을 시행하지 못하였다. 하지만 이 같은 단점들은 추후 연구를 통해서 보완될 수 있을 것이다.
Notes
Author Contribution
Conceptualization: Seok-Youl Choi, Jae-Gu Cho. Data curation: Hyunseok Choi, Seok-Youl Choi. Formal analysis: Seok-Youl Choi. Investigation: Seok-Youl Choi, Hyunseok Choi. Methodology: Seok- Youl Choi. Supervision: Jae-Gu Cho. Validation: Jae-Gu Cho. Visualization: Seok-Youl Choi. Writing—original draft: Seok-Youl Choi. Writing—review & editing: Seok-Youl Choi.
REFERENCES
1. Klein B, Thoppay JR, De Rossi SS, Ciarrocca K. Burning mouth syndrome. Dermatol Clin. 2020; 38(4):477–83.

2. Scala A, Checchi L, Montevecchi M, Marini I, Giamberardino MA. Update on burning mouth syndrome: Overview and patient management. Crit Rev Oral Biol Med. 2003; 14(4):275–91.
3. Ritchie A, Kramer JM. Recent advances in the etiology and treatment of burning mouth syndrome. J Dent Res. 2018; 97(11):1193–9.

4. Jääskeläinen SK. Pathophysiology of primary burning mouth syndrome. Clin Neurophysiol. 2012; 123(1):71–7.

5. Headache Classification Committee of the International Headache Society (IHS). The international classification of headache disorders, 3rd edition. Cephalalgia. 2018; 38(1):1–211.
6. Kolkka-Palomaa M, Jääskeläinen SK, Laine MA, Teerijoki-Oksa T, Sandell M, Forssell H. Pathophysiology of primary burning mouth syndrome with special focus on taste dysfunction: A review. Oral Dis. 2015; 21(8):937–48.

7. Lopez-Jornet P, Molino-Pagan D, Parra-Perez P, Valenzuela S. Neuropathic pain in patients with burning mouth syndrome evaluated using painDETECT. Pain Med. 2017; 18(8):1528–33.

9. Cui Y, Xu H, Chen FM, Liu JL, Jiang L, Zhou Y, et al. Efficacy evaluation of clonazepam for symptom remission in burning mouth syndrome: A meta-analysis. Oral Dis. 2016; 22(6):503–11.

10. Kisely S, Forbes M, Sawyer E, Black E, Lalloo R. A systematic review of randomized trials for the treatment of burning mouth syndrome. J Psychosom Res. 2016; 86:39–46.

11. Liu YF, Kim Y, Yoo T, Han P, Inman JC. Burning mouth syndrome: A systematic review of treatments. Oral Dis. 2018; 24(3):325–34.

12. López-D’alessandro E, Escovich L. Combination of alpha lipoic acid and gabapentin, its efficacy in the treatment of burning mouth syndrome: A randomized, double-blind, placebo controlled trial. Med Oral Patol Oral Cir Bucal. 2011; 16(5):e635–40.
13. Fenelon M, Quinque E, Arrive E, Catros S, Fricain JC. Painrelieving effects of clonazepam and amitriptyline in burning mouth syndrome: A retrospective study. Int J Oral Maxillofac Surg. 2017; 46(11):1505–11.

14. Johansen ME. Gabapentinoid use in the United States 2002 through 2015. JAMA Intern Med. 2018; 178(2):292–4.

15. Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, et al. Pharmacotherapy for neuropathic pain in adults: A systematic review and meta-analysis. Lancet Neurol. 2015; 14(2):162–73.

16. Bockbrader HN, Wesche D, Miller R, Chapel S, Janiczek N, Burger P. A comparison of the pharmacokinetics and pharmacodynamics of pregabalin and gabapentin. Clin Pharmacokinet. 2010; 49(10):661–9.

17. López-Jornet P, Camacho-Alonso F, Andujar-Mateos P, Sánchez-Siles M, Gómez-Garcia F. Burning mouth syndrome: An update. Med Oral Patol Oral Cir Bucal. 2010; 15(4):e562–8.
18. Speciali JG, Stuginski-Barbosa J. Burning mouth syndrome. Curr Pain Headache Rep. 2008; 12(4):279–84.

19. Basbaum AI, Fields HL. The origin of descending pathways in the dorsolateral funiculus of the spinal cord of the cat and rat: Further studies on the anatomy of pain modulation. J Comp Neurol. 1979; 187(3):513–31.

20. Dooley DJ, Donovan CM, Meder WP, Whetzel SZ. Preferential action of gabapentin and pregabalin at P/Q-type voltage-sensitive calcium channels: Inhibition of K+-evoked [3H]-norepinephrine release from rat neocortical slices. Synapse. 2002; 45(3):171–90.

21. Choi HG, Jung EJ, Lee WY, Kim HJ, Cha WJ, Hah JH. Comparison of pharmacological treatments for burning mouth syndrome. Korean J Otorhinolaryngol-Head Neck Surg. 2012; 55(11):707–11.

22. Heckmann SM, Heckmann JG, Ungethüm A, Hujoel P, Hummel T. Gabapentin has little or no effect in the treatment of burning mouth syndrome - results of an open-label pilot study. Eur J Neurol. 2006; 13(7):e6–7.

23. Kim MJ, Kim J, Kho HS. Treatment outcomes and related clinical characteristics in patients with burning mouth syndrome. Oral Dis. 2021; 27(6):1507–18.

24. Ito M, Tokura T, Yoshida K, Nagashima W, Kimura H, Umemura E, et al. Five patients with burning mouth syndrome in whom an antidepressant (serotonin-noradrenaline reuptake inhibitor) was not effective, but pregabalin markedly relieved pain. Clin Neuropharmacol. 2015; 38(4):158–61.

25. Amasyalı SY, Gürses AA, Aydın ON, Akyol A. Effectiveness of pregabalin for treatment of burning mouth syndrome. Clin Psychopharmacol Neurosci. 2019; 17(1):139–42.

26. Derry S, Bell RF, Straube S, Wiffen PJ, Aldington D, Moore RA. Pregabalin for neuropathic pain in adults. Cochrane Database Syst Rev. 2019; 1(1):CD007076.

27. Lee JH, Lee JC. Burning mouth syndrome (BMS). J Clin Otolaryngol Head Neck Surg. 2010; 21(2):211–20.
28. Azzi L, Veronesi G, Tagliabue A, Croveri F, Maurino V, Reguzzoni M, et al. Is there an association between drugs and burning mouth syndrome? A case-control study. Oral Dis. 2019; 25(6):1634–44.

29. Neil-Dwyer G, Marus A. ACE inhibitors in hypertension: Assessment of taste and smell function in clinical trials. J Hum Hypertens. 1989; 3 Suppl 1:169–76.
30. Salort-Llorca C,, Mínguez-Serra MP, Silvestre FJ. Drug-induced burning mouth syndrome: A new etiological diagnosis. Med Oral
Patol Oral Cir Bucal. 2008; 13(3):E167–70.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download